Method Article
Hochdurchsatzanalyse optischer Mapping-Daten mit ElectroMap
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Einrichtung und Verwendung von ElectroMap, einer MATLAB-basierten Open-Source-Softwareplattform zur Analyse von kardialen optischen Kartierungsdaten. ElectroMap bietet ein vielseitiges Hochdurchsatz-Tool für die Analyse optischer Kartierungsspannungs- und Calcium-Datensätze in einer Vielzahl von kardialen experimentellen Modellen.
Zusammenfassung
Optische Kartierung ist eine etablierte Technik zur Studie der Kardialelektrophysiologie in mehrzelligen Präparaten mit hoher raumzeitlicher Auflösung. Hier stellen wir in einer Schritt-für-Schritt-Anleitung die Verwendung von ElectroMap zur Analyse, Quantifizierung und Kartierung von hochauflösenden Spannungs- und Calcium-Datensätzen vor, die durch optischeS Mapping erfasst werden. Die ElektroMap-Analyseoptionen decken eine Vielzahl wichtiger elektrophysiologischer Parameter ab, und die grafische Benutzeroberfläche ermöglicht eine einfache Änderung der Vorverarbeitung und Parameterdefinitionen, sodass ElectroMap auf eine Vielzahl von experimentelle Modelle. Wir zeigen, wie die integrierte Tempofrequenzerkennung und Signalsegmentierung eine Analyse des hohen Durchsatzes ganzer experimenteller Aufnahmen, akuter Reaktionen und einer einzigen Beat-to-Beat-Variabilität ermöglicht. Darüber hinaus enthält ElectroMap eine automatisierte Multi-Beat-Mittelung, um die Signalqualität von lauten Datensätzen zu verbessern, und hier zeigen wir, wie diese Funktion dazu beitragen kann, elektrophysiologische Veränderungen aufzuklären, die andernfalls bei der Verwendung einzelner Beat-Analyse. Benutzerdefinierte Module sind in der Software für die detaillierte Untersuchung der Leitung, Einzeldateianalyse und Alternane enthalten, wie hier gezeigt. Diese Software-Plattform kann verwendet werden, um die Verarbeitung, Analyse und Kartierung komplexer Herzelektrophysiologie zu ermöglichen und zu beschleunigen.
Einleitung
Optische Kartierung nutzt fluoreszierende Reporter mit Spannung und/oder Kalziumkonzentration, um die Herzelektrophysiologie (EP) und die Kalziumhandhabung in mehrzelligen Präparaten zu beleuchten, mit einer größeren räumlichen Auflösung als herkömmliche Techniken1,2,3. Daher hat sich die optische Kartierung zu einer wichtigen und immer mehr genutzten Technik entwickelt, die wichtige Einblicke in das physiologische und pathophysiologische elektrische Verhalten im Herzen3,4,5 ,6,7,8. Die effektive Verarbeitung und Analyse von Daten aus optischen Kartierungsexperimenten wird durch mehrere Faktoren erschwert. Die hohe raumzeitliche Auflösung von optischen Mapping-Datasets führt zu Rohvideos, die aus Tausenden von Bildrahmen bestehen, die jeweils aus einer Reihe von einzelnen Pixeln bestehen, was zu großen Datendateien führt, die einen hohen Durchsatz und eine automatisierte Verarbeitung9. Kleine Pixelgrößen, schlechte und ungleichmäßige Farbbelastungen und kleine bruchstückhafte Veränderungen der Fluoreszenz führen zu optischen Signalen mit niedrigem Signal-Rausch-Verhältnis (SNR), die eine Vorverarbeitung erfordern, bevor eine effektive Analyse erreichbar ist10. Die Verarbeitung und Analyse kann durch die Verwendung optogenetischer Tempoprotokolle, die Licht verwenden, um die Aktivierung zu initiieren, weiter erschwert werden, wodurch das aufgezeichnete Signal der Fluoreszenzsensoren11,12möglicherweise verzerrt wird. Darüber hinaus können nach der Verarbeitung der Daten mehrere nicht konsistente Techniken und Definitionen angewandt werden, um die von Interesse abhängigen Parameter zu messen, wobei die am besten anwendbaren Techniken je nach Versuchsaufbau, Modell und Frage2variieren. 10,13. Diese Einschränkungen verhindern eine weitere Nutzung der Technologie und behindern eine wirklich objektive Analyse.
Um diese Einschränkungen zu überwinden, haben mehrere Forschungsgruppen kundenspezifische Verarbeitungspipelines entworfen, die auf ihr experimentelles Modell, ihre Frage und Hardware 7,14,15,16zugeschnitten sind. Andere verwenden kommerzielle proprietäre Software, wo die zugrunde liegenden Algorithmen schwierig sein können, um4,17zugreifen. Daher besteht ein klarer Bedarf an einer frei verfügbaren Open-Source-Softwareplattform für die Verarbeitung und Analyse optischer Mapping-Daten. Es ist wichtig, dass diese Software Open-Source ist, einfach zu bedienen, flexibel auf Parametereinstellung, anwendbar auf eine Reihe von experimentellen Modellen mit unterschiedlichen EP-Eigenschaften und ermöglicht entscheidend eine einfache und abstimmbare Quantifizierung des Bereichs der Herz Parameter, die mithilfe der optischen Zuordnung untersucht werden können.
Wir haben vor kurzem eine umfassende Software-Plattform, ElectroMap, für eine umfassende, halbautomatische Verarbeitung, Analyse und Kartierung von kardialen optischen Mapping-Datensätzenveröffentlicht 13. Hier stellen wir ein Videohandbuch zur Nutzung von ElectroMap vor und zeigen, wie es zur Verarbeitung, Analyse und Kartierung mehrerer optischer Mapping-Datasets verwendet werden kann. Wir konzentrieren uns auf die Verwendung von ElectroMap zur Quantifizierung von Standard-EP- und Calcium-Handling-Variablen und demonstrieren die Verwendung von Standalone-Leitungsgeschwindigkeit, Einzeldateianalyse und Alternans-Modulen.
Protokoll
1. Optische Mapping-Datenerfassung
- Durchführung der kardialen optischen Kartierung mit einem der breiten Palette von experimentellen Modellen einschließlich intakter und isolierter ganze Herzen6,18, isolierte Vorhöfe14,19, ventrikuläre Keile20, Herzscheiben 21 , 22und zelluläre Monolayer23. Siehe zugehörige Referenzen für experimentelle Konstruktionen, um rohe optische Kartierungsdaten aus diesen Präparaten zu sammeln. Vorausgesetzt, die erhaltenen Daten können in einen tiff-Stack konvertiert oder in einem gespeichert werden. MAT-Datei, sollte es mit ElectroMap analyzierbar sein. Dazu gehören Daten unterschiedlicher Abmessungen (quadratisch/rechteckig) und Auflösungen (maximal getestet derzeit 2048 Pixel x 2048 Pixel).
2. Softwareinstallation und Inbetriebnahme
HINWEIS: Im Folgenden sind die beiden Methoden zum Installieren und Ausführen von ElectroMap detailliert – entweder innerhalb von MATLAB, das vom Quellcode (.m) oder als eigenständige ausführbare Datei (.exe für Windows) ausgeführt wird. Die endgültige Software und ihre Funktionalität sind invariant zwischen den beiden Setup-Optionen (mit anderen als ein paar Unterschiede in der Verzeichnisnavigation). Daher sind die wichtigsten Überlegungen für die Auswahl der zu installierenden Version der Zugriff auf MATLAB und erforderliche Toolboxes und die Frage, ob der Zugriff auf Quellcode gewünscht wird. Es wird empfohlen, die MATLAB-Version nach Möglichkeit für schnellere Anlaufzeiten, kürzere Bearbeitungszeiten und einfachere Fehlerberichterstattung zu verwenden.
-
Setup 1: Ausführen von Electromap innerhalb von MATLAB
- Installieren Sie MATLAB. ElectroMap wurde in MATLAB 2017a entwickelt, jedoch wurde die Software für den Einsatz in allen nachfolgenden Versionen von MATLAB getestet (bis 2018b zum Zeitpunkt des Schreibens). Die folgenden Toolboxes sind erforderlich: Bildverarbeitung, Signalverarbeitung, Statistik und maschinelles Lernen und Kurvenanpassung.
- Laden/klonen Sie alle Dateien aus der neuesten "Quellcode"-Version von ElectroMap aus dem GitHub-Repository (https://github.com/CXO531/ElectroMap). Entpacken Sie die heruntergeladenen Inhalte an einem gewünschten Speicherort.
- Öffnen Sie MATLAB und navigieren Sie zum Ordnerspeicherort, der den ElectroMap-Quellcode enthält. Öffnen Sie dann die Datei ElectroMap.m und drücken Sie die Ausführung im Editor, oder geben Sie Alternativ ElectroMap im Befehlsfenster ein, und drücken Sie RETURN. Dadurch wird die ElectroMap-Benutzeroberfläche gestartet, Abbildung 1A.
-
Setup 2: Eigenständige EXE-Datei
- Laden Sie die Installationsdatei herunter: https://drive.google.com/open?id=1nJyI07w9WIt5zWcit0aEyIbtg31tANxI.
- Folgen Sie den Anweisungen im Installer, der die MATLAB-Laufzeit neben der ElectroMap-Software aus dem Internet herunterladen wird.
- Führen Sie ElectroMap.exeaus.
HINWEIS: Die Startzeit für die Standalone-Version kann mehrere Minuten betragen.
3. Bildbeladung und Vorverarbeitung
- Drücken Sie Ordner auswählen, und navigieren Sie zum Speicherort der zu analysierenden Datendatei. Dadurch wird das linke Listenfeld mit allen Dateien innerhalb dieses Verzeichnisses auffüllen, die den richtigen Dateityp haben (.tif oder . MATTE). . MAT-Dateien dürfen nur die Image-Stack-Variable enthalten.
HINWEIS: Beim Navigieren durch die Verzeichnisauswahl werden nur Ordner und keine einzelnen Dateien angezeigt. - Wählen Sie eine Datei aus, die in der Schnittstelle geladen werden soll, und drücken Sie Bilder laden.
- Nach dem Laden wird der erste Frame angezeigt, und die rote Umrisslinie zeigt die automatische Schwellenwertung des Bildes an. Laden Sie bei Bedarf zuvor verwendete ROIs neu, indem Sie ROI speichern/ladenauswählen. Überspringen Sie in diesem Fall Schritt 3.3.
- Standardmäßig basiert die Schwellenwertierung auf den Pixelintensitäten im ersten Frame. Ändern Sie dies bei Bedarf in einen Schwellenwert basierend auf der Amplitude des Signalzeitverlaufs, indem Sie die Option im Dropdownmenü Bild für Schwellenwert ändern. Bitte beachten Sie, dass die Schwellenwerte, sobald sie ausgewählt ist, auf den gesamten Image-Stack angewendet werden.
- Ändern Sie bei Bedarf die Option Schwellenwert in manuell, wodurch der Schieberegler aktiviert wird, um den Bildschwellenwert manuell anzupassen. Zusätzlich können Sie Bilder (Zuschneiden des Bildes) zuschneiden und/oder einen benutzerdefinierten Bereich von Interesse (Custom ROI) für die Analyse zeichnen, indem Sie das entsprechende Kontrollkästchen unterhalb der Schwellenwertoptionen auswählen. Beachten Sie, dass erweiterte Optionen für die Auswahl der Region von Interesse, wie z. B. die Anzahl der Bereiche, über die ROI-Auswahl im oberen Menü verfügbar sind.
- Sobald ein entsprechender Schwellenwert angewendet wurde, drücken Sie Prozessbilder, um die Verarbeitung anzuwenden. Die Einstellungen für die Verarbeitung sind unten aufgeführt (Schritt 3.4.1-3.4.5). Stellen Sie an dieser Stelle sicher, dass die richtigen Kameraeinstellungen eingegeben wurden. Dies sind Pixelgröße in m (WICHTIG: Dies ist die Bildpixelgröße und nicht die Größe der Pixel, aus denen der Chip oder die entsprechende Hardware im Bildverarbeitungsgerät besteht) und Framerate in kHz.
- Aktivieren Sie bei Signalinversion das Kontrollkästchen Daten umkehren, um dies zu aktivieren. Wenn das gemeldete Fluoreszenzsignal umgekehrt proportional zu den Parametern von Interesse ist (wie bei häufig verwendeten potentiometrischen Farbstoffen), kann das Signal invertiert werden.
- Wählen Sie für die räumliche Filterung Gaußisch oder Durchschnitt aus dem Kernelmenü aus. Die Größe des räumlich gemittelten Bereichs wird durch die Größeneingabe neben dem Kernel-Dropdown-Menü gesteuert (d. h. 3 Ergebnisse in 3 Pixel x 3 Pixel Filterkernel). Beim Anwenden eines Gaußschen Filters kann die Standardabweichung auch vom Sigma-Eingang eingestellt werden.
- Wählen Sie für die Baseline-Korrektur top-hat24 oder Polynomkorrektur (4th oder 11th Degree) Korrektur25 aus dem Menü Baseline aus. Die Korrektur kann einzeln (lange Bearbeitungszeit) oder als Durchschnitt des gesamten Bildes (schneller, aber von homogenen Grundlinienänderungen angenommen) auf jedes Pixel angewendet werden. Die Top-Hat-Korrektur kann auch geändert werden, indem Die Top-Hat-Länge in Millisekunden neben dem Dropdown-Menü für die Basisauswahl festgelegt wird. Die Länge des Top-Hat-Kernels sollte größer sein als die Zeitskala der einzelnen Aktionspotentiale/Calciumtransienten.
- Wählen Sie für die zeitliche Filterung savitzky-Goaly oder iiR-Filterung aus dem Filtermenü aus.
HINWEIS: Anders als für das gemittelte Gewebesignal, das unten links angezeigt wird, wird die zeitliche Filterung einzeln zum Zeitpunkt der Parameterquantifizierung aus gemittelten Bildbereichen des Ensembles angewendet. Dies wurde implementiert, um die Verarbeitungszeit zu reduzieren, indem kleine Datenabschnitte bei Bedarf und nicht ganze Dateien gefiltert werden. - Beachten Sie zum Entfernen von Rahmen, dass große Spitzen mit einer Amplitude größer als das Interessensignal aus dem Bildsatz entfernt werden können, wenn die Option Frames entfernen ausgewählt ist. Dies kann in optisch temporeichen Datensätzen wie dem optogenetischen Tempo nützlich sein, bei dem die Depolarisation durch optische Aktivierung von Opsinen wie Channelrhodopsin 211,12ausgelöst wird.
HINWEIS: Da die Entfernung des Rahmens möglicherweise unphysiologische Schrittänderungen in die Bildsignale einführt, kann die zeitliche Filterung Artefakte in die Daten einbringen und wird daher hier nicht empfohlen.
- Beachten Sie, dass das Signal segmentiert wird, sobald Prozessbilder gemäß den Optionen unter Segmentierungsoptionenausgewählt wurden, dies kann jedoch schnell geändert werden, ohne das gesamte Dataset erneut zu verarbeiten (siehe Abschnitt 4).
4. Datensegmentierung und Ensemblemittelung
HINWEIS: Sobald die Datei verarbeitet wurde, werden Spitzen im gemittelten Gewebesignal (untere rechte Spur, Abbildung 1A) erkannt und durch rote Kreise markiert. Es werden nur Spitzen wertet, die einen festgelegten Schwellenwert überschreiten (blaue Linie bei Ablaufverfolgung, die durch Peak Thresholdfestgelegt wird). Darüber hinaus werden Spitzen nur gezählt, wenn sie im Vergleich zu den vorherigen Spitzen, die durch den Min Peak Distance-Eingang festgelegt wurden, ausreichend verzögert sind. Das Signal wird dann basierend auf den erkannten Spitzen segmentiert. Zunächst wird die effektive Zykluslänge (CL) jedes Peaks berechnet, indem die Zeit zwischen ihm und dem nächsten Peak gemessen wird. Wenn eine Anzahl von Peaks (die durch die Eingabe min Number of Peaks festgelegt sind) ähnliche CLs aufweisen (Schwellenwert, für den durch minimale Boundary-Eingabe festgelegt wird), werden sie gruppiert und die durchschnittliche CL für diese Peaks berechnet.
- Für die weitere Segmentierung der Daten drücken Sie Segmentsignal. Teilsegmentierungsoptionen sind: Keine – alle Spitzen mit derselben CL gruppiert; Alle – Segmente von nPeaks innerhalb der konstanten CL-Zeiten (nSpitzen werden durch die Segmentgrößeneingabe festgelegt) werden identifiziert; Letzte – Letzten-Peaks, bevor eine CL-Änderung identifiziert und gruppiert wird, und alle anderen werden nicht analysiert; und Single Beat – Dies entspricht der Anwendung der Alle Segmentierung mit nPeaks = 1, sodass keine Gruppierung oder Ensemblemittelung (siehe 4.5) angewendet wird. Dies kann durch Auswahl der Single Beat-Taste angewendet werden.
- Wenden Sie die benutzerdefinierte Segmentierung des Signals an, indem Sie eine Zeit von Interesse vergrößern und Segmentsignalauswählen. Dadurch wird dem Abschnittslistenfeld eine zusätzliche Option mit dem Titel Zoomierter Abschnitt hinzugefügt, die den ausgewählten Zeitpunkten entspricht.
- Die Ergebnisse der Segmentierung werden im Listenfeld neben dem gemittelten Gewebesignal angezeigt und zeigen die Schnittnummer und die geschätzte CL an. Alle segmentierten Zeitabschnitte werden durch unterschiedliche Farben bezeichnet. Wählen Sie ein Segment aus dem Listenfeld aus, um diesen Abschnitt rot hervorzuheben. Dadurch werden auch automatisch Analysen dieses Abschnitts ausgelöst, als ob die Schaltfläche Karten erzeugen ausgewählt wäre (siehe Abschnitt 5).
- Analysen der gruppierten Spitzen werden anhand der "ensemble averaged"-Daten durchgeführt. Dabei werden die Spitzen in einem Segment zusammen durchschnittlich, wobei die Referenzzeiten die in Schritt 4.2 identifizierten Spitzen sind. Aktualisieren Sie das Zeitfenster auf den Durchschnitt, indem Sie die Vorher-Nachher-Eingaben ändern und Segmentsignaldrücken.
5. Wirkungspotential/Calciumtransientdauer und Leitungsgeschwindigkeitsanalyse
- Sobald Bilder verarbeitet wurden, wird die Schaltfläche Karten erzeugen aktiv. Drücken Sie Karten erstellen, um Aktionspotenzialdauer (APD), Aktivierungszeit, Leitungsgeschwindigkeit und SNR-Analyse anzuwenden. Standardmäßig wird die Analyse auf das erste Signalsegment angewendet. Wählen Sie andere Segmente aus dem Listenfeld wird Analyse auf ausgewählte Segment angewendet.
ANMERKUNG: Die Ergebnisse der Analyse werden in der Ergebnistabelle angezeigt, einschließlich Mittelwert, Standardabweichung, Standardfehler, Varianz und 5. bis 95. Perzentilanalyse. Dauerkarten werden als "APD"-Karten bezeichnet, Kalziumsignale, die mit den gleichen Einstellungen verarbeitet werden, messen die transiente Dauer des Kalziums. - Wählen Sie Pixelinfo abrufen aus, um eine detaillierte Anzeige des Signals von einem beliebigen Pixel innerhalb des Bildes anzuzeigen, und vergleichen Sie Pixel, um Signale gleichzeitig von bis zu 6 Positionen zu zeichnen.
- Verwenden Sie das Bedienfeld Signalverarbeitung, um Einstellungen für die Daueranalyse anzupassen. Dies sind: Dauer – Zeit der prozentualen Repolarisation/Deskais von oben zu messen; 'APD' Baseline – Zeitperiode des Signals, die als Referenzbasisfür Amplitudenmessungen definiert ist; und 'APD' Startzeit – Startzeit für Dauermessungen. Dies sind die gleichen Optionen für die Entscheidung der Aktivierungszeit für isochronale Karten (siehe unten) und sind als: Start ( d2F/dt2max), Upstroke (dF/dtmax), Depolarisation Midpoint (Zeit von 50% Amplitude), Peak (Zeit der maximalen Amplitude). Diese Definitionen für Die Aktionspotentiale von Maus und Meerschweinchen sind in Abbildung 2Adargestellt.
HINWEIS: Wenn Sie eine dieser Optionen ändern, werden automatisch die Dauerzuordnung und die Ergebnistabelle aktualisiert. Kartenmaßstabund- und Ausreißerentfernungsoptionen sind ebenfalls verfügbar.
- Verwenden Sie das Bedienfeld Signalverarbeitung, um Einstellungen für die Daueranalyse anzupassen. Dies sind: Dauer – Zeit der prozentualen Repolarisation/Deskais von oben zu messen; 'APD' Baseline – Zeitperiode des Signals, die als Referenzbasisfür Amplitudenmessungen definiert ist; und 'APD' Startzeit – Startzeit für Dauermessungen. Dies sind die gleichen Optionen für die Entscheidung der Aktivierungszeit für isochronale Karten (siehe unten) und sind als: Start ( d2F/dt2max), Upstroke (dF/dtmax), Depolarisation Midpoint (Zeit von 50% Amplitude), Peak (Zeit der maximalen Amplitude). Diese Definitionen für Die Aktionspotentiale von Maus und Meerschweinchen sind in Abbildung 2Adargestellt.
- Die Leitungsgeschwindigkeit wird auch innerhalb der Hauptsoftware-Schnittstelle automatisch gemessen. Dies wird mit der Multivektormethode von Bayly et al26 aus der isochronalen Karte erreicht, die durch die gewählte Aktivierungsmaßnahme definiert ist (in Schritt 5.4). Drücken Sie Aktivierungspunkte, um eine 3D-Darstellung der Aktivierungskarte zu rendern.
- Die Multivektor-Leitungsgeschwindigkeitsmessungsmethode segmentiert die isochronale Karte räumlich in Regionen von n x n Pixeln. Legen Sie den Wert von n mithilfe der Eingabe für die lokale Fenstergröße fest, und legen Sie den Bereich der Aktivierungszeiten fest, um die Analyse auf die Verwendung der Eingabewerte für die Anpassungsaktivierungszeiten anzuwenden.
ANMERKUNG: Für jede lokale Region ist eine polynomiade Oberfläche, f, angebracht, die die Beziehung zwischen Aktivierungszeit und räumlicher Position am besten beschreibt (x,y). Der Gradientenvektor, CVlocal, dieser Oberfläche wird dann wie folgt berechnet: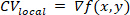 ①
①
wobei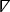 der zweidimensionale kartesische räumliche Differentialoperator26bezeichnet.
der zweidimensionale kartesische räumliche Differentialoperator26bezeichnet. - Für jedes Pixel in der isochronalen Karte wird ein lokaler Vektor berechnet, der Geschwindigkeit und Leitungsrichtung darstellt. Wählen Sie Isochronale Karte mit Vektoren aus dem Dropdown-Menü der Anzeige aus, um diese Analyse anzuzeigen.
- SNR wird als Verhältnis der maximalen Amplitude im Vergleich zur Standardabweichung des Signals zum Ausgangswert berechnet. Diese Analyse wird nach allen Bearbeitungsschritten durchgeführt. Drücken Sie im oberen Menü die SNR-Berechnung, um die Einstellungen für den Zeitraum des als Basiswert simgdefinierten Signals zu bearbeiten.
6. Leitungsanalysemodul
- Drücken Sie die Leitung, um auf eine detailliertere Analyse der Leitungsgeschwindigkeit zuzugreifen. Dadurch wird ein separates Modul geöffnet, in dem die Leitung mit der Bayly Multi-Vektor-Methode wie in der Hauptschnittstelle, Einzelvektormethoden und als Aktivierungskurve quantifiziert werden kann.
- Drücken Sie Single Vector, um die Leitung mit der Einzelvektormethode zu analysieren, bei der CV aus der Verzögerung der Aktivierungszeit zwischen zwei Punkten berechnet wird. Dies kann mit automatischen oder manuellen Methoden erfolgen, die unter der Schaltfläche "Einzelner Vektor" ausgewählt werden können.
- Wählen Sie bei der automatischen Einzelvektormethode einen Abstand und einen Startpunkt aus, von dem aus die Leitung gemessen werden soll. Die Software führt dann einen 360-Grad-Sweep vom ausgewählten Punkt aus durch, misst die Zeitverzögerung und berechnet die zugehörige Leitungsgeschwindigkeit in allen Richtungen in 1-Grad-Schritten. Die Ergebnisse dieser Analyse werden im Diagramm neben der Karte angezeigt, und die Richtung der langsamsten Leitung wird rot dargestellt.
- Wählen Sie für die manuelle Einzelvektormethode sowohl einen Start- als auch einen Endpunkt aus der isochronalen Karte aus, um die Leitungsgeschwindigkeit zu berechnen. Um einen neuen Startpunkt auszuwählen, drücken Sie Startpunkt löschen.
- Drücken Sie Lokalvektor, um die Multi-Vektor-Methode anzuwenden, wobei die Einstellungen mit denen der Hauptschnittstelle übereinstimmen. Innerhalb des Leitungsmoduls können die Verteilung der Leitungsgeschwindigkeiten sowie die Winkelverteilung der berechneten Vektoren und die Winkelabhängigkeit der Leitungsgeschwindigkeit angezeigt werden.
- Drücken Sie die Aktivierungskurve, um den Prozentsatz des als Zeit aktivierten Gewebes darzustellen. Die Aktivierung summiert sich automatisch, während benutzerdefinierte Werte für minimale (blaue) und maximale (rote) Aktivierungsprozentsätze, zwischen denen gemessen werden soll, ebenfalls ausgewählt werden können.
7. Zusätzliche Analysen und Module
- Neben automatisch durchgeführten Dauer- und Leitungsgeschwindigkeitsanalysen können mit ElectroMap weitere Parameter quantifiziert werden. Diese Analysen können im Dropdown-Menü über der Anzeigekarte ausgewählt werden. Wählen Sie eine dieser Optionen aus, um die Analyse durchzuführen, und die Ergebnisse werden in der 4. Zeile der Ergebnistabelle angezeigt: 1) Diastolisches Intervall – Zeit von 90 % Repolarisation bis zur Aktivierungszeit des nächsten Aktionspotenzials; 2) Dominante Frequenz – Frequenzspektrum jedes Pixels wird mit der schnellen Fourier-Transformation berechnet, und die Frequenz mit der meisten Leistung wird als die dominante Frequenz definiert. Erweiterte Bereichs- und Fenstereinstellungen für die dominante Frequenzanalyse sind verfügbar, indem Sie Frequency Mappingauswählen. 3) Zeit bis zum Höhepunkt – Die Anstiegszeit zwischen zwei vom Benutzer ausgewählten Prozentsätzen (Standard 10 bis 90%) der Depolarisationsphase des Aktionspotentials oder der Freisetzung von Kalzium. Prozentwerte können durch Auswahl von TTP-Einstellungengeändert werden. und 4) Entspannungskonstante ()– Entspannungskonstante wird berechnet, indem ein mono-exponentielles Zerfall der Form der Form angebracht wird:
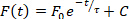 ②
②
wobei der Fluoreszenzpegel zum Zeitpunkt t von der Peakfluoreszenz, F0und dem nachfolgenden Zerfall (C ist eine Konstante)abhängt 27. Der Wert, zwischen dem Gleichung 2 passen soll, ist in den Haupt-ElectroMap-Benutzeroberflächen wählbar, sowie eine Güte der Anpassungsausschlusskriterien basierend auf dem r 2-Wert. - Drücken Sie die Einzeldateianalyse, um ein dediziertes Modul für die Dauer und Leitung jedes identifizierten Segments in einer Datei zu öffnen. Die Analyse kann entweder für das gesamte Bild (Dauer, Leitungs- und Aktivierungszeit) oder für ausgewählte Regionen oder Sehenswürdigkeiten (derzeit nur Dauer) durchgeführt werden. Die Ergebnisse werden in einer CSV-Datei ausgegeben.
HINWEIS: Bei APD-Werten aus dem gesamten Bild ist die erste Spalte in der CSV-Datei der Mittelwert, während die zweite Spalte die Standardabweichung ist. - Drücken Sie Alternans, um ein eigenständiges Modul für die dedizierte Analyse und Kartierung der Beat-to-Beat-Variabilität zu initiieren. Siehe O'Shea et al. 201913 für Details zu alternans Processing and Analysis Options. Insbesondere wurde dieses Modul entwickelt, um zwei Periodenschwingungen zu identifizieren, die als Alternane bezeichnet werden. Sowohl Dauer- als auch Amplituden-Generatoren werden berechnet und ausgegeben.
ANMERKUNG: Die Daueralternans werden gemessen, indem die Dauermessung von einem Spitzenwert zum nächsten verglichen wird; d.h. wenn Peak eins und zwei bzw. APD1 bzw. APD2, dann wird die Dauer alternan (APD) als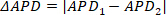 ③
③
Die Dauermessung wird über die Einstellungen in der Hauptschnittstelle durchgeführt. In der Zwischenzeit können Amplituden-Generatoren quantifiziert und über multizelluläre Präparate als absolute Veränderung abgebildet werden (definiert als Prozentsatz, wobei 0% = die gleiche Amplitude zwischen einem Schlag und dem nächsten). Darüber hinaus können die Auswirkungen von Phänomenen wie der Kalziumbelastung durch Messung und Vergleich von Last- und Freisetzungsalternen weiter untersucht werden, wie bereits berichtet wurde28. Wenn L definiert ist als die Spitzenamplitude der großen Beats (d.h. wo die Amplitude größer als der vorherige Beat ist), S die Amplitude der kleinen Beats undD die diastolische Last der kleinen Beats, die Freisetzung abwechselnd (
vorherige Beat ist), S die Amplitude der kleinen Beats undD die diastolische Last der kleinen Beats, die Freisetzung abwechselnd ( 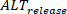 ) sind definiert als:
) sind definiert als: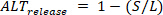 ④
④
Umgekehrt sind Lastalternativen (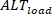 ) wie folgt definiert:
) wie folgt definiert: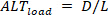 (5)
(5)
Alternans Messungen können über das gesamte Gewebe durchgeführt werden, und die Ergebnisse der Analyse werden in der unteren rechten Seite des Moduls angezeigt. Bei der ersten Verwendung des Moduls wird die Analyse in der gesamten experimentellen Datei durchgeführt, und die angezeigten Ergebnisse sind eine durchschnittliche Schlagdifferenz in der gesamten Datei. Die Analyse kann jedoch auf bestimmte Zeiten in der Datei beschränkt werden, indem Sie die Auswahl des Zoomsdeaktivieren, auf einen bestimmten Zeitraum zoomen und den Zoombereich analysierenauswählen. Dadurch wird das Ergebnisfenster aktualisiert, um die Analyse aus dem ausgewählten Zeitraum anzuzeigen.- Wählen Sie Play aus, um ein Beat-to-Beat-Video der Alternans-Analyse anzuzeigen. Wählen Sie außerdem Mittlere Karte erstellen aus, um eine Karte des alternans-Verhaltens zu exportieren, das aus den Auswahlzeitpunkten gemittelt wurde, die im Popupmenü festgelegt werden, wenn Diese Funktion verwendet wird.
- Drücken Sie Phase Map, um das Phasenzuordnungsmodul zu initiieren. Eine Hilbert-Transformation wird durchgeführt, um die momentane Phase (zwischen -- und +') der Signale zu jedem Zeitpunkt zu berechnen. Drücken Sie den Schieberegler " "Wiedergabe" oder "Ziehen", um das Phasenverhalten im Laufe der Zeit zu visualisieren, und klicken Sie auf ein Pixel, um ein Phasendiagramm zu rendern.
8. Exportieren von Daten
- Daten werden in einer Vielzahl von Formen aus ElectroMap exportiert. Drücken Sie Werte exportieren, um die Werte der aktuell angezeigten Karte in der hauptverwendeten Schnittstelle zu speichern. Gemessene Werte können entweder als Karte (Beibehalten von Pixelpositionen) oder in einer einzigen Liste komprimiert und als .csv,.txt oder gespeichert werden. MAT-Dateien.
- Drücken Sie Export Map, um ein Pop-up mit der aktuell angezeigten Karte anzuzeigen, die dann in einer Vielzahl von Bildformaten gespeichert werden kann. Die Anzeigeoptionen für die Karte werden durch Auswahl der Karteneinstellungen gesteuert, können aber auch bearbeitet werden, sobald die Karte exportieren ausgewählt wurde. Beispielsweise kann eine Farbleiste hinzugefügt werden, indem Sie dieses Symbol im oberen Menü auswählen, und der Maßstab kann durch Auswahl bearbeiten > Colormapfestgelegt werden.
- Drücken Sie Aktivierungsvideo, um eine Animation der Aktivierungssequenz zu rendern, die als animierte GIF-Datei gespeichert werden kann.
- Drücken Sie Segmentvideo, um eine .avi-Videodatei des aktuell angezeigten Parameters jedes identifizierten Segments zu speichern.
Ergebnisse
Alle arbeiten im Rahmen dieser Studie wurden in Übereinstimmung mit ethischen Leitlinien durchgeführt, die im UK Animals (Scientific Procedures) Act 1986 und der Richtlinie 2010/63/EU des Europäischen Parlaments über den Schutz von Tieren, die für wissenschaftliche Zwecke verwendet werden, festgelegt wurden. Die Experimente wurden vom Home Office (Maus: PPL 30/2967 und PFDAAF77F, Meerschweinchen: PPL PF75E5F7F) und den institutionellen Fachkollegien der University of Birmingham (Maus) und des King es College London (Meerschweinchen) genehmigt. Detaillierte Methoden zur Erfassung der hier analysierten Rohdaten finden Sie in unseren bisherigen Publikationen5,6,14,19.
Die Hauptschnittstelle, von der aus ElectroMap gesteuert wird, ist in Abbildung 1Adargestellt. Die erforderlichen Schritte zum Analysieren eines Datasets werden in erster Linie über die Schaltflächen Bilder laden, Verarbeiten von Bildernund Karten erzeugen gesteuert und in Abbildung 1Agrün, blau und rot hervorgehoben angezeigt. Abbildung 1B-D zeigt die Vorgänge, die bei der Auswahl jeder dieser Schaltflächen ausgeführt werden. "Bilder laden" wendet die vom Benutzer ausgewählten Bildschwellenoptionen an (Abbildung 1B), während Prozessbilder (Abbildung 1C) Filterung und Baselinekorrektur anwenden. Schließlich werden Karten zuerst gemäß den Zeitfenster- und Segmentierungseinstellungen ermittelt (es sei denn, es wird eine einzelne Beatsegmentierung ausgewählt) und dann die oben beschriebenen Analysen durchführen.
Ein wichtiger Aspekt von ElectroMap ist seine Flexibilität in Bezug auf Kameratyp und experimentelles Modell. Dies ist entscheidend für den Nutzen einer optischen Mapping-Software aufgrund der ausgeprägten herz-EP und anatomischen Eigenschaften, die zwischen weit verbreiteten Modellen existieren. Abbildung 2A zeigt z.B. das Wirkungspotential morphologie der murinen Vorhöfe im Vergleich zum Meerschweinchenventrikel, aufgezeichnet mit spannungsempfindlichen Farbstoffen wie zuvor berichtet6,14. Trotz der unterschiedlichen Form des Aktionspotenzials und der Verwendung von zwei separaten optischen Mapping-Kameras mit unterschiedlichen Frameraten und Pixelgrößen kann ElectroMap genutzt werden, um beide Datensätze erfolgreich zu analysieren. Dies erfordert jedoch eine Änderung einiger Parameter innerhalb der Benutzeroberfläche (Abbildung 2B). Beachten Sie, dass das verlängerte Meerschweinchen-Aktionspotenzial ein größeres Zeitfenster erfordert. Um zu verhindern, dass die Top-Hat-Baseline-Korrektur die optisch aufgezeichneten Signale unphysiologisch modifizieren, muss ihre Zeitlänge erhöht werden, so dass sie größer ist als der Zeitverlauf des Aktionspotentials.
ElectroMap bietet eine Vielzahl von Verarbeitungsoptionen, um den SNR von optisch aufgezeichneten Signalen zu verbessern, die erforderlich sein können, um EP-Parameter effektiv wiederherzustellen. Ein Beispiel ist die automatisierte Ensemble-Mittelung von Spitzen nach Datensegmentierung. Abbildung 3A-C zeigt, wie die Anwendung der Ensemblemittelung anstelle anderer Methoden SNR aus isolierten murinen linken Vorhöfen verbessern kann (n = 13). Dies reduziert die Messheterogenität und die Wahrscheinlichkeit eines Analysefehlers (Abbildung 3D). Zum Beispiel änderte eine Änderung der Schrittfrequenz von 3 Hz auf 10 Hz APD50nicht, wenn keine Ensemblemittelung durchgeführt wird, aber eine erwartete Abnahme von29 aPD50 bei 10 Hz-Takt wurde beobachtet, wenn sie anhand von Ensemble-Durchschnittsdaten gemessen wurde ( Abbildung 3E).
Abbildung 4 zeigt die Wirksamkeit und den Nutzen der automatisierten Tempofrequenzerkennung und -segmentierung, die von ElectroMap angeboten wird. Hier wurden Maus-Linke -Atria (n = 5) mit einer Zykluslänge von 120 ms und Zykluslänge schrittweise um 10 ms verkürzt, bis sie 50 ms erreichte. ElectroMap identifizierte automatisch die Taktzykluslänge und gruppierte Gewebegemittelspitzen entsprechend (Abbildung4A ). Dies wurde mit hoher Genauigkeit in allen Datensätzen erreicht (Abbildung 4B). Die automatisierte Segmentierung der Daten ermöglichte eine einfache und hohe Durchsatzanalyse der Verlangsamung der Leitungsgeschwindigkeit mit erhöhter Tempofrequenz/verkürzter Zykluslänge (Abbildung 4C,D). Gleichzeitig wurden APD50 (Abbildung 4E) und diastolisches Intervall (Abbildung 4F) verkürzt. Die Amplitude der optisch gemessenen Spitzen nahm ab, während die Zeit bis zum Höhepunkt zunahm (Abbildung 4G,H). Dies sind wiederum die erwarteten Restitutionsreaktionen im Herzgewebe29,30 und die Verwendung von ElectroMap kann daher helfen, Veränderungen als Reaktion auf Die Pacing-Frequenz in Gegenwart von pharmakologischen Wirkstoffen, genetische Modifikation, oder Krankheitszustände.
Ein wichtiger Aspekt bei der Verwendung einer Software wie ElectroMap ist das Vorhandensein von Artefakten in den zugrunde liegenden Daten. Abbildung 5zeigt beispielsweise, dass Bewegungsartefakte (die Verzerrung des optisch aufgezeichneten Signals durch Gewebebewegung) genaue Messungen der Aktivierung und insbesondere repolarisierenin innerhalb von ElectroMap ausschließen können. Weitere Überlegungen finden Sie unter Diskussion.
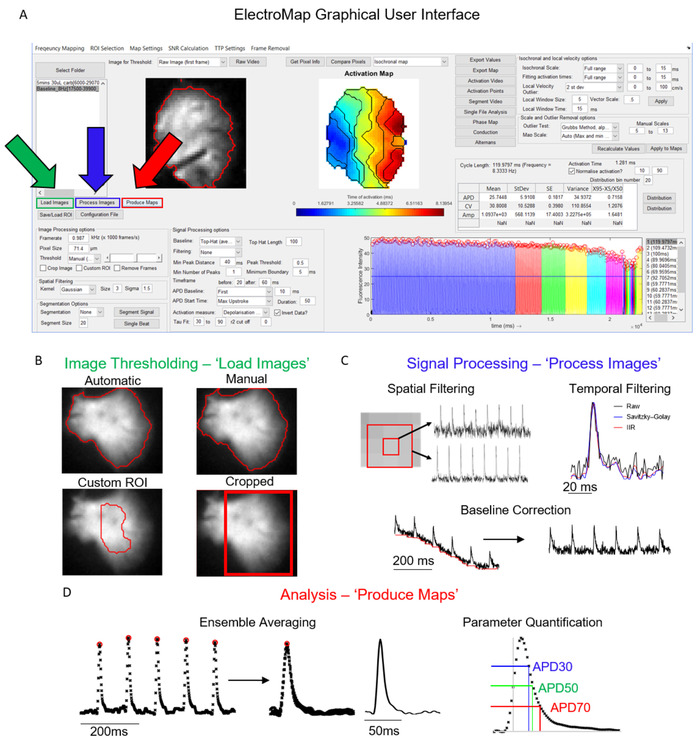
Abbildung 1: ElectroMap Hauptverarbeitungsschritte. (A) Grafische Benutzeroberfläche von ElectroMap, mit den Schaltflächen Bilder laden (grün), Prozessbilder (blau) und Karten erzeugen (rot). (B) Bildschwellenoptionen, die bei der Auswahl von Bilder ladenangewendet werden können. (C) Die dem Benutzer zur Verfügung stehenden Signalverarbeitungsoptionen umfassen räumliche und zeitliche Filterung und Baseline-Korrektur und können durch Drücken von Prozessbildernauf den Bildstapel angewendet werden. (D) Ensemblemittelung und Parameterquantifizierung (angezeigte APD-Messung), die durch Auswahl von Karten erzeugenaktiviert wird. Figur angepasst von O'Shea et al., 201913. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
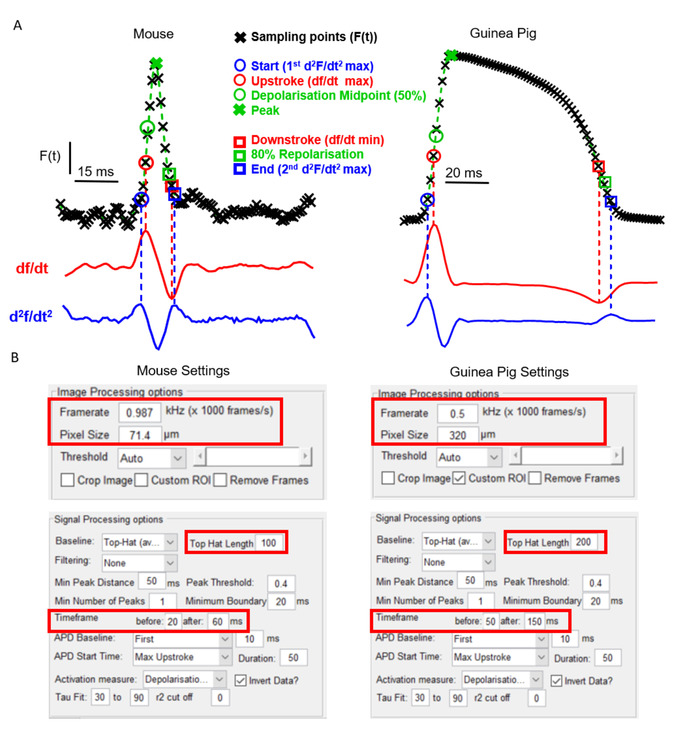
Abbildung 2: Analyse von Maus- und Meerschweinchendaten mit ElectroMap. (A) Optisch aufgezeichnetes Aktionspotential von Maus-Atria und Meerschweinchen-Ventrikeln, zusammen mit dem ersten (df/dt) und dem zweiten (d2f/dt2) Ableitung dieser Signale. Hervorgehoben werden die verschiedenen Definitionen für Aktivierungs- und Repolarisationszeiten, die in ElectroMap verwendbar sind. (B) Screenshots von Bild- und Signalverarbeitungseinstellungen, die in der ElectroMaps-Schnittstelle verwendet werden. Rote Felder markieren Einstellungen, die eine Änderung zwischen den Analysen von Maus- und Meerschweinchendaten erforderten. Figur angepasst von O'Shea et al., 201913. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
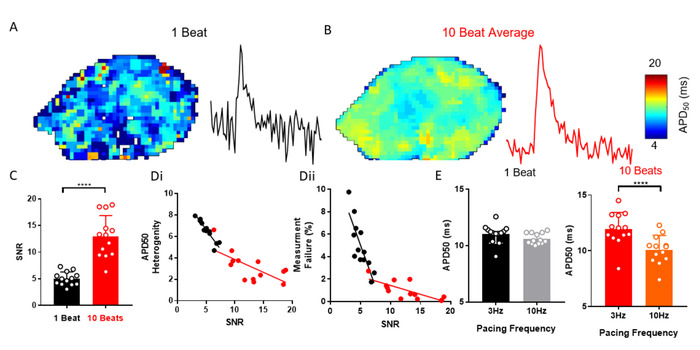
Abbildung 3: Ensemblemittelung zum Beheben von APD-Änderungen. (A) APD50 Karte und Beispiel Einzelpixelsignal von einzelnen Beat optischen Aktionspotentialen. (B) APD50 Karte und Beispiel Einzelpixelsignal aus optischen Aktionspotentialen durch Ensemble-Mittelung von 10 aufeinanderfolgenden Beats (Spitzenmethode) erzeugt. (C) SNR des Einzelbeats im Vergleich zu 10 beat durchschnittlichen Signalen. (D) APD50 Heterogenität (i) und Anzahl der Messfehler (ii) als Funktion von SNR für Single Beat und 10 beatd aPD50 Maps. (E) APD50 bei 3 und 10 Hz Schrittfrequenz, gemessen anhand von Einzelschlag- und 10 Beatkarten. (Daten, die als mittelwerter Standardfehler, n = 13 linke Vorhöfe, ****p < 0,001 durch den gekoppelten t-Test des Schülers angezeigt werden). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
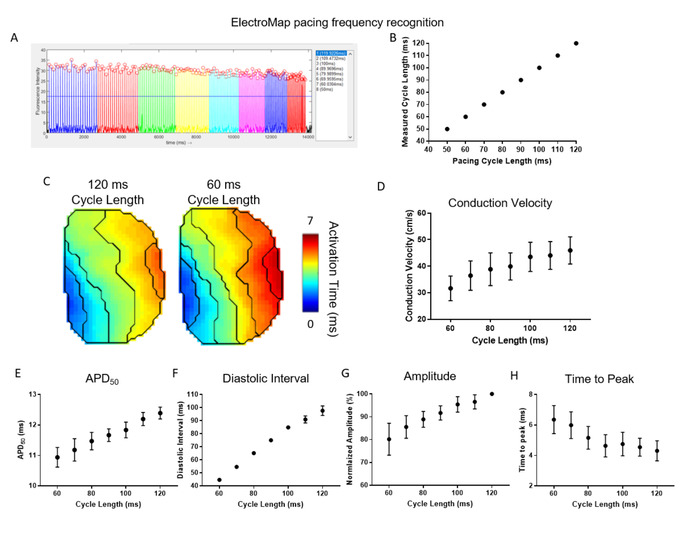
Abbildung 4: Verwendung von ElectroMap zur Untersuchung von Tempofrequenzreaktionen im Herzgewebe. (A) Beispiel ElectroMap Screenshot der Schrittfrequenzerkennung und Segmentierung. (B) Vergleich der bekannten und ElectroMap gemessenen Tempozykluslängen. (C) Aktivierungskarten mit 120 ms und 60 ms Schrittzykluslängen. (D-H) Gruppierte Daten der Leitungsgeschwindigkeit (D), APD50 (E), diastolisches Intervall (F), Amplitude (G) und Zeit bis Zur Spitze (H) als Funktion der Schrittzykluslänge, die von 120 ms auf 60 ms in 10 ms Schritten abnimmt. (Daten, die als Mittelwert angezeigt werden, Standardfehler, n = 5 linke Vorhöfe) Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
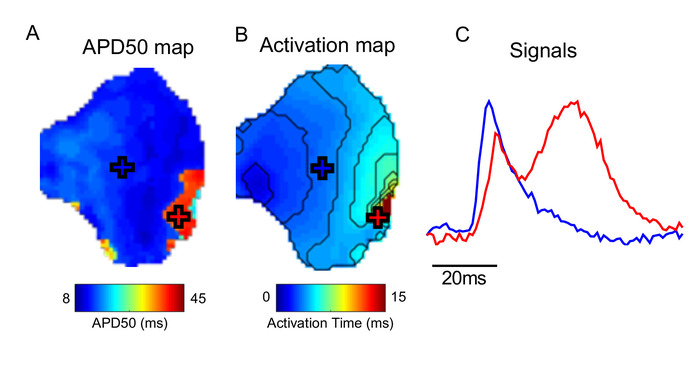
Abbildung 5: Wirkung von Bewegungsartefakten. (A) APD50 Karte. (B) Aktivierungskarte. (C) Beispielsignale von Orten, die auf APD- und Aktivierungskarten markiert sind (Kreuze). Im Bereich des mit dem Roten Kreuz markierten Gewebes wurde die Kontraktion nicht erfolgreich entkoppelt, wodurch das gemessene optische Signal verzerrt wurde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Hier stellen wir eine Schritt-für-Schritt-Anleitung für den Einsatz der Open-Source-Software ElectroMap zur flexiblen und multivariablen Analyse von kardialen optischen Mapping-Datensätzen vor. Für den erfolgreichen Einsatz von ElectroMap müssen bildgebende Daten in .tif oder sein. MAT-Formate. ElectroMap enthält mehrere veränderbare Benutzereinstellungen. Wie in Abbildung 2Agezeigt, ist dies aufgrund der großen Heterogenität zwischen experimentellen Modellen und bildgebender Hardware erforderlich. Dies bedeutet jedoch, dass die Standardeinstellungen innerhalb der Software nicht immer optimal sind, so dass ein kritischer Schritt bei der Verwendung der Software für den Benutzer ist, die Einstellungen für ihre spezielle experimentelle Einrichtung zu optimieren. Dazu gehören Kameraeinstellungen und Zeitskalen, wie in Abbildung 2Bdargestellt. Sobald optimale Einstellungen gefunden wurden, können diese gespeichert und zu späteren Zeiten neu geladen werden, indem Sie Konfigurationsdateiauswählen.
Die Integration der automatisierten CL-Messung und Signalsegmentierung sind die wichtigsten Vorteile der Software. Diese Merkmale ermöglichen die Analyse akuter Reaktionen in experimentellen Aufnahmen und erweitern die Analyse von der Fokussierung auf isolierte Einzelschläge. Sobald die gewünschte Segmentierung erreicht ist, ermöglicht das Modul Single File Analysis die automatisierte Analyse jedes einzelnen Segments (einschließlich einzelner Beats) und realisiert eine Analyse mit hohem Durchsatz mehrerer Variablen über die in einem einzelne .csv-Datei. In Verbindung mit der Ensemble-Mittelung von gruppierten Peaks ist eine effektive Methode zur Verbesserung der Qualität von lauten Signalen, die automatisch in ElectroMap ausgeführt wird. Die Mittelung des Ensembles ist jedoch nicht allgegenwärtig vorteilhaft, zum Beispiel in Studien zur Beat-to-Beat-Variabilität. Daher integriert ElectroMap die Single-Beat-Segmentierung, um Ensemble-Mittelung, alternative Verarbeitungsoptionen zur Verbesserung der SNR (räumliche und zeitliche Filterung) zu vermeiden, und umfasst das Analysemodul Alternans, um die Beat-to-Beat-Variabilität.
Optische Mapping-Datasets weisen häufig Artefakte wie Basisdrift und Bewegungsartefakte auf. Ebenso können die erzeugten Signale aufgrund kleiner Pixelgrößen, kurzer Belichtungszeiten und geringer fraktionierter Fluoreszenzänderungen2von geringer Qualität sein. Diese Faktoren verhindern eine effektive und genaue Analyse des zugrunde liegenden EP-Verhaltens. Wie bereits beschrieben, verfügt ElectroMap über mehrere Verarbeitungsstrategien, um diese Probleme zu überwinden. Die Anwendung dieser Algorithmen auf grundlegend schlechte Qualität/verzerrte Daten wird jedoch weiterhin eine effektive Analyse verhindern. SNR ist daher einer der Parameter, die in ElectroMap gemessen und angezeigt werden. Ebenso kann der Benutzer die Signale aus bestimmten Regionen aus dem Beispiel mithilfe der Pixel-Info- und Vergleichsmodule auswählen und vergleichen, so dass Phänomene wie Bewegungsartefakte, die in Abbildung 5dargestellt sind, und Ausschluss von Daten.
Derzeit unterstützt ElectroMap das Entfernen von Bewegungsartefakten aus Rohdaten nicht in der gleichen Weise wie die Baseline-Korrektur. Daher ist eine mögliche zukünftige Entwicklung der Software die Einbeziehung der Bewegungsartefakt Entfernung durch Rechenmethoden, wie berichtet31,32. Darüber hinaus beschränkt sich ElectroMap derzeit auf die Untersuchung eines optischen Signals. Für ratiometrische Farbstoffe und die gleichzeitige Verwendung von Spannungs- und Kalziumfarbstoffen27ist jedoch eine gleichzeitige Verarbeitung von zwei Wellenlängenkanälen erforderlich. Die Integration der Dual-Signal-Analyse ist daher eine wichtige zukünftige Ergänzung der Software. Die Erweiterung der Analyseoptionen für arrhythmische Datensätze, wie z. B. Phasensingularitätsverfolgung, würde den Anwendungsbereich der Software ebenfalls erweitern33,34. Schließlich können einige der beschriebenen Analyseoptionen auch bei der Analyse der Elektrodenzuordnungsdaten nützlich sein. Tatsächlich wurde ElectroMap verwendet, um Elektroden-Mapping-Daten trotz der kontrastierenden Elektrogramm-Wellenform20,35zu analysieren, und eine weitere Optimierung wird seine Verwendung für diese Modalität erweitern.
Offenlegungen
P.K. erhält Forschungsunterstützung von mehreren Pharma- und Geräteunternehmen, die im Vorhofflimmern tätig sind, und wurde von mehreren solchen Unternehmen ausgezeichnet. L.F. erhielt institutionelle Forschungsstipendien EU, BHF, MRC, DFG und Gilead. P.K. und L.F. sind als Erfinder auf zwei Patenten der University of Birmingham gelistet (Atrial Fibrillation Therapy WO 2015140571, Markers for Atrial Fibrillation WO 2016012783).
Alle anderen Autoren erklären keinen potenziellen Interessenkonflikt.
Danksagungen
Diese Arbeit wurde von der EPSRC-Studentenschaft (Sci-Phy-4-Health Centre for Doctoral Training L016346) an D.P. K.R. und L.F., Wellcome Trust Seed Award Grant (109604/Z/15/Z) an D.P., British Heart Foundation Grants (PG/17/55/33087, RG/17/15/33106) an D.P. , Europäische Union (Grant Agreement No 633196 [CATCH ME] an P.K. und L.F.), British Heart Foundation (FS/13/43/30324 an P.K. und L.F.; PG/17/30/32961 an P.K. und A.H.) und Leducq Foundation an P.K. J.W. wird von der British Heart Foundation (FS/16/35/31952) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| MATLAB and Simulink R2018a | Mathworks, Inc, Natick, MA | MATLAB software |
Referenzen
- Efimov, I. R., Nikolski, V. P., Salama, G. Optical Imaging of the Heart. Circulation Research. 94, 21-33 (2004).
- Herron, T. J., Lee, P., Jalife, J. Optical imaging of voltage and calcium in cardiac cells & tissues. Circulation Research. 110, 609-623 (2012).
- Boukens, B. J., Efimov, I. R. A century of optocardiography. IEEE Reviews in Biomedical Engineering. 7, 115-125 (2014).
- Myles, R. C., Wang, L., Kang, C., Bers, D. M., Ripplinger, C. M. Local β-adrenergic stimulation overcomes source-sink mismatch to generate focal arrhythmia. Circulation Research. 110, 1454-1464 (2012).
- Syeda, F., et al. PITX2 Modulates Atrial Membrane Potential and the Antiarrhythmic Effects of Sodium-Channel Blockers. Journal of the American College of Cardiology. 68, 1881-1894 (2016).
- Winter, J., et al. Sympathetic nervous regulation of cardiac alternans in the intact heart. Frontiers in Physiology. 9, 1-12 (2018).
- Faggioni, M., et al. Suppression of spontaneous ca elevations prevents atrial fibrillation in calsequestrin 2-null hearts. Circulation: Arrhythmia and Electrophysiology. 7, 313-320 (2014).
- Sato, P. Y., et al. Loss of Plakophilin-2 Expression Leads to Decreased Sodium Current and Slower Conduction Velocity in Cultured Cardiac Myocytes. Circulation Research. 105, 523-526 (2009).
- Yu, T. Y., et al. Optical mapping design for murine atrial electrophysiology. Computer Methods in Biomechanics and Biomedical Engineering: Imaging & Visualization. 5, 368-378 (2017).
- Laughner, J. I., Ng, F. S., Sulkin, M. S., Arthur, R. M., Efimov, I. R. Processing and analysis of cardiac optical mapping data obtained with potentiometric dyes. American Journal of Physiology. Heart and Circulatory Physiology. 303, H753-H765 (2012).
- Crocini, C., Ferrantini, C., Pavone, F. S., Sacconi, L. Optogenetics gets to the heart: A guiding light beyond defibrillation. Progress in Biophysics and Molecular Biology. 130, 132-139 (2017).
- Entcheva, E., Bub, G. All-optical control of cardiac excitation: Combined high-resolution optogenetic actuation and optical mapping. The Journal of Physiology. 9, 2503-2510 (2016).
- O’Shea, C., et al. ElectroMap: High-throughput open-source software for analysis and mapping of cardiac electrophysiology. Scientific Reports. 9, 1-13 (2019).
- Yu, T. Y., et al. An automated system using spatial oversampling for optical mapping in murine atria. Development and validation with monophasic and transmembrane action potentials. Progress in Biophysics and Molecular Biology. 115, 340-348 (2014).
- Jaimes, R., et al. Functional response of the isolated, perfused normoxic heart to pyruvate dehydrogenase activation by dichloroacetate and pyruvate. Pflugers Archiv. 468, 131-142 (2016).
- Wang, K., et al. Cardiac tissue slices: preparation, handling, and successful optical mapping. American Journal of Physiology. Heart and Circulatory Physiology. 308, H1112-H1125 (2015).
- Parrish, D. C., et al. Transient denervation of viable myocardium after myocardial infarction does not alter arrhythmia susceptibility. American Journal of Physiology. Heart and Circulatory. , (2017).
- Ihara, K., et al. Electrophysiological Assessment of Murine Atria with High-Resolution Optical Mapping. Journal of Visualized Experiments. (132), e56478 (2018).
- Holmes, A. P., et al. A Regional Reduction in Ito and IKACh in the Murine Posterior Left Atrial Myocardium Is Associated with Action Potential Prolongation and Increased Ectopic Activity. Plos One. 11, e0154077 (2016).
- Lang, D., et al. Arrhythmogenic remodeling of β2 versus β1 adrenergic signaling in the human failing heart. Circulation: Arrhythmia and Electrophysiology. 8, 409-419 (2015).
- Kang, C., et al. Human Organotypic Cultured Cardiac Slices: New Platform For High Throughput Preclinical Human Trials. Scientific Reports. 6, 1-13 (2016).
- Wen, Q., et al. Transverse cardiac slicing and optical imaging for analysis of transmural gradients in membrane potential and Ca2+ transients in murine heart. The Journal of Physiology. 596, 3951-3965 (2018).
- Houston, C., et al. Characterisation of re-entrant circuit (or rotational activity) in vitro using the HL1-6 myocyte cell line. Journal of Molecular and Cellular Cardiology. 119, 155-164 (2018).
- Yu, T. Y., et al. Optical mapping design for murine atrial electrophysiology. Computer Methods in Biomechanics and Biomedical Engineering: Imaging and Visualization. 5, 368-376 (2017).
- Laughner, J. I., Ng, F. S., Sulkin, M. S., Arthur, R. M., Efimov, I. R. Processing and analysis of cardiac optical mapping data obtained with potentiometric dyes. AJP: Heart and Circulatory Physiology. 303, H753-H765 (2012).
- Bayly, P. V., et al. Estimation of Conduction Velocity Vector Fields from Epicardial Mapping Data. IEEE Transactions on Bio-Medical Engineering. 45, 563-571 (1998).
- Jaimes, R., et al. A technical review of optical mapping of intracellular calcium within myocardial tissue. American Journal of Physiology. Heart and Circulatory Physiology. 310, H1388-H1401 (2016).
- Wang, L., et al. Optical mapping of sarcoplasmic reticulum Ca2+ in the intact heart: Ryanodine receptor refractoriness during alternans and fibrillation. Circulation Research. 114, 1410-1421 (2014).
- Winter, J., Shattock, M. J. Geometrical considerations in cardiac electrophysiology and arrhythmogenesis. Europace. , (2016).
- Mironov, S., Jalife, J., Tolkacheva, E. G. Role of conduction velocity restitution and short-term memory in the development of action potential duration alternans in isolated rabbit hearts. Circulation. 118, 17-25 (2008).
- Khwaounjoo, P., et al. Image-Based Motion Correction for Optical Mapping of Cardiac Electrical Activity. Annals of Biomedical Engineering. 43, 1235-1246 (2014).
- Christoph, J., Luther, S. Marker-Free Tracking for Motion Artifact Compensation and Deformation Measurements in Optical Mapping Videos of Contracting Hearts. Frontiers in Physiology. 9, (2018).
- Umapathy, K., et al. Phase Mapping of Cardiac Fibrillation. Circulation: Arrhythmia and Electrophysiology. 3, 105-114 (2010).
- Tomii, N., et al. Detection Algorithm of Phase Singularity Using Phase Variance Analysis for Epicardial Optical Mapping Data. IEEE Transactions on Biomedical Engineering. 63, 1795-1803 (2016).
- Cantwell, C. D., et al. Techniques for automated local activation time annotation and conduction velocity estimation in cardiac mapping. Computers in Biology and Medicine. 65, (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten