Method Article
Analyse à haut débit des données de cartographie optique à l'aide d'ElectroMap
Dans cet article
Résumé
Ce protocole décrit la configuration et l'utilisation d'ElectroMap, une plate-forme logicielle open source basée sur MATLAB pour l'analyse des données de cartographie optique cardiaque. ElectroMap fournit un outil polyvalent à haut débit pour l'analyse de la tension de cartographie optique et des ensembles de données de calcium à travers un large éventail de modèles expérimentaux cardiaques.
Résumé
La cartographie optique est une technique établie pour l'étude de résolution spatio-temporelle élevée de l'électrophysiologie cardiaque dans les préparations multicellulaires. Nous présentons ici, dans un guide étape par étape, l'utilisation d'ElectroMap pour l'analyse, la quantification et la cartographie des ensembles de données de tension et de calcium à haute résolution acquis par la cartographie optique. Les options d'analyse ElectroMap couvrent une grande variété de paramètres électrophysiologiques clés, et l'interface utilisateur graphique permet une modification simple des définitions de prétraitement et de paramètres, rendant ElectroMap applicable à un large éventail de modèles expérimentaux. Nous montrons comment la détection de fréquences et la segmentation des signaux intégrées permettent une analyse à haut débit d'enregistrements expérimentaux entiers, des réponses aigues et une variabilité unique de battement à battement. En outre, ElectroMap intègre la moyenne multi-battement automatisée pour améliorer la qualité du signal des jeux de données bruyants, et ici nous démontrons comment cette fonctionnalité peut aider à élucider les changements électrophysiologiques qui pourraient autrement passer inaperçus lors de l'utilisation unique l'analyse de battement. Des modules personnalisés sont inclus dans le logiciel pour une enquête détaillée sur la conduction, l'analyse de fichiers uniques et les alternans, comme il est démontré ici. Cette plate-forme logicielle peut être utilisée pour permettre et accélérer le traitement, l'analyse et la cartographie de l'électrophysiologie cardiaque complexe.
Introduction
La cartographie optique utilise des reporters fluorescents de tension et/ou de concentration de calcium pour interroger l'électrophysiologie cardiaque (EP) et la manipulation du calcium dans les préparations multicellulaires, avec une plus grande résolution spatiale que ce qui est réalisable avec les techniques1,2,3. Par conséquent, la cartographie optique a émergé comme une technique importante et de plus en plus utilisé, fournissant des informations clés sur le comportement électrique physiologique et pathophysiologique dans le cœur3,4,5 ,6,7,8. Le traitement et l'analyse efficaces des données obtenues à partir d'expériences de cartographie optique sont compliqués par plusieurs facteurs. La nature de résolution spatiotemporelle élevée des jeux de données de cartographie optique se traduit par des fichiers vidéo bruts composés de milliers d'images, chacune composée d'un certain nombre de pixels individuels, donnant lieu à de fichiers de données volumineux qui nécessitent un débit élevé et automatisés traitement9. Les petites tailles de pixels, la charge de colorant pauvre et inégale et les petits changements fractionnels de fluorescence entraînent des signaux optiques avec un faible rapport signal/bruit (SNR), nécessitant un prétraitement avant qu'une analyse efficace ne soit réalisable10. Le traitement et l'analyse peuvent être encore compliqués par l'utilisation de protocoles de stimulation optogénétique qui utilisent la lumière pour initier l'activation, ce qui peut fausser le signal enregistré des capteurs fluorescents11,12. En outre, une fois les données traitées, plusieurs techniques et définitions non cohérentes peuvent être appliquées pour mesurer les paramètres d'intérêt, les techniques les plus applicables variant en fonction de la configuration expérimentale, du modèle et de la question2, 10,13. Ces limitations empêchent l'apaisement de la technologie et entravent une analyse véritablement objective.
Pour surmonter ces limites, plusieurs groupes de recherche ont conçu des pipelines de traitement personnalisés adaptés à leur modèle expérimental, question et matériel7,14,15,16. D'autres utilisent des logiciels propriétaires commerciaux où les algorithmes sous-jacents peuvent être difficiles d'accès4,17. Par conséquent, il est clairement nécessaire d'avoir une plate-forme logicielle open source disponible gratuitement pour le traitement et l'analyse des données de cartographie optique. Il est important que ce logiciel soit open-source, facile à utiliser, flexible à l'ajustement des paramètres, applicable à une gamme de modèles expérimentaux avec des propriétés EP distinctes et permet de façon cruciale quantification directe et réglable de la gamme de cardiaques paramètres qui peuvent être étudiés à l'aide de la cartographie optique.
Nous avons récemment publié et publié une plate-forme logicielle complète, ElectroMap, pour le traitement, l'analyse semi-automatisée et de haut niveau, l'analyse et la cartographie des ensembles de données de cartographie optique cardiaque13. Ici, nous présentons un manuel vidéo pour l'utilisation d'ElectroMap et démontrons comment il peut être utilisé pour traiter, analyser et cartographier plusieurs ensembles de données de cartographie optique. Nous nous concentrons sur l'utilisation d'ElectroMap pour quantifier les variables standard de traitement de l'EP et du calcium et démontrer l'utilisation de la vitesse de conduction autonome, de l'analyse de fichiers uniques et des modules d'alternans.
Protocole
1. Collecte de données de cartographie optique
- Effectuer la cartographie optique cardiaque à l'aide d'un large éventail de modèles expérimentaux, y compris intacts et isolés cœurs entiers6,18, atri14isolés,19, coins ventriculaires20, tranches cardiaques 21 Ans, états-unis , 22, et monocouches cellulaires23. Voir les références associées pour les conceptions expérimentales pour recueillir des données brutes de cartographie optique à partir de ces préparations. A condition que les données obtenues puissent être converties en pile tiff ou enregistrées dans un . Fichier MAT, il doit être analysable à l'aide d'ElectroMap. Cela comprend les données de dimensions variables (carré/rectangulaire) et les résolutions (maximum testé actuellement 2048 pixels x 2048 pixels).
2. Installation et démarrage de logiciels
REMARQUE: Ci-dessous sont détaillées les deux méthodes d'installation et d'exécution ElectroMap - soit dans MATLAB exécuter à partir du code source (.m) ou comme un fichier exécutable autonome (.exe pour les fenêtres). Le logiciel final et sa fonctionnalité sont invariants entre les deux options d'configuration (autres que quelques différences dans la navigation d'annuaire). Par conséquent, les principales considérations pour le choix de la version à installer sont l'accès à MATLAB et les boîtes à outils requises et si l'accès au code source est souhaité. Dans la mesure du possible, il est recommandé d'utiliser la version MATLAB pour des temps de démarrage plus rapides, des délais de traitement plus courts et des rapports d'erreur plus faciles.
-
Configuration 1 : Exécution de l'électromap dans MATLAB
- Installer MATLAB. ElectroMap a été conçu dans MATLAB 2017a, cependant, le logiciel a été testé pour une utilisation dans toutes les versions ultérieures de MATLAB (jusqu'en 2018b au moment de la rédaction). Les boîtes à outils suivantes sont requises : Traitement d'images, traitement des signaux, statistiques et apprentissage automatique, et ajustement des courbes.
- Téléchargez/clonez tous les fichiers du dernier «code source» de ElectroMap à partir du référentiel GitHub (https://github.com/CXO531/ElectroMap). Décompressez le contenu téléchargé à un endroit désiré.
- Ouvrez MATLAB et naviguez vers l'emplacement du dossier hébergeant le code source ElectroMap. Ensuite, ouvrez le fichier ElectroMap.m et appuyez sur exécuter dans l'éditeur, ou alternativement taper ElectroMap dans la fenêtre de commande et appuyez sur RETURN. Cela va démarrer l'interface utilisateur ElectroMap, Figure 1A.
-
Configuration 2: Fichier Standalone .exe
- Téléchargez le fichier d'installateur : https://drive.google.com/open?id=1nJyI07w9WIt5zWcit0aEyIbtg31tANxI.
- Suivez les instructions dans l'installateur, qui téléchargera le temps d'exécution MATLAB requis à partir du web aux côtés du logiciel ElectroMap.
- Exécuter ElectroMap.exe.
REMARQUE : Le temps de démarrage de la version autonome peut prendre plusieurs minutes.
3. Chargement et prétraitement d'images
- Appuyez sur Sélectionnez le dossier et naviguez vers l'emplacement du fichier de données à analyser. Cela remplira la boîte de liste de gauche avec tous les fichiers dans ce répertoire qui sont du type de fichier correct (.tif ou . MAT). . Les fichiers MAT ne doivent contenir que la variable de pile d'images.
REMARQUE : Seuls les dossiers et non les fichiers individuels apparaîtront lorsque vous naviguerez dans le sélecteur d'annuaires. - Sélectionnez le fichier à charger à partir de l'interface et appuyez sur Charger Images.
- Une fois chargé, le premier cadre apparaîtra, et le contour rouge indiquera le seuil automatique de l'image. Si nécessaire, rechargez les ROI déjà utilisés en sélectionnant Save/Load ROI. Dans ce cas, sautez l'étape 3.3.
- Par défaut, le seuil est basé sur les intensités de pixels dans la première image. Si vous le souhaitez, modifiez ceci à un seuil basé sur l'amplitude du cours de temps de signal en modifiant l'option dans l'image pour le menu de dépérage de seuil. Veuillez noter qu'une fois le seuil sélectionné, il est ensuite appliqué pour l'ensemble de la pile d'images.
- Si vous le souhaitez, changer l'option de seuil en manuel, qui activera le curseur pour ajuster manuellement le seuil d'image. En outre, les images de cultures (Crop Image) et/ou dessinent une région d'intérêt personnalisée (Custom ROI) pour analyse en sélectionnant la case à cocher (es) appropriée en dessous des options de seuil. Notez que des options avancées pour la sélection de la région d'intérêt, telles que le nombre de zones sont disponibles à partir de la sélection roi du menu supérieur.
- Une fois qu'un seuil approprié a été appliqué, appuyez sur Process Images pour appliquer le traitement. Les paramètres de traitement sont détaillés ci-dessous (étape 3.4.1-3.4.5). À ce stade, assurez-vous que les réglages corrects de la caméra ont été entrés. Il s'agit de la taille des pixels en m (IMPORTANT : il s'agit de la taille du pixel d'image, et non de la taille des pixels qui composent la puce ou le matériel équivalent dans l'appareil d'imagerie) et Framerate en kHz.
- Pour l'inversion de signal, cochez la case de contrôle Invert Data pour activer. Si le signal fluorescent signalé est inversement proportionnel au paramètre d'intérêt (comme pour les colorants potentiométriques couramment utilisés), le signal peut être inversé.
- Pour le filtrage spatial, sélectionnez Gaussian ou Average dans le menu du noyau. La taille de la zone moyenne spatiale est contrôlée par l'entrée taille adjacente au menu de déclassement du noyau (c'est-à-dire 3 résultats dans un noyau de filtre de 3 pixels x 3 pixels). Lors de l'application d'un filtre Gaussian, l'écart standard peut également être réglé à partir de l'entrée Sigma.
- Pour la correction de base, sélectionnez Top-hat24 ou polynomial (4e ou 11e degré) correction25 du menu Baseline. La correction peut être appliquée à chaque pixel individuellement (long temps de traitement) ou comme une moyenne de l'image entière (plus rapide mais suppose des modifications de base homogènes). La correction du chapeau supérieur peut également être modifiée en définissant la longueur du chapeau supérieur en millisecondes, à côté du menu de sélection de base. La longueur du noyau Top-Hat devrait être supérieure à l'échelle de temps des potentiels d'action individuels/transitoires de calcium.
- Pour le filtrage temporel, sélectionnez Savitzky-Goaly ou le filtrage d'impulsion infinie (IIR) à partir du menu De filtrage.
REMARQUE : À l'autre pas du signal moyen tissulaire qui apparaît en bas à gauche, le filtrage temporel est appliqué à chaque pixel individuellement au moment de la quantification des paramètres à partir des plages d'images moyennes de l'ensemble. Cela a été mis en œuvre pour réduire le temps de traitement en filtrant de petites sections de données au besoin plutôt que des fichiers entiers. - Pour la suppression du cadre, notez que si l'option Supprimer les cadres est sélectionnée, de grands pics avec amplitude supérieur au signal d'intérêt peuvent être supprimés de l'ensemble d'images. Cela peut être utile dans les jeux de données au rythme optique tels que le rythme optogénétique où la dépolarisation est initiée par l'activation optique d'opsines telles que channelrhodopsin211,12.
REMARQUE : Comme la suppression du cadre pourrait introduire des changements d'étape non physiologiques dans les signaux d'image, le filtrage temporel peut introduire des artefacts dans les données et n'est donc pas recommandé ici.
- Notez que le signal sera segmenté une fois que Process Images aura été sélectionné en fonction des options dans le cadre des options de segmentation,mais cela peut être rapidement modifié sans retraitement de l'ensemble de données (voir la section 4).
4. Segmentation des données et moyenne des ensembles
REMARQUE : Une fois le fichier traité, les pics dans le signal moyen tissulaire (trace inférieure droite, figure 1A)auront été détectés et étiquetés par des cercles rouges. Seuls les pics au-dessus d'un seuil fixé (ligne bleue sur trace qui est fixée par Seuil de pic) sont comptés. De plus, les pics ne sont comptabilisés que s'ils sont suffisamment retardés par rapport aux pics précédents, fixés par l'entrée Min Peak Distance. Le signal est ensuite segmenté en fonction des pics détectés. Tout d'abord, la longueur effective du cycle (CL) de chaque pic est calculée en mesurant le temps entre elle et le pic suivant. Si un certain nombre de pics (fixés par Min Number of Peaks input) ont des CL similaires (seuil pour lequel est fixé par entrée limite minimale), alors ils sont regroupés et le CL moyen pour ces pics calculé.
- Pour une segmentation plus poussée des données, appuyez sur Segment Signal. Les options de sous-segmentation sont les suivantes : Aucun , tous des pics avec le même CL regroupés ; Tous les segments depics n dans les temps Constants De CL (lespics n sont définis par l'entrée de taille du segment) sont identifiés ; Dernière - Derniersn pics avant un changement CL sont identifiés et regroupés, et tous les autres ne sont pas analysés; et Single Beat - Cela équivaut à l'application de la segmentation All avec despics n 1, et donc aucun regroupement ou ensemble en moyenne (voir 4.5) sont appliqués. Cela peut être appliqué en sélectionnant le bouton Single Beat.
- Appliquer la segmentation personnalisée du signal en zoomant sur un moment d'intérêt et en sélectionnant Segment Signal. Cela ajoutera une option supplémentaire intitulée Section Zoomed à la case liste de section, correspondant aux points de temps sélectionnés.
- Les résultats de la segmentation apparaîtront dans la boîte à liste adjacente au signal moyen des tissus, et afficheront le nombre de sections et le CL estimé. Toutes les sections de temps segmentées sont indiquées par différentes couleurs. Sélectionnez un segment de la boîte à liste pour mettre en évidence cette section en rouge. Cela déclenchera également automatiquement des analyses de cette section, comme si le bouton Produce Maps avait été sélectionné (voir la section 5).
- Des analyses des pics groupés seront effectuées sur les données « moyennes d'ensemble ». Il s'agit de faire la moyenne des pics d'un segment ensemble, les temps de référence étant les pics identifiés à l'étape 4.2. Mettre à jour la fenêtre de temps à la moyenne en modifiant les entrées avant et après et en appuyant sur Le signal de segment.
5. Analyse de la durée transitoire du potentiel d'action/calcium et de la vitesse de conduction
- Une fois les images traitées, le bouton Produce Maps devient actif. Appuyez sur Produce Maps pour appliquer la durée potentielle d'action (APD), le temps d'activation, la vitesse de conduction et l'analyse SNR. Par défaut, l'analyse sera appliquée au premier segment de signal. Sélectionnez d'autres segments de la liste-boîte appliquera l'analyse au segment choisi.
REMARQUE : Les résultats de l'analyse sont affichés dans le tableau des résultats, y compris la moyenne, l'écart type, l'erreur type, la variance et l'analyse du 5e au 95e percentile. Les cartes de durée sont appelées cartes 'APD' cependant, les signaux de calcium traités à l'aide des mêmes paramètres mesureront la durée transitoire du calcium. - Sélectionnez Obtenez Pixel Info pour voir un affichage détaillé du signal à partir de n'importe quel pixel dans l'image, et Comparez les pixels pour tracer simultanément les signaux à partir de jusqu'à 6 emplacements.
- Utilisez le panneau de traitement des signaux pour ajuster les paramètres pour l'analyse de la durée. Il s'agit de: Durée - Temps de repolarisation/décroissance en pourcentage pour mesurer à partir du pic; 'APD' Baseline - Période de temps du signal qui est définie comme référence de référence pour les mesures de l'amplitude; et 'APD' Heure de début - Heure de début pour les mesures de durée. Ce sont les mêmes options pour décider du temps d'activation pour les cartes isochronales (voir ci-dessous) et sont appelés: Démarrer ( d2F/dt2max), Upstroke (dF/dtmax), Depolarisation midpoint (temps d'amplitude de 50%), Pic (temps d'amplitude maximale). Ces définitions appliquées aux potentiels d'action des souris et des cobayes sont présentées à la figure 2A.
REMARQUE : La modification de l'une de ces options mettra automatiquement à jour la carte de durée et le tableau des résultats. L'échelle de la carte et des options de suppression aberrantes sont également disponibles.
- Utilisez le panneau de traitement des signaux pour ajuster les paramètres pour l'analyse de la durée. Il s'agit de: Durée - Temps de repolarisation/décroissance en pourcentage pour mesurer à partir du pic; 'APD' Baseline - Période de temps du signal qui est définie comme référence de référence pour les mesures de l'amplitude; et 'APD' Heure de début - Heure de début pour les mesures de durée. Ce sont les mêmes options pour décider du temps d'activation pour les cartes isochronales (voir ci-dessous) et sont appelés: Démarrer ( d2F/dt2max), Upstroke (dF/dtmax), Depolarisation midpoint (temps d'amplitude de 50%), Pic (temps d'amplitude maximale). Ces définitions appliquées aux potentiels d'action des souris et des cobayes sont présentées à la figure 2A.
- La vitesse de conduction est également mesurée automatiquement dans l'interface logicielle principale. Ceci est réalisé en utilisant la méthode multi-vectorderie de Bayly et al26 à partir de la carte isochronale définie par la mesure d'activation choisie (discutée à l'étape 5.4). Appuyez sur Les points d'activation pour rendre une représentation 3D de la carte d'activation.
- La méthode de mesure de la vitesse de conduction multivectorielle segmente spatialement la carte isochronale en régions de n x n pixels. Définir la valeur de n à l'aide de l'entrée de taille de fenêtre locale, et définir la plage de temps d'activation pour appliquer l'analyse à l'aide des entrées de temps d'activation de montage.
REMARQUE: Pour chaque région locale, une surface polynomiale, f, est équipé qui décrit le mieux la relation entre le temps d'activation et la position spatiale, (x,y). Le vecteur de gradient, CVlocal,de cette surface est alors calculé comme :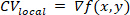 ①
①
où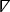 dénote l'opérateur différentiel spatial cartésien bidimensionnel26.
dénote l'opérateur différentiel spatial cartésien bidimensionnel26. - Pour chaque pixel de la carte isochronale, un vecteur local représentant la vitesse et la direction de la conduction est calculé. Sélectionnez Carte Isochronal avec des vecteurs du menu de déclassement de l'affichage pour afficher cette analyse.
- Le RNS est calculé comme le rapport de l'amplitude maximale par rapport à l'écart standard du signal à la ligne de base. Cette analyse est effectuée après toutes les étapes de traitement. Appuyez sur le calcul SNR dans le menu supérieur pour modifier les paramètres de la période du signal définie comme la ligne de base.
6. Module d'analyse de conduction
- Conduite de presse pour accéder à une analyse plus détaillée de la vitesse de conduction. Cela ouvre un module distinct où la conduction peut être quantifiée en utilisant la méthode multivectorielle Bayly comme dans l'interface principale, les méthodes vectorielles uniques, et comme une courbe d'activation.
- Appuyez sur Single Vector pour analyser la conduction à l'aide de la méthode vectorielle unique, où le CV est calculé à partir du retard dans le temps d'activation entre deux points. Cela peut être fait en utilisant des méthodes automatiques ou manuelles, sélectionnables sous le bouton Single Vector.
- Pour la méthode vectorielle unique automatique, sélectionnez une distance et un point de départ à partir duquel mesurer la conduction. Le logiciel effectuera ensuite un balayage à 360 degrés à partir du point choisi, mesurant le délai et calculant la vitesse de conduction associée dans toutes les directions par incréments de 1 degré. Les résultats de cette analyse sont affichés dans le graphique adjacent à la carte, et la direction de la conduction la plus lente est indiquée en rouge.
- Pour la méthode vectorielle unique manuelle, choisissez à la fois un point de départ et un point d'extrémité à partir de la carte isochronale pour calculer la vitesse de conduction. Pour sélectionner un nouveau point de départ, appuyez sur Clear Start Point.
- Appuyez sur Local Vector pour appliquer la méthode multi vectorielle, les paramètres correspondant à ceux de l'interface principale. Dans le module de conduction, la répartition des vitesses de conduction, ainsi que la distribution angulaire des vecteurs calculés et la dépendance angulaire de la vitesse de conduction peuvent être affichées.
- Appuyez sur la courbe d'activation pour tracer le pourcentage de tissu activé en fonction du temps. Le temps d'activation à 100% est automatiquement affiché, tandis que les valeurs personnalisées pour les pourcentages d'activation minimum (bleu) et maximum (rouge) entre lesquels mesurer peuvent également être sélectionnées.
7. Analyses et modules supplémentaires
- Outre les analyses automatiques de la durée et de la vitesse de conduction, plusieurs autres paramètres peuvent être quantifiés à l'aide d'ElectroMap. Ces analyses sont sélectionnables à partir du menu déroulant au-dessus de la carte d'affichage. Sélectionnez l'une de ces options pour effectuer l'analyse, et les résultats apparaîtront dans la 4e rangée du tableau des résultats : 1) Intervalle diastolique - Temps de 90 % de répolarisation à l'heure d'activation du potentiel d'action suivant ; 2) Fréquence dominante - Le spectre de fréquence de chaque pixel est calculé à l'aide de la transformation rapide de Fourier, et la fréquence avec le plus de puissance est définie comme la fréquence dominante. Des paramètres avancés de portée et de fenêtre pour l'analyse de fréquence dominante sont disponibles en sélectionnant la cartographiede fréquence ; 3) Temps de pointe - Le temps de montée entre deux pourcentages sélectionnés par l'utilisateur (par défaut 10 à 90%) phase de dépolarisation du potentiel d'action ou de la libération de calcium. Les valeurs de pourcentage peuvent être modifiées en sélectionnant les paramètres TTP; et 4) Relaxation constante ()- La constante de relaxation est calculée en adaptant une décomposition mono-exponentielle de la forme :
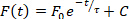 ②
②
où le niveau de fluorescence à l'époque t dépend de la fluorescence maximale, F0, et la carie subséquente (C est une constante)27. La valeur entre laquelle s'adapter à l'équation 2 sont sélectionnables dans les interfaces utilisateur electroMap principales, ainsi qu'une bonté de critères d'exclusion d'ajustement basés sur la valeur r 2. - Appuyez sur L'analyse des fichiers uniques pour ouvrir un module dédié pour la durée de débit élevé et l'analyse de conduction de chaque segment identifié dans un fichier. L'analyse peut être effectuée soit sur l'ensemble de l'image (durée, conduction et temps d'activation) soit sur des régions ou des points d'intérêt sélectionnés (actuellement durée seulement). Les résultats sont répertories sur un fichier .csv.
REMARQUE : Pour les valeurs APD de l'image entière, la première colonne du fichier .csv est la moyenne, tandis que la deuxième colonne est l'écart standard. - Appuyez sur Alternans pour lancer un module autonome pour l'analyse dédiée et la cartographie de la variabilité beat-to-beat. Voir O'Shea et coll. 201913 pour plus de détails sur les options de traitement et d'analyse des alternans. Plus précisément, ce module est conçu pour identifier deux oscillations d'époque, connues sous le nom d'alternans. Les alternans de durée et d'amplitude sont calculés et outputted.
REMARQUE : Les alternans de durée sont mesurés en comparant la mesure de durée d'un pic à l'autre ; c'est-à-dire si le pic un et deux et APD1 et APD2 respectivement, alors l'alternan de durée (APD) est calculé comme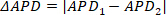 ③
③
La mesure de la durée est effectuée à l'aide des paramètres de l'interface principale. Pendant ce temps, les alternans d'amplitude peuvent être quantifiés et cartographiés à travers les préparations multicellulaires comme changement absolu (défini comme un pourcentage où 0% - même amplitude entre un battement et l'autre). En outre, les effets de phénomènes tels que la charge de calcium peuvent être étudiés plus en mesurant et en comparant les alternans de charge et de libération, comme cela a été précédemment rapporté28. Si L est défini comme l'amplitude maximale des grands battements (c.-à-d. où l'amplitude est plus grande que le battement précédent), S l'amplitude des petits battements, etD la charge diastolique des petits battements, la libération alterne (
est plus grande que le battement précédent), S l'amplitude des petits battements, etD la charge diastolique des petits battements, la libération alterne ( 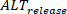 ) sont définis comme :
) sont définis comme :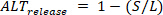 ④
④
Inversement, les alternans de charge (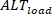 ) sont définis comme suit :
) sont définis comme suit :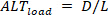 (5)
(5)
Les mesures des alternans peuvent être effectuées sur l'ensemble du tissu, et les résultats de l'analyse sont affichés en bas à droite du module. Lors de la première utilisation du module, l'analyse est effectuée sur l'ensemble du fichier expérimental, et les résultats affichés sont une différence moyenne de battement-battement sur l'ensemble du fichier. Toutefois, l'analyse peut être limitée à des heures spécifiques dans le fichier en désélectionnant Hold Zoom, en zoomant sur une période de temps spécifique, et en sélectionnant Analyse Zoomed Section. Cela permettra de mettre à jour le panneau de résultats pour afficher l'analyse de la période de temps sélectionnée.- Sélectionnez la lecture pour afficher une vidéo beat-to-beat de l'analyse des alternans. En outre, sélectionnez Créer la carte moyenne pour exporter une carte du comportement des alternans en moyenne à partir des points de temps de sélection, qui sont réglés dans le menu pop-up lors de l'utilisation de cette fonctionnalité.
- Appuyez sur La carte de phase pour lancer le module de cartographie de phase. Une transformation Hilbert est effectuée pour calculer la phase instantanée (entre - et ' ) des signaux à chaque point de temps. Appuyez sur le curseur de lecture ou de glisser pour visualiser le comportement de phase au fil du temps et cliquez sur un pixel pour rendre un diagramme de phase.
8. Données d'exportation
- Les données sont exportées à partir d'ElectroMap sous diverses formes. Appuyez sur valeurs d'exportation pour enregistrer les valeurs de la carte actuellement affichée dans l'interface principale utilisée. Les valeurs mesurées peuvent être enregistrées sous forme de carte (préservant les emplacements des pixels) ou condensées en une seule liste, et peuvent être enregistrées sous forme de .csv,.txt ou . Fichiers MAT.
- Appuyez sur La carte d'exportation pour mettre en place un pop-up contenant la carte actuellement affichée, qui peut ensuite être enregistré dans une variété de formats d'image. Les options d'affichage pour la carte sont contrôlées en sélectionnant les paramètres de carte, mais peuvent également être modifiées une fois que la carte export a été sélectionnée. Par exemple, une barre de couleur peut être ajoutée en sélectionnant cette icône dans le menu du haut, et l'échelle peut être fixée en sélectionnant Edit 'gt; Colormap.
- Appuyez sur La vidéo d'activation pour rendre une animation de la séquence d'activation, qui peut être enregistrée sous forme de fichier .gif animé.
- Press Segment Video pour enregistrer un fichier vidéo .avi du paramètre actuellement affiché de chaque segment identifié.
Résultats
Tous les travaux réalisés dans le cadre de cette étude ont été entrepris conformément aux directives éthiques énoncées par la loi britannique sur les animaux (procédures scientifiques) de 1986 et la directive 2010/63/UE du Parlement européen sur la protection des animaux utilisés à des fins scientifiques. Les expériences ont été approuvées par le siège social (souris : PPL 30/2967 et PFDAAF77F, cobaye : PPL PF75E5F7F) et les commissions d'examen institutionnelles de l'Université de Birmingham (souris) et du King's College de Londres (cochon de Guinée). Des méthodes détaillées pour la collecte des données brutes qui ont été analysées ici peuvent être trouvées dans nos publications précédentes5,6,14,19.
L'interface principale à partir de laquelle ElectroMap est contrôlé est montrée dans la figure 1A. Les étapes nécessaires à l'analyse d'un jeu de données sont contrôlées principalement par les imagesde charge , Images de processus, et produire des cartes boutons, et sont affichés mis en évidence en vert, bleu et rouge, respectivement dans la figure 1A. La figure 1B-D montre les opérations qui se produisent lors de la sélection de chacun de ces boutons. Load Images applique les options de seuil d'image choisies par l'utilisateur (Figure 1B), tandis que Process Images (Figure 1C) applique le filtrage et la correction de base. Enfin, Produce Maps effectuera d'abord la moyenne des données en fonction de la fenêtre temporelle et des paramètres de segmentation (à moins que la segmentation d'un seul battement ne soit choisie) et effectuera ensuite des analyses décrites ci-dessus.
Un aspect clé de ElectroMap est sa flexibilité en ce qui concerne le type de caméra et le modèle expérimental. Ceci est crucial pour l'utilité d'un logiciel de cartographie optique en raison de l'EP cardiaque distinct et les caractéristiques anatomiques qui existent entre les modèles largement utilisés. La figure 2A montre par exemple la morphologie potentielle de l'oreillema murine par rapport au ventricule de cobaye, enregistré à l'aide de colorants sensibles à la tension comme indiqué précédemment6,14. Malgré la forme distincte du potentiel d'action, et l'utilisation de deux caméras de cartographie optique séparées avec des framerates différents et des tailles de pixels, ElectroMap peut être utilisé pour analyser avec succès les deux jeux de données. Toutefois, cela nécessite la modification de certains paramètres dans l'interface utilisateur (Figure 2B). Notez que le potentiel prolongé d'action de cobaye nécessite une plus grande fenêtre de temps. En outre, pour empêcher la correction de base de haut-chapeau modifiant sans physiologiquement les signaux optiquement enregistrés, sa longueur de temps doit être augmentée de sorte qu'elle soit plus grande que le cours de temps du potentiel d'action.
ElectroMap offre une multitude d'options de traitement pour aider à améliorer le SNR des signaux enregistrés optiquement qui peuvent être nécessaires pour récupérer efficacement les paramètres EP. Un exemple est la moyenne automatisée d'ensemble des pics suivant la segmentation des données. La figure 3A-C montre comment l'application de la moyenne d'ensemble, au lieu d'autres méthodes, peut améliorer Le SNR à partir d'atria gauche surine sinainisolés(n - 13). Cela réduit l'hétérogénéité de la mesure et la probabilité d'échec de l'analyse (Figure 3D). Par exemple, un changement de fréquence de rythme de 3 Hz à 10 Hz n'a pas modifié APD50, quand aucune moyenne d'ensemble n'est entreprise, pourtant une diminution prévuede 29 APD50 à 10 Hz rythme a été observée une fois mesurée à partir des données moyennes d'ensemble ( Figure 3E).
La figure 4 démontre l'efficacité et l'utilité de la détection et de la segmentation automatisées des fréquences de stimulation offertes par ElectroMap. Ici, les atrias gauches de souris (n - 5) ont été rythmés à une longueur de cycle de 120 ms et la longueur du cycle a été raccourcie progressivement de 10 ms jusqu'à ce qu'elle atteigne 50 ms. ElectroMap a automatiquement identifié la longueur du cycle de rythme et les tissus groupés ont fait la moyenne des pics en conséquence (figure4A ). Ceci a été réalisé avec une grande précision dans tous les jeux de données (Figure 4B). La segmentation automatisée des données a permis une analyse directe et élevée du débit du ralentissement de la vitesse de conduction avec une fréquence de rythme accrue/longueur raccourcie du cycle (Figure 4C,D). Parallèlement, APD50 (Figure 4E) et intervalle diastolique (figure 4F) raccourci. L'amplitude des pics mesurés optiquement a diminué, tandis que le temps de pointe a augmenté (figure 4G,H). Ce sont encore les réponses de restitution attendues dans le tissu cardiaque29,30 et l'utilisation d'ElectroMap peut aider donc à élucider les changements en réponse à la fréquence de stimulation en présence d'agents pharmacologiques, modification génétique, ou les états de la maladie.
Une considération importante dans l'utilisation d'un logiciel tel qu'ElectroMap est la présence d'artefacts dans les données sous-jacentes. Figure 5, par exemple, démontre que les artefacts de mouvement (la distorsion du signal enregistré optiquement par le mouvement des tissus) peuvent empêcher des mesures précises de l'activation et surtout de la repolarisation au sein d'ElectroMap. Voir Discussion pour d'autres considérations.
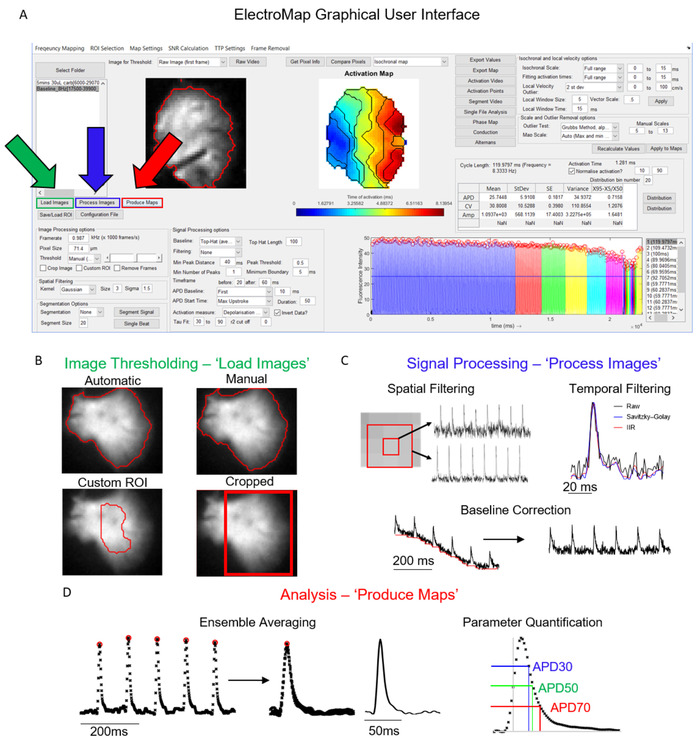
Figure 1 : Étapes principales de traitement ElectroMap. (A) Interface utilisateur graphique d'ElectroMap, avec les images de charge (vert), Images de processus (bleu) et Les boutons Produce Maps (rouge) mis en évidence. (B) Options de seuil d'image qui peuvent être appliquées sur la sélection des images de charge. (C) Les options de traitement des signaux disponibles pour l'utilisateur comprennent le filtrage spatial et temporel et la correction de base et peuvent être appliquées à la pile d'images en appuyant sur Process Images. (D) Moyenne de l'ensemble et quantification des paramètres (mesure APD illustrée) qui est activée en sélectionnant Produce Maps. Figure adaptée de O'Shea et coll., 201913. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
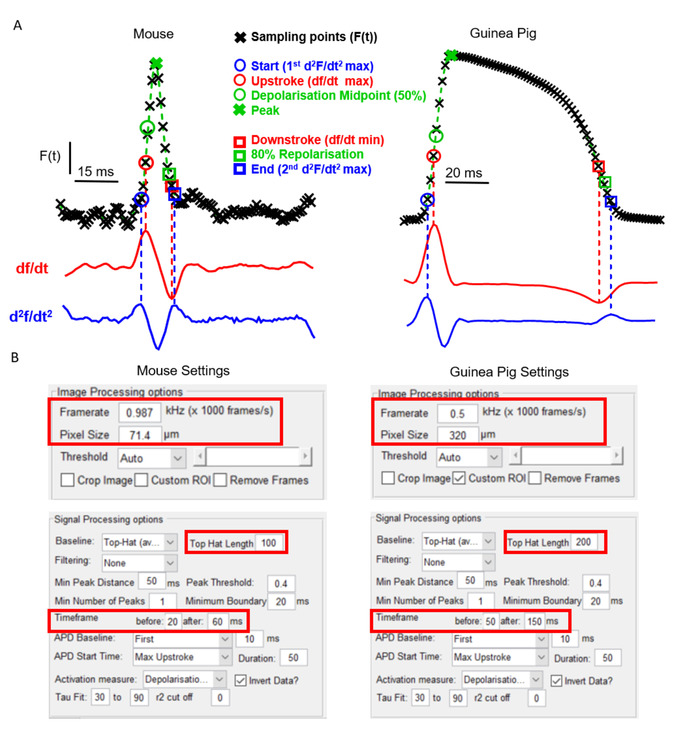
Figure 2 : Analyse des données sur les souris et les cobayes à l'aide d'ElectroMap. (A) Potentiel d'action enregistré optiquement à partir d'oreillettes de souris et de ventricules de cobaye, ainsi que le premier (df/dt) et le second (d2f/dt2) dérivant de ces signaux. Les différentes définitions des temps d'activation et de repolarisation employables dans ElectroMap sont mises en évidence. (B) Captures d'écran des paramètres de traitement d'images et de signaux utilisés dans l'interface ElectroMaps. Les boîtes rouges mettent en évidence les paramètres qui nécessitaient une modification entre les analyses des données sur les souris et les cobayes. Figure adaptée de O'Shea et coll., 201913. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
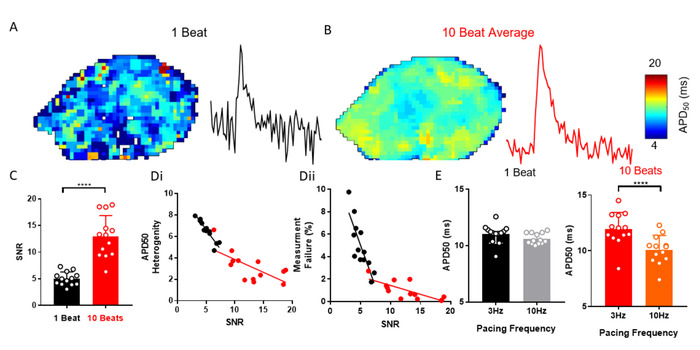
Figure 3 : Ensemble en moyenne pour résoudreles modifications de la DPA . (A) CARTE APD50 et exemple de signal de pixel unique à partir de potentiels d'action optique à battement unique. (B) APD50 carte et exemple de signal de pixel unique à partir de potentiels d'action optique générés par la moyenne d'ensemble de 10 battements successifs (méthode de pointe). (C) SNR de battement simple comparé à 10 signaux de moyenne de battement. (D) APD50 hétérogénéité (i) et le nombre de défaillances de mesure (ii) en fonction de SNR pour un seul battement et 10 battements en moyenne APD50 cartes. (E) APD50 à 3 et 10 Hz fréquence de rythme, tel que mesuré à partir de battement unique et 10 cartes de battement. (Données présentées comme moyenne - erreur standard, n 13 atria gauche, p 'lt; 0,001 par l'étudiant apparié t-test). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
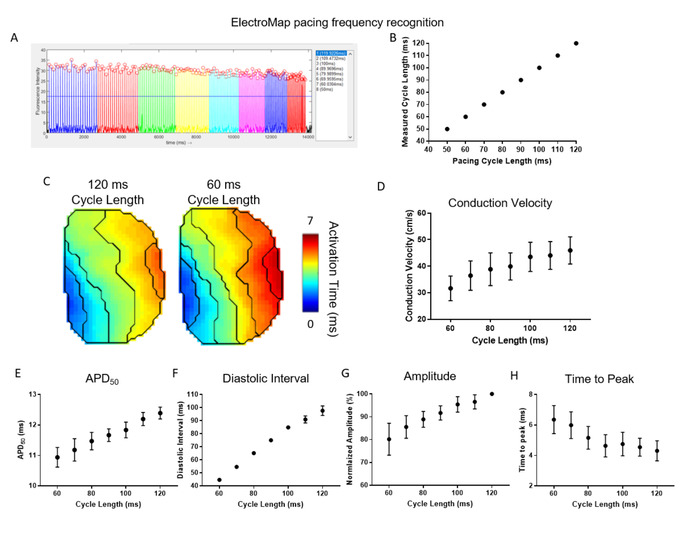
Figure 4 : Utilisation d'ElectroMap pour étudier les réponses de fréquence de stimulation dans le tissu cardiaque. (A) Exemple ElectroMap capture d'écran de la reconnaissance de fréquence de rythme et la segmentation. (B) Comparaison des longueurs de cycle de rythme de stimulation connues et ElectroMap mesurées. (C) Cartes d'activation à 120 ms et 60 ms longueurs de cycle de rythme. (D-H) Données groupées de la vitesse de conduction (D), APD50 (E), intervalle diastolique (F), amplitude (G), et le temps de pointe (H) en fonction de la longueur du cycle de rythme diminuant de 120 ms à 60 ms par incréments de 10 ms. (Données affichées comme moyenne d'erreur standard, n 5 atria gauche) Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
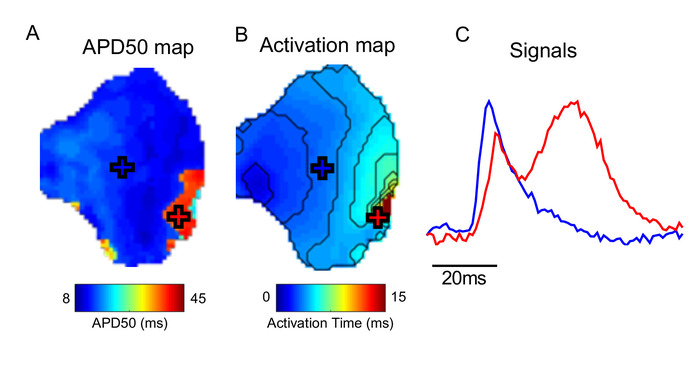
Figure 5 : Effet des artefacts de mouvement. (A) Carte APD50. (B) Carte d'activation. (C) Exemple de signaux provenant d'emplacements marqués (croix) sur les cartes APD et d'activation. Dans la zone du tissu marquée de la croix rouge, la contraction n'a pas été découplée avec succès, déformant le signal optique mesuré. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
Ici, nous présentons un guide étape par étape pour l'utilisation du logiciel open-source ElectroMap pour l'analyse flexible et multi variable des ensembles de données de cartographie optique cardiaque. Pour une utilisation réussie d'ElectroMap, les données d'imagerie doivent être en .tif ou . Formats MAT. ElectroMap intègre plusieurs paramètres utilisateur modifiables. Comme le démontre la figure 2A, cela est nécessaire en raison de la grande hétérogénéité qui existe entre les modèles expérimentaux et le matériel d'imagerie. Cela signifie cependant que les paramètres par défaut dans le logiciel ne sera pas toujours optimale, donc une étape critique dans l'utilisation du logiciel est pour l'utilisateur de régler les paramètres pour leur configuration expérimentale particulière. Il s'agit notamment des paramètres de la caméra et des échelles de temps, comme le montre la figure 2B. Une fois que les paramètres optimaux ont été trouvés, ceux-ci peuvent être enregistrés et rechargés à des moments ultérieurs en sélectionnant le fichierde configuration .
L'incorporation de la mesure CL automatisée et la segmentation des signaux sont des avantages clés du logiciel. Ces caractéristiques permettent d'analyser les réponses aigues dans les enregistrements expérimentaux et d'élargir l'analyse de se concentrer sur les battements isolés simples. Une fois la segmentation souhaitée atteinte, le module d'analyse de fichiers uniques permet l'analyse automatisée de chaque segment individuel (y compris les battements uniques), réalisant l'analyse à haut débit de plusieurs variables à travers l'enregistrement produit dans un fichier unique .csv. En conjonction, la moyenne d'ensemble des pics groupés est une méthode efficace pour améliorer la qualité des signaux bruyants qui est automatiquement effectuée dans ElectroMap. Cependant, la moyenne d'ensemble n'est pas omniprésente bénéfique, par exemple dans les études de la variabilité beat-to-beat. Par conséquent, ElectroMap intègre la segmentation à battement unique pour éviter la moyenne d'ensemble, les options de traitement alternatives pour améliorer le SNR (filtrage spatial et temporel) et inclut le module d'analyse Des Alternans pour étudier et cartographier variabilité beat-to-beat.
Les jeux de données de cartographie optique présentent souvent des artefacts tels que des artefacts de dérive de base et de mouvement. De même, les signaux générés peuvent être de faible qualité en raison de petites tailles de pixels, de temps d'exposition courts et de faibles changements fluorescents fractionnaires2. Ces facteurs empêchent l'analyse efficace et précise du comportement sous-jacent d'EP. Comme indiqué, ElectroMap a plusieurs stratégies de traitement pour surmonter ces problèmes. Cependant, l'application de ces algorithmes à des données fondamentalement de mauvaise qualité/déformées empêchera toujours l'analyse efficace. SNR est donc l'un des paramètres mesurés et affichés dans ElectroMap. De même, l'utilisateur peut sélectionner et comparer les signaux provenant de régions spécifiques de l'échantillon à l'aide des modules Pixel Info et Compare, permettant d'identifier des phénomènes tels que les artefacts de mouvement présentés à la figure 5, et appropriés l'exclusion des données.
À l'heure actuelle, ElectroMap ne prend pas en charge le retrait des artefacts de mouvement des données brutes de la même manière que la correction de base. Par conséquent, un développement futur possible du logiciel est l'inclusion de la suppression d'artefact de mouvement par des méthodes de calcul comme cela a été rapporté31,32. En outre, ElectroMap est actuellement limité à l'étude d'un signal optique. Cependant, pour les colorants ratiométriques et l'utilisation simultanée de la tension et des colorants de calcium27, le traitement simultané de deux canaux de longueur d'onde est nécessaire. L'intégration de l'analyse du double signal est donc un ajout futur important au logiciel. L'extension des options d'analyse applicables aux jeux de données arythmiques, telles que le suivi de la singularité de phase, élargirait également la portée du logiciel33,34. Enfin, plusieurs des options d'analyse décrites peuvent également être utiles dans l'analyse des données de cartographie des électrodes. En effet, ElectroMap a été utilisé pour analyser les données de cartographie des électrodes malgré la forme d'onde électrogramme contrastante20,35, et une optimisation supplémentaire permettra d'étendre son utilisation pour cette modalité.
Déclarations de divulgation
P.K. reçoit le soutien de recherche de plusieurs compagnies de drogue et d'appareils actifs dans la fibrillation auriculaire et a reçu des honoraires de plusieurs de ces entreprises. L.F. a reçu des subventions de recherche institutionnelles EU, BHF, MRC, DFG et Gilead. P.K. et L.F. sont répertoriés comme inventeurs sur deux brevets détenus par l'Université de Birmingham (Atrial Fibrillation Therapy WO 2015140571, Markers for Atrial Fibrillation WO 2016012783).
Tous les autres auteurs ne déclarent aucun conflit d'intérêts potentiel.
Remerciements
Ce travail a été financé par l'EPSRC studentship (Sci-Phy-4-Health Centre for Doctoral Training L016346) à D.P., K.R. et L.F., Wellcome Trust Seed Award Grant (109604/Z/15/Z) à D.P., British Heart Foundation Grants (PG/17/55/33087, RG/17/15/33106) à D.P. , Union européenne (accord de subvention no 633196 [CATCH ME] à P.K. et L.F.), British Heart Foundation (FS/13/43/30324 à P.K. et L.F.; PG/17/30/32961 à P.K. et A.H.), et Fondation Leducq à P.K. J.W. est soutenu par la British Heart Foundation (FS/16/35/31952).
matériels
| Name | Company | Catalog Number | Comments |
| MATLAB and Simulink R2018a | Mathworks, Inc, Natick, MA | MATLAB software |
Références
- Efimov, I. R., Nikolski, V. P., Salama, G. Optical Imaging of the Heart. Circulation Research. 94, 21-33 (2004).
- Herron, T. J., Lee, P., Jalife, J. Optical imaging of voltage and calcium in cardiac cells & tissues. Circulation Research. 110, 609-623 (2012).
- Boukens, B. J., Efimov, I. R. A century of optocardiography. IEEE Reviews in Biomedical Engineering. 7, 115-125 (2014).
- Myles, R. C., Wang, L., Kang, C., Bers, D. M., Ripplinger, C. M. Local β-adrenergic stimulation overcomes source-sink mismatch to generate focal arrhythmia. Circulation Research. 110, 1454-1464 (2012).
- Syeda, F., et al. PITX2 Modulates Atrial Membrane Potential and the Antiarrhythmic Effects of Sodium-Channel Blockers. Journal of the American College of Cardiology. 68, 1881-1894 (2016).
- Winter, J., et al. Sympathetic nervous regulation of cardiac alternans in the intact heart. Frontiers in Physiology. 9, 1-12 (2018).
- Faggioni, M., et al. Suppression of spontaneous ca elevations prevents atrial fibrillation in calsequestrin 2-null hearts. Circulation: Arrhythmia and Electrophysiology. 7, 313-320 (2014).
- Sato, P. Y., et al. Loss of Plakophilin-2 Expression Leads to Decreased Sodium Current and Slower Conduction Velocity in Cultured Cardiac Myocytes. Circulation Research. 105, 523-526 (2009).
- Yu, T. Y., et al. Optical mapping design for murine atrial electrophysiology. Computer Methods in Biomechanics and Biomedical Engineering: Imaging & Visualization. 5, 368-378 (2017).
- Laughner, J. I., Ng, F. S., Sulkin, M. S., Arthur, R. M., Efimov, I. R. Processing and analysis of cardiac optical mapping data obtained with potentiometric dyes. American Journal of Physiology. Heart and Circulatory Physiology. 303, H753-H765 (2012).
- Crocini, C., Ferrantini, C., Pavone, F. S., Sacconi, L. Optogenetics gets to the heart: A guiding light beyond defibrillation. Progress in Biophysics and Molecular Biology. 130, 132-139 (2017).
- Entcheva, E., Bub, G. All-optical control of cardiac excitation: Combined high-resolution optogenetic actuation and optical mapping. The Journal of Physiology. 9, 2503-2510 (2016).
- O’Shea, C., et al. ElectroMap: High-throughput open-source software for analysis and mapping of cardiac electrophysiology. Scientific Reports. 9, 1-13 (2019).
- Yu, T. Y., et al. An automated system using spatial oversampling for optical mapping in murine atria. Development and validation with monophasic and transmembrane action potentials. Progress in Biophysics and Molecular Biology. 115, 340-348 (2014).
- Jaimes, R., et al. Functional response of the isolated, perfused normoxic heart to pyruvate dehydrogenase activation by dichloroacetate and pyruvate. Pflugers Archiv. 468, 131-142 (2016).
- Wang, K., et al. Cardiac tissue slices: preparation, handling, and successful optical mapping. American Journal of Physiology. Heart and Circulatory Physiology. 308, H1112-H1125 (2015).
- Parrish, D. C., et al. Transient denervation of viable myocardium after myocardial infarction does not alter arrhythmia susceptibility. American Journal of Physiology. Heart and Circulatory. , (2017).
- Ihara, K., et al. Electrophysiological Assessment of Murine Atria with High-Resolution Optical Mapping. Journal of Visualized Experiments. (132), e56478 (2018).
- Holmes, A. P., et al. A Regional Reduction in Ito and IKACh in the Murine Posterior Left Atrial Myocardium Is Associated with Action Potential Prolongation and Increased Ectopic Activity. Plos One. 11, e0154077 (2016).
- Lang, D., et al. Arrhythmogenic remodeling of β2 versus β1 adrenergic signaling in the human failing heart. Circulation: Arrhythmia and Electrophysiology. 8, 409-419 (2015).
- Kang, C., et al. Human Organotypic Cultured Cardiac Slices: New Platform For High Throughput Preclinical Human Trials. Scientific Reports. 6, 1-13 (2016).
- Wen, Q., et al. Transverse cardiac slicing and optical imaging for analysis of transmural gradients in membrane potential and Ca2+ transients in murine heart. The Journal of Physiology. 596, 3951-3965 (2018).
- Houston, C., et al. Characterisation of re-entrant circuit (or rotational activity) in vitro using the HL1-6 myocyte cell line. Journal of Molecular and Cellular Cardiology. 119, 155-164 (2018).
- Yu, T. Y., et al. Optical mapping design for murine atrial electrophysiology. Computer Methods in Biomechanics and Biomedical Engineering: Imaging and Visualization. 5, 368-376 (2017).
- Laughner, J. I., Ng, F. S., Sulkin, M. S., Arthur, R. M., Efimov, I. R. Processing and analysis of cardiac optical mapping data obtained with potentiometric dyes. AJP: Heart and Circulatory Physiology. 303, H753-H765 (2012).
- Bayly, P. V., et al. Estimation of Conduction Velocity Vector Fields from Epicardial Mapping Data. IEEE Transactions on Bio-Medical Engineering. 45, 563-571 (1998).
- Jaimes, R., et al. A technical review of optical mapping of intracellular calcium within myocardial tissue. American Journal of Physiology. Heart and Circulatory Physiology. 310, H1388-H1401 (2016).
- Wang, L., et al. Optical mapping of sarcoplasmic reticulum Ca2+ in the intact heart: Ryanodine receptor refractoriness during alternans and fibrillation. Circulation Research. 114, 1410-1421 (2014).
- Winter, J., Shattock, M. J. Geometrical considerations in cardiac electrophysiology and arrhythmogenesis. Europace. , (2016).
- Mironov, S., Jalife, J., Tolkacheva, E. G. Role of conduction velocity restitution and short-term memory in the development of action potential duration alternans in isolated rabbit hearts. Circulation. 118, 17-25 (2008).
- Khwaounjoo, P., et al. Image-Based Motion Correction for Optical Mapping of Cardiac Electrical Activity. Annals of Biomedical Engineering. 43, 1235-1246 (2014).
- Christoph, J., Luther, S. Marker-Free Tracking for Motion Artifact Compensation and Deformation Measurements in Optical Mapping Videos of Contracting Hearts. Frontiers in Physiology. 9, (2018).
- Umapathy, K., et al. Phase Mapping of Cardiac Fibrillation. Circulation: Arrhythmia and Electrophysiology. 3, 105-114 (2010).
- Tomii, N., et al. Detection Algorithm of Phase Singularity Using Phase Variance Analysis for Epicardial Optical Mapping Data. IEEE Transactions on Biomedical Engineering. 63, 1795-1803 (2016).
- Cantwell, C. D., et al. Techniques for automated local activation time annotation and conduction velocity estimation in cardiac mapping. Computers in Biology and Medicine. 65, (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon