Method Article
Cuantificación de la actividad quimiotáctica monocitos en Vivo y caracterización de los macrófagos derivados de monocitos sanguíneos
En este artículo
Resumen
Aquí presentamos un protocolo para cuantificar la actividad quimiotáctica de los monocitos sanguíneos en modelos de ratón, para evaluar los efectos de las intervenciones nutricionales, farmacológicas y genéticas en los monocitos sanguíneos y para caracterizar los monocitos sanguíneos derivados de los macrófagos en modelos de ratón utilizando tapones de gel de membrana de sótano cargados de monocitos-quimioattractant-1 (MCP-1).
Resumen
La homeostasis tisular y la reparación dependen críticamente del reclutamiento de macrófagos derivados de monocitos. Tanto el reclutamiento bajo como el sobrereclutamiento de macrófagos derivados de monocitos pueden afectar la cicatrización de heridas. Demostramos que las dietas altas en grasas y altos en azúcar promueven el cebado y la disfunción de los monocitos, convirtiendo los monocitos sanguíneos sanos en un fenotipo hiperquiotáctico preparado para diferenciarse en macrófagos con perfiles de activación desregulados y fenotípicos deteriorados Plasticidad. Se cree que el sobrereclutamiento de macrófagos derivados de monocitos y el reclutamiento de macrófagos con perfiles de activación disregulados contribuyen de manera importante al desarrollo de enfermedades inflamatorias crónicas asociadas con trastornos metabólicos, incluyendo aterosclerosis y obesidad. El objetivo de este protocolo es cuantificar la actividad quimiotáctica de los monocitos sanguíneos como biomarcador para el cebado y la disfunción de los monocitos y caracterizar los monocitos sanguíneos del fenotipo macrofago están listos para diferenciarse en estos modelos de ratón. Usando el análisis de una sola célula de Western blot, mostramos que después de 24 h 33% de las células reclutadas en tapones de gel derivados de membrana de sótano cargados MCP-1 inyectados en ratones son monocitos y macrófagos; 58% después del día 3. Sin embargo, en el día 5, el número de monocitos y macrófagos disminuyó significativamente. Por último, demostramos que estos ensayos también permiten el aislamiento de macrófagos en vivo de los tapones de gel derivados de membranas de sótano recuperados quirúrgicamente, que luego pueden ser sometidos a la caracterización posterior mediante el análisis de una sola célula occidental.
Introducción
El reclutamiento de macrófagos derivados de monocitos es esencial para el desarrollo de enfermedades inflamatorias crónicas asociadas con trastornos metabólicos, incluyendo aterosclerosis y obesidad1,2,3, 4. El número de macrófagos derivados de monocitos en los sitios de lesión tisular, así como su plasticidad son críticos para la homeostasis tisular y la reparación. Tanto el reclutamiento bajo como el sobrereclutamiento de macrófagos derivados de monocitos pueden afectar la cicatrización de heridas5. Desencadenar la inflamación del tejido local, por ejemplo, por la acumulación y oxidación de lipoproteínas de baja densidad (LDL) en la pared aórtica o activación inflamatoria de adipocitos por ácidos grasos o fuga de lipopolisacárido bacteriano a través del intestino intestinal barrera, conduce a la liberación de mediadores inflamatorios, incluyendo quimioquinas como la proteína quimioattractante de monocitos-1 (MCP-1/CCL2). MCP-1 es un miembro de la familia de la quimioquina C-C y un quimioatractor clave responsable del reclutamiento de macrófagos derivados de monocitos en sitios de inflamación y lesión de tejidos6,7,8, 9,10. La activación inflamatoria del endotelio vascular da como resultado la expresión de moléculas de adherencia como la molécula de adhesión intercelular 1 (ICAM-1) y la molécula de adhesión de células vasculares 1 (VCAM-1)11,12, permitiendo monocitos circulantes activados por MCP-1 para rodar a lo largo, adherirse firmemente y posteriormente transmigrar al espacio subendotelial12. Los monocitos infiltrados se diferencian en macrófagos, que pueden activarse en un fenotipo proinflamatorio, impulsando el proceso inflamatorio agudo. Impulsados por el microambiente, los macrófagos proinflamatorios pueden convertirse en macrófagos que resuelven la inflamación, que desempeñan un papel crítico en la limpieza de células inflamatorias, la eliminación de señales proinflamatorias y la reparación y herida completación del tejido curación12,13.
El estrés metabólico crónico prepara los monocitos para mejorar drásticamente la capacidad de respuesta a los quimio-atractores y aumentar el reclutamiento de monocitos, y demostramos que los monocitos cebados dan lugar a macrófagos con programas de activación y polarización regulados y polarización estados14,15,16. El cebado de monocitos promueve la aterosclerosis, la obesidad y posiblemente otras enfermedades inflamatorias crónicas asociadas con trastornos metabólicos como la esteatohepatitis, las enfermedades renales y posiblemente el cáncer. Para evaluar y cuantificar el cebado de monocitos en modelos de ratón de enfermedades humanas, desarrollamos una nueva técnica para evaluar el estado de cebado de los monocitos sanguíneos midiendo la actividad quimiotáctica in vivo14,15,16, 17. Nuestro enfoque consiste en la inyección de gel derivado de membrana de sótano cargado con un quimioattractante —utilizamos comúnmente MCP-1— o vehículo en el flanco izquierdo y derecho, respectivamente, de ratones. Cuando se inyecta cuidadosamente por vía subcutánea, el gel derivado de la membrana del sótano formará un único tapón, del cual las quimioquinas pueden difundir y crear un gradiente quimiotáctico definido que no se ve afectado por el estado metabólico o inflamatorio de los alrededores tejido o el ratón receptor.
El gel derivado de membrana de sótano que utilizamos para nuestro ensayo es una preparación de membrana de sótano solubilizada extraída del sarcoma de ratón Engelbreth-Holm-Swarm (EHS), un tumor rico en proteínas de matriz extracelular (ECM). Esta compleja mezcla de proteínas contiene laminina (60%), colágeno IV (30%), la molécula de puente entactin (8%) y una serie de factores de crecimiento. El ensayo de tapón de matriz de membrana del sótano fue desarrollado originalmente para investigar la angiogénesis en respuesta a varios factores de crecimiento18,19. Sin embargo, con el fin de estudiar la quimiotaxis monocitos, es importante utilizar gel derivado de membrana sótano de supuse el factor de crecimiento para minimizar el reclutamiento de células endoteliales y la angiogénesis. Lo que hace que Matrigel (denominado gel derivado de membrana de sótano a partir de ahora) sea único y particularmente útil es que a temperaturas por debajo de 10oC se licua, permitiendo que las quimiocinas se disuelvan. A temperaturas superiores a 22oC, la solución derivada de la membrana del sótano pasa rápidamente por una transición de fase y forma rápidamente un hidrogel. Los tapones pueden ser extirpados quirúrgicamente, limpiados y disueltos con una metaloproteasa neutra derivada de bacilo para producir suspensiones de una sola célula, que se pueden analizar en un clasificador de células activado por fluorescencia (FACS), por RNAseq, ARN de una sola célula y una variedad de otros técnicas de omics. Aquí describimos el uso de análisis de manchas occidentales de una sola célula para la caracterización de las poblaciones celulares reclutadas en los tapones de gel derivados de membrana del sótano uno, tres o cinco días después de la inyección.
Protocolo
Todos los métodos descritos en este protocolo han sido aprobados por el Comité Institucional de Cuidado y Uso de Animales de wake Forest School of Medicine.
1. Preparación de la solución derivada de la membrana de sótano con factor de crecimiento con factor de crecimiento con carga MCP-1
NOTA: Este es un procedimiento estéril.
- Limpie la campana de cultivo celular con desinfectante antes de preparar la solución derivada de la membrana del sótano (por ejemplo, Matrigel).
- Prepare una jeringa estéril de 1 ml embalada individualmente y limpie la parte superior del vial de solución derivada de la membrana del sótano con un hisopo de alcohol antes de cargarlo en la jeringa.
- Descongelar completamente la solución derivada de membrana de sótano con factor de crecimiento reducido en hielo.
PRECAUCION: Si la matriz de membrana del sótano se descongela a temperatura ambiente (RT), asegúrese de que queda una pequeña partícula de hielo para evitar que la solución se gelifice. - Una vez descondezcado, abra el vial y mezcle MCP-1 o 1xPBS con 0.1% de BSA en el capó del cultivo celular.
- Prepare 1 ml de la jeringa estéril con una aguja de 26 G y enfríe sobre hielo.
- Preparar una solución de stock de MCP-1 disolviendo MCP-1 a una concentración final de 50 g/ml en 1PBS con 0.1% De BSA.
- Diluir MCP-1 en 5 ml de solución derivada de membrana de sótano frío a una concentración final de 500 ng/ml. Preparar una cantidad igual de solución derivada de membrana de sótano con vehículo solamente (1x PBS contienen 0.1% BSA).
- Cargue 500 ml de solución derivada de membrana de sótano (con o sin MCP-1) en la jeringa fría de 1 ml.
- Retire todas las burbujas de aire de la jeringa cargada de solución derivada de membrana del sótano antes de realizar la inyección para garantizar una formación uniforme del tapón.
2. Inyección de la solución derivada de membrana de sótano
- Rocíe 70% de etanol alrededor del área de procedimiento antes y durante las inyecciones para desinfectar el medio ambiente.
- Para inducir la anestesia, coloque el ratón en una cámara de anestesia y ajuste el medidor de flujo O2 a 1 litro/min y luego ajuste el vaporizador a 2% de isoflurano.
- Controlar la profundidad de la anestesia mediante el control de la frecuencia respiratoria (tasa/min), el reflejo corneal y el movimiento de los bigotes.
- Durante todo el procedimiento, mantenga la anestesia con un cono nasal.
- Durante el procedimiento seguir monitoreando la frecuencia respiratoria (tasa/min), reflejo corneal y movimiento de bigotes para verificar la profundidad de la anestesia.
- Después de confirmar la falta de respuesta al pellizco del dedo del pie, inyectar lentamente (aproximadamente 100 l/s) la solución derivada de la membrana del sótano por vía subcutánea en el flanco derecho (sin MCP-1) e izquierdo (con MCP-1) del ratón, respectivamente. Si la inyección es demasiado lenta, los tapones de gel derivados de la membrana del sótano pueden llegar a ser de forma irregular, o incluso fragmentado, y difícil de eliminar.
- Sujete la jeringa durante 20-30 s después de la inyección para evitar la fuga de la solución y para permitir la formación de un solo gel-enchufe liso.
- Después de la inyección, colocar el ratón en la almohadilla de calentamiento con monitoreo hasta la recuperación.
- Devuelva el ratón a la jaula original una vez que el ratón esté completamente recuperado.
3. Cosecha los tapones de gel derivados de la membrana del sótano
- Pesar dos tubos de microcentrífuga separados de 1,5 ml para cada ratón y etiquetarlos.
- Tres días después de la inyección de la solución derivada de la membrana del sótano, eutanasia el ratón en la cámara anestésica utilizando 3% de isoflurano seguido de luxación cervical.
- Retire el pelaje dorsal del ratón usando cortapelos o aplique crema removedora con palitos con punta de algodón durante 5 minutos y luego limpie.
- Sostenga la piel del ratón usando fórceps alrededor de la vértebra torácica inferior y lumbar superior y haga una incisión de 2 mm de largo en la piel.
- Corte la línea media de la parte posterior del ratón desde una incisión hecha hasta vértebras cervicales y hasta 1 cm por encima de la unión de la vértebra caudal (unión de la cola) utilizando tijeras quirúrgicas.
- Separe la piel de la capa muscular y atornine la piel en una plataforma de espuma de poliestireno.
- Sostenga cuidadosamente la cápsula fibrosa que contiene el tapón de gel derivado de la membrana del sótano usando fórceps finos y retire la cápsula fibrosa usando tijeras finas para limpiar el enchufe.
- Retire el tapón de gel derivado de membrana saciája limpia del sótano y transfiera a microcentrífuga de 1,5 ml (véase 3.1).
- Pesar el tubo de microcentrífuga con el tapón de gel derivado de membrana de sótano limpia y calcular el peso de la clavija de gel derivada de membrana del sótano.
4. Digerir los tapones de gel derivados de la membrana del sótano
- Descongelar el dispase (10 ml) en el hielo.
- Picar el tapón de gel derivado de membrana del sótano en el tubo de microcentrífuga utilizando tijeras finas limpias.
- Añadir 800 l de dosis en cada tubo de microcentrífuga que contenga un tapón de gel derivado de la membrana del sótano.
- Vórtice con velocidad máxima durante 10 s para interrumpir el enchufe.
- Incubar los tubos de microcentrífuga durante 2 h a 37 oC a 1.400 rpm en un termomezclador para disolver completamente el tapón de gel derivado de la membrana del sótano.
- Después de 2 h, centrífuga a 400 x g durante 10 minutos en RT. Retire y deseche cuidadosamente el sobrenadante.
- Resuspenda el pellet en 1 ml de 1x PBS invirtiendo o tocando.
- Repita la centrifugación a 200 x g durante 10 min a RT. Retire y deseche cuidadosamente el sobrenadante.
- Resuspenda el gránulo en 300 s de PBS.
- Tomar 50 l de suspensión celular en un tubo de microcentrífuga separado.
- Añadir 0,5 ml de calceína AM (1 M) a la suspensión celular.
NOTA: Calcein AM es un tinte de viabilidad de células fluorescentes verdes que sólo se acumula en las células vivas. - Incubar las células en una incubadora de CO2 a 37 oC durante 10 min.
- Cuente las células fluorescentes verdes (en vivo) y no fluorescentes (muertas) utilizando un contador de células automatizado.
5. Determinación de la composición celular en la suspensión celular mediante el análisis de Western Blot de una sola célula (scWB)
- Rehidratar el chip scWB antes de usarlo en 15 ml de tampón de suspensión 1x en una placa Petri durante al menos 10 minutos a RT.
- Añadir 1 ml de la suspensión de una sola célula diluida (10.000-100.000 células/ml) al chip rehidratado. Ajuste la superficie en la parte inferior de un plato Petri de 10 cm. Asegúrese de que la superficie esté plana.
- Cubra el plato Petri con una tapa para evitar el secado y deje que las células se asienten durante 5-15 minutos por gradiente.
- Coloque el chip bajo un microscopio de campo brillante e inspeccione los pozos con un aumento de 10x.
NOTA: Aproximadamente 15-20% micropozos deben ser ocupados por una sola célula, menos del 2% de los pozos deben contener 2 o más células - Incline la placa Petri de 10 cm que contiene el chip en 45 grados.
- Lave el chip con el búfer de suspensión 1x para eliminar las células no capturadas de la superficie de la viruta mediante un pipeteo suave de la parte superior a la parte inferior del chip. Repita 3 veces.
- Prepare el instrumento occidental de una sola célula.
- Establezca el tiempo de lisis, el tiempo de electroforesis y el tiempo de captura UV. Para analizar los macrófagos reclutados recuperados de la clavija de gel derivada de membrana del sótano, utilice los siguientes ajustes: tiempo de lisis: 0 s; tiempo de electroforesis: 160 s; Tiempo de captura UV 240 s.
- Cargue cuidadosamente el chip en la célula de electroforesis del instrumento occidental de una sola célula, mirando hacia el lado del gel. Tenga cuidado de no dañar el lado del gel del chip.
- Vierta el tampón de lisis/ejecución en la cámara y cubra completamente todo el chip occidental de una sola célula. Inicie la lisis celular.
- Ejecute el instrumento scWB utilizando el ajuste indicado en 5.8.
- Una vez completada la carrera, transfiera el chip a un plato Petri de 10 cm y lave el chip dos veces con 1x tampón de lavado durante 10 minutos en RT.
- Preparar las diluciones de anticuerpos primarios (anti-vinculina: 1:10; anti-CD45: 1:15, anti-CD11b: 1:20, anti-F4/80: 1:10) en un volumen total de 80 l de diluyente de anticuerpos (mezcla 8 l de anticuerpo 1 más 8 l de anticuerpo 2 más 64 l de diluyente).
- Añadir 80 l de la solución de anticuerpos primarios a la cámara de sondeo de anticuerpos y bajar el lado del gel de viruta hacia abajo para que la solución de anticuerpos se mete a través del chip.
- Incubar con la solución primaria de anticuerpos durante 2 h a RT.
- Lave el chip tres veces durante 10 minutos en 1 x tampón de lavado en la coctelera.
- Lave el chip una vez durante 10 minutos en el agua de la coctelera para desalar el gel.
- Preparar una dilución 1:20 del anticuerpo secundario en un volumen total de 80 l (mezclar 2 s de anticuerpo secundario más 78 l de diluyente).
- Incubar el chip con anticuerpo secundario durante 1 h a RT protegido de la luz.
- Lave el chip tres veces durante 10 min con 1 tampón de lavado en la coctelera.
- Gire el chip con un hilandero deslizante para eliminar cualquier búfer de lavado restante.
- Escanee el chip en un escáner de microarray de doble láser a una resolución de 5 m en el canal espectral del fluoróforo acoplado a los anticuerpos secundarios.
- Analice los datos utilizando software específico de scWB.
6. Desmontaje del chip scWB
- Guarde el chip escaneado en el tampón de lavado hasta que esté listo para desmontar.
- Coloque el baño de agua en una campana de humos.
- Coloque un portatubos de 50 ml en el baño de agua con el agua a solo 1 cm por encima del bastidor y ajuste la temperatura del agua a 60 oC.
- Prepare el búfer de desmontaje. Para 1 L de solución tampón de desmontaje, disolver 9,85 g de Tris-HCl (pH 6,8) y 20 g de SDS en 900 ml de agua destilada y ajustar el pH. A continuación, llene con agua destilada a 1L. Añadir 0,8% (v/v) de é-mercaptoetanol (-ME; 14,3 M) inmediatamente antes de cada uso.
- Después de la exploración inicial, coloque el chip en una placa Petri de 10 cm antes de desmontarla.
- Para cada chip, tome 40 ml de tampón de desmontaje y agregue 320 l de é-ME.
ADVERTENCIA: El ME es tóxico y es peligroso para el ser humano y el medio ambiente. El siguiente procedimiento debe realizarse en una campana de humos. - Coloque la viruta en el recipiente y selle el recipiente con parafilm para evitar que se filtre agua en el recipiente.
- Coloque el recipiente dentro del portatubos en el baño de agua precalentado.
- Incubar durante 90 min.
- Retire cuidadosamente el chip del recipiente y colóquelo en un plato petri fresco.
- Lave brevemente el chip una vez con 1 x tampón de lavado. A continuación, añadir 15 ml de 1x tampón de lavado a la placa Petri.
- Lave el chip durante 15 minutos en una coctelera. Repita el paso de lavado cuatro veces.
NOTA: El chip está listo para el siguiente anticuerpo primario (ver pasos 5.12 - 5.21).
Resultados
Para acceder a la capacidad de respuesta de los monocitos sanguíneos a los quimioatractores, inyectamos la solución derivada de membrana de sótano cargada por vehículo y MCP-1 en los flancos izquierdo y derecho de cada ratón. Se retiraron los tapones de gel derivados de membranas de sótano 1, 3 y 5 días después de que se contaran las inyecciones, se disolvieron y se contaban las células reclutadas en cada tapón (Figura 1A). Al restar el recuento de celdas en el enchufe cargado por el vehículo (barras abiertas) del recuento de celdas en el enchufe cargado MCP-1 (barras cerradas), obtuvimos el número de celdas específicamente reclutadas en respuesta a MCP-1 (Número de celda, Figura 1B). Observamos un reclutamiento y acumulación acelerados específicos de MCP-1 de células durante el período de 5 días, con tasas que aumentaron de 31.000 celdas/día (Día 1) a 78.000 células/día (Día 3) y 136.000 células/día en el día 5 (Figura1B).
Para identificar los tipos de células que entraron en los tapones de gel derivados de membrana del sótano, sometamos las células aisladas de cada enchufe al análisis de manchas occidentales de una sola célula (scWB), sondeando para la expresión CD45, CD11b y F4/80 para identificar monocitos (CD11b+F4/80 -), macrófagos (CD11b+F4/80+ más CD11b-F4/80+) y leucocitos no monocíticos restantes (CD45+CD11b-F4/80-) (Figura 2). Los chips scWB fueron sondeados para la vinculina para determinar el número total de células en cada gel y para confirmar la ocupación de una sola célula de los micropozos en el chip scWB. El porcentaje de monocitos dentro de los tapones de gel derivados de membrana de sótano cargados MCP-1 fue bajo en el día 1, 20%, alcanzó su punto máximo en el día 3 en 47%, respectivamente antes de caer al 14% en el día 5 (Figura2D). Los números de macrófagos dentro de los tapones de gel derivados de membranas de sótano cargados por MCP-1 aumentaron constantemente del 13% en el día 1, al 22% en el día 3 y al 23% en el día 5. Para los enchufes con carga MCP-1, el porcentaje de monocitos más macrófagos dentro de la población celular aislada fue mayor en el día 3, el 31% en los enchufes cargados por vehículos (Figura3A)y el 58% en los enchufes cargados con MCP-1 (Figura3B),lo que indica que después de 3 días la gran mayoría de las células reclutadas por la quimiotaxis dependiente del MCP-1 son monocitos y macrófagos. A pesar de que el número total de monocitos más macrófagos fue mayor en el día 5 en comparación con el día 3 (Figura3C yD), debido a la proporción significativamente mayor de monocitos y macrófagos en la población celular total (Figura3A y B), el recuento celular en el día 3 refleja con mayor precisión la quimiotaxis de monocitos sanguíneos y el reclutamiento. Por lo tanto, inyectamos rutinariamente la solución derivada de membrana del sótano tres días antes de sacrificar los animales. No se determinó si todos los macrófagos reclutados por MCP-1 son macrófagos de origen monocitos o residentes reclutados de tejidos vecinos aportados.
El análisis estadístico de los datos mostrados aquí se llevó a cabo con software de análisis (por ejemplo, SigmaPlot 14). ANOVA seguido de la prueba Fischer LSD se utilizó para comparar los valores medios entre grupos experimentales. Todos los datos se presentan como media sD de al menos 3 experimentos independientes. Los resultados se consideraron estadísticamente significativos a nivel P < 0.05.
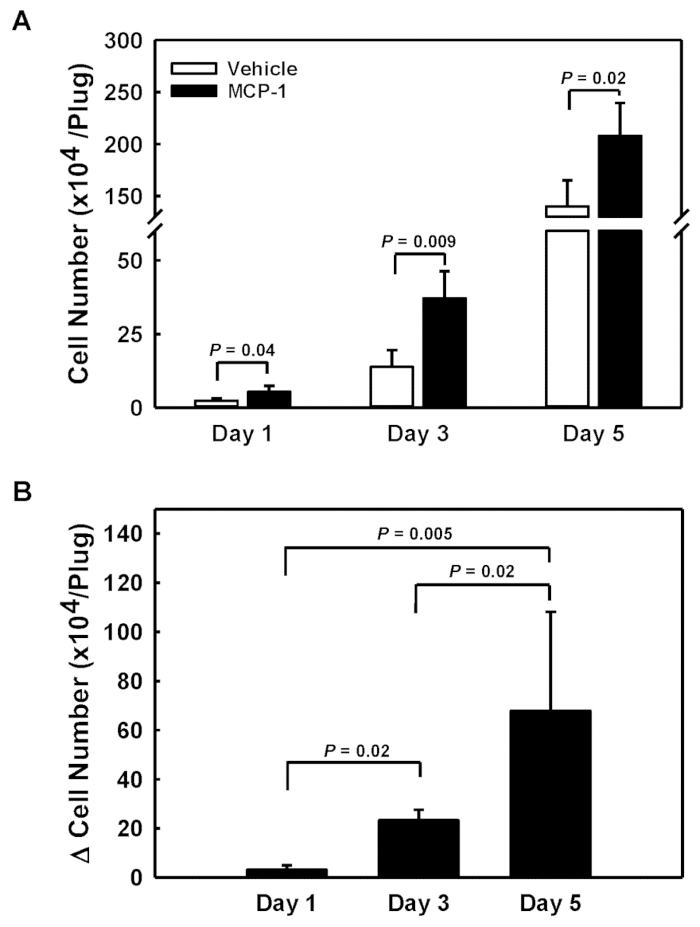
Figura 1 : Cantidad de células reclutadas en tapones de gel derivados de membranas de sótano subcutáneos. (A) Números de celda absolutos para tapones de gel derivados de membranas de sótano cargados por vehículo (barras abiertas) y MCP-1 (barras cerradas). (B) El número de células reclutadas en tapones de gel derivados de membranas de sótano por MCP-1 calculado como la diferencia en los números de celda entre los enchufes cargados por MCP-1 y los enchufes cargados por el vehículo. Los resultados se muestran como medias sD (n-4) Haga clic aquí para ver una versión más grande de esta figura.
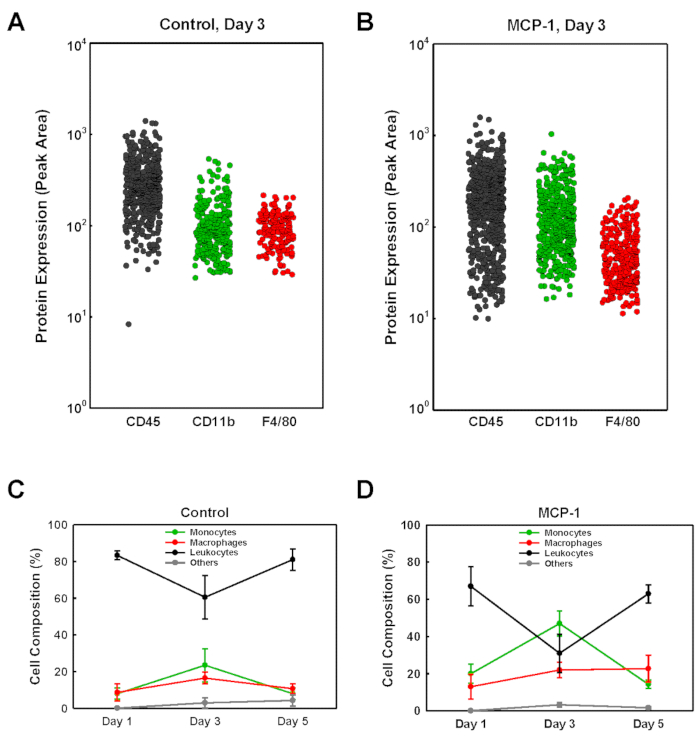
Figura 2 : Análisis de las poblaciones celulares reclutadas en tapones de gel derivados de membranas de sótano mediante el análisis de manchas occidentales de una sola célula. (A+B) Se muestran ejemplos representativos para el análisis scWB de un vehículo cargado (Control) y un enchufe con cable MCP-1 (MCP-1) aislado de un ratón tres días después de la inyección. Chips etiquetados con anticuerpos dirigidos contra CD45, CD11b y F4/80 seguidos de anticuerpos secundarios fluorescentes como se describe en el Protocolo. La intensidad de fluorescencia de la banda etiquetada para cada célula individual se muestra como área pico. (C+D) Las poblaciones celulares se identificaron como monocitos (CD11b+F4/80-,  ), macrófagos (CD11b+F4/80+ más CD11b-F4/80+,
), macrófagos (CD11b+F4/80+ más CD11b-F4/80+,  ) o como leucocitos no monocíticos (CD45+ ,
) o como leucocitos no monocíticos (CD45+ ,  ). Las celdas restantes fueron etiquetadas como "otras" (
). Las celdas restantes fueron etiquetadas como "otras" ( ). Los resultados se muestran como medias de SD (n x 3). Haga clic aquí para ver una versión más grande de esta figura.
). Los resultados se muestran como medias de SD (n x 3). Haga clic aquí para ver una versión más grande de esta figura.
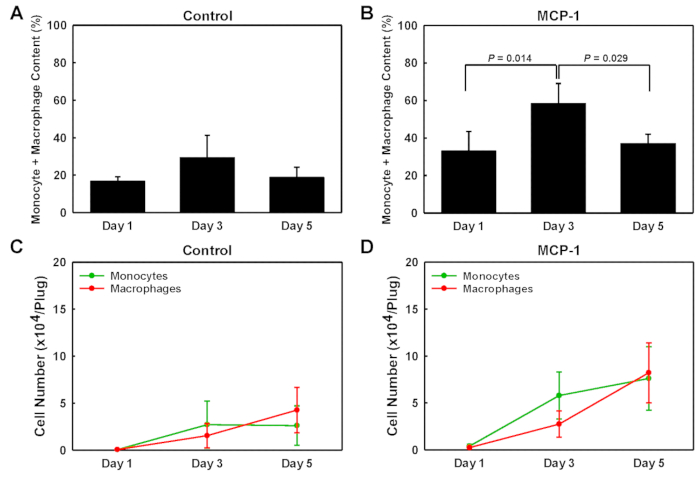
Figura 3 : Contenido de monocitos y macrófagos de tapones de gel derivados de membranas de sótano. Análisis cuantitativo del contenido de monocitos y macrófagos reclutados en tapones cargados por vehículos y MCP-1 eliminados en los días 1, 3 y 5 después de la inyección. Los valores se muestran como porcentaje de la población celular total (A + B) y en números de celda absolutos por enchufe ( C +D). Los resultados se muestran como medias de SD (n x 3). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Desarrollamos un ensayo quimiotaxis in vivo, haciendo uso de las propiedades físicas únicas de la matriz derivada de la membrana del sótano y la capacidad de cargar esta matriz única con quimiolinas e inyectarla en ratones. El ensayo nos permite evaluar en ratones vivos la capacidad de respuesta de los monocitos (y macrófagos) a las quimioquinas, como se ilustra aquí para MCP-1, y los efectos de la manipulación genética o las exposiciones farmacológicas, dietéticas y otras exposiciones ambientales en monocitos Quimiotactismo. Debido a que el gradiente de quimiocina que creamos en estos ratones no se ve esencialmente afectado por la exposición genética, farmacológica, dietética o ambiental, los cambios en la actividad quimiotáctica de los monocitos reflejan realmente los cambios funcionales en estos monocitos y, como mostramos anteriormente, también la reprogramación tanto a nivel proteico como transcripcional17,20. Informamos que el estrés metabólico en ratones aumenta la capacidad de respuesta de los monocitos a la quimioattractante y que esta actividad hiperquimiotáctica se correlaciona con el aumento de la proteína S-glutathionylation, una posttranslacional reversible, dependiente de redox modificación de proteínas, que en la mayoría de los casos conduce a la pérdida de la función enzimática y proteica21,22, y en algunos casos incluso promueve la degradación de las proteínas16,23.
Para ejecutar con éxito este procedimiento y para obtener resultados óptimos con este ensayo es fundamental que los volúmenes precisos de la solución derivada de membrana de sótano se inyectan lentamente para crear un tapón singular bien formado y las cápsulas fibrosas deben ser eliminados completamente para obtener tapones limpios cuando cosecha tapones de gel derivados de membrana sótano, facilita la disolución de todo el enchufe en la solución de dispensación. Nuestros datos muestran que dejar el enchufe en los animales durante tres días optimiza 1) la intensidad de la señal, es decir, el número de monocitos y macrófagos reclutados en cada enchufe, 2) la selectividad de la señal, es decir, el contenido de monocitos y macrófagos dentro del total de poblaciones celulares y 3) la especificidad de la señal, es decir, el aumento de monocitos y macrófagos en respuesta a MCP-1 en comparación con el vehículo. Por último, demostramos cómo los enfoques de última generación basados en células únicas junto con el ensayo de tapón de gel derivado de la membrana del sótano se pueden utilizar para caracterizar a los monocitos reclutados en los enchufes y así obtener una instantánea del fenotipo potencial de los macrófagos derivados de monocitos que se reclutan en sitios de lesión en cualquier modelo de ratón dado en respuesta a intervenciones genéticas, farmacológicas, dietéticas o ambientales específicas.
Hay una serie de limitaciones del ensayo a tener en cuenta. En primer lugar, el manejo del ratón, incluida la anestesia, la inyección de la solución derivada de la membrana del sótano y la disección quirúrgica, requiere la práctica para generar enchufes individuales y datos reproducibles. En segundo lugar, mientras que la mayoría de las células reclutadas en los tapones cargados MCP-1 son monocitos y macrófagos, un número sustancial no lo son. Esto puede afectar la interpretación de otros ensayos analíticos no basados en células únicas realizados en esta población celular. Por último, dado que las condiciones de lisis celular para el scWB son leves, las distancias de migración de proteínas pueden diferir de la WB estándar y no pueden correlacionarse con el tamaño de la proteína. Por lo tanto, tanto la lisis celular como los tiempos de ejecución deben validarse para cada nueva proteína que se va a probar y cada anticuerpo primario utilizado.
Divulgaciones
Ninguno.
Agradecimientos
Este proyecto fue apoyado por subvenciones a R.A. del NIH (AT006885).
Materiales
| Name | Company | Catalog Number | Comments |
| 10 cm petri dish | griner bio-one | 664 160 | |
| 10x suspension buffer | proteinsimple | R101 | |
| 15 cm petri dish | Falcon | 353025 | |
| 2-Mercaptoethanol | MP BIOMEDICALS | 2194705 | |
| 5% washing buffer | proteinsimple | R252 | |
| Antibody diluent | proteinsimple | 042-203 | |
| Bench Top Centrifuge | Beckman Coulter | Microfuge 22R Centrifuge | |
| Bovine Serim Albumin | Sigma-Aldrich | A7906-100G | |
| Calcein AM | ThermoFisher | C3099 | 1 mL |
| CD11b | Novus Biologicals | NB110-89474 | |
| CD45 (D4H7K) rabbit mAb | Cell Signal Technologies | 727987S | |
| CD68/SR-D1 (FA-11) | Novus Biologicals | NBP2-33337SS | |
| Cellometer Vision | Nexcelom | ||
| Dispase | BD | 354235 | 100 mL |
| Dissecting sissor | |||
| Donkey anti-Rabbit IgG secondary antibody [NL557] | Novus Biologicals | NL004 | NL 557 conjugate |
| Donkey anti-Rat IgG (H+L) secondary antibody [DyLight 650] | Novus Biologicals | NBP1-75655 | DyLight 650 conjugate |
| F4/80 (CI-A3-1) | Novus Biologicals | NB600-404SS | |
| Heat Block | effendorf | 22331 | Thermomixer |
| Lysis/Running buffer | proteinsimple | R200 | |
| Matrigel Matrix (Grwoth Factor Reduced) | BD | 354230 | 10 ml |
| Microarray scanner | PerkinElmer | ScanArray Gx | |
| Microcentrifuge tube | Fisher Scientific | 05-408-129 | |
| Microscope | ThermoFisher | Evos fl | |
| Milo | proteinsimple | Single cell western | |
| Needle | BD | 305111 | 26 G |
| Parafilm | |||
| Probing chamber | proteinsimple | 035-020 | |
| Recombinant mouse CCL2/JE/MCP-1 protein | R&D | 479-JE-050 | |
| scWEST chip | proteinsimple | C300 | |
| Shaker | Bioexpress | Gene mate orbital shaker | |
| Single cell western chip canister | proteinsimple | 035-118 | |
| Slide spinner | Labnet | C1303-T | |
| Sodium Dodecyl Sulfate (SDS) | Fisher Scientific | BP 166-500 | |
| Syringe | BD | 309602 | 1 mL |
| Tris-Hydrochloride | Fisher Scientific | BP 153-500 | |
| Tweezer | proteinsimple | 035-020 | |
| Water bath | ThermoFisher |
Referencias
- Moore, K. J., Tabas, I. Macrophages in the pathogenesis of atherosclerosis. Cell. 145 (3), 341-355 (2011).
- Chawla, A., Nguyen, K. D., Goh, Y. P. Macrophage-mediated inflammation in metabolic disease. Nature Reviews Immunology. 11 (11), 738-749 (2011).
- McNelis, J. C., Olefsky, J. M. Macrophages, immunity, and metabolic disease. Immunity. 41 (1), 36-48 (2014).
- Akiyama, T., et al. Genistein, a specific inhibitor of tyrosine-specific protein kinases. Journal of Biological Chemistry. 262 (12), 5592-5595 (1987).
- Nahrendorf, M., Pittet, M. J., Swirski, F. K. Monocytes: protagonists of infarct inflammation and repair after myocardial infarction. Circulation. 121 (22), 2437-2445 (2010).
- Gosling, J., et al. MCP-1 deficiency reduces susceptibility to atherosclerosis in mice that overexpress human apolipoprotein B. Journal of Clinical Investigation. 103 (6), 773-778 (1999).
- Fantuzzi, L., et al. Loss of CCR2 expression and functional response to monocyte chemotactic protein (MCP-1) during the differentiation of human monocytes: role of secreted MCP-1 in the regulation of the chemotactic response. Blood. 94 (3), 875-883 (1999).
- Boring, L., Gosling, J., Cleary, M., Charo, I. F. Decreased lesion formation in CCR2-/- mice reveals a role for chemokines in the initiation of atherosclerosis. Nature. 394 (6696), 894-897 (1998).
- Han, K. H., Tangirala, R. K., Green, S. R., Quehenberger, O. Chemokine receptor CCR2 expression and monocyte chemoattractant protein-1-mediated chemotaxis in human monocytes. A regulatory role for plasma LDL. Arteriosclerosis Thrombosis Vascular Biology. 18 (12), 1983-1991 (1998).
- Kanda, H., et al. MCP-1 contributes to macrophage infiltration into adipose tissue, insulin resistance, and hepatic steatosis in obesity. Journal of Clinical Investigation. 116 (6), 1494-1505 (2006).
- Davies, M. J., et al. The expression of the adhesion molecules ICAM-1, VCAM-1, PECAM, and E-selectin in human atherosclerosis. Journal of Pathology. 171, 223-229 (1993).
- Anderson, T. J., et al. The effect of cholesterol-lowering and antioxidant therapy on endothelium-dependent coronary vasomotion (see comments). New England Journal of Medicine. 332 (8), 488-493 (1995).
- Herold, S., Mayer, K., Lohmeyer, J. Acute lung injury: how macrophages orchestrate resolution of inflammation and tissue repair. Frontiers in Immunology. 2, (2011).
- Qiao, M., et al. Thiol Oxidative Stress Induced by Metabolic Disorders Amplifies Macrophage Chemotactic Responses and Accelerates Atherogenesis and Kidney Injury in LDL Receptor-Deficient Mice. Arteriosclerosis Thrombosis Vascular Biology. 29, 1779-1786 (2009).
- Ullevig, S., et al. NADPH Oxidase 4 Mediates Monocyte Priming and Accelerated Chemotaxis Induced by Metabolic Stress. Arteriosclerosis Thrombosis Vascular Biology. 32 (2), 415-426 (2012).
- Kim, H. S., Ullevig, S. L., Zamora, D., Lee, C. F., Asmis, R. Redox regulation of MAPK phosphatase 1 controls monocyte migration and macrophage recruitment. Proceedings of the National Academy of Science. 109 (41), E2803-E2812 (2012).
- Kim, H. S., Tavakoli, S., Piefer, L. A., Nguyen, H. N., Asmis, R. Monocytic MKP-1 is a Sensor of the Metabolic Environment and Regulates Function and Phenotypic Fate of Monocyte-Derived Macrophages in Atherosclerosis. Scientific Reports. 6, 34223(2016).
- Ponce, M. L. Tube formation: an in vitro matrigel angiogenesis assay. Methods in Molecular Biology. 467, 183-188 (2009).
- Auerbach, R., Lewis, R., Shinners, B., Kubai, L., Akhtar, N. Angiogenesis assays: a critical overview. Clinical Chemistry. 49 (1), 32-40 (2003).
- Kim, H. S., Ullevig, S. L., Nguyen, H. N., Vanegas, D., Asmis, R. Redox regulation of 14-3-3zeta controls monocyte migration. Arteriosclerosis, Thrombosis, and Vascular Biology. 34 (7), 1514-1521 (2014).
- Short, J. D., Downs, K., Tavakoli, S., Asmis, R. Protein Thiol Redox Signaling in Monocytes and Macrophages. Antioxidants and Redox Signaling. 25 (15), 816-835 (2016).
- Tavakoli, S., Asmis, R. Reactive oxygen species and thiol redox signaling in the macrophage biology of atherosclerosis. Antioxidants and Redox Signaling. 17 (12), 1785-1795 (2012).
- Ullevig, S. L., et al. Protein S-Glutathionylation Mediates Macrophage Responses to Metabolic Cues from the Extracellular Environment. Antioxidants and Redox Signaling. 25 (15), 836-851 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados