Method Article
Количественная оценка моноцитной хемотаксической активности in Vivo и характеристика кровяных моноцитов, полученных макрофагами
В этой статье
Резюме
Здесь мы представляем протокол количественной оценки хемотаксической активности моноцитов крови в моделях мышей, для оценки влияния питательных, фармакологических и генетических вмешательств на моноцит крови и для характеристики моноцитов крови, полученных макрофагами в мыши модели с использованием моноцитов-химиоаттрактор белка-1 (MCP-1) загружены подвалм мембраны полученных гель пробки.
Аннотация
Ткань гомеостаза и ремонта критически зависят от набора моноцитов полученных макрофагов. Как под-, так и чрезмерной вербовки моноцитов полученных макрофагов может ухудшить заживление ран. Мы показали, что диеты с высоким содержанием жира и высоким содержанием сахара способствуют моноцитной грунтовке и дисфункции, превращая здоровые моноциты крови в гипер-хемотактический фенотип, готовый дифференцироваться в макрофаги с дисрегулируемыми профилями активации и нарушениями фенотипии Пластичности. Считается, что чрезмерное набор макрофагов, полученных из моноцитов, и набор макрофагов с дисрегулируемыми профилями активации являются одним из основных факторов развития хронических воспалительных заболеваний, связанных с нарушениями обмена веществ, включая атеросклероз и ожирение. Цель этого протокола состоит в том, чтобы количественно химиотерапии хемотаксической активности моноцитов крови в качестве биомаркера для моноцитов грунтовки и дисфункции и охарактеризовать макрофаговые фенотипные моноциты крови готовы дифференцироваться в этих моделях мыши. Используя одноклеточный западный анализ помок, мы показываем, что после 24 ч 33% клеток, завербованных в MCP-1-загруженных подвальных мембранных гель пробки вводят сявок в мышах моноциты и макрофаги; 58% после 3-го дня. Однако на 5-й день количество моноцитов и макрофагов значительно уменьшилось. Наконец, мы показываем, что это анализ также позволяет для изоляции живых макрофагов от хирургически извлеченных подвале мембраны полученных гель пробки, которые затем могут быть подвергнуты последующей характеристики одной клетки Западного анализа помарки.
Введение
Набор моноцитовных макрофагов необходим для развития хронических воспалительных заболеваний, связанных с нарушениями обмена веществ, включая атеросклероз иожирение1,2, 4. Количество моноцитов полученных макрофагов в местах повреждения тканей, а также их пластичность имеют решающее значение для ткани гомеостаза и ремонта. Как под- так и чрезмерной вербовки моноцитов полученных макрофагов может ухудшить заживление ран5. Запуск местного воспаления тканей, например, накоплением и окислением липопротеинов низкой плотности (ЛПНП) в стенке аорты или воспалительной активацией адипоцитов жирными кислотами или бактериальным липополисахаридом, протекающим через кишечник барьер, приводит к высвобождению воспалительных посредников, в том числе хемокины, такие как моноцитх хемоаттракторный белок-1 (MCP-1/CCL2). MCP-1 является членом семьи C-C хемокин и ключевым хемоатантитантом, ответственным за набор моноцитов полученных макрофагов к местам воспаления тканей и травм6,7,8, 9,10. Воспалительная активация сосудистого эндотелия приводит к выражению молекул спаек, таких как межклеточная молекула адгезии 1 (ICAM-1) и молекула сцепления сосудистых клеток 1 (VCAM-1)11,12, циркулирующие моноциты, активированные MCP-1, катятся, твердо придерживаются и впоследствии перемещаются в субэндотелиальное пространство12. Проникновение моноцитов дифференцируется в макрофаги, которые могут быть активированы в провоспалительный фенотип, приводя к острому воспалительному процессу. Движимые микросредой, провоспалительные макрофаги могут превращаться в макрофаги, разрешающие воспаление, которые играют важную роль в очистке воспалительных клеток, удаляя провоспалительные сигналы и завершая восстановление тканей и раны исцеление12,13.
Хронический метаболический стресс премьермонов для резко повышенной отзывчивости к химио-аграрных и увеличение набора моноцитов, и мы показали, что загрунтованы моноциты приводят к макрофагам с дисрегулируемыми программами активации и поляризации государства14,15,16. Моноцитная грунтовка способствует атеросклерозу, ожирению и, возможно, другим хроническим воспалительным заболеваниям, связанным с нарушениями обмена веществ, такими как стеатогепатит, заболевания почек и, возможно, рак. Для оценки и количественной оценки моноцитов в мышиных моделях человеческих заболеваний, мы разработали новую методику оценки грунтового состояния моноцитов крови путем измерения хемотаксической активности in vivo14,15,16, 17. Наш подход включает в себя инъекцию подвальных мембранных гель, загруженный либо хемоатракторант - мы обычно используем MCP-1 - или транспортное средство в левый и правый фланг, соответственно, мышей. При тщательном введении подкожно, подвальная мембранно-производная гель образует единую вилку, из которой хемокины могут рассеиваться и создать определенный хемотактический градиент, который не зависит от метаболического или воспалительного состояния окружающего ткани или мыши получателя.
Вподвалммский мембранный гель, который мы используем для нашего анализа, является растворимым препаратом мембраны подвала, извлеченным из саркомы мыши Энгельбрет-Холм-Срой (EHS), опухоли, богатой такими внеклеточными белками матрицы (ECM). Эта сложная белковая смесь содержит ламинин (60%), коллаген IV (30%), молекулу моста (8%) и ряд факторов роста. Цокольный мембраны матрицы разъем асссе был первоначально разработан для исследования ангиогенеза в ответ на различные факторы роста18,19. Однако, для того, чтобы изучить моноцитх хемотаксис, важно использовать фактор роста истощенных подвале мембраны полученных гель, чтобы свести к минимуму эндотелиальной вербовки клеток и ангиогенеза. Что делает Matrigel (именуемый как подвал мембраны полученных гель отныне) уникальный и особенно полезным является то, что при температурах ниже 10 градусов по Цельсию он разжижает, что позволяет хемокины должны быть растворены. При температурах выше 22 градусов По Цельсию раствор, полученный из мембраны в подвале, быстро проходит фазовый переход и быстро образует гидрогель. Вилки могут быть хирургически вырезаны, очищены и растворены с бациллы полученных нейтральной металлопротоаз, чтобы дать одноклеточных суспензии, которые могут быть проанализированы на флуоресценции активированный сортчик клеток (FACS), по RNAseq, одноклеточной РНК и ряд других омичи методы. Здесь мы описываем использование одноклеточного западного анализа почек для характеристики популяций клеток, завербованных в подвальных мембранных гель-вилки один, три или пять дней после инъекции.
протокол
Все методы, описанные в этом протоколе, были одобрены Институциональным комитетом по уходу за животными и использованию в Медицинской школе Уэйк-Форест.
1. Подготовка MCP-1-загруженный фактор роста-уменьшенный Подвал Membrane-производные решения
ПРИМЕЧАНИЕ: Это стерильная процедура.
- Чистый капюшон клеточной культуры с дезинфицирующим средством перед приготовлением подвальной мембраны производных раствора (например, Matrigel).
- Подготовка индивидуально упакованы стерильные 1 мл шприц и протрите верхней части подвала мембраны производные раствора флакон с спиртом мазок перед загрузкой его в шприц.
- Полностью разморозить фактор роста-уменьшенный подвальный мембранно-производный раствор на льду.
ПРЕДЕКТО: Если мембранная матрица подвала размораживаются при комнатной температуре (RT), обеспечить небольшую частицу льда остается, чтобы предотвратить раствор от желе. - После оттаять, открыть флакон и смешать MCP-1 или 1xPBS с 0,1% BSA в клеточной культуре капот.
- Приготовьте 1 мл стерильного шприца с иглой 26 G и охладите на льду.
- Подготовьте складское решение MCP-1 путем растворения MCP-1 до конечной концентрации 50 мкг/мл в 1x PBS с 0,1% BSA.
- Разбавить MCP-1 в 5 мл холодного мембранного раствора, полученного в подвале, до конечной концентрации 500 нг/мл. Подготовьте равное количество раствора, полученного из мембраны в подвале, только с автомобилем (1x PBS содержит 0,1% BSA).
- Загрузите 500 л подвальных мембранных растворов (с или без MCP-1) в холодном шприцу 1 мл.
- Удалите все пузырьки воздуха из подвала мембраны производные решения загружены шприц, прежде чем сделать инъекцию для обеспечения равномерного образования плагина.
2. Инъекция подвальных мембранных растворов, полученных из подвальных вмейбранов
- Спрей 70% этанола вокруг процедуры области до и во время инъекций для дезинфекции окружающей среды.
- Чтобы вызвать анестезию, поместите мышь в анестезионную камеру и установите o2 измеритель потока до 1 литра/мин, затем отрегулируйте испаритель до 2% изофлуарана.
- Мониторинг глубины анестезии путем мониторинга частоты дыхания (скорость/мин), роговицы рефлекс а также движения усов.
- В течение всей процедуры, поддерживать анестезию с помощью конуса носа.
- Во время процедуры продолжайте мониторинг частоты дыхания (скорость/мин), роговицы рефлекса и движения усов для проверки глубины анестезии.
- После подтверждения отсутствия ответа на щепотку, медленно вводить (приблизительно 100 л/с) подкожно производный раствор мембраны подвала вправо (без MCP-1) и левый (с MCP-1) фланг мыши, соответственно. Если инъекция слишком медленно, подвал мембраны полученных гель пробки могут стать неправильной формы, или даже фрагментированные, и трудно удалить.
- Держите шприц в течение 20-30 с после инъекции, чтобы предотвратить утечку раствора и позволить одной гладкой гель-подключаемый к форме.
- После инъекции, размещение мыши на разогрева площадку с мониторингом до восстановления.
- Верните мышь в исходную клетку после полного восстановления мыши.
3. Урожай подвалм Мембрана полученных гель Plugs
- Взвесьте две отдельные микроцентрифугные трубки мощностью 1,5 мл для каждой мыши и пометьте их.
- Через три дня после инъекции подвального мембранного раствора, эвтаназии мыши в анестезии камеры с помощью 3% изофлуран с последующим вывихом шейки матки.
- Удалите тонченный мех мыши с помощью клиперов для волос или нанесите крем для удаления волос с хлопчатобумажными палочками в течение 5 минут, а затем стричь.
- Держите кожу мыши с помощью щипцов вокруг нижней грудной и верхней поясничных позвонков и сделать 2 мм длиной разрез в кожу.
- Вырежьте среднюю линию задней мыши от разреза, составленного до шейных позвонков и опуститься на 1 см над соединением хвостовых позвонков (хвостовой перекресток) хирургическими ножницами.
- Отделить кожу от мышечного слоя и закрепить кожу на платформе полистирола пены.
- Тщательно держите волокнистой капсулы, которая содержит подвал мембраны полученных гель штепсельной вилки с помощью тонких щипцов и удалить волокнистой капсулы с помощью тонких ножниц для очистки вилки.
- Удалите очищенный подвальный мембранный гель штепсельную вилку и перенесите на микроцентрифуг е 1,5 мл (см. 3.1).
- Взвесьте микроцентрифугую трубку с очищенной мембранной гельовой вилкой, полученной в подвале, и вычислите вес гель-разъема, полученного из мембраны.
4. Дайджест Подвал Мембрана полученных гель Plugs
- Оттепель раздавлить (10 мл) на льду.
- Фарш подвала мембраны полученных гель подключить в микроцентрифуге трубки с помощью чистых ножниц.
- Добавьте 800 л dispase в каждую микроцентрифугую трубку, содержащую подвальную мембранную гель-штепсельную вилку.
- Вихрь с максимальной скоростью 10 с, чтобы нарушить вилку.
- Инкубировать микроцентрифуговых труб в течение 2 ч при 37 градусах По Цельсия при 1400 об/мин в термомиксере, чтобы полностью растворить гель-штепсельную вилку, полученную в подвале мембраны.
- После 2 ч центрифуга при 400 х г в течение 10 мин на RT. Тщательно удалите и отбросьте супернатант.
- Приостановите гранулы в 1 мл 1x PBS путем инвертирования или нажав.
- Повторите центрифугацию при 200 х г в течение 10 мин на RT. Тщательно удалить и отбросить супернатант.
- Приостановите действие гранул в 300 Л Л PBS.
- Возьмите 50 зл клеточной суспензии в отдельной микроцентрифуговой трубке.
- Добавьте 0,5 л кальцина AM (1 М) в суспензию клетки.
ПРИМЕЧАНИЕ: Calcein AM является зеленый флуоресцентный краситель жизнеспособности клеток, который только накапливается в живых клетках. - Инкубировать клетки в инкубаторе CO2 при 37 градусах по Цельсию в течение 10 мин.
- Подсчитайте зеленые флуоресцентные (живые) и нефлуоресцентные (мертвые) клетки с помощью автоматизированного счетчика клеток.
5. Определение состава клеток в суспензии клеток с использованием одноклеточного западного поблуния (scWB) Анализ
- Rehydrate чип scWB перед использованием в 15 мл 1x суспензии буфера в чашке Петри, по крайней мере 10 минут на RT.
- Добавьте 1 мл разбавленной одноклеточной подвески (10 000-100 000 клеток/мл) к регидратированному чипу. Установите поверхность на дно 10 см чашку Петри. Убедитесь, что поверхность установлена плоской.
- Обложка чашку Петри с крышкой, чтобы предотвратить сушки и пусть клетки оседают на 5-15 мин градиентом.
- Поместите чип под ярко-поля микроскоп и проверить скважины на 10x увеличение.
ПРИМЕЧАНИЕ: Приблизительно 15-20% микровелл ы должны быть заняты одноклеточными, менее 2% скважин должны содержать 2 или более клеток - Наклоните 10 см Петри блюдо, содержащее чип на 45 градусов.
- Вымойте чип с 1x подвесной буфер, чтобы удалить незахваченные клетки с поверхности чипа нежным pipetting сверху вниз чипа. Повторите 3 раза.
- Подготовьте одноклеточный западный инструмент.
- Установите время лизиса, время электрофореза и время захвата УФ-излучения. Для анализа набранных макрофагов, извлеченных из мембранной гель-штепсельной вилки, используйте следующие настройки: время лизиса: 0 с; время электрофореза: 160 с; ВРЕМЯ уф-захвата 240 с.
- Тщательно загрузите чип в электрофорезную клетку одноклеточного западного инструмента, гелевой стороной. Используйте осторожность, чтобы не повредить сторону геля чипа.
- Налейте лиза/бегущий буфер в камеру и полностью покройте всю одну ячейку западного чипа. Запустите лизатиз клетки.
- Выполнить инструмент scWB с помощью параметра, указанного в 5.8.
- После того, как пробег завершен, передача чипа на 10 см Петри блюдо и мыть чип дважды с 1x стиральный буфер в течение 10 минут на RT.
- Подготовка разбавления первичных антител (анти-винкулин: 1:10; анти-CD45: 1:15, анти-CD11b: 1:20, анти-F4/80: 1:10) в общей объеме 80 л разбавлятельных антител (смесь 8 л антитела 1 плюс 8 л антитела 2 плюс 64 л разбавления).
- Добавьте 80 зл первичного раствора антитела к камере зондирования антител и опустите гель-сторону чипа вниз так, чтобы раствор антитела фитиль через чип.
- Инкубировать с основным раствором антитела для 2 ч на RT.
- Вымойте чип три раза в течение 10 минут в 1x стиральный буфер на шейкер.
- Вымойте чип один раз в течение 10 минут в воде на шейкере, чтобы обеззалить гель.
- Подготовьте 1:20 разбавления вторичных антител в общем объеме 80 зл (смесь 2 злителк вторичного антитела плюс 78 л разбавителя).
- Инкубировать чип вторичным антителом на 1 ч при РТ защищен от света.
- Вымойте чип три раза в течение 10 минут с 1x стиральный буфер на шейкер.
- Спин чип с помощью слайд-спиннер, чтобы удалить оставшийся буфер стирки.
- Сканирование чипа на двойной лазерный микроаррей сканер атс в 5 мкм разрешение на спектральный канал фторофора в сочетании со вторичными антителами.
- Анализ данных с помощью программного обеспечения scWB.
6. Зачистка scWB чип
- Храните отсканированный чип в буфере для мытья до готовности к раздеванию.
- Поместите водяную ванну в дымовой капюшон.
- Поместите 50 мл трубки стойку в водяной бане с водой всего 1 см над стойкой и установить температуру воды на уровне 60 градусов по Цельсию.
- Подготовьте буфер зачистки. Для 1 l зачистки буферного раствора, растворить 9,85 г Tris-HCl (pH 6.8) и 20 г SDS в 900 мл дистиллированной воды и настроить рН. Затем заполните дистиллированной водой до 1Л. Добавить 0,8% (v/v) из -меркаптоэтанола (к-ME; 14.3 M) непосредственно перед каждым использованием.
- После первоначального сканирования поместите чип в 10 см чашку Петри перед зачисткой.
- Для каждого чипа, возьмите 40 мл зачистки буфера и добавить 320 л из й-ME.
ВНИМАНИЕ: К-МЕ является токсичным и опасным для человека и окружающей среды. Следующая процедура должна быть сделана в капюшоне дыма. - Поместите чип в канистру и печать канистру с parafilm для предотвращения утечки воды в канистру.
- Поместите канистру внутри трубки стойку в предварительно разогретой водяной бане.
- Инкубировать в течение 90 мин.
- Аккуратно выньте чип из канистры и поместите в свежее блюдо Петри.
- Кратко промыть чип один раз с 1x мыть буфера. Затем добавьте 15 мл 1x стирального буфера к чашке Петри.
- Вымойте чип в течение 15 минут на шейкере. Повторите шаг стирки четыре раза.
ПРИМЕЧАНИЕ: Чип готов к следующему первичному антителу (см. шаги 5.12 - 5.21).
Результаты
Чтобы получить доступ к отзывчивости модонетов крови к химиоаттракторам, мы вводили автомобиль загруженных и MCP-1 загружены подвалм мембраны производные решения в левый и правый фланги каждой мыши. Подвал мембраны полученных гель пробки были удалены 1, 3 и 5 дней после инъекций, растворенных и клеток, набранных в каждой вилке были подсчитаны(Рисунок 1A). Вычитая количество клеток в транспортном средстве загруженной вилкой (открытые бары) из ячейки в MCP-1 загруженной вилке (закрытые бары), мы получили количество ячеек, специально набранных в ответ на MCP-1 (номер ячейки, рисунок 1B). Мы наблюдали ускоренный НАБОР MCP-1 конкретных и накопления клеток в течение 5-дневного периода, с темпами увеличения от 31000 клеток / день (день 1) до 78000 клеток / день (день 3) и 136000 клеток / день в день 5(рисунок 1B).
Для определения типов клеток, которые вошли в подвалм мембраны производных гель пробки, мы подвергли клетки изолированы от каждой вилки для одноклеточных Западный анализ поделок (scWB), зондирование для CD45, CD11b и F4/80 выражение для выявления моноцитов (CD11b - ,макрофаги (CD11b-F4/80плюс CD11b-F4/80)и остальные немоноцитарные лейкоциты (CD45 cd11b-F4/80- )(Рисунок 2). Чипы scWB были затем исследованы на винкулин, чтобы определить общее число клеток на каждом геле и подтвердить заполняемость одной ячейки микровелл на чипе scWB. Процент моноцитов в MCP-1-загруженных подвале мембраны полученных гель пробки был низким в день 1, 20%, достиг пика на 3 день на 47%, соответственно, прежде чем снижается до 14% в день 5(Рисунок 2D). Макрофаг номера в MCP-1-загруженных подвале мембраны полученных гель пробки неуклонно увеличивается с 13% в день 1, до 22% на 3-й день и 23% на день 5. Для MCP-1-загруженных вилок, процент моноцитов плюс макрофаги в изолированных популяции клеток был самым высоким в день 3, 31% в транспортном средстве загружены пробки(рисунок 3A) и 58% в MCP-1-загруженных вилках (Рисунок 3B), указывая, что после 3 дней подавляющее большинство клеток, набираемых MCP-1-зависимых хемотаксиса являются моноцитами и макрофагами. Несмотря на то, что общее число моноцитов плюс макрофаги были выше в день 5 по сравнению с днем 3C и D), из-за значительно более высокой доли моноцитов и макрофагов в общей популяции клеток (Рисунок 3A и B), количество клеток в день 3 более точно отражает химиотерапию моноцитов крови и вербовки. Поэтому мы регулярно вводим раствор, полученный из мембраны, за три дня до того, как мы жертвуем животными. Все макрофаги, набранные MCP-1, являются моноцитами или резидентами макрофагов, набранных из соседних тканей, не было определено.
Статистический анализ приведенных здесь данных проводился с помощью аналитического программного обеспечения (например, SigmaPlot 14). ANOVA, за которым последовал тест Фишера ЛСД, использовался для сравнения средних значений между экспериментальными группами. Все данные представлены в виде среднего sD, по крайней мере 3 независимых экспериментов. Результаты были сочтены статистически значимыми на уровне P'lt; 0.05.
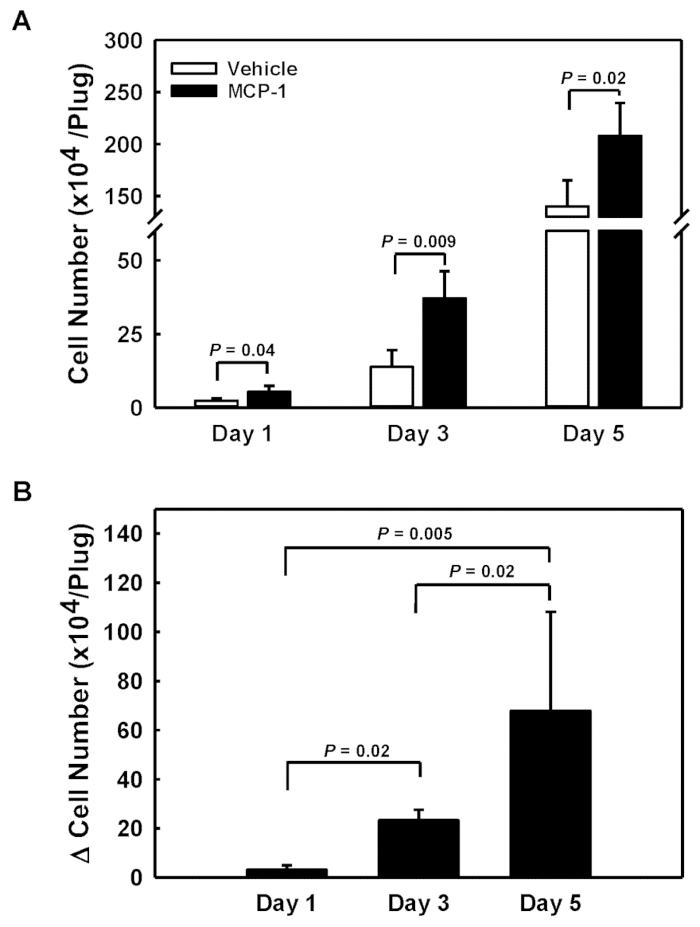
Рисунок 1 : Количественная оценка клеток, завербованных в подкожные подвальные мембранные гель-штепсельные вилки. (A) Абсолютные номера клеток для транспортного средства загружены (открытые бары) и MCP-1-загруженных подвале мембраны полученных гель пробки (закрытые бары). (B) Количество клеток, завербованных в подвале мембраны полученных гель пробки MCP-1 рассчитывается как разница в количестве клеток между MCP-1-загруженных и транспортного средства загружены пробки. Результаты отображаются как средние SD (n'4) Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
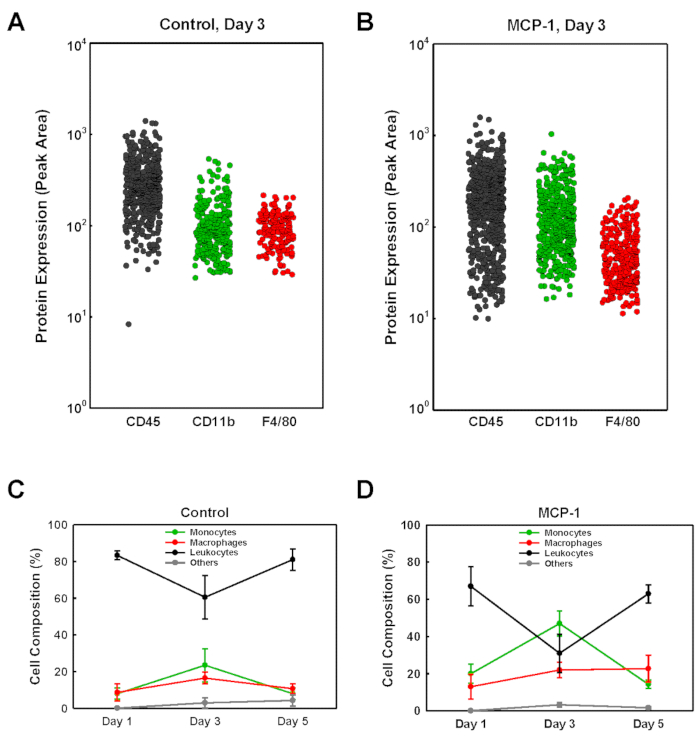
Рисунок 2 : Анализ популяций клеток, завербованных в подвальных мембранных гельных вилки с помощью одноклеточного западного анализа почек. (АЗБ) Представлены примеры для анализа scWB загруженноготранспортного средства (Control) и вилки с ведущими MCP-1(MCP-1),изолированной от мыши через три дня после инъекции. Чипсы, помеченные антителами, направленными против CD45, CD11b и F4/80, сопровождаются флуоресцентными вторичными антителами, как описано в Протоколе. Интенсивность флуоресценции помеченной полосы для каждой отдельной ячейки показана как пиковая область. (СЗД) Популяции клеток были идентифицированы как моноциты (CD11b  иF4/80-, , макрофаги (CD11bиF4/80, плюс CD11b-F4/80,
иF4/80-, , макрофаги (CD11bиF4/80, плюс CD11b-F4/80,  ) или как немоноцитарные лейкоциты (CD45 ,
) или как немоноцитарные лейкоциты (CD45 ,  ). Остальные ячейки были помечены
). Остальные ячейки были помечены как "другие" (). Результаты отображаются как средние SD (n No 3). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
как "другие" (). Результаты отображаются как средние SD (n No 3). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
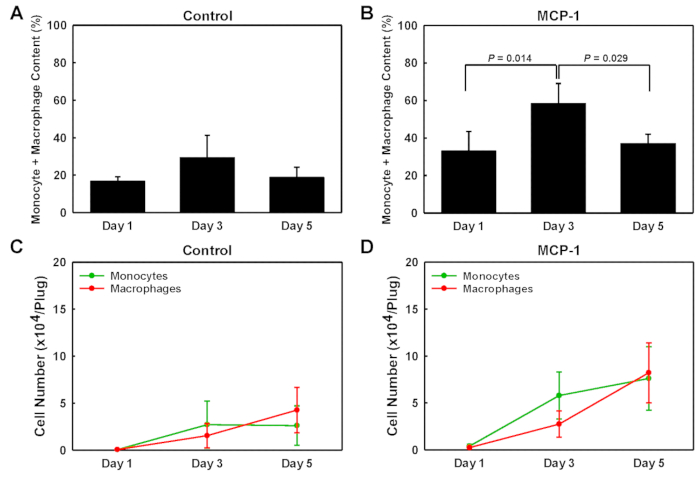
Рисунок 3 : Моноциты и макрофагсодержание подвальных мембранных гельных штепсельных вилок. Количественный анализ набранного содержания набранных моноцитов и макрофагов в загруженных автомобилях и загружаемых ветках MCP-1, удаленных в день 1, 3 и 5 после инъекций. Значения отображаются в процентах от общей численности клеток (AqB) и в абсолютных количестве клеток на плагин (C и D). Результаты отображаются как средние SD (n No 3). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Мы разработали in vivo chemotaxis, с использованием уникальных физических свойств матрицы, полученной из мембраны в подвале, и способности загружать эту уникальную матрицу хемокинами и вводить ее в мышей. Анализ позволяет оценить у живых мышей отзывчивость моноцитов (и макрофагов) к хемокины, как показано здесь для MCP-1, и последствия либо генетических манипуляций или фармакологических, диетических и других экологических воздействия на моноцитов Хемотаксис. Поскольку градиент хемокина, который мы создаем у этих мышей, по существу не зависит от генетического, фармакологического, диетического или экологического воздействия, изменения в моноцитной химиотаксической активности на самом деле отражают функциональные изменения в этих моноцитах и, как мы показали ранее, также перепрограммирование на обоих белка и транскрипционного уровня17,20. Мы сообщили, что метаболический стресс у мышей повышает реакцию моноцитов на хемоататтант и что эта гипер-химиотаксическая активность коррелирует с повышенным белком S-глютатионилированием, обратимым, редокс-зависимым посттрансляционным белковая модификация, которая в большинстве случаев приводит к потере ферментативной и белковой функции21,22,а в некоторых случаях даже способствует деградации белка16,23.
Для успешного выполнения этой процедуры и получения оптимальных результатов с этим тестом очень важно, чтобы точные объемы подвальной мембраны производные решения вводятся медленно, чтобы создать сингулярный хорошо сформированный штепсельии и волокнистые капсулы должны быть удалены полностью, чтобы получить чистые пробки, когда урожай подвале мембраны полученных гель пробки, облегчает растворение всего плагина в растворе диспаз. Наши данные показывают, что оставляя вилку в животных в течение трех дней оптимизирует 1) интенсивность сигнала, т.е. количество моноцитов и макрофагов, завербованных в каждую вилку, 2) избирательность сигнала, т.е. содержание моноцитов и макрофагов в пределах общей популяции клеток и 3) специфика сигнала, т.е. увеличение моноцитов и макрофагов в ответ на MCP-1 по сравнению с транспортным средством. Наконец, мы демонстрируем, как современные одноклеточные подходы в сочетании с анализом гель-разъема для мембраны в подвале может быть использован для характеристики моноцитов, завербованных в вилки, и таким образом получить снимок потенциального фенотипа макрофаги, полученные из моноцитов, набираются на места травм в любой модели мыши в ответ на конкретные генетические, фармакологические, диетические или экологические вмешательства.
Существует ряд ограничений, которые необходимо рассмотреть. Во-первых, обработка мышей, включая анестезию, инъекцию раствора, полученного из мембраны в подвале, и хирургическое вскрытие требует практики для создания одиночных вилок и воспроизводимых данных. Во-вторых, в то время как большинство клеток, набранных в MCP-1 загруженных вилки моноцитов и макрофагов, значительное число не являются. Это может повлиять на интерпретацию других, не одноклеточных аналитических анализов, выполняемых на этой популяции клеток. Наконец, поскольку условия клеточного лиза для scWB являются мягкими, миграционные расстояния белков могут отличаться от стандартных ВБ и не могут коррелировать с размером белка. Таким образом, как лиза клеток и время выполнения должны быть проверены для каждого нового белка, которые будут проверены и каждое первичное антитело используется.
Раскрытие информации
Ни один.
Благодарности
Этот проект был поддержан грантами Р.А. от NIH (AT006885).
Материалы
| Name | Company | Catalog Number | Comments |
| 10 cm petri dish | griner bio-one | 664 160 | |
| 10x suspension buffer | proteinsimple | R101 | |
| 15 cm petri dish | Falcon | 353025 | |
| 2-Mercaptoethanol | MP BIOMEDICALS | 2194705 | |
| 5% washing buffer | proteinsimple | R252 | |
| Antibody diluent | proteinsimple | 042-203 | |
| Bench Top Centrifuge | Beckman Coulter | Microfuge 22R Centrifuge | |
| Bovine Serim Albumin | Sigma-Aldrich | A7906-100G | |
| Calcein AM | ThermoFisher | C3099 | 1 mL |
| CD11b | Novus Biologicals | NB110-89474 | |
| CD45 (D4H7K) rabbit mAb | Cell Signal Technologies | 727987S | |
| CD68/SR-D1 (FA-11) | Novus Biologicals | NBP2-33337SS | |
| Cellometer Vision | Nexcelom | ||
| Dispase | BD | 354235 | 100 mL |
| Dissecting sissor | |||
| Donkey anti-Rabbit IgG secondary antibody [NL557] | Novus Biologicals | NL004 | NL 557 conjugate |
| Donkey anti-Rat IgG (H+L) secondary antibody [DyLight 650] | Novus Biologicals | NBP1-75655 | DyLight 650 conjugate |
| F4/80 (CI-A3-1) | Novus Biologicals | NB600-404SS | |
| Heat Block | effendorf | 22331 | Thermomixer |
| Lysis/Running buffer | proteinsimple | R200 | |
| Matrigel Matrix (Grwoth Factor Reduced) | BD | 354230 | 10 ml |
| Microarray scanner | PerkinElmer | ScanArray Gx | |
| Microcentrifuge tube | Fisher Scientific | 05-408-129 | |
| Microscope | ThermoFisher | Evos fl | |
| Milo | proteinsimple | Single cell western | |
| Needle | BD | 305111 | 26 G |
| Parafilm | |||
| Probing chamber | proteinsimple | 035-020 | |
| Recombinant mouse CCL2/JE/MCP-1 protein | R&D | 479-JE-050 | |
| scWEST chip | proteinsimple | C300 | |
| Shaker | Bioexpress | Gene mate orbital shaker | |
| Single cell western chip canister | proteinsimple | 035-118 | |
| Slide spinner | Labnet | C1303-T | |
| Sodium Dodecyl Sulfate (SDS) | Fisher Scientific | BP 166-500 | |
| Syringe | BD | 309602 | 1 mL |
| Tris-Hydrochloride | Fisher Scientific | BP 153-500 | |
| Tweezer | proteinsimple | 035-020 | |
| Water bath | ThermoFisher |
Ссылки
- Moore, K. J., Tabas, I. Macrophages in the pathogenesis of atherosclerosis. Cell. 145 (3), 341-355 (2011).
- Chawla, A., Nguyen, K. D., Goh, Y. P. Macrophage-mediated inflammation in metabolic disease. Nature Reviews Immunology. 11 (11), 738-749 (2011).
- McNelis, J. C., Olefsky, J. M. Macrophages, immunity, and metabolic disease. Immunity. 41 (1), 36-48 (2014).
- Akiyama, T., et al. Genistein, a specific inhibitor of tyrosine-specific protein kinases. Journal of Biological Chemistry. 262 (12), 5592-5595 (1987).
- Nahrendorf, M., Pittet, M. J., Swirski, F. K. Monocytes: protagonists of infarct inflammation and repair after myocardial infarction. Circulation. 121 (22), 2437-2445 (2010).
- Gosling, J., et al. MCP-1 deficiency reduces susceptibility to atherosclerosis in mice that overexpress human apolipoprotein B. Journal of Clinical Investigation. 103 (6), 773-778 (1999).
- Fantuzzi, L., et al. Loss of CCR2 expression and functional response to monocyte chemotactic protein (MCP-1) during the differentiation of human monocytes: role of secreted MCP-1 in the regulation of the chemotactic response. Blood. 94 (3), 875-883 (1999).
- Boring, L., Gosling, J., Cleary, M., Charo, I. F. Decreased lesion formation in CCR2-/- mice reveals a role for chemokines in the initiation of atherosclerosis. Nature. 394 (6696), 894-897 (1998).
- Han, K. H., Tangirala, R. K., Green, S. R., Quehenberger, O. Chemokine receptor CCR2 expression and monocyte chemoattractant protein-1-mediated chemotaxis in human monocytes. A regulatory role for plasma LDL. Arteriosclerosis Thrombosis Vascular Biology. 18 (12), 1983-1991 (1998).
- Kanda, H., et al. MCP-1 contributes to macrophage infiltration into adipose tissue, insulin resistance, and hepatic steatosis in obesity. Journal of Clinical Investigation. 116 (6), 1494-1505 (2006).
- Davies, M. J., et al. The expression of the adhesion molecules ICAM-1, VCAM-1, PECAM, and E-selectin in human atherosclerosis. Journal of Pathology. 171, 223-229 (1993).
- Anderson, T. J., et al. The effect of cholesterol-lowering and antioxidant therapy on endothelium-dependent coronary vasomotion (see comments). New England Journal of Medicine. 332 (8), 488-493 (1995).
- Herold, S., Mayer, K., Lohmeyer, J. Acute lung injury: how macrophages orchestrate resolution of inflammation and tissue repair. Frontiers in Immunology. 2, (2011).
- Qiao, M., et al. Thiol Oxidative Stress Induced by Metabolic Disorders Amplifies Macrophage Chemotactic Responses and Accelerates Atherogenesis and Kidney Injury in LDL Receptor-Deficient Mice. Arteriosclerosis Thrombosis Vascular Biology. 29, 1779-1786 (2009).
- Ullevig, S., et al. NADPH Oxidase 4 Mediates Monocyte Priming and Accelerated Chemotaxis Induced by Metabolic Stress. Arteriosclerosis Thrombosis Vascular Biology. 32 (2), 415-426 (2012).
- Kim, H. S., Ullevig, S. L., Zamora, D., Lee, C. F., Asmis, R. Redox regulation of MAPK phosphatase 1 controls monocyte migration and macrophage recruitment. Proceedings of the National Academy of Science. 109 (41), E2803-E2812 (2012).
- Kim, H. S., Tavakoli, S., Piefer, L. A., Nguyen, H. N., Asmis, R. Monocytic MKP-1 is a Sensor of the Metabolic Environment and Regulates Function and Phenotypic Fate of Monocyte-Derived Macrophages in Atherosclerosis. Scientific Reports. 6, 34223(2016).
- Ponce, M. L. Tube formation: an in vitro matrigel angiogenesis assay. Methods in Molecular Biology. 467, 183-188 (2009).
- Auerbach, R., Lewis, R., Shinners, B., Kubai, L., Akhtar, N. Angiogenesis assays: a critical overview. Clinical Chemistry. 49 (1), 32-40 (2003).
- Kim, H. S., Ullevig, S. L., Nguyen, H. N., Vanegas, D., Asmis, R. Redox regulation of 14-3-3zeta controls monocyte migration. Arteriosclerosis, Thrombosis, and Vascular Biology. 34 (7), 1514-1521 (2014).
- Short, J. D., Downs, K., Tavakoli, S., Asmis, R. Protein Thiol Redox Signaling in Monocytes and Macrophages. Antioxidants and Redox Signaling. 25 (15), 816-835 (2016).
- Tavakoli, S., Asmis, R. Reactive oxygen species and thiol redox signaling in the macrophage biology of atherosclerosis. Antioxidants and Redox Signaling. 17 (12), 1785-1795 (2012).
- Ullevig, S. L., et al. Protein S-Glutathionylation Mediates Macrophage Responses to Metabolic Cues from the Extracellular Environment. Antioxidants and Redox Signaling. 25 (15), 836-851 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены