Method Article
生体内における単球血球活性の定量化と血液単球由来マクロファージの特性化
要約
ここでは、マウスモデルにおける血液単球の化学的活性を定量化し、血液単球に対する栄養、薬理学的および遺伝的介入の影響を評価し、マクロファージ由来の血液単球を特徴付けるプロトコルを提示する。単球化学集性タンパク質-1(MCP-1)装填系地下膜由来ゲルプラグを用いてマウスモデルを用いる。
要約
組織恒常性および修復は、単球由来マクロファージの採用に大きく依存する。単球由来マクロファージの過少および過剰募集の両方が創傷治癒を損なう可能性があります。我々は、高脂肪および高糖質食が単球プライミングおよび機能不全を促進し、健康な血液単球を超化学的表現型に変換し、調節不全活性化プロファイルとプロノチピック障害を有するマクロファージに分化することを示した。可塑性。単球由来マクロファージの過剰募集と調節不全活性化プロファイルを有するマクロファージの募集は、代謝障害に関連する慢性炎症性疾患の発症に大きく寄与すると考えられている。アテローム性動脈硬化症および肥満を含む。このプロトコルの目的は、単球プライミングおよび機能不全のバイオマーカーとしての血液単球の化学的活性を定量化し、これらのマウスモデルで分化する準備ができているマクロファージ表現型血液単球を特徴付けることです。単一細胞ウェスタンブロット分析を用いて、マウスに注入されたMCP-1装填地下膜由来ゲルプラグに募集された細胞の24時間33%が単球およびマクロファージであることを示した。3日目以降58%。しかし、5日目には、単球およびマクロファージ数が有意に減少した。最後に、このアッセイは、外科的に取り出された地下膜由来ゲルプラグからの生きたマクロファージの単離も可能であり、その後、単細胞ウェスタンブロット分析によって後続の特性化を受けることができることを示す。
概要
単球由来マクロファージの募集は、アテローム性動脈硬化症および肥満を含む代謝障害に関連する慢性炎症性疾患の発症に不可欠である1,2,3, 4.組織損傷部位における単球由来マクロファージの数およびその可塑性は、組織恒常性および修復に不可欠である。単球由来マクロファージの過少および過剰募集の両方が創傷治癒5を損なう可能性がある。局所組織の炎症を引き起こす、例えば、大動脈壁における低密度リポタンパク質(LDL)の蓄積および酸化または脂肪酸または腸を通って漏出する細菌リポ多糖による脂肪細胞の炎症活性化によってバリアは、単球化学集性タンパク質-1(MCP-1/CCL2)などのケモカインを含む炎症メディエーターの放出につながる。MCP-1はC-Cケモカインファミリーの一員であり、組織の炎症および損傷の部位に単球由来マクロファージの募集を担当する主要な化学刺激剤6,7,8、 9,10.血管内皮の炎症活性化は、細胞間接着分子1(ICAM-1)および血管細胞接着分子1(VCAM-1)11、12などの接着分子の発現をもたらす。MCP-1によって活性化される循環単球は、一緒に転がり、しっかりと付着し、その後、下皮空間12に移行する。浸潤単球はマクロファージに分化し、これは炎症性表現型に活性化され、急性炎症過程を駆動する。微小環境によって駆動される、炎症性マクロファージは炎症を解決するマクロファージに変換することができ、炎症細胞の除去、炎症性シグナルの除去、組織修復および創傷の完了に重要な役割を果たすヒーリング12,13.
慢性代謝ストレス素数は、化学集客剤に対する応答性を飛躍的に高め、単球の募集を増加させ、プライム式単球が調節不変活性化プログラムと偏光を伴うマクロファージを生じることを示した。状態14,15,16.単球プライミングは、アテローム性動脈硬化症、肥満、およびおそらく脂肪性肝炎、腎臓病およびおそらく癌などの代謝障害に関連する他の慢性炎症性疾患を促進する。ヒト疾患のマウスモデルにおける単球プライミングを評価・定量化するために、生体内14,15,16における化学的活性を測定することにより、血液単球のプライミング状態を評価する新しい手法を開発した。 17.我々のアプローチは、化学刺激剤を搭載した地下膜由来ゲルの注入を含む- 我々は一般的に、マウスの左右の側面にMCP-1を使用するか、または車両をそれぞれ使用する。皮下に慎重に注入すると、基板由来ゲルは単一のプラグを形成し、そこからケモカインが拡散し、周囲の代謝または炎症状態の影響を受けない定義された化学的勾配を作成します。組織またはレシピエントマウス。
我々のアッセイに用いられる地下膜由来ゲルは、エンゲルブレス・ホルム・スウォーム(EHS)マウス肉腫から抽出された可溶化地下膜製剤であり、このような細胞外マトリックス(ECM)タンパク質を豊富に有する腫瘍である。この複雑なタンパク質混合物は、ラミニン(60%)、コラーゲンIV(30%)、ブリッジング分子エンタクチン(8%)、および多くの成長因子を含有する。地下膜マトリックスプラグアッセイは、もともと様々な成長因子18,19に応答して血管新生を調べるために開発された。しかし、単球化学症を研究するためには、成長因子枯渇した地下膜由来ゲルを使用して、内皮細胞の募集と血管新生を最小限に抑えることが重要です。マトリゲル(地下膜由来ゲルと呼ばれる)がユニークで特に有用なのは、10°C未満の温度で液化し、ケモカインを溶解させることです。22°Cを超える温度では、地下膜由来溶液は急速に相転移を経て、急速にヒドロゲルを形成する。プラグは、外科的に切除、洗浄、バチルス由来のニュートラルメタロプトーゼで溶解し、単一細胞懸濁液を得ることができ、これは、RNAAceq、単一細胞RNAおよび他の様々な蛍光活性化細胞選別機(FACS)で分析することができる。オミクスのテクニック。ここでは、注射後1、3、5日後に地下膜由来ゲルプラグに募集された細胞集団の特徴付けに対する単細胞ウェスタンブロット分析の使用について説明する。
プロトコル
このプロトコルに記載されているすべての方法は、ウェイクフォレスト医学部の機関動物ケアおよび使用委員会によって承認されています。
1. MCP-1搭載成長因子還元地下膜由来溶液の調製
注:これは無菌の手順です。
- 地下膜由来溶液(例えば、マトリゲル)を調製する前に消毒剤を使用したクリーンセル培養フード。
- 個別にパックされた無菌1 mLシリンジを準備し、シリンジにロードする前に、アルコール綿棒で地下膜由来溶液バイアルの上部を拭きます。
- 氷上の成長因子還元基体膜由来溶液を完全に解凍する。
注意:基体膜マトリックスが室温(RT)で解凍される場合は、溶液がゲル化するのを防ぐために小さな氷粒子が残っていることを確認してください。 - 解凍したら、バイアルを開き、細胞培養フードに0.1%のBSAでMCP-1または1xPBSを混合します。
- 26 G針で無菌注射器の1 mLを準備し、氷の上で冷却します。
- MCP-1を0.1%BSAで1x PBSで50 μg/mLの最終濃度に溶解することにより、MCP-1のストック溶液を調製します。
- 5 mL冷地系膜由来溶液中のMCP-1を500ng/mLの最終濃度に希釈する。車両のみで同量の地下膜由来溶液を調製する(1x PBSは0.1%BSAを含む)。
- 冷たい1 mLシリンジに500 μLの地下膜由来溶液(MCP-1の有無にかかわらず)をロードします。
- 注入を行う前に、地下膜由来の溶液装填シリンジからすべての気泡を取り除き、均一なプラグ形成を確保します。
2. 地下膜由来溶液の注入
- 環境を消毒するために注射の前と注射中に手順領域の周りに70%エタノールをスプレーします。
- 麻酔を誘発するには、マウスを麻酔室に入れ、O2流量計を1リットル/分に設定し、気化器を2%のイソファランに調整します。
- 呼吸数(レート/分)、角膜反射、ウィスカーの動きを監視することにより、麻酔の深さを監視します。
- 全体の手順の間に、鼻コーンを使用して麻酔を維持します。
- 手順の間、呼吸数(レート/分)、角膜反射およびひげの動きを監視し続け、麻酔の深さを確認します。
- つま先ピンチに対する応答の欠如を確認した後、基板由来溶液(約100μL/s)をそれぞれマウスの右(MCP-1なし)と左(MCP-1)側部に皮下に注入する。注射が遅すぎると、地下膜由来ゲルプラグが不規則な形状になったり、断片化したりして取り除きにくくなります。
- 注射後20~30sの注射器を保持し、溶液の漏れを防ぎ、単一の滑らかなゲルプラグを形成できるようにします。
- 注射後、回復するまでモニタリングを行い、マウスをウォーミングパッドに置きます。
- マウスが完全に回復したら、元のケージにマウスを戻します。
3. 地下膜由来ゲルプラグの収穫
- 各マウスに対して2本の別々の1.5mLマイクロ遠心管を計量し、ラベルを付けます。
- 地下膜由来溶液の注射の3日後に、3%のイソファルランを用いて麻酔室でマウスを安楽死させ、続いて子宮頸部脱臼を行う。
- ヘアバリカンを使用してマウスの後毛を取り除くか、5分間綿の先端の棒でヘアリムーバークリームを適用し、拭き取ります。
- 下胸部と上部腰椎の周りに鉗子を使用してマウスの皮膚を保持し、皮膚に2ミリメートルの長さの切開を行います。
- 手術用のはさみを使用して、頸椎から1cm上の角椎間接部(尾部接合部)まで、マウスの背中の中間線を切り取ります。
- 筋肉層から皮膚を分離し、ポリスチレンフォームプラットフォーム上の皮膚をピンダウンします。
- 細かい鉗子を使用して地下膜由来ゲルプラグを含む繊維状のカプセルを慎重に保持し、プラグをきれいにするために細かいはさみを使用して繊維カプセルを取り除きます。
- 洗浄された地下膜由来ゲルプラグを取り外し、1.5 mLマイクロ遠心分離機に移します(3.1参照)。
- 洗浄された地下膜由来ゲルプラグでマイクロ遠心管を計量し、地下膜由来ゲルプラグの重量を計算します。
4. 地下膜由来ゲルプラグを消化する
- 氷上で解凍ディスパーゼ(10mL)。
- きれいな細かいはさみを使用して、マイクロ遠心管に地下膜由来ゲルプラグをミンチします。
- 地下膜由来ゲルプラグを含む各マイクロ遠心管に800μLのディスパーゼを加えます。
- プラグを破壊するために10 sのための最高速度の渦。
- マイクロ遠心管をサーモミキサーで1,400rpmで37°Cで2時間インキュベートし、地下膜由来ゲルプラグを完全に溶解させます。
- 2時間後、RTで10分間400 x gで遠心分離機を慎重に取り外し、上清を廃棄します。
- 反転またはタップして、1x PBSの1mLでペレットを再ステージングします。
- RTで10分間200 x gで遠心分離を繰り返します。
- PBSの300 μLでペレットを再中断します。
- 別のマイクロ遠心管で50 μLの細胞懸濁液を取ります。
- セル懸濁液に0.5 μLのカルセインAM(1M)を加えます。
注:カルセインAMは、生細胞にのみ蓄積する緑色蛍光細胞生存率染料である。 - CO2インキュベーターで細胞を37°Cで10分間インキュベートします。
- 自動細胞カウンターを使用して、緑色蛍光(ライブ)および非蛍光(死んだ)細胞をカウントします。
5. 単一細胞ウェスタンブロット(scWB)分析を用いて細胞懸濁液中の細胞組成を決定する
- rtで少なくとも10分間、ペトリ皿で1xサスペンションバッファの15 mLで使用する前にscWBチップを水分補給します。
- 希釈した単一細胞懸濁液(10,000-100,000セル/mL)を1mLを再水和チップに加えます。10cmのペトリ皿の底に表面を設定します。サーフェスが平らに設定されていることを確認します。
- 乾燥を防ぐために蓋でペトリ皿を覆い、細胞が勾配によって5〜15分間落ち着くようにします。
- 明視野顕微鏡の下にチップを置き、10倍の倍率で井戸を検査します。
注:約15-20%のマイクロウェルは、単一細胞によって占有されるべきであり、ウェルの2%未満は2つ以上の細胞を含むべきである - チップを含む10cmのペトリ皿を45度傾けます。
- 1xサスペンションバッファでチップを洗い、チップの上から下に優しくピペッティングして、チップの表面から取り込まないセルを取り除きます。3回繰り返します。
- 単一セル西洋楽器を準備します。
- リシス時間、電気泳動時間、UV捕捉時間を設定します。地下膜由来ゲルプラグから回収された募集マクロファージを分析するには、次の設定を使用します: lysis時間: 0 s;電気泳動時間:160 s;UV捕捉時間240s。
- チップを1セル西洋機器の電気泳動セルに慎重にロードし、ゲル側に面します。チップのゲル側を損傷しないように注意してください。
- 部屋にリシス/ランニングバッファを注ぎ、完全に単一セルウエスタンチップ全体をカバーします。細胞のリシスを開始します。
- 5.8に記載されている設定を使用してscWB計測器を実行します。
- 実行が完了したら、10 cmペトリ皿にチップを転送し、RTで1x洗浄バッファで2回チップを洗浄します。
- 一次抗体の希釈(抗ビンクリン:1:10;抗CD45:1:15、抗CD11b:1:20、抗F4/80:1:10)の総体積80μLの抗体希釈(抗体1プラス8μLの抗体2プラス6μL)を調製する。
- 抗体プローブ室に一次抗体溶液の80 μLを加え、チップゲル側を下に下げて、抗体溶液がチップ全体にウィックするようにします。
- RTで2時間の一次抗体溶液でインキュベートする。
- シェーカーの1x洗浄バッファで10分間チップを3回洗います。
- シェーカーの水で10分間チップを洗い、ゲルを脱塩します。
- 総体積80μL(二次抗体の混合2μL+希釈剤78μL)で二次抗体の1:20希釈を調出します。
- 光から保護されたRTで1時間の二次抗体でチップをインキュベートします。
- シェーカーに1x洗浄バッファでチップを3回10分間洗います。
- スライドスピナーを使用してチップを回転させて、残りの洗浄バッファを取り除きます。
- 二次抗体に結合されたフッ素のスペクトルチャネルで5μmの分解能でデュアルレーザーマイクロアレイスキャナ上のチップをスキャンします。
- scWB固有のソフトウェアを使用してデータを分析します。
6. scWBチップを剥ぎ取る
- スキャンしたチップを取り除く準備ができるまでウォッシュバッファに保管します。
- 水風呂をヒュームフードに入れます。
- 50 mLのチューブラックを水浴場に置き、水がラックの上にわずか1cm上に置き、水温を60°Cに設定します。
- ストリッピング バッファを準備します。ストリッピングバッファー溶液の1Lの場合は、蒸留水の900 mLで9.85gのトリス-HCl(pH 6.8)と20gのSDSを溶解し、pHを調整します。その後、蒸留水を1Lに充填し、使用直前にβ-メルカプトエタノール(β-ME;14.3M)の0.8%(v/v)を加えます。
- 最初のスキャンの後、チップをストリッピングする前に10cmペトリ皿に入れます。
- 各チップについて、ストリッピングバッファの40 mLを取り、β-MEの320 μlを追加します。
注意:β-MEは有毒であり、人間や環境に有害です。次の手順は、ヒュームフードで行う必要があります。 - チップをキャニスターに入れ、キャニスターに水が漏れないようにパラフィルムでキャニスターを密閉します。
- キャニスターをチューブラック内の温水浴に入れます。
- 90分間インキュベートします。
- キャニスターからチップを慎重に取り出し、新鮮なペトリ皿に入れます。
- 1x洗浄バッファでチップを一度簡単に洗います。その後、ペトリ皿に1x洗浄バッファーの15 mLを追加します。
- シェーカーで15分間チップを洗います。洗浄工程を4回繰り返します。
注:チップは次の一次抗体の準備ができています(手順5.12 - 5.21を参照)。
結果
血液単球の化学集性にアクセスするために、各マウスの左右側に車載およびMCP-1装填された地下膜由来溶液を注入した。地下膜由来ゲルプラグを注射後1、3、5日後に取り出し、各プラグにリクルートした細胞を数えた(図1A)。MCP-1ロードプラグ(閉じたバー)のセル数から車両搭載プラグ(開閉棒)のセル数を差し引いて、MCP-1(Δセル番号、図1B)に応じて特異的に募集したセル数を得た。5日間でMCP-1特異的な細胞の募集と蓄積が加速し、31,000細胞/日(1日目)から78,000セル/日(3日目)、5日目に136,000セル/日(図1B)に増加した。
地下膜由来ゲルプラグに入った細胞型を同定するために、各プラグから単一細胞ウェスタンブロット分析(scWB)に分離した細胞を、CD45、CD11bおよびF4/80発現のプローブを行い、単球を同定した(CD11b+F4/80)-マクロファージ (CD11b+F4/80+プラス CD11b-F4/80+) 残りの非単球性白球 (CD45+CD11b-F4/80-) (図2)。次に、scWBチップを調べ、各ゲル上の総細胞数を決定し、scWBチップ上のマイクロウェルの単一細胞占有率を確認した。MCP-1搭載地下膜由来ゲルプラグ内の単球の割合は、1日目、20%で低く、3日目にピークを迎え、それぞれ47%でピークに達し、5日目には14%に低下した(図2D)。MCP-1装填地下膜由来ゲルプラグ内のマクロファージ数は、1日目の13%から3日目の22%、5日目の23%に着実に増加しました。MCP-1搭載プラグの場合、単球と単細胞集団内のマクロファージの割合は、3日目で最も高く、車両搭載プラグでは31%(図3A)、MCP-1搭載プラグでは58%(図3B)で、3日後にその割合が高かった。MCP-1依存性ケモタキシスによって募集された細胞の大半は、単球およびマクロファージである。単球とマクロファージの総数は3日目(図3C、D)に比べて5日目に高かったが、総細胞集団における単球およびマクロファージの割合が有意に高かった(図3A)そしてB)、3日目の細胞数は、血液単球化学血球および募集をより正確に反映する。したがって、我々は、動物を犠牲にする3日前に、日常的に地下膜由来溶液を注入する。MCP-1によって募集されたすべてのマクロファージが、寄与した隣接組織から募集された単球由来または常駐マクロファージであるかどうかは決定されなかった。
ここに示すデータの統計分析は、分析ソフトウェア(例えば、SigmaPlot 14)で行った。その後、フィッシャーLSD試験に続いて、実験群間の平均値を比較するためにANOVAを用いた。全てのデータは、少なくとも3つの独立した実験の平均±SDとして提示される。結果は、P < 0.05 レベルで統計的に有意と見なされました。
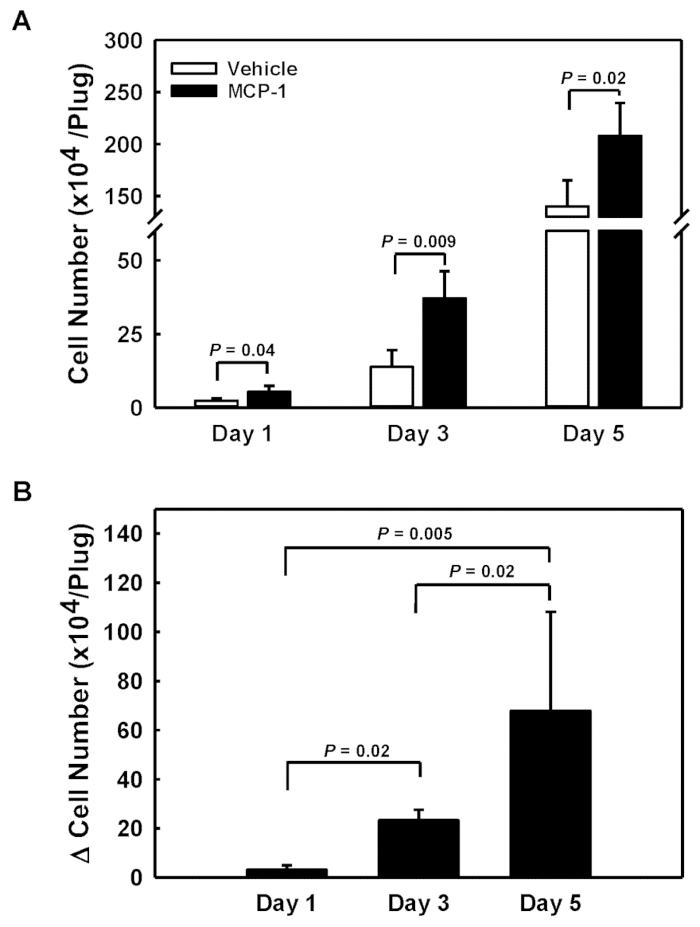
図 1:皮下基板由来ゲルプラグに募集した細胞の定量。(A) 車両搭載(オープンバー)およびMCP-1搭載地下膜由来ゲルプラグ(閉じたバー)の絶対セル番号。(B) MCP-1装填プラグと車載プラグとの細胞数の差として算出したMCP-1による地下膜由来ゲルプラグに募集した細胞数。結果は平均±SD(n=4)として表示され、この図のより大きなバージョンを表示するにはここをクリックしてください。
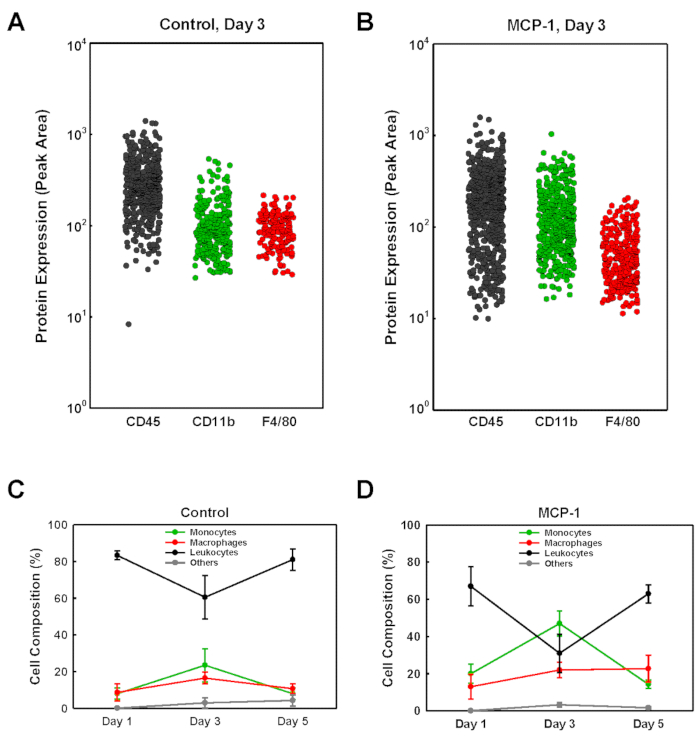
図 2:単一細胞ウェスタンブロット分析により地下膜由来ゲルプラグに募集した細胞集団の分析(A +B)代表的な例は、注射の3日後にマウスから単離された車両搭載(制御)およびMCP-1リードプラグ(MCP-1)のscWB分析について示されている。CD45、CD11bおよびF4/80に対して指向する抗体で標識されたチップは、プロトコルに記載されている蛍光二次抗体が続く。個々の細胞に対する標識バンドの蛍光強度は、ピーク領域として示される。(C +D)細胞集団は単球(CD11b+F4/80-  )、マクロファージ(CD11b+F4/80+プラスCD11b-
)、マクロファージ(CD11b+F4/80+プラスCD11b-  F4/80 +)、または非単球性白血球(CD45+,
F4/80 +)、または非単球性白血球(CD45+,  ).残りのセルには"other" というラベル
).残りのセルには"other" というラベル が付けられています。結果は平均±SD(n=3)として示される。この図のより大きなバージョンを表示するには、ここをクリックしてください。
が付けられています。結果は平均±SD(n=3)として示される。この図のより大きなバージョンを表示するには、ここをクリックしてください。
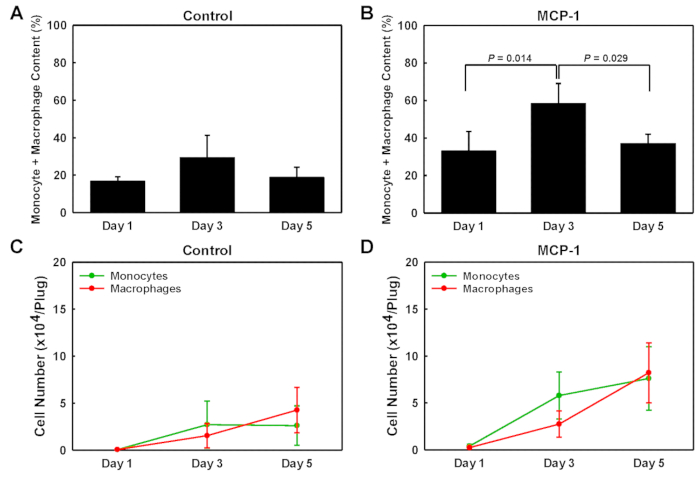
図 3: 地下膜由来ゲルプラグの単球およびマクロファージ含有量。1日目、3日目、5日目に取り外した車両搭載プラグおよびMCP-1搭載プラグにおける募集モノサイトおよびマクロファージ含有量の定量分析。値は、総セル母集団 (A+B) のパーセンテージと、プラグあたりの絶対セル数 (C+D) で表示されます。結果は平均±SD(n=3)として示される。この図のより大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
我々は、地下膜由来マトリックスのユニークな物理的特性と、このユニークなマトリックスをケモカインでロードし、マウスに注入する能力を利用して、生体内ケモタキシスアッセイを開発しました。このアッセイにより、MCP-1に示すように、生きているマウスにおける単球(およびマクロファージ)のケモカインへの応答性、および遺伝子操作または薬理学的、食事および他の環境暴露が単球に及ぼす影響を評価することができます。ケモタキシス。これらのマウスで作成するケモカイン勾配は、遺伝的、薬理学的、食事的または環境的暴露の影響を受けないため、単球分光活性の変化は実際にこれらの単球の機能変化を反映し、我々が示したように以前は、タンパク質と転写レベル17、20の両方でリプログラミングも行う。マウスの代謝ストレスは、化学集動性に対する単球応答性を増加させ、この超化学的活性は、可逆的な、レドックス依存性のポストトランスプライアルである増加したタンパク質S-グルタチオニル化と相関することを報告した。タンパク質修飾は、ほとんどの場合、酵素およびタンパク質機能21、22の喪失を引き起こし、場合によってはタンパク質分解16、23を促進する。
この手順を正常に実行し、このアッセイで最適な結果を得るためには、地下膜由来溶液の正確な量をゆっくりと注入して、特異な整形プラグと繊維状カプセルを除去することが重要です。完全に地下膜由来ゲルプラグを収穫するときにきれいなプラグを取得するために、ディスパーゼ溶液中のプラグ全体の溶解を容易にします。我々のデータは、3日間動物にプラグを残すことは、1)信号強度、すなわち、各プラグに募集された単球およびマクロファージの数、2)信号の選択性、すなわち、単球およびマクロファージ内の単球およびマクロファージの含有量を最適化することを示している。総細胞集団および3)信号の特異性、すなわち車両と比較してMCP-1に応答する単球およびマクロファージの増加。最後に、基幹膜由来ゲルプラグアッセイと組み合わせて最先端の単一細胞ベースのアプローチを使用して、プラグに採用された単球を特徴付け、潜在的な表現型のスナップショットを得る方法を示します。特定の遺伝的、薬理学的、食事的または環境的介入に応答して、任意の特定のマウスモデルの傷害部位に募集される単球由来マクロファージ。
考慮されるべきアッセイの多くの制限がある。まず、マウスの取り扱い、麻酔、基基膜由来溶液の注入、および外科的解剖は、単一のプラグと再現可能なデータを生成する練習を必要とする。第二に、MCP-1ロードプラグに募集されたほとんどの細胞は単球およびマクロファージであるが、かなりの数はそうではありません。これは、この細胞集団に対して行われる他の非単一細胞ベースの分析アッセイの解釈に影響を与える可能性がある。最後に、scWBの細胞リシス条件は軽度であるため、タンパク質の移動距離は標準WBとは異なり、タンパク質サイズと相関しない場合があります。したがって、細胞リシスとランタイムの両方を、試験する新しいタンパク質と使用される各一次抗体について検証する必要があります。
開示事項
なし。
謝辞
このプロジェクトは、NIH(AT006885)からのR.A.への助成金によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 10 cm petri dish | griner bio-one | 664 160 | |
| 10x suspension buffer | proteinsimple | R101 | |
| 15 cm petri dish | Falcon | 353025 | |
| 2-Mercaptoethanol | MP BIOMEDICALS | 2194705 | |
| 5% washing buffer | proteinsimple | R252 | |
| Antibody diluent | proteinsimple | 042-203 | |
| Bench Top Centrifuge | Beckman Coulter | Microfuge 22R Centrifuge | |
| Bovine Serim Albumin | Sigma-Aldrich | A7906-100G | |
| Calcein AM | ThermoFisher | C3099 | 1 mL |
| CD11b | Novus Biologicals | NB110-89474 | |
| CD45 (D4H7K) rabbit mAb | Cell Signal Technologies | 727987S | |
| CD68/SR-D1 (FA-11) | Novus Biologicals | NBP2-33337SS | |
| Cellometer Vision | Nexcelom | ||
| Dispase | BD | 354235 | 100 mL |
| Dissecting sissor | |||
| Donkey anti-Rabbit IgG secondary antibody [NL557] | Novus Biologicals | NL004 | NL 557 conjugate |
| Donkey anti-Rat IgG (H+L) secondary antibody [DyLight 650] | Novus Biologicals | NBP1-75655 | DyLight 650 conjugate |
| F4/80 (CI-A3-1) | Novus Biologicals | NB600-404SS | |
| Heat Block | effendorf | 22331 | Thermomixer |
| Lysis/Running buffer | proteinsimple | R200 | |
| Matrigel Matrix (Grwoth Factor Reduced) | BD | 354230 | 10 ml |
| Microarray scanner | PerkinElmer | ScanArray Gx | |
| Microcentrifuge tube | Fisher Scientific | 05-408-129 | |
| Microscope | ThermoFisher | Evos fl | |
| Milo | proteinsimple | Single cell western | |
| Needle | BD | 305111 | 26 G |
| Parafilm | |||
| Probing chamber | proteinsimple | 035-020 | |
| Recombinant mouse CCL2/JE/MCP-1 protein | R&D | 479-JE-050 | |
| scWEST chip | proteinsimple | C300 | |
| Shaker | Bioexpress | Gene mate orbital shaker | |
| Single cell western chip canister | proteinsimple | 035-118 | |
| Slide spinner | Labnet | C1303-T | |
| Sodium Dodecyl Sulfate (SDS) | Fisher Scientific | BP 166-500 | |
| Syringe | BD | 309602 | 1 mL |
| Tris-Hydrochloride | Fisher Scientific | BP 153-500 | |
| Tweezer | proteinsimple | 035-020 | |
| Water bath | ThermoFisher |
参考文献
- Moore, K. J., Tabas, I. Macrophages in the pathogenesis of atherosclerosis. Cell. 145 (3), 341-355 (2011).
- Chawla, A., Nguyen, K. D., Goh, Y. P. Macrophage-mediated inflammation in metabolic disease. Nature Reviews Immunology. 11 (11), 738-749 (2011).
- McNelis, J. C., Olefsky, J. M. Macrophages, immunity, and metabolic disease. Immunity. 41 (1), 36-48 (2014).
- Akiyama, T., et al. Genistein, a specific inhibitor of tyrosine-specific protein kinases. Journal of Biological Chemistry. 262 (12), 5592-5595 (1987).
- Nahrendorf, M., Pittet, M. J., Swirski, F. K. Monocytes: protagonists of infarct inflammation and repair after myocardial infarction. Circulation. 121 (22), 2437-2445 (2010).
- Gosling, J., et al. MCP-1 deficiency reduces susceptibility to atherosclerosis in mice that overexpress human apolipoprotein B. Journal of Clinical Investigation. 103 (6), 773-778 (1999).
- Fantuzzi, L., et al. Loss of CCR2 expression and functional response to monocyte chemotactic protein (MCP-1) during the differentiation of human monocytes: role of secreted MCP-1 in the regulation of the chemotactic response. Blood. 94 (3), 875-883 (1999).
- Boring, L., Gosling, J., Cleary, M., Charo, I. F. Decreased lesion formation in CCR2-/- mice reveals a role for chemokines in the initiation of atherosclerosis. Nature. 394 (6696), 894-897 (1998).
- Han, K. H., Tangirala, R. K., Green, S. R., Quehenberger, O. Chemokine receptor CCR2 expression and monocyte chemoattractant protein-1-mediated chemotaxis in human monocytes. A regulatory role for plasma LDL. Arteriosclerosis Thrombosis Vascular Biology. 18 (12), 1983-1991 (1998).
- Kanda, H., et al. MCP-1 contributes to macrophage infiltration into adipose tissue, insulin resistance, and hepatic steatosis in obesity. Journal of Clinical Investigation. 116 (6), 1494-1505 (2006).
- Davies, M. J., et al. The expression of the adhesion molecules ICAM-1, VCAM-1, PECAM, and E-selectin in human atherosclerosis. Journal of Pathology. 171, 223-229 (1993).
- Anderson, T. J., et al. The effect of cholesterol-lowering and antioxidant therapy on endothelium-dependent coronary vasomotion (see comments). New England Journal of Medicine. 332 (8), 488-493 (1995).
- Herold, S., Mayer, K., Lohmeyer, J. Acute lung injury: how macrophages orchestrate resolution of inflammation and tissue repair. Frontiers in Immunology. 2, (2011).
- Qiao, M., et al. Thiol Oxidative Stress Induced by Metabolic Disorders Amplifies Macrophage Chemotactic Responses and Accelerates Atherogenesis and Kidney Injury in LDL Receptor-Deficient Mice. Arteriosclerosis Thrombosis Vascular Biology. 29, 1779-1786 (2009).
- Ullevig, S., et al. NADPH Oxidase 4 Mediates Monocyte Priming and Accelerated Chemotaxis Induced by Metabolic Stress. Arteriosclerosis Thrombosis Vascular Biology. 32 (2), 415-426 (2012).
- Kim, H. S., Ullevig, S. L., Zamora, D., Lee, C. F., Asmis, R. Redox regulation of MAPK phosphatase 1 controls monocyte migration and macrophage recruitment. Proceedings of the National Academy of Science. 109 (41), E2803-E2812 (2012).
- Kim, H. S., Tavakoli, S., Piefer, L. A., Nguyen, H. N., Asmis, R. Monocytic MKP-1 is a Sensor of the Metabolic Environment and Regulates Function and Phenotypic Fate of Monocyte-Derived Macrophages in Atherosclerosis. Scientific Reports. 6, 34223(2016).
- Ponce, M. L. Tube formation: an in vitro matrigel angiogenesis assay. Methods in Molecular Biology. 467, 183-188 (2009).
- Auerbach, R., Lewis, R., Shinners, B., Kubai, L., Akhtar, N. Angiogenesis assays: a critical overview. Clinical Chemistry. 49 (1), 32-40 (2003).
- Kim, H. S., Ullevig, S. L., Nguyen, H. N., Vanegas, D., Asmis, R. Redox regulation of 14-3-3zeta controls monocyte migration. Arteriosclerosis, Thrombosis, and Vascular Biology. 34 (7), 1514-1521 (2014).
- Short, J. D., Downs, K., Tavakoli, S., Asmis, R. Protein Thiol Redox Signaling in Monocytes and Macrophages. Antioxidants and Redox Signaling. 25 (15), 816-835 (2016).
- Tavakoli, S., Asmis, R. Reactive oxygen species and thiol redox signaling in the macrophage biology of atherosclerosis. Antioxidants and Redox Signaling. 17 (12), 1785-1795 (2012).
- Ullevig, S. L., et al. Protein S-Glutathionylation Mediates Macrophage Responses to Metabolic Cues from the Extracellular Environment. Antioxidants and Redox Signaling. 25 (15), 836-851 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved