Method Article
Quantificação da atividade quimiotática de monócitos in vivo e caracterização de macrófagos derivados de monócitos sanguíneos
Neste Artigo
Resumo
Aqui nós apresentamos um protocolo para quantificar a atividade Quimiotáticos de monócitos do sangue em modelos do rato, para avaliar os efeitos de intervenções nutritivas, farmacológicas e genéticas no monocyte do sangue e para caracterizar os macrófagos derivados do sangue dos monócitos em modelos de mouse usando o monocyte-chemoattractant protein-1 (MCP-1)-carregado porão membrana-derivado gel plugs.
Resumo
A homeostase tecidual e a reparação são criticamente dependentes do recrutamento de macrófagos derivados de monócitos. O recrutamento de macrófagos derivados de monócitos pode prejudicar a cicatrização de feridas. Nós mostramos que as dietas elevadas gordas e elevadas do açúcar promovem o priming e a deficiência orgânica do monocyte, convertendo monócitos saudáveis do sangue em um phenotype Quimiotáticos Hyper preparado para diferenciar-se nos macrófagos com perfis disregulados da ativação e o fenotípico prejudicado Plasticidade. Acredita-se que o excesso de recrutamento de macrófagos derivados de monócitos e o recrutamento de macrófagos com perfis de ativação disregulados sejam um dos principais contribuintes para o desenvolvimento de doenças inflamatórias crônicas associadas a distúrbios metabólicos, incluindo aterosclerose e obesidade. O objetivo deste protocolo é quantificar a atividade quimiotática de monócitos sanguíneos como um biomarcador para a escorva e disfunção de monócitos e para caracterizar os monócitos de sangue do fenótipo de macrófago estão prestes a se diferenciar nesses modelos de camundongo. Usando a análise ocidental do borrão da única pilha, nós mostramos que após 24 h 33% das pilhas recrutadas em plugues de gel membrana-derivados do porão MCP-1-Loaded injetados em ratos são monócitos e macrófagos; 58% após o dia 3. No entanto, no 5º dia, os números de monócitos e macrófago foram significativamente reduzidos. Finalmente, nós mostramos que estes ensaios igualmente permitem a isolação de macrófagos vivos dos plugues membrana-derivados cirurgicamente recuperados do gel do porão, que podem então ser sujeitados à caracterização subseqüente pela única análise ocidental do borrão da pilha.
Introdução
O recrutamento de macrófagos derivados de monócitos é essencial para o desenvolvimento de doenças inflamatórias crônicas associadas a distúrbios metabólicos, incluindo a aterosclerose e a obesidade1,2,3, a 4. O número de macrófagos derivados de monócitos em sítios de lesão tecidual, bem como sua plasticidade, são críticos para a homeostase tecidual e reparo. Tanto o recrutamento e excesso de macrófagos derivados de monócitos pode prejudicar a cicatrização de feridas5. Desencadeando a inflamação tecidual local, por exemplo, pela acumulação e oxidação da lipoproteína de baixa densidade (LDL) na parede aórtica ou ativação inflamatória de adipócitos por ácidos graxos ou lipopolissacarídeos bacterianos vazando através do intestino barreira, conduz à liberação de mediadores inflamatórios, incluindo quimiocinas tais como a proteína-1 do chemoattractant do monocyte (MCP-1/CCL2). O MCP-1 é um membro da família c-c quimiocina e um quimioatractivo chave responsável pelo recrutamento de macrófagos derivados de monócitos para sítios de inflamação e lesão tecidual6,7,8, 9,10. A ativação inflamatória do endotélio vascular resulta na expressão de moléculas de aderências como molécula de adesão intercelular 1 (ICAM-1) e molécula de adesão de células vasculares 1 (VCAM-1)11,12, permitindo monócitos circulantes ativados pelo MCP-1 para rolar ao longo, aderir firmemente e posteriormente transmigrar para o espaço subendotelial12. Os monócitos infiltrantes se diferenciam em macrófagos, que podem ser ativados em um fenótipo pró-inflamatório, conduzindo o processo inflamatório agudo. Impulsionada pelo microambiente, os macrófagos pró-inflamatórios podem se converter em macrófagos que resolvam a inflamação, que desempenham papéis críticos no esclarecimento de células inflamatórias, removendo sinais pró-inflamatórios e completando o reparo tecidual e a ferida cura12,13.
O stress metabólico crônico primos monócitos para a resposta dramàtica aumentada aos Chemo-attractants e o recrutamento aumentado do monocyte, e nós mostramos que os monócitos aprontados dão a ascensão aos macrófagos com programas e polarização dysregulamentada da ativação Estados14,15,16. A escorva do monocyte promove a aterosclerose, a obesidade, e possivelmente outras doenças inflamatórios crônicas associadas com as desordens metabólicas tais como o Steatohepatitis, as doenças renais e possivelmente o cancro. Para avaliar e quantificar a escorva de monócitos em modelos de camundongo de doenças humanas, desenvolvemos uma nova técnica para avaliar o estado de escorva de monócitos sanguíneos medindo a atividade quimiotática in vivo14,15,16, a 17. Nossa aproximação envolve a injeção do gel membrana-derivado do porão carregado com o um chemoattractant-nós usamos geralmente o MCP-1-ou o veículo no flanco esquerdo e direito, respectivamente, dos ratos. Quando cuidadosamente injetado por via subcutânea, o gel derivado da membrana basal irá formar um único plugue, a partir do qual as quimiocinas podem difundir e criar um gradiente quimiotático definido que não é afetado pelo Estado metabólico ou inflamatório do entorno tecido ou o rato destinatário.
O gel derivado da membrana basal que utilizamos para o nosso ensaio é uma preparação de membrana basal solubilizada extraída do sarcoma de rato Engelbreth-Holm-Swarm (EHS), um tumor rico em proteínas de matriz extracelular (ECM). Esta mistura complexa de proteínas contém laminina (60%), colágeno IV (30%), a molécula de ponte entactina (8%), e uma série de fatores de crescimento. O ensaio do plugue da matriz da membrana do porão foi desenvolvido originalmente para investigar a angiogênese em resposta a vários fatores de crescimento18,19. Entretanto, a fim estudar o chemotaxis do monocyte, é importante usar o gel membrana-derivado do porão do fator de crescimento-esgotado para minimizar o recrutamento e a angiogênese endothelial da pilha. O que torna o Matrigel (referido como gel derivado da membrana do porão doravante) único e particularmente útil é que a temperaturas inferiores a 10 ° c liquefaz, permitindo que as quimiocinas sejam dissolvidas. Em temperaturas acima de 22 ° c, a solução derivada da membrana basal passa rapidamente por uma transição de fase e forma rapidamente um hidrogel. As fichas podem ser excisadas cirurgicamente, limpas e dissolvidas com um metaloprotease neutro derivado de bacilo para produzir suspensões de células únicas, que podem ser analisadas em um classificador de células ativados por fluorescência (FACS), por RNAseq, RNA de célula única e uma variedade de outros técnicas de Ômicas. Aqui nós descrevemos o uso da análise ocidental do borrão da único-pilha para a caracterização das populações da pilha recrutadas nos plugues membrana-derivados do gel do porão um, três ou cinco dias após a injeção.
Protocolo
Todos os métodos descritos neste protocolo foram aprovados pelo Comitê institucional de cuidado e uso de animais na escola de medicina Wake Forest.
1. preparação do fator de crescimento MCP-1-Loaded-solução derivada de membrana basal reduzida
Nota: É um procedimento estéril.
- Limpe a capa da cultura de pilha com desinfetante antes de preparar a solução derivada da membrana do porão (por exemplo, Matrigel).
- Prepare a seringa estéril individualmente embalada de 1 mL e limpe a parte superior do tubo de ensaio derivado da solução da membrana do porão com um cotonete do álcool antes de carregá-lo na seringa.
- Descongelar completamente o fator de crescimento-redução da solução de membrana basal derivada no gelo.
Atenção: Se a matriz da membrana do porão for descongelada à temperatura ambiente (RT), assegure-se de que uma pequena partícula de gelo permaneça para evitar que a solução se Gelling. - Uma vez descongelado, abra o frasco e misture MCP-1 ou 1xPBS com 0,1% BSA na capa de cultura celular.
- Prepare um 1 mL da seringa estéril com uma agulha de 26 G e fixe no gelo.
- Prepare uma solução de estoque de MCP-1 dissolvendo MCP-1 para uma concentração final de 50 μg/mL em 1X PBS com 0,1% de BSA.
- Diluir MCP-1 em 5 mL de solução de membrana do porão frio-derivado a uma concentração final de 500 ng/mL. Prepare uma quantidade igual da solução membrana-derivada do porão com veículo somente (1X PBS contenha 0,1% BSA).
- Carregar 500 μL de solução de membrana basal derivada (com ou sem MCP-1) na seringa fria de 1 mL.
- Remova todas as bolhas de ar da seringa de solução carregada de membrana basal antes de fazer a injeção para garantir uma formação de plugue uniforme.
2. injeção de membrana basal-solução derivada
- Pulverize 70% etanol em torno da área de procedimento antes e durante as injeções para desinfectar o ambiente.
- Para induzir a anestesia, coloque o mouse em uma câmara de anestesia e ajuste o medidor de vazão O2 para 1 litro/min e ajuste o vaporizador para isoflurano a 2%.
- Monitore a profundidade da anestesia monitorando a frequência respiratória (taxa/min), reflexo corneano e movimento de bigodes.
- Durante todo o procedimento, manter a anestesia usando um cone de nariz.
- Durante o procedimento, manter o monitoramento da frequência respiratória (taxa/min), reflexo corneano e movimento de bigodes para verificar a profundidade da anestesia.
- Depois de confirmar a falta de resposta à pinça do dedo do pé, injete lentamente (aproximadamente 100 μl/s) a solução derivada da membrana do porão por via subcutânea no flanco direito (no MCP-1) e esquerdo (com MCP-1) do rato, respectivamente. Se a injecção for demasiado lenta, as fichas de gel derivadas da membrana basal podem tornar-se irregularmente moldadas, ou mesmo fragmentadas, e difíceis de remover.
- Segure a seringa por 20-30 s após a injeção para evitar o vazamento da solução e para permitir que um único gel-plug liso para formar.
- Após a injeção, colocando o mouse sobre a almofada de aquecimento com monitoramento até a recuperação.
- Retorne o mouse para a gaiola original uma vez que o mouse está totalmente recuperado.
3. colher o porão membrana-derivado gel plugs
- Pesar dois tubos de microcentrífuga de 1,5 mL separados para cada rato e rotulá-los.
- Três dias após a injeção da solução membrana-derivada do porão, eutanizar o rato na câmara anestésica usando o isoflurano de 3% seguido pela deslocação cervical.
- Retire a pele dorsal do rato usando cortadores de cabelo ou aplique o creme do removedor do cabelo com as varas Cotton-derrubadas por 5 minutos e limpe-a então fora.
- Segure a pele do mouse usando fórceps em torno da vértebra lombar torácica inferior e superior e fazer uma incisão de 2 mm de comprimento na pele.
- Corte a linha média da parte traseira do rato de uma incisão feita até vértebras cervicais e para baixo a 1 cm acima da junção caudal da vértebra (junção da cauda) usando a tesoura cirúrgica.
- Separe a pele da camada muscular e pin-down da pele em uma plataforma de espuma de poliestireno.
- Segure cuidadosamente a cápsula fibrosa que contém o plugue de gel derivado da membrana basal usando fórceps fino e retire a cápsula fibrosa usando tesouras finas para limpar o plugue.
- Retire a ficha de gel derivada da membrana basal limpa e transfira para 1,5 mL de microcentrífuga (ver 3,1).
- Pesar o tubo de microcentrífuga com o porão limpo membrana-derivado gel plug e calcular o peso do porão membrana-derivado gel plug.
4. digerir o porão membrana-derivado gel plugs
- Thaw Dispase (10 mL) no gelo.
- Mince a membrana do porão-derivado gel plug no tubo de microcentrífuga usando limpa tesoura fina.
- Adicione 800 μL de Dispase em cada tubo do microcentrifugador que contem a plugue membrana-derivada do gel do porão.
- Vortex com velocidade máxima de 10 s para interromper o plugue.
- Incubar os tubos do microcentrifugador para 2 h em 37 ° c em 1.400 rpm em um no para dissolver completamente o plugue membrana-derivado do gel do porão.
- Após 2 h, centrifugue a 400 x g durante 10 min em RT. Retire e elimine cuidadosamente o sobrenadante.
- Ressuscitar o pellet em 1 mL de 1X PBS invertendo ou tocando.
- Repita a centrifugação em 200 x g por 10 min em RT. Retire e elimine cuidadosamente o sobrenadante.
- Ressuscitem o pellet em 300 μL de PBS.
- Tome 50 μL de suspensão celular em um tubo de microcentrífuga separado.
- Adicionar 0,5 μL de calceina AM (1 M) à suspensão celular.
Nota: Calcein AM é um corante verde da viabilidade da pilha fluorescente que se acumula somente em pilhas vivas. - Incubar as células em uma incubadora de CO2 a 37 ° c por 10 min.
- Contagem de células fluorescentes verdes (ao vivo) e não-fluorescentes (mortas) usando um contador de células automatizado.
5. determinando a composição da pilha na suspensão da pilha usando a análise ocidental do borrão da único-pilha (scWB)
- Rehidrate o chip scWB antes de usar em 15 mL de tampão de suspensão 1x em uma placa de Petri por pelo menos 10 min em RT.
- Adicione 1 mL da suspensão de célula única diluída (10000-100000 células/mL) ao chip rehidratado. Ajuste a superfície na parte inferior de um prato de Petri de 10 cm. Assegure-se de que a superfície esteja ajustada horizontalmente.
- Cubra o prato de Petri com uma tampa para evitar a secagem e deixe as células se contentarem por 5-15 min por gradiente.
- Coloc a microplaqueta um microscópio do brilhante-campo e inspecione os poços na ampliação 10x.
Nota: Aproximadamente 15-20% dos micropoços devem ser ocupados por uma única célula, menos de 2% dos poços devem conter 2 ou mais células - Incline o prato de Petri de 10 cm contendo o chip em 45 graus.
- Lave o chip com o tampão de suspensão 1x para remover células não capturadas da superfície do chip por pipetagem suave de cima para baixo do chip. Repita 3 vezes.
- Prepare o instrumento ocidental da única pilha.
- Ajuste o tempo da lise, o tempo da electroforese, e o tempo UV da captação. Para analisar os macrófagos recrutados recuperados do plugue de gel derivado da membrana basal, use as seguintes configurações: tempo de Lise: 0 s; tempo da electroforese: 160 s; Tempo de captura UV 240 s.
- Carregue com cuidado a microplaqueta na pilha da electroforese do instrumento ocidental da única pilha, revestimento do gel-lado. Tenha cuidado para não danificar o lado do gel do chip.
- Despeje a Lise/buffer de execução na câmara e cobrir completamente toda a célula única chip ocidental. Comece a lise celular.
- Execute o instrumento scWB usando a configuração listada em 5,8.
- Uma vez que a corrida estiver concluída, transfira o chip para um prato de Petri de 10 cm e lave o chip duas vezes com 1x tampão de lavagem por 10 min em RT.
- Prepare diluições de anticorpos primários (anti-vinculin: 1:10; anti-CD45:1:15, anti-CD11b: 1:20, anti-F4/80:1:10) num volume total de 80 μL de diluente de anticorpos (misturar 8 μL de anticorpo 1 mais 8 μL de anticorpo 2 mais 64 μL de diluente).
- Adicione 80 μL da solução preliminar do anticorpo à câmara de sondagem do anticorpo e abaixe o gel-lado da microplaqueta para baixo de modo que a solução do anticorpo Wicks através da microplaqueta.
- Incubar com a solução de anticorpo primário para 2 h em RT.
- Lave o chip três vezes por 10 min em 1x tampão de lavagem na coqueteleira.
- Lave o chip uma vez por 10 min na água na coqueteleira para desalt o gel.
- Prepare uma diluição 1:20 do anticorpo secundário num volume total de 80 μL (misturar 2 μL de anticorpo secundário mais 78 μL de diluente).
- Incubar a microplaqueta com o anticorpo secundário para 1 h no RT protegido da luz.
- Lave o chip três vezes por 10 min com 1x tampão de lavagem na coqueteleira.
- Gire o chip usando um Spinner deslizante para remover qualquer buffer de lavagem restante.
- Escaneie a microplaqueta em um varredor do microarray do duplo-laser na definição de 5 μm no canal espectral do fluoróforo acoplado aos anticorpos secundários.
- Analise dados usando o software scWB-specific.
6. descascando o chip scWB
- Armazene o chip digitalizado no tampão de lavagem até que esteja pronto para descascar.
- Coloc o banho de água em uma capa das emanações.
- Coloque um rack de tubo de 50 mL no banho de água com a água a apenas 1 cm acima do rack e defina a temperatura da água em 60 ° c.
- Prepare o tampão de decapagem. Para 1 L de solução tampão de decapagem, dissolver 9,85 g de Tris-HCl (pH 6,8) e 20 g de SDS em 900 mL de água destilada e ajustar o pH. Em seguida, encha com água destilada para 1L. Adicionar 0,8% (v/v) de β-mercaptoetanol (β-ME; 14,3 M) imediatamente antes de cada utilização.
- Após a digitalização inicial, coloque o chip em um prato de Petri de 10 cm antes de descascar.
- Para cada chip, tome 40 mL de tampão de decapagem e adicione 320 μL de β-ME.
Atenção: β-me é tóxico e perigoso para o ser humano e ambiente. O procedimento a seguir deve ser feito em uma capa de fumaça. - Coloque o chip na caixa e sele a vasilha com parafilm para evitar que a água vaze na vasilha.
- Coloque a vasilha dentro da cremalheira do tubo no banho de água pré-aquecido.
- Incubar por 90 min.
- Retire cuidadosamente o chip da caixa e coloque-o num prato de Petri fresco.
- Lave brevemente o chip uma vez com 1x tampão de lavagem. Em seguida, adicione 15 mL de 1x tampão de lavagem para o prato de Petri.
- Lave o chip por 15 min em uma coqueteleira. Repita o passo de lavagem quatro vezes.
Nota: Chip está pronto para o próximo anticorpo primário (ver passos 5,12-5,21).
Resultados
Para acessar a responsividade dos monócitos sanguíneos aos quimioatrativos, injetamos uma solução de membrana-derivada do porão carregada de veículo e MCP-1 nos flancos esquerdos e direito de cada mouse. Os plugues de gel derivados da membrana basal foram removidos 1, 3 e 5 dias após as injeções, dissolvidos e as células recrutadas em cada plugue foram contabilizadas (Figura 1a). Ao subtrair a contagem de células no plugue carregado pelo veículo (barras abertas) da contagem de células no plugue carregado MCP-1 (barras fechadas), obteve-se o número de células especificamente recrutadas em resposta ao MCP-1 (Δ Cell Number, Figura 1b). Observamos um recrutamento e acúmulo acelerado de células MCP-1-específicos ao longo do período de 5 dias, com taxas crescentes de 31.000 células/dia (dia 1) a 78.000 células/dia (dia 3) e 136.000 células/dia no dia 5 (Figura 1b).
Para identificar os tipos de células que entraram nas fichas de gel derivadas da membrana basal, sujeitamos as células isoladas de cada ficha a uma única célula de análise Western blot (scWB), sondagem para a expressão CD45, CD11b e F4/80 para identificar monócitos (CD11b+F4/80 -), macrófagos (CD11b+F4/80+ Plus CD11b-F4/80+) e remanescentes de leucócitos não monocíticos (CD45+CD11b-F4/80-) (Figura 2). Os chips scWB foram então sondar para vinculação para determinar o número total de células em cada gel e para confirmar a ocupação única célula dos micropoços no chip scWB. A porcentagem de monócitos dentro dos plugues de gel derivados da membrana basal do porão MCP-1 foi baixa no dia 1, 20%, atingiu o pico no dia 3 em 47%, respectivamente, antes de cair para 14% no dia 5 (Figura 2D). Os números de macrófago dentro dos plugues de gel derivados da membrana do porão MCP-1-carregados aumentaram firmemente de 13% no dia 1, a 22% no dia 3 e 23% no dia 5. Para os plugues MCP-1-carregados, a porcentagem de monócitos mais macrófagos dentro da população de células isoladas foi maior no dia 3, 31% em fichas carregadas de veículos (Figura 3a) e 58% em fichas de MCP-1-Loaded (Figura 3B), indicando que após 3 dias a grande maioria das células recrutadas por quimiotaxia dependente de MCP-1 são monócitos e macrófagos. Embora o número total de monócitos mais macrófagos tenha sido maior no 5º dia em relação ao 3º dia (Figura 3C e D), devido à proporção significativamente maior de monócitos e macrófagos na população celular total (Figura 3a e B), a contagem de células no dia 3 reflete mais precisamente a quimiotaxia e o recrutamento de monócitos sanguíneos. Nós, conseqüentemente, injetamos rotineiramente a solução membrana-derivada do porão três dias antes de sacrificar os animais. Se todos os macrófagos recrutados pelo MCP-1 são macrófagos derivados de monócitos ou residentes recrutados de tecidos vizinhos contribuídos não foram determinados.
A análise estatística dos dados aqui apresentados foi realizada com o software de análise (por exemplo, SigmaPlot 14). A ANOVA seguida pelo teste de Fischer LSD foi utilizada para comparar os valores médios entre os grupos experimentais. Todos os dados são apresentados como média ± DP de pelo menos 3 experimentos independentes. Os resultados foram considerados estatisticamente significantes no nível de P < 0, 5.
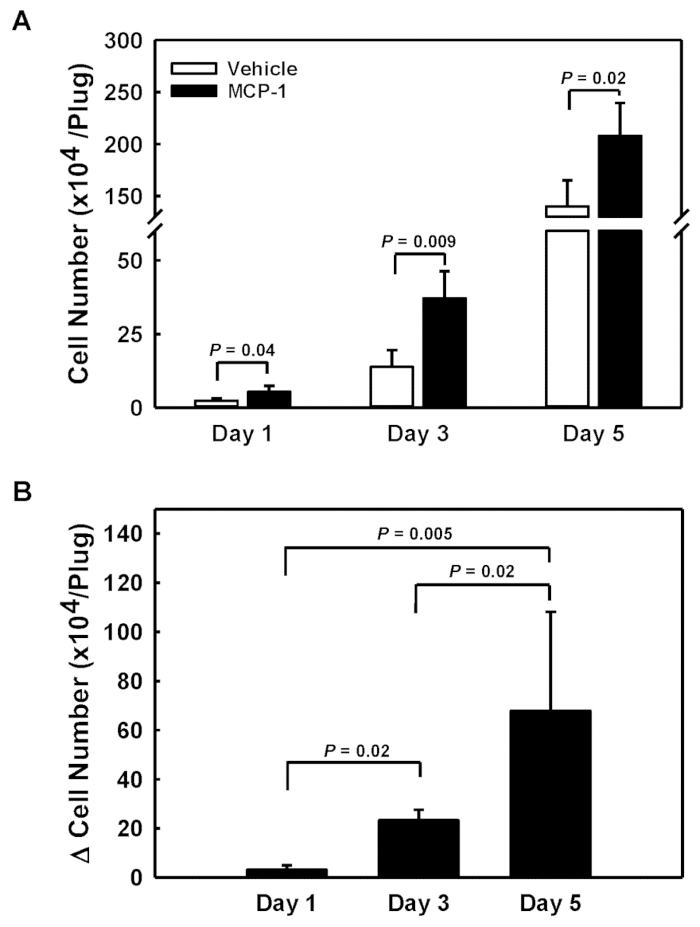
Figura 1 : Quantitation das pilhas recrutadas em plugues membrana-derivados subcutaneous do gel do porão. (A) números de células absolutas para fichas de gel derivadas de membrana do porão (barras fechadas) carregadas por veículos (barras abertas) e MCP-1. (B) o número de células recrutadas em fichas de gel derivadas de membrana basal por MCP-1 calculada como a diferença nos números de células entre as fichas MCP-1-Loaded e veículo-carregadas. Os resultados são mostrados como média ± DP (n = 4) por favor clique aqui para ver uma versão maior desta figura.
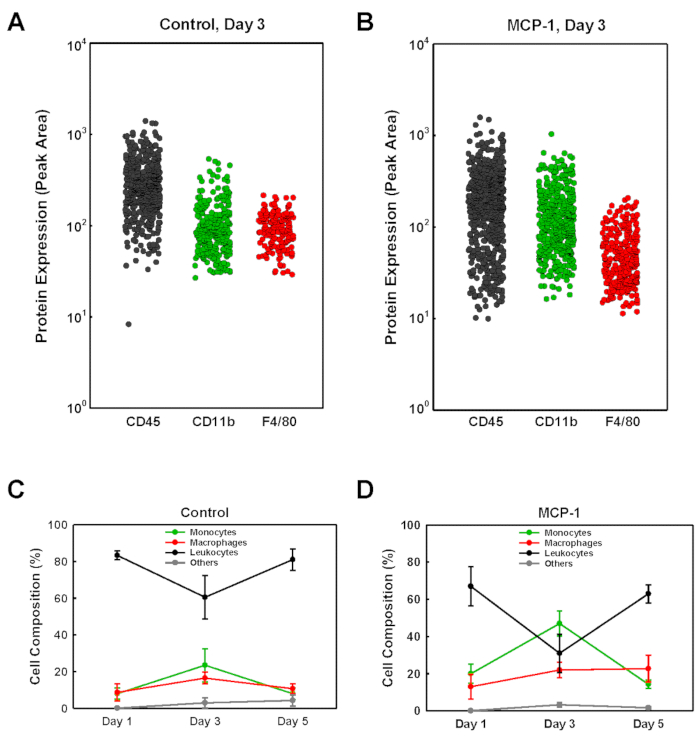
Figura 2 : A análise de populações da pilha recrutou em plugues membrana-derivados do gel do porão pela única análise ocidental do borrão da pilha. (A + B) Os exemplos representativos são mostrados para a análise de scWB de um veículo-carregado (controle) e de um plugue MCP-1-leaded (MCP-1) isolado de um rato três dias após a injeção. Chips rotulados com anticorpos direcionados contra CD45, CD11b e F4/80 seguidos de anticorpos secundários fluorescentes, conforme descrito no protocolo. A intensidade de fluorescência da banda rotulada para cada célula individual é mostrada como área de pico. (C + D) As populações de células foram identificadas como monócitos (CD11b+F4/80  -,), macrófagos (CD11b+F4/80+ Plus CD11b-F4/80
-,), macrófagos (CD11b+F4/80+ Plus CD11b-F4/80  +,) ou como leucócitos não monocíticos (CD45+ ,
+,) ou como leucócitos não monocíticos (CD45+ ,  ). As células restantes foram rotuladas como "Other
). As células restantes foram rotuladas como "Other " (). Os resultados são mostrados como média ± DP (n = 3). Por favor clique aqui para ver uma versão maior desta figura.
" (). Os resultados são mostrados como média ± DP (n = 3). Por favor clique aqui para ver uma versão maior desta figura.
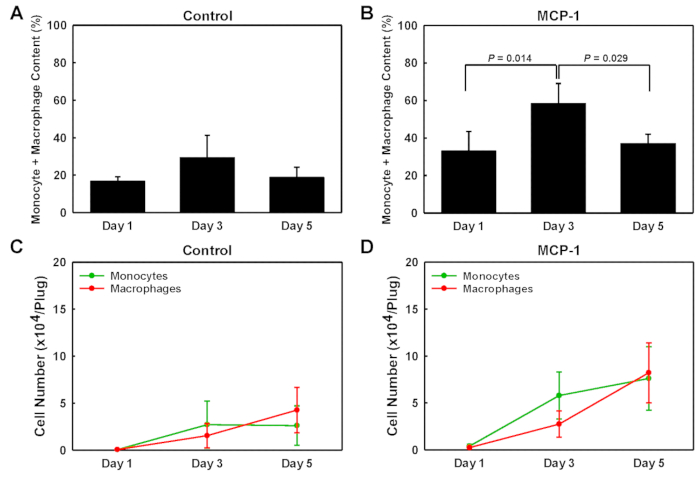
Figura 3 : Teor de monócitos e macrófago de tampões de gel derivados da membrana basal. Análise quantitativa do conteúdo de monócitos e macrófago recrutados em fichas carregadas de veículos e MCP-1, removidas no dia 1, 3 e 5 pós-injeção. Os valores são mostrados como porcentagem da população total de células (a + B) e em números de células absolutas por plugue (C + D). Os resultados são mostrados como média ± DP (n = 3). Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Desenvolvemos um ensaio de quimiotaxia in vivo, fazendo uso das propriedades físicas únicas da matriz derivada da membrana basal e da capacidade de carregar esta matriz única com quimiocinas e injetá-la em camundongos. O ensaio permite avaliar em camundongos vivos a responsividade dos monócitos (e macrófagos) às quimiocinas, como ilustrado aqui para o MCP-1, e os efeitos da manipulação genética ou da exposição farmacológica, dietética e outras exposições ambientais sobre monócitos Chemotaxis. Como o gradiente de quimiocina que criamos nesses camundongos é essencialmente afetado pela exposição genética, farmacológica, dietética ou ambiental, as alterações na atividade quimiotática de monócitos refletem, na verdade, mudanças funcionais nesses monócitos e, como mostramos anteriormente, também a reprogramação tanto na proteína quanto no nível transcricional17,20. Nós relatado que o stress metabólico nos ratos aumenta a compreensibilidade do monocyte ao chemoattractant e que esta atividade Hyper-chemotactic se correlaciona com a proteína S-glutathionylation aumentada, um redox-dependente pós-translational reversível a modificação protéica, que na maioria dos casos leva à perda da função enzimática e protéica21,22, e em algumas situações até promove a degradação protéica16,17.
Para executar com sucesso este procedimento e para obter resultados óptimos com este ensaio é crítico que os volumes exatos de solução membrana-derivada do porão estão injetados lentamente para criar um plugue bem formado singular e as cápsulas fibrosas devem ser removidas completamente para começ plugues limpos quando os plugues de gel membrana-derivados do porão da colheita, facilitam a dissolução do plugue inteiro na solução do Dispase. Nossos dados mostram que deixar a ficha nos animais por três dias otimiza 1) a intensidade do sinal, ou seja, o número de monócitos e macrófagos recrutados em cada plugue, 2) a seletividade do sinal, ou seja, o conteúdo de monócitos e macrófagos dentro do populações de células totais e 3) a especificidade do sinal, ou seja, o aumento de monócitos e macrófagos em resposta ao MCP-1 em comparação com o veículo. Finalmente, Nós demonstramos como as únicas abordagens baseadas em células de última geração em conjunto com o ensaio de plugue de gel derivado da membrana basal podem ser usadas para caracterizar os monócitos recrutados nos plugues e, assim, obter um instantâneo do fenótipo potencial de os macrófagos derivados de monócitos sendo recrutados para sítios de lesão em qualquer modelo de camundongo em resposta a intervenções genéticas, farmacológicas, dietéticas ou ambientais específicas.
Há uma série de limitações do ensaio a ser considerado. Primeiramente, a manipulação do rato, incluindo a anestesia, a injeção da solução membrana-derivada do porão, e a dissecção cirúrgica exigem a prática gerar únicos plugues e dados reprodutíveis. Em segundo lugar, enquanto a maioria das células recrutadas para o MCP-1 carregado plugues são monócitos e macrófagos, um número substancial não são. Isso pode afetar a interpretação de outros ensaios analíticos baseados em células não-únicas realizados nesta população celular. Finalmente, desde que as condições da lise da pilha para scWB são suaves, as distâncias da migração das proteínas podem diferir do WB padrão e não podem correlacionar com tamanho da proteína. Conseqüentemente, o lysis da pilha e os tempos de funcionamento têm que ser validados para que cada proteína nova seja testada e cada anticorpo preliminar usado.
Divulgações
Nenhum.
Agradecimentos
Este projeto foi apoiado por subsídios para a HNI (AT006885).
Materiais
| Name | Company | Catalog Number | Comments |
| 10 cm petri dish | griner bio-one | 664 160 | |
| 10x suspension buffer | proteinsimple | R101 | |
| 15 cm petri dish | Falcon | 353025 | |
| 2-Mercaptoethanol | MP BIOMEDICALS | 2194705 | |
| 5% washing buffer | proteinsimple | R252 | |
| Antibody diluent | proteinsimple | 042-203 | |
| Bench Top Centrifuge | Beckman Coulter | Microfuge 22R Centrifuge | |
| Bovine Serim Albumin | Sigma-Aldrich | A7906-100G | |
| Calcein AM | ThermoFisher | C3099 | 1 mL |
| CD11b | Novus Biologicals | NB110-89474 | |
| CD45 (D4H7K) rabbit mAb | Cell Signal Technologies | 727987S | |
| CD68/SR-D1 (FA-11) | Novus Biologicals | NBP2-33337SS | |
| Cellometer Vision | Nexcelom | ||
| Dispase | BD | 354235 | 100 mL |
| Dissecting sissor | |||
| Donkey anti-Rabbit IgG secondary antibody [NL557] | Novus Biologicals | NL004 | NL 557 conjugate |
| Donkey anti-Rat IgG (H+L) secondary antibody [DyLight 650] | Novus Biologicals | NBP1-75655 | DyLight 650 conjugate |
| F4/80 (CI-A3-1) | Novus Biologicals | NB600-404SS | |
| Heat Block | effendorf | 22331 | Thermomixer |
| Lysis/Running buffer | proteinsimple | R200 | |
| Matrigel Matrix (Grwoth Factor Reduced) | BD | 354230 | 10 ml |
| Microarray scanner | PerkinElmer | ScanArray Gx | |
| Microcentrifuge tube | Fisher Scientific | 05-408-129 | |
| Microscope | ThermoFisher | Evos fl | |
| Milo | proteinsimple | Single cell western | |
| Needle | BD | 305111 | 26 G |
| Parafilm | |||
| Probing chamber | proteinsimple | 035-020 | |
| Recombinant mouse CCL2/JE/MCP-1 protein | R&D | 479-JE-050 | |
| scWEST chip | proteinsimple | C300 | |
| Shaker | Bioexpress | Gene mate orbital shaker | |
| Single cell western chip canister | proteinsimple | 035-118 | |
| Slide spinner | Labnet | C1303-T | |
| Sodium Dodecyl Sulfate (SDS) | Fisher Scientific | BP 166-500 | |
| Syringe | BD | 309602 | 1 mL |
| Tris-Hydrochloride | Fisher Scientific | BP 153-500 | |
| Tweezer | proteinsimple | 035-020 | |
| Water bath | ThermoFisher |
Referências
- Moore, K. J., Tabas, I. Macrophages in the pathogenesis of atherosclerosis. Cell. 145 (3), 341-355 (2011).
- Chawla, A., Nguyen, K. D., Goh, Y. P. Macrophage-mediated inflammation in metabolic disease. Nature Reviews Immunology. 11 (11), 738-749 (2011).
- McNelis, J. C., Olefsky, J. M. Macrophages, immunity, and metabolic disease. Immunity. 41 (1), 36-48 (2014).
- Akiyama, T., et al. Genistein, a specific inhibitor of tyrosine-specific protein kinases. Journal of Biological Chemistry. 262 (12), 5592-5595 (1987).
- Nahrendorf, M., Pittet, M. J., Swirski, F. K. Monocytes: protagonists of infarct inflammation and repair after myocardial infarction. Circulation. 121 (22), 2437-2445 (2010).
- Gosling, J., et al. MCP-1 deficiency reduces susceptibility to atherosclerosis in mice that overexpress human apolipoprotein B. Journal of Clinical Investigation. 103 (6), 773-778 (1999).
- Fantuzzi, L., et al. Loss of CCR2 expression and functional response to monocyte chemotactic protein (MCP-1) during the differentiation of human monocytes: role of secreted MCP-1 in the regulation of the chemotactic response. Blood. 94 (3), 875-883 (1999).
- Boring, L., Gosling, J., Cleary, M., Charo, I. F. Decreased lesion formation in CCR2-/- mice reveals a role for chemokines in the initiation of atherosclerosis. Nature. 394 (6696), 894-897 (1998).
- Han, K. H., Tangirala, R. K., Green, S. R., Quehenberger, O. Chemokine receptor CCR2 expression and monocyte chemoattractant protein-1-mediated chemotaxis in human monocytes. A regulatory role for plasma LDL. Arteriosclerosis Thrombosis Vascular Biology. 18 (12), 1983-1991 (1998).
- Kanda, H., et al. MCP-1 contributes to macrophage infiltration into adipose tissue, insulin resistance, and hepatic steatosis in obesity. Journal of Clinical Investigation. 116 (6), 1494-1505 (2006).
- Davies, M. J., et al. The expression of the adhesion molecules ICAM-1, VCAM-1, PECAM, and E-selectin in human atherosclerosis. Journal of Pathology. 171, 223-229 (1993).
- Anderson, T. J., et al. The effect of cholesterol-lowering and antioxidant therapy on endothelium-dependent coronary vasomotion (see comments). New England Journal of Medicine. 332 (8), 488-493 (1995).
- Herold, S., Mayer, K., Lohmeyer, J. Acute lung injury: how macrophages orchestrate resolution of inflammation and tissue repair. Frontiers in Immunology. 2, (2011).
- Qiao, M., et al. Thiol Oxidative Stress Induced by Metabolic Disorders Amplifies Macrophage Chemotactic Responses and Accelerates Atherogenesis and Kidney Injury in LDL Receptor-Deficient Mice. Arteriosclerosis Thrombosis Vascular Biology. 29, 1779-1786 (2009).
- Ullevig, S., et al. NADPH Oxidase 4 Mediates Monocyte Priming and Accelerated Chemotaxis Induced by Metabolic Stress. Arteriosclerosis Thrombosis Vascular Biology. 32 (2), 415-426 (2012).
- Kim, H. S., Ullevig, S. L., Zamora, D., Lee, C. F., Asmis, R. Redox regulation of MAPK phosphatase 1 controls monocyte migration and macrophage recruitment. Proceedings of the National Academy of Science. 109 (41), E2803-E2812 (2012).
- Kim, H. S., Tavakoli, S., Piefer, L. A., Nguyen, H. N., Asmis, R. Monocytic MKP-1 is a Sensor of the Metabolic Environment and Regulates Function and Phenotypic Fate of Monocyte-Derived Macrophages in Atherosclerosis. Scientific Reports. 6, 34223(2016).
- Ponce, M. L. Tube formation: an in vitro matrigel angiogenesis assay. Methods in Molecular Biology. 467, 183-188 (2009).
- Auerbach, R., Lewis, R., Shinners, B., Kubai, L., Akhtar, N. Angiogenesis assays: a critical overview. Clinical Chemistry. 49 (1), 32-40 (2003).
- Kim, H. S., Ullevig, S. L., Nguyen, H. N., Vanegas, D., Asmis, R. Redox regulation of 14-3-3zeta controls monocyte migration. Arteriosclerosis, Thrombosis, and Vascular Biology. 34 (7), 1514-1521 (2014).
- Short, J. D., Downs, K., Tavakoli, S., Asmis, R. Protein Thiol Redox Signaling in Monocytes and Macrophages. Antioxidants and Redox Signaling. 25 (15), 816-835 (2016).
- Tavakoli, S., Asmis, R. Reactive oxygen species and thiol redox signaling in the macrophage biology of atherosclerosis. Antioxidants and Redox Signaling. 17 (12), 1785-1795 (2012).
- Ullevig, S. L., et al. Protein S-Glutathionylation Mediates Macrophage Responses to Metabolic Cues from the Extracellular Environment. Antioxidants and Redox Signaling. 25 (15), 836-851 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados