Method Article
Preparación y utilización de células musculares lisas de detrusor humano recién aisladas para la caracterización de corrientes de cationes sensibles al 9-Phenanthrol
En este artículo
Resumen
Describimos un método para la preparación de las células musculares lisas detrusorreciéntes recién aisladas a partir de muestras de vejiga urinaria humana que emplean un procedimiento enzimático de dos pasos. Las células DSM viables obtenidas pueden ser estudiadas por varias técnicas de células individuales, incluyendo la electrofisiología de abrazadera de parche anfotericina-B descrita para revelar propiedades fisiológicas y farmacológicas.
Resumen
Las células del músculo liso (DSM) de Detrusor presentes dentro de la pared urinaria de la vejiga en última instancia facilitan el almacenamiento y el vaciado de la orina. La preparación de las células DSM viables, frescas y aisladas presenta un importante desafío técnico cuyo logro proporciona células óptimas para estudios funcionales y moleculares posteriores. El método desarrollado y elaborado aquí, utilizado con éxito por nuestro grupo durante más de una década, describe la disección de muestras de vejiga urinaria humana obtenida de cirugías de vejiga abiertaseguidas de un tratamiento enzimático de dos pasos de piezas de DSM y trituración mecánica para obtener células DSM recién aisladas. El paso inicial consiste en la disección para separar la capa DSM (también conocida como muscularis propria) de la mucosa (urothelium, lamina propria, y muscularis mucosa) y los tejidos conectivos, vasculares y adiposos adyacentes presentes. A continuación, el DSM se corta en trozos (2-3 mm x 4-6 mm) en una solución nominal de disección/digestión (DS) Ca2+que contiene. Las piezas de DSM se transfieren y tratan secuencialmente por separado con DS que contiene papaína y colagenasa a 37 oC durante 30-45 minutos por paso. Después de lavados con DS que contiene suero bovino libre de enzimas y trituración con una pipeta pulida al fuego, las piezas liberan células DSM individuales. Las células DSM recién aisladas son ideales para caracterizaciones electrofisiológicas y farmacológicas de los canales iónicos con abrazaderade nalto. Específicamente, mostramos que el bloqueador de canal TRPM4 9-fenanthrol reduce las corrientes catiónicas evocadas por paso de voltaje registradas con el enfoque de abrazadera de parche perforada amphotericina-B. Las células DE DSM también se pueden estudiar mediante otras técnicas como RT-PCR de una sola célula, análisis de microarray, inmunocitoquímica, ensayo de ligadura de proximidad in situ e imágenes Ca2+. La principal ventaja de utilizar células DSM individuales es que las observaciones realizadas se relacionan directamente con las características de una sola célula reveladas. Los estudios de células dsm humanas recién aisladas han proporcionado información importante que caracteriza las propiedades de varios canales iónicos, incluyendo catiónico-permeable en la vejiga urinaria y continuará nado como un estándar de oro en el aclaramiento de propiedades celulares DSM y mecanismos reguladores.
Introducción
Las células del músculo liso de Detrusor (DSM) constituyen el tipo celular más abundante en la vejiga urinaria y, en última instancia, controlan el almacenamiento y el vaciado de orina a través de la relajación y la contracción, respectivamente. Las células DSM forman haces musculares lisos que se entrelazan con el tejido conectivo adyacente, los procesos nerviosos, las células intersticiales y otros tipos de células1. La comprensión actual del papel de las células DSM en la función de la vejiga urinaria se ha logrado a través de un enfoque integrado multinivel. Cada método experimental - ya sea basado en células individuales aisladas in vitro, tiras de tejido que contienen haces musculares lisos in vitro/ex vivo, o determinaciones in vivo (como evaluaciones de la citometría y la función de anulación) - proporciona información importante y específica sobre las propiedades fisiológicas y farmacológicas de DSM (ver comentarios1,2,3,4,5,6 para más detalles). Sin embargo, la interpretación de los resultados obtenidos a partir de celdas únicas aisladas permite atribuir específicamente las conclusiones al tipo de celda única en sí. Esta realización ha sido la fuerza motriz para establecer un método confiable y reproducible para obtener células DSM recién aisladas de muestras de vejiga urinaria de todo el espesor. A diferencia de muchos otros tipos de células, las células musculares lisas no se pueden cultivar de forma fiable debido a la pérdida de su fenotipo nativo, incluyendo cambios específicos en sus propiedades electrofisiológicas y contrácticas7,8. Este hecho refuerza aún más la importancia de los estudios realizados sobre células DSM fisiológicamente activas recién aisladas.
A finales de la década de 1980 y principios de 1990, el grupo de Isenberg (Alemania) publicó una serie de estudios electrofisiológicos sobre células DSM recién aisladas obtenidas de vejigas urinarias de conejillo de indias9,10,11,12,13 ( Tabla1). El método destacó dos observaciones importantes que ayudaron en la obtención de células vitales y sirvieron como una guía inicial para que otros las siguieran. Fueron 1) pre-tratamiento de piezas aisladas DSM con Ca2 +-solución libre / medio antes del tratamiento enzimático y 2) digestión de tejido con una solución que contiene la colagenasa. Estos dos pasos críticos se han incorporado a todas las variantes posteriores de los procedimientos de disociación de células DSM (Tabla 1). Actualmente, nuestro grupo emplea un enfoque secuencial de disociación de papaína-colagenasa de dos pasos. Las piezas de DSM se tratan primero con una solución enzimática que contiene papaína y luego con colagenasa tipo II solubilizada en la misma solución (DS, solución de disección/digestión). Este enfoque produce células de DSM únicas de varias especies, incluyendo conejillo de indias, cerdo, rata, ratón y, lo que es más importante, humano(Tabla 1).
Las células de DSM individuales proporcionan una fuente para múltiples experimentos fisiológicos y de biología molecular. Hasta ahora, las expresiones proteicas y ARNm estudiadas con inmunocitoquímica, o las determinaciones RT-PCR/qRT-PCR revelaron altos niveles de detección para varios canales iónicos, incluyendo la gran tensión de conductividad- y Ca2+-activado (BK), pequeña conductancia Ca2+-activado K+ tipo 3 (SK3), voltaje-gated K+ (Kv), voltaje de tipo L -cerrado Ca2+ (Cav), y receptor transitorio potencial de melastatina tipo 4 (TRPM4) canales de intercambio, así como un Na/Ca+ 2 + 14,15,16,17,18,19,20,21,22. Todos ellos se piensan para controlar la excitabilidad DSM, niveles intracelulares Ca2+ y contractilidad. Los enfoques electrofisiológicos de abrazadera de parche, realizados directamente sobre células dsm de conejillo de indias, ratón, rata o humanas, proporcionaron una demostración directa de las propiedades biofísicas y farmacológicas del tipo L Cav, Kv (Kv2.x. Kv7), SK, BK y TRPM4 canales17,19,20,21,22,23,24,25, 25, 25, 25, 25, 25, 25, 25, 25, 25, 25, 25, 25, 25, 25, 25, 25, 25, 25, 25, 25, 25, 25, 25, 25, 25, 25, 25, 25, 25, 25, 25, 25, 25, 25, 25, 25, 25, 25, 25, 25, 25, 25, 25, 25, 25, 25, 25, 25, 25, 25, ,26,27,28,29,30,31. Los enfoques incluían una abrazadera de voltaje de celda completa convencional, una abrazadera de voltaje perforada y grabaciones de un solo canal (configuración de celda conectada, de adentro hacia afuera y fuera). Además, el registro potencial de membrana de DSM utilizando una abrazadera de corriente proporcionó evidencia de que los agentes farmacológicos que se involucran con objetivos alteran la excitabilidad celular. Por ejemplo, el inhibidor de TRPM4 9-phenanthrol indujo hiperpolarización en células DSM obtenidas de humanos, conejillo de indias y vejigas urinarias de rata19,20,22,31. Entre los diversos métodos electrofisiológicos, las grabaciones de anfotericina B (y nistatina, gramicidina y escina) perforadas proporcionan una ventaja clave al preservar las moléculas y vías de señalización intracelular intrínsecas. Sólo los cationes de bajo peso molecular y, en menor medida, Cl- pero no proteínas o moléculas de señalización incluyendo Ca2+ - son permeables a través de los poros de membrana plasmática formados por anfotericina-B o nistatina32. El resultado exitoso de los experimentos perforados de abrazaderas de parche depende de varias variables generales únicas de esta técnica. Aquí, describimos los detalles del procedimiento utilizando anfotericina-B que nuestro grupo ha utilizado con éxito a lo largo de los años15,22,33,34,35,36,37,38,39.
Podría decirse que los canales de cationes no selectivos siguen siendo uno de los tipos de canal menos comprendidos en las células DSM. El primer informe de un canal no selectivo similar a un catión data de 1993. El artículo de Wellner e Isenberg11 describió un canal único activado por estiramiento de 33 pS que muestra el siguiente orden de rango de permeabilidad iónica: K+>Na+>Cs+>>>Ba2+>Ca2+, e inhibición de la actividad del canal por Gd3+, un inhibidor general de los canales catiónicos no selectivos. Casi una década más tarde, Thorneloe y Nelson40 describieron Na+ corrientes catiónicas permeables en células DSM de ratón, inhibidas por Gd3+,utilizando grabaciones de células enteras. Dado que las identidades moleculares de los canales de cationes no selectivos y sus caracterizaciones biofísicas están por determinar, las investigaciones futuras en esta área de investigación están justificadas. El protocolo descrito aquí para el registro de corrientes de canal catiónico no selectivos - utilizando soluciones intracelulares extracelulares y pipetas que contienen Cs+, TEA+, y nifedipino(Tabla 2) que fisiológica y farmacológicamente mitigan las corrientes Kv y Cav - ha sido y seguirá siendo útil en las investigaciones electrofisiológicas de canales catiónicos no selectivos. Hemos utilizado este protocolo específico para determinar el grado de inhibición de las corrientes catiónicas de células enteras por el bloqueador de canal TRPM4 9-fenodrol en conejillo de indias, células DSM de rata yhumanas 19,20,22.
En conjunto, el método descrito aquí para obtener células DSM únicas recién aisladas de la vejiga urinaria humana proporciona células viables altamente adecuadas para investigaciones electrofisiológicas utilizando diversas configuraciones de la técnica de abrazadera de parche, Ca2+-imágenes, inmunocitoquímica, ensayo de litigios proximales in situ y RT-PCR/qRT-PCR de una sola célula, así como técnicas avanzadas de biología molecular, incluyendo análisis de microarray, RNA-seq y CHIP-seq. El uso del método de abrazadera de parche perforada anfotericina-B preserva el entorno celular nativo a diferencia de otras configuraciones. Cuando se lleva a cabo utilizando las condiciones específicas descritas aquí, diseñadas para negar las contribuciones de corrientes K+ y Ca2+ en las células DSM, las corrientes inducidas por pasodedes de voltaje muestran las propiedades de las corrientes catiónicas no selectivas adecuadas para caracterizaciones biofísicas y farmacológicas.
Protocolo
Todos los métodos descritos aquí han sido aprobados por los Comités de la Junta de Revisión Institucional del Centro de Ciencias de la Salud de la Universidad de Tennessee (Memphis, TN, IRB-17-05714-XP), y la Universidad Médica de Carolina del Sur (Charleston, SC, IRB- 00045232). Los procedimientos aprobados permiten que las muestras de vejiga urinaria de espesor entero (>1 cm por >1 cm) - que contiene todas las capas incluyendo mucosa, músculo liso detrusor, y serosa, así son vasos sanguíneos unidos y tejido adiposo) - para ser recogidos de pacientes-donantes sometidos a extracción quirúrgica parcial de la vejiga. Los pacientes-donantes son adultos (rango de edad estudiado hasta ahora: 25 a 87 años de edad), ya sea hombre o mujer, con o sin síntomas de vejiga hiperactiva (según lo clasificado por la Asociación Americana de Urología I-PSS puntuación41). Los procedimientos quirúrgicos implican una variedad de condiciones médicas, incluyendo la cistectomía radical para el carcinoma urotelial y el adenocarcinoma. En tales casos, la muestra de vejiga urinaria recogida está alejada del sitio del tumor.
1. Disección de los tejidos de DSM y preparación de piezas DSM libres de mucosas
- Examine todo el espesor de la muestra de vejiga urinaria que llegó al laboratorio desde el quirófano en un recipiente herméticamente sellado lleno de la solución de disección/digestión en frío(Figura 1 y Tabla 2 para la composición de DS).
NOTA: La muestra generalmente se mantiene en DS fría desde unas pocas horas hasta la noche antes de la llegada al laboratorio. Para un almacenamiento más largo, DS(Tabla 2) se complementa con 1 mM CaCl2. - Retire y enjuague el espécimen DSM de espesor entero humano (que contiene todas las capas, incluyendo mucosa, DSM y serosa) con DS helado para lavar los desechos y la sangre adheridos.
- Ancle la muestra de vejiga urinaria, mucosa hacia arriba y serosa hacia abajo, sobre un plato redondo recubierto de enantiómero de silicona(Tabla de Materiales)de 150 mm de diámetro lleno de DS helado(Figura 1B).
- Retire el tejido adiposo adyacente, los vasos sanguíneos, el epitelio (urotelio) y la mucosa muscular de la muestra mediante una disección aguda utilizando microtijeras y fórceps.
- Cortar varias piezas de DSM libres de mucosas (2-3 mm de largo y 4-6 mm de ancho)(Figura 1C).
2. Disociación enzimática de piezas DSM que producen células DSM únicas recién aisladas
- Coloque de 3 a 6 piezas de DSM en un tubo que contenga de 1 a 2 ml de DS precalentado (37 oC) que contenga papaína y ditiothreitol (DS-P, Tabla 2) e incubar piezas de DSM en DS-P durante 30-45 min a 37 oC agitando suavemente el tubo ocasionalmente (una vez cada 10-15 min).
NOTA: Para controlar de forma óptima la temperatura para el tratamiento enzimático, los tubos con piezas de tejido y soluciones enzimáticas se colocan en una cámara de tejido de vidrio llena de agua conectada a un baño de agua caliente circulante(Figura 1D)o en un baño de agua agitador de alta precisión controlado por temperatura(Figura 1E). - Retire el DS-P del tubo, lave brevemente las piezas de DSM con DS frío y helado, deseche el DS frío del tubo dejando las piezas de DSM sentadas en la parte inferior del tubo.
- Añadir de 1 a 2 ml de colagenasa tipo II que contiene DS (DS-C, Tabla 2)al tubo con piezas de DSM, mezclar suavemente; e incubar durante 25-40 minutos a 37 oC agitando suavemente el tubo de vez en cuando (cada 10-15 min).
- Deseche DS-C y lave las piezas de DSM tratadas con enzimas 5-10 veces con DS helado.
- Después del último lavado, deje la solución DS dentro del tubo; triturar suavemente con una pipeta Pasteur pulida al fuego varias veces para liberar células DSM individuales.
- Coloque unas gotas de solución DS que contengan células DSM dispersas en una cámara de fondo de vidrio o una cubierta e inspeccione visualmente la calidad bajo un microscopio (utilizando un objetivo de 20x o 40x) después de al menos 5 minutos después de la aplicación para permitir que las células se adhieran a el fondo.
- Utilice inmediatamente células DSM recién aisladas para experimentos electrofisiológicos o almacene las células en un tubo que contenga DS a 4 oC, ya sea sobre hielo o en un refrigerador hasta su uso (normalmente hasta 8 horas de preparación).
NOTA: Dentro de la misma preparación, la calidad de las células varía de células DSM muertas altamente viables a excesivamente digeridas (Figura 2). Cuando el método secuencial de papaína-colagenasa produce un número muy alto de células inviables, la preparación se descarta, y se lleva a cabo una nueva digestión de las piezas de DSM pero con intervalos de incubación reducidos. Si el procedimiento da como resultado muy pocas células DSM, entonces para la digestión posterior de piezas de DSM, los intervalos de incubación se incrementan. La inmunoreactividad positiva a la actina muscular suave confirma la identidad de las células de DSM(Figura 3).
3. Registro de corrientes de cationes inducidas por el paso de voltaje de las células DSM utilizando la técnica de abrazadera de parche de voltaje de células enteras perforadas anfotericina-B
- Pipetear 0,25-1 ml de suspensión celular sobre una cámara inferior de vidrio sentada en un escenario de un microscopio invertido y permitir que las células se adhieran al fondo de vidrio.
- Después de la incubación durante al menos 45 minutos, retire DS del baño y reemplácelo por la solución E (Tabla 2) por superfusión donde el flujo de solución ayudado por la gravedad a través de la ralentización del tubo de entrada reemplace DS con la nueva solución mientras que el tubo de salida conectado a un recipiente de desecho de vacío elimina la solución de la cámara y evita el desbordamiento. Tenga en cuenta que la solución E contiene iones de tetraetilammonio (TEA+)y cesio (Cs+) para inhibir las corrientes K+.
- Preparar una solución de culata de anfotericina-B en dimetil sulfóxido (DMSO) (1 mg por 10 oL de DMSO). Para disolver completamente el polvo de anfotericina, sonicar (al menos 15 min) y vórtice bien.
NOTA: Este paso suele tardar menos de 10 minutos en disolver 3-4 mg de anfotericina-B en 30-40 l de DSMO en un tubo de microcentrífuga de 1,5 ml funciona bien. Las cantidades más altas de anfotericina-B requieren más disolvente DSMO, lo que normalmente resulta en un intervalo más largo para la mezcla y la solubilización incompleta de las partículas sólidas de anfotericina-B presentes en el tubo. - Disolver la solución de stock de anfotericina-B en la solución de pipeta (solución P, Tabla 2) para obtener una concentración final de 200-500 g/ml. Este paso requiere una sonicación y vórtice extensivos en un ajuste de alta velocidad (8-10/10) durante 30 a 60 minutos por paso para garantizar una mezcla óptima y la prevención de la formación de precipitados de anfotericina-B en la solución de pipeta.
NOTA: La anfotericina-B precipitará el tiempo y es sensible a la luz. La solución de pipeta de trabajo que contiene amphotericina-B se comprueba la solubilidad, se mezcla a mano antes del llenado de la pipeta y se mantiene en la oscuridad. - Tire de múltiples electrodos de parche, puntas de electrodo de pulido de fuego, y (si es necesario) cubra las puntas con cera dental.
- Llene la punta de un electrodo de parche con la solución de pipeta (solución P, Tabla 2)sin anfotericina-B sumergiendo brevemente el electrodo en la solución.
- Rellene el electrodo con la misma solución de pipeta que contiene anfotericina B.
- Monte el electrodo en un soporte conectado a un cabezal de amplificador con abrazadera de parche.
- Usando un micromanipulador, coloque el electrodo justo debajo de la superficie de la solución extracelular para que la punta del electrodo esté sumergida.
- En el modo de abrazadera de voltaje, ajuste el potencial de sujeción a 0 mV y ajuste la corriente a 0 pA con el dial de desplazamiento de pipeta en el amplificador comercial(Tabla de materiales).
- Determinar la resistencia del electrodo utilizando la ventana/función de prueba de membrana del software de adquisición comercial(Tabla de materiales). Para activar haga clic en Herramientas>Prueba de membrana>Reproducir o un icono de acceso directo en el software. La resistencia determinada del electrodo debe estar en el rango de 2 a 5 M.
NOTA: La función de prueba de membrana proporcionada en el software de adquisición comercial o la opción de prueba de sello en el amplificador se puede utilizar para supervisar la resistencia de los electrodos mediante la aplicación de pasos de voltaje de forma repetitiva. - Continúe monitoreando la resistencia de los electrodos mientras avanza el electrodo hacia una célula DSM elegida con un micromanipulador(Figura 4A).
NOTA: Para ser considerada una célula DSM viable, la célula debe mostrar morfología alargada en forma de husillo, un halo bien definido alrededor de la célula, bordes nítidos y apariencia semi-contráctea (serpentina). - Al tocar la superficie celular con el electrodo - indicado por un rápido aumento en la resistencia del electrodo medido con la función de prueba de membrana - formar un sello de giga mediante la aplicación de presión negativa rápida suave al soporte del electrodo a través de la tubería. Esto resulta en presión negativa creada en la punta del electrodo que tira de la membrana celular en el electrodo ayudando en la formación de un sello de giga o un contacto muy estrecho entre el electrodo y la membrana plasmática(Figura 4B).
- Una vez que se forme el sello giga, compense la capacitancia de la pipeta ajustando los diales rápidos y lentos en el amplificador comercial y monitoree la estabilidad del giga-seal (corriente de fuga) utilizando la función de prueba de membrana.
- Deje tiempo, típicamente 30-60 min, para que la anfotericina-B difunda por la pipeta y se inserte en la membrana plasmática formando poros principalmente selectivos a cationes monovalentes. Durante este paso, continúe monitoreando el giga-seal con la función Detención de membrana. A medida que aumenta la perforación celular también lo hace la amplitud de los transitorios de capacitancia (comparar la Figura 4B con la Figura 4C que no muestra la perforación celular efectiva y no, respectivamente) medida con la función de prueba de membrana.
- Cuando la perforación del parche es óptima (juzgada por una resistencia en serie estable típicamente por debajo de 50 M), cancele los transitorios de capacitancia ajustando los diales para la capacitancia celular y la resistencia en serie en el amplificador. La compensación de resistencia de serie también se puede realizar en este momento(Figura 4D).
- Una vez que se observan corrientes de cationes inducidas por el paso de voltaje estables evocadas por el protocolo especificado, aplicar una condición compuesta o fisiológica para probar por superfusión y registrar las respuestas para el control-, condición de prueba, y lavado (si es posible) con el software de adquisición comercial.
- Registre las corrientes con un protocolo de paso de voltaje de rutina que implica la retención de células DSM a -64 o -74 mV y el paso de la tensión en incrementos de 10 mV durante 400 o 500 ms de -94 a +96 o +106 mV y volver al potencial de retención.
NOTA: Los valores potenciales de membrana se ajustan para un potencial de unión líquida de 14 mV (utilizando soluciones P y E, Tabla 2). El potencial de unión líquida se obtiene en el software de adquisición comercial(Tabla de materiales)haciendo clic (Herramientas>Potencialesde unión ) e introduciendo las concentraciones de componentes de iones de solución. Un protocolo de rampa también se puede utilizar para obtener grabaciones actuales. - Ejecute el protocolo de voltaje en un intervalo continuo de 1 minuto durante un experimento que registra las corrientes para el control previo a la adición, la condición de prueba y el lavado.
- Registre las corrientes con un protocolo de paso de voltaje de rutina que implica la retención de células DSM a -64 o -74 mV y el paso de la tensión en incrementos de 10 mV durante 400 o 500 ms de -94 a +96 o +106 mV y volver al potencial de retención.
4. Análisis y visualización de datos
- Abra los archivos grabados en el software de análisis de datos comerciales(Tabla de materiales)para el control, la condición de prueba y el lavado haciendo clic en Archivo>Abrir datos y seleccionando los archivos de interés para la apertura.
NOTA: Para el análisis normalmente se abren y analizan tres archivos (cada uno con un único conjunto de seguimientos en una sola ejecución de protocolo) para cada condición. Las respuestas se promedian posteriormente para obtener una respuesta media para cada condición. El software utilizado para la adquisición de datos contiene una opción para recopilar automáticamente varias ejecuciones de prueba especificadas por el usuario y promediarlas para un solo archivo de salida que se puede utilizar como alternativa. - Obtener la respuesta media durante los últimos 200 ms para el seguimiento de corriente medido en cada voltaje; el intervalo de duración elegido refleja un nivel de estado estacionario de activación de corriente de paso de tensión. Para ello, siga los pasos que se indican a continuación.
- Seleccione un archivo de interés para su análisis en el software de análisis comercial(Tabla de materiales).
NOTA: El software coloca el archivo importado más recientemente en su ventana de visualización activa. El archivo abierto muestra una serie de trazas superpuestas obtenidas con un protocolo de paso de voltaje. De forma predeterminada, dentro de la ventana activa se muestran cuatro cursores (que muestran los valores x e y para el seguimiento resaltado). - Elija el rango para el análisis colocando el cursor 2 al final del paso de voltaje de 400 o 500 ms y el cursor 1 en el intervalo de 200 ms antes de eso para que el rango de análisis sea de 200 ms.
- Obtenga respuestas para cada voltaje haciendo clic en Analizar>Gráfico rápido>IV (o el icono de acceso directo IV) (en la ventana de solicitud antes de generar datos confirme que para el eje Y (Actual) señal opciones de región "Cursores 1..2" y "Media" están seleccionados). Haga clic en Aceptar para generar el gráfico I-V y colocar los datos en una hoja de columnas Resultados que se puede ver accediendo a Windows>Resultados.
- Analice archivos adicionales repitiendo los pasos 4.2.1 - 4.2.3. Haga clic en Analizar>Gráfico rápido>IV o en el acceso directo del icono IV, seleccione Anexar en lugar de Reemplazar para agregar datos adicionales a la hoja Resultados al procesar los seguimientos.
- Copie los datos en una hoja de cálculo seleccionando las columnas de interés y presionando CTRL+C para copiar y CTRL+V para pegar. Almacene la hoja de cálculo Resultados en el software de análisis comercial(Tabla de materiales) en formato (*.rlt) haciendo clic en Archivo>Guardar como.
- Seleccione un archivo de interés para su análisis en el software de análisis comercial(Tabla de materiales).
- Para cada celda, normalice las respuestas para las tres condiciones al valor del paso de voltaje máximo para el control de pre-adición (según la fórmula:Respuesta/Control de respuesta-Max) y grafique las respuestas como valores de corriente (o densidad de corriente) frente a relaciones de voltaje(Figura 6).
- En un procesador de hoja de trabajo, determine las respuestas promedio como corrientes (pA) o densidades de corriente (pA/pF) para el control, la condición de prueba (en este ejemplo, 9-fenanthrol) y el lavado en cada paso de voltaje.
- Divida los valores para cada voltaje de cada condición (control, 9-fenantoma y lavado) por la respuesta de control máxima obtenida en la tensión más alta (+96 mV en la Figura 6) para el control de pre-adición siguiendo la fórmula: Respuesta normalizada para condición(x) - Respuesta(x)/ Control derespuesta-Máximo para (x).
- Para el análisis de resumen, organice los datos en un formato que se pueda copiar fácilmente en un programa gráfico (por ejemplo, GraphPad Prism) para su visualización.
Resultados
La disociación enzimática de piezas DSM proporciona células DSM sanas recién aisladas que se utilizan rutinariamente en estudios funcionales y moleculares tales como: electrofisiología de abrazadera de parche e inmunocitoquímica. La Figura 1 resume los pasos de disección y visualiza las configuraciones empleadas para el control de la temperatura de los pasos de tratamiento enzimático. La Figura 2 ilustra imágenes de campo brillante de células DSM obtenidas a partir de tres muestras de vejiga urinaria humana cada una de un paciente-donante diferente. Las células sanas de DSM individuales se caracterizan por una morfología en forma de husillo, bordes nítidos bien definidos, un halo bien definido alrededor de la célula y apariencia semicontrácel (similar a la serpentina) cuando se ven bajo el microscopio (consulte células DSM marcadas por flechas blancas en la Figura 2). También responden a agentes estimulantes de la contracción como el carbachol agonista muscarínico o altas aplicaciones de K+ (60 mM). Las células de DSM muestran inmunorreactividad positiva para la actina muscular lisa que confirma su identidad(Figura 3).
Las células DSM son ideales para investigaciones electrofisiológicas con abrazaderade parche de propiedades del canal iónico. Aquí, describimos el método de grabación perforado de abrazadera de parche de anfotericina-B utilizando pipetas y soluciones extracelulares(Tabla 2)para registrar de manera óptima los canales de cationes inducidos por paso de voltaje. En las condiciones específicas empleadas, el bloqueo de corrientes Ca2+ de tipo Kv y L con Cs+/TEA+ y nifedipino, respectivamente, aseguró la eliminación de la contribución de estos componentes iónicos a las corrientes evocadas por tensión de células enteras. La Figura 4 y la Figura 5 muestran, respectivamente, los pasos experimentales del método de abrazadera de parche perforada anfotericina-B y las corrientes representativas de células enteras medidas con un paso de voltaje inducido o un protocolo de rampa en tres células DSM humanas diferentes, cada una de un donante de paciente diferente. Tenga en cuenta que las grabaciones muestran un cierto grado de variabilidad en términos de amplitudes actuales y rectificación externa. Experimentos adicionales revelaron que 9-fenantrol, un inhibidor del canal TRPM4, inhibió eficaz mente y de forma reversible corrientes catiónicas dsm humanas a voltajes negativos y positivos(Figura 6). El componente de corriente sensible al 9-fenanthrol ilustra una inhibición más fuerte en voltajes positivos y rectificación externa(Figura 6C).
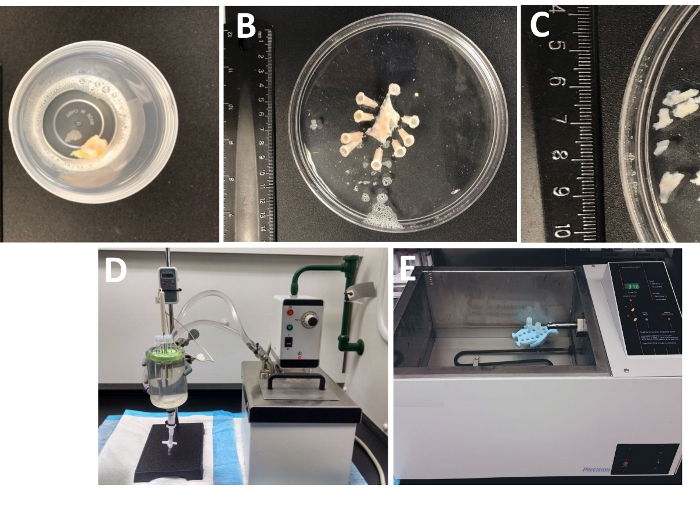
Figura 1: Resumen de los pasos de disección que dan como resultado la preparación de piezas de músculo liso detrusor (DSM) y la configuración utilizada para la disociación enzimática. Se muestran imágenes de: (A) una muestra de vejiga urinaria humana de espesor completo proporcionada a partir de una cirugía de vejiga abierta como material quirúrgico extraño en DS helado, (B) la misma preparación después de fijar con una capa DSM parcialmente diseccionada, (C) piezas DSM de dimensiones variables cortadas de la capa DSM listas para la digestión enzimática (piezas más pequeñas) u otras investigaciones experimentales (piezas más grandes), (D, E) configuraciones alternativas utilizadas para la digestión enzimática de piezas DSM que consisten en piezas DSM que consisten en piezas DSM que consisten en piezas DSM que consisten en piezas DSM que consisten en piezas DSM que consisten en piezas DSM que consisten en piezas de DSM que consisten en piezas DE DSM que consisten en piezas de DSM que consisten en piezas de DSM que consisten en piezas de DSM que consisten en piezas DE DSM que consisten en piezas DE DSM que consisten en piezas de DSM que consisten en piezas de DSM que consisten en piezas de DSM (1) un baño de agua circulante con temperatura controlada conectado a través de un tubo a una gran cámara de tejido de vidrio llena de agua, un soporte de goma para tubos, tubos de plástico que contienen piezas DSM y soluciones enzimáticas preparadas en solución de disección/digestión (DS, DS-P o DS-C, Tabla 2) y una sonda de temperatura vinculada a una pantalla que permite un monitoreo continuo (D), o (2) un gran baño de temperatura controlada lleno de agua que contiene un soporte y tubos con piezas DSM y soluciones enzimáticas (E E ). Haga clic aquí para ver una versión más grande de esta figura.
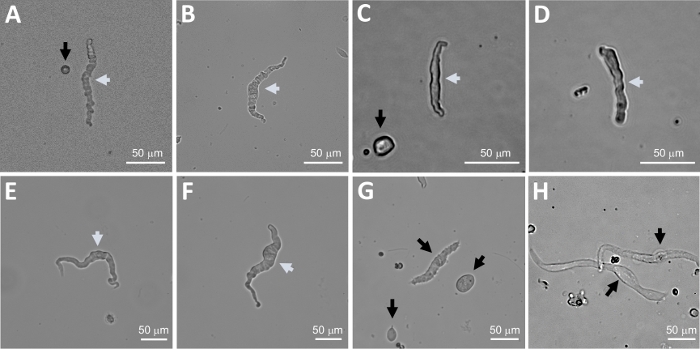
Figura 2: Imágenes representativas de campo brillante de células humanas de DSM recién aisladas obtenidas utilizando el método secuencial de digestión papaína-colagenasa. (A-F) Se muestran imágenes de células DSM viables y fisiológicamente activas consideradas candidatas adecuadas para intentar grabaciones perforadas de abrazaderas de parche. (G, H) Imágenes de células no viables o excesivamente digeridas; tales células se evitaron para experimentos con abrazaderas de parches. Las flechas blancas y negras en los paneles (A-H)apuntan a las células DSM consideradas viables y no viables, respectivamente, para intentar grabaciones de abrazaderas de parche. Tenga en cuenta que las flechas negras en los paneles (A, C y G) apuntan a fragmentos de celda (piezas circulares) o células pequeñas que carecen de morfología DSM y en (H) las células aparecen pálidas y dilatadas. Las imágenes proceden de tres muestras diferentes de vejiga urinaria(A y B: fuente paciente-donante uno, C y D: fuente paciente-donante dos, y E-H: fuente paciente-donante tres). Haga clic aquí para ver una versión más grande de esta figura.
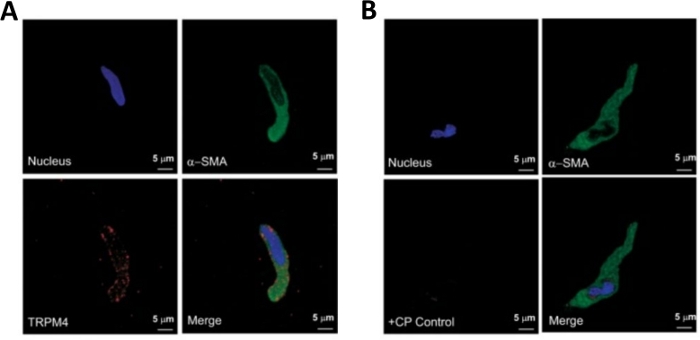
Figura 3: Expresiones del canal de melastatina potencial del receptor transitorio tipo 4 (TRPM4) y inmunorreactividades específicas de actina muscular suave en células DSM humanas individuales mediante análisis inmunocitoquímicos. (A) Se muestran imágenes confocales que muestran la detección inmunocitoquímica de la expresión de proteína del canal TRPM4 en una célula DSM humana. La tinción roja (abajo a la izquierda) indica proteínas del canal TRPM4; la tinción azul (DAPI) detecta núcleos celulares (arriba a la izquierda); la tinción verde indica la actina muscular suave (-SMA, arriba a la derecha); la imagen combinada (abajo a la derecha) ilustra la superposición de las tres imágenes. (B) Imágenes confocales que ilustran la atenuación de la detección inmunocitoquímica de la expresión de proteína del canal TRPM4 en presencia de un péptido competidor específico de TRPM4 (CP) en células DSM humanas aisladas. La tinción azul (DAPI) indica núcleos celulares (arriba a la izquierda); la tinción verde es para la actina muscular suave (-SMA, arriba a la derecha); la imagen combinada (abajo a la derecha) ilustra la superposición de las tres imágenes. Los resultados se verificaron en cuatro experimentos separados utilizando tejido entero de DSM o múltiples células DSM aisladas de cuatro pacientes. Las imágenes son de Hristov et al. (2016)22 y se utilizan con permiso. Haga clic aquí para ver una versión más grande de esta figura.
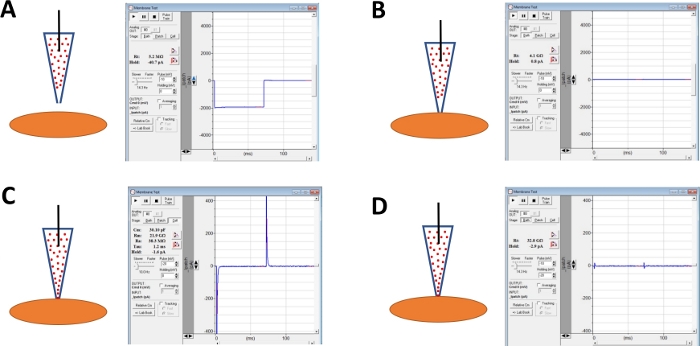
Figura 4: Ilustración esquemática de pasos involucrados en la formación de giga-sello y perforación de anfotericina-B de células humanas DSM. Se ilustran las posiciones espaciales de una pipeta que contiene anfotericina-B y una célula DSM junto con las respuestas asociadas para las pruebas de membrana obtenidas en el software de adquisición comercial(Tabla de materiales)mediante la alteración de los pasos de tensión (ya sea -10 o -20 mV en este ejemplo) determinando la resistencia. Las configuraciones son: (A) antes del enfoque celular con un electrodo, (B) después de la formación de giga-sello obtenido mediante la colocación de la pipeta que contiene anfotericina B (amphotericina-B representada por puntos rojos) en la superficie celular y la aplicación de presión negativa, (C) la configuración en la célula mostrada a 45 minutos después de la formación de giga-sello, en este momento la anfotericina-B se ha difuminado por la pipeta y sus moléculas se han insertado en la membrana plasmática en la punta del electrodo que forma cationes poros permeables, y (D) la misma configuración que en (C) pero con transitorios de capacitancia cancelados usando diales para capacitancia de células enteras y resistencia en serie en el amplificador. Haga clic aquí para ver una versión más grande de esta figura.
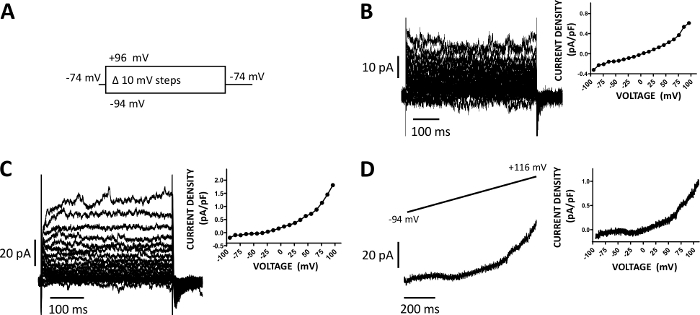
Figura 5: Corrientes catiónicas de células enteras registradas con el método de abrazadera de parche perforada anfotericina-B en células DSM humanas. (A) Un diagrama del protocolo de paso de tensión ilustra un potencial de retención de -74 mV y pasos de tensión de 400 ms de duración de -94 a +96 mV realizados en incrementos de 10 mV y luego devueltos a -74 mV. (B, C) Rastros de corriente representativos junto con gráficas de densidad-voltaje de corriente de dos células DSM humanas diferentes, cada una de un espécimen de vejiga urinaria diferente / donante de pacientes obtenido con el protocolo de paso de voltaje descrito en (A). (D) Un ejemplo de un seguimiento de corriente obtenido con un protocolo de rampa (representado gráficamente en el recuadro superior como cambio de voltaje de -94 a +116 mV durante una duración de 1 s a 0,21 mV/ms, el potencial de retención era de -94 mV). A la derecha en los paneles (B-D), los gráficos muestran la relación densidad-voltaje actual para cada celda DSM registrada. Haga clic aquí para ver una versión más grande de esta figura.
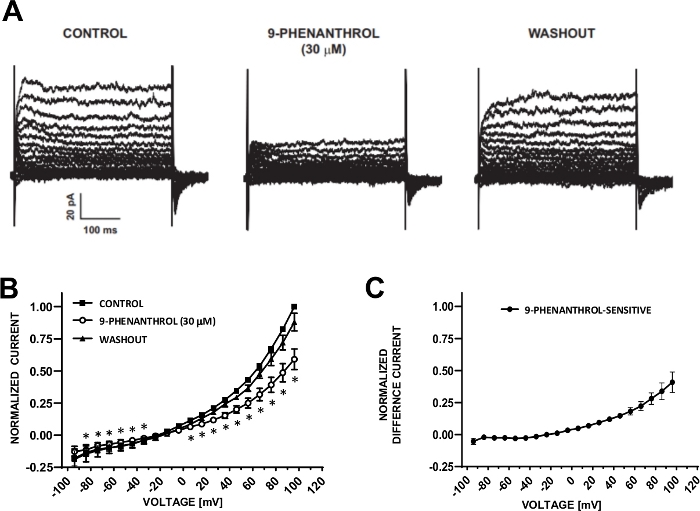
Figura 6: TRPM4 bloqueador de canales 9-fenodrol-mediada inhibición de las corrientes catiónicas inducidas por paso de voltaje en células DSM humanas. (A) Se muestran las corrientes representativas medidas con el protocolo de paso de tensión descrito en la Fig. 5A para el control, 9-fenanthrol y lavado. (B) Resumen de las respuestas normalizadas frente a la tensión de control, 9-fenanthrol y lavado en siete células DSM (de siete diferentes pacientes-donantes). (C) Corriente de diferencia para el componente sensible al 9-fenanthrol obtenido restando los valores en presencia de 9-fenantrol (30 m) de los del control que se muestra en (B). Los datos en (B) y (C) se muestran como medios con barras de error para SEM, * representa la importancia (p<0.05, prueba de estudiante emparejada) para la comparación de control vs 9-fenanfetamina en cada voltaje. Los paneles (A) y (B) se han reproducido de Hristov et al. (2016)22 y se han utilizado con permiso. Haga clic aquí para ver una versión más grande de esta figura.
| Especies | Detalles del procedimiento | Referencias | |
| Conejillo | Piezas DSM enjuagadas con Medio libre de Ca2+(en mM: 100 NaCl, 10 KCl, 1.2 KH2PO4, 5 MgCl2, 20 glucosa, 50 taurina, pCa 6 medido (o 1 mM) y luego cortadas en trozos y tratadas típicamente 90-120 min (4 períodos de 30 min) con enzima media (en mM: 130 KOH 20 taurina, 5 piruvato, 5 creatina, 10 mM HEPES, ajustado con ácido metanosulfónico a pH 7,4, 1 mg/ml de colagenasa, 0,2 mg/ml de pronasa E, 1 mg/ml de albúmina libre de ácido graso, pCa-4,2 (63 mM) o 3,7 (200 mM). Las células de DSM individuales se almacenaron en Kraft-Bruhe (KB)-medio (en mM: 85 KCl, 30 K2PO4, 5 MgSO4, 5 Na2ATP, 5 K-pyruvate, 5 creatina, 20 taurina, 5 beta-OH-butirate, 1 mg/ml de albúmina libre de ácidogra, ajustada con KOH a pH 7.2). Método alternativo: Piezas DSM enjuagadas durante 10 min en un medio libre de Ca2+(en mM): 140 NaCl, 5 KCl, 1,2 MgCl2,10 glucosa, 20 taurinas, 5 HEPES, ajustado con NaOH a pH 7.4). A continuación, piezas de DSM, incubadas en el mismo medio libre de Ca2+complementado con 5 mg% de colagenasa, 2 mg% de pronasa y 100 m de CaCl2 para 2x20 min agitación. | (1985)13,34 Klockner & Isenberg (1986)35 Schneider et al. (1991)10 Bonev & Isenberg (1992)9 Weidelt & Isenberg (2000)36 Moore et al. (2004)14 | |
| Cerdo de Guinea, cerdo Landrace y | Piezas DSM preincubadas durante 5 min en Solución Krebs Ca2+-libre, cortadas en trozos y enzimáticamente digeridas en Solución Krebs libre de Ca2+que contiene 0,5-2 mg/ml de colagenasa tipo I y pronasa de 0,1-0,5 mg/ml a 36oC para 20-30 minutos constantemente agitados. En algunos casos, las piezas digeridas se agitaban aún más con una pipeta con punta contundente o girando hasta que las células que producían. Las células aisladas se almacenaron en la solución modificada de Krebs (descrita en Klockner & Isenberg13) y se utilizaban normalmente dentro de 3 h. La composición de la solución Krebs fue (mM): 140 Na+, 6 K+, 2 Ca2+, 1.2 Mg2+, 152.4 Cl-, 10 glucosa, 10 HEPES, pH 7.35-7.4 con Tris. Para la solución ca2+-free, Ca2+ y Mg2+ se omitieron de la solución Krebs. | Inoue & Brading (1990)37 Inoue & Brading (1991)38 Nakayama & Brading (1995)39,40 | |
| Humano | Piezas DSM colocadas en la solución de HEPES Tyrode libre de Ca2+(en mM: 105.4 NaCl, 20,0 o 22,3 NaHCO3, 3,6 KCl, 0,9 MgCl2, 0,4 NaH2PO4, 19,5 o 4,9 HEPES, 5,4 o 5,5 glucosa, 4,5 o 5,5 Na-piruvato) y cortado en trozos de DSM. Piezas DE DSM empapadas en una solución enzimática (Solución HEPES libre Ca2+ con 0,7 mg/ml de colagenasa tipo I, 0,7 mg/ml de papaína, 1 mg/ml de albúmina) durante la noche a 4oC. Las tiras se calentaron a 36,5oC durante 15 a 30 minutos, se lavaron y se trituraron suavemente en solución fresca. Células aisladas que se almacenaron en Ca2+ que contenían la solución de HEPES Tyrode o se utilizaron inmediatamente para experimentos. | (1992)24 Gallegos and Fry (1994)41 Fry et al. (1994)42 Sui et al. (2001)43 Wu et al. (2002)4402) 4402 | |
| Conejillo | DSM cortado en trozos en PSS (en mM: 137 NaCl, 5.4 KCl, 2 MgCl2, 2 CaCl2, 0.42 KH2P04, 4.17 NaHCO3, 10 glucosa, 10 HEPES, pH 7.4 con NaOH). Piezas DSM colocadas durante 10 minutos en la siguiente solución de digestión (en mM: 80 Na-glutamato, 55 NaCl, 6 KCl, 10 HEPES, 11 glucosa, 2 MgCl2y 0,2 CaCl2) y luego se transfieren a un vial que contiene la misma solución pero con 1 mg/ml de colagenasa 2, 1 mg/ml inhibidor de la tripsina (a veces omitido), 1 mg/ml de albúmina bovina sin grasa, por 70 min a 35oC o 60 min a 37oC. Las células de DSM individuales se obtuvieron por trituración a través de una pipeta Pasteur en la misma solución sin calcio ni enzimas. Después de la trituración, se añadió Ca2+ (1 mM) y las células se almacenaron a 4oC. Las células siempre se usaban el mismo día. | (1993)53,54 Heppner et al. (1997)26 Petkov et al. (2001)47 Shieh et al. (2001, 2007)48,49 | |
| Cerdo de Guinea, ratón, rata y humano | El protocolo utiliza un tratamiento de disociación enzimática de dos pasos después de una disección aguda en la solución de digestión libre de Ca2+(en mM: 80 Na-glutamato, 55 NaCl, 6 KCl, 10 HEPES, 11 glucosa y 2 MgCl2). En primer lugar, las piezas de DSM se trataron durante 25-45 min a 37oC con 1-2 mg/ml de papaína, 1 mg/ml de dithioerythreitol y 1 mg/ml de albúmina sérica bovina en solución de disociación (en mM: 80 glutamato monosódico, 55 NaCl, 6 KCl, 2 MgCl2, 10 HEPES y 10 glucosa, ajustados a pH 7.3 con NaOH) y luego piezas de DSM transferidas a solución de digestión que contienen 1-5 mg/ml de colágeno XI (Sigma) o colagenasa tipo 2, 1 mg/ml de albúmina sérica bovina, 0 o 1 mg/ml de inhibidor de trippsina y 100 m deca2+,para 6.30 min. Después de la incubación, el tejido digerido fue lavado varias veces en solución de digestión sin enzimas y Ca2+ y luego triturado suavemente para producir células musculares lisas únicas. | (2001)50 Thorneloe & Nelson (2003)51 Thorneloe & Nelson (2004)33 Petkov & Nelson (2005)27 Hristov et al. (2008)52 Layne et al. (2010)53 Hristov et al. (2011)15 Xin et al. (2012)54 Parajuli et al. (2012)25 Malysz et al. (2013)29 Parajuli et al. (2013)31 Lee et al. (2013)55 Malysz et al. (2014)23 Smith et al. (2013)19, (2016)22 Lee et al. (2017)56 Yarotskyy et al. (2018)57 | |
Tabla 1: Resumen de los enfoques enzimáticos utilizados para aislar células únicas de DSM de vejigas urinarias de varias especies.
| Tipo de solución | Composición (en mM) |
| DS (Solución de disección/digestión) | 80 Na-glutamato, 55 NaCl, 6 KCl, 10 HEPES, 2 MgCl2y 11 glucosa, pH ajustado a 7.4 (con 10 M NaOH) |
| DS-P (DS que contiene Papaína) | DS que contiene 1-2 mg/ml de papaína, 1 mg/ml de ditiothreitol y 1 mg/ml de albúmina sérica bovina |
| DS-C (DS que contiene la colagenasa) | Solución DS que contiene 1-2 mg/ml de colagenasa tipo II, 1 mg/ml de albúmina sérica bovina, 0 o 1 mg/ml de inhibidor de la trippsina y 100-200 m Ca2+ |
| P (Pipeta) | 110 CsOH, 110 ácido aspártico, 10 NaCl, 1 MgCl2, 10 HEPES, 0.05 EGTA, y 30 CsCl,pH ajustado a 7.2 con CsOH, y complementado con anfotericina-B (300-500 g/ml) |
| E (Extracelular) | 10 cloruro de teetilammonio (TEA), 6 CsCl, 124 NaCl, 1 MgCl2, 2 CaCl2, 10 HEPES, y 10 glucosa, pH ajustado a 7.3-7.4 con NaOH o CsOH, y 0.002-3 (2-3 mM) nifedipino |
Tabla 2: Composiciones de solución de disección/digestión (DS), y soluciones de pipeta y extracelulares utilizadas en experimentos perforados con abrazaderas de parches.
Discusión
Los procedimientos descritos aquí explican los pasos involucrados en la preparación de células DSM viables y recién aisladas a partir de muestras de vejiga urinaria humana de espesor entero utilizando digestión enzimática y en el registro de corrientes catiónicas de células enteras sensibles al inhibidor del canal TRPM4 9-fenanthrol empleando la abrazadera de aproximación perforada de anfotericina-B. El procedimiento enzimático se basa en una exposición secuencial de dos pasos conocida en el presente documento como el método secuencial de digestión papaína-colagenasa. Los tejidos DSM se tratan primero con papaína y ditiothreitol (un agente estabilizador de enzimas) bajo una condición nominal libre de Ca2+,seguido en el segundo paso por colagenasa tipo II en presencia de ca2+bajo. La razón para llevar a cabo la digestión de la papaína en condiciones bajas de Ca2+ en células musculares lisas se remonta a finales de la década de 1980. Las células musculares lisas de la arteria carótida recién aisladas preparadas con papaína mostraron una forma alargada, mostraron viabilidad (resistencia a la suama de Trypan Blue) y respondieron a estímulos contrácles (Ca2+ superior e histamina)65. Años más tarde, este método se aplicó en la preparación de células DSM (ver Tabla 1). La elección de la colagenasa tipo II en lugar de otros tipos se relaciona con su actividad proteolítica relativamente alta ideal para los tejidos musculares lisos incluyendo DSM. De hecho, el tratamiento con colagenasa por sí solo podría producir células de DSM únicas, aunque requieren una exposición extensiva en zimática (60 min)53,54. Dado que la actividad de la colagenasa depende de Ca2+ y la enzima está inactiva en las condiciones libres de Ca2+,la digestión enzimática óptima de las piezas DSM requiere la presencia de Ca2+ 66. En nuestro caso, DS-C contiene 100-200 m [Ca2+] (Tabla 2). Después del tratamiento enzimático, las piezas de DSM digeridas se lavan suavemente varias veces con DS frío sin enzimas o Ca2+ para eliminar cualquier enzima unida a los tejidos. El DS helado ayuda a preservar la integridad celular de DSM y a limitar la actividad enzimática de cualquier papaína o colagenasa restante. En el último paso, la trituración de piezas DSM tratadas con enzimas con una pipeta Pasteur pulida por fuego libera una sola célula DSM. Las células DSM se colocan inmediatamente en una cámara de registro para estudios de abrazaderas de parche u otros tipos de experimentación o se almacenan en hielo en DS para su uso más tarde en el mismo día (normalmente dentro de las 8 horas de preparación, pero las células siguen siendo viables hasta 24 horas).
Identificamos varias consideraciones importantes para obtener con éxito células DSM únicas. El primero se refiere a la calidad de la fuente de muestras de DSM humana. Para preservar de manera óptima la integridad del tejido, las muestras de DSM obtenidas de cirugías de vejiga abierta se colocan en DS helada tan pronto como sea posible y se mantienen en un ambiente frío. Específicamente, tras la extracción quirúrgica del paciente, la muestra de vejiga se coloca inmediatamente en una mesa auxiliar totalmente preparada en el quirófano. Examen bruto de toda la muestra (generalmente obtenido durante la cistectomía radical o simple) y su apertura siguen. Después de la inspección visual, una pieza de la escalera urinaria de espesor entero se retira de un área remota de la muestra gravemente no involucrada con eltumor y se coloca inmediatamente en una taza (ya sea 50 o 100 ml) que contiene solución de disección (DS) fría (4 oC) y luego se cierra firmemente con una tapa. Debido a la naturaleza planificada de la cosecha del tejido, el personal del quirófano y el personal auxiliar que realiza la cosecha son alertados al inicio de la caja quirúrgica con el fin de tener los materiales disponibles en el quirófano en el momento de la extracción del tejido. Estas precauciones junto con la rutina, la naturaleza repetitiva de los pasos de procesamiento mantienen el tiempo de isquemia caliente para el tejido - desde la extracción hasta la colocación en el recipiente refrigerado con solución DS - a menos de 5 min. El recipiente se coloca en un refrigerador o en hielo en un refrigerador para mantener el ambiente frío y se transporta (hielo frío) al laboratorio. Una vez que el espécimen llega al laboratorio, comienzan los pasos de disección y disociación enzimática. Es muy difícil predecir si un espécimen DSM dado producirá células DSM de alta calidad después de la disociación enzimática, por lo que procedemos con los pasos de disociación enzimática. En muchos casos, en paralelo con experimentos electrofisiológicos, nuestro grupo lleva a cabo grabaciones de tensión isométrica en tiras DSM preparadas a partir de las mismas muestras de DSM. Hemos encontrado que generalmente podemos obtener células DSM de alta calidad a partir de preparaciones que también proporcionan con éxito tiras viables para estudios de contracción isométrica (nuestra observación inédita).
El segundo factor se relaciona con diferentes variabilidades de lote enzimático. Observamos que tanto para la papaína como para la colagenasa tipo II, cada vez que una nueva cantidad de enzimas llega de un proveedor, la actividad enzimática en DS para la digestión de los tejidos puede variar. Por lo tanto, optimizamos rutinariamente la concentración enzimática y los intervalos de incubación para cada lote nuevo. Para minimizar la contribución a la variabilidad del lote, ordemos cantidades mayores del mismo lote y realizamos un gran lote de soluciones de stock en alícuotas de 2 ml de enzimas y las almacenamos a 20 oC hasta su uso. Con el tiempo, sin embargo, las existencias congeladas (almacenadas hasta 2 semanas) pueden perder su actividad enzimática. La tercera variable se relaciona con la temperatura de los tratamientos de digestión enzimática. Las actividades enzimáticas tanto de la papaína como de la colagenasa muestran la dependencia de la temperatura. La papaína y la colagenasa tipo II exhiben actividad en los rangos de temperatura que abarcan la fisiología corporal normal67,68. Por lo tanto, nuestro objetivo es mantener los tratamientos enzimáticos estables a 37 oC evitando temperaturas más altas para preservar la integridad celular de DSM. La cuarta consideración se refiere a la variabilidad de la calidad de las células DSM presentes dentro de cada preparación que van desde altamente viable (exhibiendo excelentes características clásicas de músculo liso) a células no saludables, sobre-digeridas. Un intervalo prolongado de incubación enzimática es una de las principales razones para obtener un alto número de células dañadas. Los tratamientos enzimáticos excesivos también afectan las estructuras proteicas de los canales iónicos, receptores y transportadores, afectando negativamente su funcionalidad. La interpretación de los resultados obtenidos a partir de células recién aisladas obtenidas enzimáticamente debe tener en cuenta esta consideración. La optimización de las condiciones de digestión enzimática tiene como objetivo aumentar el porcentaje de células altamente viables. Los enfoques experimentales basados en un mayor número de células viables, como los análisis de microarrays, requieren optimizaciones más sólidas que las realizadas con éxito en menos células, como la electrofisiología de abrazadera de parche de una sola célula o la creación de imágenes Ca2+. La consideración de los factores antes mencionados ha guiado nuestros esfuerzos de investigación durante la última década en la obtención de células de DSM únicas de alta calidad.
La técnica perforada de abrazadera de parche ha sido un enfoque electrofisiológico de pilar durante más de un cuarto de siglo. Varias publicaciones proporcionan detalles de las consideraciones técnicas69,70,71,72,73. La perforación celular se puede obtener con anfotericina B, nistatina, gramicidina o escina (ver32para una visión general de cada uno). La principal ventaja de las grabaciones perforadas de abrazaderas de parche sobre otros enfoques electrofisiológicos es que el entorno intracelular nativo - incluyendo Ca intracelular2+y se conservan las moléculas de señalización (por ejemplo, campo, PKA, fosfatos y fosfodiesterasas). Esta técnica es, por lo tanto, ideal para investigar corrientes de canales ióniónicos de células enteras y sus mecanismos reguladores en condiciones casi fisiológicas. Una advertencia clave es que la composición celular intracelular no se puede controlar con precisión a diferencia de otros métodos electrofisiológicos, como las grabaciones convencionales de células enteras y de un solo canal extirpados (dentro y fuera). En nuestra experiencia, tres factores contribuyen rutinariamente a resultados experimentales exitosos de experimentos de abrazaderas de parches perforados con anfotericina-B. La primera es la calidad de la célula DSM elegida para intentar una grabación. Cuando las células DSM son altamente viables mostrando un aspecto semi-contráctico (similar a la serpentina), de alto contraste con un halo bien definido alrededor de la superficie celular y se adhieren firmemente a la parte inferior de vidrio de la cámara de grabación, entonces la formación de giga-sello y la perforación celular se producen relativamente fácil. El segundo y tercer factores para el éxito, respectivamente, se relacionan con la calidad de la fuente y la solubilización de la anfotericina B (en el dimetil sulfóxido/DMSO y la solución de pipeta intracelular). Observamos discrepancias entre diferentes proveedores en términos de variabilidades de fuentes y lotes. Cada día preparamos una solución fresca de solución de anfotericina-B a partir de polvo seguida de su dilución en solución de pipeta intracelular. Estos pasos requieren una sonicación extensa y vórtice. Con solución de pipeta que contiene anfotericina-B recién hecha, perforación celular exitosa (<50 MΩ) following giga-seal formation can be usually obtained within 30 min. The concentration of amphotericin-B in the pipette solution also requires optimization dependent on the amphotericin-B lot and source. Under our experimental conditions, the final amphotericin-B concentrations in the pipette range from 200 to 500 µg/mL. Since amphotericin-B exhibits light sensitivity, its solutions need to be kept in the dark. Using the amphotericin-B perforated patch-clamp technique, our group recorded voltage-step induced K mω)="" following="" giga-seal="" formation="" can="" be="" usually="" obtained="" within="" 30="" min.="" the="" concentration="" of="" amphotericin-b="" in="" the="" pipette="" solution="" also="" requires="" optimization="" dependent="" on="" the="" amphotericin-b="" lot="" and="" source.="" under="" our="" experimental="" conditions,="" the="" final="" amphotericin-b="" concentrations="" in="" the="" pipette="" range="" from="" 200="" to="" 500="" µg/ml.="" since="" amphotericin-b="" exhibits="" light="" sensitivity,="" its="" solutions="" need="" to="" be="" kept="" in="" the="" dark.="" using="" the="" amphotericin-b="" perforated="" patch-clamp="" technique,="" our="" group="" recorded="" voltage-step="" induced="">+Ca2+, y corrientes catiónicas no selectivas de células humanas, de conejillo de indias, ratón y/o células DSM de rata17,21,22,23,29,30,31,35,60. Aquí, describimos las condiciones para registrar corrientes catiónicas no selectivas en células DSM humanas. 9-Phenanthrol, un bloqueador de canales TRPM4, corrientes inducidas por paso de tensión atenuada que soportan el papel de estos canales en el control de la excitabilidad DSM. Como nota, por lo general requiere al menos 45 minutos después de obtener un sello giga y el inicio de la perforación para registrar corrientes catiónicas no selectivas inducidas por el paso de voltaje estable óptimo. Las rampas de tensión también se pueden utilizar como alternativa a los protocolos de paso de voltaje30,64. Aquí, se prefirió un protocolo de paso de voltaje de un potencial de membrana de retención hiperpolarizado en lugar de un protocolo de rampa, ya que el enfoque anterior minimiza el efecto de la inactivación dependiente del voltaje y permite promediar la corriente evocada durante una duración de un paso de tensión en el que la rampa proporciona un único punto de datos por voltaje. Este último punto se aplica especialmente a las células DSM humanas, ya que las corrientes muestran actividad variable durante los pasos de tensión (Figura 5YFigura 6). La técnica de abrazadera de parche perforada anfotericina-B ha sido esencial para identificar las propiedades de las células DSM y otros tipos de células y continuará sirviendo para proporcionar nuevos descubrimientos en el futuro. Además, las células DSM únicas recién aisladas se pueden utilizar con éxito para medir K de células enteras+Cl-, y Ca2+corrientes con el modo convencional de la técnica de abrazadera de parche, grabación potencial de membrana con la abrazadera actual, y grabaciones de un solo canal como se ejemplifica en nuestros informes anteriores23,29,35,64.
Además de los métodos de abrazadera de parche de una sola célula, las células DSM recién aisladas se pueden estudiar con otros enfoques técnicos, como la toma de imágenes Ca2+, RT-PCR/q-RT-PCR, inmunocitoquímica, ensayo de ligadura de proximidad in situ y enfoques genómicos (por ejemplo, microarray, RNA-seq, CHIP-seq)15,18,30,33,34. A medida que los métodos de determinación de transcriptomas de una sola célula continúan evolucionando y se vuelven altamente sensibles, imaginamos en una futura capacidad para vincular de forma rutinaria y específica las propiedades eléctricas o farmacológicas de las células DSM individuales con sus perfiles de transcriptoma/proteome. Esto se logrará registrando primero desde una célula DSM y luego extrayendo ARNm o proteína seguida de análisis transcriptómicos/proteómicos. Aunque estos métodos ya han sido probados en células que no son de DSM, en la actualidad son técnicamente desafiantes, carecen de sensibilidad para ser considerados rutinarios y se limitan a la detección exitosa de algunos productos genéticos seleccionados74. La expresión del perfil molecular de la función vincula los estudios cuando se realizan en células DSM obtenidas de vejigas urinarias derivadas de los donantes de pacientes enfermos y de control proporcionarán información sobre los procesos fisiológicos esenciales para impulsar las funciones normales de DSM, la patogénesis y para identificar enfoques terapéuticos novedosos eficaces.
Divulgaciones
Ninguno.
Agradecimientos
Este trabajo fue apoyado por las subvenciones NIH-R01DK106964 y P20DK123971 a Georgi V. Petkov. Los autores agradecen al Dr. Viktor Yarotskyy y a la Sra. Sarah Maxwell por la evaluación crítica del manuscrito. También estamos agradecidos a los cirujanos del personal de urología en MUSC y UTHSC: Drs. Thomas Keane, Harry Clarke, Stephen Savage, Ross Rames, Sandip Prasad, Jonathan Picard, Christopher Ledbetter, y Anthony Patterson, así como los residentes de MUSC y UTHSC Urology: Drs. Taylor Vaughan, Samuel Walker Nickles, Matthew Young, Erin Burns, Justin Ellett, Ryan Levey, Austin Younger, Mark Currin, Nima Baradaran, Olugbemisola McCoy, Tracy Tipton, Bryce Wyatt, Alyssa Greiman, Sarah Starosta, Aaron Bloch, Christine Callaway, Lucille Cox, Christian Dewan, Erin Heitman, Bradley Houston, Stephen Legg, Robert S. Libby, Cole Locklear, Kristen Marley, Monica O'Hanlon, Patrick Probst, Cynthia Sharadin, Elizabeth Tourville, Daniel Zapata por su ayuda con la colección de tejido humano.
Materiales
| Name | Company | Catalog Number | Comments |
| 5 ml polystyrene round-bottom tube | Falcon | 352054 | Tubes for DS containing enzymes used in digestion steps |
| 9-Phenanthrol | Sigma-Aldrich | 211281 | TRPM4 channel inhibitor |
| Amphotericin-B | Fisher | BP928-250 | Used for patch/cell perforation |
| Amphotericin-B | European Pharmacopoeia Reference Standards | 5 | Used for patch/cell perforation |
| Amphotericin-B | Sigma-Aldrich | A9528-100MG | Used for patch/cell perforation |
| Analog vortex mixer | VWR | 58816-121 | |
| Aspartic acid | Sigma-Aldrich | A9006 | Intracellular pipette solution |
| Bovine serum albumin | Sigma-Aldrich | A7906 | DS |
| CaCl2 | Sigma-Aldrich | C1016 | Extracellular solution and DS |
| Capillary Glass | Sutter | BF150-110-7.5 | Capillary for preparation of pulled patch electrodes |
| Cesium hydroxide hydrate | Sigma-Aldrich | C8518 | Intracellular pipette solution |
| Clampex ver. 10 software includes data acqusition (Clampex) and analysis (Clampfit) programs | Axon Instruments/ Molecular Devices | pCLAMP-10 | Commerical software and part of patch-clamp rig setup |
| Collagenase type 2 | Worthington Biochemical Corporation | LS004177 | DS-C |
| CsCl | Sigma-Aldrich | 203025 | Extracellular and intracellular solutions |
| Dental wax | Miltex Dental Wax Technologies, Inc. | 18058351 | |
| Digital Thermometer with Probe | Fisher Scientific | 15-077-32 | Placed in tissue bath to monitor temperature |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2650 | Solvent |
| DL-Dithiothreitol (DDT) | Sigma-Aldrich | D9779 | Reducing agents used together with Papain |
| EGTA | Sigma-Aldrich | E3889 | Ca2+ chelator, used in intracellular pipette solution |
| Flaming/Brown micropipette puller | Sutter | P-97 | Required to pull electrodes with very fine tips |
| Floating foam tube rack/holder | VWR Scientific | 82017-634 | Used for holding tubes with enzymes for temperature control |
| Glucose | Sigma | G8270 | |
| Glutamic acid (Na salt) | Sigma-Aldrich | G1626 | DS |
| HEPES | Sigma-Aldrich | H3375 | pH Buffer |
| KCl | Fisher Scientific | BP366-1 | Extracellular solution |
| Low Noise Data Acquisition System | Axon Instruments/ Molecular Devices | Digidata 1440A | Part of patch-clamp rig setup |
| Magnetic stirrer | VWR | 01-442-684 | |
| MgCl2 (hexahydrate) | Sigma-Aldrich | M2670 | Extracellular and intracellular solutions |
| MicroForge | Narishige | MF-830 | Used for fire-polishing electrodes |
| NaCl | Sigma-Aldrich | S7653 | Extracellular and intracellular solutions |
| NaOH | Sigma-Aldrich | S8045 | |
| Nifedipine | Sigma-Aldrich | N7634 | L-type voltage-gated Ca2+ channel blocker |
| Nikon inverted microscope, TS100 with T1-SM stage with 5x, 10x, 20x, and 40x objectives | Nikon | Discontinued | Part of Patch-clamp rig setup |
| Non-metalic syringe needle, MicroFil | WPI | MF-34G-5 | Filling of intracellular pipette solution |
| Papain | Worthington Biochemical Corporation | LS003126 | DS-P |
| Pasteur pipette | FisherBrand | 13-678-20A | Tips are broken off and fire-polished and used for titration of enzymatically treated tissues to release single DSM cells from pieces |
| Patch-clamp amplifier | Axon Instruments/ Molecular Devices | Axon Axopatch 200B | Part of patch-clamp rig setup |
| PC computer | DELL | Custom configuration | Part of patch-clamp rig setup |
| pH Meter | Aspera Instruments | PH700 | |
| Polyethylene tubing | Intramedic | 427-436 | Tubing for superfusion of extracellular bath connected to glass-bottom recording chamber |
| Tetraethylammonium chloride | Sigma-Aldrich | T2265 | Ion channel blocker of Kv and BK channels added to the extracellular bath solution |
| Thermo Scientific Precision shaking water bath (model 2870) | Thermo Scientific | Discontinued | Water bath for temperature control of enzymatic digestion employed as an alternative to tissue chamber-circulating bath setup |
| Tissue bath, 100 mL | Radnoti | 1583-101 | Connected to a circulating bath and filled with water, tubes with DS and DSM pieces are placed in the setup to control the temperature of digestion steps |
| Vinyl tubing | ColePalmer | 06405-3 | Multiple uses including for connecting tissue bath to circulating water bath |
| Water circulator bath, Haake D1 L | Haake | Discontinued | Connected to tissue bath |
| Weighting scale | Mettler Toledo | XS64 | |
| ZeissAxiovert 40C inverted microscope with 10x and 40x objectives | Carl-Zeiss | Discontinued | Part of patch-clamp rig setup |
Referencias
- Andersson, K. E., Arner, A. Urinary bladder contraction and relaxation: physiology and pathophysiology. Physiological Reviews. 84 (3), 935-986 (2004).
- Brading, A. F., Brain, K. L., Andersson, K. E., Michel, M. C. Ion channel modulators and urinary tract function. Urinary Tract. 202, 375-393 (2011).
- Brading, A. F. Spontaneous activity of lower urinary tract smooth muscles: correlation between ion channels and tissue function. Journal of Physiology. 570, 13-22 (2006).
- Brading, A. F., Heaton, J. P., Hashitani, H. A survey of commonalities relevant to function and dysfunction in pelvic and sexual organs. International Journal of Impotence Research. 20 (1), 1-16 (2008).
- Petkov, G. V. Role of potassium ion channels in detrusor smooth muscle function and dysfunction. Nature Reviews Urology. 9 (1), 30-40 (2012).
- Andersson, K. E. Treatment-resistant detrusor overactivity--underlying pharmacology and potential mechanisms. International Journal of Clinical Practice Supplement. 151, 8-16 (2006).
- Sui, G. P., Wu, C., Fry, C. H. The electrophysiological properties of cultured and freshly isolated detrusor smooth muscle cells. Journal of Urology. 165 (2), 627-632 (2001).
- Kropp, B. P., et al. Characterization of cultured bladder smooth muscle cells: assessment of in vitro contractility. Journal of Urology. 162 (5), 1779-1784 (1999).
- Bonev, A., Isenberg, G. Arginine-vasopressin induces mode-2 gating in L-type Ca2+ channels (smooth muscle cells of the urinary bladder of the guinea-pig). Pflügers Archive - European Journal of Physiology. 420 (2), 219-222 (1992).
- Schneider, P., Hopp, H. H., Isenberg, G. Ca2+ influx through ATP-gated channels increments [Ca2+]i and inactivates ICa in myocytes from guinea-pig urinary bladder. Journal of Physiology. 440, 479-496 (1991).
- Wellner, M. C., Isenberg, G. Properties of stretch-activated channels in myocytes from the guinea-pig urinary bladder. Journal of Physiology. 466, 213-227 (1993).
- Wellner, M. C., Isenberg, G. Stretch-activated nonselective cation channels in urinary bladder myocytes: importance for pacemaker potentials and myogenic response. Experientia Supplementum. 66, 93-99 (1993).
- Klockner, U., Isenberg, G. Action potentials and net membrane currents of isolated smooth muscle cells (urinary bladder of the guinea-pig). Pflügers Archive - European Journal of Physiology. 405 (4), 329-339 (1985).
- Moore, E. D., et al. Organization of Ca2+ release units in excitable smooth muscle of the guinea-pig urinary bladder. Biophysical Journal. 87 (3), 1836-1847 (2004).
- Hristov, K. L., Chen, M., Kellett, W. F., Rovner, E. S., Petkov, G. V. Large conductance voltage- and Ca2+-activated K+ channels regulate human detrusor smooth muscle function. American Journal of Physiology - Cell Physiology. 301 (4), 903-912 (2011).
- Afeli, S. A., Rovner, E. S., Petkov, G. V. SK but not IK channels regulate human detrusor smooth muscle spontaneous and nerve-evoked contractions. American Journal of Physiology - Renal Physiology. 303 (4), 559-568 (2012).
- Hristov, K. L., et al. Kv2.1 and electrically silent Kv channel subunits control excitability and contractility of guinea pig detrusor smooth muscle. American Journal of Physiology - Cell Physiology. 302 (2), 360 (2012).
- Afeli, S. A., Malysz, J., Petkov, G. V. Molecular expression and pharmacological evidence for a functional role of Kv7 channel subtypes in Guinea pig urinary bladder smooth muscle. PLoS One. 8 (9), 75875 (2013).
- Smith, A. C., et al. TRPM4 channel: a new player in urinary bladder smooth muscle function in rats. American Journal of Physiology - Renal Physiology. 304 (7), 918-929 (2013).
- Smith, A. C., et al. Novel role for the transient potential receptor melastatin 4 channel in guinea pig detrusor smooth muscle physiology. American Journal of Physiology - Cell Physiology. 304 (5), 467 (2013).
- Hristov, K. L., Smith, A. C., Parajuli, S. P., Malysz, J., Petkov, G. V. Large-conductance voltage- and Ca2+-activated K+ channel regulation by protein kinase C in guinea pig urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 306 (5), 460-470 (2014).
- Hristov, K. L., et al. Novel regulatory mechanism in human urinary bladder: central role of transient receptor potential melastatin 4 channels in detrusor smooth muscle function. American Journal of Physiology - Cell Physiology. 310 (7), 600-611 (2016).
- Malysz, J., Afeli, S. A., Provence, A., Petkov, G. V. Ethanol-mediated relaxation of guinea pig urinary bladder smooth muscle: involvement of BK and L-type Ca2+ channels. American Journal of Physiology - Cell Physiology. 306 (1), 45-58 (2014).
- Montgomery, B. S., Fry, C. H. The action potential and net membrane currents in isolated human detrusor smooth muscle cells. Journal of Urology. 147 (1), 176-184 (1992).
- Parajuli, S. P., Soder, R. P., Hristov, K. L., Petkov, G. V. Pharmacological activation of small conductance calcium-activated potassium channels with naphtho[1,2-d]thiazol-2-ylamine decreases guinea pig detrusor smooth muscle excitability and contractility. Journal of Pharmacology and Experimental Therapeutics. 340 (1), 114-123 (2012).
- Heppner, T. J., Bonev, A. D., Nelson, M. T. Ca2+-activated K+ channels regulate action potential repolarization in urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 273 (1), 110-117 (1997).
- Petkov, G. V., Nelson, M. T. Differential regulation of Ca2+-activated K+ channels by beta-adrenoceptors in guinea pig urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 288 (6), 1255-1263 (2005).
- Herrera, G. M., Etherton, B., Nausch, B., Nelson, M. T. Negative feedback regulation of nerve-mediated contractions by KCa channels in mouse urinary bladder smooth muscle. American Journal of Physiology - Regulatory Integrative Comparative Physiology. 289 (2), 402-409 (2005).
- Malysz, J., Rovner, E. S., Petkov, G. V. Single-channel biophysical and pharmacological characterizations of native human large-conductance calcium-activated potassium channels in freshly isolated detrusor smooth muscle cells. Pflügers Archive - European Journal of Physiology. 465 (7), 965-975 (2013).
- Provence, A., Angoli, D., Petkov, G. V. Kv7 channel pharmacological activation by the novel activator ML213: role for heteromeric Kv7.4/Kv7.5 channels in guinea pig detrusor smooth muscle function. Journal of Pharmacology and Experimental Therapeutics. 364 (1), 131-144 (2018).
- Parajuli, S. P., et al. Control of urinary bladder smooth muscle excitability by the TRPM4 channel modulator 9-phenanthrol. Channels (Austin). 7 (6), 537-540 (2013).
- Ishibashi, H., Moorhouse, A. J., Nabekura, J., Okada, Y. Perforated whole-cell patch-clamp technique: a user's guide. Patch Clamp Techniques: From Beginning to Advanced Protocols. 4, 71-83 (2012).
- Provence, A., Rovner, E. S., Petkov, G. V. Regulation of transient receptor potential melastatin 4 channel by sarcoplasmic reticulum inositol trisphosphate receptors: Role in human detrusor smooth muscle function. Channels (Austin). 11 (5), 459-466 (2017).
- Hristov, K. L., et al. Suppression of human detrusor smooth muscle excitability and contractility via pharmacological activation of large conductance Ca2+-activated K+ channels. American Journal of Physiology - Cell Physiology. 302 (11), 1632-1641 (2012).
- Xin, W., Soder, R. P., Cheng, Q., Petkov, G. V. Inhibition of phosphodiesterases relaxes detrusor smooth muscle via activation of the large conductance voltage- and Ca2+-activated K+ channel. American Journal of Physiology - Cell Physiology. 302 (9), 1361-1370 (2012).
- Hristov, K. L., et al. Neurogenic detrusor overactivity is associated with decreased expression and function of the large conductance voltage- and Ca2+-activated K+ channels. PLoS One. 8 (7), 68052 (2013).
- Hristov, K. L., Parajuli, S. P., Provence, A., Rovner, E. S., Petkov, G. V. Nongenomic modulation of the large conductance voltage- and Ca2+-activated K+ channels by estrogen: A novel regulatory mechanism in human detrusor smooth muscle. Physiological Reports. 5 (14), (2017).
- Parajuli, S. P., et al. Functional link between muscarinic receptors and large-conductance Ca2+ -activated K+ channels in freshly isolated human detrusor smooth muscle cells. Pflügers Archiv - European Journal of Physiology. 467 (4), 665-675 (2015).
- Malysz, J., Rovner, E. S., Petkov, G. V. Single-channel biophysical and pharmacological characterizations of native human large-conductance calcium-activated potassium channels in freshly isolated detrusor smooth muscle cells. Pflügers Archiv - European Journal of Physiology. 465 (7), 965-975 (2013).
- Thorneloe, K. S., Nelson, M. T. Properties of a tonically active, sodium-permeable current in mouse urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 286 (6), 1246-1257 (2004).
- Barry, M. J., et al. The American Urological Association symptom index for benign prostatic hyperplasia. The Measurement Committee of the American Urological Association. Journal of Urology. 148 (5), 1549-1557 (1992).
- Klockner, U., Isenberg, G. Calcium currents of cesium loaded isolated smooth muscle cells (urinary bladder of the guinea pig). Pflügers Archiv - European Journal of Physiology. 405 (4), 340-348 (1985).
- Klockner, U., Isenberg, G. Tiapamil reduces the calcium inward current of isolated smooth muscle cells. Dependence on holding potential and pulse frequency. European Journal of Pharmacology. 127 (3), 165-171 (1986).
- Weidelt, T., Isenberg, G. Augmentation of SR Ca2+ release by rapamycin and FK506 causes K+-channel activation and membrane hyperpolarization in bladder smooth muscle. British Journal of Pharmacology. 129 (7), 1293-1300 (2000).
- Inoue, R., Brading, A. F. The properties of the ATP-induced depolarization and current in single cells isolated from the guinea-pig urinary bladder. British Journal of Pharmacology. 100 (3), 619-625 (1990).
- Inoue, R., Brading, A. F. Human, pig and guinea-pig bladder smooth muscle cells generate similar inward currents in response to purinoceptor activation. British Journal of Pharmacology. 103 (4), 1840-1841 (1991).
- Nakayama, S., Brading, A. F. Possible contribution of long open state to noninactivating Ca2+ current in detrusor cells. American Journal of Physiology - Cell Physiology. 269 (1), 48-54 (1995).
- Nakayama, S., Brading, A. F. Interaction of Ca2+ agonist and depolarization on Ca2+ channel current in guinea pig detrusor cells. Journal of General Physiology. 106 (6), 1211-1224 (1995).
- Gallegos, C. R., Fry, C. H. Alterations to the electrophysiology of isolated human detrusor smooth muscle cells in bladder disease. Journal of Urology. 151 (3), 754-758 (1994).
- JournalFry, C. H., Gallegos, C. R., Montgomery, B. S. The actions of extracellular H+ on the electrophysiological properties of isolated human detrusor smooth muscle cells. Journal of Physiology. 480, 71-80 (1994).
- Sui, G. P., Wu, C., Fry, C. H. A description of Ca2+ channels in human detrusor smooth muscle. BJU International Journal. 92 (4), 476 (2003).
- Wu, C., Sui, G., Fry, C. H. The role of the L-type Ca2+ channel in refilling functional intracellular Ca2+ stores in guinea-pig detrusor smooth muscle. Journal of Physiology. 538, 357-369 (2002).
- Bonev, A. D., Nelson, M. T. Muscarinic inhibition of ATP-sensitive K+ channels by protein kinase C in urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 265 (6), 1723-1728 (1993).
- Bonev, A. D., Nelson, M. T. ATP-sensitive potassium channels in smooth muscle cells from guinea pig urinary bladder. American Journal of Physiology - Cell Physiology. 264 (5), 1190-1200 (1993).
- Petkov, G. V., Heppner, T. J., Bonev, A. D., Herrera, G. M., Nelson, M. T. Low levels of KATP channel activation decrease excitability and contractility of urinary bladder. American Journal of Physiology - Regulatory Integrative Comparative Physiology. 280 (5), 1427-1433 (2001).
- Shieh, C. C., et al. Functional implication of spare ATP-sensitive K+ channels in bladder smooth muscle cells. Journal of Pharmacology and Experimental Therapeutics. 296 (3), 669-675 (2001).
- Shieh, C. C., et al. Characterization of a novel ATP-sensitive K+ channel opener, A-251179, on urinary bladder relaxation and cystometric parameters. British Journal of Pharmacology. 151 (4), 467-475 (2007).
- Petkov, G. V., et al. Beta1-subunit of the Ca2+-activated K+ channel regulates contractile activity of mouse urinary bladder smooth muscle. Journal of Physiology. 537, 443-452 (2001).
- Thorneloe, K. S., Nelson, M. T. Properties and molecular basis of the mouse urinary bladder voltage-gated K+ current. Journal of Physiology. 549, 65-74 (2003).
- Hristov, K. L., et al. Stimulation of beta3-adrenoceptors relaxes rat urinary bladder smooth muscle via activation of the large-conductance Ca2+-activated K+ channels. American Journal of Physiology - Cell Physiology. 295 (5), 1344-1353 (2008).
- Layne, J. J., Nausch, B., Olesen, S. P., Nelson, M. T. BK channel activation by NS11021 decreases excitability and contractility of urinary bladder smooth muscle. American Journal of Physiology - Regulatory Integrative Comparative Physiology. 298 (2), 378-384 (2010).
- Lee, H., Koh, B. H., Peri, L. E., Sanders, K. M., Koh, S. D. Functional expression of SK channels in murine detrusor PDGFRalpha+ cells. Journal of Physiology. 591 (2), 503-513 (2013).
- Lee, H., et al. Premature contractions of the bladder are suppressed by interactions between TRPV4 and SK3 channels in murine detrusor PDGFRalpha+ cells. Scientific Reports. 7 (1), 12245 (2017).
- Yarotskyy, V., Malysz, J., Petkov, G. V. Properties of single channel and whole-cell Cl- currents in guinea pig detrusor smooth muscle cells. American Journal of Physiology - Cell Physiology. 316 (5), 698-710 (2019).
- Driska, S. P., Porter, R. Isolation of smooth muscle cells from swine carotid artery by digestion with papain. American Journal of Physiology - Cell Physiology. 251 (3), 474-481 (1986).
- Seltzer, J. L., Welgus, H. G., Jeffrey, J. J., Eisen, A. Z. The function of Ca2+ in the action of mammalian collagenases. Archives of Biochemistry and Biophysics. 173 (1), 355-361 (1976).
- Skelton, G. S. Papaya proteinases. I. Temperature-and pH-stability curves. Enzymologia. 35 (5), 270-274 (1968).
- Petrova, D., Derekova, A., Vlahov, S. Purification and properties of individual collagenases from Streptomyces sp. strain 3B. Folia Microbiologica (Praha). 51 (2), 93-98 (2006).
- Sharpe, E. J., St Clair, J. R., Proenza, C. Methods for the isolation, culture, and functional characterization of sinoatrial node myocytes from adult mice. Journal of Visualized Experiments. (116), (2016).
- Brueggemann, L. I., Mani, B. K., Haick, J., Byron, K. L. Exploring arterial smooth muscle Kv7 potassium channel function using patch clamp electrophysiology and pressure myography. Journal of Visualized Experiments. (67), e4263 (2012).
- Jarriault, D., Grosmaitre, X. Perforated patch-clamp recording of mouse olfactory sensory neurons in intact neuroepithelium: functional analysis of neurons expressing an identified odorant receptor. Journal of Visualized Experiments. (101), e52652 (2015).
- Rae, J., Cooper, K., Gates, P., Watsky, M. Low access resistance perforated patch recordings using amphotericin B. Journal of Neuroscience Methods. 37 (1), 15-26 (1991).
- Knutson, K., et al. Whole cell electrophysiology of primary cultured murine enterochromaffin cells. Journal of Visualized Experiments. (139), (2018).
- Devienne, G., Le Gac, B., Piquet, J., Cauli, B. Single cell multiplex reverse transcription polymerase chain reaction after patch-clamp. Journal of Visualized Experiments. (136), (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados