Method Article
Préparation et utilisation des cellules musculaires lisses de Détrusor humain fraîchement isolées pour la caractérisation des courants de cation 9-Phenanthrol-sensibles
Dans cet article
Résumé
Nous décrivons une méthode pour la préparation des cellules lisses lisses fraîchement isolées de détrusor de spécimens humains de réservoir urinaire employant une procédure enzymatique de deux étapes. Les cellules DSM viables obtenues peuvent être étudiées par diverses techniques de cellules uniques, y compris l'électrophysiologie de patch-clamp d'amphotericin-B décrite pour révéler des propriétés physiologiques et pharmacologiques.
Résumé
Les cellules lisses de muscle lisse de Detrusor (DSM) présentes dans la paroi urinaire de réservoir souple facilitent finalement le stockage et l'annulation d'urine. La préparation des cellules DSM viables, fraîches et isolées présente un défi technique important dont la réalisation fournit des cellules optimales pour les études fonctionnelles et moléculaires ultérieures. La méthode développée et élaborée ci-dessus, utilisée avec succès par notre groupe depuis plus d'une décennie, décrit la dissection des spécimens de vessie urinaire humaine obtenus à partir de chirurgies ouvertes de la vessie suivies d'un traitement enzymatique en deux étapes des pièces DeSM et de la trituration mécanique pour obtenir des cellules DSM fraîchement isolées. L'étape initiale consiste à dissectionr pour séparer la couche DSM (également connue sous le nom de muscleis propria) de la muqueuse (urothélium, lamina propria et muqueuse musculaire) et des tissus conjonctifs, vasculaires et adipeux adjacents présents. Le DSM est ensuite coupé en morceaux (2-3 mm x 4-6 mm) en solution nominale Ca2MD-contenantla dissection/digestion (DS). Les pièces DSM sont ensuite transférées et traitées de façon séquentielle séparément avec dS contenant de la papaïne et du collagène à 37 oC pour 30-45 min par étape. Après les lavages avec DS contenant le sérum bovin sans enzyme et la trituration avec une pipette feu-polie, les morceaux libèrent les cellules simples de DSM. Les cellules DSM fraîchement isolées sont idéalement adaptées aux caractérisations électrophysiologiques et pharmacologiques des canaux ioniques. Plus précisément, nous montrons que le bloqueur de canal TRPM4 9-phenanthrol réduit les courants de cation évoqués par étape de tension enregistrés avec l'approche de patch-clamp perforée d'amphotericin-B. Les cellules DSM peuvent également être étudiées par d'autres techniques telles que la RT-PCR à cellule unique, l'analyse de microarray, l'immunocytochimie, l'analyse in situ de ligature de proximité, et l'imagerie De Ca2. Le principal avantage de l'utilisation de cellules DSM uniques est que les observations faites se rapportent directement aux caractéristiques des cellules individuelles révélées. Les études des cellules humaines fraîchement isolées de DSM ont fourni des perspicacités importantes caractérisant les propriétés de divers canaux d'ion comprenant cation-perméable dans la vessie urinaire et continueront comme étalon d'or en élucidant des propriétés cellulaires et des mécanismes régulateurs de DSM.
Introduction
Les cellules lisses de muscle de détruseur (DSM) constituent le type de cellules le plus abondant dans la vessie urinaire et contrôlent finalement le stockage d'urine et la vidange par la relaxation et la contraction, respectivement. Les cellules DSM forment des faisceaux musculaires lisses qui s'entrelacent avec le tissu conjonctif adjacent, les processus nerveux, les cellules interstitiels et d'autres types de cellules1. La compréhension actuelle du rôle des cellules DSM dans la fonction urinaire de réservoir souple a été réalisée par une approche intégrée à plusieurs niveaux. Chaque méthode expérimentale - qu'elle soit basée sur des cellules uniques isolées in vitro, des bandes de tissu contenant des faisceaux musculaires lisses in vitro/ex vivo, ou des déterminations in vivo (telles que la cytométrie et les évaluations de la fonction d'annulation) - fournit des informations importantes et spécifiques sur les propriétés physiologiques et pharmacologiques du DSM (s'il vous plaît voir les commentaires1,2,3,4,5,6 pour plus de détails). Cependant, l'interprétation des résultats obtenus à partir de cellules individuelles isolées permet d'attribuer spécifiquement les conclusions au type de cellule unique lui-même. Cette réalisation a été la force motrice pour établir une méthode fiable et reproductible pour obtenir des cellules DSM fraîchement isolées à partir de l'épaisseur entière des spécimens de vessie urinaire. Contrairement à de nombreux autres types de cellules, les cellules musculaires lisses ne peuvent pas être cultivées de façon fiable en raison de la perte de leur phénotype indigène, y compris des changements spécifiques dans leurs propriétés électrophysiologiques et contractiles7,8. Ce fait renforce encore l'importance des études menées sur des cellules DSM physiologiquement actives fraîchement isolées.
À la fin des années 1980 et au début des années 1990, le groupe d'Isenberg (Allemagne) a publié une série d'études électrophysiologiques sur des cellules DSM fraîchement isolées obtenues à partir de vessies urinaires de cobaye9,10,11,12,13 ( tableau1). La méthode a mis en évidence deux observations importantes qui ont aidé à obtenir des cellules vitales et ont servi de ligne directrice initiale pour d'autres à suivre. Ils étaient 1) pré-traiter les morceaux isolés de DSM avec Ca2 -solutionlibre/moyen avant le traitement enzymatique et 2) digestion de tissu avec une solution contenant la collagène. Ces deux étapes critiques ont été incorporées dans toutes les variantes ultérieures des procédures de dissociation cellulaire DSM (tableau 1). Actuellement, notre groupe emploie une approche séquentielle de dissociation de papain-collagenase en deux étapes. Les morceaux de DSM sont d'abord traités avec une solution enzymatique contenant de la papaïne, puis avec du collagène de type II solubilisé dans la même solution (DS, dissection/solution de digestion). Cette approche donne des cellules DSM uniques de diverses espèces, y compris le cobaye, porc, rat, souris, et surtout humain (tableau 1).
Les cellules DSM uniques fournissent une source pour la biologie moléculaire multiple et les expériences physiologiques. Jusqu'à présent, les expressions protéiques et arnas étudiées avec l'immunocytochimie, ou les déterminations RT-PCR/qRT-PCR ont révélé des niveaux élevés de détection pour divers canaux ioniques, y compris la grande tension de conductance et Ca2-activé (BK), la petite conductance Ca2-activéK- type 3 (SK3), les canauxK (Kv),La tension de type L À la porte de tension Ca2 (Ca v), et les canaux de mélastatine potentiel de récepteur transitoire de type 4 (TRPM4), ainsi qu'un échangeur Na/Ca2 14,15,16,17,18,19,20,21,22. Ils sont tous pensés pour contrôler l'excitabilité d'IDS, les niveaux intracellulaires de Ca2 et la contractilité. Patch-clamp approches électrophysiologiques, effectuées directement sur le cobaye, souris, rat, ou des cellules DSM humaines, a fourni une démonstration directe des propriétés biophysiques et pharmacologiques de Type L Cav, Kv (Kv2.x. Kv7), SK, BK, et TRPM4 canaux17,19,20,21,22,23,24,25 ,26,27,28,29,30,31. Les approches comprenaient une pince à tension à cellules entières conventionnelle, une pince à tension perforée et des enregistrements à un seul canal (configurations attachées à la cellule, à l'intérieur et à l'extérieur). En outre, l'enregistrement potentiel de membrane de DSM utilisant un courant-clamp a fourni l'évidence que les agents pharmacologiques target-engaging modifient l'excitabilité de cellules. Par exemple, l'inhibiteur TRPM4 9-phenanthrol induit hyperpolarisation dans les cellules DSM obtenus à partir de l'homme, cobaye, et les vessies urinaires de rat19,20,22,31. Parmi les diverses méthodes électrophysiologiques, l'amphotericin-B (et la nystatine, la gramicidine, et l'escin) les enregistrements perforés de correction-clamp fournissent un avantage principal en préservant les molécules et les voies intracellulaires intrinsèques de signalisation. Seules les cations de faible poids moléculaire et, dans une moindre mesure, Cl- mais pas les protéines ou les molécules de signalisation, y compris Ca2 - sont perméables à travers les pores de la membrane plasmatique formés par l'amphotéricine-B ou la nystatine32. Le succès des expériences perforées de patch-clamp dépend de plusieurs variables générales uniques à cette technique. Ici, nous décrivons les détails de la procédure utilisant amphotericin-B que notre groupe a utilisé avec succès au cours des années15,22,33,34,35,36,37,38,39.
On peut soutenir que les canaux de cation non sélectifs demeurent l'un des types de canaux les moins compris dans les cellules DSM. Le premier rapport d'un canal non sélectif ressemblant à une cation remonte à 1993. L'article de Wellner et Isenberg11 décrit un canal unique activé par l'étirement 33 pS affichant l'ordre de classement suivant de la perméabilité ion:K''gt;Na'gt;Cs'gt;'gt;Ba2 ',et l'inhibition de l'activité du canal par Gd3 ',un inhibiteur général des canaux de cation non-sélective. Près d'une décennie plus tard, Thorneloe et Nelson40 ont décrit les courants de cation perméables Nadans les cellules DSM de souris, inhibés par Gd3,à l'aide d'enregistrements à cellules entières. Étant donné que les identités moléculaires des canaux de cation non sélectifs et leurs caractérisations biophysiques restent à déterminer, des études futures dans ce domaine de recherche sont justifiées. Le protocole décrit ci-dessus pour l'enregistrement des courants non sélectifs des canaux de cation - à l'aide de solutions intracellulaires extracellulaires et de pipettes contenant des Cs,TEAet nifédipine (tableau 2) qui atténuent physiologiquement et pharmacologiquement les courants Kv et Cav - a été et continuera d'être utile dans les enquêtes électrophysiologiques des canaux de cation non sélectifs. Nous avons utilisé ce protocole spécifique pour déterminer l'étendue de l'inhibition des courants de cation à cellules entières par le bloqueur de canal TRPM4 9-phenanthrol dans les cellules de cobaye, de rat et de DSM humain19,20,22.
Pris ensemble, la méthode décrite ici pour obtenir des cellules DSM uniques fraîchement isolées de la vessie urinaire humaine fournit des cellules viables très appropriées pour les investigations électrophysiologiques en utilisant diverses configurations de la technique de patch-clamp, Ca2 -imagerie,immunocytochemistry, essai de litige proximal in situ, et cellule unique RT-PCR/qRT-PCR ainsi que des techniques avancées de biologie moléculaire, y compris l'analyse de microarray, ARN-seq, et CHIP-seq. L'utilisation de la méthode de pince à patch perforée amphotericin-B préserve l'environnement cellulaire natif contrairement à d'autres configurations. Lorsqu'ils sont exécutés à l'aide des conditions spécifiques décrites ici, conçues pour annuler les apports des courantsK et Ca2 dans les cellules DSM, les courants induits par la tension présentent les propriétés des courants de cation non sélectifs adaptés aux caractérisations biophysiques et pharmacologiques.
Protocole
Toutes les méthodes décrites ici ont été approuvées par les comités de la Commission d'examen institutionnel du Centre des sciences de la santé de l'Université du Tennessee (Memphis, TN, IRBMD 17-05714-XP) et par l'Université médicale de Caroline du Sud (Charleston, SC, IRBMD 00045232). Les procédures approuvées permettent aux échantillons de vessie urinaire d'épaisseur entière (par '1 cm par '1 cm) - contenant toutes les couches comprenant la muqueuse, le muscle lisse de détruseur, et le serosa aussi bien sont attachés des vaisseaux sanguins et le tissu adipeux) - pour être rassemblés des patients-donneurs subissant l'extraction partielle chirurgicale de la vessie. Les patients-donneurs sont adultes (tranche d'âge étudiée jusqu'à présent : 25 à 87 ans), hommes ou femmes, avec ou sans symptômes d'hyperactivité vésicale (classés par l'American Urological Association I-PSS score41). Les procédures chirurgicales impliquent une série de conditions médicales comprenant la cystectomie radicale pour le carcinome urothelial, et l'adénocarcinome. Dans de tels cas, le spécimen de réservoir urinaire recueilli est éloigné du site de la tumeur.
1. Dissection des tissus DSM et préparation des morceaux d'DSM sans muqueuse
- Examiner l'ensemble du spécimen de la vessie urinaire d'épaisseur qui est arrivé en laboratoire de la salle d'opération dans un récipient hermétiquement scellé rempli de la solution de dissection/digestion froide(figure 1 et tableau 2 pour la composition de DS).
REMARQUE : Le spécimen est habituellement conservé dans la DS froide de quelques heures à la nuit avant l'arrivée dans le laboratoire. Pour un stockage plus long, DS (Tableau 2) est complété par 1 mM CaCl2. - Enlever et rincer le spécimen d'épaisseur humaine DSM (contenant toutes les couches, y compris la muqueuse, DSM, et le sérostrope) avec dS glacé pour laver les débris attachés et le sang.
- Épinglez le spécimen de la vessie urinaire, muqueuse vers le haut et sérosrosa vers le bas, sur un enantiomère en silicone enduit (Table of Materials) 150 mm de diamètre plat rond rempli de glace-froid DS ( Figure1B).
- Retirez le tissu adipeux adjacent, les vaisseaux sanguins, l'épithélium (urothélium) et la muqueuse musculaire du spécimen par dissection pointue à l'aide de microscissors et de forceps.
- Découpez plusieurs pièces DSM sans muqueuse (2 à 3 mm de long et 4 à 6 mm de large)(figure 1C).
2. Dissociation enzymatique des morceaux de DSM donnant des cellules simples fraîchement isolées de DSM
- Placer 3 à 6 pièces de DSM dans un tube contenant de 1 à 2 ml de DS préréchauffée (37 oC) contenant du papaïne et du dithiothreitol (DS-P, tableau 2) et incuber des morceaux de DSM en DS-P pendant 30 à 45 min à 37 oC secouant doucement le tube de temps en temps (une fois tous les 10-15 min).
REMARQUE : Pour contrôler de façon optimale la température pour le traitement enzymatique, des tubes avec des morceaux de tissu et des solutions enzymatiques sont placés soit dans une chambre de tissu en verre remplie d'eau reliée à un bain d'eau chauffé e circulant(figure 1D) ou dans un bain d'eau de haute précision à température contrôlée (Figure 1E). - Retirez DS-P du tube, lavez brièvement les morceaux de DSM avec du DS froid glacé, jetez le DS froid du tube en laissant des morceaux de DSM assis au fond du tube.
- Ajouter 1 à 2 ml de collagène contenant du DS de type II (DS-C, tableau 2) au tube avec des pièces DSM, mélanger délicatement; et incuber de 25 à 40 min à 37 oC en secouant doucement le tube de temps en temps (toutes les 10-15 min).
- Jetez le DS-C et lavez les morceaux de DSM traités par les enzymes 5 à 10 fois avec du DS glacé.
- Après le dernier lavage, laissez la solution DS à l'intérieur du tube; triturate doucement avec une pipette Pasteur polie par le feu plusieurs fois pour libérer des cellules DSM uniques.
- Placez quelques gouttes de solution DS contenant des cellules DSM dispersées sur une chambre à fond de verre ou un bordereau et inspectez visuellement la qualité au microscope (à l'aide d'un objectif de 20x ou 40x) après au moins 5 minutes après l'application pour permettre aux cellules d'adhérer à le fond.
- Utilisez immédiatement des cellules DSM fraîchement isolées pour des expériences électrophysiologiques ou entreposez les cellules dans un tube contenant de la DS à 4 oC, soit sur glace, soit dans un réfrigérateur jusqu'à utilisation (généralement jusqu'à 8 h de préparation).
REMARQUE : Dans le cadre d'une même préparation, la qualité des cellules varie de cellules DSM mortes et surdifiées (figure 2). Lorsque la méthode séquentielle de papain-collagenase donne un nombre très élevé de cellules non viables, la préparation est jetée, et une nouvelle digestion des morceaux de DSM est effectuée mais avec des intervalles d'incubation réduits. Si la procédure entraîne trop peu de cellules DSM, puis pour la digestion ultérieure des morceaux DSM, les intervalles d'incubation sont augmentés. L'immunoréactivité positive à l'actine musculaire lisse confirme l'identité des cellules DSM (figure 3).
3. Enregistrement des courants de cation induits par la tension-étape des cellules DSM à l'aide de la technique de correction de tension à cellules entières perforée par amphotericine-B
- Pipette 0.25-1 ml de suspension cellulaire sur une chambre de fond en verre située sur une scène d'un microscope inversé et permettre aux cellules d'adhérer au fond de verre.
- Après l'incubation pendant au moins 45 min, retirer d'après-la-d-seing du bain et remplacer par la solution E (tableau 2) par superfusion où le flux de solution aidé par la gravité par le biais d'un ralentissement des tubes d'entrée remplace DS par la nouvelle solution tandis que le tube de sortie relié à un récipient de déchets sous vide élimine la solution de la chambre et empêche le débordement. Notez que la solution E contient des ions de tétraethylammonium(TEA)et de césium (Cs)pour inhiber lescourants K.
- Préparer une solution de stock de travail d'amphotéricine-B en sulfoxide de diméthyle (DMSO) (1 mg par 10 l de DMSO). Pour dissoudre complètement la poudre d'amphotéricine, sonicate (au moins 15 min) et vortex la solution bien.
REMARQUE : Cette étape prend habituellement moins de 10 min. Dissolving 3-4 mg d'amphotericin-B dans 30-40 l de DSMO dans un tube microcentrifuge de 1,5 ml fonctionne bien. Des quantités plus élevées d'amphotericine-B nécessitent plus de solvant DSMO, ce qui entraîne généralement un intervalle plus long pour le mélange et la solubilisation incomplète des particules solides amphotericin-B présentes dans le tube. - Dissoudre la solution de stock d'amphotericin-B dans la solution pipette (solution P, tableau 2) pour obtenir une concentration finale de 200-500 g/mL. Cette étape nécessite une sonication et un vortex à grande vitesse (8-10/10) pour 30 à 60 min par étape afin d'assurer un mélange optimal et la prévention de la formation de précipitation d'amphotéricine-B dans la solution pipette.
REMARQUE : Amphotericin-B va précipiter le temps et est sensible à la lumière. La solution de pipette de travail contenant Amphotericin-B est vérifiée pour la solubilité, mélangée à la main avant le remplissage de pipette, et maintenue dans l'obscurité. - Tirez plusieurs électrodes de patch, des pointes d'électrode de feu-polish, et (si nécessaire) enrobez les bouts avec la cire dentaire.
- Remplissez la pointe d'une électrode de patch avec la solution pipette (solution P, tableau 2) sans amphotericin-B en trempant brièvement l'électrode dans la solution.
- Remblayer l'électrode avec la même solution de pipette contenant de l'amphotéricine-B.
- Montez l'électrode sur un support relié à une tête d'amplificateur de patch-clamp.
- À l'aide d'un micromanipulateur, placez l'électrode juste en dessous de la surface de la solution extracellulaire afin que la pointe de l'électrode soit submergée.
- Dans le mode tension-clamp, réglez le potentiel de fixation à 0 mV et ajustez le courant à 0 pA avec le cadran décalé de pipette sur l'amplificateur commercial (Table des Matériaux).
- Déterminer la résistance aux électrodes à l'aide de la fenêtre/fonction du logiciel d'acquisition commerciale(Tableau des matériaux). Pour activer, cliquez sur Outils-m.-m.'à l'essai ou à une icône de raccourci dans le logiciel. La résistance à l'électrode déterminée doit être de l'ordre de 2 à 5 M.
REMARQUE : La fonction d'essai de membrane fournie dans le logiciel d'acquisition commerciale ou l'option d'essai de joint sur l'amplificateur peut être employée pour surveiller la résistance d'électrode en appliquant des étapes de tension répétitivement. - Continuer à surveiller la résistance aux électrodes tout en faisant avancer l'électrode vers une cellule DSM choisie avec un micromanipulateur (Figure 4A).
REMARQUE : Pour être considérée comme une cellule DSM viable, la cellule doit montrer la morphologie allongée en forme de fuseau, un halo bien défini autour de la cellule, les bords croquants, et l'aspect semi-contractile (serpentine). - Lorsque vous touchez la surface de la cellule avec l'électrode - indiquée par une augmentation rapide de la résistance à l'électrode mesurée avec la fonction D'essai de membrane - formez un giga-sceau en appliquant une pression négative rapide douce au support d'électrode par l'intermédiaire du tube. Il en résulte une pression négative créée à l'extrémité de l'électrode qui tire la membrane cellulaire en électrode aidant à la formation d'un giga-sceau ou un contact très serré entre l'électrode et la membrane plasmatique (Figure 4B).
- Une fois que le giga-scellese se forme, compensez la capacité de pipette en ajustant les cadrans rapides et lents sur l'amplificateur commercial et surveillez la stabilité giga-scelle (courant de fuite) en utilisant la fonction de test de membrane.
- Prévoyez du temps, généralement de 30 à 60 min, pour que l'amphotericine-B diffuse la pipette et soit insérée dans la membrane plasmatique formant des pores principalement sélectifs aux cations monovalentes. Pendant cette étape, continuez à surveiller le giga-seal avec la fonction Detest Membrane. À mesure que la perforation cellulaire augmente, l'amplitude des transitoires de capacité (comparez la figure 4B par rapport à la figure 4C n'affichant aucune perforation cellulaire efficace, respectivement) mesurée avec la fonction d'essai de membrane.
- Lorsque la perforation du patch est optimale (jugée par une résistance de série stable généralement inférieure à 50 M), annulez les transitoires de capacité en ajustant les cadrans pour la capacité cellulaire et la résistance des séries sur l'amplificateur. La compensation de résistance de série peut également être exécutée à ce moment-( figure 4D).
- Une fois que les courants de cation induits par la tension stable-étape évoqués par le protocole spécifié sont observés, appliquer un composé ou une condition physiologique pour tester par superfusion et enregistrer les réponses pour le contrôle-, l'état d'essai, et le lavage (si possible) avec le logiciel d'acquisition commerciale.
- Enregistrez les courants avec un protocole de tension-étape de routine qui implique la tenue des cellules DSM à -64 ou -74 mV et le recul de la tension par incréments de 10 mV pour 400 ou 500 ms de -94 à 96 ou 106 mV et le retour au potentiel de retenue.
REMARQUE : Les valeurs potentielles de la membrane sont ajustées pour un potentiel de jonction liquide de 14 mV (à l'aide des solutions P et E, tableau 2). Le potentiel de jonction liquide est obtenu dans le logiciel d'acquisition commerciale (Table of Materials) en cliquant sur ( Tools-gt;Junction Potentials) et en entrant dans les concentrations de composants ionde de solution. Un protocole de rampe peut également être utilisé pour obtenir des enregistrements actuels. - Exécutez le protocole de tension en intervalle continu de 1 min pendant une expérience enregistrant les courants pour le contrôle de pré-addition, l'état d'essai, et le lavage.
- Enregistrez les courants avec un protocole de tension-étape de routine qui implique la tenue des cellules DSM à -64 ou -74 mV et le recul de la tension par incréments de 10 mV pour 400 ou 500 ms de -94 à 96 ou 106 mV et le retour au potentiel de retenue.
4. Analyse et visualisation des données
- Ouvrez les fichiers enregistrés dans le logiciel d'analyse de données commerciales (Table of Materials) pour le contrôle, l'état de test et le lavage en cliquant sur File -gt;Open Data et en sélectionnant les fichiers d'intérêt pour l'ouverture.
REMARQUE : Pour l'analyse, trois fichiers (chacun contenant un seul ensemble de traces à une seule exécution de protocole) pour chaque condition sont ouverts et analysés. Les réponses sont ensuite moyennes pour obtenir une réponse moyenne pour chaque condition. Le logiciel utilisé pour l'acquisition de données contient une option pour collecter automatiquement des tests multiples spécifiés par l'utilisateur et les moyenne pour un seul fichier de sortie qui peut être utilisé comme alternative. - Obtenir la réponse moyenne au cours des 200 derniers ms pour la trace actuelle mesurée à chaque tension; l'intervalle de durée choisi reflète un niveau d'activation du courant de tension-étape stable. Pour ce faire, suivez les étapes ci-dessous.
- Sélectionnez un fichier d'intérêt pour analyse dans le logiciel d'analyse commerciale (Tableau des matériaux).
REMARQUE : Le logiciel positionne le fichier le plus récemment importé dans sa fenêtre d'affichage active. Le fichier ouvert affiche une série de traces qui se chevauchent obtenues avec un protocole de tension-étape. Par défaut, dans la fenêtre active, quatre curseurs (affichage des valeurs x et y pour la trace mise en surbrillance) sont affichés. - Choisissez la plage pour l'analyse en positionnant le curseur 2 à la fin de l'étape de tension de 400 ou 500 ms et le curseur 1 à l'intervalle de 200 ms avant cela de sorte que la plage d'analyse est de 200 ms.
- Obtenir des réponses pour chaque tension en cliquant sur Analyze 'gt;Quick Graph 'gt;IV (ou l'icône de raccourci IV) (dans la fenêtre rapide avant de générer des données confirment que pour y-axis (actuel) signal Options région "Curses 1..2" et "Mean" sont sélectionnés). Cliquez sur OK pour générer le graphique I-V et pour placer les données dans une feuille de colonne de résultats qui peut être consultée en accédant à Windows .'Résultats.
- Analysez des fichiers supplémentaires en répétant les étapes 4.2.1 - 4.2.3. Cliquez sur Analyze-gt;Quick Graph 'gt;IV ou le raccourci icône IV, sélectionnez Append plutôt que De remplacer pour ajouter des données supplémentaires à la feuille de résultats lors du traitement des traces.
- Copiez les données d'une feuille de calcul en sélectionnant les colonnes d'intérêt et en appuyant sur CTRL-C pour copier et CTRL-V à coller. Stockez la feuille de travail des résultats dans le logiciel d'analyse commerciale (Table of Materials) dans le format (.rlt) en cliquant sur File .g;Save As.
- Sélectionnez un fichier d'intérêt pour analyse dans le logiciel d'analyse commerciale (Tableau des matériaux).
- Pour chaque cellule, normaliser les réponses pour les trois conditions à la valeur de l'étape de tension maximale pour le contrôle pré-additionnel (selon la formule : Response/ResponseControl-Max) et graphiquer les réponses en tant que valeurs actuelles (ou densité de courant) par rapport aux relations de tension (figure 6).
- Dans un processeur de feuille de travail, déterminez les réponses moyennes en fonction des courants (pA) ou des densités actuelles (pA/pF) pour le contrôle, l'état d'essai (dans cet exemple, 9-phéenanthrol) et le lavage à chaque étape de tension.
- Divisez les valeurs pour chaque tension de chaque condition (contrôle, 9-phenanthrol et lavage) par la réponse de contrôle maximale obtenue à la tension la plus élevée (96 mV à la figure 6) pour le contrôle de pré-addition suivant la formule : Réponse normalisée pour l'état (x) - Réponse (x)/ Contrôlede réponse-Max pour (x).
- Pour une analyse sommaire, disposer les données dans un format qui peut être facilement copié à un programme graphique (par exemple GraphPad Prism) pour la visualisation.
Résultats
La dissociation enzymatique des pièces de DSM fournit des cellules DSM fraîchement isolées saines couramment utilisées dans des études fonctionnelles et moléculaires telles que : l'électrophysiologie de patch-clamp et l'immunocytochemistry. La figure 1 résume les étapes de dissection et visualise les configurations utilisées pour le contrôle de la température des étapes de traitement enzymatiques. La figure 2 illustre des images de champs lumineux de cellules DSM obtenues à partir de trois spécimens de vessie urinaire humaine chacun d'un patient-donneur différent. Les cellules DSM simples saines sont caractérisées par une morphologie en forme de fuseau, des bords bien définis, un halo bien défini autour de la cellule et une apparence semi-contractile (serpentine) lorsqu'on les regarde au microscope (voir cellules DSM marquées par des flèches blanches à la figure 2). Ils répondent également aux agents stimulants de contraction tels que le carbachol agoniste muscarinique ou les applications de Kélevé (60 mM). Les cellules DSM présentent une immunoréactivité positive pour l'actine musculaire lisse confirmant leur identité (Figure 3).
Les cellules DSM sont idéalement adaptées aux investigations électrophysiologiques patch-clamp des propriétés des canaux ioniques. Ici, nous décrivons la méthode d'enregistrement perforée de patch-clamp d'amphotericin-B utilisant la pipette et les solutions extracellulaires (tableau 2) pour enregistrer de manière optimale des canaux induits par tension-étape de cation. Dans les conditions spécifiques employées, le blocus des courants Kv et L-type Ca2 avec Cs/TEAet nifedipine, respectivement, a assuré l'élimination de la contribution de ces composants ioniques aux courants de tension de l'ensemble des cellules. La figure 4 et la figure 5 montrent, respectivement, les étapes expérimentales de la méthode de la pince à patch perforée amphotericin-B et les courants représentatifs de cellules entières mesurés soit par une étape de tension induite, soit avec un protocole de rampe dans trois cellules DSM humaines différentes, chacune provenant d'un donneur patient différent. Notez que les enregistrements présentent un certain degré de variabilité en termes d'amplitudes actuelles et de rectification extérieure. D'autres expériences ont révélé que le 9-phenanthrol, un inhibiteur du canal TRPM4, inhibait efficacement et réversiblement les courants de cation d'IsM humains à des tensions négatives et positives(figure 6). Le composant de courant 9-phenanthrol-sensible illustre une inhibition plus forte aux tensions positives et à la rectification extérieure (figure 6C).
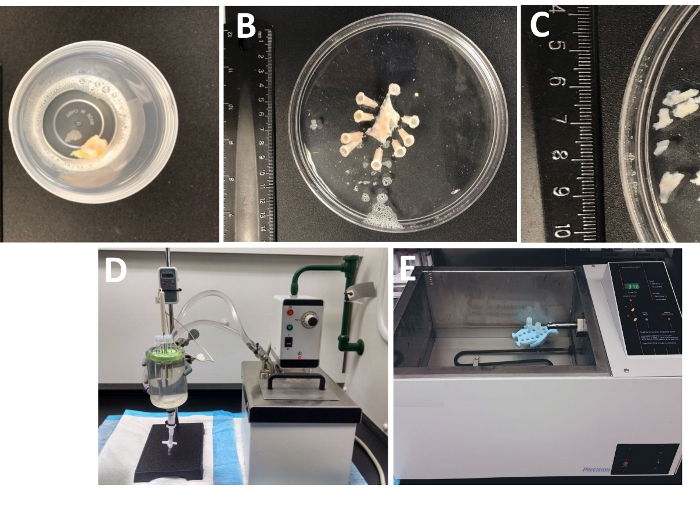
Figure 1 : Résumé des étapes de dissection résultant de la préparation des morceaux lisses de muscle detrusor (DSM) et de la configuration employées pour la dissociation enzymatique. On y voit des images de : (A) un spécimen de vessie humaine d'épaisseur entière fourni à partir d'une chirurgie ouverte de la vessie comme matériel chirurgical extra-marin dans la DS glacée, (B) la même préparation après l'épinglage avec une couche DSM partiellement disséquée, (C) d'autres morceaux de Dimensions variables découpés dans la couche DSM prête pour la digestion enzymatique (pièces plus petites) ou d'autres investigations expérimentales (pièces plus grandes), (D, E) d'autres configurations utilisées pour la digestion enzymatique des pièces DSM composées de soit (1) un bain d'eau circulant à température contrôlée relié par un tube à une grande chambre de tissu en verre remplie d'eau, un support en caoutchouc pour tubes, tubes en plastique contenant des pièces DSM et des solutions enzymatiques préparés en solution de dissection/digestion (DS, DS-P ou DS-C, tableau 2) et une sonde de température liée à un écran permettant une surveillance continue (D), ou (2) un grand bain à température contrôlée rempli d'eau contenant un support et des tubes avec des pièces DSM et des solutions enzymatiques (E ). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
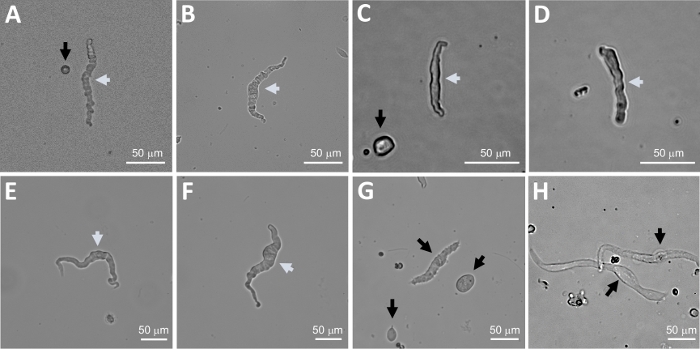
Figure 2 : Images représentatives sur le terrain lumineux de cellules DSM humaines fraîchement isolées obtenues à l'aide de la méthode séquentielle de digestion de papain-collagenase. (A-F) Des images de cellules DSM viables et physiologiquement actives sont considérées comme des candidats appropriés pour tenter des enregistrements de patch-clamp perforés. (G, H) Images de cellules non viables ou sur-digérées; ces cellules ont été évitées pour des expériences de patch-clamp. Les flèches blanches et noires dans les panneaux (A-H) indiquent que les cellules DSM sont considérées comme viables et non viables, respectivement, pour tenter des enregistrements de pinces. Notez que les flèches noires dans les panneaux(A, C et G) pointent vers des fragments de cellules (pièces circulaires) ou de petites cellules dépourvues de morphologie DSM et dans (H) les cellules semblent pâles et dilatées. Les images proviennent de trois spécimens de vessie séparhe sépariaux différents(A et B : source patient-donneur un, C et D : source patient-donneur deux, et E-H : source patient-donneur trois). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
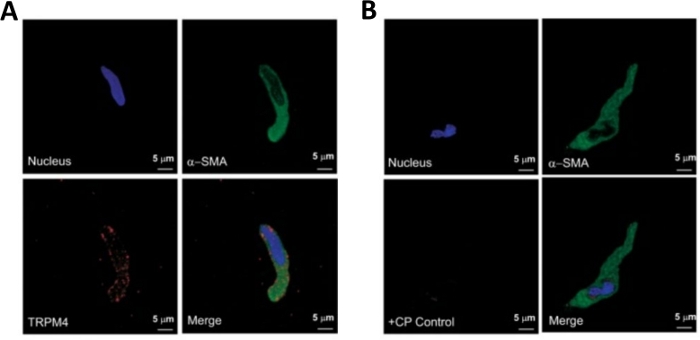
Figure 3 : Expressions du canal de melastatin potentiel transitoire de melastatin 4 (TRPM4) et des immunoreactivities spécifiques d'actine de muscle de 'lisse-lisse dans les cellules humaines simples de DSM par l'analyse d'immunocytochemistry. (A) Sont montrés des images confocales montrant la détection immunocytochimique de l'expression de protéine de canal TRPM4 dans une cellule humaine de DSM. La coloration rouge (en bas à gauche) indique les protéines du canal TRPM4; la coloration bleue (DAPI) détecte les noyaux cellulaires (en haut à gauche); la coloration verte indique l'actine musculaire lisse (SMA, en haut à droite); l'image fusionnée (en bas à droite) illustre le chevauchement des trois images. (B) Images confocales illustrant l'atténuation de la détection immunocytochimique de l'expression des protéines trPM4 en présence d'un peptide concurrent TRPM4 (CP) dans des cellules DSM humaines isolées. La coloration bleue (DAPI) indique les noyaux cellulaires (en haut à gauche); coloration verte est pour l'actine musculaire lisse (-SMA, en haut à droite); l'image fusionnée (en bas à droite) illustre le chevauchement des trois images. Les résultats ont été vérifiés dans quatre expériences séparées utilisant le tissu entier de DSM ou les cellules multiples de DSM isolées de quatre patients. Les images proviennent de Hristov et coll. (2016)22 et sont utilisées avec permission. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
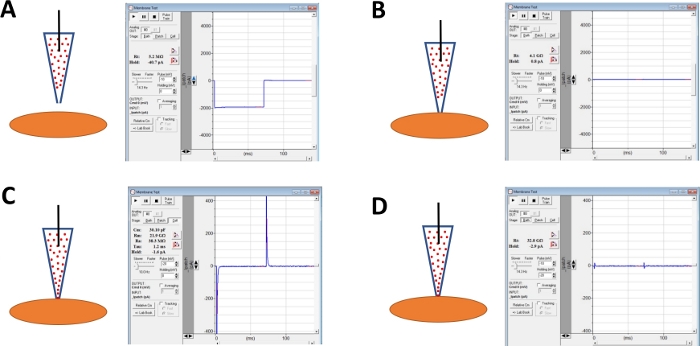
Figure 4 : Illustration schématique des étapes impliquées dans la formation de giga-sceau et la perforation d'amphotericin-B des cellules humaines de DSM. Illustrées sont les positions spatiales d'une pipette amphotericine-B contenant et d'une cellule DSM ainsi que les réponses associées pour les tests membranaires obtenus dans le logiciel d'acquisition commerciale(Tableau des matériaux) en modifiant les étapes de tension (soit -10 ou -20 mV dans cet exemple) déterminant la résistance. Les configurations sont : (A) avant l'approche cellulaire avec une électrode, (B) après formation giga-scelle obtenue en positionnant la pipette contenant de l'amphotéricine-B (amphotericin-B représentée par des points rouges) sur la surface de la cellule et en appliquant une pression négative, (C) la configuration sur cellule montrée 45 min après la formation giga-sceau, à ce moment-là amphotericin-B a diffusé la pipette et ses molécules ont inséré dans la membrane plasmatique à la pointe de l'électrode pores perméables, et (D) la même configuration que dans (C) mais avec des transitoires de capacité annulé à l'aide de cadrans pour la capacité de cellules entières et la résistance de série sur l'amplificateur. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
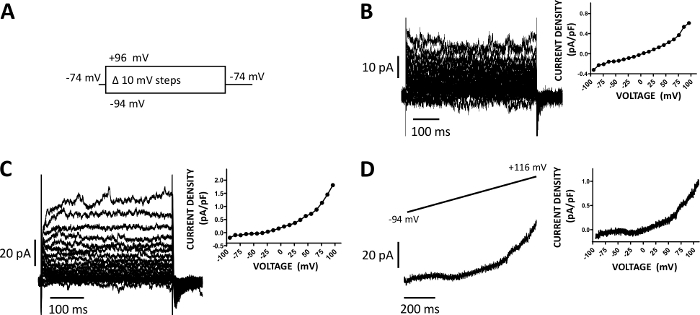
Figure 5 : Courants de cation à cellules entières enregistrés avec la méthode de patch-clamp perforée d'amphotericin-B dans les cellules humaines de DSM. (A) Un diagramme du protocole de tension-étape illustre un potentiel de retenue de -74 mV et des étapes de tension de durée de 400 ms de -94 à 96 mV effectuées par incréments de 10 mV, puis retournées à -74 mV. (B, C) Des traces de courant représentatives ainsi que des parcelles de tension de densité de courant provenant de deux cellules DSM humaines différentes, chacune provenant d'un échantillon de vessie urinaire différent/patient-donneur obtenu avec le protocole de tension-étape décrit dans (A). (D) Exemple d'une trace actuelle obtenue avec un protocole de rampe (graphiquement représenté dans l'encours supérieur comme changement de tension de -94 à 116 mV sur une durée de 1 s à 0,21 mV/ms, le potentiel de possession était de -94 mV). Sur la droite dans les panneaux (B-D), les graphiques affichent la relation densité-tension actuelle pour chaque cellule DSM enregistrée. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
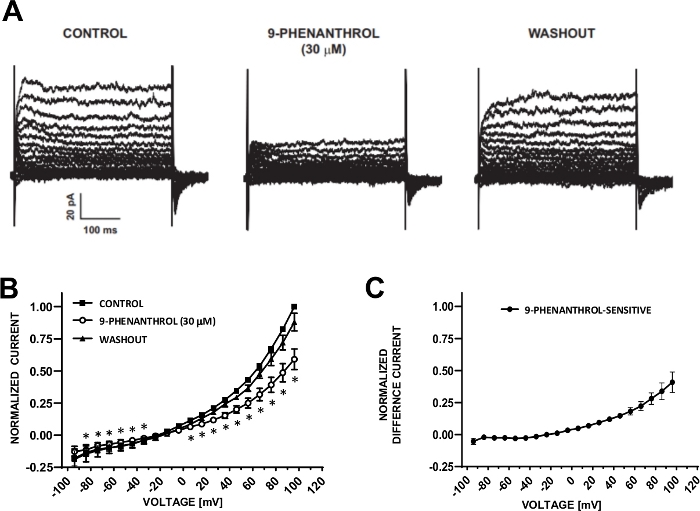
Figure 6 : Le bloqueur de canal TRPM4 9-phenanthrol-mediated inhibition des courants de cation induits par tension-étape dans les cellules humaines de DSM. (A) Sont indiqués sont des courants représentatifs mesurés avec le protocole de tension-étape décrit dans la figue 5A pour le contrôle, 9-phenanthrol, et le lavage. (B) Résumé des réponses normalisées par rapport à la tension pour le contrôle, 9-phenanthrol, et le lavage dans sept cellules DSM (de sept patients-donneurs différents). (C) Courant de différence pour le composant sensible au 9-phénanthrol obtenu en soustrayant les valeurs en présence de 9-phéenanthrol (30 M) de celles du contrôle indiqué dans (B). Les données de (B) et (C) sont affichées comme des moyens avec des barres d'erreur pour SEM, - représente la signification (p-lt;0.05, test de l'étudiant jumelé) pour la comparaison du contrôle vs 9-phenanthrol à chaque tension. Les panneaux (A) et (B) ont été reproduits à partir de Hristov et coll. (2016)22 et utilisés avec permission. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
| Espèces | Détails de la procédure | Références | |
| Cobaye | Pièces DSM rincées avec Ca2 -libremilieu (en mM: 100 NaCl, 10 KCl, 1.2 KH2PO4, 5 MgCl2, 20 glucose, 50 taurine, mesurée pCa 6 (ou 1 mM) et ensuite coupé en morceaux et traité généralement 90-120 min (4 périodes de 30 min) avec une enzyme moyenne (mM: 130, KOH 20 taurine, 5 pyruvates, 5 créatine, 10 mM HEPES, ajusté avec de l'acide méthansulfonique au pH 7,4, 1 mg/ml de collagène, 0,2 mg/ml de pronase E, 1 mg/ml d'albumine sans acide gras, pCa 4,2 (63 mM) ou 3,7 (200 mM). Les cellules DSM simples ont été stockées dans Kraft-Bruhe (KB)-moyen (en mM: 85 KCl, 30 K2PO4, 5 MgSO4, 5 Na2ATP, 5 K-pyruvate, 5 créatine, 20 taurine, 5 bêta-OH-butyrate, 1 mg/ml d'acide gras albumin e, ajusté avec KOH à pH 7,2). Méthode alternative : pièces DSM rincées pendant 10 min dans un milieu Ca2 'libre(en mM): 140 NaCl, 5 KCl, 1.2 MgCl2, 10 glucose, 20 taurine, 5 HEPES, ajusté avec NaOH à pH 7.4). Ensuite, les morceaux de DSM, incubés dans le même milieu Sans Ca2- complété par 5 mg de collagène, 2 mg% de pronase et 100 M CaCl2 pour 2x20 min en remuant. | Klockner et Isenberg (1985)13,34 Klockner et Isenberg (1986)35 Schneider et coll. (1991)10 Bonev et Isenberg (1992)9 Weidelt et Isenberg (2000)36 Moore et coll. (2004)14 | |
| Cochon de Guinée, cochon de Landrace, et humain | Pièces DSM pré-incubées pendant 5 min dans la solution Krebs sans Ca2,puis coupées en morceaux et digérées enZymatiquement dans la solution Krebs sans Ca2mo contenant 0,5-2 mg/ml de collagène de type I et 0,1-0,5 mg/ml de pronase à 36 oC pendant 20-30 min constamment remuées. Dans certains cas, les morceaux digérés ont été encore agités par une pipette à pointe émoussée ou en tournant jusqu'à ce que les cellules de rendement. Les cellules isolées ont été stockées dans la solution modifiée de Krebs (décrite dans Klockner et Isenberg13) et ont été normalement employées dans un délai de 3 h. La composition de la solution Krebs a été (mM): 140 Na,6 K,2 Ca2, 1,2 Mg2, 152,4 Cl-, 10 glucose, 10 HEPES, pH 7,35-7,4 avec Tris. Pour la solution Sans Ca2,Ca2 et Mg2 ont été omis de la solution Krebs. | Inoue et Brading (1990)37 Inoue et Brading (1991)38 Nakayama et Brading (1995)39,40 | |
| Humain | Pièces DSM placées dans la solution HEPES Tyrode sans Ca2(en mM : 105,4 NaCl, 20.0 ou 22.3 NaHCO3, 3.6 KCl, 0.9 MgCl2, 0.4 NaH2PO4, 19.5 ou 4.9 HEPES, 5.4 ou 5.5 glucose, 4.5 ou 5.5 Na-pyruvate) et coupé en morceaux d'IndM. Pièces DSM trempées dans une solution enzymatique (ca2 ' solution HEPES libre de Ca 2 avec 0,7 mg/ml de collagène de type I, 0,7 mg/ml de papain, 1 mg/ml d'albumine) pendant la nuit à 4 oC. Les bandes ont ensuite été chauffées à 36,5 oC pendant 15 à 30 min, lavées et triturées délicatement en solution fraîche. Cellules isolées qui ont été stockées dans Ca2 mD contenant la solution de HEPES Tyrode ou utilisées immédiatement pour des expériences. | Montgomery et Fry (1992)24 Gallegos et Fry (1994)41 Fry et coll. (1994)42 Sui et coll. (2001)43 Wu et coll. (2002)44 | |
| Cobaye | DSM coupé en morceaux en PSS (en mM: 137 NaCl, 5.4 KCl, 2 MgCl2, 2 CaCl2, 0.42 KH2P04, 4.17 NaHCO3, 10 glucose, 10 HEPES, pH 7.4 avec NaOH). Pièces DSM placées pendant 10 min dans la solution de digestion suivante (en mM : 80 Na-glutamate, 55 NaCl, 6 KCl, 10 HEPES, 11 glucose, 2 MgCl2, et 0.2 CaCl2) et ensuite transféré dans une fiole contenant la même solution, mais avec 1 mg/ml de collagène 2, 1 mg/ml inhibiteur de la trypsine (parfois omis), 1 mg/ml d'albumine bovine sans gras, pour 70 min à 35 oC ou 60 min à 37 oC. Les cellules DSM simples ont été obtenues par trituration par une pipette Pasteur dans la même solution sans calcium et enzymes. Après la trituration, Ca2M (1 m) a été ajouté et les cellules ont été stockées à 4 oC. Les cellules étaient toujours utilisées le même jour. | Bonev et Nelson (1993)53,54 Heppner et coll. (1997)26 Petkov et coll. (2001)47 Shieh et coll. (2001, 2007)48,49 | |
| Cochon de Guinée, souris, rat, et humain | Le protocole utilise un traitement de dissociation enzymatique en deux étapes après une dissection pointue dans la solution de digestion sans Ca2(en mM : 80 Na-glutamate, 55 NaCl, 6 KCl, 10 HEPES, 11 glucose, et 2 MgCl2). Tout d'abord, les morceaux de DSM ont été traités pendant 25-45 min à 37 oC avec 1-2 mg/ml de papain, 1 mg/ml de dithioerythreitol et 1 mg/ml d'albumine de sérum bovin en solution de dissociation (en mM : 80 glutamate monosodique, 55 NaCl, 6 KCl, 2 MgCl2, 10 HEPES, et 10 glucose, ajusté au pH 7.3 avec NaOH) puis pièces DSM transférés à la solution de digestion contenant 1-5 mg/ml de collagène XI (Sigma) ou collagène de type 2, 1 mg/ml d'albumine de sérum bovin, 0 ou 1 mg/ml d'inhibiteur de la trypsine et 100 M Ca2', pour 6-30 min. Après l'incubation, le tissu digéré a été lavé plusieurs fois dans la solution de digestion sans enzymes et Ca2, puis doucement trituré pour produire des cellules musculaires lisses simples. | Petkov et coll. (2001)50 Thorneloe et Nelson (2003)51 Thorneloe et Nelson (2004)33 Petkov et Nelson (2005)27 Hristov et al. (2008)52 Layne et al. (2010)53 Hristov et al. (2011)15 Xin et al. (2012)54 Parajuli et coll. (2012)25 Malysz et coll. (2013)29 Parajuli et al. (2013)31 Lee et al. (2013)55 Malysz et al. (2014)23 Smith et al. (2013)19, 20 Hristov et coll. (2016)22 Lee et coll. (2017)56 Yarotskyy et coll. (2018)57 | |
Tableau 1 : Résumé des approches enzymatiques utilisées pour isoler les cellules DSM uniques des vessies urinaires de diverses espèces.
| Solution Type | Composition (en mM) |
| DS (Dissection/Solution de digestion) | 80 Na-glutamate, 55 NaCl, 6 KCl, 10 HEPES, 2 MgCl2, et 11 glucose, pH ajusté à 7,4 (avec 10 M NaOH) |
| DS-P (DS contenant du papa) | DS contenant 1-2 mg/ml de papaïne, 1 mg/ml de dithiothreitol et 1 mg/ml d'albumine de sérum bovin |
| DS-C (DS contenant de la collagène) | Solution DS contenant 1-2 mg/ml de collagène de type II, 1 mg/ml d'albumine de sérum bovin, 0 ou 1 mg/ml d'inhibiteur de la trypsine et 100-200 M Ca2 |
| P (Pipette) | 110 CsOH, 110 acide aspartique, 10 NaCl, 1 MgCl2, 10 HEPES, 0,05 EGTA, et 30 CsCl, pH ajusté à 7,2 avec CsOH, et complété par de l'amphotéritine-B (300-500 g/ml) |
| E (Extracellulaire) | 10 chlorure de tétraethylammonium (TEA), 6 CsCl, 124 NaCl, 1 MgCl2, 2 CaCl2, 10 HEPES, et 10 glucose, pH ajusté à 7,3-7,4 avec NaOH ou CsOH, et 0,002-3 (2-3 mM) nifedipine |
Tableau 2 : Compositions de la solution de dissection/digestion (DS), et de la pipette et des solutions extracellulaires utilisées dans les expériences perforées de patch-clamp.
Discussion
Les procédures décrites ici expliquent les étapes impliquées dans la préparation des cellules DSM viables et fraîchement isolées à partir de spécimens de vessie humaine d'épaisseur entière utilisant la digestion enzymatique et dans l'enregistrement des courants de cation de cellules entières sensibles à l'inhibiteur de canal TRPM4 9-phenanthrol employant l'approche de patch-clamp perforé d'amphotericin-B. La procédure enzymatique repose sur une exposition séquentielle en deux étapes appelée méthode séquentielle de digestion papain-collagenase. Les tissus DSM sont d'abord traités avec de la papaïne et du dithiothreitol (un agent stabilisateur enzymatique) dans un état nominal ca2- libre, suivi dans la deuxième étape par le type de collagène II en présence de ca faible2. La raison d'être de la digestion papaïne dans de faibles conditions Ca2 dans les cellules musculaires lisses remonte à la fin des années 1980. Les cellules musculaires lisses lisses fraîchement isolées d'artère carotide préparées avec le papain ont montré une forme allongée, ont montré la viabilité (résistance à l'uptake bleu de Trypan) et ont répondu aux stimulus contractiles (plus haut Ca2 et histamine)65. Des années plus tard, cette méthode a été appliquée dans la préparation des cellules DSM (voir tableau 1). Le choix de collagène type II plutôt que d'autres types se rapporte à son activité protéolytique relativement élevée idéalement adaptée pour les tissus musculaires lisses, y compris Le DSM. En effet, le traitement de collagène seul pourrait produire des cellules Simples de DSM bien qu'exigeant l'exposition intensive d'enzyme (60 min)53,54. Étant donné que l'activité de collagène dépend de Ca2 et que l'enzyme est inactive dans les conditions sans Ca2,la digestion enzymatique optimale des pièces DSM nécessite la présence de Ca2 66. Dans notre cas, DS-C contient 100-200 M [Ca2](Tableau 2). Après traitement enzymatique, les morceaux digérés de DSM sont lavés doucement un certain nombre de fois avec le DS froid sans enzymes ou Ca2 pour enlever n'importe quelle enzyme liée aux tissus. Le DS glacé aide à préserver l'intégrité cellulaire DSM et à limiter l'activité enzymatique de tout papaïne ou collagène restant. Dans la dernière étape, la trituration des pièces DSM traitées enzymatiques avec une pipette Pasteur polie par le feu libère une seule cellule DSM. Les cellules DSM sont soit immédiatement placées sur une chambre d'enregistrement pour des études de patch-clamp ou d'autres types d'expérimentation ou stockées sur la glace dans DS pour une utilisation plus tard le même jour (généralement dans les 8 heures de préparation, mais les cellules restent viables jusqu'à 24 h).
Nous avons identifié plusieurs considérations importantes pour obtenir avec succès des cellules d'IDM simples. La première concerne la qualité de la source du spécimen DSM humain. Afin de préserver de façon optimale l'intégrité tissulaire, les échantillons de DSM obtenus lors de chirurgies de la vessie ouverte sont placés dans un DS glacé dès que possible et maintenus dans un environnement froid. Plus précisément, lors de l'extraction chirurgicale du patient, le spécimen de vessie est immédiatement placé sur une table d'appoint entièrement préparée dans la salle d'opération. L'examen brut du spécimen entier (généralement obtenu pendant la cystectomie radicale ou simple) et son ouverture suivent. Après inspection visuelle, un morceau de spécimen d'échelle urinaire d'épaisseur entière est enlevé d'une zone éloignée du spécimen grossièrement non impliqué avec la tumeur et immédiatement placé dans une tasse (soit 50 ou 100 ml) contenant la solution de dissection froide (4 oC) (DS) (tableau 2) et puis étroitement fermé avec un couvercle. En raison de la nature prévue de la récolte du tissu, le personnel de la salle d'opération et le personnel auxiliaire effectuant la récolte sont alertés au début du cas chirurgical afin d'avoir le matériel disponible dans la salle d'opération au moment de l'extraction des tissus. Ces précautions ainsi que la nature ruse et répétitive des étapes de traitement maintiennent le temps chaud d'ischémie pour le tissu - de l'extraction au placement dans le récipient réfrigéré avec la solution dsS - à moins de 5 min. Le contenant est ensuite placé dans un réfrigérateur ou sur de la glace dans une glacière pour maintenir l'environnement froid et transporté (glace-froid) au laboratoire. Une fois que le spécimen arrive en laboratoire, les étapes de dissection et de dissociation enzymatique commencent. Il est très difficile de prédire si un spécimen DSM donné donnera des cellules DSM de haute qualité après la dissociation enzymatique, ainsi nous procédons aux étapes de dissociation enzymatiques. Dans de nombreux cas, parallèlement à des expériences électrophysiologiques, notre groupe effectue des enregistrements de tension isométrique sur des bandes DSM préparées à partir des mêmes spécimens DSM. Nous avons constaté que nous pouvons habituellement obtenir des cellules DSM de haute qualité à partir de préparations qui fournissent également avec succès des bandes viables pour les études de contraction isométrique (notre observation non publiée).
Le deuxième facteur se rapporte à différentes variations de lot d'enzymes. Nous avons observé que pour la papaïne et le collagène de type II, chaque fois qu'un nouveau lot d'enzyme arrive d'un fournisseur, l'activité enzymatique dans DS pour la digestion des tissus peut varier. Par conséquent, nous optimisons systématiquement la concentration en zymatique et les intervalles d'incubation pour chaque nouveau lot. Afin de minimiser la contribution à la variabilité du lot, nous commandons de plus grandes quantités du même lot et faisons un grand lot de solutions de stock dans 2 ml d'aliquots d'enzymes et les stockons à 20 oC jusqu'à l'utilisation. Au fil du temps, cependant, les stocks congelés (stockés jusqu'à 2 semaines) peuvent perdre leur activité enzymatique. La troisième variable concerne la température des traitements de digestion enzymatiques. Les activités enzymatiques de la papaïne et de la collagène affichent la température-dépendance. Papain et collagène type II montrent l'activité dans les gammes de température englobant la physiologie normale du corps67,68. Par conséquent, nous visons à maintenir les traitements enzymatiques stables à 37 oC en évitant des températures plus élevées pour préserver l'intégrité des cellules DSM. La quatrième considération concerne la variabilité de la qualité des cellules DSM présentes dans chaque préparation allant de très viables (présentant d'excellentes caractéristiques musculaires lisses classiques) à des cellules non saines et sur-digérées. Un intervalle prolongé d'incubation enzymatique est l'une des principales raisons pour obtenir un nombre élevé de cellules endommagées. Les traitements enzymatiques excessifs altèrent également les structures protéiques des canaux ioniques, des récepteurs et des transporteurs, affectant négativement leur fonctionnalité. L'interprétation des résultats obtenus à partir de cellules enzymatiquement obtenues, fraîchement isolées devrait garder cette considération à l'esprit. L'optimisation des conditions de digestion enzymatiquevise l'augmentation du pourcentage de cellules hautement viables. Les approches expérimentales s'appuyant sur un plus grand nombre de cellules viables telles que les analyses de microarray nécessitent des optimisations plus robustes que celles réalisées avec succès sur moins de cellules telles que l'électrophysiologie monocellulaire patch-clamp ou l'imagerie Ca2. La prise en compte des facteurs susmentionnés a guidé nos efforts de recherche au cours de la dernière décennie dans l'obtention de cellules DSM uniques de haute qualité.
La technique perforée de patch-clamp a été une approche électrophysiologique de pilier pendant plus d'un quart de siècle. Plusieurs publications fournissent des détails sur les considérations techniques69,70,71,72,73. La perforation cellulaire peut être obtenue avec de l'amphotéricine-B, de la nystatine, de la gramicidine ou de l'escine (voir référence32pour une vue d'ensemble de chacun). Le principal avantage des enregistrements perforés de patch-clamp par rapport à d'autres approches électrophysiologiques est que l'environnement intracellulaire indigène - y compris le Ca intracellulaire2 ans et pluset les molécules de signalisation (p. ex. cAMP, PKA, phosphates et phosphodiesterases) - sont conservées. Cette technique est donc idéalepour étudier les courants des canaux ioniques à cellules entières et leurs mécanismes de régulation dans des conditions physiologiques proches. Une mise en garde clé est que la composition cellulaire intracellulaire ne peut pas être contrôlée avec précision contrairement à d'autres méthodes électrophysiologiques telles que les enregistrements conventionnels à cellule entière et à un seul canal (à l'intérieur et à l'extérieur). Dans notre expérience, trois facteurs contribuent systématiquement aux résultats expérimentaux réussis des expériences de patch-clamp amphotericin-B-perforated. La première est la qualité de la cellule DSM choisie pour tenter un enregistrement. Lorsque les cellules DSM sont très viables affichant un semi-contractile (serpentine-like), l'aspect brillant à contraste élevé avec un halo bien défini autour de la surface cellulaire et attacher étroitement au fond de verre de la chambre d'enregistrement, puis la formation giga-scelle et la perforation cellulaire se produisent relativement facile. Les deuxième et troisième facteurs de réussite, respectivement, sont liés à la qualité de la source et à la solubilisation de l'amphotéricine-B (dans le sulfoxide de diméthyle/DMSO et la solution intracellulaire de pipette). Nous avons observé des écarts entre les différents fournisseurs en termes de source et de variations de lot. Chaque jour, nous préparons une nouvelle solution de solution de stock d'amphotéricine-B à partir de poudre suivie de sa dilution dans la solution de pipette intracellulaire. Ces étapes nécessitent une sonication et un tourbillon sélifiants étendus. Avec la solution de pipette fraîchement faite d'amphotéricine-B-contenante, perforation réussie de cellules (<50 MΩ) following giga-seal formation can be usually obtained within 30 min. The concentration of amphotericin-B in the pipette solution also requires optimization dependent on the amphotericin-B lot and source. Under our experimental conditions, the final amphotericin-B concentrations in the pipette range from 200 to 500 µg/mL. Since amphotericin-B exhibits light sensitivity, its solutions need to be kept in the dark. Using the amphotericin-B perforated patch-clamp technique, our group recorded voltage-step induced K mω)="" following="" giga-seal="" formation="" can="" be="" usually="" obtained="" within="" 30="" min.="" the="" concentration="" of="" amphotericin-b="" in="" the="" pipette="" solution="" also="" requires="" optimization="" dependent="" on="" the="" amphotericin-b="" lot="" and="" source.="" under="" our="" experimental="" conditions,="" the="" final="" amphotericin-b="" concentrations="" in="" the="" pipette="" range="" from="" 200="" to="" 500="" µg/ml.="" since="" amphotericin-b="" exhibits="" light="" sensitivity,="" its="" solutions="" need="" to="" be="" kept="" in="" the="" dark.="" using="" the="" amphotericin-b="" perforated="" patch-clamp="" technique,="" our="" group="" recorded="" voltage-step="" induced="">+, Ca2 ans et plus, et les courants de cation non sélectifs provenant de cellules DSM humaines, cobayes, souris et/ou rats17,21,22,23,29,30,31,35,60. Ici, nous décrivons des conditions pour enregistrer les courants non sélectifs de cation dans les cellules humaines de DSM. 9-Phenanthrol, un bloqueur des canaux TRPM4, a atténué les courants induits par la tension-étape soutenant le rôle de ces canaux dans le contrôle de l'excitabilité d'Escitabilité de DSM. Comme note, il exige habituellement au moins 45 min après obtention d'un giga-sceau et l'initiation de la perforation pour enregistrer les courants de cation non sélectifs induits par tension-étape stable optimale. Les rampes de tension peuvent également être utilisées comme alternative aux protocoles de tension-étape30,64. Ici, un protocole de tension-étape d'un potentiel de membrane de fixation hyperpolarized a été préféré plutôt qu'un protocole de rampe puisque l'ancienne approche minimise l'effet de l'inactivation tension-dépendante et permet la moyenne du courant évoqué sur une durée d'une étape de tension où la rampe fournit un point de données unique par tension. Ce dernier point s'applique particulièrement aux cellules DSM humaines car les courants montrent une activité variable pendant les étapes de tension (Figure 5EtFigure 6). La technique de pince à patch perforée par amphotéricine-B a été essentielle pour identifier les propriétés des cellules DSM et d'autres types de cellules et continuera d'aider à fournir de nouvelles découvertes à l'avenir. En outre, les cellules DSM simples fraîchement isolées peuvent être utilisées avec succès pour mesurer la+Cl-, et Ca2 ans et pluscourants avec le mode conventionnel de la technique de patch-clamp, l'enregistrement potentiel de membrane avec la pince courante, et les enregistrements de canal simple comme illustré par nos rapports précédents23,29,35,64.
En plus des méthodes de pince à patch à cellule unique, les cellules DSM fraîchement isolées peuvent être étudiées avec d'autres approches techniques, y compris l'imagerie Ca2, RT-PCR/q-RT-PCR, l'immunocytochimie, l'analyse de la ligature de proximité in situ et les approches génomiques (p. ex. microarray, ARN-seq, CHIP-seq)15,18,30,33,34. Comme les méthodes de détermination de transcriptome d'une seule cellule continuent d'évoluer et de devenir très sensibles, nous envisageons dans une capacité future de lier systématiquement et spécifiquement les propriétés électriques ou pharmacologiques des cellules DSM individuelles avec leurs profils de transcriptome/protéome. Ceci sera réalisé en enregistrant d'abord à partir d'une cellule DSM, puis en extrayant l'ARNm ou la protéine suivie d'analyses transcriptomiques/protéomiques. Bien que de telles méthodes aient déjà été testées dans des cellules non DSM, elles sont actuellement techniquement difficiles, manquent de sensibilité pour être considérées comme routinières, et se limitent à la détection réussie de quelques produits génétiques sélectionnés74. L'expression de profil fonction-moléculaire liant des études une fois faite sur des cellules de DSM obtenues des réservoirs urinaires dérivés du contrôle et des patients-donneurs malades fournira des perspicacités dans les processus physiologiques essentiels pour conduire les fonctions normales de DSM, la pathogénie, et dans l'identification des approches thérapeutiques nouvelles efficaces.
Déclarations de divulgation
Aucun.
Remerciements
Ce travail a été soutenu par des subventions NIH-R01DK106964 et P20DK123971 à Georgi V. Petkov. Les auteurs remercient le Dr Viktor Yarotskyy et Mme Sarah Maxwell pour l'évaluation critique du manuscrit. Nous sommes également reconnaissants aux chirurgiens du personnel d'urologie du MUSC et de l'UTHSC : les Drs Thomas Keane, Harry Clarke, Stephen Savage, Ross Rames, Sandip Prasad, Jonathan Picard, Christopher Ledbetter et Anthony Patterson, ainsi que les résidents du MUSC et de l'UTHSC en urologie : les Drs Taylor Vaughan, Samuel Walker Nickles, Matthew Young, Erin Burns, Justin Ellett, Ryan Levey, Austin Younger, Mark Currin, Nima Baradaran, Olugbemisola McCoy, Tracy Tipton, Bryce Wyatt, Alyssa Greiman, Sarah Starosta, Aaron Bloch, Christine Callaway, Lucille Cox, Christian Dewan, Erin Heitman, Bradley Houston, Stephen Legg, Robert S. Libby, Cole Locklear, Kristen Marley, Monica O'Hanlon, Patrick Probst, Cynthia Sharadin, Elizabeth Tourville, Daniel Zapata pour leur aide avec la collecte de tissus humains.
matériels
| Name | Company | Catalog Number | Comments |
| 5 ml polystyrene round-bottom tube | Falcon | 352054 | Tubes for DS containing enzymes used in digestion steps |
| 9-Phenanthrol | Sigma-Aldrich | 211281 | TRPM4 channel inhibitor |
| Amphotericin-B | Fisher | BP928-250 | Used for patch/cell perforation |
| Amphotericin-B | European Pharmacopoeia Reference Standards | 5 | Used for patch/cell perforation |
| Amphotericin-B | Sigma-Aldrich | A9528-100MG | Used for patch/cell perforation |
| Analog vortex mixer | VWR | 58816-121 | |
| Aspartic acid | Sigma-Aldrich | A9006 | Intracellular pipette solution |
| Bovine serum albumin | Sigma-Aldrich | A7906 | DS |
| CaCl2 | Sigma-Aldrich | C1016 | Extracellular solution and DS |
| Capillary Glass | Sutter | BF150-110-7.5 | Capillary for preparation of pulled patch electrodes |
| Cesium hydroxide hydrate | Sigma-Aldrich | C8518 | Intracellular pipette solution |
| Clampex ver. 10 software includes data acqusition (Clampex) and analysis (Clampfit) programs | Axon Instruments/ Molecular Devices | pCLAMP-10 | Commerical software and part of patch-clamp rig setup |
| Collagenase type 2 | Worthington Biochemical Corporation | LS004177 | DS-C |
| CsCl | Sigma-Aldrich | 203025 | Extracellular and intracellular solutions |
| Dental wax | Miltex Dental Wax Technologies, Inc. | 18058351 | |
| Digital Thermometer with Probe | Fisher Scientific | 15-077-32 | Placed in tissue bath to monitor temperature |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2650 | Solvent |
| DL-Dithiothreitol (DDT) | Sigma-Aldrich | D9779 | Reducing agents used together with Papain |
| EGTA | Sigma-Aldrich | E3889 | Ca2+ chelator, used in intracellular pipette solution |
| Flaming/Brown micropipette puller | Sutter | P-97 | Required to pull electrodes with very fine tips |
| Floating foam tube rack/holder | VWR Scientific | 82017-634 | Used for holding tubes with enzymes for temperature control |
| Glucose | Sigma | G8270 | |
| Glutamic acid (Na salt) | Sigma-Aldrich | G1626 | DS |
| HEPES | Sigma-Aldrich | H3375 | pH Buffer |
| KCl | Fisher Scientific | BP366-1 | Extracellular solution |
| Low Noise Data Acquisition System | Axon Instruments/ Molecular Devices | Digidata 1440A | Part of patch-clamp rig setup |
| Magnetic stirrer | VWR | 01-442-684 | |
| MgCl2 (hexahydrate) | Sigma-Aldrich | M2670 | Extracellular and intracellular solutions |
| MicroForge | Narishige | MF-830 | Used for fire-polishing electrodes |
| NaCl | Sigma-Aldrich | S7653 | Extracellular and intracellular solutions |
| NaOH | Sigma-Aldrich | S8045 | |
| Nifedipine | Sigma-Aldrich | N7634 | L-type voltage-gated Ca2+ channel blocker |
| Nikon inverted microscope, TS100 with T1-SM stage with 5x, 10x, 20x, and 40x objectives | Nikon | Discontinued | Part of Patch-clamp rig setup |
| Non-metalic syringe needle, MicroFil | WPI | MF-34G-5 | Filling of intracellular pipette solution |
| Papain | Worthington Biochemical Corporation | LS003126 | DS-P |
| Pasteur pipette | FisherBrand | 13-678-20A | Tips are broken off and fire-polished and used for titration of enzymatically treated tissues to release single DSM cells from pieces |
| Patch-clamp amplifier | Axon Instruments/ Molecular Devices | Axon Axopatch 200B | Part of patch-clamp rig setup |
| PC computer | DELL | Custom configuration | Part of patch-clamp rig setup |
| pH Meter | Aspera Instruments | PH700 | |
| Polyethylene tubing | Intramedic | 427-436 | Tubing for superfusion of extracellular bath connected to glass-bottom recording chamber |
| Tetraethylammonium chloride | Sigma-Aldrich | T2265 | Ion channel blocker of Kv and BK channels added to the extracellular bath solution |
| Thermo Scientific Precision shaking water bath (model 2870) | Thermo Scientific | Discontinued | Water bath for temperature control of enzymatic digestion employed as an alternative to tissue chamber-circulating bath setup |
| Tissue bath, 100 mL | Radnoti | 1583-101 | Connected to a circulating bath and filled with water, tubes with DS and DSM pieces are placed in the setup to control the temperature of digestion steps |
| Vinyl tubing | ColePalmer | 06405-3 | Multiple uses including for connecting tissue bath to circulating water bath |
| Water circulator bath, Haake D1 L | Haake | Discontinued | Connected to tissue bath |
| Weighting scale | Mettler Toledo | XS64 | |
| ZeissAxiovert 40C inverted microscope with 10x and 40x objectives | Carl-Zeiss | Discontinued | Part of patch-clamp rig setup |
Références
- Andersson, K. E., Arner, A. Urinary bladder contraction and relaxation: physiology and pathophysiology. Physiological Reviews. 84 (3), 935-986 (2004).
- Brading, A. F., Brain, K. L., Andersson, K. E., Michel, M. C. Ion channel modulators and urinary tract function. Urinary Tract. 202, 375-393 (2011).
- Brading, A. F. Spontaneous activity of lower urinary tract smooth muscles: correlation between ion channels and tissue function. Journal of Physiology. 570, 13-22 (2006).
- Brading, A. F., Heaton, J. P., Hashitani, H. A survey of commonalities relevant to function and dysfunction in pelvic and sexual organs. International Journal of Impotence Research. 20 (1), 1-16 (2008).
- Petkov, G. V. Role of potassium ion channels in detrusor smooth muscle function and dysfunction. Nature Reviews Urology. 9 (1), 30-40 (2012).
- Andersson, K. E. Treatment-resistant detrusor overactivity--underlying pharmacology and potential mechanisms. International Journal of Clinical Practice Supplement. 151, 8-16 (2006).
- Sui, G. P., Wu, C., Fry, C. H. The electrophysiological properties of cultured and freshly isolated detrusor smooth muscle cells. Journal of Urology. 165 (2), 627-632 (2001).
- Kropp, B. P., et al. Characterization of cultured bladder smooth muscle cells: assessment of in vitro contractility. Journal of Urology. 162 (5), 1779-1784 (1999).
- Bonev, A., Isenberg, G. Arginine-vasopressin induces mode-2 gating in L-type Ca2+ channels (smooth muscle cells of the urinary bladder of the guinea-pig). Pflügers Archive - European Journal of Physiology. 420 (2), 219-222 (1992).
- Schneider, P., Hopp, H. H., Isenberg, G. Ca2+ influx through ATP-gated channels increments [Ca2+]i and inactivates ICa in myocytes from guinea-pig urinary bladder. Journal of Physiology. 440, 479-496 (1991).
- Wellner, M. C., Isenberg, G. Properties of stretch-activated channels in myocytes from the guinea-pig urinary bladder. Journal of Physiology. 466, 213-227 (1993).
- Wellner, M. C., Isenberg, G. Stretch-activated nonselective cation channels in urinary bladder myocytes: importance for pacemaker potentials and myogenic response. Experientia Supplementum. 66, 93-99 (1993).
- Klockner, U., Isenberg, G. Action potentials and net membrane currents of isolated smooth muscle cells (urinary bladder of the guinea-pig). Pflügers Archive - European Journal of Physiology. 405 (4), 329-339 (1985).
- Moore, E. D., et al. Organization of Ca2+ release units in excitable smooth muscle of the guinea-pig urinary bladder. Biophysical Journal. 87 (3), 1836-1847 (2004).
- Hristov, K. L., Chen, M., Kellett, W. F., Rovner, E. S., Petkov, G. V. Large conductance voltage- and Ca2+-activated K+ channels regulate human detrusor smooth muscle function. American Journal of Physiology - Cell Physiology. 301 (4), 903-912 (2011).
- Afeli, S. A., Rovner, E. S., Petkov, G. V. SK but not IK channels regulate human detrusor smooth muscle spontaneous and nerve-evoked contractions. American Journal of Physiology - Renal Physiology. 303 (4), 559-568 (2012).
- Hristov, K. L., et al. Kv2.1 and electrically silent Kv channel subunits control excitability and contractility of guinea pig detrusor smooth muscle. American Journal of Physiology - Cell Physiology. 302 (2), 360 (2012).
- Afeli, S. A., Malysz, J., Petkov, G. V. Molecular expression and pharmacological evidence for a functional role of Kv7 channel subtypes in Guinea pig urinary bladder smooth muscle. PLoS One. 8 (9), 75875 (2013).
- Smith, A. C., et al. TRPM4 channel: a new player in urinary bladder smooth muscle function in rats. American Journal of Physiology - Renal Physiology. 304 (7), 918-929 (2013).
- Smith, A. C., et al. Novel role for the transient potential receptor melastatin 4 channel in guinea pig detrusor smooth muscle physiology. American Journal of Physiology - Cell Physiology. 304 (5), 467 (2013).
- Hristov, K. L., Smith, A. C., Parajuli, S. P., Malysz, J., Petkov, G. V. Large-conductance voltage- and Ca2+-activated K+ channel regulation by protein kinase C in guinea pig urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 306 (5), 460-470 (2014).
- Hristov, K. L., et al. Novel regulatory mechanism in human urinary bladder: central role of transient receptor potential melastatin 4 channels in detrusor smooth muscle function. American Journal of Physiology - Cell Physiology. 310 (7), 600-611 (2016).
- Malysz, J., Afeli, S. A., Provence, A., Petkov, G. V. Ethanol-mediated relaxation of guinea pig urinary bladder smooth muscle: involvement of BK and L-type Ca2+ channels. American Journal of Physiology - Cell Physiology. 306 (1), 45-58 (2014).
- Montgomery, B. S., Fry, C. H. The action potential and net membrane currents in isolated human detrusor smooth muscle cells. Journal of Urology. 147 (1), 176-184 (1992).
- Parajuli, S. P., Soder, R. P., Hristov, K. L., Petkov, G. V. Pharmacological activation of small conductance calcium-activated potassium channels with naphtho[1,2-d]thiazol-2-ylamine decreases guinea pig detrusor smooth muscle excitability and contractility. Journal of Pharmacology and Experimental Therapeutics. 340 (1), 114-123 (2012).
- Heppner, T. J., Bonev, A. D., Nelson, M. T. Ca2+-activated K+ channels regulate action potential repolarization in urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 273 (1), 110-117 (1997).
- Petkov, G. V., Nelson, M. T. Differential regulation of Ca2+-activated K+ channels by beta-adrenoceptors in guinea pig urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 288 (6), 1255-1263 (2005).
- Herrera, G. M., Etherton, B., Nausch, B., Nelson, M. T. Negative feedback regulation of nerve-mediated contractions by KCa channels in mouse urinary bladder smooth muscle. American Journal of Physiology - Regulatory Integrative Comparative Physiology. 289 (2), 402-409 (2005).
- Malysz, J., Rovner, E. S., Petkov, G. V. Single-channel biophysical and pharmacological characterizations of native human large-conductance calcium-activated potassium channels in freshly isolated detrusor smooth muscle cells. Pflügers Archive - European Journal of Physiology. 465 (7), 965-975 (2013).
- Provence, A., Angoli, D., Petkov, G. V. Kv7 channel pharmacological activation by the novel activator ML213: role for heteromeric Kv7.4/Kv7.5 channels in guinea pig detrusor smooth muscle function. Journal of Pharmacology and Experimental Therapeutics. 364 (1), 131-144 (2018).
- Parajuli, S. P., et al. Control of urinary bladder smooth muscle excitability by the TRPM4 channel modulator 9-phenanthrol. Channels (Austin). 7 (6), 537-540 (2013).
- Ishibashi, H., Moorhouse, A. J., Nabekura, J., Okada, Y. Perforated whole-cell patch-clamp technique: a user's guide. Patch Clamp Techniques: From Beginning to Advanced Protocols. 4, 71-83 (2012).
- Provence, A., Rovner, E. S., Petkov, G. V. Regulation of transient receptor potential melastatin 4 channel by sarcoplasmic reticulum inositol trisphosphate receptors: Role in human detrusor smooth muscle function. Channels (Austin). 11 (5), 459-466 (2017).
- Hristov, K. L., et al. Suppression of human detrusor smooth muscle excitability and contractility via pharmacological activation of large conductance Ca2+-activated K+ channels. American Journal of Physiology - Cell Physiology. 302 (11), 1632-1641 (2012).
- Xin, W., Soder, R. P., Cheng, Q., Petkov, G. V. Inhibition of phosphodiesterases relaxes detrusor smooth muscle via activation of the large conductance voltage- and Ca2+-activated K+ channel. American Journal of Physiology - Cell Physiology. 302 (9), 1361-1370 (2012).
- Hristov, K. L., et al. Neurogenic detrusor overactivity is associated with decreased expression and function of the large conductance voltage- and Ca2+-activated K+ channels. PLoS One. 8 (7), 68052 (2013).
- Hristov, K. L., Parajuli, S. P., Provence, A., Rovner, E. S., Petkov, G. V. Nongenomic modulation of the large conductance voltage- and Ca2+-activated K+ channels by estrogen: A novel regulatory mechanism in human detrusor smooth muscle. Physiological Reports. 5 (14), (2017).
- Parajuli, S. P., et al. Functional link between muscarinic receptors and large-conductance Ca2+ -activated K+ channels in freshly isolated human detrusor smooth muscle cells. Pflügers Archiv - European Journal of Physiology. 467 (4), 665-675 (2015).
- Malysz, J., Rovner, E. S., Petkov, G. V. Single-channel biophysical and pharmacological characterizations of native human large-conductance calcium-activated potassium channels in freshly isolated detrusor smooth muscle cells. Pflügers Archiv - European Journal of Physiology. 465 (7), 965-975 (2013).
- Thorneloe, K. S., Nelson, M. T. Properties of a tonically active, sodium-permeable current in mouse urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 286 (6), 1246-1257 (2004).
- Barry, M. J., et al. The American Urological Association symptom index for benign prostatic hyperplasia. The Measurement Committee of the American Urological Association. Journal of Urology. 148 (5), 1549-1557 (1992).
- Klockner, U., Isenberg, G. Calcium currents of cesium loaded isolated smooth muscle cells (urinary bladder of the guinea pig). Pflügers Archiv - European Journal of Physiology. 405 (4), 340-348 (1985).
- Klockner, U., Isenberg, G. Tiapamil reduces the calcium inward current of isolated smooth muscle cells. Dependence on holding potential and pulse frequency. European Journal of Pharmacology. 127 (3), 165-171 (1986).
- Weidelt, T., Isenberg, G. Augmentation of SR Ca2+ release by rapamycin and FK506 causes K+-channel activation and membrane hyperpolarization in bladder smooth muscle. British Journal of Pharmacology. 129 (7), 1293-1300 (2000).
- Inoue, R., Brading, A. F. The properties of the ATP-induced depolarization and current in single cells isolated from the guinea-pig urinary bladder. British Journal of Pharmacology. 100 (3), 619-625 (1990).
- Inoue, R., Brading, A. F. Human, pig and guinea-pig bladder smooth muscle cells generate similar inward currents in response to purinoceptor activation. British Journal of Pharmacology. 103 (4), 1840-1841 (1991).
- Nakayama, S., Brading, A. F. Possible contribution of long open state to noninactivating Ca2+ current in detrusor cells. American Journal of Physiology - Cell Physiology. 269 (1), 48-54 (1995).
- Nakayama, S., Brading, A. F. Interaction of Ca2+ agonist and depolarization on Ca2+ channel current in guinea pig detrusor cells. Journal of General Physiology. 106 (6), 1211-1224 (1995).
- Gallegos, C. R., Fry, C. H. Alterations to the electrophysiology of isolated human detrusor smooth muscle cells in bladder disease. Journal of Urology. 151 (3), 754-758 (1994).
- JournalFry, C. H., Gallegos, C. R., Montgomery, B. S. The actions of extracellular H+ on the electrophysiological properties of isolated human detrusor smooth muscle cells. Journal of Physiology. 480, 71-80 (1994).
- Sui, G. P., Wu, C., Fry, C. H. A description of Ca2+ channels in human detrusor smooth muscle. BJU International Journal. 92 (4), 476 (2003).
- Wu, C., Sui, G., Fry, C. H. The role of the L-type Ca2+ channel in refilling functional intracellular Ca2+ stores in guinea-pig detrusor smooth muscle. Journal of Physiology. 538, 357-369 (2002).
- Bonev, A. D., Nelson, M. T. Muscarinic inhibition of ATP-sensitive K+ channels by protein kinase C in urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 265 (6), 1723-1728 (1993).
- Bonev, A. D., Nelson, M. T. ATP-sensitive potassium channels in smooth muscle cells from guinea pig urinary bladder. American Journal of Physiology - Cell Physiology. 264 (5), 1190-1200 (1993).
- Petkov, G. V., Heppner, T. J., Bonev, A. D., Herrera, G. M., Nelson, M. T. Low levels of KATP channel activation decrease excitability and contractility of urinary bladder. American Journal of Physiology - Regulatory Integrative Comparative Physiology. 280 (5), 1427-1433 (2001).
- Shieh, C. C., et al. Functional implication of spare ATP-sensitive K+ channels in bladder smooth muscle cells. Journal of Pharmacology and Experimental Therapeutics. 296 (3), 669-675 (2001).
- Shieh, C. C., et al. Characterization of a novel ATP-sensitive K+ channel opener, A-251179, on urinary bladder relaxation and cystometric parameters. British Journal of Pharmacology. 151 (4), 467-475 (2007).
- Petkov, G. V., et al. Beta1-subunit of the Ca2+-activated K+ channel regulates contractile activity of mouse urinary bladder smooth muscle. Journal of Physiology. 537, 443-452 (2001).
- Thorneloe, K. S., Nelson, M. T. Properties and molecular basis of the mouse urinary bladder voltage-gated K+ current. Journal of Physiology. 549, 65-74 (2003).
- Hristov, K. L., et al. Stimulation of beta3-adrenoceptors relaxes rat urinary bladder smooth muscle via activation of the large-conductance Ca2+-activated K+ channels. American Journal of Physiology - Cell Physiology. 295 (5), 1344-1353 (2008).
- Layne, J. J., Nausch, B., Olesen, S. P., Nelson, M. T. BK channel activation by NS11021 decreases excitability and contractility of urinary bladder smooth muscle. American Journal of Physiology - Regulatory Integrative Comparative Physiology. 298 (2), 378-384 (2010).
- Lee, H., Koh, B. H., Peri, L. E., Sanders, K. M., Koh, S. D. Functional expression of SK channels in murine detrusor PDGFRalpha+ cells. Journal of Physiology. 591 (2), 503-513 (2013).
- Lee, H., et al. Premature contractions of the bladder are suppressed by interactions between TRPV4 and SK3 channels in murine detrusor PDGFRalpha+ cells. Scientific Reports. 7 (1), 12245 (2017).
- Yarotskyy, V., Malysz, J., Petkov, G. V. Properties of single channel and whole-cell Cl- currents in guinea pig detrusor smooth muscle cells. American Journal of Physiology - Cell Physiology. 316 (5), 698-710 (2019).
- Driska, S. P., Porter, R. Isolation of smooth muscle cells from swine carotid artery by digestion with papain. American Journal of Physiology - Cell Physiology. 251 (3), 474-481 (1986).
- Seltzer, J. L., Welgus, H. G., Jeffrey, J. J., Eisen, A. Z. The function of Ca2+ in the action of mammalian collagenases. Archives of Biochemistry and Biophysics. 173 (1), 355-361 (1976).
- Skelton, G. S. Papaya proteinases. I. Temperature-and pH-stability curves. Enzymologia. 35 (5), 270-274 (1968).
- Petrova, D., Derekova, A., Vlahov, S. Purification and properties of individual collagenases from Streptomyces sp. strain 3B. Folia Microbiologica (Praha). 51 (2), 93-98 (2006).
- Sharpe, E. J., St Clair, J. R., Proenza, C. Methods for the isolation, culture, and functional characterization of sinoatrial node myocytes from adult mice. Journal of Visualized Experiments. (116), (2016).
- Brueggemann, L. I., Mani, B. K., Haick, J., Byron, K. L. Exploring arterial smooth muscle Kv7 potassium channel function using patch clamp electrophysiology and pressure myography. Journal of Visualized Experiments. (67), e4263 (2012).
- Jarriault, D., Grosmaitre, X. Perforated patch-clamp recording of mouse olfactory sensory neurons in intact neuroepithelium: functional analysis of neurons expressing an identified odorant receptor. Journal of Visualized Experiments. (101), e52652 (2015).
- Rae, J., Cooper, K., Gates, P., Watsky, M. Low access resistance perforated patch recordings using amphotericin B. Journal of Neuroscience Methods. 37 (1), 15-26 (1991).
- Knutson, K., et al. Whole cell electrophysiology of primary cultured murine enterochromaffin cells. Journal of Visualized Experiments. (139), (2018).
- Devienne, G., Le Gac, B., Piquet, J., Cauli, B. Single cell multiplex reverse transcription polymerase chain reaction after patch-clamp. Journal of Visualized Experiments. (136), (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon