Method Article
制备和利用新鲜分离的人类分离器平滑肌细胞,用于9-苯酚敏感阳离子电流的表征
摘要
我们描述了一种从人类膀胱标本中制备单一新分离的分离性肌细胞的方法,采用两步酶程序。获得可行的DSM细胞可以通过各种单细胞技术进行研究,包括所述的amphotericin-B贴片-钳电生理学,以揭示生理和药理特性。
摘要
膀胱壁内的缓除肌平滑肌(DSM)细胞最终促进尿液储存和排空。制备可行、新鲜和分离的DSM细胞是一项重要的技术挑战,其成果为后续的功能和分子研究提供了最佳细胞。本文开发和阐述的方法,由我们小组成功使用十多年,描述了从开放膀胱手术中获得的人类膀胱标本的解剖,然后对DSM片件进行酶式两步处理和机械三聚获得新鲜分离的DSM细胞。第一步是解剖,将DSM层(也称为肌肉体)从粘管(尿毒症、拉米纳皮面和肌肉粘管)和相邻的连接、血管和脂肪组织中分离出来。然后,DSM 在标称 Ca2+包含解剖/消化溶液 (DS) 中切成片(2-3 mm x 4-6 mm)。下一步是在+37°C下,用含有木瓜蛋白和胶原酶的DS单独转移到并依次处理,每步30-45分钟。在用含有无酶牛血清的DS进行乳液和用火抛光移液器进行三聚体处理后,这些碎片释放出单个DSM细胞。新鲜分离的 DSM 细胞非常适合对电通道进行贴片夹电生理和药理表征。具体来说,我们表明TRPM4通道阻滞剂9-phenanthrol减少了电压步进引起的阳离子电流记录与安培林-B穿孔贴片夹方法。DSM 细胞也可以通过其他技术进行研究,如单细胞RT-PCR、微阵列分析、免疫细胞化学、原位接近结扎测定和Ca2+成像。利用单个 DSM 细胞的主要优点是所观察到的与显示的单细胞特性直接相关。对新鲜分离的人类DSM细胞的研究提供了重要的见解,揭示了各种离子通道(包括膀胱中的可渗透的阳离子)的特性,并将继续作为阐明DSM细胞特性和监管机制的黄金标准。
引言
去向肌平滑肌(DSM)细胞构成膀胱中最丰富的细胞类型,最终分别通过放松和收缩控制尿液储存和排空。DSM细胞形成平滑的肌肉束,与相邻的结缔组织、神经过程、间质细胞和其他细胞类型1交织在一起。目前对DSM细胞在膀胱功能中的作用的理解是通过多层次的集成方法实现的。每种实验方法——无论是基于体外分离的单细胞、体外/体外平滑肌肉束的组织条,还是体内测定(如细胞学和排空功能评估)——都为DSM的生理和药理特性提供了重要而具体的见解(详情请参阅评论1、2、3、4、5、6)。然而,对从分离的单细胞获得的结果的解释允许将结论具体归因于单个细胞类型本身。这一认识是建立可靠和可重复的方法,从整个厚度膀胱标本获得新鲜分离的DSM细胞的驱动力。与许多其他细胞类型不同,平滑肌细胞由于失去其原生表型(包括其电生理和收缩特性的特异性变化)而无法可靠地培养。这一事实进一步强化了对生理活性新分离的DSM细胞进行研究的重要性。
在20世纪80年代末和90年代初,伊森伯格的研究小组(德国)发表了一系列电生理学研究,研究从豚鼠膀胱9、10、11、12、13(表1)中新分离的DSM细胞。该方法强调了两个重要观察结果,这两个观察方法有助于获得重要的细胞,并作为其他人应遵循的初始指南。在酶治疗之前,用Ca2+无溶液/介质预处理分离的DSM片件,2)使用含有胶原酶的溶液进行组织消化。这两个关键步骤已纳入DSM细胞分离程序的所有后续变体中(表1)。目前,我们集团采用两步顺序木瓜蛋白-胶原酶解离方法。DSM 片首先使用含有木瓜的酶溶液进行处理,然后用胶原酶 II 型在同一溶液中溶解(DS、解剖/消化溶液)。这种方法产生来自各种物种的单一DSM细胞,包括豚鼠、猪、大鼠、小鼠,以及重要的人类(表1)。
单DSM细胞为多种分子生物学和生理实验提供了来源。到目前为止,用免疫细胞化学研究了蛋白质和mRNA表达, 或RT-PCR/qRT-PCR测定揭示了各种电通道的高检测水平,包括大电导电压和Ca2+-激活(BK)、小电导Ca2+-激活K+类型3(SK3)、电压门K+(K v)、L型电压门控Ca2+(Ca v)和瞬态受体电位麦莱他素4型(TRPM4)通道14,15,16,17,18,19,20,21,22 。它们都被认为控制DSM兴奋性、细胞内Ca2+水平和收缩性。修补钳电生理方法,直接在豚鼠、小鼠、大鼠或人类DSM细胞上执行,直接演示了L型Cav、K v(Kv2.x.Kv7)、SK、BK和TRPM4通道17、19、20、21、22、23、24、25的生物物理和药理特性,26,27,28,29,30,31。这些方法包括传统的全单元电压夹、穿孔电压夹和单通道记录(单元连接、内向和外出配置)。此外,使用电流钳对DSM进行膜电位记录提供了证据,证明靶向作用药理剂会改变细胞的兴奋性。例如,从人类、豚鼠和大鼠膀胱19、20、22、31获得的DSM细胞中的TRPM4抑制剂9-phenanthrol诱导超极化。在各种电生理方法中,五聚他林-B(和尼他汀、克霉素和β-escin)穿孔贴片夹记录通过保留细胞内固有的信号分子和通路提供了关键优势。只有低分子量阳离子和在较小程度上,Cl- - 但不是蛋白质或信号分子,包括Ca2+-渗透通过血浆膜孔形成五氯霉素-B或尼他汀32。穿孔贴片夹实验的成功结果取决于此技术特有的几个一般变量。在这里,我们描述了我们小组在15年、22年、33年、34年、35年、36年、37年、38年、39年成功使用amphotericin-B的程序的细节。
可以说,非选择性阳离子通道仍然是DSM细胞中最不为人所知的通道类型之一。非选择性阳离子通道的第一个报告可追溯到 1993 年。Wellner 和 Isenberg11的论文描述了一个 33 pS 拉伸激活的单通道,显示离子渗透性的以下排名顺序:K=>Na=> >> Ba 2 = > Ca2+,以及由 Gd3+抑制通道活性,这是非选择性阳离子通道的一般抑制剂。近十年后,Thorneloe和Nelson40使用全细胞记录描述了小鼠DSM细胞中的Na+渗透阳离子电流,Gd3+抑制了。由于非选择性阳离子通道的分子特性及其生物物理特征仍有待确定,因此有必要在此研究领域开展未来的研究。本文描述的用于记录非选择性阳离子通道电流的协议- 使用含有Cs+、TEA+和nifedipine的细胞外和移液器细胞内溶液(表2),在生理和药理上缓解Kv和Cav电流——已经并将继续在非选择性阳离子通道的电生理研究中有用。我们利用这个特定的协议来确定在豚鼠、大鼠和人类DSM细胞19、20、22中TRPM4通道阻滞剂9-phenanthrol抑制全细胞阳离子电流的程度。
综上所述从人类膀胱中获取新鲜分离的单 DSM 细胞的方法提供了非常适用于电生理研究的活细胞,使用贴片夹技术、Ca2+-成像、免疫细胞化学、原位近端诉讼测定、单细胞 RT-PCR/qRT-PCR 以及包括微阵列分析、RNA-seq 和 CHIP-sq 在内的高级分子生物学技术。与其他配置不同,使用 amphotericin-B 穿孔贴片夹法可保留本机单元环境。当使用此处概述的特定条件进行时,旨在抵消 DSM 电池中 K+和 Ca2+电流的贡献时,电压步进感应电流显示适用于生物物理和药理表征的非选择性阳离子电流的特性。
研究方案
此处描述的所有方法均已获得田纳西大学健康科学中心(孟菲斯、田纳西州、IRB# 17-05714-XP)和南卡罗来纳医科大学(查尔斯顿,SC,IRB# 00045232)的机构审查委员会的批准。批准的程序允许从接受手术部分提取膀胱的患者-捐赠者那里采集全厚膀胱标本(>1 x x >1 cm) - 包含所有层,包括粘膜、脱氧核糖核合物平滑肌和血清,以及附着的血管和脂肪组织。患者捐赠者是成人(年龄范围研究到现在:25至87岁),男性或女性,有或没有过度活跃的膀胱症状(根据美国泌尿学协会I-PSS评分41分类)。外科手术涉及各种医疗条件,包括尿皮癌和腺癌的根囊切除术。在这种情况下,收集的膀胱标本远离肿瘤部位。
1. 解剖DSM组织和制备无粘部DSM片件
- 检查从手术室抵达实验室的整个厚度膀胱标本,在一个密封的容器中,装有冷解剖/消化溶液(图1和表2用于DS的组成)。
注:标本通常在抵达实验室前几个小时至一夜之间保存在冷DS中。对于更长的存储时间,DS(表 2) 辅以 1 mM CaCl2。 - 用冰冷的DS去除和冲洗人类整体厚度DSM标本(包含所有层,包括黏膜、DSM和serosa),以洗掉附着的碎片和血液。
- 将膀胱标本、粘膜朝上和下塞,固定在硅胶涂层(材料表)直径150毫米的圆形盘上,里面装满了冰冷的DS(图1B)。
- 使用微剪刀和钳子从标本中清除相邻的脂肪组织、血管、上皮(尿皮)和肌肉粘血。
- 切出几个不含粘的DSM片(+2-3毫米长,4-6毫米宽)(图1C)。
2. DSM 片段的酶分离,产生新鲜分离的单 DSM 细胞
- 将 3 至 6 块 DSM 片放入含有 1 至 2 mL 的预加热 (+37 °C) DS 的管中(DS-P,表 2),并在 DS-P 中孵育 DSM 片件 30-45 分钟,偶尔轻轻摇动管部(每 10-15 分钟一次)。
注:为了最佳控制酶处理的温度,将带有组织块和酶溶液的管子放置在玻璃组织室中,里面装满了与循环加热水浴相连的水(图1D)或高精度温控摇水浴(图1E)。 - 从管中取出 DS-P,用冰冷的 DS 短暂清洗 DSM 件,从管中丢弃冷 DS,使 DSM 件位于管的底部。
- 将1至2 mL含有DS的胶原酶II型(DS-C,表2)加入与DSM片管,轻轻混合;并在+37°C下孵育25-40分钟,偶尔轻轻摇动管(每10-15分钟)。
- 用冰冷的DS丢弃DS-C和洗酶处理的DSM片5-10次。
- 上次清洗后,将 DS 溶液留在管内;用火抛光的巴斯德移液器轻轻三聚,以释放单个 DSM 细胞。
- 在应用后至少 5 分钟后,将几滴含有分散的 DSM 细胞的 DS 溶液放入玻璃底室或盖玻片上,并在显微镜下目视检查质量(使用 20x 或 40x 物镜),使细胞能够粘附在底部。
- 立即使用新鲜分离的 DSM 细胞进行电生理学实验,或将细胞储存在含有 DS 的管中,在 +4 °C 的管中,或放在冰上或冰箱中,直到使用(通常长达 8 小时的制备)。
注:在相同的制剂中,细胞的质量从高度可行到过度消化、死亡的DSM细胞不等(图2)。当连续的木瓜蛋白-胶原酶方法产生大量无法存活的细胞时,制剂被丢弃,并进行新的DSM片段消化,但孵育间隔缩短。如果程序导致的DSM细胞太少,那么随后消化DSM片段,孵育间隔增加。对β-平滑肌动因的阳性免疫反应证实了DSM细胞的身份(图3)。
3. 使用安培林-B穿孔全电池电压贴片夹技术记录DSM电池的电压步进感应阳离子电流
- 将0.25-1 mL的细胞悬浮液放在玻璃底部室上,放在倒置显微镜的舞台上,使细胞粘附在玻璃底部。
- 孵育至少45分钟后,从浴缸中取出DS,用E溶液(表2)代替超聚液,其中溶液通过进气管的重力辅助,缓慢地用新溶液取代DS,而连接到真空废物容器的出口管将去除腔室溶液并防止溢出。请注意,E溶液含有四乙酸铵 (TEA+) 和镉 (C+) 离子来抑制 K+电流。
- 在二甲基亚硫酸盐(DMSO)中制备安培林-B的工作溶液(DMSO每10μL1毫克)。要完全溶解安培林粉,声波(至少15分钟)和涡旋溶液好。
注:此步骤通常需要不到 10 分钟。 在 1.5 mL 微离心管中溶解 30-40 μL DSMO 中的 3-4 mg 的安他林-B 效果良好。较高的二聚体-B需要更多的DSMO溶剂,通常会导致混合间隔较长,并且管中存在的环溶性B固体颗粒的溶解不完全。 - 在移液器溶液中溶解五氯环基乙的液溶液(溶液P,表2),以获得200-500μg/mL的最终浓度。此步骤要求在高速设置(8-10/10)下进行广泛的声波和涡旋,每步为±30至60分钟,以确保最佳的混合,并防止移液器溶液中的环热素-B沉淀形成。
注: 安非他林-B会沉淀过时间,并且对光敏感。含有安普霍瑞林-B的工作移液器溶液经检查溶解度,在移液器灌装前手工混合,并在黑暗中保存。 - 拉动多个贴片电极、防火电极尖端,以及(如果需要)用牙蜡涂覆牙尖。
- 将电极短暂浸入溶液中,用移液器溶液(溶液P,表2)填充贴片电极的尖端,而不使用五环球-B。
- 用含有五氯环基汞-B的相同移液器溶液回填电极。
- 将电极安装到连接到贴片夹放大器头级的支架上。
- 使用微操作器,将电极放在细胞外溶液表面正下方,以便电极尖端刚刚被淹没。
- 在电压夹紧模式下,将保持电位设置为 0 mV,并在商业放大器上的移液器偏移盘(材料表)将电流调整到 0 pA。
- 使用商业采集软件的膜测试窗口/功能(材料表)确定电极电阻。要激活,请单击"工具">膜测试>播放或软件中的快捷方式图标。确定的电极电阻应在 2 到 5 MΩ 的范围内。
注:在商业采集软件或放大器上的密封测试选项中提供的膜测试功能可用于通过重复应用电压步骤来监控电极电阻。 - 使用微操作器将电极推进到选定的 DSM 电池(图 4A)。 继续监测电极电阻。
注:要被视为可行的 DSM 细胞,该细胞必须显示主轴形状的细长形态、围绕细胞的清晰定义的光晕、脆的边缘和半收缩(蛇形)外观。 - 当用电极接触电池表面时(通过膜测试功能测量的电极电阻迅速增加表示)通过通过管向电极支架施加温和的快速负压,形成千兆密封。这导致在电极尖端产生负压,将细胞膜拉入电极,帮助电极与等离子膜形成千兆密封或非常紧密的接触(图4B)。
- 一旦千兆密封形成,通过调整商业放大器上的快速和慢速表盘来补偿移液器电容,并使用膜测试功能监控千兆密封稳定性(漏电流)。
- 留出时间(通常为 30-60 分钟)让 amphotericin-B 扩散到移液器中,并插入等离子膜中,形成主要选择性到单价阳离子的孔隙。在此步骤中,使用膜测试功能继续监控千兆密封。随着细胞穿孔的增加,电容瞬变的振幅(图4B与图4C分别显示无有效细胞穿孔)也随着膜测试功能的测量而增大。
- 当片片穿孔最佳时(由稳定串联电阻通常低于 50 MΩ 判断),通过调整放大器上的单元电容和串联电阻的拨盘来抵消电容瞬变。此时也可以执行串联电阻补偿 (图4D)。
- 一旦观察到指定协议引起的稳定电压步进诱导阳离子电流,应用化合物或生理条件通过超液测试,并记录控制、测试条件以及冲洗(如果可能)的响应( 如果可能)商业采购软件。
- 使用常规电压步进协议记录电流,该协议涉及将 DSM 电池保持在 -64 或 -74 mV,以 10 mV 的增量将电压以 10 mV 递进,从 -94 到 +96 或 +106 mV,并返回到保持电位。
注:根据液体结电位为 14 mV(使用 P 和 E 溶液,表 2) 调整膜电位值。通过单击(工具>结电位)并输入溶液电组分的浓度,在商业采集软件(材料表)中获得液体结电位。斜坡协议也可用于获取当前录像。 - 在实验记录电流期间,连续 ±1 分钟间隔运行电压协议,以便进行预加控制、测试条件和冲洗。
- 使用常规电压步进协议记录电流,该协议涉及将 DSM 电池保持在 -64 或 -74 mV,以 10 mV 的增量将电压以 10 mV 递进,从 -94 到 +96 或 +106 mV,并返回到保持电位。
4. 数据分析和可视化
- 通过单击File>打开数据并选择要打开的感兴趣文件,打开商业数据分析软件(材料表)中的记录文件,用于控制、测试条件和冲洗。
注: 对于分析,通常打开和分析每个条件的三个文件(每个文件包含一组到单个协议运行的跟踪)。随后对响应求平均值,以获得每个条件的平均响应。用于数据采集的软件包含一个选项,用于自动收集用户指定的多个测试运行,并为可用作替代的单个输出文件平均运行。 - 获取在每个电压下测量的电流轨迹的最后 200 毫秒的平均响应;选择的持续时间间隔反映了电压步速活化的稳定状态水平。为此,请按照以下步骤操作。
- 在商业分析软件(材料表)中选择一个感兴趣的文件进行分析。
注: 软件将最近导入的文件放入其活动显示窗口中。打开的文件显示一系列通过电压步长协议获得的重叠跟踪。默认情况下,在活动窗口中显示四个游标(显示突出显示的跟踪的 x 和 y 值)。 - 通过将光标 2 定位在 400 或 500 ms 电压步长末尾,将光标 1 定位到 200 ms 的间隔,从而将分析范围设置为 200 ms,选择分析范围。
- Obtain responses for each voltage by clicking Analyze>Quick Graph>IV (or the IV shortcut icon) (in the prompt window before generating data confirm that for y-axis (Current) signal Region options "Cursors 1..2" and "Mean" are selected).单击"确定"以生成I-V 图形,并将数据放入"结果"列表中,可通过访问Windows>结果来查看。
- 通过重复步骤 4.2.1 - 4.2.3 分析其他文件。单击"分析>快速图形>gt;GT;GT"或IV 图标快捷方式,选择"追加"而不是"替换",以在处理跟踪时向"结果"表添加其他数据。
- 通过选择感兴趣的列并按CTRL+C进行复制和按CTRL+V粘贴,将数据复制到电子表格。通过单击"文件>另存为",将结果工作表存储在商业分析软件(材料表)中(*.rlt)格式。
- 在商业分析软件(材料表)中选择一个感兴趣的文件进行分析。
- 对于每个单元,将所有三个条件的响应规范化为预加法控制的最大电压步长值(根据公式:响应/响应控制-Max),并将响应图形为电流(或电流密度)值与电压关系(图 6)。
- 在工作表处理器中,确定控制、测试条件(在此示例中为 9-phenanrol)的平均响应为控制、测试条件(在本示例中为 9-phenanrol)以及每个电压步骤的洗涤电流 (pA) 或电流密度 (pA/pF)。
- 将每个条件的每个电压(控制、9-phenanrol 和洗涤)的值除以在最高电压(图 6中为 +96 mV)处获得的最大控制响应,用于公式下的预加控制:条件(x) 的标准化响应 = 响应(x)/响应控制-最大值 (x)。
- 对于摘要分析,请将数据排列为易于复制到图形程序(例如图形板棱镜)以进行可视化的格式。
结果
DSM 片体的酶分离提供健康的新分离的 DSM 细胞,通常用于功能和分子研究,例如:贴片夹电生理学和免疫细胞化学。图 1总结了解剖步骤,并可视化了用于酶处理步骤温度控制的设置。图2显示了从三个人类膀胱标本中分别从不同的患者捐赠者获得的DSM细胞的明亮场图像。健康的单个 DSM 细胞的特点是主轴形形态、清晰明确定义的边缘、细胞周围定义良好的光晕以及显微镜下观察时的半收缩(类似蛇形)外观(参见图 2中用白色箭头标记的 DSM 细胞)。它们还响应收缩刺激剂,如肌肉激动剂卡巴乔或高K+ (60 mM)应用。DSM细胞对β-平滑肌动因表现出积极的免疫反应,以确认其身份(图3)。
DSM 电池非常适合对电通道特性进行贴片夹电生理研究。在这里,我们描述了使用移液器和细胞外溶液(表2)的安培林-B穿孔贴片夹记录方法,以最佳方式记录电压步进诱导阳离子通道。在采用的特定条件下,分别用C+/TEA+和nifedipine对Kv和L型Ca2+电流进行封锁,确保消除这些离子元件对全单元电压唤起电流的贡献。图4和图5分别显示了amphotericin-B穿孔贴片钳法的实验步骤和具有代表性的全细胞电流,分别测量了三个不同人类DSM细胞中的电压步进诱导或斜坡协议,每个细胞分别来自不同的患者供体。请注意,这些录音在当前振幅和向外整整方面表现出一定程度的可变性。其他实验表明,9-phenanthrol,一种TRPM4通道抑制剂,在负电压和正电压下有效和可逆地抑制人类DSM阳离子电流(图6)。9-phenanthrol敏感电流分量在正电压和向外整整时具有更强的抑制作用(图6C)。
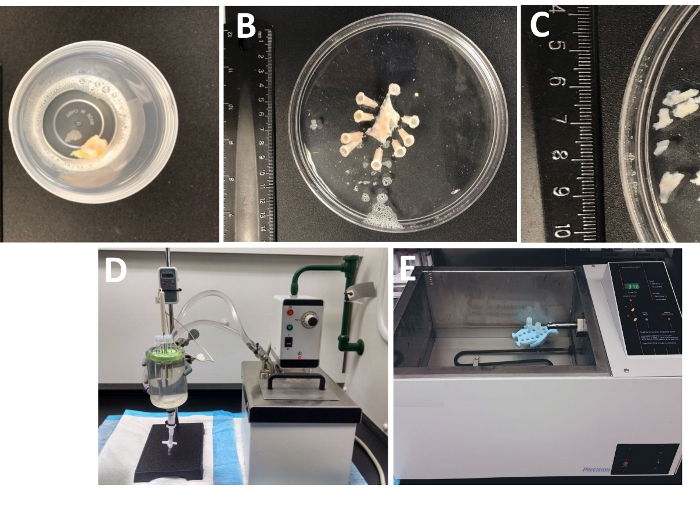
图1:导致准备分离器平滑肌(DSM)片断的解剖步骤和用于酶分离的设置的解剖步骤摘要。所示图像为: (A) 从开放膀胱手术提供的整个厚度的人膀胱标本作为在冰冷的DS的无关手术材料, (B) 相同的准备后固定与部分解剖的DSM层, (C) DSM片的可变尺寸切出从 DSM 层准备酶消化 (小件) 或其他实验调查 (较大的件), (D, E) 用于酶消化的替代方案(1) 通过管道连接到装满水的大型玻璃组织室的温度控制循环水浴、管的橡胶支架、含有 DSM 片件的塑料管和在解剖/消化溶液中制备的酶溶液(DS,DS-P 或 DS-C,表 2))和与显示器相连的温度探头(允许连续监测(D),或 (2) 包含带 DSM 件和酶的管的大型水填充温控浴( 2)).请点击此处查看此图的较大版本。
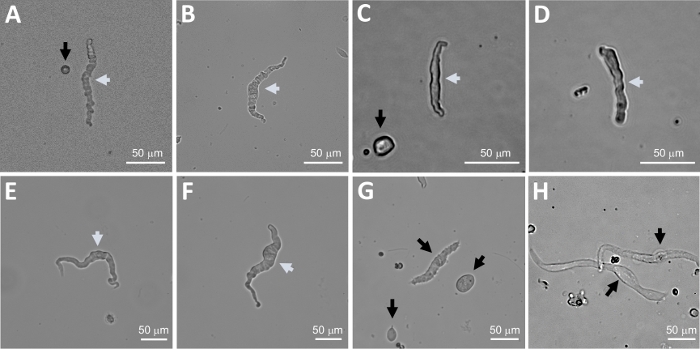
图2:使用顺序木瓜-胶原酶消化法获得的人类新鲜分离的DSM细胞的代表性亮场图像。(A-F)显示的是可行、生理活跃的 DSM 细胞的图像,这些细胞被认为是尝试穿孔贴片夹记录的合适候选对象。(G, H)无法存活或过度消化的细胞的图像;这种细胞避免进行贴片夹实验。面板 (A-H) 中的白色和黑色箭头分别指向被认为可行和不可行的 DSM 单元,用于尝试贴片夹记录。请注意,面板(A、C 和 G)中的黑色箭头指向细胞片段(圆形碎片)或缺乏 DSM 形态的小细胞,在 (H) 中,细胞显得苍白和扩张。图像来自三个不同的膀胱标本(A和B:患者-供体来源一,C和D:患者-供体来源二,和E-H:患者-供体来源三)。请点击此处查看此图的较大版本。
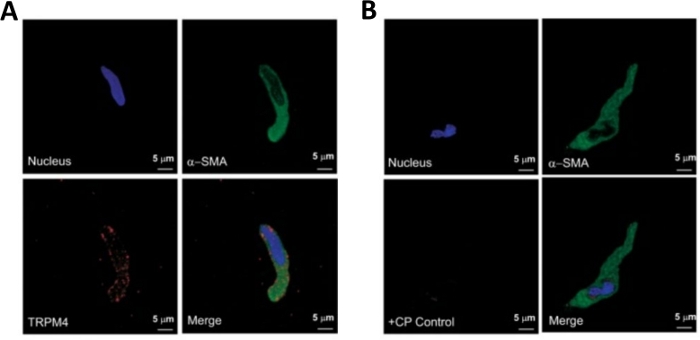
图3:通过免疫细胞化学分析,单人DSM细胞中瞬态受体电位麦他素4型(TRPM4)通道和β-平滑肌特异性活性活性活性的表达。(A) 所示是共聚焦图像,显示人类DSM细胞中TRPM4通道蛋白表达的免疫细胞化学检测。红色染色(左下角)表示 TRPM4 通道蛋白;蓝色 (DAPI) 染色检测细胞核(左上);绿色染色表示β-平滑肌活动(β-SMA,右上);合并的图像(右下角)说明了所有三个图像的重叠。(B) 共聚焦图像,说明在分离的人类DSM细胞中存在TRPM4特异性竞争肽(CP)的情况下,TRPM4通道蛋白表达的免疫细胞化学检测衰减。蓝色 (DAPI) 染色表示细胞核(左上);绿色染色用于 β-平滑肌活动(α-SMA,右上);合并的图像(右下角)说明了所有三个图像的重叠。使用从四个患者分离的DSM全组织或多个DSM细胞,在四个单独的实验中验证了结果。图片来自赫里斯托夫等人(2016)22,并经许可使用。请点击此处查看此图的较大版本。
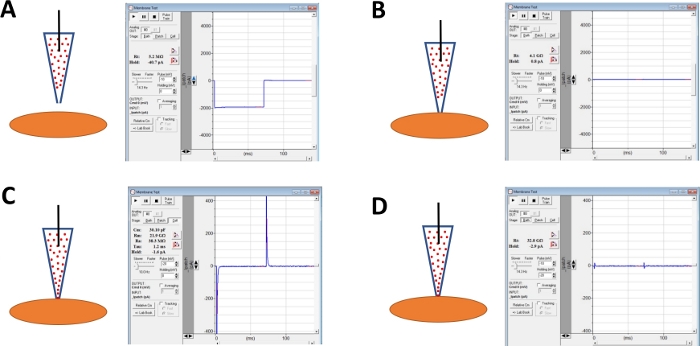
图4:人体DSM细胞的千兆密封形成和安培林-B穿孔所涉及的步骤的原理图。图中所示是含有移液器和 DSM 电池的 amphotericin-B 的空间位置,以及通过改变确定电阻的电压步长(本例中为 -10 或 -20 mV)在商业采集软件(材料表)中获得的膜测试的相关响应。配置是: (A) 之前与电极的电池方法, (B) 通过将含有移液器的 amphotericin-B(由红点表示的环二环-B)定位到细胞表面并施加负压而获得千兆密封形成后,(C)在千兆密封形成后显示的细胞内配置 ,此时,五聚基林-B已扩散到移液器上,其分子已插入电极尖端的等离子膜中。渗透孔,和(D) 与 (C) 相同的配置, 但与电容瞬变取消使用拨号全单元电容和串联电阻上的放大器.请点击此处查看此图的较大版本。
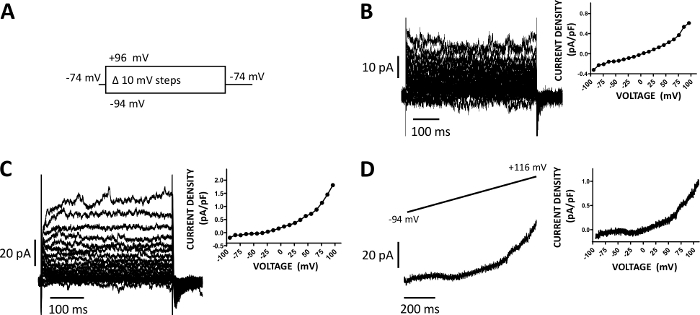
图5:用安培林-B穿孔贴片夹法记录在人类DSM细胞中的全细胞阳离子电流。(A) 电压步长协议的图显示了保持电位 -74 mV 和电压步长为 400 ms 的持续时间,从 -94 到 +96 mV 以 10 mV 的增量执行,然后返回到 -74 mV。(B, C)代表电流轨迹以及来自两个不同人类 DSM 细胞的电流密度电压图,每个图(分别来自使用 (A) 中所述的电压步程协议获得的不同膀胱标本/患者-供体。(D) 使用斜坡协议获得的电流跟踪示例(在 1 s 持续时间内,在 0.21 mV/ms 的持续时间内,在顶部内电中图形表示为 -94 mV,保持电位为 -94 mV)。在面板(B-D)的右侧,图表显示所记录的每个DSM单元的电流密度-电压关系。请点击此处查看此图的较大版本。
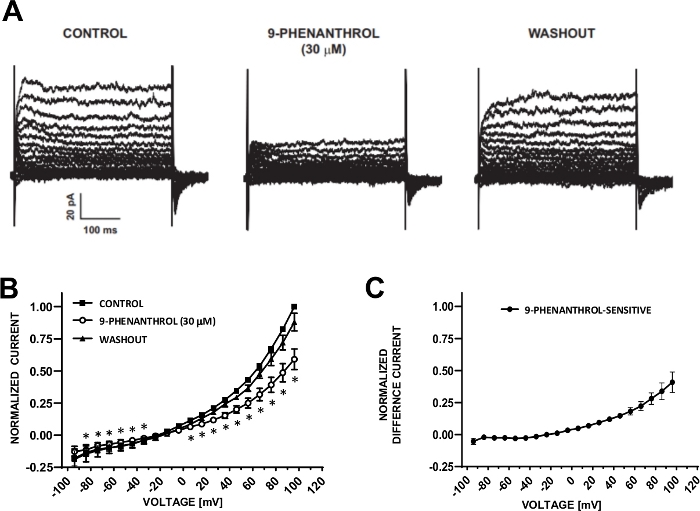
图6:TRPM4通道阻滞剂9-phenanthrol介导抑制人类DSM细胞中的电压步进诱导阳离子电流。(A) 图 5A 中描述的电压步程测量的代表性电流用于控制、9-phenanrol 和冲洗。(B) 在7个DSM细胞(来自7个不同的患者捐赠者)中,对控制电压的标准化反应与电压的摘要,9-phenanthrol和洗涤。(C) 通过从(B) 中所示的控件中减去存在 9-phenanthrol (30 μM) 的值而获得的 9-phenanthrol 敏感组分的差电流。(B) 和 (C) 中的数据显示为与 SEM 的误差条的均值, * 描述显著性 (p<0.05, 配对学生测试), 用于比较每个电压下的控制与 9-phenanthrol。面板 (A) 和 (B) 已由赫里斯托夫等人 (2016)22转载,并经许可使用.请点击此处查看此图的较大版本。
| 物种 | 程序详细信息 | 引用 | |
| 豚鼠 | DSM 件用 Ca2+无介质冲洗(mM:100 NaCl,10 KCl,1.2 KH2PO4,5 MgCl2,20 葡萄糖, 50 牛磺酸, 测量 pCa=6 (或 1 mM), 然后切成片,用酶培养基(mM: 130 KOH, 20牛磺酸,5丙酸,5肌酸,10mM HEPES,用硫磺酸调节至pH 7.4,1mg/ml胶原酶,0.2毫克/毫升丙酮酶E,1毫克/毫升无脂肪酸白蛋白,pCa=4.2(63 mM)或3.7(200 mM)。单 DSM 细胞储存在卡夫-布鲁赫 (KB) 培养基中(在 mM: 85 KCl, 30K2PO4, 5 MgSO4,5 Na2ATP, 5 K-硫磷酸, 5 肌酸, 20 牛磺酸, 5 β-OH-丁酸, 1 mg/ml 脂肪酸不含白蛋白, 与 KOH 调整到 pH 7.2)。 替代方法:DSM 件在 Ca2+无量介质(以 mM 中)冲洗 10 分钟:140 NaCl,5 KCl,1.2 MgCl2,10葡萄糖,20 牛磺酸,5 个 HEPES,与 NaOH 一起调节至 pH 7.4)。然后,在相同的Ca2+-无培养基中孵育,辅以5mg%胶原酶、2mg%蛋白酶和100μM CaCl2,搅拌2x20分钟。 | 克洛克纳和伊森伯格 (1985)13,34克洛克纳和伊森伯格 (1986)施耐德等人 (1991)10博内夫和伊森贝格 (1992)9魏德尔特和伊森伯格 (2000)36摩尔等人 (2004)14 | |
| 几内亚猪,兰拉西猪和人类 | DSM 片在 Ca2+无 Krebs 溶液中预孵育 5 分钟,然后切成片状,在含有 0.5-2 mg/ml 胶原酶 I 型和 0.1-0.5 mg/ml 丙酶的 Ca2+-无 Krebs 溶液中酶消化,在 36°C 下持续搅拌 20-30 分钟。在某些情况下,消化的片段被钝倾斜移液器或旋转,直到产生细胞进一步激动。分离的细胞储存在经过改造的Krebs溶液中(在Klockner & Isenberg13中描述),通常在3小时内使用。Krebs溶液的组成是(mM):140纳+,6K+,2Ca2+,1.2Mg2+,152.4Cl-10葡萄糖,10个HEPES,pH 7.35-7.4与Tris。对于 Ca2+无解决方案,克雷布斯解决方案中省略了 Ca2+和 Mg2+。 | 伊努埃和布雷丁 (1990)37伊努埃和布雷丁 (1991)38中山和布雷丁 (1995)39,40 | |
| 人类 | 放置在 Ca2+免费 HEPES Tyrode 溶液中的 DSM 件(在 mM 中:105.4 NaCl、20.0 或 22.3 NaHCO 3、3.6 KCl、0.9 MgCl2、0.4NaH2PO4、19.5或 4.9 HEPES、5.4 或 5.5 葡萄糖、4.5 或 5.5 Na-pyruvate)和切割成 DSM 片件。在酶溶液中浸泡的 DSM 片(Ca2+免费 HEPES 溶液,0.7 mg/ml 胶原酶 I 型,0.7 mg/ml 木瓜素,1 mg/ml 白蛋白)在 4°C 过夜。然后,在36.5°C加热条,加热15至30分钟,用新鲜溶液轻轻清洗和三聚。储存在Ca2+中,含有HEPES Tyrode溶液或立即用于实验的分离细胞。 | 蒙哥马利和弗莱 (1992)24加列戈斯和弗莱 (1994)41弗莱等人 (1994)42 Sui 等人 (2001)43 Wu 等人 (2002)44 | |
| 豚鼠 | DSM 切成 PSS 中的碎片(在 mM: 137 NaCl, 5.4 KCl, 2 MgCl2,2 CaCl2, 0.42 KH2P04, 4.17 NaHCO3, 10 葡萄糖, 10 HEPES, pH 7.4 与 NaOH).在以下消化溶液中放置 10 分钟的 DSM 件(mM:80 Na-谷氨酸, 55 NaCl, 6 KCl, 10 HEPES, 11 葡萄糖, 2 MgCl2,和 0.2 CaCl2), 然后转移到含有相同溶液的瓶中,但有 1 mg/ml 胶原酶 2, 1 mg/ml 胰蛋白酶抑制剂 (有时省略), 1 mg/ml 无脂肪牛白蛋白, ± 70 分钟在 35°C 或 +60 分钟在 37°C.单DSM细胞通过Pasteur移液器在同一溶液中通过三聚体获得,无需钙和酶。三聚体后,加入Ca2+(1 mM),将细胞储存在4°C。这些细胞总是在同一天使用。 | 博内夫·纳尔逊 (1993)53,54赫普纳等人 (1997)26佩特科夫等人 (2001)47 Shieh等人 (2001, 2007)48,49 | |
| 几内亚猪、老鼠、老鼠和人类 | 协议在Ca2+无消化溶液(在mM:80纳谷氨酸、55 NaCl、6 KCl、10 HEPES、11葡萄糖和2MgCl2)中进行剧烈解剖后,采用两步酶分离治疗。首先,在37°C下,DSM片件在1-2毫克/毫升帕霉素、1mg/ml二聚氨酰亚醇和1mg/ml牛血清白蛋白解脱脱溶液中进行25-45分钟的处理(在mM:80谷氨酸钠, 55 NaCl, 6 KCl, 2 MgCl2,10 HEPES, 和 10 葡萄糖, 调整到 pH 7.3 与 NaOH), 然后 DSM 片转移到消化溶液包含 1-5 毫克/毫升胶原酶 XI (西格玛) 或胶原酶类型 2, 1 mg/ml 牛血清白蛋白, 0 或 1 毫克/毫升胰蛋白酶抑制剂和 100 μM Ca2+,6-30 分钟.孵育后,在消化溶液中洗涤多次,无需酶和Ca2+,然后轻轻三聚,产生单平滑肌细胞。 | 佩特科夫等人(2001年)50索恩罗埃和纳尔逊 (2003)51索恩罗埃和纳尔逊 (2004)33佩特科夫和纳尔逊 (2005)27赫里斯托夫等人 (2008)52 Layne等人 (2010)53赫里斯托夫等人 (2011)15 Xin等人(2012年)54帕拉朱利等人(2012年)25 Malysz等人(2013年)29 Parajuli等人(2013年)31 Lee等人(2013年)55 Malysz等人(2014年)23 Smith等人(2013年)19 20赫里斯托夫等人 (2016)22李等人 (2017)56亚罗茨基等人 (2018)57 | |
表1:用于从不同物种的膀胱中分离单个DSM细胞的酶学方法摘要。
| 解决方案类型 | 成分(以 mM 表示) |
| DS(解剖/消化解决方案) | 80 纳-谷氨酸、55 纳Cl、6 KCl、10 HEPES、2 MgCl2和 11 葡萄糖,pHH 调整为 7.4(10 M NaOH) |
| DS-P(含帕平 DS) | 含有1-2毫克/毫升木瓜素、1毫克/毫升二硫尿醇和1毫克/毫升牛血清白蛋白的DS |
| DS-C(含胶原酶的DS) | 含有1-2mg/ml胶原酶II型、1毫克/毫升牛血清白蛋白、0或1毫克/毫升胰蛋白酶抑制剂和100-200[M Ca2]的DS溶液 |
| P(移位器) | 110 CsOH, 110 阿斯巴酸, 10 NaCl, 1 MgCl2, 10 HEPES, 0.05 EGTA, 和 30 CsCl, pH 调整到 7.2 与 CsOH, 并辅以五聚丙酸-B (300-500 μg/ml) |
| E(细胞外) | 10 四乙酰氨基甲酸铵 (TEA), 6 CsCl, 124 NaCl, 1 MgCl2,2 CaCl2,10 HEPES, 和 10 葡萄糖, pH 被调整到 7.3-7.4 与 NaOH 或 CsOH, 和 0.002-3 (2-3 mM) 尼菲迪平 |
表2:解剖/消化溶液(DS)的组成,以及用于穿孔贴片夹实验的移液器和细胞外溶液。
讨论
此处描述的程序解释了使用酶消化和记录对TRPM4通道抑制剂9-phenanthrol敏感的全细胞阳离子电流,使用amphotericin-B穿孔贴片夹法从全厚度人类膀胱标本制备活的、新鲜分离的DSM细胞的步骤。酶过程依赖于两步顺序暴露,本文称为顺序木瓜蛋白-胶原酶消化方法。DSM组织首先在名义Ca2+无条件下使用木瓜蛋白和二硫乙醇(一种酶稳定剂)进行治疗,第二步在低Ca2+的情况下由胶原酶II型进行治疗。在平滑肌细胞的低Ca2+条件下进行木瓜消化的原理可追溯到20世纪80年代末。新鲜分离的胡萝卜动脉平滑肌细胞与木瓜显示一个拉长的形状,显示活力(抵抗对Trypan蓝色吸收)和反应收缩刺激(更高的Ca2+和组胺)65。多年后,这种方法应用于DSM细胞的制备(见表1)。胶原酶II型的选择,而不是其他类型的,与其相对较高的蛋白解细胞活性有关,非常适合平滑的肌肉组织,包括DSM。事实上,光胶原酶治疗可以产生单一的DSM细胞,尽管需要大量的酶暴露(+60分钟)53,54。由于胶原酶活性取决于Ca2+,并且酶在Ca2+无条件下处于非活性状态,因此DSM片块的最佳酶消化需要Ca2+66的存在。在我们的例子中,DS-C包含100-200[M[Ca2](表2)。酶处理后,消化的DSM片件用冷DS轻轻清洗多次,不带酶或Ca2+,以去除任何与组织结合的酶。冰冷的DS有助于保持DSM细胞的完整性,并限制任何剩余的木瓜蛋白或胶原酶的酶活性。在最后一步中,用经过火抛光的巴斯德移液器对酶处理的 DSM 片进行三聚化可释放单个 DSM 细胞。DSM 细胞要么立即放置在记录室进行贴片夹研究或其他类型的实验,要么储存在 DS 中的冰上,以便当天晚些时候使用(通常在制备后 8 小时内使用,但细胞最多可存活 24 小时)。
我们确定了成功获得单一 DSM 细胞的几个重要考虑因素。第一种涉及人类DSM标本源质量。为了最佳地保持组织的完整性,从开放膀胱手术中获得的 DSM 样本将尽快放入冰冷的 DS 中,并在寒冷的环境中保存。具体来说,从患者身上手术提取后,膀胱标本立即放在手术室准备充分准备的侧桌上。整个标本的毛检查(通常在激进或简单的囊肿切除术期间获得)及其开口。目视检查后,从严重与肿瘤无关的标本的偏远地区取出一块全厚度的尿梯试样,并立即放入装有冷(+4°C)解剖溶液(DS)的杯子(50或100 mL)中,然后用盖子紧紧闭合。由于组织采集的计划性质,手术室人员和进行收获的辅助人员在手术开始时得到提醒,以便在组织提取时在手术室内提供材料。这些预防措施以及处理步骤的常规重复性,使组织的温暖缺血时间( 从提取到放置在带有 DS 溶液的冷冻容器中 ) 保持不到 5 分钟。然后将容器放在冰箱中或放在冷却器的冰上,以保持寒冷环境,并将(冰冷)运送到实验室。一旦标本到达实验室,解剖和酶分离步骤开始。很难预测给定的DSM样本在酶解散后是否会产生高质量的DSM细胞,因此我们继续酶分离步骤。在许多情况下,在电生理学实验的同时,我们小组对从同一DSM试样制备的DSM条进行等轴测张力记录。我们发现,我们通常可以从制剂中获得高质量的DSM细胞,这些制剂也成功地为等轴测收缩研究(我们未发表的观察)提供了可行的条带。
第二个因素与不同的酶位变异有关。我们观察到,对于二型木瓜蛋白和胶原酶,每次从供应商处收到新的酶时,用于组织消化的DS中的酶活性可能会有所不同。因此,我们定期优化每个新批次的酶浓度和孵育间隔。为了尽量减少批次变异性贡献,我们订购大量相同批次,并在 2 mL 等分酶中生产大量库存溶液,并将其储存在 +-20°C,直到使用。然而,随着时间的推移,冷冻库存(储存长达2周)可能会失去其酶活性。第三个变量与酶消化处理的温度有关。木瓜蛋白和胶原酶的酶活动表现出温度依赖性。帕帕因和胶原酶II型在温度范围内表现出活性,包括正常身体生理67,68。因此,我们的目标是保持酶处理在+37°C下保持稳定,避免高温,以保持DSM细胞的完整性。第四个考虑因素涉及每个制剂中存在 DSM 细胞质量的可变性,从高度可行(表现出出色的经典平滑肌特性)到非健康、过度消化的细胞。酶潜伏间隔延长是获得大量受损细胞的主要原因之一。过度的酶处理也会损害电一通道、受体和输送机的蛋白质结构,对其功能产生不利影响。解释从酶获得的结果,新鲜分离的细胞应牢记这一点。优化酶消化条件的目的是增加高度可行的细胞的百分比。与在较少细胞(如单细胞贴片夹电生理学或 Ca2+成像)上成功进行的优化相比,依赖更多可行细胞(如微阵列分析)的实验方法需要更强健的优化。考虑到上述因素,我们在过去十年中一直在进行研究,以获得高质量的单一DSM细胞。
穿孔贴片钳技术是四分之一个多世纪以来一直研究的主要电生理方法。若干出版物详细介绍了技术注意事项69,70,71,72,73.细胞穿孔可使用安培林-B、尼他汀、克霉素或β-escin获得(参见参考32用于每个概述)。与其他电生理方法不同,穿孔贴片夹记录的主要优点是原生细胞内环境 - 包括细胞内 Ca2+和信号分子(如cAMP、PKA、磷酸盐和磷酸酯酶) - 被保存。因此,该技术非常适合在接近生理条件下研究全细胞电通道电流及其调节机制。一个关键的警告是,细胞内细胞组成不能与其他电生理方法(如传统的全细胞和单通道切除贴片(内和外)记录不同,无法精确控制。根据我们的经验,有三个因素通常有助于安培林-B穿孔贴片夹实验的成功实验结果。第一个是选择尝试录制的 DSM 单元的质量。当 DSM 细胞高度可行时,显示半收缩(蛇形样),高对比度的闪亮外观,在细胞表面周围具有定义明确的光晕,并紧密地固定在记录室的玻璃底部,然后千兆密封形成和细胞穿孔发生相对容易。成功的第二和第三个因素分别涉及安培-B的来源质量和溶解(二甲基磺酸/DMSO和细胞内移液器溶液)。我们观察到不同供应商在来源和批次差异方面存在差异。我们每天从粉末中制备一种新的五氯环生-B库存溶液溶液,随后在细胞内移液器溶液中稀释。这些步骤需要大量的声波和涡流。使用新制作的含安培林-B移液器溶液,成功进行细胞穿孔(<50 MΩ) following giga-seal formation can be usually obtained within 30 min. The concentration of amphotericin-B in the pipette solution also requires optimization dependent on the amphotericin-B lot and source. Under our experimental conditions, the final amphotericin-B concentrations in the pipette range from 200 to 500 µg/mL. Since amphotericin-B exhibits light sensitivity, its solutions need to be kept in the dark. Using the amphotericin-B perforated patch-clamp technique, our group recorded voltage-step induced K mω)="" following="" giga-seal="" formation="" can="" be="" usually="" obtained="" within="" 30="" min.="" the="" concentration="" of="" amphotericin-b="" in="" the="" pipette="" solution="" also="" requires="" optimization="" dependent="" on="" the="" amphotericin-b="" lot="" and="" source.="" under="" our="" experimental="" conditions,="" the="" final="" amphotericin-b="" concentrations="" in="" the="" pipette="" range="" from="" 200="" to="" 500="" µg/ml.="" since="" amphotericin-b="" exhibits="" light="" sensitivity,="" its="" solutions="" need="" to="" be="" kept="" in="" the="" dark.="" using="" the="" amphotericin-b="" perforated="" patch-clamp="" technique,="" our="" group="" recorded="" voltage-step="" induced="">+约2+,以及来自人类、豚鼠、小鼠和/或大鼠 DSM 细胞的非选择性阳离子电流17,21,22,23,29,30,31,35,60.在这里,我们描述了记录人类DSM细胞中非选择性阳离子电流的条件。9-Phenanthrol 是 TRPM4 通道的阻滞器,衰减电压步进感应电流支持这些通道在控制 DSM 兴奋性中的作用。作为说明,它通常需要至少45分钟后获得千兆密封和启动穿孔,以记录最佳稳定电压步进诱导的非选择性阳离子电流。电压斜带也可用作电压步进协议的替代品30,64.在这里,采用超极化保持膜电位的电压步法是首选,而不是斜坡协议,因为前一种方法将电压依赖性失活的影响降至最低,并允许在持续时间内平均振流电压步长,其中斜坡提供每个电压的单个数据点。后一点尤其适用于人类 DSM 电池,因为电流显示电压步长期间的可变活动(图 5和图 6).amphotericin-B穿孔贴片夹技术对于识别DSM细胞和其他细胞类型的特性至关重要,并将继续为将来提供新的发现提供辅助。此外,新分离的单 DSM 细胞可成功地用于测量全细胞 K+Cl-、和卡2+采用贴片夹技术的传统模式的电流、使用电流钳夹进行膜电位记录以及单通道记录,如我们以前的报告所证明的那样23,29,35,64.
除了单细胞贴片夹方法外,新分离的DSM细胞还可以与其他技术方法进行研究,包括Ca2+成像、RT-PCR/q-RT-PCR、免疫细胞化学、原位接近结扎测定和基因组方法(例如微阵列、RNA-seq、CHIP-seq)15、18、30、33、34 。随着单细胞转录组测定方法的不断发展,并变得高度敏感,我们设想在未来能够定期和具体地将单个DSM细胞的电或药理特性与其转录组/蛋白酶谱联系起来。这将通过首先从DSM细胞记录,然后提取mRNA或蛋白质,然后转录组/蛋白质组分析来实现。虽然这些方法已经在非DSM细胞中进行了测试,但它们目前在技术上具有挑战性,缺乏敏感性,不能被视为常规,并且仅限于成功检测出一些选定的基因产物74。功能-分子轮廓表达链接研究,当从从从从膀胱获得的从控制和患病的患者-捐赠者获得的DSM细胞,将提供对生理过程的见解,对驱动正常的DSM功能,发病机制,和在识别有效的新治疗方法。
披露声明
没有。
致谢
这项工作得到了NIH-R01DK106964和P20DK123971赠款的支持。作者感谢维克多·亚罗茨基博士和莎拉·麦克斯韦尔女士对手稿的批判性评价。我们也感谢MUSC和UTHSC的泌尿科工作人员外科医生:托马斯·基恩博士、哈利·克拉克、斯蒂芬·萨维奇、罗斯·拉姆斯、桑迪普·普拉萨德、乔纳森·皮卡德、克里斯托弗·莱德贝特和安东尼·帕特森以及MUSC和UTHSC泌尿科居民:泰勒博士沃恩、塞缪尔·沃克·尼克斯、马修·杨、艾琳·伯恩斯、贾斯汀·埃莱特、瑞安·莱维、奥斯汀·扬格、马克·库林、尼玛·巴拉达兰、奥卢贝米索·麦科伊、特雷西·蒂普顿、布莱斯·怀亚特、阿莉莎·格里曼、莎拉·斯塔罗斯塔、亚伦·布洛赫、克里斯蒂娜·卡拉韦、露西尔·考克斯、克里斯蒂安·德万、艾琳·海特曼、布拉德利·休斯顿、斯蒂芬·莱格、罗伯特·利比、科尔·洛克利尔、克里斯汀·马利、莫妮卡·奥汉隆、帕特里克·普罗布斯特、辛西娅·沙拉丁、伊丽莎白·图尔维尔、丹尼尔·萨帕塔帮助收集人体组织。
材料
| Name | Company | Catalog Number | Comments |
| 5 ml polystyrene round-bottom tube | Falcon | 352054 | Tubes for DS containing enzymes used in digestion steps |
| 9-Phenanthrol | Sigma-Aldrich | 211281 | TRPM4 channel inhibitor |
| Amphotericin-B | Fisher | BP928-250 | Used for patch/cell perforation |
| Amphotericin-B | European Pharmacopoeia Reference Standards | 5 | Used for patch/cell perforation |
| Amphotericin-B | Sigma-Aldrich | A9528-100MG | Used for patch/cell perforation |
| Analog vortex mixer | VWR | 58816-121 | |
| Aspartic acid | Sigma-Aldrich | A9006 | Intracellular pipette solution |
| Bovine serum albumin | Sigma-Aldrich | A7906 | DS |
| CaCl2 | Sigma-Aldrich | C1016 | Extracellular solution and DS |
| Capillary Glass | Sutter | BF150-110-7.5 | Capillary for preparation of pulled patch electrodes |
| Cesium hydroxide hydrate | Sigma-Aldrich | C8518 | Intracellular pipette solution |
| Clampex ver. 10 software includes data acqusition (Clampex) and analysis (Clampfit) programs | Axon Instruments/ Molecular Devices | pCLAMP-10 | Commerical software and part of patch-clamp rig setup |
| Collagenase type 2 | Worthington Biochemical Corporation | LS004177 | DS-C |
| CsCl | Sigma-Aldrich | 203025 | Extracellular and intracellular solutions |
| Dental wax | Miltex Dental Wax Technologies, Inc. | 18058351 | |
| Digital Thermometer with Probe | Fisher Scientific | 15-077-32 | Placed in tissue bath to monitor temperature |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2650 | Solvent |
| DL-Dithiothreitol (DDT) | Sigma-Aldrich | D9779 | Reducing agents used together with Papain |
| EGTA | Sigma-Aldrich | E3889 | Ca2+ chelator, used in intracellular pipette solution |
| Flaming/Brown micropipette puller | Sutter | P-97 | Required to pull electrodes with very fine tips |
| Floating foam tube rack/holder | VWR Scientific | 82017-634 | Used for holding tubes with enzymes for temperature control |
| Glucose | Sigma | G8270 | |
| Glutamic acid (Na salt) | Sigma-Aldrich | G1626 | DS |
| HEPES | Sigma-Aldrich | H3375 | pH Buffer |
| KCl | Fisher Scientific | BP366-1 | Extracellular solution |
| Low Noise Data Acquisition System | Axon Instruments/ Molecular Devices | Digidata 1440A | Part of patch-clamp rig setup |
| Magnetic stirrer | VWR | 01-442-684 | |
| MgCl2 (hexahydrate) | Sigma-Aldrich | M2670 | Extracellular and intracellular solutions |
| MicroForge | Narishige | MF-830 | Used for fire-polishing electrodes |
| NaCl | Sigma-Aldrich | S7653 | Extracellular and intracellular solutions |
| NaOH | Sigma-Aldrich | S8045 | |
| Nifedipine | Sigma-Aldrich | N7634 | L-type voltage-gated Ca2+ channel blocker |
| Nikon inverted microscope, TS100 with T1-SM stage with 5x, 10x, 20x, and 40x objectives | Nikon | Discontinued | Part of Patch-clamp rig setup |
| Non-metalic syringe needle, MicroFil | WPI | MF-34G-5 | Filling of intracellular pipette solution |
| Papain | Worthington Biochemical Corporation | LS003126 | DS-P |
| Pasteur pipette | FisherBrand | 13-678-20A | Tips are broken off and fire-polished and used for titration of enzymatically treated tissues to release single DSM cells from pieces |
| Patch-clamp amplifier | Axon Instruments/ Molecular Devices | Axon Axopatch 200B | Part of patch-clamp rig setup |
| PC computer | DELL | Custom configuration | Part of patch-clamp rig setup |
| pH Meter | Aspera Instruments | PH700 | |
| Polyethylene tubing | Intramedic | 427-436 | Tubing for superfusion of extracellular bath connected to glass-bottom recording chamber |
| Tetraethylammonium chloride | Sigma-Aldrich | T2265 | Ion channel blocker of Kv and BK channels added to the extracellular bath solution |
| Thermo Scientific Precision shaking water bath (model 2870) | Thermo Scientific | Discontinued | Water bath for temperature control of enzymatic digestion employed as an alternative to tissue chamber-circulating bath setup |
| Tissue bath, 100 mL | Radnoti | 1583-101 | Connected to a circulating bath and filled with water, tubes with DS and DSM pieces are placed in the setup to control the temperature of digestion steps |
| Vinyl tubing | ColePalmer | 06405-3 | Multiple uses including for connecting tissue bath to circulating water bath |
| Water circulator bath, Haake D1 L | Haake | Discontinued | Connected to tissue bath |
| Weighting scale | Mettler Toledo | XS64 | |
| ZeissAxiovert 40C inverted microscope with 10x and 40x objectives | Carl-Zeiss | Discontinued | Part of patch-clamp rig setup |
参考文献
- Andersson, K. E., Arner, A. Urinary bladder contraction and relaxation: physiology and pathophysiology. Physiological Reviews. 84 (3), 935-986 (2004).
- Brading, A. F., Brain, K. L., Andersson, K. E., Michel, M. C. Ion channel modulators and urinary tract function. Urinary Tract. 202, 375-393 (2011).
- Brading, A. F. Spontaneous activity of lower urinary tract smooth muscles: correlation between ion channels and tissue function. Journal of Physiology. 570, 13-22 (2006).
- Brading, A. F., Heaton, J. P., Hashitani, H. A survey of commonalities relevant to function and dysfunction in pelvic and sexual organs. International Journal of Impotence Research. 20 (1), 1-16 (2008).
- Petkov, G. V. Role of potassium ion channels in detrusor smooth muscle function and dysfunction. Nature Reviews Urology. 9 (1), 30-40 (2012).
- Andersson, K. E. Treatment-resistant detrusor overactivity--underlying pharmacology and potential mechanisms. International Journal of Clinical Practice Supplement. 151, 8-16 (2006).
- Sui, G. P., Wu, C., Fry, C. H. The electrophysiological properties of cultured and freshly isolated detrusor smooth muscle cells. Journal of Urology. 165 (2), 627-632 (2001).
- Kropp, B. P., et al. Characterization of cultured bladder smooth muscle cells: assessment of in vitro contractility. Journal of Urology. 162 (5), 1779-1784 (1999).
- Bonev, A., Isenberg, G. Arginine-vasopressin induces mode-2 gating in L-type Ca2+ channels (smooth muscle cells of the urinary bladder of the guinea-pig). Pflügers Archive - European Journal of Physiology. 420 (2), 219-222 (1992).
- Schneider, P., Hopp, H. H., Isenberg, G. Ca2+ influx through ATP-gated channels increments [Ca2+]i and inactivates ICa in myocytes from guinea-pig urinary bladder. Journal of Physiology. 440, 479-496 (1991).
- Wellner, M. C., Isenberg, G. Properties of stretch-activated channels in myocytes from the guinea-pig urinary bladder. Journal of Physiology. 466, 213-227 (1993).
- Wellner, M. C., Isenberg, G. Stretch-activated nonselective cation channels in urinary bladder myocytes: importance for pacemaker potentials and myogenic response. Experientia Supplementum. 66, 93-99 (1993).
- Klockner, U., Isenberg, G. Action potentials and net membrane currents of isolated smooth muscle cells (urinary bladder of the guinea-pig). Pflügers Archive - European Journal of Physiology. 405 (4), 329-339 (1985).
- Moore, E. D., et al. Organization of Ca2+ release units in excitable smooth muscle of the guinea-pig urinary bladder. Biophysical Journal. 87 (3), 1836-1847 (2004).
- Hristov, K. L., Chen, M., Kellett, W. F., Rovner, E. S., Petkov, G. V. Large conductance voltage- and Ca2+-activated K+ channels regulate human detrusor smooth muscle function. American Journal of Physiology - Cell Physiology. 301 (4), 903-912 (2011).
- Afeli, S. A., Rovner, E. S., Petkov, G. V. SK but not IK channels regulate human detrusor smooth muscle spontaneous and nerve-evoked contractions. American Journal of Physiology - Renal Physiology. 303 (4), 559-568 (2012).
- Hristov, K. L., et al. Kv2.1 and electrically silent Kv channel subunits control excitability and contractility of guinea pig detrusor smooth muscle. American Journal of Physiology - Cell Physiology. 302 (2), 360 (2012).
- Afeli, S. A., Malysz, J., Petkov, G. V. Molecular expression and pharmacological evidence for a functional role of Kv7 channel subtypes in Guinea pig urinary bladder smooth muscle. PLoS One. 8 (9), 75875 (2013).
- Smith, A. C., et al. TRPM4 channel: a new player in urinary bladder smooth muscle function in rats. American Journal of Physiology - Renal Physiology. 304 (7), 918-929 (2013).
- Smith, A. C., et al. Novel role for the transient potential receptor melastatin 4 channel in guinea pig detrusor smooth muscle physiology. American Journal of Physiology - Cell Physiology. 304 (5), 467 (2013).
- Hristov, K. L., Smith, A. C., Parajuli, S. P., Malysz, J., Petkov, G. V. Large-conductance voltage- and Ca2+-activated K+ channel regulation by protein kinase C in guinea pig urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 306 (5), 460-470 (2014).
- Hristov, K. L., et al. Novel regulatory mechanism in human urinary bladder: central role of transient receptor potential melastatin 4 channels in detrusor smooth muscle function. American Journal of Physiology - Cell Physiology. 310 (7), 600-611 (2016).
- Malysz, J., Afeli, S. A., Provence, A., Petkov, G. V. Ethanol-mediated relaxation of guinea pig urinary bladder smooth muscle: involvement of BK and L-type Ca2+ channels. American Journal of Physiology - Cell Physiology. 306 (1), 45-58 (2014).
- Montgomery, B. S., Fry, C. H. The action potential and net membrane currents in isolated human detrusor smooth muscle cells. Journal of Urology. 147 (1), 176-184 (1992).
- Parajuli, S. P., Soder, R. P., Hristov, K. L., Petkov, G. V. Pharmacological activation of small conductance calcium-activated potassium channels with naphtho[1,2-d]thiazol-2-ylamine decreases guinea pig detrusor smooth muscle excitability and contractility. Journal of Pharmacology and Experimental Therapeutics. 340 (1), 114-123 (2012).
- Heppner, T. J., Bonev, A. D., Nelson, M. T. Ca2+-activated K+ channels regulate action potential repolarization in urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 273 (1), 110-117 (1997).
- Petkov, G. V., Nelson, M. T. Differential regulation of Ca2+-activated K+ channels by beta-adrenoceptors in guinea pig urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 288 (6), 1255-1263 (2005).
- Herrera, G. M., Etherton, B., Nausch, B., Nelson, M. T. Negative feedback regulation of nerve-mediated contractions by KCa channels in mouse urinary bladder smooth muscle. American Journal of Physiology - Regulatory Integrative Comparative Physiology. 289 (2), 402-409 (2005).
- Malysz, J., Rovner, E. S., Petkov, G. V. Single-channel biophysical and pharmacological characterizations of native human large-conductance calcium-activated potassium channels in freshly isolated detrusor smooth muscle cells. Pflügers Archive - European Journal of Physiology. 465 (7), 965-975 (2013).
- Provence, A., Angoli, D., Petkov, G. V. Kv7 channel pharmacological activation by the novel activator ML213: role for heteromeric Kv7.4/Kv7.5 channels in guinea pig detrusor smooth muscle function. Journal of Pharmacology and Experimental Therapeutics. 364 (1), 131-144 (2018).
- Parajuli, S. P., et al. Control of urinary bladder smooth muscle excitability by the TRPM4 channel modulator 9-phenanthrol. Channels (Austin). 7 (6), 537-540 (2013).
- Ishibashi, H., Moorhouse, A. J., Nabekura, J., Okada, Y. Perforated whole-cell patch-clamp technique: a user's guide. Patch Clamp Techniques: From Beginning to Advanced Protocols. 4, 71-83 (2012).
- Provence, A., Rovner, E. S., Petkov, G. V. Regulation of transient receptor potential melastatin 4 channel by sarcoplasmic reticulum inositol trisphosphate receptors: Role in human detrusor smooth muscle function. Channels (Austin). 11 (5), 459-466 (2017).
- Hristov, K. L., et al. Suppression of human detrusor smooth muscle excitability and contractility via pharmacological activation of large conductance Ca2+-activated K+ channels. American Journal of Physiology - Cell Physiology. 302 (11), 1632-1641 (2012).
- Xin, W., Soder, R. P., Cheng, Q., Petkov, G. V. Inhibition of phosphodiesterases relaxes detrusor smooth muscle via activation of the large conductance voltage- and Ca2+-activated K+ channel. American Journal of Physiology - Cell Physiology. 302 (9), 1361-1370 (2012).
- Hristov, K. L., et al. Neurogenic detrusor overactivity is associated with decreased expression and function of the large conductance voltage- and Ca2+-activated K+ channels. PLoS One. 8 (7), 68052 (2013).
- Hristov, K. L., Parajuli, S. P., Provence, A., Rovner, E. S., Petkov, G. V. Nongenomic modulation of the large conductance voltage- and Ca2+-activated K+ channels by estrogen: A novel regulatory mechanism in human detrusor smooth muscle. Physiological Reports. 5 (14), (2017).
- Parajuli, S. P., et al. Functional link between muscarinic receptors and large-conductance Ca2+ -activated K+ channels in freshly isolated human detrusor smooth muscle cells. Pflügers Archiv - European Journal of Physiology. 467 (4), 665-675 (2015).
- Malysz, J., Rovner, E. S., Petkov, G. V. Single-channel biophysical and pharmacological characterizations of native human large-conductance calcium-activated potassium channels in freshly isolated detrusor smooth muscle cells. Pflügers Archiv - European Journal of Physiology. 465 (7), 965-975 (2013).
- Thorneloe, K. S., Nelson, M. T. Properties of a tonically active, sodium-permeable current in mouse urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 286 (6), 1246-1257 (2004).
- Barry, M. J., et al. The American Urological Association symptom index for benign prostatic hyperplasia. The Measurement Committee of the American Urological Association. Journal of Urology. 148 (5), 1549-1557 (1992).
- Klockner, U., Isenberg, G. Calcium currents of cesium loaded isolated smooth muscle cells (urinary bladder of the guinea pig). Pflügers Archiv - European Journal of Physiology. 405 (4), 340-348 (1985).
- Klockner, U., Isenberg, G. Tiapamil reduces the calcium inward current of isolated smooth muscle cells. Dependence on holding potential and pulse frequency. European Journal of Pharmacology. 127 (3), 165-171 (1986).
- Weidelt, T., Isenberg, G. Augmentation of SR Ca2+ release by rapamycin and FK506 causes K+-channel activation and membrane hyperpolarization in bladder smooth muscle. British Journal of Pharmacology. 129 (7), 1293-1300 (2000).
- Inoue, R., Brading, A. F. The properties of the ATP-induced depolarization and current in single cells isolated from the guinea-pig urinary bladder. British Journal of Pharmacology. 100 (3), 619-625 (1990).
- Inoue, R., Brading, A. F. Human, pig and guinea-pig bladder smooth muscle cells generate similar inward currents in response to purinoceptor activation. British Journal of Pharmacology. 103 (4), 1840-1841 (1991).
- Nakayama, S., Brading, A. F. Possible contribution of long open state to noninactivating Ca2+ current in detrusor cells. American Journal of Physiology - Cell Physiology. 269 (1), 48-54 (1995).
- Nakayama, S., Brading, A. F. Interaction of Ca2+ agonist and depolarization on Ca2+ channel current in guinea pig detrusor cells. Journal of General Physiology. 106 (6), 1211-1224 (1995).
- Gallegos, C. R., Fry, C. H. Alterations to the electrophysiology of isolated human detrusor smooth muscle cells in bladder disease. Journal of Urology. 151 (3), 754-758 (1994).
- JournalFry, C. H., Gallegos, C. R., Montgomery, B. S. The actions of extracellular H+ on the electrophysiological properties of isolated human detrusor smooth muscle cells. Journal of Physiology. 480, 71-80 (1994).
- Sui, G. P., Wu, C., Fry, C. H. A description of Ca2+ channels in human detrusor smooth muscle. BJU International Journal. 92 (4), 476 (2003).
- Wu, C., Sui, G., Fry, C. H. The role of the L-type Ca2+ channel in refilling functional intracellular Ca2+ stores in guinea-pig detrusor smooth muscle. Journal of Physiology. 538, 357-369 (2002).
- Bonev, A. D., Nelson, M. T. Muscarinic inhibition of ATP-sensitive K+ channels by protein kinase C in urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 265 (6), 1723-1728 (1993).
- Bonev, A. D., Nelson, M. T. ATP-sensitive potassium channels in smooth muscle cells from guinea pig urinary bladder. American Journal of Physiology - Cell Physiology. 264 (5), 1190-1200 (1993).
- Petkov, G. V., Heppner, T. J., Bonev, A. D., Herrera, G. M., Nelson, M. T. Low levels of KATP channel activation decrease excitability and contractility of urinary bladder. American Journal of Physiology - Regulatory Integrative Comparative Physiology. 280 (5), 1427-1433 (2001).
- Shieh, C. C., et al. Functional implication of spare ATP-sensitive K+ channels in bladder smooth muscle cells. Journal of Pharmacology and Experimental Therapeutics. 296 (3), 669-675 (2001).
- Shieh, C. C., et al. Characterization of a novel ATP-sensitive K+ channel opener, A-251179, on urinary bladder relaxation and cystometric parameters. British Journal of Pharmacology. 151 (4), 467-475 (2007).
- Petkov, G. V., et al. Beta1-subunit of the Ca2+-activated K+ channel regulates contractile activity of mouse urinary bladder smooth muscle. Journal of Physiology. 537, 443-452 (2001).
- Thorneloe, K. S., Nelson, M. T. Properties and molecular basis of the mouse urinary bladder voltage-gated K+ current. Journal of Physiology. 549, 65-74 (2003).
- Hristov, K. L., et al. Stimulation of beta3-adrenoceptors relaxes rat urinary bladder smooth muscle via activation of the large-conductance Ca2+-activated K+ channels. American Journal of Physiology - Cell Physiology. 295 (5), 1344-1353 (2008).
- Layne, J. J., Nausch, B., Olesen, S. P., Nelson, M. T. BK channel activation by NS11021 decreases excitability and contractility of urinary bladder smooth muscle. American Journal of Physiology - Regulatory Integrative Comparative Physiology. 298 (2), 378-384 (2010).
- Lee, H., Koh, B. H., Peri, L. E., Sanders, K. M., Koh, S. D. Functional expression of SK channels in murine detrusor PDGFRalpha+ cells. Journal of Physiology. 591 (2), 503-513 (2013).
- Lee, H., et al. Premature contractions of the bladder are suppressed by interactions between TRPV4 and SK3 channels in murine detrusor PDGFRalpha+ cells. Scientific Reports. 7 (1), 12245 (2017).
- Yarotskyy, V., Malysz, J., Petkov, G. V. Properties of single channel and whole-cell Cl- currents in guinea pig detrusor smooth muscle cells. American Journal of Physiology - Cell Physiology. 316 (5), 698-710 (2019).
- Driska, S. P., Porter, R. Isolation of smooth muscle cells from swine carotid artery by digestion with papain. American Journal of Physiology - Cell Physiology. 251 (3), 474-481 (1986).
- Seltzer, J. L., Welgus, H. G., Jeffrey, J. J., Eisen, A. Z. The function of Ca2+ in the action of mammalian collagenases. Archives of Biochemistry and Biophysics. 173 (1), 355-361 (1976).
- Skelton, G. S. Papaya proteinases. I. Temperature-and pH-stability curves. Enzymologia. 35 (5), 270-274 (1968).
- Petrova, D., Derekova, A., Vlahov, S. Purification and properties of individual collagenases from Streptomyces sp. strain 3B. Folia Microbiologica (Praha). 51 (2), 93-98 (2006).
- Sharpe, E. J., St Clair, J. R., Proenza, C. Methods for the isolation, culture, and functional characterization of sinoatrial node myocytes from adult mice. Journal of Visualized Experiments. (116), (2016).
- Brueggemann, L. I., Mani, B. K., Haick, J., Byron, K. L. Exploring arterial smooth muscle Kv7 potassium channel function using patch clamp electrophysiology and pressure myography. Journal of Visualized Experiments. (67), e4263 (2012).
- Jarriault, D., Grosmaitre, X. Perforated patch-clamp recording of mouse olfactory sensory neurons in intact neuroepithelium: functional analysis of neurons expressing an identified odorant receptor. Journal of Visualized Experiments. (101), e52652 (2015).
- Rae, J., Cooper, K., Gates, P., Watsky, M. Low access resistance perforated patch recordings using amphotericin B. Journal of Neuroscience Methods. 37 (1), 15-26 (1991).
- Knutson, K., et al. Whole cell electrophysiology of primary cultured murine enterochromaffin cells. Journal of Visualized Experiments. (139), (2018).
- Devienne, G., Le Gac, B., Piquet, J., Cauli, B. Single cell multiplex reverse transcription polymerase chain reaction after patch-clamp. Journal of Visualized Experiments. (136), (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。