Method Article
Preparazione e utilizzo di cellule muscolari lisce del detrusore umano appena isolate per la caratterizzazione delle correnti di Cazione sensibili a 9-Phenanthrol
In questo articolo
Riepilogo
Descriviamo un metodo per la preparazione delle singole cellule muscolari lisce dei detrusivi appena isolate da campioni di vescica urinaria umana utilizzando una procedura enzimatica in due fasi. Le cellule DSM vitali ottenute possono essere studiate con varie tecniche a cella singola, tra cui l'elettrofisiologia patch-clamp amphotericin-B descritta per rivelare proprietà fisiologiche e farmacologiche.
Abstract
Le cellule di detrusor smooth muscle (DSM) presenti all'interno della parete della vescica urinaria facilitano infine l'accumulo e il vuoto delle urine. La preparazione delle cellule DSM vitali, fresche e isolate presenta un'importante sfida tecnica il cui raggiungimento fornisce cellule ottimali per i successivi studi funzionali e molecolari. Il metodo sviluppato ed elaborato nel presente documento, utilizzato con successo dal nostro gruppo per oltre un decennio, descrive la dissezione dei campioni di vescica urinaria umana ottenuti da interventi chirurgici alla vescica aperta seguiti da un trattamento enzimatico in due fasi di pezzi DSM e triturazione meccanica per ottenere cellule DSM appena isolate. La fase iniziale prevede la dissezione per separare lo strato DSM (noto anche come muscularis propria) dalla mucosa (urotelium, lamina propria e mucosa muscularis) e dai tessuti connettivi, vascolari e adipose adiacenti presenti. Il DSM viene poi tagliato a pezzi (2-3 mm x 4-6 mm) in soluzione nominale Ca2o-contenente dissezione /digestione (DS). I pezzi DSM vengono successivamente trasferiti e trattati in sequenza con DS contenente papaina e collagena e collagena e 37 gradi centigradi per 30-45 min al passo. Dopo aver conto di DS contenente siero bovino privo di enzimi e triturazione con una pipetta levigata dal fuoco, i pezzi rilasciano singole cellule DSM. Le cellule DSM appena isolate sono ideali per caratterizzazioni elettrofisiologiche e farmacologiche dei canali ionici. In particolare, mostriamo che il bloccante del canale TRPM4 9-phenanthrol riduce le correnti di cazione evocate a passo di tensione registrate con l'approccio amphotericin-B perforato patch-clamp. Le cellule DSM possono anche essere studiate con altre tecniche come RT-PCR a singola cellula, analisi di microarray, immunocitochimica, analisi di legatura di prossimità in situ e imaging Ca2. Il vantaggio principale dell'utilizzo di singole cellule DSM è che le osservazioni fatte si riferiscono direttamente alle caratteristiche delle singole cellule rivelate. Studi su cellule DSM umane appena isolate hanno fornito importanti approfondimenti che caratterizzano le proprietà di vari canali ionici, tra cui cation-permeable nella vescica urinaria e continueranno come gold standard nel chiarire le proprietà cellulari DSM e i meccanismi normativi.
Introduzione
Le cellule detrustori di muscoli lisci (DSM) costituiscono il tipo di cellule più abbondanti nella vescica urinaria e, in ultima analisi, controllano lo stoccaggio e il vuoto delle urine attraverso il rilassamento e la contrazione, rispettivamente. Le cellule DSM formano fasci muscolari lisci che si intrecciano con il tessuto connettivo adiacente, i processi nervosi, le cellule interstiziali e altri tipi di cellule1. L'attuale comprensione del ruolo delle cellule DSM nella funzione della vescica urinaria è stata raggiunta attraverso un approccio integrato multilivello. Ogni metodo sperimentale - sia basato su singole cellule isolate in vitro, strisce di tessuto contenenti fasci muscolari lisci in vitro/ex vivo, o in determinazioni in vivo (come la citometria e le valutazioni delle funzioni di annullamento) - fornisce informazioni importanti e specifiche sulle proprietà fisiologiche e farmacologiche del DSM (si prega di consultare le recensioni1,2,3,4,5,6 per i dettagli). Tuttavia, l'interpretazione dei risultati ottenuti da singole cellule isolate consente di attribuire specificamente le conclusioni al tipo di singola cellula stessa. Questa realizzazione è stata la forza motrice per stabilire un metodo affidabile e riproducibile per ottenere cellule DSM appena isolate dai campioni di vescica urinaria di spessore intero. A differenza di molti altri tipi di cellule, le cellule muscolari lisce non possono essere coltivate in modo affidabile a causa della perdita del loro fenotipo nativo, compresi cambiamenti specifici nelle loro proprietà elettrofisiologiche e contrattuali7,8. Questo fatto rafforza ulteriormente l'importanza degli studi effettuati su cellule DSM appena isolate fisiologicamente attive.
Alla fine degli anni '80 e all'inizio degli anni '90, il gruppo di Isenberg (Germania) pubblicò una serie di studi elettrofisiologici sulle cellule DSM appena isolate ottenute dalle vesciche urinarie di porcellino d'India9,10,11,12,13 ( Tabella1). Il metodo ha evidenziato due importanti osservazioni che hanno aiutato ad ottenere cellule vitali e servito come linea guida iniziale per gli altri a seguire. Sono stati 1) pre-trattamento di pezzi DSM isolati con soluzione/mezzo senza Ca2o più prima del trattamento enzimatico e 2) digestione dei tessuti con una soluzione contenente collagenasi. Questi due passaggi critici sono stati incorporati in tutte le varianti successive delle procedure di dissociazione cellulare DSM(tabella 1). Attualmente, il nostro gruppo impiega un approccio sequenziale di dissociazione papaina-collagene in due fasi. I pezzi DSM vengono prima trattati con una soluzione enzimatica contenente papaina e poi con la collagenana di tipo II solulutta nella stessa soluzione (DS, soluzione di dissezione/digestione). Questo approccio produce singole cellule DSM di varie specie, tra cui porcellino d'India, maiale, ratto, topo e, soprattutto, umani (Tabella 1).
Le singole cellule DSM forniscono una fonte per molteplici esperimenti di biologia molecolare ed fisiologici. Finora, le espressioni di proteine e mRNA studiate con l'immunocitochimica, o le determinazioni RT-PCR/qRT-PCR hanno rivelato elevati livelli di rilevamento per vari canali ionici, tra cui la grande tensione di conduttanza- e Ca2-attivato (BK), piccola conduttanza Ca2 -attivato K- tipo 3 (SK3), voltage-gated K(K v),L-type voltage-gated Ca2 , e il recettore transitorio potenziale melastatin di tipo 4 (TRPM4), così come uno scambiatore Na/Ca2 14,15,16,17,18,19,20,21,22. Sono tutti pensati per controllare l'eccitabilità del DSM, i livelli intracellulare Ca2 e la contrattilità. Approcci elettrofisiologici patch-clamp, eseguiti direttamente su cavie, topi, ratti o cellule DSM umane, hanno fornito la dimostrazione diretta delle proprietà biofisiche e farmacologiche di L-type Cav, Kv (Kv2.x. Kv7), canali SK, BK e TRPM417,19,20,21,22,23,24,25 ,26,27,28,29,30,31. Gli approcci includevano un blocco di tensione a celle intere convenzionale, un morsetto a tensione perforato e registrazioni a canale singolo (configurazioni a celle collegate, interne ed esterne). Inoltre, la registrazione potenziale della membrana del DSM utilizzando un morsetto di corrente ha fornito la prova che gli agenti farmacologici che coinvolgono il bersaglio alterano l'eccitabilità cellulare. Ad esempio, l'inibitore di TRPM4 9-phenanthrol ha indotto l'iperpolarizzazione nelle cellule DSM ottenute da esseri umani, caviee e vesciche urinarie di ratto19,20,22,31. Tra i vari metodi elettrofisiologici, le registrazioni perforate di amphotericin-B (e nystatin, gramicidin e z-escin) forniscono un vantaggio chiave preservando molecole e percorsi intrinseci di segnalazione intracellulare. Solo le cazioni a basso peso molecolare e, in misura minore, Cl- ma non le proteine o le molecole di segnalazione, tra cui Ca2 , sono permeabili attraverso i pori della membrana plasmatica formati da amphotericin-B o nystatin32. Il risultato positivo degli esperimenti di patch-tè perforati dipende da diverse variabili generali uniche di questa tecnica. Qui, descriviamo i dettagli della procedura utilizzando amphotericin-B che il nostro gruppo ha utilizzato con successo nel corso degli anni15,22,33,34,35,36,37,38,39.
Probabilmente, i canali di cation non selettivi rimangono uno dei tipi di canale meno compresi nelle cellule DSM. La prima relazione di un canale non selettivo simile alla cation risale al 1993. L'articolo di Wellner e Isenberg11 descriveva un singolo canale attivato da 33 pS che mostrava il seguente ordine di rango della permeabilità ione: K>Na>Cs>>>Ba2 >Ca2el'inibizione dell'attività del canale da parte di Gd3,un inibitore generale dei canali di cation non selettiva. Quasi un decennio più tardi, Thorneloe e Nelson40 descrissero le correnti di cazionepermeabili nelle cellule DSM del topo, inibite da Gd3,utilizzando registrazioni intere delle cellule. Poiché le identità molecolari dei canali di cation non selettiva e le loro caratterizzazioni biofisiche rimangono da determinare, sono giustificate indagini future in questo settore di ricerca. Il protocollo descritto qui per la registrazione di correnti di canali di cazione non selettiva - utilizzando soluzioni intracellulari extracellulari e pipettari che contengono soluzioni intracellulari contenenti soluzioni C,TEAe nifedipine (Tabella 2) che mitigano fisiologicamente e farmacologicamente le correnti Kv e Cav - è stato e continuerà ad essere utile nelle indagini elettrofisiologiche sui canali cation non selettivi. Abbiamo utilizzato questo protocollo specifico per determinare l'entità dell'inibizione delle correnti di cazione a cellule intere dal bloccante del canale TRPM4 9-phenanthrol in porcellino d'India, ratto e cellule DSM umane19,20,22.
Nel loro insieme, il metodo descritto qui per ottenere cellule DSM singole appena isolate dalla vescica urinaria umana fornisce cellule vitali altamente adatte per indagini elettrofisiologiche utilizzando varie configurazioni della tecnica del morfo patch, Ca2o-imaging,immunocitochimica, in situ proximal litigation e singola cella RT-PCR/qRT-PCR, nonché tecniche di biologia molecolare avanzata, tra cui analisi microarray, RNA-seq e CHIP-seq. L'uso del metodo patch-clamp perforato per amphotericin-B mantiene l'ambiente cellulare nativo a differenza di altre configurazioni. Quando viene effettuata utilizzando le condizioni specifiche qui descritte, progettate per negare i contributi delle correnti Ke Ca2 nelle celle DSM, le correnti indotte a passo di tensione mostrano le proprietà delle correnti di cation non selettive adatte alle caratterizzazioni biofisiche e farmacologiche.
Protocollo
Tutti i metodi qui descritti sono stati approvati dai comitati del Consiglio di Revisione Istituzionale del Centro Scienze Della Salute dell'Università del Tennessee (Memphis, TN, IRB 17-05714-XP) e dalla Medical University of South Carolina (Charleston, SC, IRB 00045232). Le procedure approvate consentono che i campioni della vescica urinaria di spessore intero (>1 cm da >1 cm) - contenenti tutti gli strati tra cui mucosa, muscolo liscio detrusore e serosa, sono attaccati vasi sanguigni e tessuto adiposo) - da raccogliere da pazienti-donatori sottoposti a estrazione chirurgica parziale della vescica. I donatori di pazienti sono adulti (età studiata fino ad ora: 25-87 anni), maschio o femmina, con o senza sintomi di vescica iperattiva (come classificato dall'American Urological Association I-PSS score41). Le procedure chirurgiche coinvolgono una varietà di condizioni mediche tra cui la cistectomia radicale per il carcinoma uroteliale e l'adenocarcinoma. In questi casi, il campione della vescica urinaria raccolto è remoto dal sito del tumore.
1. Dissezione dei tessuti DSM e preparazione di pezzi DSM senza mucosa
- Esaminare l'intero campione della vescica urinaria di spessore arrivato in laboratorio dalla sala operatoria in un contenitore ben sigillato riempito con la soluzione di dissezione/digestione del freddo(Figura 1 e Tabella 2 per la composizione di DS).
NOTA: Il campione viene solitamente conservato in DS freddo da poche ore alla notte prima dell'arrivo in laboratorio. Per una maggiore conservazione, DS (Tabella 2) è integrato con 1 mM CaCl2. - Rimuovere e sciacquare l'intero campione DSM dello spessore umano (contenente tutti gli strati, tra cui mucosa, DSM e sirosa) con DS ghiacciato per lavare i detriti attaccati e il sangue.
- Pin il campione della vescica urinaria, mucosa rivolto verso l'alto e serosa verso il basso, su un enantiomer rivestito in silicone (Tabella dei materiali) 150 mm di diametro piatto rotondo riempito con ghiaccio-freddo DS ( Figura1B).
- Rimuovere il tessuto adiposo adiacente, i vasi sanguigni, l'epitelio (urothelium) e la mucosa muscularis dal campione mediante una forte dissezione utilizzando microscissors e pinze.
- Ritagliare diversi pezzi DSM senza mucosa (da 2 a 3 mm di lunghezza e 4-6 mm di larghezza) (Figura 1C).
2. dissociazione enzimatica di pezzi DSM che producono cellule DSM singole appena isolate
- Mettete da 3 a 6 pezzi DSM in un tubo contenente da 1 a 2 mL di DS preriscaldati contenenti papaina e dithiothreitol (DS-P, Tabella 2) e incubate i pezzi DSM in DS-P per 30-45 min a 37 gradi centigradi scuotendo delicatamente il tubo occasionalmente (una volta ogni 10-15 min).
NOTA: Per controllare in modo ottimale la temperatura per il trattamento enzimatico, i tubi con pezzi di tessuto e soluzioni enzimatiche sono collocati in una camera di tessuto di vetro riempita con acqua collegata a un bagno d'acqua riscaldata circolante (Figura 1D) o in un bagno d'acqua agitazione ad alta precisione a temperatura controllata (Figura 1E). - Rimuovere DS-P dal tubo, lavare brevemente i pezzi DSM con ghiaccio freddo DS, scartare dS freddo dal tubo lasciando pezzi DSM seduti sul fondo del tubo.
- Aggiungere da 1 a 2 mL di collagenasi di tipo DS II (DS-C, tabella 2) al tubo con pezzi DSM, mescolare delicatamente; e incubare per 25-40 min a 37 gradi centigradi scuotendo delicatamente il tubo di tanto in tanto (ogni 10-15 min).
- Scartare DS-C e lavare i pezzi DSM trattati con enzimi 5-10 volte con DS ghiacciato.
- Dopo l'ultimo lavaggio, lasciare la soluzione DS all'interno del tubo; triturare delicatamente con una pipetta Pasteur lucidata dal fuoco più volte per rilasciare singole celle DSM.
- Posizionare alcune gocce di soluzione DS contenenti celle DSM disperse su una camera con fondo di vetro o un coperchio e ispezionare visivamente la qualità al microscopio (utilizzando un obiettivo 20x o 40x) dopo almeno 5 min seguendo l'applicazione per consentire alle cellule di aderire sul fondo.
- Utilizzare immediatamente cellule DSM appena isolate per esperimenti elettrofisiologici o conservare le cellule in un tubo contenente DS a 4 gradi centigradi sul ghiaccio o in frigorifero fino all'uso (tipicamente per un massimo di 8 h di preparazione).
NOTA: All'interno della stessa preparazione la qualità delle cellule varia da cellule DSM morte altamente vitali a cellule morte (Figura 2). Quando il metodo sequenziale papaina-collagenase produce un numero molto elevato di cellule non vitali, la preparazione viene scartata e viene effettuata una nuova digestione dei pezzi DSM ma con intervalli di incubazione ridotti. Se la procedura risulta in troppo poche cellule DSM, per la successiva digestione dei pezzi DSM, gli intervalli di incubazione vengono aumentati. L'immunoreattività positiva all'actina muscolare a z-liscio conferma l'identità delle cellule DSM (Figura 3).
3. Registrazione delle correnti di cazione indotta da una tensione indotta da cellule DSM utilizzando la tecnica di morpe perforata di anfoericina-B perforata
- Pipetta 0,25-1 mL di sospensione cellulare su una camera inferiore di vetro seduta su uno stadio di un microscopio invertito e consentire alle cellule di aderire al fondo del vetro.
- Dopo l'incubazione per almeno 45 min, rimuovere DS dal bagno e sostituire con la soluzione E (Tabella 2) per superfusione in cui il flusso della soluzione aiutato dalla gravità tramite rallentamento del tubo di ingresso sostituisce DS con la nuova soluzione mentre la tubazione di uscita collegata a un recipiente di rifiuti sottovuoto rimuove la soluzione della camera e previene l'overflow. Si noti che la soluzione E contienetetraethylammonium (TEA ) e ioni di cesio(C)per inibire lecorrenti K.
- Preparare una soluzione di riserva di anfoericina-B in zolfo dimetilo (DMSO) (1 mg per 10 -L di DMSO). Per sciogliere completamente la polvere di anfoericina, sonicare (almeno 15 min) e vortice la soluzione bene.
NOTA: Questo passaggio richiede solitamente meno di 10 min. La dissoluzione di 3-4 mg di amphotericina-B in 30-40 L di DSMO in un tubo di microcentrifuga da 1,5 mL funziona bene. Le quantità più elevate di anfoericina-B richiedono più solvente DSMO in genere con conseguente un intervallo più lungo per la miscelazione e la soluluttazione incompleta delle particelle solide amphotericin-B presenti nel tubo. - Sciogliere la soluzione di amphotericin-B nella soluzione pipetta (soluzione P, Tabella 2) per ottenere una concentrazione finale di 200-500 g/mL. Questo passaggio richiede un'ampia sonalfo e vortice ad un ambiente ad alta velocità (8-10/10) per 30-60 minuti per passo per garantire una miscelazione e una prevenzione ottimali della formazione di precipitazioni di anfoericina-B nella soluzione pipetta.
NOTA: L'anfoericina-B precipiterà nel tempo ed è sensibile alla luce. La soluzione di pipetta di lavoro contenente Amphotericin-B viene verificata la solubilità, mescolata a mano prima del riempimento della pipetta, e mantenuta al buio. - Tirare più elettrodi patch, punte di elettrodo lucidafuoco, e (se necessario) coprire le punte con cera dentale.
- Riempire la punta di un elettrodo con la soluzione pipetta (soluzione P, Tabella 2) senza amphotericin-B immergendo brevemente l'elettrodo nella soluzione.
- Riempire l'elettrodo con la stessa soluzione di pipetta contenente amphotericin-B.
- Montare l'elettrodo su un supporto collegato a un amplificatore patch-clamp headstage.
- Utilizzando un micromanipolatore, posizionare l'elettrodo appena sotto la superficie della soluzione extracellulare in modo che la punta dell'elettrodo sia appena sommersa.
- Nella modalità tensione-morsetto, impostare il potenziale di mantenimento su 0 mV e regolare la corrente su 0 pA con il quadrante di offset della pipetta sull'amplificatore commerciale (Tabella dei materiali).
- Determinare la resistenza agli elettrodi utilizzando la finestra/funzione membrana test del software di acquisizione commerciale (Tabella dei materiali). Per attivare fare clic su Strumenti>Test della membrana>Riproduci o un'icona di collegamento nel software. La resistenza determinata agli elettrodi dovrebbe essere compresa tra 2 e 5 M.
NOTA: la funzione Membrane Test fornita nel software di acquisizione commerciale o nell'opzione Seal Test sull'amplificatore può essere utilizzata per monitorare la resistenza agli elettrodi applicando passaggi di tensione ripetutamente. - Continuare a monitorare la resistenza agli elettrodi mentre avanza l'elettrodo verso una cellula DSM scelta con un micromanipolatore (Figura 4A).
NOTA: per essere considerata una cella DSM vitale, la cella deve mostrare morfologia allungata a forma di mandrino, un alone ben definito intorno alla cellula, bordi nitidi e aspetto semi-contradlesse (serpentina). - Quando si tocca la superficie cellulare con l'elettrodo - indicato da un rapido aumento della resistenza agli elettrodi misurata con la funzione Membrane Test - siforma un sigillamento giga applicando una leggera pressione negativa rapida al supporto dell'elettrodo tramite tubi. Ciò si traduce in una pressione negativa creata sulla punta dell'elettrodo che tira la membrana cellulare in elettrodo aiutando nella formazione di un giga-sigillo o di un contatto molto stretto tra l'elettrodo e la membrana plasmatica (Figura 4B).
- Una volta che le forme di sigillo giga-sigillo, compensare la capacità pipetta regolando quadranti veloci e lenti sull'amplificatore commerciale e monitorare la stabilità del sigillo giga-sigillante (corrente di perdita) utilizzando la funzione Membrane Test.
- Lasciare che il tempo, tipicamente 30-60 min, per l'amphotericina-B per diffondere la pipetta ed essere inseriti nella membrana plasmatica formando pori principalmente selettivi alle cazioni monovalenti. Durante questa fase, continuare a monitorare il giga-sigillo con la funzione Membrane Test. Con l'aumentare della perforazione cellulare aumenta anche l'ampiezza dei transitori di capacità (confrontare Figura 4B rispetto alla figura 4C che non mostrano rispettivamente la perforazione cellulare non diversa ed efficace) misurata con la funzione Membrane Test.
- Quando la perforazione del cerotto è ottimale (valutata da una resistenza stabile della serie tipicamente inferiore a 50 M, annullare i transitori di capacità regolando i quadranti per la capacità cellulare e la resistenza della serie sull'amplificatore. La compensazione della resistenza della serie può essere eseguita anche in questo momento (Figura 4D).
- Una volta osservate le correnti di cazione indotta da una tensione stabile evocate dal protocollo specificato, applicare una condizione composta o fisiologica per testare la superfusione e registrare le risposte per il controllo,, la condizione di prova e il software di acquisizione commerciale.
- Registrare le correnti con un protocollo di routine passo tensione che comporta la detenzione di celle DSM a -64 o -74 mV e l'esecuzione della tensione in incrementi di 10 mV per 400 o 500 ms da -94 a 96 o 106 mV e il ritorno al potenziale di mantenimento.
NOTA: i valori potenziali della membrana sono regolati per un potenziale di giunzione liquida di 14 mV (utilizzando soluzioni P ed E, tabella 2). Il potenziale di giunzione del liquido si ottiene nel software di acquisizione commerciale (Tabella dei materiali) cliccando (Strumenti>Junction Potenziali) e inserendo le concentrazioni dei componenti dello ios di soluzione. Un protocollo ramp può essere utilizzato anche per ottenere le registrazioni correnti. - Eseguire il protocollo di tensione in intervallo continuo di 1 min durante un esperimento di registrazione delle correnti per il controllo pre-aggiunta, le condizioni di prova e il lavaggio.
- Registrare le correnti con un protocollo di routine passo tensione che comporta la detenzione di celle DSM a -64 o -74 mV e l'esecuzione della tensione in incrementi di 10 mV per 400 o 500 ms da -94 a 96 o 106 mV e il ritorno al potenziale di mantenimento.
4. Analisi e visualizzazione dei dati
- Aprire i file registrati nel software di analisi dei dati commerciali (Tabella dei materiali) per il controllo, la condizione di test e il washout facendo clic su File>Apri dati e selezionando i file di interesse per l'apertura.
NOTA: per l'analisi in genere vengono aperti e analizzati tre file (ciascuno contenente un singolo set di tracce per un singolo protocollo) per ogni condizione. Successivamente vengono mediate le risposte per ottenere una risposta media per ogni condizione. Il software utilizzato per l'acquisizione dei dati contiene un'opzione per raccogliere automaticamente più esecuzioni di test specificate dall'utente e calcolarle come media per un singolo file di output che può essere utilizzato come alternativa. - Ottenere la risposta media negli ultimi 200 ms per la traccia corrente misurata ad ogni tensione; l'intervallo di durata scelto riflette un livello di attivazione della corrente a passo costante. A tale scopo, attenersi alla seguente procedura.
- Selezionare un file di interesse per l'analisi nel software di analisi commerciale (Tabella dei materiali).
NOTA: il software posiziona il file importato più di recente nella finestra di visualizzazione attiva. Il file aperto visualizza una serie di tracce sovrapposte ottenute con un protocollo di passaggio di tensione. Per impostazione predefinita, all'interno della finestra attiva vengono visualizzati quattro cursori (visualizzando i valori x e y per la traccia evidenziata). - Scegliere l'intervallo per l'analisi posizionando il cursore 2 alla fine del passaggio di tensione 400 o 500 ms e il cursore 1 all'intervallo di 200 ms prima che in modo che l'intervallo di analisi sia 200 ms.
- Ottenere risposte per ogni tensione facendo clic su Analizza>Grafico rapido>IV (o sull'icona di scelta rapida IV) (nella finestra del prompt prima di generare dati confermare che per le opzioni dell'asse y (Corrente) segnale Regione "Cursori 1..2" e ""Media" sono selezionate). Fare clic su OK per generare il grafico I-V e inserire i dati in un foglio di colonna Risultati che può essere visualizzato accedendo a Windows>Risultati.
- Analizzare file aggiuntivi ripetendo i passaggi da 4.2.1 a 4.2.3. Fare clic su Analizza>Grafico rapido>IV o collegamento all'icona IV, selezionare Aggiungi anziché Sostituisci per aggiungere altri dati al foglio Risultati durante l'elaborazione delle tracce.
- Copiare i dati in un foglio di calcolo selezionando le colonne di interesse e premendo CTRL-C per copiare e CTRL-V per incollare. Memorizzare il foglio di lavoro Risultati nel software di analisi commerciale (Tabella dei materiali) in formato (con estensione rlt) facendo clic su File>Salva con nome.
- Selezionare un file di interesse per l'analisi nel software di analisi commerciale (Tabella dei materiali).
- Per ogni cella, normalizzare le risposte per tutte e tre le condizioni al valore del passaggio di tensione massima per il controllo pre-aggiunta (secondo la formula: Controllo risposta/risposta-Max ) e rappresentare graficamente le risposte come valori correnti (o densità di densità di corrente) rispetto alle relazioni di tensione (Figura 6).
- In un processore del foglio di lavoro, determinare le risposte medie come correnti (pA) o densità correnti (pA/pF) per il controllo, la condizione di test (in questo esempio, 9-phenanthrol) e il washout a ogni passo di tensione.
- Dividere i valori per ogni tensione di ogni condizione (controllo, 9-phenanthrol e washout) per la risposta di controllo massima ottenuta alla tensione massima (96 mV nella figura 6) per il controllo di pre-aggiunta seguendo la formula: Risposta normalizzata per condition(x) : Risposta(x)/ Controllorisposta-Max per (x).
- Per l'analisi riepilogativa, disporre i dati in un formato che possa essere facilmente copiato in un programma grafico (ad esempio GraphPad Prism) per la visualizzazione.
Risultati
La dissociazione enzimatica dei pezzi DSM fornisce cellule DSM sane appena isolate regolarmente utilizzate in studi funzionali e molecolari come: elettrofisiologia patch-clamp e immunocitochimica. Figura 1 riepiloga i passaggi di dissezione e visualizza le impostazioni impiegate per il controllo della temperatura dei passaggi di trattamento enzimatico. La figura 2 illustra le immagini a campo luminoso delle cellule DSM ottenute da tre campioni di vescica urinaria umana, ciascuno da un diverso donatore di pazienti. Le cellule DSM singole sane sono caratterizzate da una morfologia a forma di mandrino, da bordi ben definiti e ben definiti, da un alone ben definito intorno alla cellula e da un aspetto semi-contraente (simile a quello serpentino) se visualizzate al microscopio (vedere cellule DSM contrassegnate da frecce bianche nella Figura 2). Essi rispondono anche ad agenti stimolanti di contrazione come il carbacholo agonista muscarinico o altaapplicazione K (60 mM). Le cellule DSM mostrano un'immunoreattività positiva per l'actina muscolare zolle che conferma la loro identità (Figura 3).
Le cellule DSM sono ideali per le indagini elettrofisiologiche patch-malamp sulle proprietà del canale ionico. In questo caso, descriviamo il metodo di registrazione del morsetto perforato per anfoericina-B utilizzando pipetta e soluzioni extracellulari (Tabella 2) per registrare in modo ottimale i canali di cazione indotta da passaggio di tensione. Nelle condizioni specifiche impiegate, il blocco delle correnti Kv e L-type Ca2 o con Le correnti Cs,/TEA e nifedipine, rispettivamente, garantiva l'eliminazione del contributo di questi componenti ionici alle correnti evocate da tensione all'intera cella. La figura 4 e la figura 5 mostrano, rispettivamente, le fasi sperimentali del metodo patch-clamp perforato per anfoericina-B e le correnti rappresentative a celle intere misurate con un protocollo di tensione indotta o rampa in tre diverse cellule DSM umane, ciascuna da un diverso donatore di pazienti. Si noti che le registrazioni mostrano un certo grado di variabilità in termini di ampiezza e rettifica esterna. Ulteriori esperimenti hanno rivelato che 9-phenanthrol, un inibitore del canale TRPM4, inibiva efficacemente e reversibilmente le correnti umane DSM a tensioni negative e positive (Figura 6). Il componente di corrente sensibile al 9-phenanthrol illustra un'inibizione più forte a tensioni positive e rettifica esterna (Figura 6C).
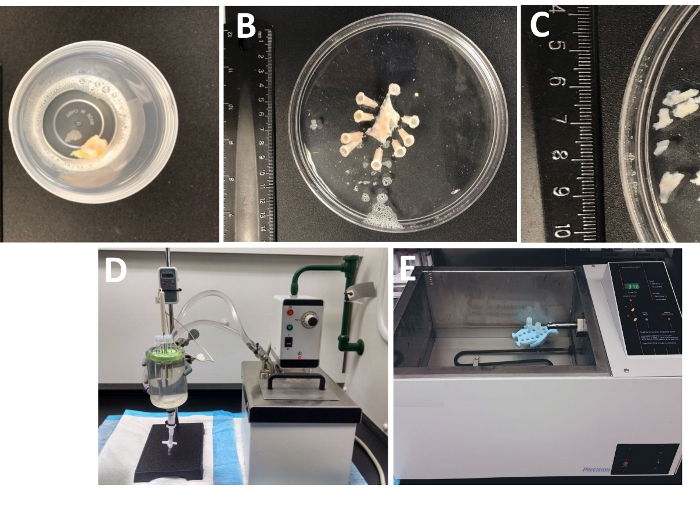
Figura 1: Riepilogo dei passaggi di dissezione con conseguente preparazione di pezzi di detrusor smooth muscle (DSM) e configurazione utilizzata per la dissociazione enzimatica. Sono mostrate immagini di: (A) un campione di vescica urinaria umana interamente fornito da un intervento chirurgico alla vescica aperta come materiale chirurgico estraneo in DS ghiacciato, (B) la stessa preparazione dopo l'aggiunta con uno strato DSM parzialmente sezionato, (C) pezzi DSM di dimensioni variabili ricavate dallo strato DSM pronte per la digestione enzimatica (pezzi più piccoli) o altre indagini sperimentali (pezzi più grandi), (D, E) configurazioni alternative utilizzate per la digestione ezimatica di DSM costituita da pezzi di (1) un bagno d'acqua circolante a temperatura controllata collegato tramite tubing ad una grande camera di tessuto di vetro piena d'acqua, un porta gomma per tubi, tubi di plastica contenenti pezzi DSM e soluzioni enzimatiche preparate in soluzione di dissezione/digestione (DS, DS-P o DS-C, Tabella 2) e una sonda di temperatura collegata a un display che consente un monitoraggio continuo (D)o (2) un grande bagno a temperatura pieno d'acqua contenente un supporto e tubi con pezzi DSM e soluzioni enzimatiche (E ). Fare clic qui per visualizzare una versione più grande di questa figura.
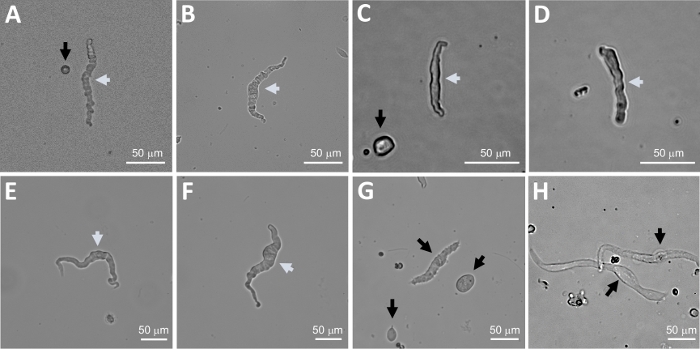
Figura 2: Immagini rappresentative a campo luminoso di cellule DSM appena isolate umane ottenute utilizzando il metodo di digestione sequenziale papaina-collagenase. (A-F) Le immagini di cellule DSM vitali e fisiologicamente attive sono considerate candidate idonee per tentare registrazioni patch-clamp perforate. (G, H) Immagini di cellule non vitali o sovra-digerite; tali cellule sono state evitate per esperimenti di morsetto. Le frecce bianche e nere nei pannelli (A-H) puntano a celle DSM considerate vitali e non vitali, rispettivamente, per tentare registrazioni patch-clamp. Si noti che le frecce nere nei pannelli (A, C e G) puntano a frammenti di cellule (pezzi circolari) o a piccole cellule prive di morfologia DSM e inHle cellule appaiono pallide e dilatate. Le immagini provengono da tre diversi campioni della vescica urinaria (A e B : fonte di donatore paziente uno, C e D : fonte di donatore paziente due, ed E-H : fonte donatore paziente tre). Fare clic qui per visualizzare una versione più grande di questa figura.
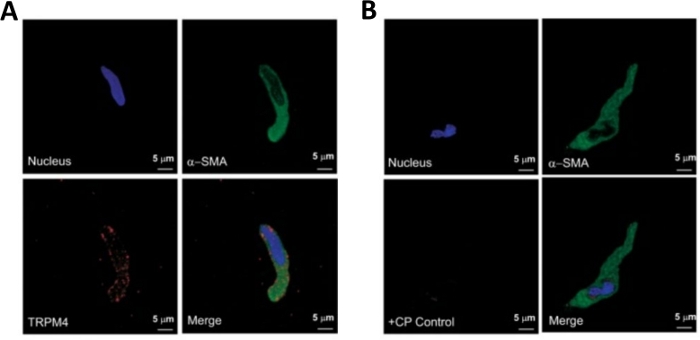
Figura 3: Espressioni del potenziale di melastatina del recettore transitorio di tipo 4 (TRPM4) e dell'immunoreattività dell'attore specifico del muscolo zombi nella singola analisi umana del DSM mediante analisi immunocitochimica. (A) Le immagini confocali mostrano immagini confocali che mostrano il rilevamento immunocitochimico dell'espressione della proteina del canale TRPM4 in una cellula DSM umana. La colorazione rossa (in basso a sinistra) indica le proteine del canale TRPM4; la colorazione blu (DAPI) rileva i nuclei cellulari (in alto a sinistra); la colorazione verde indica l'atto muscolare di z-liscio (z-SMA, in alto a destra); l'immagine unita (in basso a destra) illustra la sovrapposizione di tutte e tre le immagini. (B) Immagini confocali che illustrano l'attenuazione del rilevamento immunocitochimico dell'espressione della proteina del canale TRPM4 in presenza di un peptide concorrente (CP) specifico di TRPM4 in cellule DSM umane isolate. La colorazione blu (DAPI) indica i nuclei cellulari (in alto a sinistra); colorazione verde è per l'atto muscolare s-liscio (z-SMA, in alto a destra); l'immagine unita (in basso a destra) illustra la sovrapposizione di tutte e tre le immagini. I risultati sono stati verificati in quattro esperimenti separati utilizzando il tessuto intero DSM o più cellule DSM isolate da quattro pazienti. Le immagini provengono da Hristov et al. (2016)22 e utilizzate con autorizzazione. Fare clic qui per visualizzare una versione più grande di questa figura.
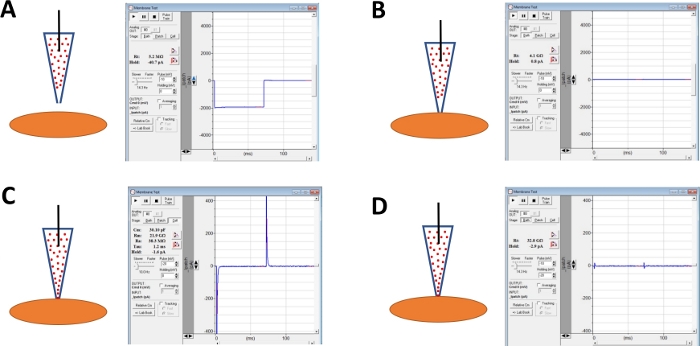
Figura 4: Illustrazione schematica dei passi coinvolti nella formazione di giga-sigilli e nella perforazione di amphotericin-B delle cellule DSM umane. Sono illustrate le posizioni spaziali di una pipetta con contenitore di amphotericin-B e di una cellula DSM insieme alle relative risposte per i test di membrana ottenuti nel software di acquisizione commerciale (Tabella dei materiali)alterando i passaggi di tensione (-10 o -20 mV in questo esempio) determinando la resistenza. Le configurazioni sono: (A) prima dell'approccio cellulare con un elettrodo, (B) dopo la formazione giga-sigilla ottenuta posizionando la pipetta amphotericin-B contenente pipetta (amphotericin-B rappresentata da punti rossi) sulla superficie cellulare e applicando una pressione negativa, (C) la configurazione on-cell mostrata a 45 min dopo la formazione di giga-sigilli, a questo punto amphotericin-B ha diffuso la pipetta e le sue molecole hanno inserito nella membrana plasmatica sulla punta dell'elettrodo che forma cation pori permeabili e (D) la stessa configurazione di in (C, ma con transitori di capacità cancellata cancellata utilizzando quadranti per capacità a celle intere e resistenza di serie sull'amplificatore. Fare clic qui per visualizzare una versione più grande di questa figura.
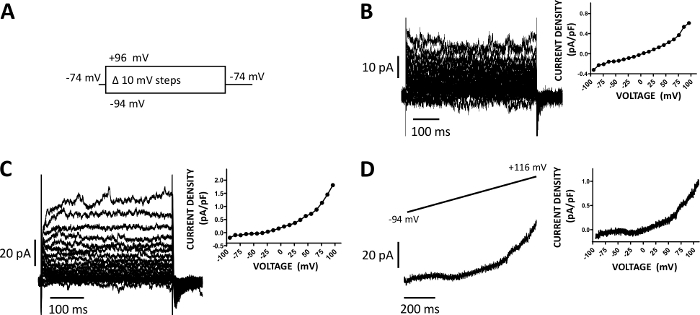
Figura 5: correnti di cazione a cellule intere registrate con metodo di morpe perforato di anfoericina-B nelle cellule DSM umane. (A) Un diagramma del protocollo passotensione illustra un potenziale di detenzione di -74 mV e gradini di tensione della durata di 400 ms da -94 a 96 mV effettuati in incrementi di 10 mV e poi restituiti a -74 mV. (B, C) Tracce di corrente rappresentative insieme alle attuali trame di densità-tensione provenienti da due diverse cellule DSM umane, ciascuna da un diverso campione di vescica urinaria/donatore di pazienti ottenuto con il protocollo di tensione-passo descritto in (A). (D) Un esempio di traccia attuale ottenuta con un protocollo di rampa (rappresentata graficamente nell'interno superiore come cambio di tensione da -94 a 116 mV per una durata di 1 s a 0,21 mV/ms, il potenziale di mantenimento era di -94 mV). A destra nei pannelli (B-D), i grafici visualizzano la relazione densità-tensione corrente per ogni cella DSM registrata. Fare clic qui per visualizzare una versione più grande di questa figura.
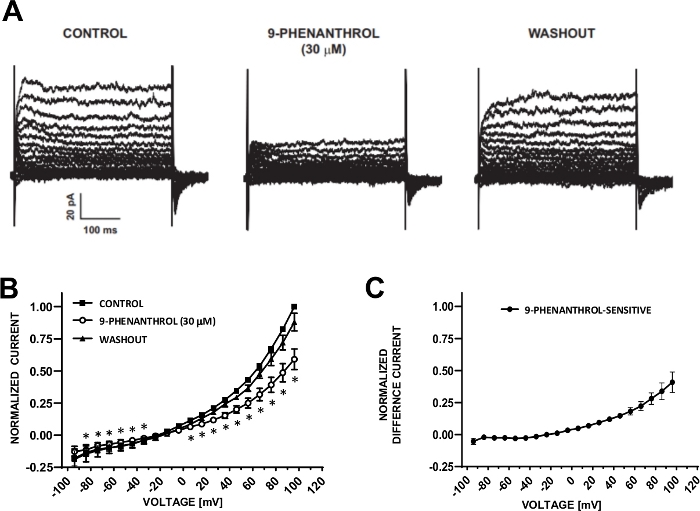
Figura 6: Bloccante di canale TRPM4 Inibizione mediata da 9 fenomenetrolo delle correnti di cazione indotta dal passo di tensione nelle cellule DSM umane. (A) Le correnti rappresentative sono indicate con il protocollo passo tensione descritto in Fig. 5A per il controllo, il 9-phenanthrol e il washout. (B) Riepilogo delle risposte normalizzate rispetto alla tensione per il controllo, 9-phenanthrol e washout in sette cellule DSM (da sette diversi donatori di pazienti). (C) Differenza corrente per componente sensibile al 9-fenantrol ottenuta sottraendo i valori in presenza di 9-phenanthrol (30 M) da quelli del controllo mostrato in (B). I dati in (B) e (C) vengono visualizzati come mezzi con le barre di errore per SEM, il simbolo : rappresenta il significato (p<0.05, test di Studente accoppiato) per il confronto tra controllo e 9-fenanthrol ad ogni tensione. I pannelli (A) e (B) sono stati riprodotti da Hristov et al. (2016)22 e utilizzati con autorizzazione. Fare clic qui per visualizzare una versione più grande di questa figura.
| Specie | Dettagli procedura | Riferimenti | |
| Cavia | Pezzi DSM sciacquati con mezzo libero Ca2o (in mM: 100 NaCl, 10 KCl, 1,2 KH2PO4, 5 MgCl2, 20 glucosio, 50 taurina, misurato pCa 6 (o 1 mM) e poi tagliato a pezzi e trattato tipicamente 90-120 min (4 periodi di 30 min) con enzima medio (in mM: 130 KOH, 20 taurina, 5 pirano, 5 creatina, 10 mHE HEPES, regolata con acido metanosonico a pH 7,4, 1 collagenase mg/ml, 0,2 mg/ml pronase E, 1 mg/ml di acidi grassi albumina libera, pCa -4,2 (63 mM) o 3,7 (200 mM). Le singole cellule DSM sono state conservate in Kraft-Bruhe (KB)-medio (in mM: 85 KCl, 30 K2PO4, 5 MgSO4, 5 Na2ATP, 5 K-pyruvate, 5 creatine, 20 taurina, 5 beta-OH-butyrate, 1 mg/ml di acido grasso album, regolato con KOH a pH 7.2). Metodo alternativo: pezzi DSM sciacquati per 10 min in un mezzo libero Ca2o senza (in mM): 140 NaCl, 5 KCl, 1.2 MgCl2, 10 glucosio, 20 taurina, 5 HEPES, regolato con NaOH a pH 7.4). Poi i pezzi del DSM, incubati nello stesso mezzo libero Ca2o gratuitamente, integrati con 5 mg% collagenase, 2 mg% pronase e 100 Cin 2per 2x20 min stirring. | Klockner & Isenberg (1985)13,34 Klockner & Isenberg (1986)35 Schneider et al. (1991)10 Bonev & Isenberg (1992)9 Weidelt & Isenberg (2000)36 Moore et al. (2004)14 | |
| maialino guinea, maiale Landrace e | I pezzi DSM pre-incubati per 5 min nella soluzione Krebs senza Ca2o più poi tagliati a pezzi e digeriti in modo enzimatico nella soluzione Krebs gratuita Ca2o free contenenti 0,5-2 mg/ml di tipo collagenase di tipo I e 0,1-0.5 mg/ml di pronasi a 36oC per 20-30 min costantemente mescolato. In alcuni casi, i pezzi digeriti sono stati ulteriormente agitati da una pipetta con punta smussata o dalla rotazione fino a quando non cedono le cellule. Le cellule isolate sono state conservate nella soluzione Krebs modificata (descritta in Klockner & Isenberg13)e sono state normalmente utilizzate entro 3 h. La composizione della soluzione Krebs è stata (mM): 140 Na,6 K,2 Ca2 ,1,2 Mg2 ,152,4 Cl-, 10 glucosio, 10 HEPES, pH 7.35-7.4 con Tris. Per la soluzione senza Ca2,la soluzione Krebs è stata omessa da Ca2 e Mg2. | Inoue & Brading (1990)37 Inoue & Brading (1991)38 Nakayama & Brading (1995)39,40 | |
| Umano | I pezzi DSM collocati nella soluzione gratuita di Ca2 oHEPES Tyrode (in mM: 105.4 NaCl, 20.0 o 22.3 NaHCO3, 3.6 KCl, 0.9 MgCl2, 0.4 NaH2PO4, 19.5 o 4.9 HEPES, 5.4 o 5.5 glucosio, 4.5 o 5.5 Na-pyruvate) e tagliato in pezzi DSM. I pezzi DSM imbevuti di una soluzione enzimatica (soluzione HEPES gratuita Ca2 o con 0,7 mg/ml di collagenae di tipo I, 0,7 mg/ml di papaina, 1 albumina mg/ml) durante la notte a 4 . Le strisce sono state poi riscaldate a 36,5 gradi centigradi per 15-30 min, lavate e triturate delicatamente in soluzione fresca. Cellule isolate che sono state conservate in Ca2 o contenenti la soluzione di HEPES Tyrode o utilizzate immediatamente per esperimenti. | Montgomery & Fry (1992)24 Gallegos and Fry (1994)41 Fry et al. (1994)42 Sui et al. (2001)43 Wu et al. (2002)44 | |
| Cavia | DSM tagliato a pezzi in PSS (in mM: 137 NaCl, 5.4 KCl, 2 MgCl2, 2 CaCl2, 0.42 KH2P04, 4.17 NaHCO3, 10 glucosio, 10 HEPES, pH 7.4 con NaOH). Pezzi DSM posti per 10 min nella seguente soluzione di digestione (in mM: 80 Na-glutamate, 55 NaCl, 6 KCl, 10 HEPES, 11 glucosio, 2 MgCl2e 0,2 CaCl2) e poi trasferiti in una fiala contenente la stessa soluzione ma con 1 mg/ml di collagenase 2, 1 mg/ml di trypsin inhibitor (talvolta omesso), 1 albumina bovina senza grassi mg/ml, per 70 min a 35oC o 60 min a 37 gradi. Singole cellule DSM sono state ottenute per triturazione attraverso una pasteur pipette nella stessa soluzione senza calcio ed enzimi. Dopo la triturazione, è stato aggiunto Ca2 (1 mM) e le cellule sono state immagazzinate a 4 gradi centigradi. Le cellule sono sempre state usate nello stesso giorno. | Bonev & Nelson (1993)53,54 Heppner et al. (1997)26 Petkov et al. (2001)47 Shieh et al. (2001, 2007)48,49 | |
| maiale guinea, topo, ratto, e umana | Il protocollo utilizza un trattamento di dissociazione enzimatica in due fasi a seguito di una forte dissezione nella soluzione di digestione libera da Ca2o (in mM: 80 Na-glutamate, 55 NaCl, 6 KCl, 10 HEPES, 11 glucosio e 2 MgCl2). In primo luogo, i pezzi DSM sono stati trattati per 25-45 min a 37oC con 1-2 mg/ml di papaina, 1 mg/ml dithioerythreitol e 1 mg/ml di album di siero bovine in soluzione di dissociazione (in mM: 80 glutammato monosodico, 55 NaCl, 6 KCl, 2 MgCl2, 10 HEPES e 10 glucosio, regolati su pH 7.3 con NaOH) e poi pezzi DSM trasferiti alla soluzione di digestione contenente 1-5 mg/ml di collagenase XI (Sigma) o collagenase tipo 2, 1 mg/ml e albumina di siero bovino, 0 o 1 mg/ml di inibizione di mlpsina e 100M - Ca2,per 6-30 min. A seguito di incubazione, il tessuto digerito è stato lavato più volte in soluzione di digestione senza enzimi e Ca2 e poi delicatamente triturato per produrre singole cellule muscolari lisce. | Petkov et al. (2001)50 Thorneloe & Nelson (2003)51 Thorneloe & Nelson (2004)33 Petkov & Nelson (2005)27 Hristov et al. (2008)52 Layne et al. (2010)53 Hristov et al. (2012)54 Parajuli et al. (2012)25 Malysz et al. (2013)29 Parajuli et al. (2013)31 Lee et al. (2013)55 Malysz et al. (2014)23 Smith et al. (2013)19 20 Hristov et al. (2016)22 Lee et al. (2017)56 Yarotskyy et al. (2018)57 | |
Tabella 1: Riepilogo degli approcci enzimatici utilizzati per isolare singole cellule DSM da vesciche urinarie di varie specie.
| Tipo di soluzione | Composizione (in mM) |
| DS (Soluzione di dissezione/digestione) | 80 Na-glutammato, 55 NaCl, 6 KCl, 10 HEPES, 2 MgCl2e 11 glucosio, pH regolato a 7,4 (con 10 M NaOH) |
| DS-P (DS contenente papain) | DS contenente 1-2 mg/ml di papaina, 1 mg/ml dithiothreitol e 1 mg/ml di albumina di siero bovino |
| DS-C (DS contenente collagenase) | Soluzione DS contenente 1-2 mg/ml di tipo iI, 1 albumina di siero bovino mg/ml, 0 o 1 mg/ml di asinista della prova e 100-200M Ca2 |
| P (Pipette) | 110 CsOH, 110 acido aspartico, 10 NaCl, 1 MgCl2,10 HEPES, 0,05 EGTA e 30 CsCl,pH regolato a 7,2 con CsOH, e integrato con amphotericin-B (300-500 g/ml) |
| E (Extracellulare) | 10 cloruro di tetraetilelonio (TEA), 6 CsCl, 124 NaCl, 1 MgCl2, 2 CaCl2, 10 HEPES e 10 glucosio, pH regolato a 7.3-7.4 con NaOH o CsOH e 0.002-3 (2-3 mM) nifedipine |
Tabella 2: Composizioni di soluzione di dissezione/digestione (DS) e di pipetta ed extracellulare utilizzate negli esperimenti di patch-clamp perforati.
Discussione
Le procedure descritte qui spiegano i passaggi coinvolti nella preparazione di cellule DSM vitali e appena isolate da campioni di vescica urinaria umana di spessore intero utilizzando la digestione enzimatica e nella registrazione di correnti di cazione a cellule intere sensibili all'inibitore del canale TRPM4 9-phenanthrol che impiega l'approccio di morsetto perforato di anfistra-B. La procedura ezimatica si basa su un'esposizione sequenziale in due fasi di cui al presente riferimento come il metodo sequenziale di digestione papaina-collagenase. I tessuti DSM vengono prima trattati con papaina e dithiothreitol (un agente enzimatico stabilizzante) in una condizione nominale di Ca2,seguita nella seconda fase da collagenase di tipo II in presenza di ca2 . La logica per l'esecuzione della digestione della papaina in basse condizioni di Ca2 o nelle cellule muscolari lisce risale alla fine degli anni '80. Le cellule muscolari listre di carotide appena isolate preparate con papaina mostravano una forma allungata, mostravano vitalità (resistenza all'assorbimento di Trypan Blue) e rispondevano agli stimoli contrattili (superiore Ca2 e istamina)65. Anni dopo, questo metodo è stato applicato nella preparazione delle cellule DSM (vedere la tabella 1). La scelta del collagenano di tipo II piuttosto che di altri tipi si riferisce alla sua attività proteolitica relativamente elevata ideale per tessuti muscolari lisci tra cui DSM. Infatti, il trattamento del collagenasi da solo potrebbe produrre singole cellule DSM, anche se richiedono un'ampia esposizione enzimatica (60 min)53,54. Dal momento che l'attività di collagenase dipende da Ca2 e l'enzima è inattivo in condizioni di Ca2,la digestione enzimatica ottimale dei pezzi DSM richiede la presenza di Ca2 66. Nel nostro caso, DS-C contiene 100-200 M [Ca2 ](Tabella 2). Dopo un trattamento enzimatico, i pezzi DSM digeriti vengono lavati delicatamente un certo numero di volte con DS freddo senza enzimi o Ca2 per rimuovere qualsiasi enzima legato ai tessuti. Il DS ghiacciato aiuta a preservare l'integrità delle cellule DSM e a limitare l'attività enzimatica di qualsiasi papaina o collagena e semina rimanente. Nell'ultima fase, la triturazione di pezzi DSM trattati con enzimi con una pipetta Pasteur lucidata dal fuoco rilascia una singola cellula DSM. Le cellule DSM vengono immediatamente poste su una camera di registrazione per studi di patch-clamp o altri tipi di sperimentazione o memorizzate sul ghiaccio in DS per l'uso in un secondo momento lo stesso giorno (in genere entro 8 ore dalla preparazione, ma le cellule rimangono vitali fino a 24 h).
Abbiamo identificato diverse considerazioni importanti per ottenere con successo singole cellule DSM. Il primo riguarda la qualità della fonte di campioni DSM umana. Per preservare in modo ottimale l'integrità dei tessuti, i campioni DSM ottenuti da interventi chirurgici alla vescica aperti vengono collocati nel DS ghiacciato il prima possibile e mantenuti in un ambiente freddo. In particolare, al momento dell'estrazione chirurgica dal paziente, il campione della vescica viene immediatamente posto su un tavolino completamente preparato in sala operatoria. Seguono l'esame lordo dell'intero campione (di solito ottenuto durante la cistettomia radicale o semplice) e la sua apertura. Dopo l'ispezione visiva, un pezzo di spessore intero, il campione della scala urinaria viene rimosso da un'area remota del provino grossolanamente non coinvolto con un tumore e immediatamente messo in una tazza (50 o 100 mL) contenente soluzione di dissezione fredda (4 gradi centigradi)(Tabella 2) e quindi strettamente chiusa con un coperchio. A causa della natura pianificata della raccolta del tessuto, il personale della sala operatoria e il personale ausiliario che effettua la raccolta vengono avvisati all'inizio della custodia chirurgica al fine di avere i materiali disponibili in sala operatoria al momento dell'estrazione dei tessuti. Queste precauzioni insieme alla natura ordinaria e ripetitiva delle fasi di lavorazione mantengono il tempo caldo dell'ischemia per il tessuto - dall'estrazione al posizionamento nel contenitore refrigerato con soluzione DS - a meno di 5 min. Il contenitore viene quindi posto in frigorifero o su ghiaccio in un refrigeratore per mantenere l'ambiente freddo e trasportato (freddo) in laboratorio. Una volta che il campione arriva in laboratorio, iniziano le fasi di dissociazione eziomatica. È molto difficile prevedere se un dato campione DSM produrrà cellule DSM di alta qualità a seguito di dissociazione enzimatica, quindi procediamo con le fasi di dissociazione enzimatica. In molti casi, parallelamente agli esperimenti elettrofisiologici, il nostro gruppo conduce registrazioni di tensione isometrica su strisce DSM preparate dagli stessi campioni DSM. Abbiamo scoperto che di solito possiamo ottenere cellule DSM di alta qualità dai preparati che forniscono anche strisce vitali per gli studi di contrazione isometrica (la nostra osservazione inedita).
Il secondo fattore si riferisce a diverse variabilità di lotto enzimatici. Abbiamo osservato che sia per la papaina che per il collagenano di tipo II, ogni volta che un nuovo enzima arriva da un fornitore, l'attività degli enzimi in DS per la digestione tissutale può variare. Noi, quindi, monitoriamo regolarmente la concentrazione enzimatica e gli intervalli di incubazione per ogni nuovo lotto. Per ridurre al minimo il contributo di variabilità del lotto, ordiniamo grandi quantità dello stesso lotto e facciamo un grande lotto di soluzioni di magazzino in 2 mL di aliquote di enzimi e li conserviamo a 20 gradi centigradi fino all'uso. Nel corso del tempo, tuttavia, le scorte congelate (conservate fino a 2 settimane) possono perdere la loro attività ezimatica. La terza variabile si riferisce alla temperatura dei trattamenti per la digestione enzimatica. Le attività ezimatiche di papaina e collagenasi mostrano la dipendenza dalla temperatura. Papaina e collagene tipo II mostrano attività nelle gamme di temperatura che comprendono la fisiologia normale del corpo67,68. Pertanto, ci proponiamo di mantenere i trattamenti enzimatici stabili a 37 gradi centigradi evitando temperature più elevate per preservare l'integrità delle cellule DSM. La quarta considerazione riguarda la variabilità della qualità delle cellule DSM presenti all'interno di ogni preparazione che vanno da altamente vitali (che presentano eccellenti caratteristiche muscolari lisce classiche) alle cellule non sane e sovraditate. Un intervallo prolungato di incubazione degli enzimi è uno dei motivi principali per ottenere un elevato numero di cellule danneggiate. Trattamenti enzimatici eccessivi compromettono anche le strutture proteiche di canali ionici, recettori e trasportatori, influenzando negativamente la loro funzionalità. L'interpretazione dei risultati ottenuti da cellule eccessivamente ottesi e appena isolate dovrebbe tenere presente questa considerazione. L'ottimizzazione delle condizioni di digestione enzimatica mira ad aumentare la percentuale di cellule altamente vitali. Gli approcci sperimentali basati su un numero maggiore di cellule vitali come le analisi di microarray richiedono ottimizzazioni più robuste rispetto a quelle eseguite con successo su un numero inferiore di cellule come l'elettrofisiologia dei morsetti a morsetto unicellulare ol'imaging Ca 2. La considerazione dei fattori di cui sopra ha guidato i nostri sforzi di ricerca nell'ultimo decennio nell'ottenere cellule DSM singole di alta qualità.
La tecnica del morsetto perforato è stata un approccio elettrofisiologico di pilastro per oltre un quarto di secolo. Diverse pubblicazioni forniscono informazioni dettagliate sulle considerazioni tecniche69,70,71,72,73. La perforazione cellulare può essere ottenuta con amphotericina-B, nystatin, gramicidin o32per una panoramica di ciascuno). Il vantaggio principale delle registrazioni dei morsetti perforati rispetto ad altri approcci elettrofisiologici è che l'ambiente intracellulare nativo - tra cui Ca intracellulare2 anni di euroe le molecole di segnalazione (ad esempio, cAMP, PKA, fosfati e fosfodiesterai) - è conservato. Questa tecnica è quindi ideale per studiare le correnti del canale ionico interocellulare e i loro meccanismi regolatori in condizioni quasi fisiologiche. Un avvertimento chiave è che la composizione cellulare intracellulare non può essere controllata con precisione a differenza di altri metodi elettrofisiologici come le registrazioni convenzionali a cellule intere e a canale singolo (all'interno e all'esterno). Nella nostra esperienza, tre fattori contribuiscono regolarmente agli esiti sperimentali di successo degli esperimenti di morsetto di perforazione amphotericina-B-perforato. Il primo è la qualità della cella DSM scelta per tentare una registrazione. Quando le cellule DSM sono altamente vitali che mostrano un semi-contractile (serpentine-like), aspetto lucido ad alto contrasto con un alone ben definito intorno alla superficie della cella e si attaccano saldamente al fondo di vetro della camera di registrazione, quindi la formazione giga-sigillo e la perforazione cellulare si verificano relativamente facile. Il secondo e il terzo fattore di successo, rispettivamente, riguardano la qualità della fonte e la solubilizzazione dell'amphotericina-B (nel difossido di zolletto/DMSO e nella soluzione di pipetta intracellulare). Abbiamo osservato discrepanze tra i diversi fornitori in termini di variabilità di origine e lotto. Ogni giorno prepariamo una soluzione fresca di forno amphotericin-B in polvere seguita dalla sua diluizione nella soluzione intracellular pipetta. Questi passaggi richiedono un'ampia sonicazione e vortice. Con la soluzione di pipetta contenente amphotericin-B appena realizzata, la perforazione cellulare di successo (<50 MΩ) following giga-seal formation can be usually obtained within 30 min. The concentration of amphotericin-B in the pipette solution also requires optimization dependent on the amphotericin-B lot and source. Under our experimental conditions, the final amphotericin-B concentrations in the pipette range from 200 to 500 µg/mL. Since amphotericin-B exhibits light sensitivity, its solutions need to be kept in the dark. Using the amphotericin-B perforated patch-clamp technique, our group recorded voltage-step induced K mω)="" following="" giga-seal="" formation="" can="" be="" usually="" obtained="" within="" 30="" min.="" the="" concentration="" of="" amphotericin-b="" in="" the="" pipette="" solution="" also="" requires="" optimization="" dependent="" on="" the="" amphotericin-b="" lot="" and="" source.="" under="" our="" experimental="" conditions,="" the="" final="" amphotericin-b="" concentrations="" in="" the="" pipette="" range="" from="" 200="" to="" 500="" µg/ml.="" since="" amphotericin-b="" exhibits="" light="" sensitivity,="" its="" solutions="" need="" to="" be="" kept="" in="" the="" dark.="" using="" the="" amphotericin-b="" perforated="" patch-clamp="" technique,="" our="" group="" recorded="" voltage-step="" induced="">+Ca2 anni di euro, e correnti di cazione non selettive da cellule umane, cavie, topi e/o ratti17,21,22,23,29,30,31,35,60. Qui, descriviamo le condizioni per la registrazione di correnti di cazione non selettive nelle cellule DSM umane. 9-Phenanthrol, un bloccante dei canali TRPM4, correnti indotte a passo di tensione attenuate che sostengono il ruolo di questi canali nel controllo dell'eccitabilità DSM. Come nota, di solito richiede almeno 45 min dopo aver ottenuto un sigillo giga-sigillo e l'avvio della perforazione per registrare le correnti di cazione non selettive indotte da una tensione stabile ottimale. Le rampe di tensione possono essere utilizzate anche come alternativa ai protocolli a passo di tensione30,64. Qui, è stato preferito un protocollo di tensione-passo da un potenziale di membrana di tenuta iperpolarizzata piuttosto che un protocollo rampa poiché il primo approccio riduce al minimo l'effetto di inattivazione dipendente dalla tensione e consente di media della corrente evocata per un periodo di tempo di una tensione-step in cui la rampa fornisce un singolo punto dati per tensione. Quest'ultimo punto si applica in particolare alle cellule DSM umane in quanto le correnti mostrano attività variabile durante le fasi di tensione (Figura 5EFigura 6). La tecnica del morsetto perforato per anfoericina-B è stata essenziale per identificare le proprietà delle cellule DSM e di altri tipi di cellule e continuerà ad aiutare a fornire nuove scoperte in futuro. Inoltre, le celle DSM singole appena isolate possono essere utilizzate con successo per misurare+Cl-, e Ca2 anni di eurocorrenti con la modalità convenzionale della tecnica patch-clamp, la registrazione del potenziale della membrana con l'attuale morsetto e le registrazioni a canale singolo, come esemplificato dai nostri rapporti precedenti23,29,35,64.
Oltre ai metodi di morsetto a singola cellula, le cellule DSM appena isolate possono essere studiate con altri approcci tecnici, tra cui l'imaging Ca2, l'imaging RT-PCR/q-RT-PCR, l'immunocitochimica, l'analisi della legatura di prossimità in situ e gli approcci genomici (ad esempio, microarray, RNA-seq, CHIP-seq)15,18,30,33. Poiché i metodi di determinazione del trascrittoma a singola cellula continuano ad evolversi e a diventare altamente sensibili, inuna visione in una futura capacità di collegare regolarmente e specificamente le proprietà elettriche o farmacologiche delle singole cellule DSM con i loro profili trascrittoma/proteoma. Questo obiettivo sarà ottenuto registrando prima da una cellula DSM e poi estraendo mRNA o proteine seguite da analisi trascrittomiche/proteomiche. Anche se tali metodi sono già stati testati in cellule non DSM, sono attualmente tecnicamente impegnativi, mancano di sensibilità per essere considerati di routine e limitati al rilevamento di successo di alcuni prodotti genici selezionati74. L'espressione del profilo funzionale-molecolare che collega gli studi condotti su cellule DSM ottenute da vesciche urinarie derivate da donatori di controllo e malati per i pazienti forniranno informazioni sui processi fisiologici essenziali per guidare le normali funzioni DSM, la patogenesi e per identificare nuovi approcci terapeutici efficaci.
Divulgazioni
Nessuno.
Riconoscimenti
Questo lavoro è stato supportato dalle sovvenzioni NIH-R01DK106964 e P20DK123971 a Georgi V. Petkov. Gli autori ringraziano la dott.ssa Viktor Yarotskyy e la signora Sarah Maxwell per la valutazione critica del manoscritto. Siamo anche grati ai chirurghi del personale di urologia di MUSC e UTHSC: Drs. Thomas Keane, Harry Clarke, Stephen Savage, Ross Rames, Sandip Prasad, Jonathan Picard, Christopher Ledbetter, e Anthony Patterson, così come i residenti MUSC e UTHSC Urology: Drs Taylor. Vaughan, Samuel Walker Nickles, Matthew Young, Erin Burns, Justin Ellett, Ryan Levey, Austin Younger, Mark Currin, Nima Baradaran, Olugbemisola McCoy, Tracy Tipton, Bryce Wyatt, Alyssa Greiman, Sarah Starosta, Aaron Bloch, Christine Callaway, Lucille Cox, Christian Dewan, Erin Heitman, Bradley Houston, Stephen Legg, Robert S. Libby, Cole Locklear, Kristen Marley, Monica O'Hanlon, Patrick Probst, Cynthia Sharadin, Elizabeth Tourville, Daniel s'apata per il loro aiuto con la raccolta dei tessuti umani.
Materiali
| Name | Company | Catalog Number | Comments |
| 5 ml polystyrene round-bottom tube | Falcon | 352054 | Tubes for DS containing enzymes used in digestion steps |
| 9-Phenanthrol | Sigma-Aldrich | 211281 | TRPM4 channel inhibitor |
| Amphotericin-B | Fisher | BP928-250 | Used for patch/cell perforation |
| Amphotericin-B | European Pharmacopoeia Reference Standards | 5 | Used for patch/cell perforation |
| Amphotericin-B | Sigma-Aldrich | A9528-100MG | Used for patch/cell perforation |
| Analog vortex mixer | VWR | 58816-121 | |
| Aspartic acid | Sigma-Aldrich | A9006 | Intracellular pipette solution |
| Bovine serum albumin | Sigma-Aldrich | A7906 | DS |
| CaCl2 | Sigma-Aldrich | C1016 | Extracellular solution and DS |
| Capillary Glass | Sutter | BF150-110-7.5 | Capillary for preparation of pulled patch electrodes |
| Cesium hydroxide hydrate | Sigma-Aldrich | C8518 | Intracellular pipette solution |
| Clampex ver. 10 software includes data acqusition (Clampex) and analysis (Clampfit) programs | Axon Instruments/ Molecular Devices | pCLAMP-10 | Commerical software and part of patch-clamp rig setup |
| Collagenase type 2 | Worthington Biochemical Corporation | LS004177 | DS-C |
| CsCl | Sigma-Aldrich | 203025 | Extracellular and intracellular solutions |
| Dental wax | Miltex Dental Wax Technologies, Inc. | 18058351 | |
| Digital Thermometer with Probe | Fisher Scientific | 15-077-32 | Placed in tissue bath to monitor temperature |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2650 | Solvent |
| DL-Dithiothreitol (DDT) | Sigma-Aldrich | D9779 | Reducing agents used together with Papain |
| EGTA | Sigma-Aldrich | E3889 | Ca2+ chelator, used in intracellular pipette solution |
| Flaming/Brown micropipette puller | Sutter | P-97 | Required to pull electrodes with very fine tips |
| Floating foam tube rack/holder | VWR Scientific | 82017-634 | Used for holding tubes with enzymes for temperature control |
| Glucose | Sigma | G8270 | |
| Glutamic acid (Na salt) | Sigma-Aldrich | G1626 | DS |
| HEPES | Sigma-Aldrich | H3375 | pH Buffer |
| KCl | Fisher Scientific | BP366-1 | Extracellular solution |
| Low Noise Data Acquisition System | Axon Instruments/ Molecular Devices | Digidata 1440A | Part of patch-clamp rig setup |
| Magnetic stirrer | VWR | 01-442-684 | |
| MgCl2 (hexahydrate) | Sigma-Aldrich | M2670 | Extracellular and intracellular solutions |
| MicroForge | Narishige | MF-830 | Used for fire-polishing electrodes |
| NaCl | Sigma-Aldrich | S7653 | Extracellular and intracellular solutions |
| NaOH | Sigma-Aldrich | S8045 | |
| Nifedipine | Sigma-Aldrich | N7634 | L-type voltage-gated Ca2+ channel blocker |
| Nikon inverted microscope, TS100 with T1-SM stage with 5x, 10x, 20x, and 40x objectives | Nikon | Discontinued | Part of Patch-clamp rig setup |
| Non-metalic syringe needle, MicroFil | WPI | MF-34G-5 | Filling of intracellular pipette solution |
| Papain | Worthington Biochemical Corporation | LS003126 | DS-P |
| Pasteur pipette | FisherBrand | 13-678-20A | Tips are broken off and fire-polished and used for titration of enzymatically treated tissues to release single DSM cells from pieces |
| Patch-clamp amplifier | Axon Instruments/ Molecular Devices | Axon Axopatch 200B | Part of patch-clamp rig setup |
| PC computer | DELL | Custom configuration | Part of patch-clamp rig setup |
| pH Meter | Aspera Instruments | PH700 | |
| Polyethylene tubing | Intramedic | 427-436 | Tubing for superfusion of extracellular bath connected to glass-bottom recording chamber |
| Tetraethylammonium chloride | Sigma-Aldrich | T2265 | Ion channel blocker of Kv and BK channels added to the extracellular bath solution |
| Thermo Scientific Precision shaking water bath (model 2870) | Thermo Scientific | Discontinued | Water bath for temperature control of enzymatic digestion employed as an alternative to tissue chamber-circulating bath setup |
| Tissue bath, 100 mL | Radnoti | 1583-101 | Connected to a circulating bath and filled with water, tubes with DS and DSM pieces are placed in the setup to control the temperature of digestion steps |
| Vinyl tubing | ColePalmer | 06405-3 | Multiple uses including for connecting tissue bath to circulating water bath |
| Water circulator bath, Haake D1 L | Haake | Discontinued | Connected to tissue bath |
| Weighting scale | Mettler Toledo | XS64 | |
| ZeissAxiovert 40C inverted microscope with 10x and 40x objectives | Carl-Zeiss | Discontinued | Part of patch-clamp rig setup |
Riferimenti
- Andersson, K. E., Arner, A. Urinary bladder contraction and relaxation: physiology and pathophysiology. Physiological Reviews. 84 (3), 935-986 (2004).
- Brading, A. F., Brain, K. L., Andersson, K. E., Michel, M. C. Ion channel modulators and urinary tract function. Urinary Tract. 202, 375-393 (2011).
- Brading, A. F. Spontaneous activity of lower urinary tract smooth muscles: correlation between ion channels and tissue function. Journal of Physiology. 570, 13-22 (2006).
- Brading, A. F., Heaton, J. P., Hashitani, H. A survey of commonalities relevant to function and dysfunction in pelvic and sexual organs. International Journal of Impotence Research. 20 (1), 1-16 (2008).
- Petkov, G. V. Role of potassium ion channels in detrusor smooth muscle function and dysfunction. Nature Reviews Urology. 9 (1), 30-40 (2012).
- Andersson, K. E. Treatment-resistant detrusor overactivity--underlying pharmacology and potential mechanisms. International Journal of Clinical Practice Supplement. 151, 8-16 (2006).
- Sui, G. P., Wu, C., Fry, C. H. The electrophysiological properties of cultured and freshly isolated detrusor smooth muscle cells. Journal of Urology. 165 (2), 627-632 (2001).
- Kropp, B. P., et al. Characterization of cultured bladder smooth muscle cells: assessment of in vitro contractility. Journal of Urology. 162 (5), 1779-1784 (1999).
- Bonev, A., Isenberg, G. Arginine-vasopressin induces mode-2 gating in L-type Ca2+ channels (smooth muscle cells of the urinary bladder of the guinea-pig). Pflügers Archive - European Journal of Physiology. 420 (2), 219-222 (1992).
- Schneider, P., Hopp, H. H., Isenberg, G. Ca2+ influx through ATP-gated channels increments [Ca2+]i and inactivates ICa in myocytes from guinea-pig urinary bladder. Journal of Physiology. 440, 479-496 (1991).
- Wellner, M. C., Isenberg, G. Properties of stretch-activated channels in myocytes from the guinea-pig urinary bladder. Journal of Physiology. 466, 213-227 (1993).
- Wellner, M. C., Isenberg, G. Stretch-activated nonselective cation channels in urinary bladder myocytes: importance for pacemaker potentials and myogenic response. Experientia Supplementum. 66, 93-99 (1993).
- Klockner, U., Isenberg, G. Action potentials and net membrane currents of isolated smooth muscle cells (urinary bladder of the guinea-pig). Pflügers Archive - European Journal of Physiology. 405 (4), 329-339 (1985).
- Moore, E. D., et al. Organization of Ca2+ release units in excitable smooth muscle of the guinea-pig urinary bladder. Biophysical Journal. 87 (3), 1836-1847 (2004).
- Hristov, K. L., Chen, M., Kellett, W. F., Rovner, E. S., Petkov, G. V. Large conductance voltage- and Ca2+-activated K+ channels regulate human detrusor smooth muscle function. American Journal of Physiology - Cell Physiology. 301 (4), 903-912 (2011).
- Afeli, S. A., Rovner, E. S., Petkov, G. V. SK but not IK channels regulate human detrusor smooth muscle spontaneous and nerve-evoked contractions. American Journal of Physiology - Renal Physiology. 303 (4), 559-568 (2012).
- Hristov, K. L., et al. Kv2.1 and electrically silent Kv channel subunits control excitability and contractility of guinea pig detrusor smooth muscle. American Journal of Physiology - Cell Physiology. 302 (2), 360 (2012).
- Afeli, S. A., Malysz, J., Petkov, G. V. Molecular expression and pharmacological evidence for a functional role of Kv7 channel subtypes in Guinea pig urinary bladder smooth muscle. PLoS One. 8 (9), 75875 (2013).
- Smith, A. C., et al. TRPM4 channel: a new player in urinary bladder smooth muscle function in rats. American Journal of Physiology - Renal Physiology. 304 (7), 918-929 (2013).
- Smith, A. C., et al. Novel role for the transient potential receptor melastatin 4 channel in guinea pig detrusor smooth muscle physiology. American Journal of Physiology - Cell Physiology. 304 (5), 467 (2013).
- Hristov, K. L., Smith, A. C., Parajuli, S. P., Malysz, J., Petkov, G. V. Large-conductance voltage- and Ca2+-activated K+ channel regulation by protein kinase C in guinea pig urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 306 (5), 460-470 (2014).
- Hristov, K. L., et al. Novel regulatory mechanism in human urinary bladder: central role of transient receptor potential melastatin 4 channels in detrusor smooth muscle function. American Journal of Physiology - Cell Physiology. 310 (7), 600-611 (2016).
- Malysz, J., Afeli, S. A., Provence, A., Petkov, G. V. Ethanol-mediated relaxation of guinea pig urinary bladder smooth muscle: involvement of BK and L-type Ca2+ channels. American Journal of Physiology - Cell Physiology. 306 (1), 45-58 (2014).
- Montgomery, B. S., Fry, C. H. The action potential and net membrane currents in isolated human detrusor smooth muscle cells. Journal of Urology. 147 (1), 176-184 (1992).
- Parajuli, S. P., Soder, R. P., Hristov, K. L., Petkov, G. V. Pharmacological activation of small conductance calcium-activated potassium channels with naphtho[1,2-d]thiazol-2-ylamine decreases guinea pig detrusor smooth muscle excitability and contractility. Journal of Pharmacology and Experimental Therapeutics. 340 (1), 114-123 (2012).
- Heppner, T. J., Bonev, A. D., Nelson, M. T. Ca2+-activated K+ channels regulate action potential repolarization in urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 273 (1), 110-117 (1997).
- Petkov, G. V., Nelson, M. T. Differential regulation of Ca2+-activated K+ channels by beta-adrenoceptors in guinea pig urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 288 (6), 1255-1263 (2005).
- Herrera, G. M., Etherton, B., Nausch, B., Nelson, M. T. Negative feedback regulation of nerve-mediated contractions by KCa channels in mouse urinary bladder smooth muscle. American Journal of Physiology - Regulatory Integrative Comparative Physiology. 289 (2), 402-409 (2005).
- Malysz, J., Rovner, E. S., Petkov, G. V. Single-channel biophysical and pharmacological characterizations of native human large-conductance calcium-activated potassium channels in freshly isolated detrusor smooth muscle cells. Pflügers Archive - European Journal of Physiology. 465 (7), 965-975 (2013).
- Provence, A., Angoli, D., Petkov, G. V. Kv7 channel pharmacological activation by the novel activator ML213: role for heteromeric Kv7.4/Kv7.5 channels in guinea pig detrusor smooth muscle function. Journal of Pharmacology and Experimental Therapeutics. 364 (1), 131-144 (2018).
- Parajuli, S. P., et al. Control of urinary bladder smooth muscle excitability by the TRPM4 channel modulator 9-phenanthrol. Channels (Austin). 7 (6), 537-540 (2013).
- Ishibashi, H., Moorhouse, A. J., Nabekura, J., Okada, Y. Perforated whole-cell patch-clamp technique: a user's guide. Patch Clamp Techniques: From Beginning to Advanced Protocols. 4, 71-83 (2012).
- Provence, A., Rovner, E. S., Petkov, G. V. Regulation of transient receptor potential melastatin 4 channel by sarcoplasmic reticulum inositol trisphosphate receptors: Role in human detrusor smooth muscle function. Channels (Austin). 11 (5), 459-466 (2017).
- Hristov, K. L., et al. Suppression of human detrusor smooth muscle excitability and contractility via pharmacological activation of large conductance Ca2+-activated K+ channels. American Journal of Physiology - Cell Physiology. 302 (11), 1632-1641 (2012).
- Xin, W., Soder, R. P., Cheng, Q., Petkov, G. V. Inhibition of phosphodiesterases relaxes detrusor smooth muscle via activation of the large conductance voltage- and Ca2+-activated K+ channel. American Journal of Physiology - Cell Physiology. 302 (9), 1361-1370 (2012).
- Hristov, K. L., et al. Neurogenic detrusor overactivity is associated with decreased expression and function of the large conductance voltage- and Ca2+-activated K+ channels. PLoS One. 8 (7), 68052 (2013).
- Hristov, K. L., Parajuli, S. P., Provence, A., Rovner, E. S., Petkov, G. V. Nongenomic modulation of the large conductance voltage- and Ca2+-activated K+ channels by estrogen: A novel regulatory mechanism in human detrusor smooth muscle. Physiological Reports. 5 (14), (2017).
- Parajuli, S. P., et al. Functional link between muscarinic receptors and large-conductance Ca2+ -activated K+ channels in freshly isolated human detrusor smooth muscle cells. Pflügers Archiv - European Journal of Physiology. 467 (4), 665-675 (2015).
- Malysz, J., Rovner, E. S., Petkov, G. V. Single-channel biophysical and pharmacological characterizations of native human large-conductance calcium-activated potassium channels in freshly isolated detrusor smooth muscle cells. Pflügers Archiv - European Journal of Physiology. 465 (7), 965-975 (2013).
- Thorneloe, K. S., Nelson, M. T. Properties of a tonically active, sodium-permeable current in mouse urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 286 (6), 1246-1257 (2004).
- Barry, M. J., et al. The American Urological Association symptom index for benign prostatic hyperplasia. The Measurement Committee of the American Urological Association. Journal of Urology. 148 (5), 1549-1557 (1992).
- Klockner, U., Isenberg, G. Calcium currents of cesium loaded isolated smooth muscle cells (urinary bladder of the guinea pig). Pflügers Archiv - European Journal of Physiology. 405 (4), 340-348 (1985).
- Klockner, U., Isenberg, G. Tiapamil reduces the calcium inward current of isolated smooth muscle cells. Dependence on holding potential and pulse frequency. European Journal of Pharmacology. 127 (3), 165-171 (1986).
- Weidelt, T., Isenberg, G. Augmentation of SR Ca2+ release by rapamycin and FK506 causes K+-channel activation and membrane hyperpolarization in bladder smooth muscle. British Journal of Pharmacology. 129 (7), 1293-1300 (2000).
- Inoue, R., Brading, A. F. The properties of the ATP-induced depolarization and current in single cells isolated from the guinea-pig urinary bladder. British Journal of Pharmacology. 100 (3), 619-625 (1990).
- Inoue, R., Brading, A. F. Human, pig and guinea-pig bladder smooth muscle cells generate similar inward currents in response to purinoceptor activation. British Journal of Pharmacology. 103 (4), 1840-1841 (1991).
- Nakayama, S., Brading, A. F. Possible contribution of long open state to noninactivating Ca2+ current in detrusor cells. American Journal of Physiology - Cell Physiology. 269 (1), 48-54 (1995).
- Nakayama, S., Brading, A. F. Interaction of Ca2+ agonist and depolarization on Ca2+ channel current in guinea pig detrusor cells. Journal of General Physiology. 106 (6), 1211-1224 (1995).
- Gallegos, C. R., Fry, C. H. Alterations to the electrophysiology of isolated human detrusor smooth muscle cells in bladder disease. Journal of Urology. 151 (3), 754-758 (1994).
- JournalFry, C. H., Gallegos, C. R., Montgomery, B. S. The actions of extracellular H+ on the electrophysiological properties of isolated human detrusor smooth muscle cells. Journal of Physiology. 480, 71-80 (1994).
- Sui, G. P., Wu, C., Fry, C. H. A description of Ca2+ channels in human detrusor smooth muscle. BJU International Journal. 92 (4), 476 (2003).
- Wu, C., Sui, G., Fry, C. H. The role of the L-type Ca2+ channel in refilling functional intracellular Ca2+ stores in guinea-pig detrusor smooth muscle. Journal of Physiology. 538, 357-369 (2002).
- Bonev, A. D., Nelson, M. T. Muscarinic inhibition of ATP-sensitive K+ channels by protein kinase C in urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 265 (6), 1723-1728 (1993).
- Bonev, A. D., Nelson, M. T. ATP-sensitive potassium channels in smooth muscle cells from guinea pig urinary bladder. American Journal of Physiology - Cell Physiology. 264 (5), 1190-1200 (1993).
- Petkov, G. V., Heppner, T. J., Bonev, A. D., Herrera, G. M., Nelson, M. T. Low levels of KATP channel activation decrease excitability and contractility of urinary bladder. American Journal of Physiology - Regulatory Integrative Comparative Physiology. 280 (5), 1427-1433 (2001).
- Shieh, C. C., et al. Functional implication of spare ATP-sensitive K+ channels in bladder smooth muscle cells. Journal of Pharmacology and Experimental Therapeutics. 296 (3), 669-675 (2001).
- Shieh, C. C., et al. Characterization of a novel ATP-sensitive K+ channel opener, A-251179, on urinary bladder relaxation and cystometric parameters. British Journal of Pharmacology. 151 (4), 467-475 (2007).
- Petkov, G. V., et al. Beta1-subunit of the Ca2+-activated K+ channel regulates contractile activity of mouse urinary bladder smooth muscle. Journal of Physiology. 537, 443-452 (2001).
- Thorneloe, K. S., Nelson, M. T. Properties and molecular basis of the mouse urinary bladder voltage-gated K+ current. Journal of Physiology. 549, 65-74 (2003).
- Hristov, K. L., et al. Stimulation of beta3-adrenoceptors relaxes rat urinary bladder smooth muscle via activation of the large-conductance Ca2+-activated K+ channels. American Journal of Physiology - Cell Physiology. 295 (5), 1344-1353 (2008).
- Layne, J. J., Nausch, B., Olesen, S. P., Nelson, M. T. BK channel activation by NS11021 decreases excitability and contractility of urinary bladder smooth muscle. American Journal of Physiology - Regulatory Integrative Comparative Physiology. 298 (2), 378-384 (2010).
- Lee, H., Koh, B. H., Peri, L. E., Sanders, K. M., Koh, S. D. Functional expression of SK channels in murine detrusor PDGFRalpha+ cells. Journal of Physiology. 591 (2), 503-513 (2013).
- Lee, H., et al. Premature contractions of the bladder are suppressed by interactions between TRPV4 and SK3 channels in murine detrusor PDGFRalpha+ cells. Scientific Reports. 7 (1), 12245 (2017).
- Yarotskyy, V., Malysz, J., Petkov, G. V. Properties of single channel and whole-cell Cl- currents in guinea pig detrusor smooth muscle cells. American Journal of Physiology - Cell Physiology. 316 (5), 698-710 (2019).
- Driska, S. P., Porter, R. Isolation of smooth muscle cells from swine carotid artery by digestion with papain. American Journal of Physiology - Cell Physiology. 251 (3), 474-481 (1986).
- Seltzer, J. L., Welgus, H. G., Jeffrey, J. J., Eisen, A. Z. The function of Ca2+ in the action of mammalian collagenases. Archives of Biochemistry and Biophysics. 173 (1), 355-361 (1976).
- Skelton, G. S. Papaya proteinases. I. Temperature-and pH-stability curves. Enzymologia. 35 (5), 270-274 (1968).
- Petrova, D., Derekova, A., Vlahov, S. Purification and properties of individual collagenases from Streptomyces sp. strain 3B. Folia Microbiologica (Praha). 51 (2), 93-98 (2006).
- Sharpe, E. J., St Clair, J. R., Proenza, C. Methods for the isolation, culture, and functional characterization of sinoatrial node myocytes from adult mice. Journal of Visualized Experiments. (116), (2016).
- Brueggemann, L. I., Mani, B. K., Haick, J., Byron, K. L. Exploring arterial smooth muscle Kv7 potassium channel function using patch clamp electrophysiology and pressure myography. Journal of Visualized Experiments. (67), e4263 (2012).
- Jarriault, D., Grosmaitre, X. Perforated patch-clamp recording of mouse olfactory sensory neurons in intact neuroepithelium: functional analysis of neurons expressing an identified odorant receptor. Journal of Visualized Experiments. (101), e52652 (2015).
- Rae, J., Cooper, K., Gates, P., Watsky, M. Low access resistance perforated patch recordings using amphotericin B. Journal of Neuroscience Methods. 37 (1), 15-26 (1991).
- Knutson, K., et al. Whole cell electrophysiology of primary cultured murine enterochromaffin cells. Journal of Visualized Experiments. (139), (2018).
- Devienne, G., Le Gac, B., Piquet, J., Cauli, B. Single cell multiplex reverse transcription polymerase chain reaction after patch-clamp. Journal of Visualized Experiments. (136), (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon