Method Article
Vorbereitung und Nutzung von frisch isolierten menschlichen Detrusor glatte Muskelzellen für die Charakterisierung von 9-Phenanthrol-Sensitive KationStröme
In diesem Artikel
Zusammenfassung
Wir beschreiben eine Methode zur Herstellung der einzelnen frisch isolierten Detrusor glatten Muskelzellen aus menschlichen Harnblasenproben mit einem zweistufigen enzymatischen Verfahren. Die erhaltenen lebensfähigen DSM-Zellen können mit verschiedenen Einzelzelltechniken untersucht werden, einschließlich der beschriebenen Amphotericin-B-Patch-Clamp-Elektrophysiologie, um physiologische und pharmakologische Eigenschaften aufzudecken.
Zusammenfassung
Detrusor glatte Muskel (DSM) Zellen in der Harnblase Wand vorhanden schließlich erleichtern Urin Lagerung und Leerung. Die Vorbereitung der lebensfähigen, frischen und isolierten DSM-Zellen stellt eine wichtige technische Herausforderung dar, deren Leistung optimale Zellen für nachfolgende funktionelle und molekulare Studien bietet. Die hier entwickelte und ausgearbeitete Methode, die von unserer Gruppe seit über einem Jahrzehnt erfolgreich eingesetzt wird, beschreibt die Zerlegung menschlicher Harnblasenproben, die aus offenen Blasenoperationen gewonnen wurden, gefolgt von einer enzymatischen zweistufigen Behandlung von DSM-Stücken und mechanischer Triturierung, um frisch isolierte DSM-Zellen zu erhalten. Der erste Schritt beinhaltet die Zerlegung, um die DSM-Schicht (auch bekannt als muscularis propria) von der Schleimhaut (Urothelium, Lamina Propria und Muscularis Mucosa) und dem angrenzenden Binde-, Gefäß- und Fettgewebe zu trennen. Der DSM wird dann in Stücke geschnitten (2-3 mm x 4-6 mm) in nominell Ca2+-haltige Rortungs-/Verdauungslösung (DS). DSM-Stücke werden als nächstes auf DS-haltiges Papain und Kollagennase bei 37 °C für 30-45 min pro Schritt übertragen und nacheinander getrennt behandelt. Nach dem Einwaschgerät mit DS- enthaltendem enzymfreien Rinderserum und Trituration mit einer feuerpolierten Pipette setzen die Stücke einzelne DSM-Zellen frei. Frisch isolierte DSM-Zellen eignen sich ideal für elektrophysiologische und pharmakologische Charakterisierungen von Ionenkanälen. Insbesondere zeigen wir, dass der TRPM4-Kanalblocker 9-Phenanthrol spannungsschrittsevoktionierte Kationströme reduziert, die mit dem perforierten Patch-Clamp-Ansatz von Amphotericin-B aufgezeichnet wurden. DSM-Zellen können auch mit anderen Techniken wie einzellige RT-PCR, Mikroarray-Analyse, Immunzytochemie, In-situ-Näherungligationassay und Ca2+ Bildgebung untersucht werden. Der Hauptvorteil der Verwendung einzelner DSM-Zellen besteht darin, dass sich die gemachten Beobachtungen direkt auf einzelne Zellmerkmale beziehen, die aufgedeckt wurden. Studien an frisch isolierten menschlichen DSM-Zellen haben wichtige Erkenntnisse geliefert, die die Eigenschaften verschiedener Ionenkanäle charakterisieren, einschließlich kationdurchlässig in der Harnblase und werden als Goldstandard bei der Aufklärung der zellulären Eigenschaften und Regulatorischen Mechanismen von DSM fortgesetzt.
Einleitung
Detrusor glatte Muskelzellen (DSM) Zellen bilden die am häufigsten vorkommende Zelltyp in der Harnblase und schließlich Kontrolle Urin Lagerung und Leerung durch Entspannung und Kontraktion, beziehungsweise. DSM-Zellen bilden glatte Muskelbündel, die mit angrenzendem Bindegewebe, Nervenprozessen, interstitiellen Zellen und anderen Zelltypen1verzahnt sind. Das aktuelle Verständnis der Rolle von DSM-Zellen in der Harnblasenfunktion wurde durch einen mehrstufigen integrierten Ansatz erreicht. Jede experimentelle Methode - ob auf der Grundlage isolierter Einzelzellen in vitro, Gewebestreifen mit glatten Muskelbündeln in vitro/ex vivo oder In-vivo-Bestimmungen (wie Zytometrie und Leerungsfunktion) - liefert wichtige und spezifische Einblicke in physiologische und pharmakologische Eigenschaften von DSM (siehe Reviews1,2,3,4,5,6 für Details). Die Interpretation der Ergebnisse isolierter Einzelzellen ermöglicht es jedoch, Schlussfolgerungen speziell dem Einzelzelltyp selbst zuzuschreiben. Diese Erkenntnis war die treibende Kraft für die Etablierung einer zuverlässigen und reproduzierbaren Methode zur Gewinnung frisch isolierter DSM-Zellen aus den gesamten Dicken-Harnblasenproben. Im Gegensatz zu vielen anderen Zelltypen können glatte Muskelzellen aufgrund des Verlustes ihres nativen Phänotyps nicht zuverlässig kultiviert werden, einschließlich spezifischer Veränderungen ihrer elektrophysiologischen und kontraktilen Eigenschaften7,8. Diese Tatsache unterstreicht die Bedeutung von Studien an physiologisch aktiven, frisch isolierten DSM-Zellen.
In den späten 1980er und frühen 1990er Jahren veröffentlichte Isenbergs Gruppe (Deutschland) eine Reihe elektrophysiologischer Studien an frisch isolierten DSM-Zellen, die aus Meerschweinchen-Harnblasen9,10,11,12,13 ( Tabelle1) gewonnen wurden. Die Methode hob zwei wichtige Beobachtungen hervor, die bei der Gewinnung lebenswichtiger Zellen halfen und als erste Leitlinie für andere dienten. Sie behandelten 1) isolierte DSM-Stücke mit Ca2+-freier Lösung/Medium vor der enzymatischen Behandlung und 2) Gewebeverdauung mit einer Lösung, die Kollagennase enthält. Diese beiden kritischen Schritte wurden in alle nachfolgenden Varianten von DSM-Zelltrennungsverfahren integriert (Tabelle 1). Derzeit verwendet unsere Gruppe einen zweistufigen sequenziellen Ansatz zur Dissoziation von Papain-Kollagenase. DSM-Stücke werden zunächst mit einer Enzymlösung behandelt, die Papain enthält, und dann mit Kollagenase Typ II, die in der gleichen Lösung (DS, Dissektions-/Verdauungslösung) solubilisiert werden. Dieser Ansatz ergibt einzelne DSM-Zellen verschiedener Arten, darunter Meerschweinchen, Schwein, Ratte, Maus und vor allem Menschen (Tabelle 1).
Einzelne DSM-Zellen bieten eine Quelle für mehrere molekularbiologische und physiologische Experimente. Bisher wurden Protein- und mRNA-Expressionsmitnoniden mit Immunzytochemie, oder RT-PCR/qRT-PCR-Bestimmungen ergaben hohe Detektionsniveaus für verschiedene Ionenkanäle, einschließlich der großen Leitfähigkeitsspannung- und Ca2+-aktiviert (BK), kleiner Leitfähigkeit Ca2+-aktiviert K+ Typ 3 (SK3), spannungsgekabelte K+ (Kv), L-Typ spannungsbewehrte Ca2+ (Cav), und transiente Rezeptorpotential-Melastatin Typ 4 (TRPM4) Kanäle, sowie ein Na/Ca2+ Austauscher 14,15,16,17,18,19,20,21,22. Sie alle sind gedacht, um DSM Erregbarkeit zu steuern, intrazelluläre Ca2 + Ebenen und Kontraktilität. Elektrophysiologische Ansätze mit Patch-Clamp, die direkt an Meerschweinchen-, Maus-, Ratten- oder menschlichen DSM-Zellen durchgeführt werden, lieferten einen direkten Nachweis der biophysikalischen und pharmakologischen Eigenschaften von L-Typ Cav, Kv (Kv2.x. Kv7), SK, BK und TRPM4 Kanäle17,19,20,21,22,23,24,25 ,26,27,28,29,30,31. Die Ansätze umfassten eine konventionelle Ganzzell-Spannungsklemme, eine perforierte Spannungsklemme und einkanalige Aufnahmen (Zellen-, Innen- und Außenkonfigurationen). Darüber hinaus lieferte die Membran-Potenzialaufzeichnung von DSM mit einer Stromklemme Beweise dafür, dass zielorientierte pharmakologische Wirkstoffe die Zellerregbarkeit verändern. Zum Beispiel, die TRPM4-Hemmer 9-Phenanthrol induzierte Hyperpolarisation in DSM-Zellen von Menschen, Meerschweinchen, und Ratte Harnleitern19,20,22,31. Unter den verschiedenen elektrophysiologischen Methoden bieten die perforierten Patch-Clamp-Aufnahmen von Amphotericin-B (und Nystatin, Gramicidin und A-Escin) einen entscheidenden Vorteil, da sie intrinsische intrazelluläre Signalmoleküle und -wege erhalten. Nur niedermolekulare Kationen und in geringerem Maße sind Cl- - aber keine Proteine oder Signalmoleküle einschließlich Ca2+ - durch die Plasmamembranporen durchlässig, die durch Amphotericin-B oder Nystatin32gebildet werden. Das erfolgreiche Ergebnis perforierter Patch-Clamp-Experimente hängt von mehreren allgemeinen Variablen ab, die für diese Technik einzigartig sind. Hier beschreiben wir die Details des Verfahrens mit Amphotericin-B, die unsere Gruppe erfolgreich in den Jahren15,22,33,34,35,36,37,38,39.
Vermutlich bleiben nicht-selektive Kationenkanäle einer der am wenigsten verstandenen Kanaltypen in DSM-Zellen. Der erste Bericht eines nicht selektiven kationenähnlichen Kanals stammt aus dem Jahr 1993. Das Papier von Wellner und Isenberg11 beschrieb einen 33 pS Stretch-aktivierten Einzelkanal, der die folgende Rangfolge der Ionenpermeabilität anzeigt: K+>Na+>Cs+>>>Ba2+>Ca2+, und Hemmung der Kanalaktivität durch Gd3+, ein allgemeiner Inhibitor nicht-selektiver Kationenkanäle. Fast ein Jahrzehnt später beschrieben Thorneloe und Nelson40 Na+ durchlässige Kationströme in Maus-DSM-Zellen, die von Gd3+gehemmt wurden, mit Ganzzellaufnahmen. Da molekulare Identitäten nicht-selektiver Kationenkanäle und deren biophysikalische Charakterisierungen noch zu bestimmen sind, sind zukünftige Untersuchungen in diesem Forschungsbereich gerechtfertigt. Das hier beschriebene Protokoll zur Erfassung nichtselektiver Kationenkanalströme - unter Verwendung extrazellulärer und pipetten intrazellulärer Lösungen, die Cs+, TEA+und Nifedipin enthalten (Tabelle 2), die k v- und caologisch milderndeK-v- undCa-v-Ströme - war und bleibt bei elektrophysiologischen Untersuchungen nicht-selektiver Kationenkanäle nützlich. Wir haben dieses spezifische Protokoll verwendet, um das Ausmaß der Hemmung von Ganzzell-Kationströmen durch den TRPM4-Kanalblocker 9-Phenanthrol in Meerschweinchen-, Ratten- und menschlichen DSM-Zellen19,20,22zu bestimmen.
Zusammengenommen bietet das hier beschriebene Verfahren zur Gewinnung frisch isolierter einzeler DSM-Zellen aus der menschlichen Harnblase lebensfähige Zellen, die sich hervorragend für elektrophysiologische Untersuchungen eignen, mit verschiedenen Konfigurationen der Patch-Clamp-Technik, Ca2+-Imaging, Immunocytochemistry, in situ proximal litigation assay und single cell RT-PCR/qRT-PCR sowie fortgeschrittenemolekulare Biologietechniken wie Mikroarrayanalyse, RNA-seq und CHIP-seq. Die Verwendung der perforierten Patch-Clamp-Methode Amphotericin-B bewahrt die native Zellumgebung im Gegensatz zu anderen Konfigurationen. Bei der Durchführung der hier beschriebenen spezifischen Bedingungen, die dazu bestimmt sind, Beiträge von K+ und Ca2+ Strömen in DSM-Zellen zu negieren, zeigen spannungsschrittinduzierte Ströme die Eigenschaften nichtselektiver Kationströme an, die für biophysikalische und pharmakologische Charakterisierungen geeignet sind.
Protokoll
Alle hier beschriebenen Methoden wurden von institutional Review Board Committees des University of Tennessee Health Science Center (Memphis, TN, IRB- 17-05714-XP) und der Medical University of South Carolina (Charleston, SC, IRB-00045232) genehmigt. Die zugelassenen Verfahren ermöglichen es, ganze Dicke Harnblase Proben (>1 cm x >1 cm) - enthält alle Schichten einschließlich Schleimhaut, Detrusor glatten Muskel, und Serosa sowie sind angebundene Blutgefäße und Fettgewebe) - von Patienten-Spendern unter einer chirurgischen partiellen Extraktion der Blase gesammelt werden. Patientenspender sind erwachsene (Altersspanne, die bisher untersucht wurde: 25 bis 87 Jahre alt), entweder männlich oder weiblich, mit oder ohne Symptome einer überaktiven Blase (nach Der American Urological Association I-PSS Score41). Chirurgische Verfahren beinhalten eine Vielzahl von Erkrankungen einschließlich radikaler Zystektomie für urotheliale Karzinom, und Adenokarzinom. In solchen Fällen ist die gesammelte Harnblase Probe entfernt von der Stelle des Tumors.
1. Zerlegung von DSM-Geweben und Herstellung von schleimhautfreien DSM-Stücken
- Untersuchen Sie die gesamte Dicke der Harnblase, die aus dem Operationssaal in einem dicht verschlossenen Behälter mit der kalten Dissektions-/Verdauungslösung im Labor ankam(Abbildung 1 und Tabelle 2 für die Zusammensetzung von DS).
HINWEIS: Die Probe wird in der Regel in kaltem DS von ein paar Stunden bis über Nacht vor der Ankunft im Labor aufbewahrt. Für längere Speicher wird DS (Tabelle 2) um 1 mM CaCl2ergänzt. - Entfernen und spülen Sie die menschliche Gesamtdicke DSM-Probe (enthält alle Schichten einschließlich Schleimhaut, DSM und Serosa) mit eiskaltem DS, um befestigte Trümmer und Blut auszuwaschen.
- Pin die Harnblase Probe, Schleimhaut nach oben und serosa nach unten, auf einem Silikon Enantiomer beschichtet (Tisch der Materialien) 150 mm Durchmesser runde Schale gefüllt mit eiskalten DS ( Abbildung1B).
- Entfernen Sie das angrenzende Fettgewebe, die Blutgefäße, das Epithel (Urothel) und die Muskulatur schleimhaut aus der Probe durch scharfe Zerlegung mit Mikroschere und Zange.
- Schneiden Sie mehrere schleimhautfreie DSM-Stücke (2-3 mm lang und 4-6 mm breit) aus (Abbildung 1C).
2. Enzymatische Dissoziation von DSM-Stücken, die frisch isolierte Einzel-DSM-Zellen ergeben
- 3 bis 6 DSM-Stücke in ein Rohr geben, das 1 bis 2 ml vorgewärmte DS enthält, die Papain und Dithiothreitol (DS-P, Tabelle 2)enthalten, und DSM-Stücke in DS-P für 30-45 min bei 37 °C vorsichtiges Schütteln des Rohres gelegentlich (einmal alle 10-15 min) inkubieren.
HINWEIS: Um die Temperatur für die enzymatische Behandlung optimal zu steuern, werden Rohre mit Gewebeteilen und Enzymlösungen entweder in einer Glasgewebekammer platziert, die mit Wasser gefüllt ist, das mit einem zirkulierenden beheizten Wasserbad verbunden ist (Abbildung 1D) oder in einem hochpräzisen, temperaturgeregelten Schüttelwasserbad (Abbildung 1E). - DS-P aus dem Rohr nehmen, DSM-Stücke kurz mit eiskaltem DS waschen, kalteS DS aus dem Rohr werfen und DSM-Stücke an der Unterseite des Rohres zurücklassen lassen.
- 1 bis 2 ml DS-haltige Kollagenase Typ II (DS-C, Tabelle 2) mit DSM-Stücken in das Rohr geben, sanft mischen; und inkubieren Sie für 25-40 min bei 37 °C sanft schütteln das Rohr gelegentlich (alle 10-15 min).
- DS-C entsorgen und enzymbehandelte DSM-Stücke 5-10 Mal mit eiskaltem DS waschen.
- Nach der letzten Wäsche, lassen Sie DS-Lösung in der Röhre; sanft trituieren Sie mehrmals mit einer feuerpolierten Pasteurpipette, um einzelne DSM-Zellen freizusetzen.
- Legen Sie ein paar Tropfen DS-Lösung mit dispergierten DSM-Zellen auf eine Glasbodenkammer oder einen Deckelschlupf und überprüfen Sie die Qualität unter dem Mikroskop (mit einem 20x oder 40x Objektiv) nach mindestens 5 min nach der Anwendung, damit die Zellen unten.
- Verwenden Sie sofort frisch isolierte DSM-Zellen für elektrophysiologische Experimente oder lagern Sie die Zellen in einer Tube, die DS bei 4 °C enthält, entweder auf Eis oder im Kühlschrank bis zur Verwendung (typischerweise für bis zu 8 h Zubereitung).
HINWEIS: Innerhalb derselben Zubereitung variiert die Qualität der Zellen von hochgradig lebensfähig bis zu überauten, abgestorbenen DSM-Zellen (Abbildung 2). Wenn die sequentielle Papain-Kollagenase-Methode eine sehr hohe Anzahl von nicht lebensfähigen Zellen ergibt, wird die Zubereitung verworfen, und eine neue Verdauung von DSM-Stücken wird durchgeführt, jedoch mit reduzierten Inkubationsintervallen. Wenn das Verfahren zu wenig DSM-Zellen ergibt, werden für die anschließende Verdauung von DSM-Stücken die Inkubationsintervalle erhöht. Die positive Immunreaktivität auf den glatten Muskelakt in bestätigt die Identität der DSM-Zellen (Abbildung 3).
3. Aufzeichnung von Spannungsschritt induzierten Kationenströmen von DSM-Zellen mit Amphotericin-B perforierte Ganzzellspannung Patch-Clamp-Technik
- Pipette 0,25-1 ml Zellsuspension auf eine Glasbodenkammer, die auf einer Bühne eines invertierten Mikroskops sitzt, und lassen Sie die Zellen am Glasboden haften.
- Nach der Inkubation für mindestens 45 min, entfernen DS aus dem Bad und ersetzen sie durch die E-Lösung (Tabelle 2) durch Superfusion, bei der der durch die Schwerkraft unterstützte Lösungsfluss durch Einlassschläuche DS durch die neue Lösung ersetzt, während Auslassschläuche, die mit einem Vakuumabfallbehälter verbunden sind, die Kammerlösung entfernen und überlaufen. Beachten Sie, dass die E-Lösung Tetraethylammonium (TEA+) und Cäsium (Cs+) Ionen enthält, um K+ Ströme zu hemmen.
- Bereiten Sie eine Arbeitsstocklösung von Amphotericin-B in Dimethylsulfoxid (DMSO) (1 mg pro 10 l DMSO) vor. Um Amphotericinpulver vollständig aufzulösen, beschallen (mindestens 15 min) und wirbeln Sie die Lösung gut aus.
HINWEIS: Dieser Schritt dauert in der Regel weniger als 10 min. Lösen 3-4 mg Amphotericin-B in 30-40 l DSMO in einem 1,5 ml Mikrozentrifugenrohr funktioniert gut. Höhere Mengen an Amphotericin-B erfordern mehr DSMO-Lösungsmittel, was typischerweise zu einem längeren Intervall für das Mischen und die unvollständige Löslichkeit der im Rohr vorhandenen Amphotericin-B-Feststoffpartikel führt. - Lösen Sie die Vorratslösung von Amphotericin-B in der Pipettenlösung (Lösung P, Tabelle 2), um eine Endkonzentration von 200-500 g/ml zu erhalten. Dieser Schritt erfordert eine umfangreiche Beschallung und Wirbelung bei einer Hochgeschwindigkeitseinstellung (8-10/10) für 30 bis 60 min pro Schritt, um eine optimale Durchmischung und Vermeidung von Amphotericin-B-Ausscheidung in der Pipettenlösung zu gewährleisten.
HINWEIS: Amphotericin-B fällt über die Zeit und ist lichtempfindlich. Die Arbeitspipettenlösung mit Amphotericin-B wird auf Löslichkeit geprüft, vor der Pipettenfüllung von Hand gemischt und im Dunkeln gehalten. - Ziehen Sie mehrere Patchelektroden, feuerpolige Elektrodenspitzen und beschichten Sie die Spitzen (falls erforderlich) mit Zahnwachs.
- Füllen Sie die Spitze einer Patchelektrode mit der Pipettenlösung (Lösung P, Tabelle 2) ohne Amphotericin-B, indem Sie die Elektrode kurz in die Lösung tauchen.
- Füllen Sie die Elektrode mit der gleichen Pipettenlösung, die Amphotericin-B enthält.
- Montieren Sie die Elektrode an einem Halter, der mit einer Patch-Clamp-Verstärker-Kopfbühne verbunden ist.
- Platzieren Sie die Elektrode mit einem Mikromanipulator direkt unter der Oberfläche der extrazellulären Lösung, so dass die Spitze der Elektrode einfach untergetaucht ist.
- Stellen Sie im Spannungsklemmenmodus das Haltepotential auf 0 mV ein und stellen Sie den Strom mit dem Pipettenoffsetrad am kommerziellen Verstärker(Tabelle der Materialien)auf 0 pA ein.
- Bestimmen Sie den Elektrodenwiderstand mit dem Membrantestfenster/der Funktion der kommerziellen Erfassungssoftware (Tabelle der Materialien). Um Tools>Membrantest>Wiedergabe oder ein Verknüpfungssymbol in der Software zu aktivieren. Der ermittelte Elektrodenwiderstand sollte im Bereich von 2 bis 5 M' liegen.
HINWEIS: Die Membrantestfunktion, die in der kommerziellen Erfassungssoftware oder der Seal Test-Option am Verstärker bereitgestellt wird, kann verwendet werden, um den Elektrodenwiderstand durch wiederholtes Anwenden von Spannungsschritten zu überwachen. - Setzen Sie die Überwachung des Elektrodenwiderstands fort, während Sie die Elektrode mit einem Mikromanipulator auf eine ausgewählte DSM-Zelle zubewegen (Abbildung 4A).
HINWEIS: Um als lebensfähige DSM-Zelle betrachtet zu werden, muss die Zelle eine spindelförmige, längs verlängerte Morphologie, einen klar definierten Halo um die Zelle, scharfe Kanten und ein semi-kontraktiles (Serpentin)-Erscheinungsbild aufweisen. - Beim Berühren der Zelloberfläche mit der Elektrode - angezeigt durch eine schnelle Erhöhung des Elektrodenwiderstands gemessen mit der Membrantestfunktion - bilden Sie eine Giga-Dichtung, indem Sie über Schläuche einen sanften, schnellen Unterdruck auf den Elektrodenhalter anwenden. Dies führt zu einem Negativen Druck an der Spitze der Elektrode, der die Zellmembran in die Elektrode zieht und dabei hilft, eine Giga-Dichtung zu bilden, oder zu einem sehr engen Kontakt zwischen Elektrode und Plasmamembran(Abbildung 4B).
- Sobald sich die Giga-Dichtung bildet, kompensieren Sie die Pipettenkapazität, indem Sie schnelle und langsame Zifferblätter am kommerziellen Verstärker einstellen und die Giga-Dichtungsstabilität (Leckstrom) mit der Membrantestfunktion überwachen.
- Erlauben Sie Zeit, typischerweise 30-60 min, damit Amphotericin-B die Pipette nach unten diffundieren und in die Plasmamembran eingeführt werden, die Poren bilden, die hauptsächlich selektiv auf monovalente Kationen sind. Führen Sie in diesem Schritt die Überwachung der Giga-Dichtung mit der Membrantestfunktion fort. Mit zunehmender Zellperforation wird auch die Amplitude der Kapazitätstransienten (vergleiche Abbildung 4B im Vergleich zu Abbildung 4C mit keiner bzw. effektiven Zellperforation) mit der Membrantestfunktion gemessen.
- Wenn die Patch-Perforation optimal ist (gemessen an einem stabilen Serienwiderstand, der typischerweise unter 50 Mio. m liegt), heben Sie die Kapazitätstransienten auf, indem Sie die Zifferblätter für die Zellkapazität und den Serienwiderstand am Verstärker anpassen. Zu diesem Zeitpunkt kann auch eine Widerstandskompensation der Serie durchgeführt werden (Abbildung 4D).
- Sobald stabile Spannungsschritt-induzierte Kationströme beobachtet werden, die durch das angegebene Protokoll evoziert werden, wenden Sie eine verbindung oder physiologische Bedingung an, um durch Superfusion zu testen, und zeichnen Sie die Reaktionen für die Steuerung- kommerzielle Akquisitionssoftware.
- Zeichnen Sie Ströme mit einem routinemäßigen Spannungsschrittprotokoll auf, bei dem DSM-Zellen bei -64 oder -74 mV gehalten und die Spannung in 10 mV-Schritten für 400 oder 500 ms von -94 bis +96 oder +106 mV erhöht und zum Haltepotenzial zurückgefahren wird.
ANMERKUNG: Die Membranpotentialwerte werden für ein flüssiges Anschlusspotential von 14 mV angepasst (mit P- und E-Lösungen, Tabelle 2). Das flüssige Anschlusspotenzial wird in der kommerziellen Erfassungssoftware (Tabelle der Materialien) durch Klicken (Werkzeuge>Junction Potentials) und Eingabe der Konzentrationen von Lösungsionenkomponenten ermittelt. Ein Rampenprotokoll kann auch verwendet werden, um aktuelle Aufnahmen zu erhalten. - Führen Sie das Spannungsprotokoll im kontinuierlichen Intervall von 1 min während eines Experiments aus, um Ströme für Voradditionssteuerung, Testbedingung und Auswaschung aufzuzeichnen.
- Zeichnen Sie Ströme mit einem routinemäßigen Spannungsschrittprotokoll auf, bei dem DSM-Zellen bei -64 oder -74 mV gehalten und die Spannung in 10 mV-Schritten für 400 oder 500 ms von -94 bis +96 oder +106 mV erhöht und zum Haltepotenzial zurückgefahren wird.
4. Datenanalyse und Visualisierung
- Öffnen Sie aufgezeichnete Dateien in der kommerziellen Datenanalysesoftware (Tabelle der Materialien) für die Steuerung, Testbedingung und Auswaschung, indem Sie auf Datei>Daten öffnen klicken und Dateien auswählen, die für das Öffnen von Interesse sind.
HINWEIS: Für die Analyse werden in der Regel drei Dateien (die jeweils einen einzigen Satz von Ablaufverfolgungen zu einem einzelnen Protokolllauf enthalten) für jede Bedingung geöffnet und analysiert. Die Antworten werden anschließend gemittelt, um eine mittlere Antwort für jede Bedingung zu erhalten. Die für die Datenerfassung verwendete Software enthält eine Option, um automatisch benutzerdefinierte mehrere Testläufe zu erfassen und für einzelne Ausgabedateien, die als Alternative verwendet werden können, zu durchschnittlich zu sein. - Erhalten Sie die durchschnittliche Antwort in den letzten 200 ms für die Stromspur, die bei jeder Spannung gemessen wird; das gewählte Dauerintervall spiegelt eine stationäre Spannungs-Schritt-Stromaktivierung wider. Führen Sie dazu die folgenden Schritte aus.
- Wählen Sie eine Datei von Interesse für die Analyse in der kommerziellen Analyse-Software (Tabelle der Materialien).
HINWEIS: Die Software positioniert die zuletzt importierte Datei in ihrem aktiven Anzeigefenster. Die geöffnete Datei zeigt eine Reihe von überlappenden Ablaufverfolgungen an, die mit einem Spannungsschrittprotokoll erhalten wurden. Standardmäßig werden im aktiven Fenster vier Cursor (Anzeige von x- und y-Werten für die hervorgehobene Ablaufverfolgung) angezeigt. - Wählen Sie den Analysebereich aus, indem Sie den Cursor 2 am Ende des Spannungsschritts 400 oder 500 ms und den Cursor 1 im Abstand von 200 ms davor positionieren, so dass der Analysebereich 200 ms beträgt.
- Erhalten Sie Antworten für jede Spannung, indem Sie auf Analysieren>Schnellgraph>IV (oder das IV-Verknüpfungssymbol) klicken (im Eingabeaufforderungsfenster vor dem Generieren von Daten bestätigen, dass für y-Achsen (Aktuelle) Signalbereichsoptionen "Cursor 1..2" und "Mittelwert" ausgewählt sind). Klicken Sie auf OK, um das I-V-Diagramm zu generieren und die Daten in ein Ergebnisspaltenblatt zu platzieren, das durch Zugriff auf Windows>Ergebnisseangezeigt werden kann.
- Analysieren Sie zusätzliche Dateien, indem Sie die Schritte 4.2.1 - 4.2.3 wiederholen. Klicken Sie auf Analysieren>Schnellgraph>IV oder die IV-Symbolverknüpfung, und wählen Sie Anfügen statt Ersetzen aus, um dem Ergebnisblatt bei der Verarbeitung der Ablaufverfolgungen zusätzliche Daten hinzuzufügen.
- Kopieren Sie Daten in eine Kalkulationstabelle, indem Sie die interessierten Spalten auswählen und STRG+C zum Kopieren und STRG+V zum Einfügen drücken. Speichern Sie das Ergebnis-Arbeitsblatt in der kommerziellen Analysesoftware (Tabelle der Materialien) im Format (*.rlt), indem Sie auf Datei>Speichern unterklicken.
- Wählen Sie eine Datei von Interesse für die Analyse in der kommerziellen Analyse-Software (Tabelle der Materialien).
- Normalisieren Sie für jede Zelle die Antworten für alle drei Bedingungen auf den Wert des maximalen Spannungsschritts für die Voradditionssteuerung (gemäß der Formel: Response/ResponseControl-Max) und grafisch die Antworten als Stromwerte (oder Stromdichte) im Vergleich zu Spannungsbeziehungen (Abbildung 6).
- Bestimmen Sie in einem Arbeitsblattprozessor die durchschnittlichen Antworten als Ströme (pA) oder Stromdichten (pA/pF) zur Steuerung, Testbedingung (in diesem Beispiel 9-Phenanthrol) und Auswaschen bei jedem Spannungsschritt.
- Teilen Sie die Werte für jede Spannung jeder Bedingung (Steuerung, 9-Phenanthrol und Auswaschen) durch die maximale Kontrollantwort, die bei der höchsten Spannung (+96 mV in Abbildung 6)für die Voradditionssteuerung nach der Formel: Normalisiertes Ansprechverhalten für Condition(x) = Response(x)/ ResponseControl-Max für (x)erhalten wird.
- Ordnen Sie die Daten für die Zusammenfassungsanalyse in einem Format an, das zur Visualisierung einfach in ein grafisches Programm (z. B. GraphPad Prism) kopiert werden kann.
Ergebnisse
Die enzymatische Dissoziation von DSM-Stücken bietet gesunde, frisch isolierte DSM-Zellen, die routinemäßig in funktionellen und molekularen Studien wie: Patch-Clamp-Elektrophysiologie und Immunzytochemie verwendet werden. Abbildung 1 fasst die Sezierschritte zusammen und visualisiert die Einstellungen für die Temperaturregelung enzymatischer Behandlungsschritte. Abbildung 2 zeigt Hellfeldbilder von DSM-Zellen, die aus drei menschlichen Harnblasenproben jeweils von einem anderen Patientenspender gewonnen wurden. Gesunde einzelne DSM-Zellen zeichnen sich durch spindelförmige Morphologie, gestochen scharfe, gut definierte Kanten, einen klar definierten Halo um die Zelle und ein halbkontraktiles (serpentinartiges) Aussehen aus, wenn sie unter dem Mikroskop betrachtet werden (siehe DSM-Zellen, die durch weiße Pfeile in Abbildung 2gekennzeichnet sind). Sie reagieren auch auf kontraktionsstimulierende Mittel wie die muskarinischen Agonisten Carbachol oder hohe K+ (60 mM) Anwendungen. DSM-Zellen zeigen eine positive Immunreaktivität für den glatten Muskelakt, der ihre Identität bestätigt (Abbildung 3).
DSM-Zellen eignen sich ideal für elektrophysiologische Patch-Clamp-Untersuchungen von Ionenkanaleigenschaften. Hier beschreiben wir die amperein-B perforierte Patch-Clamp-Aufnahmemethode mit Pipetten und extrazellulären Lösungen (Tabelle 2), um spannungsschrittinduzierte Kationenkanäle optimal aufzuzeichnen. Unter den eingesetzten spezifischen Bedingungen sorgte die Blockade von Kv- und L-Typ Ca2+-Strömen mit Cs+/TEA+ bzw. Nifedipin für die Eliminierung des Beitrags dieser ionenförmigen Komponenten zu den ganzzelligen spannungsbeschworenen Strömen. Abbildung 4 und Abbildung 5 zeigen die experimentellen Schritte der amperhotericin-B perforierten Patch-Clamp-Methode und repräsentativen Ganzzellströmen, die entweder mit einem spannungsbedingten induzierten oder einem Rampenprotokoll in drei verschiedenen menschlichen DSM-Zellen gemessen werden, jeweils von einem anderen Patientenspender. Beachten Sie, dass die Aufnahmen eine gewisse Variabilität in Bezug auf aktuelle Amplituden und äußere Korrektur aufweisen. Weitere Experimente ergaben, dass 9-Phenanthrol, ein TRPM4-Kanalinhibitor, menschliche DSM-Kationströme bei negativen und positiven Spannungen effektiv und reversibel hemmte (Abbildung 6). Die 9-Phenanthrol-empfindliche Stromkomponente veranschaulicht eine stärkere Hemmung bei positiven Spannungen und äußerer Korrektur (Abbildung 6C).
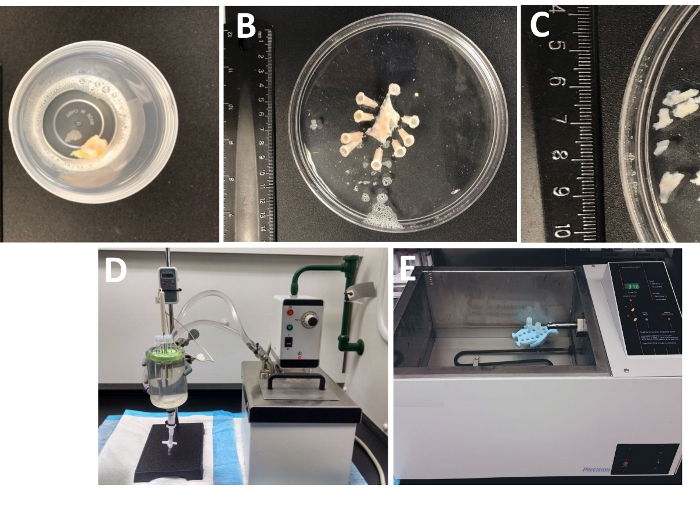
Abbildung 1: Zusammenfassung der Sezierschritte, die zur Herstellung von Detrusor-Smooth Muscle (DSM)-Stücken und Setup für enzymatische Dissoziation führen. Gezeigt werden Bilder von: (A) einer ganzen Dicke menschlichen Harnblasenprobe aus einer offenen Blasenoperation als fremdes chirurgisches Material in eiskaltem DS zur Verfügung gestellt, (B) die gleiche Zubereitung nach dem Anheften mit einer teilweise sezierten DSM-Schicht, (C) DSM-Stücke variabler Abmessungen, die aus der DSM-Schicht ausgeschnitten sind, die für die enzymatische Verdauung bereit sind (kleinere Stücke) oder andere experimentelle Untersuchungen (größere Stücke), (D, E) alternative Setups, die für die enzymatische Verdauung von DSM-Stücken verwendet werden, die aus entweder (1) ein temperaturgeregeltes Zirkulierendes Wasserbad, das über Schläuche mit einer großen mit Wasser gefüllten Glasgewebekammer verbunden ist, ein Gummihalter für Rohre, Kunststoffrohre mit DSM-Stücken und Enzymlösungen, die in Zerlegungs-/Verdauungslösung hergestellt werden (DS, entweder DS-P oder DS-C, Tabelle 2) und eine Temperatursonde, die mit einem Display verbunden ist, das eine kontinuierliche Überwachung ermöglicht (D), oder (2) ein großes wassergefülltes, temperaturgeregeltes Bad, das einen Halter und Röhren mit DSM-Stücken und Enzymlösungen enthält (E ). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
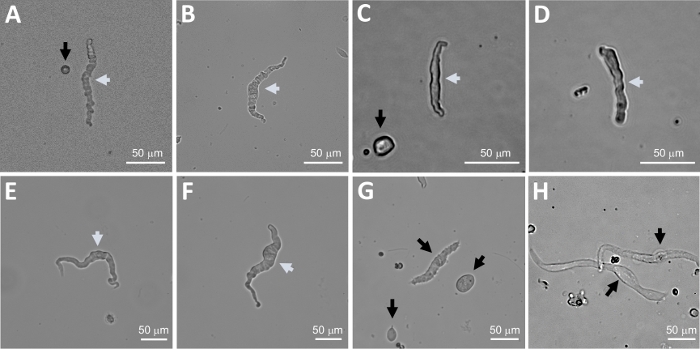
Abbildung 2: Repräsentative Hellfeldbilder menschlicher, frisch isolierter DSM-Zellen, die mit der sequenziellen Papain-Kollagenase-Gärungsmethode gewonnen wurden. (A-F) Gezeigt werden Bilder lebensfähiger, physiologisch aktiver DSM-Zellen, die als geeignete Kandidaten für den Versuch von perforierten Patch-Clamp-Aufnahmen gelten. (G, H) Bilder von nicht lebensfähigen oder überautierten Zellen; solche Zellen wurden für Patch-Clamp-Experimente vermieden. Weiße und schwarze Pfeile in Paneelen (A-H) weisen auf DSM-Zellen hin, die als lebensfähig bzw. nicht lebensfähig gelten, um Patch-Clamp-Aufnahmen zu versuchen. Beachten Sie, dass die schwarzen Pfeile in den Feldern (A, C und G) auf Zellfragmente (kreiste Stücke) oder kleine Zellen ohne DSM-Morphologie zeigen und in (H) erscheinen die Zellen blass und erweitert. Die Bilder stammen von drei verschiedenen Harnblasenproben(A und B : Patienten-Spender-Quelle eins, C und D : Patienten-Spender-Quelle zwei und E-H : Patienten-Spender-Quelle drei). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
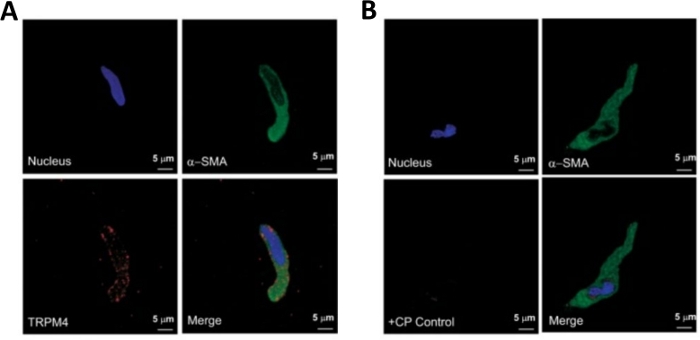
Abbildung 3: Ausdrücke des transienten Rezeptorpotential-Melastatin-Typ-4-Kanals (TRPM4) und der muskelspezifischen Actin-Immunreaktivität in einzelnen menschlichen DSM-Zellen durch Immunzytochemie-Analyse. (A) Gezeigt werden konfokale Bilder, die den immunzytochemischen Nachweis der TRPM4-Kanalproteinexpression in einer menschlichen DSM-Zelle zeigen. Rote Färbung (unten links) zeigt TRPM4-Kanalproteine an; blaue (DAPI) Färbung erkennt Zellkerne (oben links); grüne Färbung zeigt auf den glatten Muskelaktin (-SMA, oben rechts); Das zusammengeführte Bild (unten rechts) veranschaulicht die Überlappung aller drei Bilder. (B) Konfokale Bilder zur Veranschaulichung der Dämpfung des immunzytochemischen Nachweises der TRPM4-Kanalproteinexpression in Gegenwart eines TRPM4-spezifischen konkurrierenden Peptids (CP) in isolierten menschlichen DSM-Zellen. Blaue (DAPI) Färbung zeigt Zellkerne (oben links); grüne Färbung ist für den glatten Muskelaktin (-SMA, oben rechts); Das zusammengeführte Bild (unten rechts) veranschaulicht die Überlappung aller drei Bilder. Die Ergebnisse wurden in vier separaten Experimenten mit DSM-Vollgewebe oder mehreren DSM-Zellen, die von vier Patienten isoliert wurden, verifiziert. Die Bilder stammen von Hristov et al. (2016)22 und werden mit Genehmigung verwendet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
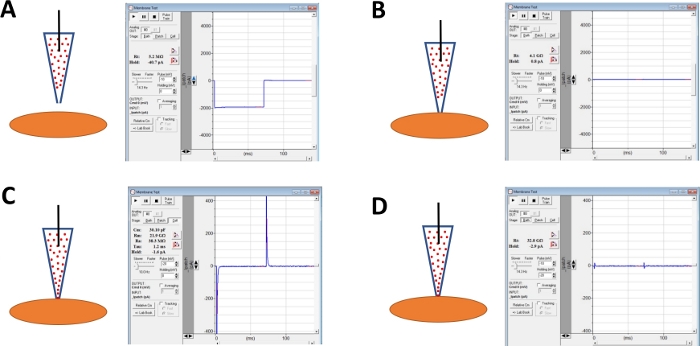
Abbildung 4: Schematische Darstellung von Schritten bei der Giga-Siegelbildung und Amphotericin-B-Perforation menschlicher DSM-Zellen. Illustriert sind räumliche Positionen einer Amphotericin-B enthaltenden Pipette und einer DSM-Zelle zusammen mit den zugehörigen Antworten für Membrantests, die in der kommerziellen Erfassungssoftware (Tabelle der Materialien) durch Änderung von Spannungsschritten (in diesem Beispiel -10 oder -20 mV) zur Bestimmung des Widerstands erhalten wurden. Konfigurationen sind: (A) vor dem Zellansatz mit einer Elektrode, (B) nach Giga-Dichtungsbildung durch Positionierung der Amphotericin-B-haltigen Pipette (Amphotericin-B durch rote Punkte dargestellt) auf die Zelloberfläche und Anwendung von Unterdruck, (C) die on-cell-Konfiguration, die nach Derichtäusbildung 45 min gezeigt wurde, hat zu diesem Zeitpunkt Amphotericin-B die Pipette nach unten diffundiert und ihre Moleküle haben sich an der Spitze der Elektrode in die Plasmamembran eingefügt. durchlässige Poren, und (D) die gleiche Konfiguration wie in (C), aber mit Kapazität Transienten mit Zifferblättern für Ganzzell-Kapazität und Serienwiderstand auf dem Verstärker abgebrochen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
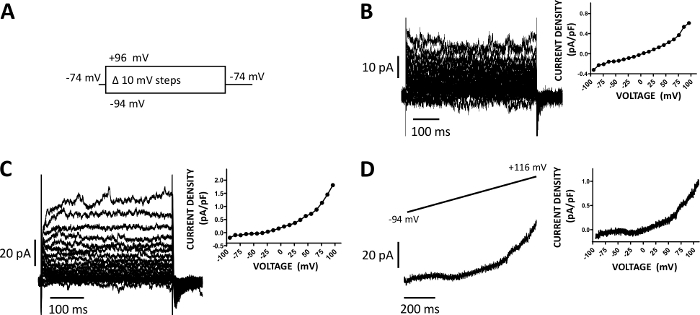
Abbildung 5: Vollzellkationsströme, die mit amphotericin-B perforierter Patch-Clamp-Methode in menschlichen DSM-Zellen aufgezeichnet wurden. (A) Ein Diagramm des Spannungsschrittprotokolls zeigt ein Haltepotential von -74 mV und Spannungsschritte von 400 ms Dauer von -94 bis +96 mV, das in 10 mV-Schritten durchgeführt und dann auf -74 mV zurückgeführt wird. (B, C) Repräsentative Stromspuren zusammen mit Stromdichte-Spannungsdiagrammen von zwei verschiedenen menschlichen DSM-Zellen, jeweils von einer anderen Harnblase Probe/Patienten-Spender mit dem Spannungs-Schritt-Protokoll unter (A) beschrieben erhalten. (D) Ein Beispiel für eine Stromspur, die mit einem Rampenprotokoll erhalten wurde (grafisch dargestellt im oberen Einset als Spannungsänderung von -94 auf +116 mV über eine Dauer von 1 s bei 0,21 mV/ms, Haltepotenzial betrug -94 mV). Auf der rechten Seite in Panels (B-D) zeigen die Diagramme die aktuelle Dichte-Spannungs-Beziehung für jede aufgezeichnete DSM-Zelle an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
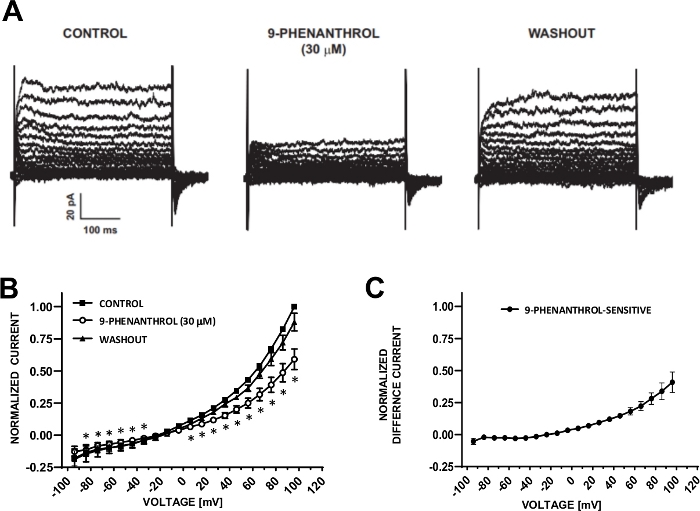
Abbildung 6: TRPM4-Kanalblocker 9-Phenanthrol-vermittelte Hemmung von Spannungsschritt-induzierten Kationenströmen in menschlichen DSM-Zellen. (A) Gezeigt werden repräsentative Ströme, die mit dem in Abb. 5A beschriebenen Spannungsschrittprotokoll zur Steuerung, 9-Phenanthrol und Auswaschung gemessen werden. (B) Zusammenfassung normalisierter Ansprechvorgänge versus Spannung zur Steuerung, 9-Phenanthrol und Auswaschen in sieben DSM-Zellen (von sieben verschiedenen Patientenspendern). (C) Differenzstrom für 9-Phenanthrol-sensitive Komponente durch Subtraktion der Werte in Gegenwart von 9-Phenanthrol (30 M) von denen der Kontrolle in (B) gezeigt Daten in (B) und (C) werden als Mittel mit Fehlerbalken für SEM angezeigt, * zeigt die Bedeutung (p<0.05, gepaarter Schülertest) für den Vergleich von Steuerung vs 9-Phenanthrol bei jeder Spannung. Die Panels (A) und (B) wurden von Hristov et al. (2016)22 reproduziert und mit Genehmigung verwendet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Spezies | Verfahrensdetails | Verweise | |
| Meerschweinchen | DSM-Stücke mit Ca2+-freiem Medium (in mM: 100 NaCl, 10 KCl, 1.2 KH2PO4, 5 MgCl2, 20 Glucose, 50 Taurin, gemessen pCa=6 (oder 1 mM) und dann in Stücke geschnitten und typischerweise 90-120 min (4 Perioden von 30 min) mit Enzymmedium (in mM: 130 KOH, KOH) behandelt 20 Taurin, 5 Pyruvat, 5 Kreatin, 10 mM HEPES, angepasst mit Methansulfonsäure auf pH 7,4, 1 mg/ml Kollagenase, 0,2 mg/ml Pronase E, 1 mg/ml fettsäurefreies Albumin, pCa=4,2 (63 mM) oder 3,7 (200 mM). Einzelne DSM-Zellen wurden in Kraft-Bruhe (KB)-Medium (in mM: 85 KCl, 30 K2PO4, 5 MgSO4, 5 Na2ATP, 5 K-Pyruvat, 5 Kreatin, 20 Taurin, 5 Beta-OH-Butyrat, 1 mg/ml fettsäurefreies Albumin, angepasst mit KOH auf pH 7,2) gelagert. Alternative Methode: DSM-Stücke, die 10 min in einem Ca2+-freien Medium (in mM) gespült werden: 140 NaCl, 5 KCl, 1.2 MgCl2, 10 Glukose, 20 Taurin, 5 HEPES, angepasst mit NaOH auf pH 7.4). Dann DSM-Stücke, inkubiert in der gleichen Ca2+-freies Medium mit 5 mg% Kollagennase, 2 mg% Pronase und 100 'M CaCl2 für 2x20 min Rühren ergänzt. | Klockner & Isenberg (1985)13,34 Klockner & Isenberg (1986)35 Schneider et al. (1991)10 Bonev & Isenberg (1992)9 Weidelt & Isenberg (2000)36 Moore et al. (2004)14 | |
| Meerschweinchen, Landrasseschwein und Mensch | DSM-Stücke, die für 5 min in Ca2+-freier Krebslösung vorbrütet werden, dann in Stücke geschnitten und enzymatisch in Ca2+-freier Krebslösung mit 0,5-2 mg/ml Kollagennase Typ I und 0,1-0,5 mg/ml Pronase bei 36°C für 20-30 min ständig gerührt. In einigen Fällen wurden verdaute Stücke durch eine stumpf gekippte Pipette oder durch Spinnen bis zur Zellausbeute weiter aufgewärmt. Isolierte Zellen wurden in modifizierter Krebslösung (beschrieben in Klockner & Isenberg13) gelagert und normalerweise innerhalb von 3 h verwendet. Die Zusammensetzung der Krebs-Lösung war (mM): 140 Na+, 6 K+, 2 Ca2+, 1.2 Mg2+, 152.4 Cl-, 10 Glucose, 10 HEPES, pH 7.35-7.4 mit Tris. Für Ca2+-freie Lösung wurden Ca2+ und Mg2+ aus der Krebs-Lösung gestrichen. | Inoue & Brading (1990)37 Inoue & Brading (1991)38 Nakayama & Brading (1995)39,40 | |
| Menschlichen | DSM-Stücke in Ca2+-frei HEPES Tyrodes Lösung platziert (in mM: 105.4 NaCl, 20,0 oder 22,3 NaHCO3, 3,6 KCl, 0,9 MgCl2, 0,4 NaH2PO4, 19,5 oder 4,9 HEPES, 5,4 oder 5,5 Glukose, 4,5 oder 5,5 Na-Pyruvat) und in DSM-Stücke geschnitten. DSM-Stücke in einer Enzymlösung (Ca2+ freie HEPES-Lösung mit 0,7 mg/ml Kollagennase Typ I, 0,7 mg/ml Papain, 1 mg/ml Albumin) über Nacht bei 4°C. Die Streifen wurden dann bei 36,5°C für 15 bis 30 min erhitzt, gewaschen und in frischer Lösung sanft trituiert. Isolierte Zellen, die in Ca2+ gelagert wurden und die Lösung von HEPES Tyrode enthielten oder sofort für Experimente verwendet wurden. | Montgomery & Fry (1992)24 Gallegos and Fry (1994)41 Fry et al. (1994)42 Sui et al. (2001)43 Wu et al. (2002)44 | |
| Meerschweinchen | DSM in PSS geschnitten (in mM: 137 NaCl, 5.4 KCl, 2 MgCl2, 2 CaCl2, 0.42 KH2P04, 4.17 NaHCO3, 10 Glucose, 10 HEPES, pH 7.4 mit NaOH). DSM-Stücke für 10 min in der folgenden Verdauungslösung (in mM: 80 Na-Glutamat, 55 NaCl, 6 KCl, 10 HEPES, 11 Glukose, 2 MgCl2und 0.2 CaCl2) und dann in eine Durchstechflasche mit der gleichen Lösung übertragen, jedoch mit 1 mg/ml Kollagennase 2, 1 mg/ml Trypsin-Inhibitor (manchmal weggelassen), 1 mg/ml fettfreies Rinderalbumin, für ca. 70 min bei 35 °C oder 60 min bei 37 °C. Einzelne DSM-Zellen wurden durch Triturierung durch eine Pasteurpipette in der gleichen Lösung ohne Kalzium und Enzyme gewonnen. Nach der Trituration wurde Ca2+ (1 mM) hinzugefügt und die Zellen bei 4°C gespeichert. Die Zellen wurden immer am selben Tag verwendet. | Bonev & Nelson (1993)53,54 Heppner et al. (1997)26 Petkov et al. (2001)47 Shieh et al. (2001, 2007)48,49 | |
| Meerschweinchen, Maus, Ratte und Mensch | Protokoll verwendet eine zweistufige enzymatische Dissoziationsbehandlung nach scharfer Zerlegung in Ca2+-freier Verdauungslösung (in mM: 80 Na-Glutamat, 55 NaCl, 6 KCl, 10 HEPES, 11 Glukose und 2 MgCl2). Zunächst wurden DSM-Stücke für 25-45 min bei 37°C mit 1-2 mg/ml Papain, 1 mg/ml Dithioerythreitol und 1 mg/ml Rinderserumalbumin in Dissoziationslösung (in mM: 80 Mononatriumglutamat, 55 NaCl, 6 KCl, 2 MgCl2, 10 HEPES und 10 Glukose, angepasst an pH 7.3 mit NaOH) und dann DSM-Stücke in Verdauungslösung übertragen, die 1-5 mg/ml Kollagennase XI (Sigma) oder Kollagennase Typ 2, 1 mg/ml Rinderserumalbumin, 0 oder 1 mg/ml Trypsin-Inhibitor und 100 m Ca2+für 6-30 min enthält. Nach der Inkubation wurde das verdaute Gewebe mehrmals in Verdauungslösung ohne Enzyme und Ca2+ gewaschen und dann sanft trituiert, um einzelne glatte Muskelzellen zu ergeben. | Petkov et al. (2001)50 Thorneloe & Nelson (2003)51 Thorneloe & Nelson (2004)33 Petkov & Nelson (2005)27 Hristov et al. (2008)52 Layne et al. (2010)53 Hristov et al. (2011)15 Xin et al. (2012)54 Parajuli et al. (2012)25 Malysz et al. (2013)29 Parajuli et al. (2013)31 Lee et al. (2013)55 Malysz et al. (2014)23 Smith et al. (2013)19, 20 Hristov et al. (2016)22 Lee et al. (2017)56 Yarotskyy et al. (2018)57 | |
Tabelle 1: Zusammenfassung der enzymatischen Ansätze zur Isolierung einzelner DSM-Zellen aus Harnblasen verschiedener Arten.
| Lösungstyp | Zusammensetzung (in mM) |
| DS (Dissektions-/Verdauungslösung) | 80 Na-Glutamat, 55 NaCl, 6 KCl, 10 HEPES, 2 MgCl2und 11 Glukose, pH-Wert auf 7,4 eingestellt (mit 10 M NaOH) |
| DS-P (Papain-haltiges DS) | DS mit 1-2 mg/ml Papain, 1 mg/ml Dithiothreitol und 1 mg/ml Rinderserumalbumin |
| DS-C (Collagenase-haltiges DS) | DS-Lösung mit 1-2 mg/ml Kollagennase Typ II, 1 mg/ml Rinderserumalbumin, 0 oder 1 mg/ml Trypsin-Inhibitor und 100-200 m Ca2+ |
| P (Pipette) | 110 CsOH, 110 Aspartinsäure, 10 NaCl, 1 MgCl2, 10 HEPES, 0,05 EGTA und 30 CsCl, pH angepasst auf 7,2 mit CsOH, ergänzt mit Amphotericin-B (300-500 g/ml) |
| E (extrazellular) | 10 Tetraethylammoniumchlorid (TEA), 6 CsCl, 124 NaCl, 1 MgCl2, 2 CaCl2, 10 HEPES und 10 Glukose, pH-Angepasst auf 7,3-7,4 mit NaOH oder CsOH und 0,002-3 (2-3 mM) Nifedipin |
Tabelle 2: Zusammensetzungen von Sezier-/Verdauungslösungen (DS) sowie Pipetten- und extrazellulären Lösungen, die in perforierten Patch-Clamp-Experimenten verwendet werden.
Diskussion
Die hier beschriebenen Verfahren erklären die Schritte bei der Herstellung lebensfähiger, frisch isolierter DSM-Zellen aus ganzdicken menschlichen Harnblasenproben mittels enzymatischer Verdauung und bei der Aufzeichnung von ganzzelligen Kationenströmen, die empfindlich auf den TRPM4-Kanalinhibitor 9-Phenanthrol mit dem perforierten Patch-Clamp-Ansatz amphotericin-B reagieren. Das enzymatische Verfahren beruht auf einer zweistufigen sequenziellen Exposition, die hierin als sequenzielle Papain-Kollagenase-Verdauungsmethode bezeichnet wird. DSM-Gewebe werden zuerst mit Papain und Dithiothreitol (einem Enzymstabilisierungsmittel) unter einem nominellen Ca2+-freien Zustand behandelt, gefolgt im zweiten Schritt von Kollagenase Typ II in Gegenwart von low Ca2+. Die Gründe für die Durchführung der Papain-Verdauung unter niedrigen Ca2+ Bedingungen in glatten Muskelzellen stammen aus den späten 1980er Jahren. Frisch isolierte Karotisarterie glatte Muskelzellen mit Papain vorbereitet zeigte eine längliche Form, zeigte Lebensfähigkeit (Widerstand gegen Trypan Blue Aufnahme) und reagierte auf kontraktile Reize (höhere Ca2+ und Histamin)65. Jahre später wurde diese Methode bei der Herstellung von DSM-Zellen angewendet (siehe Tabelle 1). Die Wahl der Kollagenase Typ II statt anderer Arten bezieht sich auf seine relativ hohe proteolytische Aktivität ideal für glatte Muskelgewebe einschließlich DSM geeignet. Tatsächlich könnte die Kollagenasebehandlung allein einzelne DSM-Zellen ergeben, obwohl eine umfassende Enzymexposition erforderlich ist (ca. 60 min)53,54. Da die Kollagenaseaktivität von Ca2+ abhängt und das Enzym unter den Ca2+-freien Bedingungen inaktiv ist, erfordert eine optimale enzymatische Verdauung von DSM-Stücken die Anwesenheit von Ca2+ 66. In unserem Fall enthält DS-C 100-200 m [Ca2+] (Tabelle 2). Nach der enzymatischen Behandlung werden verdaute DSM-Stücke mehrmals mit kaltem DS ohne Enzyme oder Ca2+ vorsichtig gewaschen, um jedes an Gewebe gebundene Enzym zu entfernen. Das eiskalte DS trägt dazu bei, die DSM-Zellintegrität zu erhalten und die enzymatische Aktivität aller verbleibenden Papain- oder Kollagenase zu begrenzen. Im letzten Schritt setzt die Triturierung enzymbehandelter DSM-Stücke mit einer feuerpolierten Pasteurpipette einzelne DSM-Zellen frei. DSM-Zellen werden entweder sofort in eine Aufnahmekammer für Patch-Clamp-Studien oder andere Arten von Experimenten gelegt oder auf Eis in DS zur späteren Verwendung am selben Tag gelagert (in der Regel innerhalb von 8 Stunden nach der Vorbereitung, aber die Zellen bleiben lebensfähig für bis zu 24 h).
Wir haben mehrere wichtige Überlegungen für die erfolgreiche Erlangung einzelner DSM-Zellen identifiziert. Die erste bezieht sich auf die menschliche DSM-Probenquelle. Um die Gewebeintegrität optimal zu erhalten, werden DSM-Proben aus offenen Blasenoperationen so schnell wie möglich in eiskaltem DS platziert und in einer kalten Umgebung aufbewahrt. Insbesondere wird die Blasenprobe bei chirurgischer Extraktion vom Patienten sofort auf einen vollständig vorbereiteten Beistelltisch im Operationssaal gestellt. Es folgt eine grobe Untersuchung der gesamten Probe (in der Regel bei radikaler oder einfacher Zystektomie) und deren Öffnung. Nach der Sichtprüfung wird ein Stück ganzer Dicke Harnleiter Probe aus einem abgelegenen Bereich der Probe grob unbeteiligt mit Tumor entfernt und sofort in eine Tasse (entweder 50 oder 100 ml) mit kalt (ca. 4 °C) Dissektionlösung (DS)(Tabelle 2) und dann fest mit einem Deckel geschlossen. Aufgrund der geplanten Art der Entnahme des Gewebes werden das OP-Personal und das Hilfspersonal, das die Ernte durchmacht, zu Beginn des operationsreichen Falls alarmiert, um die Materialien zum Zeitpunkt der Gewebeentnahme im Operationssaal zur Verfügung zu haben. Diese Vorsichtsmaßnahmen zusammen mit der routinemäßigen, sich wiederholenden Natur der Verarbeitungsschritte halten die warme Ischämiezeit für das Gewebe - von der Extraktion bis zur Platzierung in den gekühlten Behälter mit DS-Lösung - auf weniger als 5 min. Der Behälter wird dann in einen Kühlschrank oder auf Eis in einem Kühler gelegt, um die kalte Umgebung zu erhalten und (eiskalt) ins Labor transportiert. Sobald die Probe im Labor eintrifft, beginnen Die Sezieren und enzymatischen Dissoziationsschritte. Es ist sehr schwierig vorherzusagen, ob eine bestimmte DSM-Probe nach enzymatischer Dissoziation qualitativ hochwertige DSM-Zellen ergibt, daher gehen wir mit den enzymatischen Dissoziationsschritten fort. In vielen Fällen führt unsere Gruppe parallel zu elektrophysiologischen Experimenten isometrische Spannungsaufzeichnungen auf DSM-Streifen durch, die aus denselben DSM-Proben hergestellt werden. Wir haben herausgefunden, dass wir in der Regel qualitativ hochwertige DSM-Zellen aus Präparaten erhalten können, die auch erfolgreich tragfähige Streifen für isometrische Kontraktionsstudien liefern (unsere unveröffentlichte Beobachtung).
Der zweite Faktor bezieht sich auf unterschiedliche Enzym-Losvariabilitäten. Wir beobachteten, dass sowohl für Papain als auch kollagennase Typ II jedes Mal, wenn eine neue Menge Enzym von einem Lieferanten ankommt, die Enzymaktivität in DS zur Gewebeverdauung variieren kann. Daher optimieren wir routinemäßig die Enzymkonzentration und Inkubationsintervalle für jedes neue Los. Um den Losvariabilitätsbeitrag zu minimieren, bestellen wir größere Mengen des gleichen Loses und stellen eine große Charge von Lagerlösungen in 2 ml Aliquots von Enzymen her und lagern diese bis zum Einsatz bei 20 °C. Im Laufe der Zeit können gefrorene Bestände (die bis zu 2 Wochen gelagert werden) jedoch ihre enzymatische Aktivität verlieren. Die dritte Variable bezieht sich auf die Temperatur der Enzymverdauungsbehandlungen. Enzymatische Aktivitäten von Papain und Kollagenase zeigen Temperaturabhängigkeit. Papain und Kollagenase Typ II zeigen Aktivität in den Temperaturbereichen, die normale Körperphysiologie67,68umfassen. Daher streben wir an, die Enzymbehandlungen stabil bei 37 °C zu halten, um höhere Temperaturen zu vermeiden, um die DSM-Zellintegrität zu erhalten. Die vierte Überlegung betrifft die Variabilität der Qualität der DSM-Zellen, die in jedem Präparat vorhanden sind, von hochlebensfähigen (mit hervorragenden klassischen glatten Muskeleigenschaften) bis hin zu nicht gesunden, überautierten Zellen. Ein verlängertes Enzyminkubationsintervall ist einer der Hauptgründe für die Beschaffung einer hohen Anzahl von geschädigten Zellen. Übermäßige Enzymbehandlungen beeinträchtigen auch die Proteinstrukturen von Ionenkanälen, Rezeptoren und Transportern, was ihre Funktionalität beeinträchtigt. Die Interpretation der Ergebnisse, die aus enzymatisch erhaltenen, frisch isolierten Zellen gewonnen wurden, sollte diese Berücksichtigung berücksichtigen. Die Optimierung der Enzymverdauungsbedingungen zielt darauf ab, den Prozentsatz der hochlebensfähigen Zellen zu erhöhen. Experimentelle Ansätze, die sich auf eine höhere Anzahl lebensfähiger Zellen stützen, wie z. B. Mikroarrayanalysen, erfordern robustere Optimierungen als diejenigen, die erfolgreich an weniger Zellen wie einzelliger Patch-Clamp-Elektrophysiologie oder Ca 2+-Bildgebung durchgeführt werden. Die Berücksichtigung der oben genannten Faktoren hat unsere Forschungsbemühungen in den letzten zehn Jahren bei der Gewinnung hochwertiger Einzel-DSM-Zellen geleitet.
Die perforierte Patch-Clamp-Technik ist seit über einem Vierteljahrhundert ein elektrophysiologischer Ansatz. Mehrere Veröffentlichungen enthalten Einzelheiten zu den technischen69,70,71,72,73. Die Zellperforation kann mit Amphotericin-B, Nystatin, Gramicidin oder32für einen Überblick über die einzelnen). Der Hauptvorteil perforierter Patch-Clamp-Aufnahmen gegenüber anderen elektrophysiologischen Ansätzen besteht darin, dass die native intrazelluläre Umgebung - einschließlich intrazellulärer2+und Signalmoleküle (z.B. cAMP, PKA, Phosphate und Phosphodiesterasen) - erhalten bleibt. Diese Technik eignet sich daher ideal für die Untersuchung von Ganzzell-Ionenkanalströmen und deren Regulierungsmechanismen unter nahezu physiologischen Bedingungen. Ein wichtiger Vorbehalt ist, dass die intrazelluläre Zellzusammensetzung im Gegensatz zu anderen elektrophysiologischen Methoden wie konventionellen Vollzell- und Single-Channel-Aufnahmen (innen- und außen) nicht genau gesteuert werden kann. Nach unserer Erfahrung tragen drei Faktoren routinemäßig zu erfolgreichen experimentellen Ergebnissen von Amphotericin-B-perforierten Patch-Clamp-Experimenten bei. Die erste ist die Qualität der DSM-Zelle, die zum Versuch einer Aufzeichnung ausgewählt wurde. Wenn DSM-Zellen sehr lebensfähig sind und ein semi-kontraktiles (serpentinartiges), kontrastreiches glänzendes Aussehen mit einem klar definierten Halo um die Zelloberfläche aufweisen und fest an der Glasunterseite der Aufnahmekammer befestigen, dann treten Giga-Siegelbildung und Zellperforation relativ einfach auf. Der zweite bzw. dritte Erfolgsfaktor bezieht sich auf die Qualität der Quelle und die Löslichkeit von Amphotericin-B (in Dimethylsulfoxid/DMSO und intrazellulärer Pipettenlösung). Wir beobachteten Diskrepanzen zwischen verschiedenen Lieferanten in Bezug auf Quelle und Losvariabilitäten. Jeden Tag bereiten wir eine frische Lösung von Amphotericin-B-Stammlösung aus Pulver, gefolgt von seiner Verdünnung in intrazellulärer Pipettenlösung. Diese Schritte erfordern eine umfangreiche Beschallung und Wirbelung. Mit frisch zubereiteter Amphotericin-B-haltiger Pipettenlösung, erfolgreicher Zellperforation (<50 MΩ) following giga-seal formation can be usually obtained within 30 min. The concentration of amphotericin-B in the pipette solution also requires optimization dependent on the amphotericin-B lot and source. Under our experimental conditions, the final amphotericin-B concentrations in the pipette range from 200 to 500 µg/mL. Since amphotericin-B exhibits light sensitivity, its solutions need to be kept in the dark. Using the amphotericin-B perforated patch-clamp technique, our group recorded voltage-step induced K mω)="" following="" giga-seal="" formation="" can="" be="" usually="" obtained="" within="" 30="" min.="" the="" concentration="" of="" amphotericin-b="" in="" the="" pipette="" solution="" also="" requires="" optimization="" dependent="" on="" the="" amphotericin-b="" lot="" and="" source.="" under="" our="" experimental="" conditions,="" the="" final="" amphotericin-b="" concentrations="" in="" the="" pipette="" range="" from="" 200="" to="" 500="" µg/ml.="" since="" amphotericin-b="" exhibits="" light="" sensitivity,="" its="" solutions="" need="" to="" be="" kept="" in="" the="" dark.="" using="" the="" amphotericin-b="" perforated="" patch-clamp="" technique,="" our="" group="" recorded="" voltage-step="" induced="">+Ca2+, und nicht-selektive Kationströme aus menschlichen, Meerschweinchen-, Maus- und/oder Ratten-DSM-Zellen17,21,22,23,29,30,31,35,60. Hier beschreiben wir Bedingungen für die Aufzeichnung nicht-selektiver Kationströme in menschlichen DSM-Zellen. 9-Phenanthrol, ein Blocker von TRPM4-Kanälen, abgeschwächte Spannungsschritt induzierte Ströme unterstützen die Rolle dieser Kanäle bei der Kontrolle der DSM Erregbarkeit. Als Hinweis, es dauert in der Regel mindestens 45 min nach Erhalt einer Giga-Dichtung und Einleitung der Perforation, um optimal stabile Spannungsschritt induzierte nicht-selektive Kationströme aufzuzeichnen. Spannungsrampen können auch als Alternative zu Spannungs-Schritt-Protokollen verwendet werden30,64. Hier wurde ein Spannungsschrittprotokoll aus einem hyperpolarisierten Haltemembranpotential bevorzugt als ein Rampenprotokoll, da der frühere Ansatz die Wirkung einer spannungsabhängigen Inaktivierung minimiert und eine Mittelung des evozierten Stroms über eine Dauer ermöglicht. eines Spannungsschritts, bei dem die Rampe einen einzelnen Datenpunkt pro Spannung bereitstellt. Letzterer Punkt gilt insbesondere für menschliche DSM-Zellen, da die Ströme während spannungsschritten eine variable Aktivität aufweisen (Abbildung 5UndAbbildung 6). Die amperhotericin-B perforierte Patch-Clamp-Technik war wesentlich für die Identifizierung der Eigenschaften von DSM-Zellen und anderen Zelltypen und wird auch in Zukunft bei der Bereitstellung neuer Entdeckungen helfen. Darüber hinaus können frisch isolierte Einzel-DSM-Zellen erfolgreich zur Messung von Vollzell-K+Cl-, und Ca2+Ströme im konventionellen Modus der Patch-Clamp-Technik, Membranpotentialaufzeichnung mit der Stromklemme und Einkanalaufnahmen, wie unsere bisherigen Berichte23,29,35,64.
Neben einzelligen Patch-Clamp-Methoden können frisch isolierte DSM-Zellen mit anderen technischen Ansätzen wie Ca2+ Imaging, RT-PCR/q-RT-PCR, Immunzytochemie, In-situ-Proximity Ligationassay und genomischen Ansätzen (z.B. Mikroarray, RNA-seq, CHIP-seq)15,18,30,33,34. Da sich die Methode der Einzelzell-Transkriptombestimmung weiter entwickelt und hochsensibel wird, stellen wir uns in zukunfttlich die Fähigkeit vor, elektrische oder pharmakologische Eigenschaften einzelner DSM-Zellen routinemäßig und spezifisch mit ihren Transkriptom-/Proteomprofilen zu verknüpfen. Dies wird durch erstaufnahmemittelige Aufnahme aus einer DSM-Zelle und anschließende Extraktion von mRNA oder Protein, gefolgt von transkriptomischen/proteomischen Analysen, erreicht. Obwohl solche Methoden bereits in Nicht-DSM-Zellen getestet wurden, sind sie derzeit technisch anspruchsvoll, haben keine Empfindlichkeit, um als Routine betrachtet zu werden, und beschränken sich auf den erfolgreichen Nachweis einiger ausgewählter Genprodukte74. Funktionmolekulare Profilexpressionsverknüpfungsstudien, die an DSM-Zellen durchgeführt werden, die aus Harnblasen aus Kontroll- und erkrankten Patientenspendern gewonnen werden, geben Einblicke in physiologische Prozesse, die für das Fahren normaler DSM-Funktionen, die Pathogenese und die Identifizierung wirksamer neuartiger therapeutischer Ansätze unerlässlich sind.
Offenlegungen
nichts.
Danksagungen
Diese Arbeit wurde unterstützt durch NIH-R01DK106964 und P20DK123971 Stipendien an Georgi V. Petkov. Die Autoren danken Dr. Viktor Yarotskyy und Frau Sarah Maxwell für die kritische Bewertung des Manuskripts. Wir sind auch den Urologie-Ärzten von MUSC und UTHSC dankbar: Dr. Thomas Keane, Harry Clarke, Stephen Savage, Ross Rames, Sandip Prasad, Jonathan Picard, Christopher Ledbetter und Anthony Patterson sowie die Bewohner von MUSC und UTHSC Urology: Drs. Taylor Vaughan, Samuel Walker Nickles, Matthew Young, Erin Burns, Justin Ellett, Ryan Levey, Austin Younger, Mark Currin, Nima Baradaran, Olugbemisola McCoy, Tracy Tipton, Bryce Wyatt, Alyssa Greiman, Sarah Starosta, Aaron Bloch, Christine Callaway, Lucille Cox, Christian Dewan, Erin Heitman, Bradley Houston, Stephen Legg, Robert S. Libby, Cole Locklear, Kristen Marley, Monica O'Hanlon, Patrick Probst, Cynthia Sharadin, Elizabeth Tourville, Daniel Zapata für ihre Hilfe bei der Sammlung menschlicher Gewebe.
Materialien
| Name | Company | Catalog Number | Comments |
| 5 ml polystyrene round-bottom tube | Falcon | 352054 | Tubes for DS containing enzymes used in digestion steps |
| 9-Phenanthrol | Sigma-Aldrich | 211281 | TRPM4 channel inhibitor |
| Amphotericin-B | Fisher | BP928-250 | Used for patch/cell perforation |
| Amphotericin-B | European Pharmacopoeia Reference Standards | 5 | Used for patch/cell perforation |
| Amphotericin-B | Sigma-Aldrich | A9528-100MG | Used for patch/cell perforation |
| Analog vortex mixer | VWR | 58816-121 | |
| Aspartic acid | Sigma-Aldrich | A9006 | Intracellular pipette solution |
| Bovine serum albumin | Sigma-Aldrich | A7906 | DS |
| CaCl2 | Sigma-Aldrich | C1016 | Extracellular solution and DS |
| Capillary Glass | Sutter | BF150-110-7.5 | Capillary for preparation of pulled patch electrodes |
| Cesium hydroxide hydrate | Sigma-Aldrich | C8518 | Intracellular pipette solution |
| Clampex ver. 10 software includes data acqusition (Clampex) and analysis (Clampfit) programs | Axon Instruments/ Molecular Devices | pCLAMP-10 | Commerical software and part of patch-clamp rig setup |
| Collagenase type 2 | Worthington Biochemical Corporation | LS004177 | DS-C |
| CsCl | Sigma-Aldrich | 203025 | Extracellular and intracellular solutions |
| Dental wax | Miltex Dental Wax Technologies, Inc. | 18058351 | |
| Digital Thermometer with Probe | Fisher Scientific | 15-077-32 | Placed in tissue bath to monitor temperature |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2650 | Solvent |
| DL-Dithiothreitol (DDT) | Sigma-Aldrich | D9779 | Reducing agents used together with Papain |
| EGTA | Sigma-Aldrich | E3889 | Ca2+ chelator, used in intracellular pipette solution |
| Flaming/Brown micropipette puller | Sutter | P-97 | Required to pull electrodes with very fine tips |
| Floating foam tube rack/holder | VWR Scientific | 82017-634 | Used for holding tubes with enzymes for temperature control |
| Glucose | Sigma | G8270 | |
| Glutamic acid (Na salt) | Sigma-Aldrich | G1626 | DS |
| HEPES | Sigma-Aldrich | H3375 | pH Buffer |
| KCl | Fisher Scientific | BP366-1 | Extracellular solution |
| Low Noise Data Acquisition System | Axon Instruments/ Molecular Devices | Digidata 1440A | Part of patch-clamp rig setup |
| Magnetic stirrer | VWR | 01-442-684 | |
| MgCl2 (hexahydrate) | Sigma-Aldrich | M2670 | Extracellular and intracellular solutions |
| MicroForge | Narishige | MF-830 | Used for fire-polishing electrodes |
| NaCl | Sigma-Aldrich | S7653 | Extracellular and intracellular solutions |
| NaOH | Sigma-Aldrich | S8045 | |
| Nifedipine | Sigma-Aldrich | N7634 | L-type voltage-gated Ca2+ channel blocker |
| Nikon inverted microscope, TS100 with T1-SM stage with 5x, 10x, 20x, and 40x objectives | Nikon | Discontinued | Part of Patch-clamp rig setup |
| Non-metalic syringe needle, MicroFil | WPI | MF-34G-5 | Filling of intracellular pipette solution |
| Papain | Worthington Biochemical Corporation | LS003126 | DS-P |
| Pasteur pipette | FisherBrand | 13-678-20A | Tips are broken off and fire-polished and used for titration of enzymatically treated tissues to release single DSM cells from pieces |
| Patch-clamp amplifier | Axon Instruments/ Molecular Devices | Axon Axopatch 200B | Part of patch-clamp rig setup |
| PC computer | DELL | Custom configuration | Part of patch-clamp rig setup |
| pH Meter | Aspera Instruments | PH700 | |
| Polyethylene tubing | Intramedic | 427-436 | Tubing for superfusion of extracellular bath connected to glass-bottom recording chamber |
| Tetraethylammonium chloride | Sigma-Aldrich | T2265 | Ion channel blocker of Kv and BK channels added to the extracellular bath solution |
| Thermo Scientific Precision shaking water bath (model 2870) | Thermo Scientific | Discontinued | Water bath for temperature control of enzymatic digestion employed as an alternative to tissue chamber-circulating bath setup |
| Tissue bath, 100 mL | Radnoti | 1583-101 | Connected to a circulating bath and filled with water, tubes with DS and DSM pieces are placed in the setup to control the temperature of digestion steps |
| Vinyl tubing | ColePalmer | 06405-3 | Multiple uses including for connecting tissue bath to circulating water bath |
| Water circulator bath, Haake D1 L | Haake | Discontinued | Connected to tissue bath |
| Weighting scale | Mettler Toledo | XS64 | |
| ZeissAxiovert 40C inverted microscope with 10x and 40x objectives | Carl-Zeiss | Discontinued | Part of patch-clamp rig setup |
Referenzen
- Andersson, K. E., Arner, A. Urinary bladder contraction and relaxation: physiology and pathophysiology. Physiological Reviews. 84 (3), 935-986 (2004).
- Brading, A. F., Brain, K. L., Andersson, K. E., Michel, M. C. Ion channel modulators and urinary tract function. Urinary Tract. 202, 375-393 (2011).
- Brading, A. F. Spontaneous activity of lower urinary tract smooth muscles: correlation between ion channels and tissue function. Journal of Physiology. 570, 13-22 (2006).
- Brading, A. F., Heaton, J. P., Hashitani, H. A survey of commonalities relevant to function and dysfunction in pelvic and sexual organs. International Journal of Impotence Research. 20 (1), 1-16 (2008).
- Petkov, G. V. Role of potassium ion channels in detrusor smooth muscle function and dysfunction. Nature Reviews Urology. 9 (1), 30-40 (2012).
- Andersson, K. E. Treatment-resistant detrusor overactivity--underlying pharmacology and potential mechanisms. International Journal of Clinical Practice Supplement. 151, 8-16 (2006).
- Sui, G. P., Wu, C., Fry, C. H. The electrophysiological properties of cultured and freshly isolated detrusor smooth muscle cells. Journal of Urology. 165 (2), 627-632 (2001).
- Kropp, B. P., et al. Characterization of cultured bladder smooth muscle cells: assessment of in vitro contractility. Journal of Urology. 162 (5), 1779-1784 (1999).
- Bonev, A., Isenberg, G. Arginine-vasopressin induces mode-2 gating in L-type Ca2+ channels (smooth muscle cells of the urinary bladder of the guinea-pig). Pflügers Archive - European Journal of Physiology. 420 (2), 219-222 (1992).
- Schneider, P., Hopp, H. H., Isenberg, G. Ca2+ influx through ATP-gated channels increments [Ca2+]i and inactivates ICa in myocytes from guinea-pig urinary bladder. Journal of Physiology. 440, 479-496 (1991).
- Wellner, M. C., Isenberg, G. Properties of stretch-activated channels in myocytes from the guinea-pig urinary bladder. Journal of Physiology. 466, 213-227 (1993).
- Wellner, M. C., Isenberg, G. Stretch-activated nonselective cation channels in urinary bladder myocytes: importance for pacemaker potentials and myogenic response. Experientia Supplementum. 66, 93-99 (1993).
- Klockner, U., Isenberg, G. Action potentials and net membrane currents of isolated smooth muscle cells (urinary bladder of the guinea-pig). Pflügers Archive - European Journal of Physiology. 405 (4), 329-339 (1985).
- Moore, E. D., et al. Organization of Ca2+ release units in excitable smooth muscle of the guinea-pig urinary bladder. Biophysical Journal. 87 (3), 1836-1847 (2004).
- Hristov, K. L., Chen, M., Kellett, W. F., Rovner, E. S., Petkov, G. V. Large conductance voltage- and Ca2+-activated K+ channels regulate human detrusor smooth muscle function. American Journal of Physiology - Cell Physiology. 301 (4), 903-912 (2011).
- Afeli, S. A., Rovner, E. S., Petkov, G. V. SK but not IK channels regulate human detrusor smooth muscle spontaneous and nerve-evoked contractions. American Journal of Physiology - Renal Physiology. 303 (4), 559-568 (2012).
- Hristov, K. L., et al. Kv2.1 and electrically silent Kv channel subunits control excitability and contractility of guinea pig detrusor smooth muscle. American Journal of Physiology - Cell Physiology. 302 (2), 360 (2012).
- Afeli, S. A., Malysz, J., Petkov, G. V. Molecular expression and pharmacological evidence for a functional role of Kv7 channel subtypes in Guinea pig urinary bladder smooth muscle. PLoS One. 8 (9), 75875 (2013).
- Smith, A. C., et al. TRPM4 channel: a new player in urinary bladder smooth muscle function in rats. American Journal of Physiology - Renal Physiology. 304 (7), 918-929 (2013).
- Smith, A. C., et al. Novel role for the transient potential receptor melastatin 4 channel in guinea pig detrusor smooth muscle physiology. American Journal of Physiology - Cell Physiology. 304 (5), 467 (2013).
- Hristov, K. L., Smith, A. C., Parajuli, S. P., Malysz, J., Petkov, G. V. Large-conductance voltage- and Ca2+-activated K+ channel regulation by protein kinase C in guinea pig urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 306 (5), 460-470 (2014).
- Hristov, K. L., et al. Novel regulatory mechanism in human urinary bladder: central role of transient receptor potential melastatin 4 channels in detrusor smooth muscle function. American Journal of Physiology - Cell Physiology. 310 (7), 600-611 (2016).
- Malysz, J., Afeli, S. A., Provence, A., Petkov, G. V. Ethanol-mediated relaxation of guinea pig urinary bladder smooth muscle: involvement of BK and L-type Ca2+ channels. American Journal of Physiology - Cell Physiology. 306 (1), 45-58 (2014).
- Montgomery, B. S., Fry, C. H. The action potential and net membrane currents in isolated human detrusor smooth muscle cells. Journal of Urology. 147 (1), 176-184 (1992).
- Parajuli, S. P., Soder, R. P., Hristov, K. L., Petkov, G. V. Pharmacological activation of small conductance calcium-activated potassium channels with naphtho[1,2-d]thiazol-2-ylamine decreases guinea pig detrusor smooth muscle excitability and contractility. Journal of Pharmacology and Experimental Therapeutics. 340 (1), 114-123 (2012).
- Heppner, T. J., Bonev, A. D., Nelson, M. T. Ca2+-activated K+ channels regulate action potential repolarization in urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 273 (1), 110-117 (1997).
- Petkov, G. V., Nelson, M. T. Differential regulation of Ca2+-activated K+ channels by beta-adrenoceptors in guinea pig urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 288 (6), 1255-1263 (2005).
- Herrera, G. M., Etherton, B., Nausch, B., Nelson, M. T. Negative feedback regulation of nerve-mediated contractions by KCa channels in mouse urinary bladder smooth muscle. American Journal of Physiology - Regulatory Integrative Comparative Physiology. 289 (2), 402-409 (2005).
- Malysz, J., Rovner, E. S., Petkov, G. V. Single-channel biophysical and pharmacological characterizations of native human large-conductance calcium-activated potassium channels in freshly isolated detrusor smooth muscle cells. Pflügers Archive - European Journal of Physiology. 465 (7), 965-975 (2013).
- Provence, A., Angoli, D., Petkov, G. V. Kv7 channel pharmacological activation by the novel activator ML213: role for heteromeric Kv7.4/Kv7.5 channels in guinea pig detrusor smooth muscle function. Journal of Pharmacology and Experimental Therapeutics. 364 (1), 131-144 (2018).
- Parajuli, S. P., et al. Control of urinary bladder smooth muscle excitability by the TRPM4 channel modulator 9-phenanthrol. Channels (Austin). 7 (6), 537-540 (2013).
- Ishibashi, H., Moorhouse, A. J., Nabekura, J., Okada, Y. Perforated whole-cell patch-clamp technique: a user's guide. Patch Clamp Techniques: From Beginning to Advanced Protocols. 4, 71-83 (2012).
- Provence, A., Rovner, E. S., Petkov, G. V. Regulation of transient receptor potential melastatin 4 channel by sarcoplasmic reticulum inositol trisphosphate receptors: Role in human detrusor smooth muscle function. Channels (Austin). 11 (5), 459-466 (2017).
- Hristov, K. L., et al. Suppression of human detrusor smooth muscle excitability and contractility via pharmacological activation of large conductance Ca2+-activated K+ channels. American Journal of Physiology - Cell Physiology. 302 (11), 1632-1641 (2012).
- Xin, W., Soder, R. P., Cheng, Q., Petkov, G. V. Inhibition of phosphodiesterases relaxes detrusor smooth muscle via activation of the large conductance voltage- and Ca2+-activated K+ channel. American Journal of Physiology - Cell Physiology. 302 (9), 1361-1370 (2012).
- Hristov, K. L., et al. Neurogenic detrusor overactivity is associated with decreased expression and function of the large conductance voltage- and Ca2+-activated K+ channels. PLoS One. 8 (7), 68052 (2013).
- Hristov, K. L., Parajuli, S. P., Provence, A., Rovner, E. S., Petkov, G. V. Nongenomic modulation of the large conductance voltage- and Ca2+-activated K+ channels by estrogen: A novel regulatory mechanism in human detrusor smooth muscle. Physiological Reports. 5 (14), (2017).
- Parajuli, S. P., et al. Functional link between muscarinic receptors and large-conductance Ca2+ -activated K+ channels in freshly isolated human detrusor smooth muscle cells. Pflügers Archiv - European Journal of Physiology. 467 (4), 665-675 (2015).
- Malysz, J., Rovner, E. S., Petkov, G. V. Single-channel biophysical and pharmacological characterizations of native human large-conductance calcium-activated potassium channels in freshly isolated detrusor smooth muscle cells. Pflügers Archiv - European Journal of Physiology. 465 (7), 965-975 (2013).
- Thorneloe, K. S., Nelson, M. T. Properties of a tonically active, sodium-permeable current in mouse urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 286 (6), 1246-1257 (2004).
- Barry, M. J., et al. The American Urological Association symptom index for benign prostatic hyperplasia. The Measurement Committee of the American Urological Association. Journal of Urology. 148 (5), 1549-1557 (1992).
- Klockner, U., Isenberg, G. Calcium currents of cesium loaded isolated smooth muscle cells (urinary bladder of the guinea pig). Pflügers Archiv - European Journal of Physiology. 405 (4), 340-348 (1985).
- Klockner, U., Isenberg, G. Tiapamil reduces the calcium inward current of isolated smooth muscle cells. Dependence on holding potential and pulse frequency. European Journal of Pharmacology. 127 (3), 165-171 (1986).
- Weidelt, T., Isenberg, G. Augmentation of SR Ca2+ release by rapamycin and FK506 causes K+-channel activation and membrane hyperpolarization in bladder smooth muscle. British Journal of Pharmacology. 129 (7), 1293-1300 (2000).
- Inoue, R., Brading, A. F. The properties of the ATP-induced depolarization and current in single cells isolated from the guinea-pig urinary bladder. British Journal of Pharmacology. 100 (3), 619-625 (1990).
- Inoue, R., Brading, A. F. Human, pig and guinea-pig bladder smooth muscle cells generate similar inward currents in response to purinoceptor activation. British Journal of Pharmacology. 103 (4), 1840-1841 (1991).
- Nakayama, S., Brading, A. F. Possible contribution of long open state to noninactivating Ca2+ current in detrusor cells. American Journal of Physiology - Cell Physiology. 269 (1), 48-54 (1995).
- Nakayama, S., Brading, A. F. Interaction of Ca2+ agonist and depolarization on Ca2+ channel current in guinea pig detrusor cells. Journal of General Physiology. 106 (6), 1211-1224 (1995).
- Gallegos, C. R., Fry, C. H. Alterations to the electrophysiology of isolated human detrusor smooth muscle cells in bladder disease. Journal of Urology. 151 (3), 754-758 (1994).
- JournalFry, C. H., Gallegos, C. R., Montgomery, B. S. The actions of extracellular H+ on the electrophysiological properties of isolated human detrusor smooth muscle cells. Journal of Physiology. 480, 71-80 (1994).
- Sui, G. P., Wu, C., Fry, C. H. A description of Ca2+ channels in human detrusor smooth muscle. BJU International Journal. 92 (4), 476 (2003).
- Wu, C., Sui, G., Fry, C. H. The role of the L-type Ca2+ channel in refilling functional intracellular Ca2+ stores in guinea-pig detrusor smooth muscle. Journal of Physiology. 538, 357-369 (2002).
- Bonev, A. D., Nelson, M. T. Muscarinic inhibition of ATP-sensitive K+ channels by protein kinase C in urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 265 (6), 1723-1728 (1993).
- Bonev, A. D., Nelson, M. T. ATP-sensitive potassium channels in smooth muscle cells from guinea pig urinary bladder. American Journal of Physiology - Cell Physiology. 264 (5), 1190-1200 (1993).
- Petkov, G. V., Heppner, T. J., Bonev, A. D., Herrera, G. M., Nelson, M. T. Low levels of KATP channel activation decrease excitability and contractility of urinary bladder. American Journal of Physiology - Regulatory Integrative Comparative Physiology. 280 (5), 1427-1433 (2001).
- Shieh, C. C., et al. Functional implication of spare ATP-sensitive K+ channels in bladder smooth muscle cells. Journal of Pharmacology and Experimental Therapeutics. 296 (3), 669-675 (2001).
- Shieh, C. C., et al. Characterization of a novel ATP-sensitive K+ channel opener, A-251179, on urinary bladder relaxation and cystometric parameters. British Journal of Pharmacology. 151 (4), 467-475 (2007).
- Petkov, G. V., et al. Beta1-subunit of the Ca2+-activated K+ channel regulates contractile activity of mouse urinary bladder smooth muscle. Journal of Physiology. 537, 443-452 (2001).
- Thorneloe, K. S., Nelson, M. T. Properties and molecular basis of the mouse urinary bladder voltage-gated K+ current. Journal of Physiology. 549, 65-74 (2003).
- Hristov, K. L., et al. Stimulation of beta3-adrenoceptors relaxes rat urinary bladder smooth muscle via activation of the large-conductance Ca2+-activated K+ channels. American Journal of Physiology - Cell Physiology. 295 (5), 1344-1353 (2008).
- Layne, J. J., Nausch, B., Olesen, S. P., Nelson, M. T. BK channel activation by NS11021 decreases excitability and contractility of urinary bladder smooth muscle. American Journal of Physiology - Regulatory Integrative Comparative Physiology. 298 (2), 378-384 (2010).
- Lee, H., Koh, B. H., Peri, L. E., Sanders, K. M., Koh, S. D. Functional expression of SK channels in murine detrusor PDGFRalpha+ cells. Journal of Physiology. 591 (2), 503-513 (2013).
- Lee, H., et al. Premature contractions of the bladder are suppressed by interactions between TRPV4 and SK3 channels in murine detrusor PDGFRalpha+ cells. Scientific Reports. 7 (1), 12245 (2017).
- Yarotskyy, V., Malysz, J., Petkov, G. V. Properties of single channel and whole-cell Cl- currents in guinea pig detrusor smooth muscle cells. American Journal of Physiology - Cell Physiology. 316 (5), 698-710 (2019).
- Driska, S. P., Porter, R. Isolation of smooth muscle cells from swine carotid artery by digestion with papain. American Journal of Physiology - Cell Physiology. 251 (3), 474-481 (1986).
- Seltzer, J. L., Welgus, H. G., Jeffrey, J. J., Eisen, A. Z. The function of Ca2+ in the action of mammalian collagenases. Archives of Biochemistry and Biophysics. 173 (1), 355-361 (1976).
- Skelton, G. S. Papaya proteinases. I. Temperature-and pH-stability curves. Enzymologia. 35 (5), 270-274 (1968).
- Petrova, D., Derekova, A., Vlahov, S. Purification and properties of individual collagenases from Streptomyces sp. strain 3B. Folia Microbiologica (Praha). 51 (2), 93-98 (2006).
- Sharpe, E. J., St Clair, J. R., Proenza, C. Methods for the isolation, culture, and functional characterization of sinoatrial node myocytes from adult mice. Journal of Visualized Experiments. (116), (2016).
- Brueggemann, L. I., Mani, B. K., Haick, J., Byron, K. L. Exploring arterial smooth muscle Kv7 potassium channel function using patch clamp electrophysiology and pressure myography. Journal of Visualized Experiments. (67), e4263 (2012).
- Jarriault, D., Grosmaitre, X. Perforated patch-clamp recording of mouse olfactory sensory neurons in intact neuroepithelium: functional analysis of neurons expressing an identified odorant receptor. Journal of Visualized Experiments. (101), e52652 (2015).
- Rae, J., Cooper, K., Gates, P., Watsky, M. Low access resistance perforated patch recordings using amphotericin B. Journal of Neuroscience Methods. 37 (1), 15-26 (1991).
- Knutson, K., et al. Whole cell electrophysiology of primary cultured murine enterochromaffin cells. Journal of Visualized Experiments. (139), (2018).
- Devienne, G., Le Gac, B., Piquet, J., Cauli, B. Single cell multiplex reverse transcription polymerase chain reaction after patch-clamp. Journal of Visualized Experiments. (136), (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten