Method Article
הכנה ושימוש בתאי השריר החלקים הרגילים של האדם הבודד לאפיון של 9-פניל-זרמים רגישים לקטיון
In This Article
Summary
אנו מתארים שיטה להכנת התאים בודדים טרי שרירים מבודדים או חלקה מתוך דגימות שלפוחית השתן של האדם העסקת שני צעדים הליך אנזימטי. תאים DSM שהתקבלו קיימא ניתן ללמוד על ידי שונים שיטות תא בודד כולל המתואר אמפוריטיצין-B תיקון מלחציים אלקטרופיזיולוגיה כדי לחשוף תכונות פיזיולוגיות ופרמקולוגית.
Abstract
תאים שריר החלקה (DSM) הנמצאים בתוך הקיר שלפוחית השתן בסופו של דבר להקל על אחסון שתן והווצמה. הכנת תאי ה-DSM הניתנים, הטריים והמבודדים, מציגה אתגר טכני חשוב שההישג שלהם מספק תאים אופטימליים למחקרים פונקציונליים ומולקולריים נוספים. השיטה פותחה ופירט בזאת, בהצלחה בשימוש על ידי הקבוצה שלנו למעלה מעשור, מתאר את הניתוח של דגימות השתן האנושי האדם שהתקבלו ניתוחים שלפוחית משתן לאחר מכן טיפול בשני השלבים אנזימטי של חתיכות dsm ו נשחקו מכני כדי לקבל תאים מבודדים של dsm טרי. הצעד הראשון כרוך בניתוח כדי להפריד בין שכבת ה-DSM (המוכרת גם בשם מוסקולאריס) מרירית (אורוטאלינום, לאמינה קינאה, ורירית מוסקולריס) והרקמות החיבור, כלי הדם והאדיפוז הסמוכות. ה-DSM נחתך לחתיכות (2-3 מ"מ x 4-6 מ"מ) ב-Ca הנומינלי2 +המכיל פתרון לניתוח/עיכול (DS). חתיכות DSM מועברים בשלב הבא ומטופלים באופן רציף בנפרד עם DS המכיל פפאין ו-כולגנאז ב ~ 37 ° צ' צלזיוס עבור 30-45 דקות לכל שלב. בעקבות שוטף עם DS המכיל סרום ללא אנזים ומשולש עם מצננת אש מלוטשת, החלקים משחררים תאי DSM בודדים. תאי ה-DSM הבודדים מתאימים באופן אידיאלי לגבי מהדק-מלחציים ולמאפיינים פרמקלוגיים של ערוצי יונים. באופן ספציפי, אנו מראים כי TRPM4 channel חוסם 9-פניל מפחית זרמים מתח המסלול המתעלה הקליט עם הגישה אמפוריטיצין-B מחורר טלאי להתקרב. תאים DSM יכולים להיות גם ללמוד על ידי טכניקות אחרות כגון תא יחיד RT-PCR, ניתוח microarray, אימונוציטוטוכימיה, בסמיכות באתרו הקירבה, ו-Ca2 + הדמיה. היתרון העיקרי של ניצול תאי DSM יחיד הוא שתצפיות שנעשו מתייחסות ישירות מאפייני תא בודד נחשף. מחקרים של תאי ה-DSM הבודדים הטריים סיפקו תובנות חשובות המאפיינים את המאפיינים של ערוצי יונים שונים כולל לקטבת בשלפוחית השתן ותמשיך כתקן זהב בהסבר למאפייני הסלולר של DSM ומנגנוני רגולציה.
Introduction
תאים השריר החלקה (DSM) מהווים את סוג התא הנפוץ ביותר בשלפוחית השתן ובסופו של דבר שליטה בשתן אחסון והשרירים דרך הרפיה והתכווצות, בהתאמה. תאים DSM טופס שריר החלקה צרורות השילוב עם רקמת חיבור סמוכים, תהליכי עצב, תאים ביניים, סוגי תאים אחרים1. ההבנה הנוכחית של התפקיד של תאי DSM בתפקוד שלפוחית השתן הושגה באמצעות גישה משולבת מרובת רמות. כל שיטה ניסיונית-בין אם מבוסס על תאים יחידים בודדים בתוך מבחנה, רצועות רקמה המכילות שריר החלקה צרורות בחוץ-גופית/ex vivo, או ב vivo דטרמיניזם (כגון cy try והערכות פונקציה ההיגוי)- מספק תובנות חשובות וספציפיות לתוך תכונות פיזיולוגיות ופרמקולוגית של DSM (ראה ביקורות1,2,3,4 עם זאת, פרשנות של תוצאות שהתקבלו תאים בודדים בודדים מאפשר מסקנות במיוחד לייחס את סוג התא בודד עצמו. הבנה זו הייתה הכוח המניע להקמת שיטה אמינה ובעלת שימוש לגילוי לקבלת תאים מבודדים של ה-DSM מפני כל דגימות שלפוחית השתן הכוללת. שלא כמו סוגים רבים של תאים אחרים, תאים שריר החלקה לא יכול להיות תרבותי באופן אמין עקב אובדן של שלהם פנוטיפ הילידים כולל שינויים ספציפיים ב-electroפיסיולוגית שלהם נכסים7,8. עובדה זו מחזקת יותר את החשיבות של מחקרים שבוצעו בתאי DSM מבודדים מבחינה פיזיולוגית.
בשלהי שנות השמונים ותחילת שנות התשעים, הקבוצה של אידנברג (גרמניה) פרסמה סדרה של מחקרים אלקטרופיסיולוגיים על תאי DSM מבודדים טריים שהתקבלו מפני שלפוחיות שתן של חזיר מגינאה9,10,11,12,13 (שולחן 1). השיטה הדגישה שני תצפיות חשובות שסייעו בהשגת תאים חיוניים ושימשה כהנחיה ראשונית לאחרים. הם היו 1) טיפול מקדים בחתיכות DSM מבודדים עם Ca2 +-פתרון חינם/בינוני לפני טיפול אנזימטי ו 2) העיכול רקמות עם פתרון המכיל את הקולגן. שני צעדים קריטיים אלה שולבו בכל הגרסאות העוקבות של הליכי דיסוציאציה של תא DSM (שולחן 1). כיום, הקבוצה שלנו מעסיקה שניים שלבים רציפים papain הגישה לדיסוציאציה. חתיכות DSM מטופלים לראשונה עם פתרון אנזים המכיל פפאין ולאחר מכן עם הקולגן סוג II מסיסות באותו פתרון (DS, ניתוח/עיכול פתרון). גישה זו מניבה תאי DSM בודדים ממינים שונים, כולל שפן ניסיונות, חזיר, חולדה, עכבר, וחשוב ביותר (שולחן 1).
תאי DSM בודדים מספקים מקור לביולוגיה מולקולרית מספר ניסויים פיזיולוגיים. עד כה, ביטויי חלבון ו-mRNA למדו באמצעות האימונוציטוכימיה, או בדיקות ה-RT-PCR/רביעיית-PCR התגלו רמות גבוהות של גילוי עבור ערוצי יונים שונים, כולל מתח מוליכות גדול-ו-Ca2 +מופעל (BK), מוליכות קטנה ca2 +-הופעל k+ סוג 3 (SK3), מגודרת מתח k+ (kv), L-סוג מגודרת מתח Ca2 + (Cav), ו קולטן ארעי הפוטנציאל מסוג 4 (TRPM4) ערוצים, כמו גם Na/Ca2 + מחליף 14,15,16,17,18,19,20,21,22. הם כולם חשבו לשלוט על היכולת של ה-DSM, התאיים על2 + רמות והקונקטיליות. תיקון-קלאמפ גישות פיסיולוגיים, שבוצעו ישירות על חזיר גינאה, עכבר, עכברוש, או תאים DSM האדם, סיפק הפגנה ישירה של תכונות ביופיזיקלי ו פרמקולוגית של L-סוג Cav, kv (kv2. x. Kv7), SK, BK, ו TRPM4 ערוצים17,19,20,21,22,23,24,25 ,26,27,28,29,30,31. הגישות כללו מלחציים בעלי מתח פנימי רגיל, מלחציים מחוררים ומצמד מתח מחורר, והקלטות של ערוץ יחיד (מצורפות תא, הפנים-החוצה ותצורות חיצוניות). בנוסף, הקלטה פוטנציאלית הממברנה של DSM באמצעות מלחציים הנוכחי סיפק ראיות כי היעד מרתק סוכנים תרופתי לשנות את היכולת של הסלולר. לדוגמה, TRPM4 מעכב 9-פנילאני המושרה היפרפולריזציה בתאי DSM שהתקבלו בני אדם, שפן גינאה, ו עכברוש שלפוחיות שתןשככים19,20,22,31. בין שיטות אלקטרופיזיולוגיות שונות, אמפוריטיצין-B (ו nystatin, מגרסידין, ו β-escin) מחורר הקלטות תיקון-קלאמפ לספק יתרון מפתח על ידי שמירה על מולקולות איתות מהותי תאיים ומסלולים. רק משקל מולקולרי נמוך הקטרים במידה פחותה, קלרנית- -אבל לא חלבונים או מולקולות איתות כולל Ca2 + -הם חדיר דרך נקבוביות קרום הפלזמה נוצר על ידי אמפוריטיצין-B או nystatin32. התוצאה המוצלחת של ניסויים מחורר מלחציים טלאי תלוי במספר משתנים כלליים ייחודי לטכניקה זו. כאן, אנו מתארים את פרטי ההליך ניצול אמפוריטיצין-B כי הקבוצה שלנו השתמשה בהצלחה במהלך השנים15,22,33,34,35,36,37,38,39.
לטעון, ערוצי הקטיון שאינם סלקטיבית נותרים אחד מסוגי הערוצים הפחות מובנים בתאי DSM. הדוח הראשון של ערוץ היון שאינו סלקטיבי מתאריך חזרה ל1993. המאמר על ידי ולנר וישראנברג11 תיאר 33 pS ערוץ יחיד המופעל למתוח המציג את סדר הדירוג הבא של חדירות היונים: K+> Na+>Cs+> > > Ba2 +> Ca2 +, ועיכוב של פעילות ערוץ על ידי Gd3 +, מעכב כללי של ערוצי קטיון לא סלקטיבית. כמעט עשור לאחר מכן, Thorneloe ו נלסון40 תיאר Na+ לחדיר זרמים היון בתאי DSM העכבר, מעוכבים על ידי Gd3 +, באמצעות הקלטות התאים השלם. מאז הזהויות המולקולריות של ערוצי הקטיון הבלתי-סלקטיבית והמאפיינים הביופיסיים שלהם נותרים, יש לקבוע חקירות עתידיות באזור מחקר זה. הפרוטוקול המתואר בזאת להקלטה של זרמים בערוץ הקטיון לא סלקטיבי-באמצעות מסחטות ומוצרים תאיים המכילים פתרונות מבוססי Cs+, תה+, ו nifedipine (שולחן 2) כי הטיה מבחינה פיזיולוגית ופרמקולוגית Kv ו-Cav והוא ימשיך להיות שימושי בחקירות אלקטרופיזיולוגיות של ערוצי היון לא סלקטיבי יש לנו מנוצל זה פרוטוקול ספציפי כדי לקבוע את היקף העיכוב של זרמי הקטיון של תא שלם על ידי TRPM4 channel חוסם 9-פנילl בפיג שפן, עכברוש ותאי DSM האדם19,20,22.
ביחד, השיטה המתוארת כאן לקבלת תאים מבודדים בודד DSM מתוך שלפוחית השתן האנושית מספק תאים קיימא מתאים מאוד לחקירות אלקטרופיזיולוגיות באמצעות תצורות שונות של טכניקת התיקון-קלאמפ, Ca2 +-הדמיה, אימונוציטוטוכימיה, בתוך שיטת הליטיגציה האבובית באתרו, ואת תא בודד RT-Pcr/רביעיית-PCR, כמו גם טכניקות מתקדמות בביולוגיה מולקולרית כולל ניתוח MICROARRAY, RNA-seq, ו-שבב-seq. השימוש בשיטת התיקון האמפוריטיצין-B המחריב משמר את סביבת התא המקורי בניגוד לתצורות אחרות. כאשר בוצעו באמצעות התנאים הספציפיים המפורטים כאן, נועד לשלול את התרומות של K+ ו-Ca2 + זרמים בתאי DSM, זרמים המושרה בשלב המתח להציג את המאפיינים של זרמים היון לא סלקטיבי מתאים לביופיסיים ו פרמקולוגית.
Protocol
כל השיטות המתוארות כאן אושרו על ידי ועדות מוסדי הדירקטוריון של אוניברסיטת טנסי מדעי הבריאות מרכז (ממפיס, TN, IRB 17-05714-XP), ואת האוניברסיטה הרפואית של דרום קרוליינה (צ'רלסטון, SC, IRB 00045232). ההליכים שאושרו מאפשרים שלמות עובי שלפוחית השתן דגימות (> 1 ס"מ על ידי > 1 ס מ)-המכיל את כל השכבות כולל רירית, שריר השרירים החלק, ו serosa כמו גם המצורפת כלי הדם ורקמת האדיפוז)-כדי לאסוף מהחולים-תורמים שעברו החילוץ חלקי כירורגי של השלפוחית. המטופל-תורמים הם מבוגרים (טווח גיל למד עד עכשיו: 25 עד 87 שנים), או זכר או נקבה, עם או בלי תסמינים של שלפוחית השתן הפרוע (כפי שסווגו על ידי האגודה האמריקנית אורולוגית I-PSS ציון41). הליכים כירורגיים כוללים מגוון רחב של מצבים רפואיים כולל כריתת ציסטליה רדיקלית עבור קרצינומה של אורוטאליאל, ו אדנוקרצינומה. במקרים כאלה, הדגימה של שלפוחית השתן שנאספו הוא מרוחק מהאתר של הגידול.
1. חיתוך רקמות ה-DSM והכנת מטבעות ה-DSM ללא שימוש ברירית
- בדוק את כל עובי שלפוחית השתן הדגימה שהגיעה למעבדה מחדר הניתוח במיכל אטום היטב מילא את הפתרון לניתוח/עיכול קר (איור 1 ושולחן 2 עבור הרכב של DS).
הערה: הדגימה נשמרת בדרך כלל ב-DS קר מספר שעות ללילה לפני ההגעה למעבדה. עבור אחסון ארוך יותר, DS (טבלה 2) הוא שיושלם עם 1 מ"מ cacl2. - הסר ושטוף את הדגימה השלמה של ה-DSM האנושי (המכיל את כל השכבות כולל רירית, DSM ו-serosa) עם DS קר הקרח כדי לשטוף את הפסולת המצורפת דם.
- הצמד את הדגימה של שלפוחית השתן, רירית פונה כלפי מעלה, serosa למטה, אל הסיליקון enantiomer מצופה (טבלה של חומרים) 150 mm קוטר עגול מלאה בקרח קר DS (איור 1B).
- הסר את רקמת האדיפוז הסמוכה, כלי הדם, האפיתל (אורואלינום) ורירית מוסקולריס מהדגימה באמצעות ניתוח חד באמצעות מיקרו מספריים ומלקחיים.
- גזור מספר חתיכות DSM נטול רירית (~ 2-3 מ"מ ארוכים ו 4-6 מ"מ רחב) (איור 1ג).
2. דיסוציאציה אנזימטית של מיכלי DSM המניבים מבודדים בודדים מתאי DSM בודדים
- מקום 3 כדי 6 החלקים DSM לתוך צינור המכיל 1 עד 2 מ ל של טרום מחומם (~ 37 ° c) DS המכיל פפאין ו dithioטרטיםol (DS-p, שולחן 2) ו הדגירה החלקים DSM ב DS-P עבור 30-45 דקות ב ~ 37 ° c לרעוד בעדינות את הצינור מדי פעם (פעם 10-15 אחת
הערה: כדי לשלוט באופן אופטימלי בטמפרטורה לטיפול אנזימטי, צינורות בעלי רקמה ופתרונות אנזימים ממוקמים בחדר רקמת זכוכית מלא במים המחוברים לאמבט מים מחוממים (איור 1ד) או מרחץ מהיר בטמפרטורה גבוהה הנשלט על-ידי מים (איור 1E). - הסירו את DS-P מהצינור, רוחצים בקצרה את חתיכות ה-DSM עם הקרח הקר DS, מסירים את הקור DS מהצינור ועוזבים את חתיכות ה-DSM שיושבות בתחתית הצינורית.
- הוסף 1 ל 2 מ ל של מכיל DS המכילים הקולגן סוג II (DS-C, שולחן 2) לצינור עם חתיכות DSM, לערבב בעדינות; ו-דגירה עבור 25-40 דקות ב ~ 37 ° צ' מטלטל בעדינות את הצינור מדי פעם (כל 10-15 דקות).
- התעלם DS-C ושטוף שטופלו באנזימים מטופלים 5-10 פעמים עם DS קר קרח.
- לאחר השטיפה האחרונה, השאר את פתרון DS בתוך השפופרת; בעדינות קצוצות עם מלוטש אש הצינורות פסטר מספר פעמים כדי לשחרר תאים DSM יחיד.
- מניחים כמה טיפות של הפתרון DS המכיל תאי DSM מפוזרים על חדר זכוכית תחתון או שמיכות ולבדוק חזותית עבור איכות תחת מיקרוסקופ (באמצעות מטרה 20x או 40x) לאחר 5 דקות לפחות בעקבות היישום כדי לאפשר לתאים לדבוק התחתון.
- השתמש מיד בתאי DSM מבודדים באופן טרי עבור ניסויים אלקטרולוגיים או לאחסן את התאים בצינור המכיל DS ב ~ 4 ° c או על הקרח או במקרר עד השימוש (בדרך כלל עד 8 h ההכנה).
הערה: במסגרת אותה הכנה איכות התאים משתנה מאוד לתאי ה-DSM המתים, שאינם מתעכלים (איור 2). כאשר השיטה הרציפה papain-קולגן מניב מספר גבוה מאוד של תאים לא קיימא, ההכנה מושלך, ואת העיכול החדש של חתיכות DSM מבוצעת אבל עם מרווחי דגירה מופחתת. אם ההליך מביא מעט מדי תאי DSM לאחר מכן לעיכול הבאים של חתיכות DSM, מרווחי הדגירה מוגברת. החיסונית חיובית הפעילות כדי α-השריר החלקה אקטין מאשרת את זהותו של תאי DSM (איור 3).
3. הקלטת ומתח המושרה זרמי הקטיון מתאי ה-DSM באמצעות אמפוריטיצין-B מחורר-תא שלם-מהדק תיקון טכניקת
- פיפטה 0.25-1 מ ל של השעיה לתא על תא זכוכית תחתון יושב על הבמה של מיקרוסקופ הפוך ולאפשר לתאים לדבוק בתחתית הזכוכית.
- לאחר דגירה עבור לפחות 45 דקות, להסיר DS מהאמבטיה ולהחליף עם הפתרון E (טבלה 2) על ידי superfusion שבו זרימת הפתרון בסיוע על ידי כוח הכבידה באמצעות אבובים כניסת האטה מחליף DS עם הפתרון החדש בעוד אבובים לשקע מחובר כלי פסולת ואקום מסיר את הפתרון קאמרית מונע גלישה. שימו לב: התמיסה האלקטרונית מכילה את הטאטיוליאמילמוניום (תה+) ו צסיום (Cs+) כדי לעכב את K+ זרמים.
- הכנת פתרון מלאי עבודה של אמפוריטיצין-B בדימתיל סולפוקסיד (DMSO) (1 מ"ג לכל 10 μL של DMSO). כדי לפזר במלואו אמפוריטיצין אבקה, sonicate (לפחות 15 דקות) ומערבולת הפתרון היטב.
הערה: שלב זה אורך בדרך כלל פחות מ-10 דקות. המסת 3-4 mg של אמפוריטיצין-B ב 30-40 μL של DSMO בצינור מיקרוצנטריפוגה של 1.5 mL היטב. כמויות גבוהות יותר של אמפוריטיצין-B דורשים הממס DSMO יותר בדרך כלל וכתוצאה מכך מרווח ארוך יותר עבור ערבוב ופתרונות לא שלמים של חלקיקים מוצק אמפוריטיצין-B הנמצאים בתוך הצינור. - התמוססות פתרון מלאי של אמפוריטיצין-B בפתרון הפיפטה (פתרון P, שולחן 2) כדי לקבל ריכוז סופי של 200-500 μg/mL. שלב זה דורש sonication והורטקנג נרחבים בהגדרה במהירות גבוהה (8-10/10) עבור ~ 30 עד 60 דקות לשלב כדי להבטיח ערבוב אופטימלי ומניעה של היווצרות אמפוריטיצין-B מזרז בפתרון הפיפטה.
הערה: אמפוריטיצין-B יזרז את הזמן והוא רגיש לאור. פתרון הפיפטה הפועל המכיל אמפוריטיצין-B נבדק מסיסות, מעורב ביד לפני מילוי הפיפטה ונשמר בחשכה. - משוך אלקטרודות מרובות, האלקטרודות אש-פולנית, ו (במידת הצורך) לחלוק את הטיפים עם שעווה שיניים.
- למלא את קצה האלקטרודה תיקון עם פתרון הפיפטה (פתרון P, שולחן 2) ללא אמפוריטיצין-B על ידי שטבילה קצרה האלקטרודה בפתרון.
- ממלאים את האלקטרודה עם פתרון הפיפטה זהה המכיל אמפוריטיצין-B.
- הבהר את האלקטרודה על מחזיק המחובר לשלב הכותרת של מגבר מהדק.
- באמצעות מיקרומניפולציה, מניחים את האלקטרודה ממש מתחת לפני השטח של הפתרון לחילוץ כך קצה האלקטרודה הוא פשוט שקוע.
- במצב מהדק מתח, להגדיר את הפוטנציאל המחזיק 0 mV ולהתאים את הנוכחי ל -0 הרשות עם חיוג הקיזוז הצינורות על המגבר המסחרי (לוח חומרים).
- לקבוע את ההתנגדות אלקטרודה באמצעות החלון בדיקת קרום/תפקוד של תוכנת הרכישה המסחרית (טבלת חומרים). כדי להפעיל את כלי לחץ > מבחן ממברנה ≫ Play או סמל קיצור בתוכנה. התנגדות האלקטרודה נחוש צריך להיות בטווח של 2 כדי 5 MΩ.
הערה: מבחן ממברנה פונקציה המסופקת בתוכנת הרכישה המסחרית או חותם בדיקה האפשרות על המגבר ניתן להשתמש כדי לפקח על עמידות האלקטרודה על ידי הפעלת צעדי מתח באופן חוזר. - המשך לעקוב אחר התנגדות האלקטרודה תוך קידום האלקטרודה לעבר תא DSM שנבחר עם מיקרומניפולציה (איור 4א).
הערה: כדי להיחשב כתא DSM בר קיימא, על התא להציג מורפולוגיה מוארך בצורת ציר, הילה מוגדרת היטב סביב התא, קצוות חדים ומראה למחצה (הסרפנטיין). - כאשר נוגעים משטח התא עם האלקטרודה-מצוין על ידי עלייה מהירה התנגדות אלקטרודה נמדד עם הפונקציה מבחן קרום-טופס giga-חותם על ידי החלת לחץ שלילי עדין מהירה על מחזיק האלקטרודה דרך אבובים. התוצאה היא לחץ שלילי שנוצר בקצה של האלקטרודה כי מושך קרום התא לתוך האלקטרודה לסייע היווצרות של giga-חותם או קשר הדוק מאוד בין האלקטרודה ואת קרום פלזמה (איור 4B).
- פעם אחת את הטפסים giga-חותם, לפצות על הקיבוליות באמצעות כוונון מהיר ואיטי מחייג על מגבר מסחרי ניטור giga-חותם יציבות (דליפה הנוכחי) באמצעות הפונקציה מבחן קרום.
- לאפשר זמן, בדרך כלל 30-60 דקות, עבור אמפוריטיצין-B לפזר את הפיפטה ולהיות מוכנס לתוך קרום הפלזמה להרכיב נקבוביות בעיקר סלקטיבי להנשות מונוטוני. במהלך שלב זה, להמשיך לעקוב אחר החותם giga עם הפונקציה מבחן קרום. כמו מחורר תא מגדילה כך משרעת של הקיבוליות הקיבול (להשוות את הדמות 4B לעומת איור 4C הצגת מחורר תא לא יעיל, בהתאמה) נמדד עם הפונקציה בדיקת קרום.
- כאשר ניקוב התיקון הוא אופטימלי (נשפט על-ידי התנגדות סדרה יציבה בדרך כלל מתחת 50 MΩ), לבטל את ארעיות הקיבול על ידי התאמת מחייג לקיבוליות תא התנגדות סדרה על המגבר. פיצוי התנגדות סדרה יכול להתבצע גם בשלב זה (איור 4D).
- ברגע שאחד מהזרמים התקפים של זרמי הקטיון המושרה על ידי הפרוטוקול שצוין, מוחלים על תנאי מורכב או פיזיולוגי כדי לבדוק את התגובות לפקד-, מצב בדיקה וכשלון (אם אפשר) עם ה תוכנה לרכישת מסחר.
- זרמים מקליטים עם פרוטוקול שגרתי בשלב המתח הכרוך בהחזקת תאי DSM ב-64 או-74 mV ומעבר למתח במרווחים של 10 mV עבור 400 או 500 ms מ-94 + 96 או + 106 mV וחוזר לפוטנציאל המחזיק.
הערה: ערכי הממברנה הפוטנציאליים מותאמים לפוטנציאל הצומת הנוזלי של 14 mV (באמצעות פתרונות P ו-E, שולחן 2). הפוטנציאל הגלום בצומת הנוזלי מתקבל בתוכנת הרכישה המסחרית (לוח חומרים) על ידי לחיצה (כלים > הפוטנציאל של ההסתעפויות) וכניסה לריכוזים של רכיבי יון פתרונות. ניתן להשתמש בפרוטוקול רמפה גם לקבלת הקלטות נוכחיות. - הפעל את פרוטוקול המתח במרווח זמן של ~ 1 דקות רציף במהלך זרמים של הקלטת ניסוי עבור בקרה טרום-הוספה, תנאי בדיקה וכשלון.
- זרמים מקליטים עם פרוטוקול שגרתי בשלב המתח הכרוך בהחזקת תאי DSM ב-64 או-74 mV ומעבר למתח במרווחים של 10 mV עבור 400 או 500 ms מ-94 + 96 או + 106 mV וחוזר לפוטנציאל המחזיק.
4. ניתוח נתונים והדמיה
- פתח קבצים מוקלטים בתוכנה לניתוח נתונים מסחריים (טבלת חומרים) עבור הפקד, תנאי הבדיקה וכשלון על-ידי לחיצה על קובץ > פתח נתונים ובחירת קבצים מעניינים לפתיחה.
הערה: לניתוח בדרך כלל שלושה קבצים (כל אחד מהם מכיל ערכה יחידה של עקבות להפעלת פרוטוקול יחיד) עבור כל תנאי נפתח ומנותח. התגובות מממוצע לאחר מכן כדי לקבל תגובה מרושעת עבור כל תנאי. התוכנה המשמשת לרכישת נתונים מכילה אפשרות לאסוף באופן אוטומטי הפעלת בדיקות מרובות שצוינו על-ידי המשתמש וממוצעי אותם עבור קובץ פלט יחיד שניתן להשתמש בו כחלופה. - השג את התגובה הממוצעת ב200 האחרונות עבור המעקב הנוכחי הנמדד בכל מתח; מרווח הזמן שנבחר משקף רמת מצב קבוע של הפעלה נוכחית של שלב המתח. כדי לעשות זאת בצע את השלבים הבאים.
- בחר קובץ מעניין לניתוח בתוכנת הניתוח המסחרי (טבלת חומרים).
הערה: התוכנה ממקמת את הקובץ האחרון שיובא לחלון התצוגה הפעיל שלה. הקובץ הפתוח מציג סדרה של עקבות חופפים שהושגו עם פרוטוקול של שלב מתח. כברירת מחדל, בחלון הפעיל ארבעה סמנים (הצגת ערכי x ו-y עבור הסימן המסומן) מוצגים. - בחר את טווח ניתוח על ידי מיקום הסמן 2 בסוף 400 או 500 ms בצעד מתח הסמן 1 במרווח של 200 ms לפני זה, כך טווח ניתוח הוא 200 ms.
- השג תגובות עבור כל מתח על-ידי לחיצה על ניתוח ≫ גרף מהיר > IV (או סמל קיצור הדרך של IV) (בחלון הבקשה לפני יצירת אישור נתונים המהווה את האפשרות 'סמניםלציר y (נוכחי) '. לחץ על אישור כדי ליצור את גרף ה-I-V ולמקם את הנתונים בגליון עמודות תוצאות שניתן להציג על-ידי גישה ל-Windows > תוצאות.
- ניתוח קבצים נוספים על-ידי שלבים חוזרים 4.2.1-4.2.3. לחץ על נתח ≫ גרף מהיר > IV או את קיצור הדרך של סמל iv , בחר באפשרות צרף במקום להוסיף נתונים נוספים לגליון התוצאות בעת עיבוד העקבות.
- העתק נתונים לגיליון אלקטרוני על-ידי בחירת עמודות הריבית והקשה על ctrl + C כדי להעתיק ו- ctrl + V כדי להדביק. אחסן את גליון העבודה תוצאות בתוכנת הניתוח המסחרי (טבלת חומרים) בתבנית (*. rlt) על-ידי לחיצה על קובץ > שמירה בשם.
- בחר קובץ מעניין לניתוח בתוכנת הניתוח המסחרי (טבלת חומרים).
- עבור כל תא, התאם את התגובות עבור כל שלושת התנאים לערך של שלב המתח המקסימלי עבור הפקד מראש בתוספת (בהתאם לנוסחה: בקרת תגובה/תגובה-Max) וגרף התגובות כערכים נוכחיים (או דחיסות נוכחית) לעומת קשרי מתח (איור 6).
- במעבד גליון עבודה, קבע את התגובות הממוצעות כזרמים (pA) או הצפיפויות הנוכחיות (pA/pF) עבור בקרה, תנאי הבדיקה (בדוגמה זו, 9-פניל) וכשלון בכל צעד מתח.
- לחלק ערכים עבור כל מתח של כל תנאי (שליטה, 9-פניל, וכשלון) על ידי תגובת הבקרה המקסימלית שהתקבל במתח הגבוה ביותר (+ 96 mV באיור 6) עבור שליטה מראש בתוספת בעקבות הנוסחה: תגובה מנורמלת עבור מצב (x) = תגובה (x)/בקרת תגובה-Max עבור (x
- לניתוח סיכום, סדר את הנתונים בתבנית שניתן להעתיק בקלות לתוכנית גרפית (לדוגמה, מנסרה) עבור פריט חזותי.
תוצאות
דיסוציאציה אנזימטית של מוצרי DSM מספקת תאי DSM בריאים ומבודדים המשמשים באופן שגרתי במחקרים פונקציונליים ומולקולריים כגון: מהדק-מלחציים לתיקון וכימיה אימונוציטוטוזאור. איור 1 מסכם את צעדי החיתוך ומדמיין את הכיוונונים המועסקים בבקרת טמפרטורה של צעדי טיפול אנזימטיים. איור 2 ממחיש תמונות בשדה בהיר של תאים DSM שהתקבלו משלוש דגימות של שלפוחית השתן האנושית כל אחד מתורם מטופל שונה. תאי DSM בריאים בודדים מאופיינים על ידי מורפולוגיה בצורת ציר, קצוות מוגדרים היטב, הילה מוגדרת היטב סביב התא, והמראה למחצה (הסרפנטיין) כאשר הוא מוצג תחת המיקרוסקופ (ראה תאי DSM המסומנים בחצים לבנים באיור 2). הם גם מגיבים התכווצות סוכנים כגון האגוניסט השרירינית carbachol או גבוהה K+ (60 מ"מ) יישומים. תאי DSM להראות פעילות immunoreactivity עבור α-השריר החלקה אקטין המאשר את זהותם (איור 3).
תאי ה-DSM מתאימים באופן אידיאלי לחקירות מהדק-מלחציים בעלי מאפיינים של ערוץ יונים. כאן, אנו מתארים את אמפוריטיצין-B מחורר-הקלטה מחוררים שיטת ההקלטה באמצעות פיפטה ומסחטות פתרונות (שולחן 2) להקליט בצורה אופטימלית מתח המושרה ערוצים. תחת התנאים הספציפיים המועסקים, המצור של Kv ו-L-סוג Ca2 + זרמים עם Cs+/תה+ ו nifedipine, בהתאמה, הבטיחו את חיסול התרומה של רכיבים אלה יוניים לתוך הזרם השלם-מתח מעורר. איור 4 ואיור 5 להראות, בהתאמה, את הצעדים הניסיוניים של אמפוריטיצין-B מחורר טלאי שיטת התיקון ואת הזרמים של תא שלם הנמדד עם המושרה צעד מתח או פרוטוקול השיפוע בשלושה תאים שונים של ה-DSM האנושי, כל אחד מתורם מטופל שונה. שימו לב כי ההקלטות מציגות מידה מסוימת של שינויים במונחים של הגברה ותיקון כלפי חוץ. ניסויים נוספים התגלו כי 9-פניל, מעכב ערוץ TRPM4, ביעילות ומעכבות הפיך זרמים האדם של היון DSM במתח שלילי וחיובי (איור 6). המרכיב הנוכחי הרגיש בתשעה פניל, ממחיש עיכוב חזק יותר במתח חיובי ותיקון כלפי חוץ (איור 6ג).
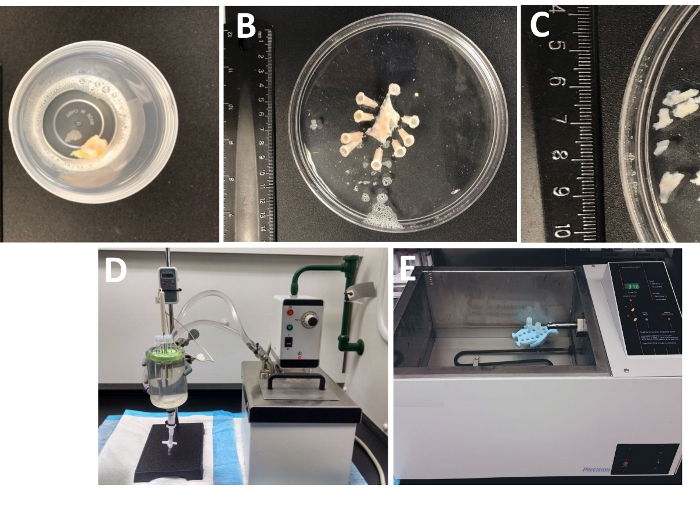
איור 1: סיכום צעדי החיתוך הנובעים מהכנת פיסות השריר החלקות (DSM) והכיוונון המשמש לדיסוציאציה אנזימטית. מוצגים הם תמונות של: (א) עובי שלם האדם שלפוחית השתן דגימה שסופקו ניתוח שלפוחית פתוחה כחומר כירורגי חיצוני בקרח קר DS, (ב) הכנה זהה לאחר הצמדה עם שכבת dsm שנחתכה באופן חלקי (C), חתיכות dsm של ממדים משתנים שנחתכו משכבת ה-dsm מוכנות לעיכול אנזימטי (בחלקים קטנים) או לחקירות נסיוניות אחרות (חתיכות גדולות), (ד, ה) כיוונונים חלופיים המשמשים לעיכול אנזימטי של חתיכות DSM הכוללות אחד (1) מקלחת טמפרטורה מבוקרת מים מחובר דרך אבובים לחדר רקמת זכוכית גדולה מלא מים, מחזיק גומי לצינורות, צינורות פלסטיק המכילים חתיכות DSM ופתרונות אנזימים שהוכנו בפתרון לניתוח/עיכול (DS, או ds-P או DS-C, שולחן 2) ובדיקת טמפרטורה מקושרת לתצוגה המאפשרת ניטור רציף (ד), או (2) מים גדולים מלא טמפרטורה מבוקרת באמבטיה המכיל מחזיק וצינורות עם חתיכות DSM ופתרונות אנזימים ). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
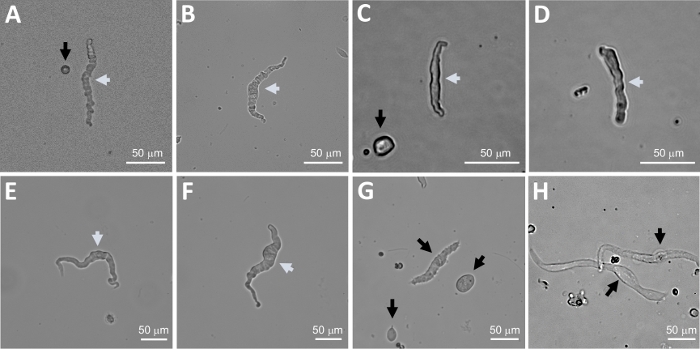
איור 2: הנציג באור בהיר תמונות של תאים מבודדים של ה-DSM האדם המתקבל באמצעות שיטת העיכול הרציף papain-קולגן. (A-F) המוצגים הם תמונות של תאים מבחינה מבחינה פיזיולוגית, בתאי DSM הנחשבים מועמדים מתאימים לניסיון מחורר הקלטות מהדק. (ז, ח) תמונות של תאים שאינם ניתנים לקיימא או מעולים מחדש; תאים כאלה נמנעו עבור ניסויים מלחציים טלאי. חצים לבנים ושחורים בחלוניות (A-H) מצביעים על תאי DSM הנחשבים לפעילים וללא קיימא, בהתאמה, לצורך ניסיון בהקלטות של קלאמפ. שים לב שהחיצים השחורים בחלוניות (A, C ו-G) מצביעים על שברי תאים (חלקים עגולים) או תאים קטנים החסרים במבנה DSM ובתוך (H) התאים מופיעים חיוורים ומורחבים. תמונות הן משלושה דגימות שונות של שלפוחיתהשתן (A ו-B: מקור תורם מטופל אחד, C ו-D : מקור תורם מטופל 2, ו -E-H : מקור תורם החולה שלושה). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
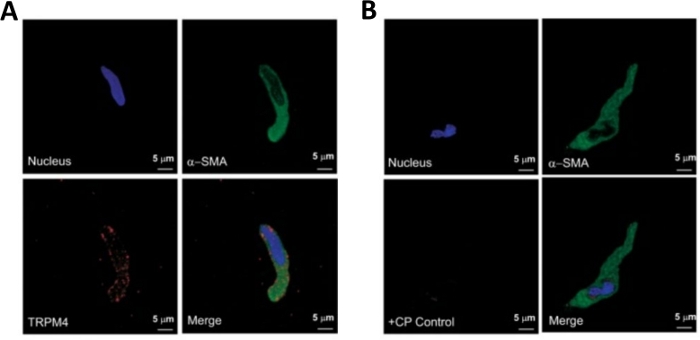
איור 3: ביטויים של קולטן ארעי הפוטנציאל הפוטנציאלי melastatin 4 (TRPM4) ערוץ ו-α-חלקה שריר ספציפי אקטין מערכת החיסונית בתאי ה-DSM האדם יחיד על ידי ניתוח החיסונית של אימונוtoכימיה. (א) המוצג הם תמונות קונפוקלית וקד המציג זיהוי אימונוציטוטוכימיה של ביטוי חלבון TRPM4 channel בתא DSM אנושי. אדום מכתים (למטה משמאל) מציין TRPM4 ערוץ חלבונים; צבע כחול (DAPI) מזהה גרעיני תאים (למעלה משמאל); ירוק מציין α-השריר החלקה אקטין (α-SMA, למעלה מימין); התמונה הממוזגת (הימנית התחתונה) ממחישה את החפיפה של כל שלוש התמונות. (ב) מיקוד תמונות הממחיש החליש של גילוי כימי של TRPM4 ביטוי חלבון ערוץ בנוכחות של פפטיד מתחרה ספציפי TRPM4 (CP) בתאי ה-DSM האנושי הבודד. צביעת כחול (DAPI) מציינת גרעין תא (משמאל למעלה); כתמים ירוקים היא α-השריר חלקה אקטין (α-SMA, למעלה מימין); התמונה הממוזגת (הימנית התחתונה) ממחישה את החפיפה של כל שלוש התמונות. התוצאות אומתו בארבעה ניסויים נפרדים תוך שימוש ברקמה שלמה של DSM או בתאי DSM מרובים מבודדים מארבעה חולים. התמונות מחריסטוב ואח ' (2016)22 ומשמשות באישור. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
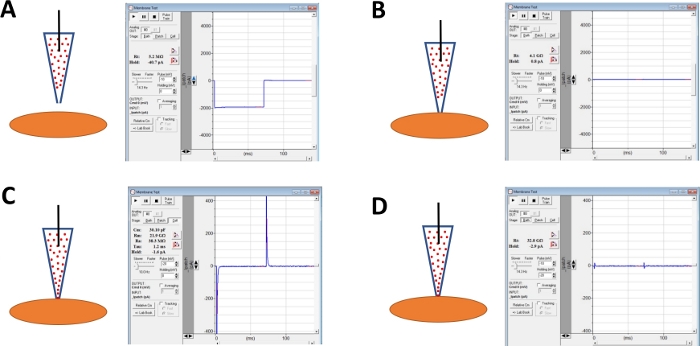
איור 4: איור סכמטי של צעדים המעורבים במערך החותמות giga ו-אמפוריטיצין-B של תאי ה-DSM האנושיים. מומחש הן עמדות מרחבית של אמפוריטיצין-B המכילים פיפטה ותאי DSM יחד עם תגובות משויכות עבור בדיקות רפידים שהתקבלו בתוכנת הרכישה המסחרית (טבלת חומרים) על ידי שינוי שלבי מתח (או-10 או-20 mV בדוגמה זו) קביעת התנגדות. תצורות הן: (א) לפני הגישה לתא עם אלקטרודה, (ב) לאחר היווצרות giga-חותם המתקבל על ידי מיקום אמפוריטיצין-b המכיל את הפיפטה (אמפוריטיצין-B מיוצגים על ידי נקודות אדומות) על פני השטח התא והפעלת לחץ שלילי, (ג) התצורה על התאים המוצג ~ 45 דקות לאחר היווצרות giga-חותם, בשלב זה זמן אמפוריטיצין-B יש הפיזור למטה את הפיפטה ואת המולקולות שלה הוכנסו לתוך קרום הפלזמה בקצה של הקטיית האלקטרודות הנקבוביות חדיר, ו (ד) את התצורה זהה כמו ב (ג) אבל עם ארעיות קיבוליות בוטלה באמצעות חוגות עבור הקיבולת תא שלם התנגדות הסדרה על המגבר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
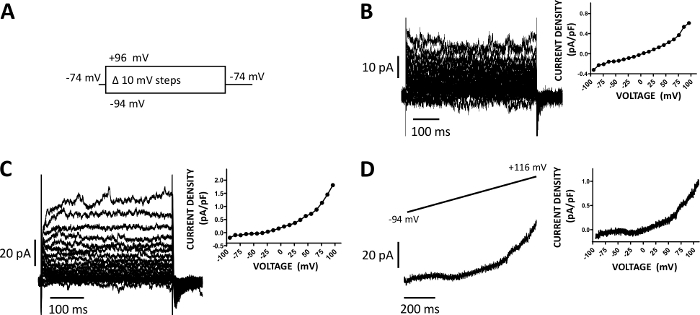
איור 5: זרמי הקטיון של תא שלם שנרשמו עם אמפוריטיצין-B שיטת הדבקה מחורר בתאי ה-DSM האנושי. (א) דיאגרמה של פרוטוקול צעד מתח ממחיש פוטנציאל ההחזקה של-74 mV ו-שלבי מתח של 400 ms המשך מ-94 כדי + 96 mv ביצעו במרווחים של 10 mV ולאחר מכן חזר ל-74 mV. (ב, ג) נציג עקבות הנוכחי יחד עם מגרשים הצפיפות הנוכחית מתח משני תאי DSM אנושי שונים, כל אחד מן שונה שלפוחית השתן דגימה/תורם המטופל השיג עם פרוטוקול צעד המתח המתואר ב (א). (ד) דוגמה למעקב הנוכחי שהושג עם פרוטוקול רמפה (המיוצג באופן גרפי בכניסה העליונה כשינוי מתח מ-94 ל-+ 116 mV במהלך המשך של 1 ב-0.21 mv/ms, הפוטנציאל המחזיק היה-94 mV). מימין לחלוניות (B-D), הגרפים מציגים את יחסי הצפיפות הנוכחיים עבור כל תא DSM שנרשם. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
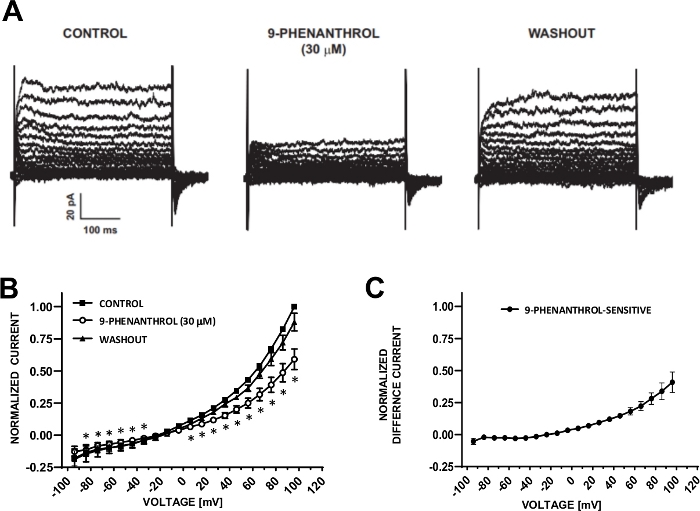
איור 6: TRPM4 ערוץ חוסם 9-פנילאני-מתווך עיכוב של זרמי הקטיון מושרה במתח בתאי ה-DSM האנושי. (א) המוצגים הם זרמים מייצגים הנמדדים בפרוטוקול של צעד המתח המתואר באיור 5a לשליטה, 9-פניל, וכשלון. (ב) סיכום תגובות מנורמלות לעומת מתח לשליטה, 9-פניל, וכשלון בשבעה תאי DSM (משבעה מטופלים שונים-תורמים). (ג) ההבדל הנוכחי עבור מרכיב 9-פנינטי-רגיש שהושג על ידי הפחתת הערכים בנוכחות של 9-פניל (30 μm) מאלה של הפקד המוצג ב (ב). נתונים ב (ב) ו-(ג) מוצגים כאמצעי עם קווי שגיאה עבור SEM, * מתאר משמעות (p < 0.05, לזווג מבחן סטודנט) להשוואת השליטה לעומת 9-פנינאי בכל מתח. חלוניות (א) ו-(ב) שוחזרו מחריסטוב אל (2016)22 ומשומשים עם הרשאה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| ינים | פרטי הפרוצדורה | פניות | |
| שפן ניסיונות | חתיכות DSM שוטפים עם Ca2 +-בינוני (mM: 100, 10 kcl, 1.2 KH2PO4, 5 mgcl2, 20 גלוקוז, 50 taurine נמדד pca = 6 (או 1 מ"מ) ולאחר מכן חותכים לחתיכות ומטופלים בדרך כלל 90-120 דקות (4 תקופות של 30 דקות) עם בינונית אנזים (mM: 130 KOH, 20 taurine, 5 פירובט, 5 קריאטין, 10 מ"מ hepes, מותאם עם חומצה methansulfonic ל-pH 7.4, 1 מ"ג/ml קולגן, 0.2 mg/ml בינוי E, 1 מ"ג/Ml חומצת שומן חינם אלבומין, pca = 4.2 (63 mM) או 3.7 (200 mm). תאי DSM בודדים אוחסנו ב קראפט-Bruhe (KB)-בינוני (ב-mM: 85 KCl, 30 K2הפו4, 5 Mgso4, 5 Na2ATP, 5 K-pyruvate 5 קראטין, 20 taurine, 5 ביתא-הו בוטימטר, 1 מ"ג/ml חומצת שומן חינם אלבומין, מותאם עם KOH כדי pH 7.2). שיטה חלופית: חתיכות DSM שוטפים עבור 10 דקות ב-Ca2 +-בינוני חינם (ב mM): 140 היום, 5 kcl, 1.2 MgCl2, 10 גלוקוז, 20 TAURINE, 5 hepes, מותאם עם Naoh ל-pH 7.4). אז, חתיכות DSM, מודב באותו Ca2 +-בינונית חינם להשלמה עם 5 מ"ג% כמוסות, 2 מ"ג% וכדומה ו-100 μmק2 עבור 2x20 דקות ערבוב. | קלנסנר & ישראנברג (1985)13,34 לוקנר & ישרנברג (1986)35 שניידר ואח ' (1991)10 בונייב & ישרנברג (1992)9 Weidelt & איזנברג (2000)36 מור ואח ' (2004)14 | |
| שפן ניסיונות, חזיר לנדסמן, ואדם | חתיכות DSM pre-מודלת עבור 5 דקות ב-Ca2 +הפתרון krebs חינם ולאחר מכן חותכים לחתיכות ו מתעכלים ב ca2 +-חינם הפתרון krebs המכיל 0.5-2 מ"ג/ml כלומר סוג I ו 0.1-0.5 מ ג/ml באופן קבוע ב 36 ° c עבור 20-30 דקות מעורבב כל הזמן. במקרים מסוימים, החלקים המעולים היו מוטרדים יותר מפיפטה קהה או מספינינג עד לתאים מניבים. תאים מבודדים אוחסנו בתמיסה קרייבס ששונתה (המתוארת בקליננר & איזנברג13) ושימשו בדרך כלל בתוך 3 שעות. הרכב הפתרון Krebs היה (mM): 140 Na+, 6 K+, 2 Ca2 +, 1.2 Mg2 +, 152.4 CL-, 10 גלוקוז, 10 hepes, pH 7.35-7.4 עם טריס. עבור Ca2 +-הפתרון חינם, ca2 + ו-Mg2 + הושמטו מהפתרון krebs. | Inoue & הברדינג (1990)37 inoue &Amp; brading (1991)38 נאואיאמה & brading (1995)39, 40 | |
| אדם | חתיכות DSM להציב Ca2 +-FREE hepes הפתרון של tyrode (ב mM: 105.4 ה, 20.0 או 22.3 נחקו3, 3.6 Kcl, 0.9 mgcl2, 0.4 ארנה2PO4, 19.5 or 4.9 Hepes, 5.4 או 5.5 גלוקוז, 4.5 או 5.5 Na-פירובט) וחותכים לחתיכות DSM. חתיכות DSM שנספג פתרון אנזים (Ca2 + הפתרון hepes חינם עם 0.7 mg/ml כלומר סוג I, 0.7 mg/ml papain, 1 מ"ג/ml אלבומין) לילה ב 4 ° c. רצועות התחממו אז ב 36.5 ° c עבור 15 כדי 30 דקות, שטף ובעדינות triturated בתמיסה טרייה. תאים מבודדים שאוחסנו ב-Ca2 + המכיל את הפתרון של Hepes tyrode או משמש באופן מיידי לניסויים. | מונטגומרי & פריי (1992)24 גלגוס ומטגנים (1994)41 פריי ואח ' (1994)42 סוי ואח ' (2001) 43 וו ואח ' (2002)44 | |
| שפן ניסיונות | DSM לחתוך לחתיכות PSS (ב mM: 137, 5.4 KCl, 2 MgCl2, 2 cacl2, 0.42 KH2P04, 4.17 נחקו3, 10 גלוקוז, 10 hepes, pH 7.4 עם naoh). חתיכות DSM להציב עבור 10 דקות בפתרון העיכול הבא (ב mM: 80 Na-גלוטמט, 55 הנאל, 6 KCl, 10 HEPES, 11 גלוקוז, 2 MgCl2, ו 0.2 cacl2) ולאחר מכן הועבר לבקבוקון המכיל את אותו פתרון אך עם 1 מ"ג/ml קולגן והוא 2, 1 מ"ג/ml טריפסין מעכב (לעיתים מושמט), 1 מ"ג/ml שומן חינם בשור, עבור ~ 70 דקות ב 35 ° צ' או ~ 60 דקות ב 37 ° תאי DSM בודדים הושגו על ידי הטריטורציה דרך פיפטה פסטר באותו פתרון ללא סידן ואנזימים. לאחר הוספת משולש, Ca2 + (1 מ"מ) התווסף והתאים אוחסנו ב 4 ° c. התאים תמיד היו בשימוש באותו היום. | Bonev & נלסון (1993)53,54 heppner ואח ' (1997)26 פטקוב ואח ' (2001)47 שייב ואח ' (2001, 2007)48,49 | |
| שפן ניסיונות, עכבר, עכברוש ואדם | הפרוטוקול משתמש בטיפול בדיסוציאציה בשני שלבים בעקבות הניתוח החריף של Ca2 +(ב mM: 80 Na-גלוטמט, 55 הנאל, 6 kcl, 10 hepes, 11 גלוקוז, ו 2 mgcl2). ראשון, החלקים DSM טופלו עבור 25-45 דקות ב 37 ° צ' עם 1-2 mg/ml papain, 1 מ"ג/ml dithioאריטינול ו 1 מ"ג/ml סרום הפרה אלבומין בפתרון הדיסוציאציה (mM: 80 מונוסודיום גלוטמט, 55 הנאל, 6 KCl, 2 MgCl2, 10 hepes, ו 10 גלוקוז, מותאם ל-pH 7.3 עם naoh) ולאחר מכן חתיכות DSM הועברו לפתרון העיכול המכיל 1-5 mg/ml כמוסות מסוג XI (סיגמא) או קולגן הקלד 2, 1 מ"ג/ml סרום אלבומין, 0 או 1 מ"ג/ml טריפסין מעכב ו 100 Μm Ca2 +, עבור 6-30 min. בעקבות דגירה, הרקמה מתעכל נשטפה מספר פעמים בפתרון העיכול ללא אנזימים Ca2 + ולאחר מכן בעדינות triturated לתשואה בודד תאים שריר חלק. | פטקוב ואח ' (2001)50 ת'ורנלאי & נלסון (2003)51 תורנלסון & נלסון (2004)33 פטקוב & נלסון (2005)27 הריסטוב אל (2008)52 ליין ואח ' (2010)53 . (2011)15 קסין ואח ' (2012)54 פרג'ולי ואח ' (2012)25 מלאכי ואח ' (2013)29 פאראג'ולי ואח ' (2013)31 לי ואח ' (2013)55 מmalysz ואח ' (2014)23 סמית ואח ' (2013)19, 20 הריסטוב ואח ' (2016)22 לי ואח ' אל (2017)56 yarotskyy ואח ' (2018)57 | |
טבלה 1: סיכום גישות אנזימטיות המשמשות לבידוד תאי DSM בודדים מפני שלפוחיות שתן של מינים שונים.
| סוג הפתרון | קומפוזיציה (in mM) |
| DS (פתרון לחיתוך/עיכול) | 80 Na-גלוטמט, 55 הנאל, 6 KCl, 10 HEPES, 2 MgCl2, ו -11 גלוקוז, pH מותאם 7.4 (עם 10 M naoh) |
| DS-P (המכיל מעין DS) | DS המכיל 1-2 מ"ג/ml papain, 1 מ"ג/מ"ל dithiothreitol ו 1 מ"ג/ml סרום אלבומין |
| DS-C (קולגנאז-המכילים DS) | הפתרון DS המכיל 1-2 מ"ג/ml קולגן סוג II, 1 מ"ג/ml סרום אלבומין, 0 או 1 מ"ג/ml טריפסין מעכבי ו 100-200 μM Ca2 + |
| פ (פיפטה) | 110 csoh, 110 חומצה אספרטית, 10 הנאגול, 1 mgcl2, 10 hepes, 0.05 egta, ו 30 cscl, pH מותאם ל 7.2 עם csoh, ו שיושלם עם אמפוריטיצין-B (300-500 μg/ml) |
| E (מסחטות) | 10 טטראטימימוניום כלוריד (תה), 6 CsCl, 124, 1MgCl 2, 2cacl2, 10 hepes, ו-10 גלוקוז, pH מותאם ל 7.3-7.4 עם naoh או csoh, ו 0.002-3 (2-3 mM) nifedipine |
שולחן 2: קומפוזיציות של פתרון לנתיחה/עיכול (DS), ופתרונות פיפטה ומסחטות המשמשים בניסויים מחוררים של מלחציים.
Discussion
ההליכים המתוארים כאן להסביר את השלבים המעורבים בהכנת התאים הקיימא, מבודדים בתאי DSM מעובי שלמות האדם דגימות שלפוחית השתן באמצעות העיכול אנזימטי ובהקלטה של זרמים שלמים תא היון רגיש לTRPM4 channel מעכב 9-פנילl העסקת אמפוריטיצין-B מחורר תיקון מהדק הגישה. ההליך האנזימטי מסתמך על חשיפה דו-שיטית בעלת שני שלבים המכונה בזאת כשיטת העיכול הרציפה. הרקמות DSM מטופלים לראשונה עם פפאין ו dithioitol (מייצב החומר האנזים) תחת Ca הנומינלי2 +-מצב חופשי, ואחריו בשלב השני על ידי הקולגן סוג II בנוכחות נמוכה Ca2 +. הרציונל לביצוע עיכול פפאין תחת נמוך Ca2 + התנאים בתאי שריר חלקה תאריכים בחזרה לסוף שנות השמונים. מבודד העורק הראשי מבודדים התאים השריר חלקה הכינה עם פפאין מוצג צורה מוארך, הראה הכדאיות (התנגדות ספיגת כחול טריטן) והגיבו גירויים הקונקטילה (Ca גבוהה יותר2 + ו היסטמין)65. שנים מאוחר יותר, שיטה זו הוחלה בהכנת תאי DSM (ראה טבלה 1). הבחירה של מסוג הספר השני במקום סוגים אחרים מתייחס הפעילות הפרוטחרדה שלה גבוה יחסית מתאים באופן אידיאלי רקמות שרירים חלקות כולל DSM. אכן, הטיפול בקולגן בלבד יכול להניב תאים DSM יחיד, אם כי דורש חשיפה אנזים נרחב (≥ 60 min)53,54. מאז הפעילות הקולגנאז תלויה ב-Ca2 + והאנזים אינו פעיל בתנאים של ca2 +-free, העיכול האנזימטי האופטימלי של חתיכות DSM דורש את הנוכחות של Ca2 + 66. במקרה שלנו, DS-C מכיל 100-200 μM [Ca2 +] (טבלה 2). לאחר טיפול אנזימטי, חתיכות DSM מתעכל שוטפים בעדינות מספר פעמים עם DS קר ללא אנזימים או Ca2 + כדי להסיר את כל האנזים המאוגד רקמות. התקררות הקרח מסייעת לשמר את שלמות התא של DSM ולהגביל את הפעילות האנזימטית של כל פפאין או הקולגן שנותרו. בשלב האחרון, נשחקו של חתיכות DSM שטופלו באנזימים עם אש מלוטשת מבריק פסטר משחרר תא DSM יחיד. תאי DSM ממוקמים מיד על תא הקלטה עבור לימודי תיקון או סוגים אחרים של ניסויים או מאוחסנים על קרח ב-DS לשימוש מאוחר יותר באותו יום (בדרך כלל בתוך 8 שעות של הכנה, אבל התאים נשארים קיימא עד 24 h).
זיהינו מספר שיקולים חשובים להשגת בהצלחה תאי DSM בודדים. הראשון מתייחס לאיכות המקור. של הדגימה האנושית של ה-DSM כדי לשמר בצורה אופטימלית את שלמות הרקמה, דגימות DSM שהתקבלו מניתוחי שלפוחית השתן הפתוחה ממוקמים DS קר קרח בהקדם האפשרי ומתוחזק בסביבה קרה. באופן ספציפי, על החילוץ כירורגי של המטופל, הדגימה שלפוחית השתן ממוקם מיד על שולחן צדדי מוכן בחדר הניתוח. בדיקה ברוטו של הדגימה כולה (מושגת בדרך כלל במהלך כריתת cystectomy קיצונית או פשוטה) והפתיחה שלה. לאחר בדיקה חזותית, פיסת עובי שלמות סולם השתן מוסר מאזור מרוחק של הדגימה מאוד לא מעורב עם הגידול ממוקם מיד לתוך ספל (או 50 או 100 mL) המכילים קר (~ 4 ° c) פתרון חיתוך (DS) (טבלה 2) ולאחר מכן סגור היטב עם מכסה. בשל האופי המתוכנן של קצירת הרקמה, אנשי חדר הניתוח וצוות העזר שעושים את הקציר מוזהרים בתחילת המקרה הכירורגי על מנת לקבל את החומרים הזמינים בחדר הניתוח בזמן הפקת הרקמה. אמצעי זהירות אלה יחד עם האופי השגרתי והחוזר של שלבי העיבוד לשמור על הזמן החמים איסכמיה עבור הרקמה-מן החילוץ למיקום במיכל מקורר עם פתרון DS-כדי פחות מ 5 דקות. המיכל ממוקם לאחר מכן במקרר או בקרח בצידנית כדי לשמור על הסביבה הקרה ומועבר (קר בקרח) למעבדה. ברגע שהוא מגיע למעבדה, מתחילים לבצע את צעדי הדיסוציאציה. קשה מאוד לנבא אם מדגם DSM מסוים יניב תאי DSM באיכות גבוהה בעקבות דיסוציאציה אנזימטית, ולכן נמשיך בצעדי הדיסוציאציה האנזימטיים. במקרים רבים, במקביל לניסויים אלקטרולוגיים, הקבוצה שלנו מבצעת הקלטות מתח שונות על רצועות DSM המוכנות מאותם דגימות DSM. גילינו כי בדרך כלל אנו יכולים להשיג תאים DSM באיכות גבוהה מן ההכנות כי גם לספק בהצלחה רצועות קיימא עבור לימודי התכווצות איזומטרי (ההתבוננות שלא פורסמה שלנו).
הגורם השני מתייחס ליכולות שונות של אנזימים. הבחנו כי עבור שניהם פפאין ו כולקולאז סוג II, בכל פעם הרבה חדש של אנזים מגיע הספק, פעילות האנזים DS עבור העיכול רקמות יכול להשתנות. אנו, לפיכך, לייעל באופן שגרתי את ריכוז האנזים ואת מרווחי דגירה עבור כל הרבה חדש. כדי למזער את התרומה הרבה להשתנות, אנו מסודרים כמויות גדולות יותר של אותו הרבה ולעשות אצווה גדולה של פתרונות מניות ב 2 mL הבליטים של אנזימים ולאחסן אותם ב ~-20 ° צ' עד השימוש. לאורך זמן, עם זאת, מניות קפוא (מאוחסן עד 2 שבועות) יכול לאבד פעילות אנזימטית שלהם. המשתנה השלישי מתייחס לטמפרטורה של טיפולי עיכול אנזימים. פעילויות אנזימטיות של פפאין ו הקולגנאז להציג תלות טמפרטורה. Papain ו-קולגן סוג II פעילות התערוכה בטווחים טמפרטורה המקיף פיזיולוגיה הגוף הרגיל67,68. לכן, אנו שואפים לשמור על טיפולי האנזים יציבים ב-~ 37 ° c הימנעות טמפרטורות גבוהות יותר כדי לשמור על שלמות התא DSM. השיקול הרביעי מדאיג את השונות של איכות תאי ה-DSM הנמצאים בתוך כל הכנה החל מאוד קיימא (מציג מצוין מאפייני שריר חלקה קלאסית) לתאים לא בריאים, מתעכל יותר. מרווח הדגירה האנזים ממושך היא אחת הסיבות העיקריות להשגת מספר גבוה של תאים פגומים. טיפולים אנזימים מוגזמת פוגעים גם במבני חלבונים של ערוצי יונים, קולטנים ושנאים, להשפיע לרעה על הפונקציונליות שלהם. פרשנות של תוצאות שהתקבלו מתוך אנזימטי, תאים מבודדים טרי צריך לשאת את השיקול הזה בראש. אופטימיזציה של התנאים לעיכול אנזימים שואפת להגדיל את אחוז התאים הקיימא ביותר. גישות ניסיוני להסתמך על מספר גבוה יותר של תאים קיימא כגון ניתוחים microarray דורשים מיטוב חזקים יותר מאשר אלה ביצעו בהצלחה על פחות תאים כגון תיקון תא בודד-מלחציים אלקטרופיזיולוגיה או Ca2 + הדמיה. התחשבות בגורמים הנ ל הנחה את מאמצי המחקר שלנו בעשור האחרון בהשגת תאים בעלי איכות גבוהה בודדת DSM.
הטכניקה מחורר הטלאי הפטנט כבר הגישה האלקטרולוגית החשמלית במשך רבע מאה. מספר פרסומים מספקים פירוט של השיקולים הטכניים69,70,71,72,73. ניקוב תאים ניתן להשיג עם אמפוריטיצין-B, nystatin, מגרסידין, או β-escin (ראה הפניה32למבט כולל על כל אחד מהם). היתרון העיקרי של הקלטות מחורר הדבקה הצמד על פני גישות אלקטרופיזיולוגיות אחרות היא כי הסביבה תאיים הילידים-כולל Ca תאיים2 +ואיתות מולקולות (למשל, מחנה, PKA, פוספטים, ו זרחן)-נשמר. טכניקה זו, מכאן, מתאימה באופן אידיאלי לחקירת זרמים של ערוצי יונים שלמים ומנגנוני הרגולציה שלהם בתנאים פיזיולוגיים. האזהרה מפתח היא כי הרכב התא תאיים לא יכול להיות נשלט בדיוק בניגוד שיטות אלקטרופיזיולוגיות אחרות כגון רגיל-תא כולו ו-הערוץ יחיד-טלאי (בפנים ומחוץ לבית) הקלטות. בניסיון שלנו, שלושה גורמים לתרום באופן שגרתי התוצאות הנסיוניות מוצלחת של אמפוריטיצין-B-מחורר ניסויים מלחציים טלאי. הראשונה היא האיכות של תא ה-DSM שנבחרה לנסות הקלטה. כאשר תאי DSM הם מאוד קיימא הצגת למחצה הקונקטילה (דמוי סרפנטיין), מראה מבריק בחדות גבוהה עם הילה מוגדרת היטב סביב משטח התא ולהצמיד היטב לתחתית הזכוכית של חדר ההקלטה ולאחר מכן giga-חותם היווצרות תא ניקוב מתרחשים יחסית קל. הגורמים השני והשלישי להצלחה, בהתאמה, להתייחס לאיכות של מקור ומסיסות של אמפוריטיצין-B (בתוך diמתיל סולפוקסיד/DMSO ופתרון הצינורות התאיים). הבחנו בסתירות בין ספקים שונים במונחים של מקור ושונות הרבה יכולות. בכל יום אנו מכינים פתרון טרי של אמפוריטיצין-B פתרון מניות מאבקה ואחריו דילול התמיסה התאיים. שלבים אלה דורשים sonication נרחב ומורטקסנג. עם האמפוריטיצין-B המכיל פתרון פיפטה טרי, ניקוב תאים מוצלח (<50 MΩ) following giga-seal formation can be usually obtained within 30 min. The concentration of amphotericin-B in the pipette solution also requires optimization dependent on the amphotericin-B lot and source. Under our experimental conditions, the final amphotericin-B concentrations in the pipette range from 200 to 500 µg/mL. Since amphotericin-B exhibits light sensitivity, its solutions need to be kept in the dark. Using the amphotericin-B perforated patch-clamp technique, our group recorded voltage-step induced K mω)="" following="" giga-seal="" formation="" can="" be="" usually="" obtained="" within="" 30="" min.="" the="" concentration="" of="" amphotericin-b="" in="" the="" pipette="" solution="" also="" requires="" optimization="" dependent="" on="" the="" amphotericin-b="" lot="" and="" source.="" under="" our="" experimental="" conditions,="" the="" final="" amphotericin-b="" concentrations="" in="" the="" pipette="" range="" from="" 200="" to="" 500="" µg/ml.="" since="" amphotericin-b="" exhibits="" light="" sensitivity,="" its="" solutions="" need="" to="" be="" kept="" in="" the="" dark.="" using="" the="" amphotericin-b="" perforated="" patch-clamp="" technique,="" our="" group="" recorded="" voltage-step="" induced="">+, קליפורניה2 +, וזרמים לא סלקטיבית מתאי ה-DSM האנושיים, השפן, העכבר, ו/או העכברים17,21,22,23,29,30,31,35,60. כאן, אנו מתארים תנאים להקלטת זרמים לא סלקטיבית של הקטיון בתאי ה-DSM האנושיים. 9-פניל, חוסם של ערוצים TRPM4, זרמים מחליש בשלב המתח המושרה לתמוך בתפקיד של ערוצים אלה בשליטה של היכולת של ה-DSM. כהערה, זה בדרך כלל דורש לפחות 45 דקות לאחר קבלת החותם giga וחניכה של ניקוב כדי להקליט את המתח האופטימלי של הזרם הגבוה המושרה זרמים היון לא סלקטיבי. רמפות מתח יכול לשמש גם כחלופה לפרוטוקולים שלב מתח30,64. כאן, פרוטוקול של צעד מתח מן הפוטנציאל המחזיק מקוטב השפעה היה מועדף ולא פרוטוקול רמפה מאז הגישה לשעבר ממזער את ההשפעה של הפעלה תלויה מתח ומאפשר בממוצע של זרם מעורר על משך זמן של מתח-שלב שבו השיפוע מספק נקודת נתונים אחת לכל מתח. הנקודה האחרונה מתייחסת במיוחד לתאי ה-DSM האנושיים כאשר הזרמים מציגים פעילות משתנה במהלך צעדי מתח (איור 5ואיור 6). הטכניקה האמפוריטיצין-B מחורר לתיקון, הכרחית בזיהוי המאפיינים של תאי DSM וסוגי תאים אחרים, וימשיכו לספק מספר תגליות בעתיד. יתרה מזאת, ניתן להשתמש בהצלחה בתאים מבודדים של DSM בודד עבור מדידת תא שלם K+, קלרנית-, ו-Ca2 +זרמים עם המצב המקובל של טכניקת המדבקה, ההקלטה הפוטנציאלית עם המלחציים הנוכחיים, והקלטות ערוץ יחיד כפי שאנו מדגיבים את הדיווחים הקודמים שלנו23,29,35,64.
בנוסף לתיקון תאים בודדים-קלאמפ שיטות, תאים בודדים DSM מבודדים ניתן ללמוד עם גישות טכניות אחרות כולל Ca2 + הדמיה, RT-pcr/q-RT-PCR, אימונוציטוטוכימיה, בסמיכות באתרו בקירבה, וגישות גנומית (g., microarray, RNA-seq, שבב-seq)15,18,303433, כמו תא יחיד ההמרה שיטות ההגדרה להמשיך להתפתח ולהיות רגיש מאוד, אנו לדמיין את היכולת העתידית לקשר באופן שגרתי ובמיוחד הקישור תכונות החשמל או תרופתי של תאים DSM בודדים עם ההמרה שלהם פרופילים. זה יהיה מושגת על ידי ההקלטה הראשונה מתא DSM ולאחר מכן חילוץ mRNA או חלבון ואחריו הטרנססקריפט/פרוטאנדומית ניתוח. למרות ששיטות כאלה נבדקו כבר בתאים שאינם-DSM, הם נמצאים כרגע מאתגרת טכנית, חוסר רגישות להיחשב שגרתי, ומוגבל לגילוי מוצלח של כמה מוצרים גנים נבחרים74. פונקציה-ביטוי הפרופיל המולקולרי המקשר מחקרים כאשר נעשה על התאים DSM שהתקבלו שלפוחיות שתן שנגזר שליטה וחולים חולים-תורמים תספק תובנות לתהליכים פיזיולוגיים חיוניים לנהיגה פונקציות DSM רגיל, פתוגנזה, ובזיהוי גישות אפקטיביות הרומן הרפואי.
Disclosures
לא.
Acknowledgements
עבודה זו נתמכה על ידי NIH-R01DK106964 ו P20DK123971 מענקים לגאורגי V. פטקוב. המחברים מודים לד ר ויקטור יאררוצצקי ו גברת שרה מקסוול על הערכה קריטית של כתב היד. אנחנו גם אסירי תודה על מנתחים הצוות של אורולוגיה ב MUSC ו UTHSC: ד"ר תומס קין, הארי קלארק, סטיבן סאבאג ', רוס Rames, Sandip סאד, ג'ונתן פיקארד, כריסטופר Ledbetter יותר, אנתוני פטרסון, כמו גם התושבים MUSC ו UTHSC אורולוגיה: ד"ר. טיילור ווהן, סמואל ווקר Nickles, מתיו יאנג, ארין ברנס, ג'סטין אללט, ריאן לייני, אוסטין יאנגר, מארק קורי, נימה ברדראן, מקוי מק, טרייסי טיפטון, ברייס וויאט, אליסה גריימן, שרה Starosta, אהרון בלוך, כריסטין קאלדרך, לוסיל קוקס, כריסטיאן Dewan, ארין הטמן, בראדלי יוסטון, סטיבן לג, רוברט ס. ליבי, קול לוקליר, קריסטן מארלי, מוניקה או'נלון, פטריק פרובסט, סינתיה שרעדין, אליזבת Tourville, דניאל זפאטה עבור עזרתם עם אוסף רקמות האדם.
Materials
| Name | Company | Catalog Number | Comments |
| 5 ml polystyrene round-bottom tube | Falcon | 352054 | Tubes for DS containing enzymes used in digestion steps |
| 9-Phenanthrol | Sigma-Aldrich | 211281 | TRPM4 channel inhibitor |
| Amphotericin-B | Fisher | BP928-250 | Used for patch/cell perforation |
| Amphotericin-B | European Pharmacopoeia Reference Standards | 5 | Used for patch/cell perforation |
| Amphotericin-B | Sigma-Aldrich | A9528-100MG | Used for patch/cell perforation |
| Analog vortex mixer | VWR | 58816-121 | |
| Aspartic acid | Sigma-Aldrich | A9006 | Intracellular pipette solution |
| Bovine serum albumin | Sigma-Aldrich | A7906 | DS |
| CaCl2 | Sigma-Aldrich | C1016 | Extracellular solution and DS |
| Capillary Glass | Sutter | BF150-110-7.5 | Capillary for preparation of pulled patch electrodes |
| Cesium hydroxide hydrate | Sigma-Aldrich | C8518 | Intracellular pipette solution |
| Clampex ver. 10 software includes data acqusition (Clampex) and analysis (Clampfit) programs | Axon Instruments/ Molecular Devices | pCLAMP-10 | Commerical software and part of patch-clamp rig setup |
| Collagenase type 2 | Worthington Biochemical Corporation | LS004177 | DS-C |
| CsCl | Sigma-Aldrich | 203025 | Extracellular and intracellular solutions |
| Dental wax | Miltex Dental Wax Technologies, Inc. | 18058351 | |
| Digital Thermometer with Probe | Fisher Scientific | 15-077-32 | Placed in tissue bath to monitor temperature |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2650 | Solvent |
| DL-Dithiothreitol (DDT) | Sigma-Aldrich | D9779 | Reducing agents used together with Papain |
| EGTA | Sigma-Aldrich | E3889 | Ca2+ chelator, used in intracellular pipette solution |
| Flaming/Brown micropipette puller | Sutter | P-97 | Required to pull electrodes with very fine tips |
| Floating foam tube rack/holder | VWR Scientific | 82017-634 | Used for holding tubes with enzymes for temperature control |
| Glucose | Sigma | G8270 | |
| Glutamic acid (Na salt) | Sigma-Aldrich | G1626 | DS |
| HEPES | Sigma-Aldrich | H3375 | pH Buffer |
| KCl | Fisher Scientific | BP366-1 | Extracellular solution |
| Low Noise Data Acquisition System | Axon Instruments/ Molecular Devices | Digidata 1440A | Part of patch-clamp rig setup |
| Magnetic stirrer | VWR | 01-442-684 | |
| MgCl2 (hexahydrate) | Sigma-Aldrich | M2670 | Extracellular and intracellular solutions |
| MicroForge | Narishige | MF-830 | Used for fire-polishing electrodes |
| NaCl | Sigma-Aldrich | S7653 | Extracellular and intracellular solutions |
| NaOH | Sigma-Aldrich | S8045 | |
| Nifedipine | Sigma-Aldrich | N7634 | L-type voltage-gated Ca2+ channel blocker |
| Nikon inverted microscope, TS100 with T1-SM stage with 5x, 10x, 20x, and 40x objectives | Nikon | Discontinued | Part of Patch-clamp rig setup |
| Non-metalic syringe needle, MicroFil | WPI | MF-34G-5 | Filling of intracellular pipette solution |
| Papain | Worthington Biochemical Corporation | LS003126 | DS-P |
| Pasteur pipette | FisherBrand | 13-678-20A | Tips are broken off and fire-polished and used for titration of enzymatically treated tissues to release single DSM cells from pieces |
| Patch-clamp amplifier | Axon Instruments/ Molecular Devices | Axon Axopatch 200B | Part of patch-clamp rig setup |
| PC computer | DELL | Custom configuration | Part of patch-clamp rig setup |
| pH Meter | Aspera Instruments | PH700 | |
| Polyethylene tubing | Intramedic | 427-436 | Tubing for superfusion of extracellular bath connected to glass-bottom recording chamber |
| Tetraethylammonium chloride | Sigma-Aldrich | T2265 | Ion channel blocker of Kv and BK channels added to the extracellular bath solution |
| Thermo Scientific Precision shaking water bath (model 2870) | Thermo Scientific | Discontinued | Water bath for temperature control of enzymatic digestion employed as an alternative to tissue chamber-circulating bath setup |
| Tissue bath, 100 mL | Radnoti | 1583-101 | Connected to a circulating bath and filled with water, tubes with DS and DSM pieces are placed in the setup to control the temperature of digestion steps |
| Vinyl tubing | ColePalmer | 06405-3 | Multiple uses including for connecting tissue bath to circulating water bath |
| Water circulator bath, Haake D1 L | Haake | Discontinued | Connected to tissue bath |
| Weighting scale | Mettler Toledo | XS64 | |
| ZeissAxiovert 40C inverted microscope with 10x and 40x objectives | Carl-Zeiss | Discontinued | Part of patch-clamp rig setup |
References
- Andersson, K. E., Arner, A. Urinary bladder contraction and relaxation: physiology and pathophysiology. Physiological Reviews. 84 (3), 935-986 (2004).
- Brading, A. F., Brain, K. L., Andersson, K. E., Michel, M. C. Ion channel modulators and urinary tract function. Urinary Tract. 202, 375-393 (2011).
- Brading, A. F. Spontaneous activity of lower urinary tract smooth muscles: correlation between ion channels and tissue function. Journal of Physiology. 570, 13-22 (2006).
- Brading, A. F., Heaton, J. P., Hashitani, H. A survey of commonalities relevant to function and dysfunction in pelvic and sexual organs. International Journal of Impotence Research. 20 (1), 1-16 (2008).
- Petkov, G. V. Role of potassium ion channels in detrusor smooth muscle function and dysfunction. Nature Reviews Urology. 9 (1), 30-40 (2012).
- Andersson, K. E. Treatment-resistant detrusor overactivity--underlying pharmacology and potential mechanisms. International Journal of Clinical Practice Supplement. 151, 8-16 (2006).
- Sui, G. P., Wu, C., Fry, C. H. The electrophysiological properties of cultured and freshly isolated detrusor smooth muscle cells. Journal of Urology. 165 (2), 627-632 (2001).
- Kropp, B. P., et al. Characterization of cultured bladder smooth muscle cells: assessment of in vitro contractility. Journal of Urology. 162 (5), 1779-1784 (1999).
- Bonev, A., Isenberg, G. Arginine-vasopressin induces mode-2 gating in L-type Ca2+ channels (smooth muscle cells of the urinary bladder of the guinea-pig). Pflügers Archive - European Journal of Physiology. 420 (2), 219-222 (1992).
- Schneider, P., Hopp, H. H., Isenberg, G. Ca2+ influx through ATP-gated channels increments [Ca2+]i and inactivates ICa in myocytes from guinea-pig urinary bladder. Journal of Physiology. 440, 479-496 (1991).
- Wellner, M. C., Isenberg, G. Properties of stretch-activated channels in myocytes from the guinea-pig urinary bladder. Journal of Physiology. 466, 213-227 (1993).
- Wellner, M. C., Isenberg, G. Stretch-activated nonselective cation channels in urinary bladder myocytes: importance for pacemaker potentials and myogenic response. Experientia Supplementum. 66, 93-99 (1993).
- Klockner, U., Isenberg, G. Action potentials and net membrane currents of isolated smooth muscle cells (urinary bladder of the guinea-pig). Pflügers Archive - European Journal of Physiology. 405 (4), 329-339 (1985).
- Moore, E. D., et al. Organization of Ca2+ release units in excitable smooth muscle of the guinea-pig urinary bladder. Biophysical Journal. 87 (3), 1836-1847 (2004).
- Hristov, K. L., Chen, M., Kellett, W. F., Rovner, E. S., Petkov, G. V. Large conductance voltage- and Ca2+-activated K+ channels regulate human detrusor smooth muscle function. American Journal of Physiology - Cell Physiology. 301 (4), 903-912 (2011).
- Afeli, S. A., Rovner, E. S., Petkov, G. V. SK but not IK channels regulate human detrusor smooth muscle spontaneous and nerve-evoked contractions. American Journal of Physiology - Renal Physiology. 303 (4), 559-568 (2012).
- Hristov, K. L., et al. Kv2.1 and electrically silent Kv channel subunits control excitability and contractility of guinea pig detrusor smooth muscle. American Journal of Physiology - Cell Physiology. 302 (2), 360 (2012).
- Afeli, S. A., Malysz, J., Petkov, G. V. Molecular expression and pharmacological evidence for a functional role of Kv7 channel subtypes in Guinea pig urinary bladder smooth muscle. PLoS One. 8 (9), 75875 (2013).
- Smith, A. C., et al. TRPM4 channel: a new player in urinary bladder smooth muscle function in rats. American Journal of Physiology - Renal Physiology. 304 (7), 918-929 (2013).
- Smith, A. C., et al. Novel role for the transient potential receptor melastatin 4 channel in guinea pig detrusor smooth muscle physiology. American Journal of Physiology - Cell Physiology. 304 (5), 467 (2013).
- Hristov, K. L., Smith, A. C., Parajuli, S. P., Malysz, J., Petkov, G. V. Large-conductance voltage- and Ca2+-activated K+ channel regulation by protein kinase C in guinea pig urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 306 (5), 460-470 (2014).
- Hristov, K. L., et al. Novel regulatory mechanism in human urinary bladder: central role of transient receptor potential melastatin 4 channels in detrusor smooth muscle function. American Journal of Physiology - Cell Physiology. 310 (7), 600-611 (2016).
- Malysz, J., Afeli, S. A., Provence, A., Petkov, G. V. Ethanol-mediated relaxation of guinea pig urinary bladder smooth muscle: involvement of BK and L-type Ca2+ channels. American Journal of Physiology - Cell Physiology. 306 (1), 45-58 (2014).
- Montgomery, B. S., Fry, C. H. The action potential and net membrane currents in isolated human detrusor smooth muscle cells. Journal of Urology. 147 (1), 176-184 (1992).
- Parajuli, S. P., Soder, R. P., Hristov, K. L., Petkov, G. V. Pharmacological activation of small conductance calcium-activated potassium channels with naphtho[1,2-d]thiazol-2-ylamine decreases guinea pig detrusor smooth muscle excitability and contractility. Journal of Pharmacology and Experimental Therapeutics. 340 (1), 114-123 (2012).
- Heppner, T. J., Bonev, A. D., Nelson, M. T. Ca2+-activated K+ channels regulate action potential repolarization in urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 273 (1), 110-117 (1997).
- Petkov, G. V., Nelson, M. T. Differential regulation of Ca2+-activated K+ channels by beta-adrenoceptors in guinea pig urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 288 (6), 1255-1263 (2005).
- Herrera, G. M., Etherton, B., Nausch, B., Nelson, M. T. Negative feedback regulation of nerve-mediated contractions by KCa channels in mouse urinary bladder smooth muscle. American Journal of Physiology - Regulatory Integrative Comparative Physiology. 289 (2), 402-409 (2005).
- Malysz, J., Rovner, E. S., Petkov, G. V. Single-channel biophysical and pharmacological characterizations of native human large-conductance calcium-activated potassium channels in freshly isolated detrusor smooth muscle cells. Pflügers Archive - European Journal of Physiology. 465 (7), 965-975 (2013).
- Provence, A., Angoli, D., Petkov, G. V. Kv7 channel pharmacological activation by the novel activator ML213: role for heteromeric Kv7.4/Kv7.5 channels in guinea pig detrusor smooth muscle function. Journal of Pharmacology and Experimental Therapeutics. 364 (1), 131-144 (2018).
- Parajuli, S. P., et al. Control of urinary bladder smooth muscle excitability by the TRPM4 channel modulator 9-phenanthrol. Channels (Austin). 7 (6), 537-540 (2013).
- Ishibashi, H., Moorhouse, A. J., Nabekura, J., Okada, Y. Perforated whole-cell patch-clamp technique: a user's guide. Patch Clamp Techniques: From Beginning to Advanced Protocols. 4, 71-83 (2012).
- Provence, A., Rovner, E. S., Petkov, G. V. Regulation of transient receptor potential melastatin 4 channel by sarcoplasmic reticulum inositol trisphosphate receptors: Role in human detrusor smooth muscle function. Channels (Austin). 11 (5), 459-466 (2017).
- Hristov, K. L., et al. Suppression of human detrusor smooth muscle excitability and contractility via pharmacological activation of large conductance Ca2+-activated K+ channels. American Journal of Physiology - Cell Physiology. 302 (11), 1632-1641 (2012).
- Xin, W., Soder, R. P., Cheng, Q., Petkov, G. V. Inhibition of phosphodiesterases relaxes detrusor smooth muscle via activation of the large conductance voltage- and Ca2+-activated K+ channel. American Journal of Physiology - Cell Physiology. 302 (9), 1361-1370 (2012).
- Hristov, K. L., et al. Neurogenic detrusor overactivity is associated with decreased expression and function of the large conductance voltage- and Ca2+-activated K+ channels. PLoS One. 8 (7), 68052 (2013).
- Hristov, K. L., Parajuli, S. P., Provence, A., Rovner, E. S., Petkov, G. V. Nongenomic modulation of the large conductance voltage- and Ca2+-activated K+ channels by estrogen: A novel regulatory mechanism in human detrusor smooth muscle. Physiological Reports. 5 (14), (2017).
- Parajuli, S. P., et al. Functional link between muscarinic receptors and large-conductance Ca2+ -activated K+ channels in freshly isolated human detrusor smooth muscle cells. Pflügers Archiv - European Journal of Physiology. 467 (4), 665-675 (2015).
- Malysz, J., Rovner, E. S., Petkov, G. V. Single-channel biophysical and pharmacological characterizations of native human large-conductance calcium-activated potassium channels in freshly isolated detrusor smooth muscle cells. Pflügers Archiv - European Journal of Physiology. 465 (7), 965-975 (2013).
- Thorneloe, K. S., Nelson, M. T. Properties of a tonically active, sodium-permeable current in mouse urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 286 (6), 1246-1257 (2004).
- Barry, M. J., et al. The American Urological Association symptom index for benign prostatic hyperplasia. The Measurement Committee of the American Urological Association. Journal of Urology. 148 (5), 1549-1557 (1992).
- Klockner, U., Isenberg, G. Calcium currents of cesium loaded isolated smooth muscle cells (urinary bladder of the guinea pig). Pflügers Archiv - European Journal of Physiology. 405 (4), 340-348 (1985).
- Klockner, U., Isenberg, G. Tiapamil reduces the calcium inward current of isolated smooth muscle cells. Dependence on holding potential and pulse frequency. European Journal of Pharmacology. 127 (3), 165-171 (1986).
- Weidelt, T., Isenberg, G. Augmentation of SR Ca2+ release by rapamycin and FK506 causes K+-channel activation and membrane hyperpolarization in bladder smooth muscle. British Journal of Pharmacology. 129 (7), 1293-1300 (2000).
- Inoue, R., Brading, A. F. The properties of the ATP-induced depolarization and current in single cells isolated from the guinea-pig urinary bladder. British Journal of Pharmacology. 100 (3), 619-625 (1990).
- Inoue, R., Brading, A. F. Human, pig and guinea-pig bladder smooth muscle cells generate similar inward currents in response to purinoceptor activation. British Journal of Pharmacology. 103 (4), 1840-1841 (1991).
- Nakayama, S., Brading, A. F. Possible contribution of long open state to noninactivating Ca2+ current in detrusor cells. American Journal of Physiology - Cell Physiology. 269 (1), 48-54 (1995).
- Nakayama, S., Brading, A. F. Interaction of Ca2+ agonist and depolarization on Ca2+ channel current in guinea pig detrusor cells. Journal of General Physiology. 106 (6), 1211-1224 (1995).
- Gallegos, C. R., Fry, C. H. Alterations to the electrophysiology of isolated human detrusor smooth muscle cells in bladder disease. Journal of Urology. 151 (3), 754-758 (1994).
- JournalFry, C. H., Gallegos, C. R., Montgomery, B. S. The actions of extracellular H+ on the electrophysiological properties of isolated human detrusor smooth muscle cells. Journal of Physiology. 480, 71-80 (1994).
- Sui, G. P., Wu, C., Fry, C. H. A description of Ca2+ channels in human detrusor smooth muscle. BJU International Journal. 92 (4), 476 (2003).
- Wu, C., Sui, G., Fry, C. H. The role of the L-type Ca2+ channel in refilling functional intracellular Ca2+ stores in guinea-pig detrusor smooth muscle. Journal of Physiology. 538, 357-369 (2002).
- Bonev, A. D., Nelson, M. T. Muscarinic inhibition of ATP-sensitive K+ channels by protein kinase C in urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 265 (6), 1723-1728 (1993).
- Bonev, A. D., Nelson, M. T. ATP-sensitive potassium channels in smooth muscle cells from guinea pig urinary bladder. American Journal of Physiology - Cell Physiology. 264 (5), 1190-1200 (1993).
- Petkov, G. V., Heppner, T. J., Bonev, A. D., Herrera, G. M., Nelson, M. T. Low levels of KATP channel activation decrease excitability and contractility of urinary bladder. American Journal of Physiology - Regulatory Integrative Comparative Physiology. 280 (5), 1427-1433 (2001).
- Shieh, C. C., et al. Functional implication of spare ATP-sensitive K+ channels in bladder smooth muscle cells. Journal of Pharmacology and Experimental Therapeutics. 296 (3), 669-675 (2001).
- Shieh, C. C., et al. Characterization of a novel ATP-sensitive K+ channel opener, A-251179, on urinary bladder relaxation and cystometric parameters. British Journal of Pharmacology. 151 (4), 467-475 (2007).
- Petkov, G. V., et al. Beta1-subunit of the Ca2+-activated K+ channel regulates contractile activity of mouse urinary bladder smooth muscle. Journal of Physiology. 537, 443-452 (2001).
- Thorneloe, K. S., Nelson, M. T. Properties and molecular basis of the mouse urinary bladder voltage-gated K+ current. Journal of Physiology. 549, 65-74 (2003).
- Hristov, K. L., et al. Stimulation of beta3-adrenoceptors relaxes rat urinary bladder smooth muscle via activation of the large-conductance Ca2+-activated K+ channels. American Journal of Physiology - Cell Physiology. 295 (5), 1344-1353 (2008).
- Layne, J. J., Nausch, B., Olesen, S. P., Nelson, M. T. BK channel activation by NS11021 decreases excitability and contractility of urinary bladder smooth muscle. American Journal of Physiology - Regulatory Integrative Comparative Physiology. 298 (2), 378-384 (2010).
- Lee, H., Koh, B. H., Peri, L. E., Sanders, K. M., Koh, S. D. Functional expression of SK channels in murine detrusor PDGFRalpha+ cells. Journal of Physiology. 591 (2), 503-513 (2013).
- Lee, H., et al. Premature contractions of the bladder are suppressed by interactions between TRPV4 and SK3 channels in murine detrusor PDGFRalpha+ cells. Scientific Reports. 7 (1), 12245 (2017).
- Yarotskyy, V., Malysz, J., Petkov, G. V. Properties of single channel and whole-cell Cl- currents in guinea pig detrusor smooth muscle cells. American Journal of Physiology - Cell Physiology. 316 (5), 698-710 (2019).
- Driska, S. P., Porter, R. Isolation of smooth muscle cells from swine carotid artery by digestion with papain. American Journal of Physiology - Cell Physiology. 251 (3), 474-481 (1986).
- Seltzer, J. L., Welgus, H. G., Jeffrey, J. J., Eisen, A. Z. The function of Ca2+ in the action of mammalian collagenases. Archives of Biochemistry and Biophysics. 173 (1), 355-361 (1976).
- Skelton, G. S. Papaya proteinases. I. Temperature-and pH-stability curves. Enzymologia. 35 (5), 270-274 (1968).
- Petrova, D., Derekova, A., Vlahov, S. Purification and properties of individual collagenases from Streptomyces sp. strain 3B. Folia Microbiologica (Praha). 51 (2), 93-98 (2006).
- Sharpe, E. J., St Clair, J. R., Proenza, C. Methods for the isolation, culture, and functional characterization of sinoatrial node myocytes from adult mice. Journal of Visualized Experiments. (116), (2016).
- Brueggemann, L. I., Mani, B. K., Haick, J., Byron, K. L. Exploring arterial smooth muscle Kv7 potassium channel function using patch clamp electrophysiology and pressure myography. Journal of Visualized Experiments. (67), e4263 (2012).
- Jarriault, D., Grosmaitre, X. Perforated patch-clamp recording of mouse olfactory sensory neurons in intact neuroepithelium: functional analysis of neurons expressing an identified odorant receptor. Journal of Visualized Experiments. (101), e52652 (2015).
- Rae, J., Cooper, K., Gates, P., Watsky, M. Low access resistance perforated patch recordings using amphotericin B. Journal of Neuroscience Methods. 37 (1), 15-26 (1991).
- Knutson, K., et al. Whole cell electrophysiology of primary cultured murine enterochromaffin cells. Journal of Visualized Experiments. (139), (2018).
- Devienne, G., Le Gac, B., Piquet, J., Cauli, B. Single cell multiplex reverse transcription polymerase chain reaction after patch-clamp. Journal of Visualized Experiments. (136), (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved