Method Article
9-フェナントロル感受性カチオン電流の特性評価のための新たに分離されたヒトデトルサトール平滑筋細胞の調製と利用
要約
2段階の酵素手順を用いたヒト尿膀胱標本からの単一の単一の単離されたデトルザス平滑筋細胞の調製方法を記載する。得られた生存可能なDSM細胞は、生理学的および薬理学的特性を明らかにするために記載されたアンホテリシン-Bパッチクランプ電気生理学を含む様々な単一細胞技術によって研究することができる。
要約
尿膀胱壁内に存在するデトルサ平滑筋(DSM)細胞は、最終的に尿の貯蔵および消損を促進する。生存可能、新鮮な、および単離されたDSM細胞の調製は、その達成が後続の機能的および分子的研究に最適な細胞を提供する重要な技術的課題を提示する。本明細書で開発され、精巧な方法は、10年以上にわたって私たちのグループによって正常に使用され、開いた膀胱手術から得られたヒト膀胱標本の解剖と、DSM片の酵素的な2段階治療と、新たに分離されたDSM細胞を得るための機械的トリチュレーションについて説明しています。最初のステップは、DSM層(筋肉質プロプリアとも呼ばれる)を粘膜(ウロテリウム、ラミナプログリア、および筋粘膜)および隣接する結合組織、血管および脂肪組織から分離することを含む。DSMは、公称Ca2+含有解離/消化溶液(DS)で断片(2-3 mm x 4-6mm)に切断されます。DSM片は次に、ステップあたり30〜45分間〜37°Cでパパインおよびコラゲターゼを含むDSと別々に移され、連続して処理される。酵素フリーウシ血清を含むDSと、火で磨かれたピペットによるトリチュレーションを用いた後、単一のDSM細胞を放出する。新たに分離されたDSM細胞は、イオンチャネルの電気生理学的および薬理学的特性を示すパッチクランプに最適です。具体的には、TRPM4チャネルブロッカー9フェナントロルは、アンホテリシン-B穿球パッチクランプアプローチで記録された電圧ステップ誘発カチオン電流を減少させることを示す。DSM細胞は、単一細胞RT-PCR、マイクロアレイ分析、免疫細胞化学、その位置近接ライゲーションアッセイ、およびCa2+イメージングなどの他の技術によっても研究することができる。単一のDSM細胞を利用することの主な利点は、観察が明らかにされた単一細胞特性に直接関連していることである。新たに分離されたヒトDSM細胞の研究は、尿膀胱におけるカチオン透過性を含む様々なイオンチャネルの特性を特徴付ける重要な洞察を提供し、DSM細胞特性および調節機構を解明する上でゴールドスタンダードとして継続する。
概要
デトルサム筋肉(DSM)細胞は、尿膀胱内で最も豊富な細胞型を構成し、最終的には、それぞれ、弛緩および収縮を通じて尿貯蔵およびボイドを制御する。DSM細胞は、隣接する結合組織、神経プロセス、間質細胞、および他の細胞タイプ1と絡み合う平滑筋束を形成する。泌尿器膀胱機能におけるDSM細胞の役割の現在の理解は、マルチレベル統合アプローチを通じて達成された。各実験方法は、インビトロ内の単一細胞に基づくかどうか、インビトロ/ex vivoにおける平滑筋束を含む組織ストリップ、またはインビボ決定(サイトメトリーおよびボイド機能評価など)のいずれであっても、DSMの生理学的および薬理学的特性に関する重要かつ具体的な洞察を提供する(詳細についてはレビュー1、2、3、4、5を参照)。しかし、単一細胞から得られた結果の解釈は、結論が単一細胞型自体に具体的に帰属することを可能にする。この実現は、全厚の尿膀胱標本から単離したてのDSM細胞を得るための信頼性の高い再現性の高い方法を確立するための原動力となっています。他の多くの細胞タイプとは異なり、平滑筋細胞は、それらの電気生理学的および収縮特性の特定の変化を含むそれらの天然表現型の喪失のために確実に培養することができない7、8。この事実は、生理活性の新たに単離されたDSM細胞に対して行われる研究の重要性をさらに強化する。
1980年代後半から1990年代初頭にかけて、イゼンベルグのグループ(ドイツ)は、モルモット尿膀胱9、10、11、12、13(表1)から得られた新たに単離されたDSM細胞に関する一連の電気生理学的研究を発表した。この方法は、重要な細胞を得るのに役立ち、他の人が従うための最初のガイドラインとして役立つ2つの重要な観察を強調した。それらは、1)酵素処理前のCa2+フリー溶液/培地で単離されたDSM片を前処理し、2)コラゲナーゼを含む溶液で組織消化した。これら2つの重要なステップは、DSM細胞解離手順の全ての後続の変異体に組み込まれている(表1)。現在、当社グループは2段階の逐次パパイン・コラゲターゼ解離アプローチを採用しています。DSM片は、まずパパインを含む酵素溶液で処理され、次いでコラゲターゼII型を同じ溶液(DS、解剖/消化液)中で可溶化した溶液で処理される。このアプローチは、モルモット、ブタ、ラット、マウス、および重要なヒト(表1)を含む様々な種から単一のDSM細胞を生成する。
単一のDSM細胞は、複数の分子生物学および生理学的実験のためのソースを提供する。これまで、免疫細胞化学で研究されたタンパク質およびmRNAの表現、 RT-PCR/qRT-PCRの判定により、大導電電圧とCa 2+活性化(BK)、小コンダクタンスCa2+アクティベートK+タイプ3(SK3)、電圧ゲート付きK +(Kv)、L型電圧ゲート付きCa+(Ca v)、および過渡型受容体電位メラスタチンタイプ4(T4)を含む様々なイオンチャネルに対する高レベルの検出が明らかになった。14,15,16,17,18,19,20,21,22.これらはすべてDSM興奮性、細胞内Ca2+レベルおよび収縮性を制御すると考えられている。Patch-clamp electrophysiological approaches, performed directly on guinea pig, mouse, rat, or human DSM cells, provided direct demonstration of biophysical and pharmacological properties of L-type Cav, Kv (Kv2.x. Kv7), SK, BK, and TRPM4 channels17,19,20,21,22,23,24,25 、26, 27,28,29,30,31.このアプローチには、従来の全セル電圧クランプ、穿水電圧クランプ、およびシングルチャンネル記録(セル接続、内部および外部構成)が含まれていました。さらに、電流クランプを用いたDSMの膜電位記録は、標的に係合する薬理学的薬剤が細胞興奮性を変化させるという証拠を提供した。例えば、TRPM4阻害剤9−フェナントロルは、ヒトから得られたDSM細胞において過分極化を誘導し、モルモット、およびラット尿膀胱19、20、22、31を挙げることができる。様々な電気生理学的方法の中で、アンホテリシン-B(およびナイスタチン、グラミシジン、β-エスキン)穿引パッチクランプ記録は、本質的な細胞内シグナル伝達分子および経路を維持することによって重要な利点を提供する。低分子量カチオンとより少ない程度に、Cl-しかし、Ca2+を含むタンパク質またはシグナル伝達分子ではない - アンホテリシンBまたはナイスタチン32によって形成された形質膜孔を通して透過性である。穿くりパッチクランプ実験の成功の結果は、この手法に特有のいくつかの一般的な変数に依存する。ここでは、我々のグループが15年、22年、33年、34年、35年、36、37、38、39年間にうまく使用したアンホテリシンBを利用した手順の詳細について説明します。
間違いなく、非選択的なカチオンチャネルは、DSM細胞の中で最も理解されていないチャネルタイプの1つです。非選択的なカチオンのようなチャネルの最初のレポートは1993年にさかのぼります。ウェルナーとイゼンバーグ11の論文は、イオン透過性のランク順序を表示する33 pSストレッチ活性化シングルチャンネルについて説明しました:K+>Na+>Cs+>Ba 2+ >Ca2+、 非選択的なカチオンチャネルの一般的な阻害剤である Gd3+によるチャネル活性の阻害。ほぼ10年後、ThorneloeとNelson40は、全細胞記録を用いて、マウスDSM細胞におけるNa+透過性カチオン電流をGd3+によって阻害したと説明した。非選択的カチオンチャネルの分子的アイデンティティとその生物物理学的特徴付けは依然として決定されていないので、この研究分野における将来の調査が保証される。本明細書で説明する非選択的カチオンチャネル電流の記録に関するプロトコルは、Cs+、TEA+、及びニフェジピン(表2)を用いて、生理学的および薬理学的にKvおよびCav電流を緩和する−非選択的カチオンチャネルの電気生理学的調査において有用であり続けるであろう。我々は、モルモットにおけるTRPM4チャネルブロッカー9-フェナントロルによる全細胞カチオン電流の阻害の程度を決定するためにこの特定のプロトコルを利用した、ラットおよびヒトDSM細胞19、20、22。
ここでは、ヒト尿膀胱から単離された単一DSM細胞を得るための方法は、パッチクランプ技術、Ca2+イメージング、免疫細胞化学、その場近位訴訟アッセイ、および単一細胞RT-PCR/qRT PCR-および単細胞RT-PCR/qRT PCR-および単細胞RT-PCR/qRT PCR-およびチップチップを含む高度な分子生物学的技術の様々な構成を使用した電気生理学的調査に非常に適した生存細胞を提供する。アンホテリシン-B穿引パッチクランプ法を使用すると、他の構成とは異なり、ネイティブセル環境が維持されます。ここで概説する特定の条件を使用して行われると、DSM細胞におけるK+およびCa2+電流の寄与を否定するように設計され、電圧ステップ誘導電流は、生物物理学的および薬理学的特性評価に適した非選択的カチオン電流の特性を示す。
プロトコル
ここに記載されているすべての方法は、テネシー大学健康科学センター(メンフィス、TN、IRB#17-05714-XP)、サウスカロライナ医科大学(チャールストン、SC、IRB#00045232)の機関審査委員会によって承認されています。承認された手順は、粘膜、排尿筋平滑筋、ソローサを含むすべての層を含む全厚尿膀胱標本(>1 cm)を、膀胱の外科的部分的抽出を受けている患者ドナーから採取することを可能にする。患者ドナーは成人(現在まで研究された年齢範囲:25〜87歳)、男性または女性のいずれか、過活動膀胱の症状の有無(米国泌尿器科学会I-PSSスコア41によって分類される)。外科的処置は、尿路上皮癌に対する根治性膀胱切除術、腺癌を含む様々な病状を伴う。このような場合、採取した尿膀胱標本は腫瘍の部位から離れたものである。
1. DSM組織の解剖と粘膜フリーDSM片の調製
- 冷間解離・消化液で満たされた密閉容器で手術室から実験室に到着した全厚の尿膀胱標本を調べる(図1および表2DSの組成)。
注:試験片は、通常、数時間から一晩の間、冷たいDSで保管されています。より長いストレージの場合、DS (表 2) は 1 mM CaCl2で補足されます。 - 人間の厚みDSM試料(粘膜、DSM、ソローサを含むすべての層を含む)を氷冷DSで除去し、洗浄し、付着した破片および血液を洗い流します。
- 尿中膀胱標本をピン留めし、上向きの粘膜とソローサを下に、シリコーンエヌンテオマーコーティング(材料表)150mm直径150mmの丸皿に氷冷DSを充填した(図1B)。
- マイクロシザーと鉗子を用いた鋭い解剖により、隣接する脂肪組織、血管、上皮(ウロテリウム)および筋粘膜を試料から取り除きます。
- 粘膜フリーのDSMピース(長さ約2~3mm、幅4~6mm)を切り取ります(図1C)。
2. 単離した単一のDSM細胞を生み出すDSM片の酵素解離
- 3~6個のDSM片を、パパインとジチオトライトルを含む1~2mLのDS(DS-P、表2)を含むチューブに入れ、DS-P中のDSM片を30〜45分間インキュベートし、〜37°Cで30〜45分間チューブを穏やかに振ります(時には10〜15分ごとに1回)。
注:酵素処理の温度を最適に制御するために、組織片と酵素液を含むチューブを、循環加熱水浴(図1D)または高精度の温度制御振潮浴(図1E)に接続された水で満たされたガラス組織室に置きます( - チューブからDS-Pを取り出し、氷冷DSでDSM片を短時間洗浄し、チューブの底に座っているDSM片を残して、冷たいDSをチューブから廃棄します。
- DS含有コラゲアーゼII(DS-C、表2)をDSM片でチューブに1~2mL加え、軽く混ぜます。~37°Cで25~40分間、時折チューブを軽く振ります(10~15分おき)。
- DS-Cを捨て、酵素処理されたDSM片を氷冷DSで5〜10回洗浄する。
- 最後の洗浄に続いて、チューブの中にDS溶液を残します。火で磨かれたパスツールピペットで軽くトチュレートし、単一のDSM細胞を放出します。
- DSM細胞を含むDS溶液をガラス底のチャンバーまたはカバースリップに数滴置き、少なくとも5分後に顕微鏡で品質を視覚的に検査し(20xまたは40xの目的を使用)、細胞が付着できるようにアプリケーションに従って底部。
- すぐに電気生理学的実験のために新たに単離されたDSM細胞を使用するか、または使用するまで氷上または冷蔵庫でDSを含むチューブに細胞を保存します(通常は8時間までの調製)。
注: 同じ調製物の中で、細胞の品質は、非常に生存可能なDSM細胞から、過剰に消化されたDSM細胞までさまざまです(図2)。連続的なパパイン・コラゲターゼ法が非常に多くの生存不可能な細胞を生み出す場合、調製物は廃棄され、DSM片の新しい消化が行われるが、潜伏間隔は減少する。手順がDSM個の後続の消化のためにあまりにも少ないDSM細胞をもたらす場合、インキュベーション間隔が増加する。α平滑筋アクチンに対する陽性免疫反応性は、DSM細胞の同一性を確認する(図3)。
3. アンホテリシン-B穿球全セル電圧パッチクランプ技術を用いてDSM細胞からの電圧ステップ誘導カチオン電流を記録する
- 反転顕微鏡のステージに座っているガラス底のチャンバーに細胞懸濁液0.25-1 mLの細胞懸濁液を、細胞がガラス底に付着することを可能にする。
- 少なくとも45分間インキュベートした後、浴からDSを取り出し、入口管減速を介して重力によって助けられた溶液流が新しい溶液にDSを置き換え、真空廃棄物容器に接続された出口チューブがチャンバー溶液を除去し、オーバーフローを防ぐスーパーフュージョンによってE溶液(表2)に置き換えます。なお、E溶液には、テトラエチランモニウム(TEA+)およびセシウム(Cs+)イオンが含まれ、K+電流を阻害する。
- ジメチルスルホキシド(DMSO)中のアンホテリシン-Bの働くストック溶液を調製する(DMSOの10μLあたり1mg)。アンホテリシン粉末を完全に溶解するには、超音波処理(少なくとも15分)と溶液をよくボルテックス。
注:このステップは通常10分未満かかります。1.5 mLマイクロ遠心管でのDSMOの30-40 μLで3〜4mgのアンホテリシンBを溶解します。より多量のアンホテリシン-Bは、通常、より多くのDSMO溶媒を必要とし、チューブ内に存在するアンホテリシン-B固体粒子の混合および不完全な可溶化のためのより長い間隔をもたらす。 - アンホテリシン-Bのストック溶液をピペット溶液中に溶解し(溶液P、表2)、最終濃度200~500μg/mLを得た。このステップでは、ピペット溶液中のアンホテリシン-B沈殿物形成の最適な混合と予防を確実にするために、ステップあたり30〜60分間の高速設定(8-10/10)での広範な超音波処理と渦を必要とします。
注:アンホテリシン-Bは、時間の経過とともに沈殿し、光感受性です。アンホテリシンBを含む働くピペット溶液は、溶解性をチェックし、ピペット充填前に手混合し、暗闇の中に保ちます。 - 複数のパッチ電極、火磨き電極チップを引っ張り、必要に応じて先端を歯科用ワックスでコーティングします。
- パッチ電極の先端をピペット溶液(溶液P、表2)でアンホテリシン-Bを使用せずに、溶液中に電極を短時間浸漬して充填します。
- アンホテリシンBを含む同じピペット溶液で電極をバックフィルします。
- パッチクランプアンプヘッドステージに接続されたホルダーに電極を取り付けます。
- マイクロマニピュレーターを使用して、電極の先端が水没するように細胞外溶液の表面のすぐ下に電極を置きます。
- 電圧クランプモードでは、保持電位を0 mVに設定し、商用アンプのピペットオフセットダイヤル(材料表)で電流を0 pAに調整します。
- 商業用取得ソフトウェア(材料表)の膜試験ウィンドウ/機能を使用して電極抵抗を決定します。アクティブにするには、[ツール] → [メンブレン テスト] →[再生] をクリックするか、ソフトウェアのショートカット アイコンをクリックします。決定された電極抵抗は、2~5MΩの範囲にする必要があります。
注:市販の集録ソフトウェアまたはアンプのシールテストオプションで提供される膜テスト機能は、電圧ステップを繰り返し適用することによって、電極抵抗を監視するために使用することができます。 - マイクロマニピュレータを使用して選択したDSMセルに向かって電極を進めながら電極抵抗の監視を続けます(図4A)。
注:実行可能なDSM細胞と見なされるためには、細胞はスピンドル状の細長い形態、細胞の周りの明確なハロー、鮮明なエッジ、半収縮(蛇行)の外観を示す必要があります。 - 電極で細胞表面に触れるとき - 膜試験機能で測定された電極抵抗の急速な増加によって示される - チューブを介して電極ホルダーに穏やかな急速な負圧を加えることによってギガシールを形成する。この結果、電極の先端に生じる負圧が生じ、電極膜を電極に引き込み、ギガシールの形成や電極と形質膜との間の非常に密着性を助ける(図4B)。
- ギガシールが形成されたら、商用アンプの高速かつ低速のダイヤルを調整してピペット容量を補正し、膜テスト機能を使用してギガシールの安定性(リーク電流)を監視します。
- 時間を許可する,典型的には30〜60分,アンホテリシン-Bがピペットを拡散させ,1価のカチオンに対して主に選択的に細孔を形成する細孔に挿入する。このステップでは、膜試験機能を使用してギガシールのモニタリングを続けます。細胞穿球が増加するにつれて、静電容量のトランジェントの振幅(図4Bと図4Cを比較して、それぞれ非効果的な細胞穿調を表示する)を膜試験関数で測定する。
- パッチ穿水が最適な場合(通常は50MΩ未満の安定したシリーズ抵抗によって判断される)、アンプのセル容量とシリーズ抵抗のダイヤルを調整して静電容量トランジェントを取り消します。このとき、シリーズ抵抗補償も行うことができる(図4D)。
- 指定されたプロトコルによって誘発される安定した電圧ステップ誘導型カチオン電流が観測されたら、スーパーフュージョンによってテストする化合物または生理学的状態を適用し、制御、試験条件、および(可能であれば)洗浄応答を記録する商用取得ソフトウェア。
- DSMセルを-64または-74 mVに保持し、電圧を400または500 msの-94~+96または+106 mVに10 mV単位で踏み込んで保持電位に戻すことを含む、定期的な電圧ステッププロトコルで電流を記録します。
注:膜電位値は、14 mVの液体接合電位に合わせて調整されます(PおよびE溶液を使用して、表2)。液体接合電位は、商業用集録ソフトウェア([材料の表]) で 、[ツール]→ [ジャンクション電位] をクリックし、溶液イオン成分の濃度を入力することによって得られます。ランプ プロトコルは、現在の記録を取得するためにも使用できます。 - 加算前制御、試験条件、および洗浄のための記録電流を記録する実験中に、連続〜1分間隔で電圧プロトコルを実行します。
- DSMセルを-64または-74 mVに保持し、電圧を400または500 msの-94~+96または+106 mVに10 mV単位で踏み込んで保持電位に戻すことを含む、定期的な電圧ステッププロトコルで電流を記録します。
4. データ分析と可視化
- [ファイル]>[開く] をクリックして、開くファイルを選択して、コントロール、テスト条件、およびウォッシュアウト用の商用データ分析ソフトウェア([マテリアルの表]) で、記録されたファイルを開きます。
注: 分析の場合、通常は、条件ごとに 3 つのファイル (1 つのプロトコル実行に対する 1 つのトレースセットを含む) が開かれ、分析されます。応答は、その後、各条件の平均応答を得るために平均化されます。データ取得に使用されるソフトウェアには、ユーザーが指定した複数のテスト実行を自動的に収集し、代替として使用できる単一の出力ファイルの平均化オプションが含まれています。 - 各電圧で測定された電流トレースの最後の200ミリ秒にわたる平均応答を取得します。選択された期間間隔は、定常レベルの電圧ステップ電流活性化を反映します。これを行うには、次の手順に従います。
- 商業用解析ソフトウェア (資料表) で分析対象のファイルを選択します。
注: ソフトウェアは、最後にインポートしたファイルをアクティブな表示ウィンドウに配置します。オープン・ファイルには、電圧ステップ・プロトコルで得られた一連の重複トレースが表示されます。デフォルトでは、アクティブウィンドウ内に4つのカーソル(ハイライトされたトレースのx値とy値を表示)が表示されます。 - 分析範囲が200 msになるように、400または500 msの電圧ステップの終わりにカーソル2を配置し、その前の200 msの間隔でカーソル1を配置することによって、分析のための範囲を選択します。
- [分析]>[クイックグラフ]>[IV]ショートカットアイコンをクリックして、各電圧の応答を取得します(データを生成する前のプロンプトウィンドウで、Y軸(現在の)信号領域オプション「Cursors 1.2」と「平均」が選択されていることを確認します。[OK] をクリックしてI-V グラフを生成し、そのデータを [結果] 列シートに配置します。
- 手順 4.2.1 から 4.2.3 を繰り返して、追加のファイルを分析します。[分析]→[クイックグラフ]>[IV]またはIV アイコンのショートカットをクリックし、[置換]ではなく[追加]を選択して、トレースの処理中に[結果]シートに追加データを追加します。
- データをスプレッドシートにコピーするには、目的の列を選択し、Ctrl キーを押しながら Cキーを押してコピーし、Ctrl キーを押しながら Vキーを押して貼り付けます。[ファイル] → [名前を付けて保存] をクリックして、結果ワークシートを商用分析ソフトウェア ([材料のテーブル] ) の (*.rlt) 形式で保存します。
- 商業用解析ソフトウェア (資料表) で分析対象のファイルを選択します。
- 各セルについて、3 つの条件すべてについて、事前加算制御の最大電圧ステップの値に対する応答を正規化し (式:応答/応答制御-最大)、応答を電流(または電流密度)値と電圧関係の比較としてグラフ化します(図 6)。
- ワークシートプロセッサで、電流(pA)または電流密度(pA/pF)のいずれかとして平均応答を決定し、制御、試験条件(この例では9フェナントロル)、および各電圧ステップでのウォッシュアウトを行います。
- 各条件の電圧(制御、9-フェナントロル、およびウォッシュアウト)の値を、式に続く事前加算制御の最高電圧(図6の+96 mV)で得られる最大制御応答で除算します。
- 概要分析では、視覚化用のグラフィカル プログラム (GraphPad Prism など) に簡単にコピーできる形式でデータを配置します。
結果
DSM片の酵素解離は、機能および分子研究で日常的に使用される健康で単離されたDSM細胞を提供します:パッチクランプ電気生理学および免疫細胞化学。図1は、解剖工程を要約し、酵素処理ステップの温度制御に用いるセットアップを可視化する。図2は、それぞれ異なる患者ドナーから3つのヒト尿膀胱標本から得られたDSM細胞の明視野画像を示す。健康な単一DSM細胞は、スピンドル型の形態、鮮明な明確なエッジ、細胞の周りの明確なハロー、および顕微鏡下で見たときの半収縮性(蛇のような)外観によって特徴付けられる(図2の白い矢印で示されたDSM細胞を参照)。それらはまた、ムスカリン作動薬カルバコールまたは高K +(60mM)アプリケーションなどの収縮刺激剤に応答する。DSM細胞は、α平滑筋アクチンに対して陽性免疫反応性を示し、それらの同一性を確認する(図3)。
DSMセルは、イオンチャネル特性のパッチクランプ電気生理学的調査に最適です。ここでは、ピペットと細胞外溶液を用いたアンホテリシン-B穿引パッチクランプ記録法(表2)を説明し、電圧ステップ誘導カチオンチャネルを最適に記録する。採用された特定の条件下では、Cs+/TEA+およびニフェジピンを用いたKvおよびL型Ca2+電流の遮断は、これらのイオン成分が全細胞電圧誘発電流に寄与することを確実にした。図4と図5はそれぞれ、アンホテリシン-B穿出パッチクランプ法および代表的な全細胞電流の実験ステップを、3つの異なるヒトDSM細胞においてそれぞれ異なるヒトDSM細胞において誘導またはランププロトコルで測定し、それぞれ異なる患者ドナーから測定した。記録は、現在の振幅と外向きの整流の点で一定の変動性を表示します。その他の実験では、TRPM4チャネル阻害剤である9-フェナントロルが、負および正の電圧でヒトDSM陽開電流を効果的かつ可逆的に阻害することを明らかにした(図6)。9フェナントロル感受性電流成分は、正の電圧および外向きの整流におけるより強い阻害を示している(図6C)。
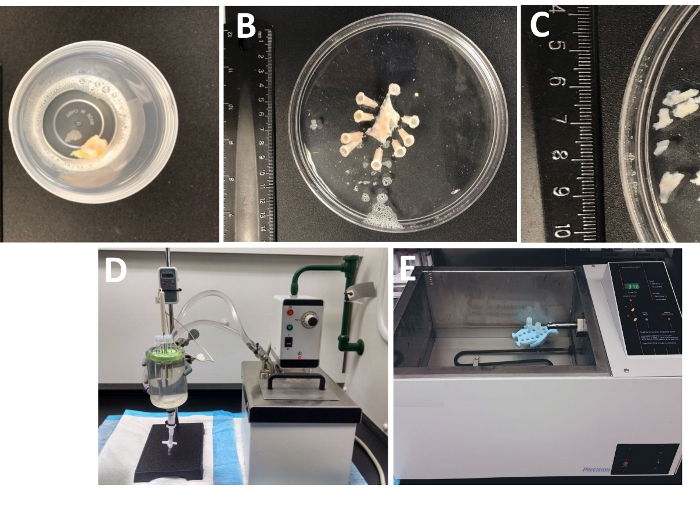
図1:酵素解離に用いるデトルササ平滑筋(DSM)ピース及びセットアップの調製に起因する解剖ステップの要約。(A)開いた膀胱手術から提供された全厚の人間の尿膀胱標本を氷冷DSの無関係な外科材料として示した画像、 (B) 部分的に解剖されたDSM層で固定した後の同じ調製物、(C)DSM層から切り出された可変寸法のDSM片は、酵素消化(より小さい部分)または他の実験的調査(より大きな部分)、(D、E)DSM片の酵素消化に使用される代替セットアップからなるDSM断片(1)水で満たされた大きなガラス組織室にチューブを介して接続された温度制御循環水浴のいずれか、 チューブ用のゴムホルダー、DSMピースを含むプラスチックチューブ、解剖/消化溶液(DS、DS-PまたはDS-C、表2)、およびDSMピースと溶液を含むホルダーとチューブを含む大きな水充填温度制御浴を可能にするディスプレイにリンクされた温度プローブ().この図の大きなバージョンを表示するには、ここをクリックしてください。
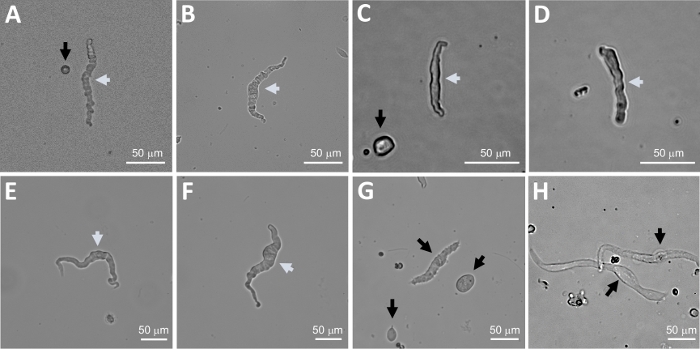
図2:逐次パパイン・コラゲターゼ消化法を用いて得られたヒトの新たに単離されたDSM細胞の代表的な明視野画像。(A-F)表示されるのは、穿引パッチクランプ記録を試みるための適切な候補と考えられる生存可能で生理的に活性なDSM細胞の画像である。(G, H)生存不可能または過剰に消化された細胞の画像;そのような細胞は、パッチクランプ実験のために避けられた。パネルの白矢印と黒矢印(A-H)は、パッチクランプ記録を試みるために、それぞれ実行可能と生存不可能と見なされる DSM セルを指します。パネル(A、C、および G)の黒い矢印は、セル断片 (円形部分) または DSM の形態を欠く小さなセルを指し、(H)ではセルが薄く広がって表示されることに注意してください。画像は、3つの異なる尿膀胱標本(AおよびB:患者ドナー源1、CおよびD:患者ドナー源2、およびE-H:患者ドナー源3)からである。この図の大きなバージョンを表示するには、ここをクリックしてください。
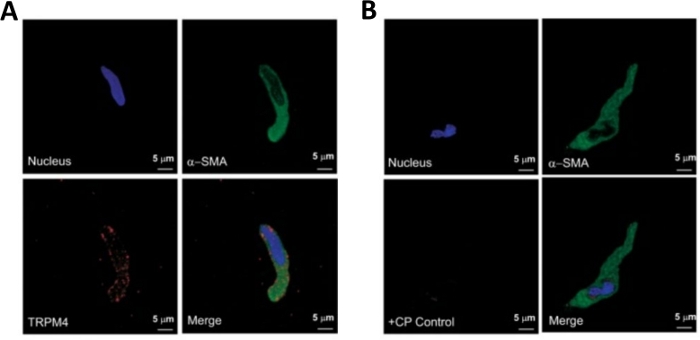
図3:免疫細胞化学分析による単一ヒトDSM細胞における過渡的受容体電位メラスタチン4型(TRPM4)チャネルおよびα平滑筋特異的アクチン免疫活性の表現。(A) ヒトDSM細胞におけるTRPM4チャネルタンパク質発現の免疫細胞化学的検出を示す共焦点画像を示す図である。赤い染色(左下)はTRPM4チャネルタンパク質を示す。青(DAPI)染色は細胞核(左上)を検出する。緑の染色は、α平滑筋アクチン(α-SMA、右上)を示す。マージされたイメージ(右下)は、3 つのイメージの重なりを示しています。(B)単離されたヒトDSM細胞におけるTRPM4特異的競合ペプチド(CP)の存在下におけるTRPM4チャネルタンパク質発現の免疫細胞化学的検出の減衰を示す共焦点画像。青(DAPI)染色は細胞核(左上)を示す。緑の染色は、α平滑筋アクチン(α-SMA、右上)のためのものです。マージされたイメージ(右下)は、3 つのイメージの重なりを示しています。結果は、4人の患者から単離されたDSM全体組織または複数のDSM細胞を用いた4つの別々の実験で検証された。画像はHristovら(2016)22からであり、許可を得て使用されます。この図の大きなバージョンを表示するには、ここをクリックしてください。
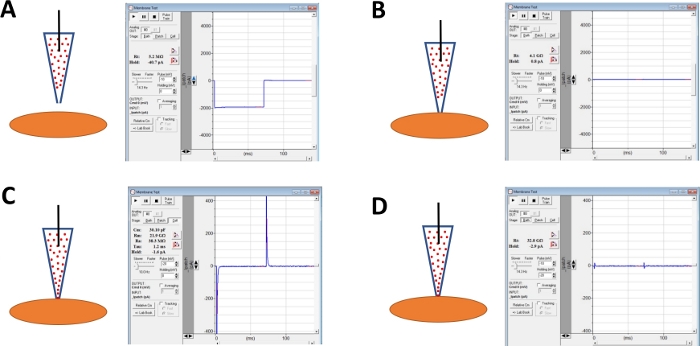
図4:ヒトDSM細胞のギガシール形成およびアンホテリシン-B穿調に関与するステップの概略図。図示は、ピペットとDSM細胞を含むアンホテリシンBの空間位置と、電圧ステップ(この例では-10または-20mVのいずれか)を変化させることによって商業集録ソフトウェアで得られた膜試験に関連する応答(この例では-10または-20mV)抵抗を決定する。構成は、電極を用いたセルアプローチの前に:(A)、(B)ピペットを含むアンホテリシンB(赤い点で表されるアンホテリシンB)を細胞表面に位置付け、負圧を加えて得たギガシール形成後に得られた(C)ギガシール形成後に約45分、この時点でアンポテリシンBがピペットとその分子を拡散させた透過性の細孔、および(D)と同じ構成(C)が、キャパシタンストランジェントは、アンプ上の全セル容量とシリーズ抵抗のためのダイヤルを使用して取り消されました。この図の大きなバージョンを表示するには、ここをクリックしてください。
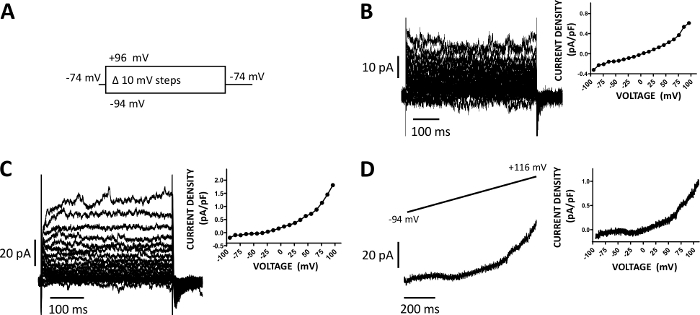
図5:ヒトDSM細胞におけるアンホテリシン-B穿水パッチクランプ法で記録された全細胞カチオン電流。(A) 電圧ステッププロトコルの図は、-74 mVの保持電位と、-94~+96 mVの400 ms持続時間の電圧ステップを10 mV単位で行い、その後-74 mVに戻した様子を示しています。(B, C)代表的な電流トレースは、2つの異なるヒトDSM細胞からの電流密度電圧プロットと共に、それぞれ(A)に記載された電圧ステッププロトコルで得られた異なる尿膀胱検体/患者ドナーから得られる。(D) ランププロトコルで得られた電流トレースの例(0.21 mV/msで1秒の間に-94から+116 mVまでの電圧変化として、上部インセットでグラフィカルに表され、保持電位は-94 mVであった)。右側のパネル(B-D)では、記録された各 DSM セルの電流密度と電圧の関係がグラフに表示されます。この図の大きなバージョンを表示するには、ここをクリックしてください。
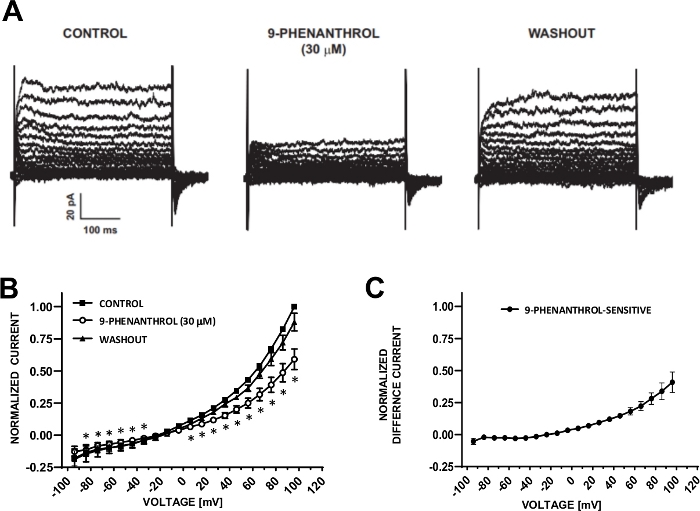
図6:TRPM4チャネルブロッカー9-フェナントロル媒介性電圧ステップ誘導カチオン電流のヒトDSM細胞の阻害。(A) 図5A制御用電圧ステッププロトコル、9-フェナントロル、およびウォッシュアウトで測定された代表的な電流です。(B) 7つのDSM細胞(7つの異なる患者ドナーから)における、制御、9-フェナントロル、およびウォッシュアウトのための正規化応答対電圧の要約。(C)9フェナントロル感受性成分に対する差電流は、9-フェナントロル(30μM)の存在下で、Bに示す対照の値から差し引いた。(B) および (C) のデータは、SEM のエラー バーの手段として表示されます * 各電圧でコントロールと 9 フェナントロルの比較の重要性 (p<0.05,ペアの学生のテスト) を表します。パネル(A)および (B) は、Hristov ら (2016)22から複製され、許可を得て使用されています。この図の大きなバージョンを表示するには、ここをクリックしてください。
| 種 | 手順の詳細 | 参照 | |
| モルモット | DSM片をCa2+フリー培地(mM:100 NaCl、10KCl、1.2 KH2PO4、5MgCl2、20グルコース、50タウリン、pCa=6(または1mM)に測定し、典型的には90〜120分(30分の4周期)で処理した 20タウリン、5ピルビン酸、5クレアチン、10 mM HEPES、pH 7.4、1mg/mlコラゲナーゼ、0.2mg/mlプロナーゼ、1mg/ml脂肪酸フリーアルブミン、pCa=4.2(63mM)または3.7(200mM)に調整した。シングルDSM細胞をクラフト・ブルーエ(KB)培地に保存した(mM:85 KCl、30K2PO4、5MgSO4、5Na2ATP、5 K-ピルビン酸、5クレアチン、20タウリン、5 β-OH-ブチレート、1mg/ml脂肪酸フリーアルブミン、KOHをpH7.2に調整)。 代替法:Ca2+フリー培地(mM)で10分間すすするDSM片:140 NaCl、5 KCl、1.2MgCl2、10グルコース、20タウリン、5 HEPES、NaOHをpH 7.4に調整した。次いで、DSM個を、5mg%コラゲナーゼ、2mg%プロナーゼ、100μMCaCl2で相補した同じCa2+遊離培地で2x20分間攪拌する。 | クロックナー&イゼンバーグ (1985)13,34クロックナー & イゼンバーグ (1986)35シュナイダーら (1991)10ボネフ&イゼンバーグ (1992)9ヴァイデルト&イゼンバーグ (2000)36ムーアら (2004)14 | |
| モルモット、ランドレースブタ、人間 | Ca2+フリークレブス溶液で5分間プレインキュベートされたDSM片は、Ca 2+フリークレブーゼタイプIと0.1-0.5mg/mlプロナーゼを含むCa2+フリークレブ溶液で酵素的に消化し、36°Cで30〜30分のプロナーゼを常に攪拌します。いくつかのケースでは、消化された部分は、鈍い先端のピペットによって、または細胞を生み出すまで回転することによってさらに攪拌された。単離された細胞は、修飾されたクレブス溶液(Klockner及びIsenberg13に記載)に保存され、通常3時間以内に使用された。クレブス溶液の組成は(mM):140 Na+、6K+、2Ca 2+、1.2Mg2+、152.4 Cl-、10グルコース、10 HEPES、pH 7.35-7.4トリスを有する。Ca2+フリー溶液の場合、Krebs溶液からCa2+およびMg2+を省略した。 | 井上とブラッド (1990)37井上とブラッド (1991)38中山&ブラッド (1995)39,40 | |
| 人間 | DSMの部分はCa2+フリーHEPES Tyrodeのソリューションに置かれる(mMで:105.4 NaCl、 20.0または22.3 NaHCO 3、3.6 KCl、0.9 MgCl2、0.4NaH2PO4、19.5または4.9 HEPES、5.4または5.5グルコース、4.5または5.5 Na-ピルビン酸)に切断し、DSM片にカットします。DSM片を酵素溶液に浸した(Ca2+遊離HEPES溶液は0.7mg/mlコラゲターゼタイプI、0.7mg/mlパパイン、1mg/mlアルブミン)を4°Cで一晩浸した。その後、ストリップを36.5°Cで15〜30分間加熱し、新鮮な溶液で洗浄し、穏やかにトリチュレートしました。HePES Tyrodeの溶液を含むCa2+に保存された単離された細胞、または実験のためにすぐに使用された。 | モンゴメリー&フライ (1992)24ガレゴとフライ (1994)41フライら (1994)42スイら (2001)43 Wu et al. (2002)44 | |
| モルモット | DSMはPSSで断片的に切断(mM:137 NaCl、5.4 KCl、2 MgCl2、2CaCl 2、0.42 KH2P04、4.17 NaHCO3、10グルコース、10 HEPES、PH 7.4 NaOH)。DSM片は、以下の消化液中に10分間入れ(mM:80 Na-グルタミン酸、 55 NaCl、 6 KCl、 10 HEPES, 11 グルコース, 2 MgCl2, 0.2 CaCl2) と同じ溶液を含むバイアルに移しますが、1 mg/ml コラゲナーゼ 2, 1 mg/ml トリプシン阻害剤 (時には省略), 1 mg/ml 脂肪フリーウシアルブミン, ~35°Cまたは〜60°Cで70分単一DSM細胞は、カルシウムおよび酵素を含まない同じ溶液中のパスツールピペットを介したトリウト化によって得られた。トリチュエーション後、Ca2+(1mM)を加え、細胞を4°Cで保存した。細胞は常に同じ日に使用されました。 | ボネフ&ネルソン (1993)53,54ヘップナーら (1997)26ペトコフら (2001)47 Shiehら (2001, 2007)48,49 | |
| モルモット、マウス、ラット、そしてヒト | プロトコルは、Ca2+フリー消化溶液(mM:80 Na-グルタミン酸、55 NaCl、6 KCl、10 HEPES、11グルコース、および2MgCl2)の鋭い解離に続く2段階の酵素解離処理を利用する。まず、DSMピースを1-2mg/mlパパイン、1mg/mlジチオエリスライトル、1mg/mlウシ血清アルブミンで37°Cで25~45分間処理しました(mM:80個の一ナトリウム酸菌、55 NaCl、 6 KCl、2 MgCl 2、10HEPES、および10グルコース、NaOHでpH 7.3に調整し、1-5mg/mlコラゲナーゼXI(シグマ)またはコラゲナーゼタイプ2、1mg/mlウシ血清アルブミン、0または1mg/mlmpM阻害剤および100μM2-m+のDSM片を消化溶液に移した。インキュベーション後、消化組織を酵素およびCa2+を含まない消化液中で数回洗浄し、その後、単一平滑筋細胞を得るために穏やかにトリチュレートした。 | Petkovら(2001)50ソーンロエ&ネルソン(2003)51ソーンロエ&ネルソン(2004)33ペトコフ&ネルソン(2005)27フリストフら(2008)52レインら(2010)53フリストフら (2011)15 Xinら (2012)54パラジュリら (2012)25マリシュら (2013)29パラジュリら (2013)31 Leeら (2013)55 Malyszら (2014) 23 (2014) 20フリストフら (2016)22 Leeら (2017)56ヤロツキーら (2018)57 | |
表1:種々の種の膀胱から単一DSM細胞を単離するために用いられる酵素的アプローチの要約。
| ソリューションの種類 | コンポジション(mM) |
| DS (解剖・消化液) | 80 ナグルタミン酸、55 NaCl、6 KCl、10 HEPES、2 MgCl2、および 11 グルコース、pH を 7.4 に調整 (10 M NaOH) |
| DS-P (パパイン含有 DS) | 1-2 mg/ml パパイン、1 mg/ml ジチオトレイトール、1 mg/ml ウシ血清アルブミンを含む DS |
| DS-C(コラゲナーゼ含有DS) | 1-2 mg/ml コラゲターゼII型、1 mg/ml ウシ血清アルブミン、0または1 mg/mlトリプシン阻害剤および100〜200 μM Ca2+を含有するDS溶液 |
| P (ピペット) | 110 CsOH,110アスパラギン酸、10 NaCl、1MgCl 2、10 HEPES、0.05 EGTA、および30 CsCl、pHはCsOHで7.2に調整され、アンホテリシンB(300-500 μg/ml)で補いました。 |
| E(細胞外) | 10 テトラエチルランモニウム(TEA)、6 CsCl、124 NaCl、1 MgCl2、2CaCl2、10HEPES、および10グルコース、NaOHまたはCsOHで7.3-7.4に調整されたpH、および0.002-3(2-3 mM)ニフェディピン |
表2:解剖・消化溶液(DS)の組成物、および穿水パッチクランプ実験で使用されるピペットおよび細胞外溶液。
ディスカッション
ここで説明する手順は、酵素消化を使用して全厚ヒト尿膀胱標本から生存可能で新しく単離されたDSM細胞の調製に関与するステップと、アンホテリシンB穿孔パッチクランプアプローチを用いたTRPM4チャネル阻害剤9-フェナントロルに敏感な全細胞カチオン電流の記録に関与するステップを説明する。酵素的手順は、シーケンシャルパパインコラゲターゼ消化方法として本明細書と呼ばれる2段階の逐次暴露に依存する。DSM組織は、まず、公称Ca2+フリー条件下でパパインおよびジチオトレイトール(酵素安定剤)で処理され、続いて第2段階において、低Ca2+の存在下でコラゲターゼII型によって行われる。平滑筋細胞の低Ca2+条件下でパパイン消化を行うための根拠は、1980年代後半にさかのぼります。パパインで調製した新たに単離された頸動脈平滑筋細胞は、細長い形状を示し、生存率(トリパンブルー取り込みに対する耐性)を示し、収縮刺激(より高いCa2+およびヒスタミン)65に応答した。数年後、この方法はDSM細胞の調製に適用されました(表1を参照)。他のタイプではなく、コラゲターゼII型の選択は、DSMを含む平滑筋組織に理想的に適する比較的高いタンパク質分解活性に関連する。実際、コラゲ酵素処理だけでも、広範な酵素暴露(≥60分)53、54を必要とするが、単一のDSM細胞を生じることができた。コラゲ酵素活性はCa2+に依存し、酵素はCa2+フリー条件下では不活性であるため、DSM片の最適酵素消化はCa2+66の存在を必要とする。この場合、DS-Cには100-200 μM [Ca2+] (表 2)が含まれています。酵素処理後、消化されたDSM片は、酵素またはCa2+を使用せずに冷たいDSで何度も穏やかに洗浄され、組織に結合した酵素を除去する。氷冷DSは、DSM細胞の完全性を維持し、残りのパパインまたはコラゲターゼの酵素活性を制限するのに役立ちます。最後のステップでは、酵素処理されたDSM片を火で研磨したパスツールピペットでトリトリケーションすると、単一のDSM細胞が放出されます。DSM細胞は、パッチクランプ研究または他のタイプの実験のために記録室にすぐに置かれるか、または同じ日に後で使用するためにDSの氷の上に保存される(通常、調製から8時間以内に、細胞は最大24時間生存可能なままである)。
単一のDSM細胞を正常に取得するためのいくつかの重要な考慮事項を特定しました。最初は人間のDSMの標本の源の質に関係する。組織の完全性を最適に維持するために、開いた膀胱の外科から得られるDSMのサンプルはできるだけ早く氷冷DSに置かれ、冷たい環境で維持される。具体的には、患者からの外科的抽出時に、膀胱標本は手術室で完全に準備されたサイドテーブルの上に直ちに置かれる。標本全体の総検査(通常は根治または単純な嚢胞切除術中に得られる)とその開口部が続く。目視検査の後、全厚尿中のはしご標本の片片を、腫瘍とひどく関与していない試料の遠隔領域から取り出し、すぐに冷たい(〜4°C)解剖溶液(DS)(表2)を入れたカップ(50または100mL)に入れ、蓋で密閉した。組織の収穫の計画的な性質に起因して、収穫を行う手術室の人員および補助スタッフは、組織抽出時に手術室で利用可能な材料を持つために手術ケースの開始時に警告される。これらの予防措置は、処理ステップのルーチンと一緒に、繰り返し、組織のための暖かい虚血時間を維持する - 抽出からDS溶液を有する冷蔵容器内の配置 - 5分未満に。容器は冷たい環境を維持するために冷却器で冷却装置または氷の上に置かれ、実験室に運ばれます(氷冷)。試験体が実験室に到着すると、解剖と酵素解離のステップが開始されます。酵素解離後に、与えられたDSM標本が高品質のDSM細胞をもたらすかどうかを予測することは非常に困難であるため、酵素解離ステップを進めます。多くの場合、電気生理学的実験と並行して、我々のグループは、同じDSM標本から調製されたDSMストリップに等角張力記録を行います。我々は、通常、等角収縮研究(我々の未発表の観察)のための実行可能なストリップを提供することに成功した製剤から高品質のDSM細胞を得ることができることを発見しました。
第2の因子は、異なる酵素ロット変動に関連しています。パパインとコラゲターゼII型の両方について、サプライヤーから新しい多くの酵素が到着するたびに、組織消化のためのDSにおける酵素活性が変化する可能性があることを観察した。したがって、我々は、定期的に、各新しいロットのための酵素濃度とインキュベーション間隔を最適化します。ロット変動寄与を最小限に抑えるために、同じロットの大量の注文を行い、使用まで2 mLのアリコートに大量のストック溶液を作り、~-20°Cで保存します。しかし、時間が経つにつれて、凍結された株式(2週間まで保存)は、その酵素活性を失う可能性があります。第3の変数は酵素消化処理の温度に関する。パパインとコラゲターゼの両方の酵素活性は、温度依存性を示す。パパインおよびコラゲターゼII型は、正常身体生理学67、68を包含する温度範囲において活性を示す。そこで、DSM細胞の完全性を保つために、より高い温度を避けて~37°Cで酵素処理を安定に保ち、これを目指します。第4の考察は、生存性の高い(優れた古典的平滑筋特性を示す)から非健康な過剰消化細胞に至るまで、各調製物内に存在するDSM細胞の品質の変動に関するものである。長期の酵素インキュベーション間隔は、多数の損傷細胞を得る主な理由の1つです。過剰な酵素処理はまた、イオンチャネル、受容体、および輸送体のタンパク質構造を損ない、その機能性に悪影響を及ぼします。酵素的に得られた結果の解釈は、新たに分離された細胞は、この配慮を念頭に置く必要があります。酵素消化条件の最適化は、生存度の高い細胞の割合を増加させることを目的としています。マイクロアレイ解析のようなより多くの生存可能な細胞に依存する実験的アプローチは、単一細胞パッチクランプ電気生理学やCa2+イメージングなどの少数の細胞で正常に行われたものよりも堅牢な最適化を必要とします。上記の要因を考慮することで、過去10年間の研究努力が、高品質の単一DSM細胞を得る上で導かれました。
穿くりパッチクランプ技術は、四半世紀以上にわたって電気生理学的アプローチの主力となっています。いくつかの出版物は技術的な考慮事項の詳細を提供します69,70,71,72,73.細胞穿水は、アンホテリシン-B、ナイスタチン、グラミシジン、またはβ-エスシンで得ることができます(参照参照32各概要) を参照)。他の電気生理学的アプローチよりも穿水されたパッチクランプ記録の主な利点は、天然の細胞内環境(細胞内Caを含む)です。2+シグナル伝達分子(例えば、cAMP、PKA、リン酸塩、ホスホジエステラーゼ)が保存される。したがって、この技術は、生理的条件下で全細胞イオンチャネル電流およびその調節機構を調査するのに理想的である。重要な注意点は、細胞内細胞組成は、従来の全細胞および単一チャネル切除パッチ(内部および外部)記録のような他の電気生理学的方法とは異なり、正確に制御できないことです。我々の経験では、3つの因子が、アンホテリシン-B-穿状パッチクランプ実験の実験結果の成功に日常的に寄与する。1 つ目は、録音を試みるために選択された DSM セルの品質です。DSM細胞が半収縮性(蛇様)を表示して生存率が高いとき、細胞表面の周りに明確に定義されたハローを有する高コントラストの光沢のある外観を、記録室のガラス底にしっかりと付着させ、その後ギガシール形成および細胞穿調が比較的容易に起こる。成功のための第2および第3の要因は、それぞれ、アンホテリシン-B(ジメチルスルホキシド/DMSOおよび細胞内ピペット溶液)の供給源および可溶化の質に関連する。我々は、ソースとロット変動の面で異なるサプライヤー間の不一致を観察した。毎日、粉末からアンホテリシン-Bストック溶液の新鮮な溶液を調製し、その後に細胞内ピペット溶液で希釈します。これらのステップは、広範な超音波処理と渦を必要とします。作りたてのアンホテリシン-B含有ピペット溶液で、細胞穿水に成功した(<50 MΩ) following giga-seal formation can be usually obtained within 30 min. The concentration of amphotericin-B in the pipette solution also requires optimization dependent on the amphotericin-B lot and source. Under our experimental conditions, the final amphotericin-B concentrations in the pipette range from 200 to 500 µg/mL. Since amphotericin-B exhibits light sensitivity, its solutions need to be kept in the dark. Using the amphotericin-B perforated patch-clamp technique, our group recorded voltage-step induced K mω)="" following="" giga-seal="" formation="" can="" be="" usually="" obtained="" within="" 30="" min.="" the="" concentration="" of="" amphotericin-b="" in="" the="" pipette="" solution="" also="" requires="" optimization="" dependent="" on="" the="" amphotericin-b="" lot="" and="" source.="" under="" our="" experimental="" conditions,="" the="" final="" amphotericin-b="" concentrations="" in="" the="" pipette="" range="" from="" 200="" to="" 500="" µg/ml.="" since="" amphotericin-b="" exhibits="" light="" sensitivity,="" its="" solutions="" need="" to="" be="" kept="" in="" the="" dark.="" using="" the="" amphotericin-b="" perforated="" patch-clamp="" technique,="" our="" group="" recorded="" voltage-step="" induced="">+Ca2+、ヒト、モルモット、マウス、ラットDSM細胞からの非選択的カチオン電流17,21,22,23,29,30,31,35,60.ここで、ヒトDSM細胞における非選択的カチオン電流を記録するための条件について説明する。9-フェナントロル, TRPM4 チャネルのブロッカー, DSM 興奮性の制御でこれらのチャネルの役割をサポートする減衰電圧ステップ誘導電流.注意として、それは通常、ギガシールを取得した後、少なくとも45分を必要とし、最適安定な電圧ステップ誘発非選択的なカチオン電流を記録するために穿調の開始。電圧ランプは、電圧ステッププロトコルの代替として使用することもできます。30,64.ここでは、前者のアプローチは電圧依存性の不活性化の影響を最小限に抑え、持続時間にわたって誘発電流の平均化を可能にするので、過偏極性保持膜電位からの電圧ステッププロトコルがランププロトコルよりも好ましかったランプが電圧ごとに単一のデータポイントを提供する電圧-ステップの。後者の点は、電流が電圧ステップ中に可変的な活動を示すので、特にヒトDSM細胞に適用されます(図 5そして図 6).アンホテリシン-B穿刺パッチクランプ技術は、DSM細胞および他の細胞タイプの特性を同定する上で不可欠であり、今後も新たな発見を提供する際に引き続き補佐官となるだろう。さらに、新たに単離された単一DSM細胞を全細胞Kの測定に使用できる+Cl-、および Ca2+パッチクランプ技術の従来のモード、電流クランプによる膜電位記録、および当社の以前の報告に例示された単一チャンネル記録を用いた電流23,29,35,64.
単一細胞パッチクランプ法に加えて、新たに分離されたDSM細胞は、Ca2+イメージング、RT-PCR/q-RT-PCR、免疫細胞化学、その位置近接ライゲーションアッセイ、およびゲノムアプローチ(例えば、マイクロアレイ、RNA-セク、CHIP-seq)15、18、30、34を含む他の技術的アプローチで研究することができます。単一細胞転写体測定法が進化し続け、高感度になる中、個々のDSM細胞の電気的または薬理学的特性をそれらの転写/プロテオームプロファイルと日常的かつ特異的に結びつける能力を将来に想定しています。これは、まずDSM細胞から記録し、次にmRNAまたはタンパク質を抽出し、続いて転写/プロテオミック分析を行うことによって達成されます。このような方法は非DSM細胞で既に試験されているが、それらは、現在のところ技術的に困難であり、ルーチンと考えられる感度に欠け、そしていくつかの選択された遺伝子産物74の検出に成功することに限定されている。制御および罹患患者ドナーから得られたDSM細胞に対して行われる機能分子プロファイル発現連結研究は、正常なDSM機能、病因、および効果的な新規治療アプローチの同定に不可欠な生理学的プロセスに関する洞察を提供する。
開示事項
なし。
謝辞
この作品は、ジョージ・V・ペトコフへのNIH-R01DK106964とP20DK123971の助成金によってサポートされました。著者らは、原稿の批判的な評価に対するヴィクトル・ヤロツキー博士とサラ・マクスウェル氏に感謝する。また、MUSCとUTHSCの泌尿器科スタッフ外科医(トーマス・キーン博士、ハリー・クラーク博士、スティーブン・サベージ、ロス・ラメス博士、サンディップ・プラサド博士、ジョナサン・ピカール、クリストファー・レッドベター、アンソニー・パターソン、MUSCとUTHSC泌尿器科の住民)にも感謝しています。ヴォーン、サミュエル・ウォーカー・ニックルズ、マシュー・ヤング、エリン・バーンズ、ジャスティン・エレット、ライアン・レヴェイ、オースティン・ヤング、マーク・カリン、ニマ・バラダラン、オルグベミソラ・マッコイ、トレイシー・ティプトン、ブライス・ワイアット、アリッサ・グライマン、サラ・スタロスタ、アーロン・ブロッホ、クリスティーン・キャロウェイ、ルシル・コックス、クリスチャン・ディーワン、エリン・ハイトマン、ブラッドリー・ヒューストン、スティーブン・レッグ、ロバート・S・リビー、コール・ロックリア、クリステン・マーリー、モニカ・オハンロン、パトリック・プロブスト、シンシア・シャラディン、エリザベス・ツアービル、ダニエル・サパタが人間の組織収集に役立つ。
資料
| Name | Company | Catalog Number | Comments |
| 5 ml polystyrene round-bottom tube | Falcon | 352054 | Tubes for DS containing enzymes used in digestion steps |
| 9-Phenanthrol | Sigma-Aldrich | 211281 | TRPM4 channel inhibitor |
| Amphotericin-B | Fisher | BP928-250 | Used for patch/cell perforation |
| Amphotericin-B | European Pharmacopoeia Reference Standards | 5 | Used for patch/cell perforation |
| Amphotericin-B | Sigma-Aldrich | A9528-100MG | Used for patch/cell perforation |
| Analog vortex mixer | VWR | 58816-121 | |
| Aspartic acid | Sigma-Aldrich | A9006 | Intracellular pipette solution |
| Bovine serum albumin | Sigma-Aldrich | A7906 | DS |
| CaCl2 | Sigma-Aldrich | C1016 | Extracellular solution and DS |
| Capillary Glass | Sutter | BF150-110-7.5 | Capillary for preparation of pulled patch electrodes |
| Cesium hydroxide hydrate | Sigma-Aldrich | C8518 | Intracellular pipette solution |
| Clampex ver. 10 software includes data acqusition (Clampex) and analysis (Clampfit) programs | Axon Instruments/ Molecular Devices | pCLAMP-10 | Commerical software and part of patch-clamp rig setup |
| Collagenase type 2 | Worthington Biochemical Corporation | LS004177 | DS-C |
| CsCl | Sigma-Aldrich | 203025 | Extracellular and intracellular solutions |
| Dental wax | Miltex Dental Wax Technologies, Inc. | 18058351 | |
| Digital Thermometer with Probe | Fisher Scientific | 15-077-32 | Placed in tissue bath to monitor temperature |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2650 | Solvent |
| DL-Dithiothreitol (DDT) | Sigma-Aldrich | D9779 | Reducing agents used together with Papain |
| EGTA | Sigma-Aldrich | E3889 | Ca2+ chelator, used in intracellular pipette solution |
| Flaming/Brown micropipette puller | Sutter | P-97 | Required to pull electrodes with very fine tips |
| Floating foam tube rack/holder | VWR Scientific | 82017-634 | Used for holding tubes with enzymes for temperature control |
| Glucose | Sigma | G8270 | |
| Glutamic acid (Na salt) | Sigma-Aldrich | G1626 | DS |
| HEPES | Sigma-Aldrich | H3375 | pH Buffer |
| KCl | Fisher Scientific | BP366-1 | Extracellular solution |
| Low Noise Data Acquisition System | Axon Instruments/ Molecular Devices | Digidata 1440A | Part of patch-clamp rig setup |
| Magnetic stirrer | VWR | 01-442-684 | |
| MgCl2 (hexahydrate) | Sigma-Aldrich | M2670 | Extracellular and intracellular solutions |
| MicroForge | Narishige | MF-830 | Used for fire-polishing electrodes |
| NaCl | Sigma-Aldrich | S7653 | Extracellular and intracellular solutions |
| NaOH | Sigma-Aldrich | S8045 | |
| Nifedipine | Sigma-Aldrich | N7634 | L-type voltage-gated Ca2+ channel blocker |
| Nikon inverted microscope, TS100 with T1-SM stage with 5x, 10x, 20x, and 40x objectives | Nikon | Discontinued | Part of Patch-clamp rig setup |
| Non-metalic syringe needle, MicroFil | WPI | MF-34G-5 | Filling of intracellular pipette solution |
| Papain | Worthington Biochemical Corporation | LS003126 | DS-P |
| Pasteur pipette | FisherBrand | 13-678-20A | Tips are broken off and fire-polished and used for titration of enzymatically treated tissues to release single DSM cells from pieces |
| Patch-clamp amplifier | Axon Instruments/ Molecular Devices | Axon Axopatch 200B | Part of patch-clamp rig setup |
| PC computer | DELL | Custom configuration | Part of patch-clamp rig setup |
| pH Meter | Aspera Instruments | PH700 | |
| Polyethylene tubing | Intramedic | 427-436 | Tubing for superfusion of extracellular bath connected to glass-bottom recording chamber |
| Tetraethylammonium chloride | Sigma-Aldrich | T2265 | Ion channel blocker of Kv and BK channels added to the extracellular bath solution |
| Thermo Scientific Precision shaking water bath (model 2870) | Thermo Scientific | Discontinued | Water bath for temperature control of enzymatic digestion employed as an alternative to tissue chamber-circulating bath setup |
| Tissue bath, 100 mL | Radnoti | 1583-101 | Connected to a circulating bath and filled with water, tubes with DS and DSM pieces are placed in the setup to control the temperature of digestion steps |
| Vinyl tubing | ColePalmer | 06405-3 | Multiple uses including for connecting tissue bath to circulating water bath |
| Water circulator bath, Haake D1 L | Haake | Discontinued | Connected to tissue bath |
| Weighting scale | Mettler Toledo | XS64 | |
| ZeissAxiovert 40C inverted microscope with 10x and 40x objectives | Carl-Zeiss | Discontinued | Part of patch-clamp rig setup |
参考文献
- Andersson, K. E., Arner, A. Urinary bladder contraction and relaxation: physiology and pathophysiology. Physiological Reviews. 84 (3), 935-986 (2004).
- Brading, A. F., Brain, K. L., Andersson, K. E., Michel, M. C. Ion channel modulators and urinary tract function. Urinary Tract. 202, 375-393 (2011).
- Brading, A. F. Spontaneous activity of lower urinary tract smooth muscles: correlation between ion channels and tissue function. Journal of Physiology. 570, 13-22 (2006).
- Brading, A. F., Heaton, J. P., Hashitani, H. A survey of commonalities relevant to function and dysfunction in pelvic and sexual organs. International Journal of Impotence Research. 20 (1), 1-16 (2008).
- Petkov, G. V. Role of potassium ion channels in detrusor smooth muscle function and dysfunction. Nature Reviews Urology. 9 (1), 30-40 (2012).
- Andersson, K. E. Treatment-resistant detrusor overactivity--underlying pharmacology and potential mechanisms. International Journal of Clinical Practice Supplement. 151, 8-16 (2006).
- Sui, G. P., Wu, C., Fry, C. H. The electrophysiological properties of cultured and freshly isolated detrusor smooth muscle cells. Journal of Urology. 165 (2), 627-632 (2001).
- Kropp, B. P., et al. Characterization of cultured bladder smooth muscle cells: assessment of in vitro contractility. Journal of Urology. 162 (5), 1779-1784 (1999).
- Bonev, A., Isenberg, G. Arginine-vasopressin induces mode-2 gating in L-type Ca2+ channels (smooth muscle cells of the urinary bladder of the guinea-pig). Pflügers Archive - European Journal of Physiology. 420 (2), 219-222 (1992).
- Schneider, P., Hopp, H. H., Isenberg, G. Ca2+ influx through ATP-gated channels increments [Ca2+]i and inactivates ICa in myocytes from guinea-pig urinary bladder. Journal of Physiology. 440, 479-496 (1991).
- Wellner, M. C., Isenberg, G. Properties of stretch-activated channels in myocytes from the guinea-pig urinary bladder. Journal of Physiology. 466, 213-227 (1993).
- Wellner, M. C., Isenberg, G. Stretch-activated nonselective cation channels in urinary bladder myocytes: importance for pacemaker potentials and myogenic response. Experientia Supplementum. 66, 93-99 (1993).
- Klockner, U., Isenberg, G. Action potentials and net membrane currents of isolated smooth muscle cells (urinary bladder of the guinea-pig). Pflügers Archive - European Journal of Physiology. 405 (4), 329-339 (1985).
- Moore, E. D., et al. Organization of Ca2+ release units in excitable smooth muscle of the guinea-pig urinary bladder. Biophysical Journal. 87 (3), 1836-1847 (2004).
- Hristov, K. L., Chen, M., Kellett, W. F., Rovner, E. S., Petkov, G. V. Large conductance voltage- and Ca2+-activated K+ channels regulate human detrusor smooth muscle function. American Journal of Physiology - Cell Physiology. 301 (4), 903-912 (2011).
- Afeli, S. A., Rovner, E. S., Petkov, G. V. SK but not IK channels regulate human detrusor smooth muscle spontaneous and nerve-evoked contractions. American Journal of Physiology - Renal Physiology. 303 (4), 559-568 (2012).
- Hristov, K. L., et al. Kv2.1 and electrically silent Kv channel subunits control excitability and contractility of guinea pig detrusor smooth muscle. American Journal of Physiology - Cell Physiology. 302 (2), 360 (2012).
- Afeli, S. A., Malysz, J., Petkov, G. V. Molecular expression and pharmacological evidence for a functional role of Kv7 channel subtypes in Guinea pig urinary bladder smooth muscle. PLoS One. 8 (9), 75875 (2013).
- Smith, A. C., et al. TRPM4 channel: a new player in urinary bladder smooth muscle function in rats. American Journal of Physiology - Renal Physiology. 304 (7), 918-929 (2013).
- Smith, A. C., et al. Novel role for the transient potential receptor melastatin 4 channel in guinea pig detrusor smooth muscle physiology. American Journal of Physiology - Cell Physiology. 304 (5), 467 (2013).
- Hristov, K. L., Smith, A. C., Parajuli, S. P., Malysz, J., Petkov, G. V. Large-conductance voltage- and Ca2+-activated K+ channel regulation by protein kinase C in guinea pig urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 306 (5), 460-470 (2014).
- Hristov, K. L., et al. Novel regulatory mechanism in human urinary bladder: central role of transient receptor potential melastatin 4 channels in detrusor smooth muscle function. American Journal of Physiology - Cell Physiology. 310 (7), 600-611 (2016).
- Malysz, J., Afeli, S. A., Provence, A., Petkov, G. V. Ethanol-mediated relaxation of guinea pig urinary bladder smooth muscle: involvement of BK and L-type Ca2+ channels. American Journal of Physiology - Cell Physiology. 306 (1), 45-58 (2014).
- Montgomery, B. S., Fry, C. H. The action potential and net membrane currents in isolated human detrusor smooth muscle cells. Journal of Urology. 147 (1), 176-184 (1992).
- Parajuli, S. P., Soder, R. P., Hristov, K. L., Petkov, G. V. Pharmacological activation of small conductance calcium-activated potassium channels with naphtho[1,2-d]thiazol-2-ylamine decreases guinea pig detrusor smooth muscle excitability and contractility. Journal of Pharmacology and Experimental Therapeutics. 340 (1), 114-123 (2012).
- Heppner, T. J., Bonev, A. D., Nelson, M. T. Ca2+-activated K+ channels regulate action potential repolarization in urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 273 (1), 110-117 (1997).
- Petkov, G. V., Nelson, M. T. Differential regulation of Ca2+-activated K+ channels by beta-adrenoceptors in guinea pig urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 288 (6), 1255-1263 (2005).
- Herrera, G. M., Etherton, B., Nausch, B., Nelson, M. T. Negative feedback regulation of nerve-mediated contractions by KCa channels in mouse urinary bladder smooth muscle. American Journal of Physiology - Regulatory Integrative Comparative Physiology. 289 (2), 402-409 (2005).
- Malysz, J., Rovner, E. S., Petkov, G. V. Single-channel biophysical and pharmacological characterizations of native human large-conductance calcium-activated potassium channels in freshly isolated detrusor smooth muscle cells. Pflügers Archive - European Journal of Physiology. 465 (7), 965-975 (2013).
- Provence, A., Angoli, D., Petkov, G. V. Kv7 channel pharmacological activation by the novel activator ML213: role for heteromeric Kv7.4/Kv7.5 channels in guinea pig detrusor smooth muscle function. Journal of Pharmacology and Experimental Therapeutics. 364 (1), 131-144 (2018).
- Parajuli, S. P., et al. Control of urinary bladder smooth muscle excitability by the TRPM4 channel modulator 9-phenanthrol. Channels (Austin). 7 (6), 537-540 (2013).
- Ishibashi, H., Moorhouse, A. J., Nabekura, J., Okada, Y. Perforated whole-cell patch-clamp technique: a user's guide. Patch Clamp Techniques: From Beginning to Advanced Protocols. 4, 71-83 (2012).
- Provence, A., Rovner, E. S., Petkov, G. V. Regulation of transient receptor potential melastatin 4 channel by sarcoplasmic reticulum inositol trisphosphate receptors: Role in human detrusor smooth muscle function. Channels (Austin). 11 (5), 459-466 (2017).
- Hristov, K. L., et al. Suppression of human detrusor smooth muscle excitability and contractility via pharmacological activation of large conductance Ca2+-activated K+ channels. American Journal of Physiology - Cell Physiology. 302 (11), 1632-1641 (2012).
- Xin, W., Soder, R. P., Cheng, Q., Petkov, G. V. Inhibition of phosphodiesterases relaxes detrusor smooth muscle via activation of the large conductance voltage- and Ca2+-activated K+ channel. American Journal of Physiology - Cell Physiology. 302 (9), 1361-1370 (2012).
- Hristov, K. L., et al. Neurogenic detrusor overactivity is associated with decreased expression and function of the large conductance voltage- and Ca2+-activated K+ channels. PLoS One. 8 (7), 68052 (2013).
- Hristov, K. L., Parajuli, S. P., Provence, A., Rovner, E. S., Petkov, G. V. Nongenomic modulation of the large conductance voltage- and Ca2+-activated K+ channels by estrogen: A novel regulatory mechanism in human detrusor smooth muscle. Physiological Reports. 5 (14), (2017).
- Parajuli, S. P., et al. Functional link between muscarinic receptors and large-conductance Ca2+ -activated K+ channels in freshly isolated human detrusor smooth muscle cells. Pflügers Archiv - European Journal of Physiology. 467 (4), 665-675 (2015).
- Malysz, J., Rovner, E. S., Petkov, G. V. Single-channel biophysical and pharmacological characterizations of native human large-conductance calcium-activated potassium channels in freshly isolated detrusor smooth muscle cells. Pflügers Archiv - European Journal of Physiology. 465 (7), 965-975 (2013).
- Thorneloe, K. S., Nelson, M. T. Properties of a tonically active, sodium-permeable current in mouse urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 286 (6), 1246-1257 (2004).
- Barry, M. J., et al. The American Urological Association symptom index for benign prostatic hyperplasia. The Measurement Committee of the American Urological Association. Journal of Urology. 148 (5), 1549-1557 (1992).
- Klockner, U., Isenberg, G. Calcium currents of cesium loaded isolated smooth muscle cells (urinary bladder of the guinea pig). Pflügers Archiv - European Journal of Physiology. 405 (4), 340-348 (1985).
- Klockner, U., Isenberg, G. Tiapamil reduces the calcium inward current of isolated smooth muscle cells. Dependence on holding potential and pulse frequency. European Journal of Pharmacology. 127 (3), 165-171 (1986).
- Weidelt, T., Isenberg, G. Augmentation of SR Ca2+ release by rapamycin and FK506 causes K+-channel activation and membrane hyperpolarization in bladder smooth muscle. British Journal of Pharmacology. 129 (7), 1293-1300 (2000).
- Inoue, R., Brading, A. F. The properties of the ATP-induced depolarization and current in single cells isolated from the guinea-pig urinary bladder. British Journal of Pharmacology. 100 (3), 619-625 (1990).
- Inoue, R., Brading, A. F. Human, pig and guinea-pig bladder smooth muscle cells generate similar inward currents in response to purinoceptor activation. British Journal of Pharmacology. 103 (4), 1840-1841 (1991).
- Nakayama, S., Brading, A. F. Possible contribution of long open state to noninactivating Ca2+ current in detrusor cells. American Journal of Physiology - Cell Physiology. 269 (1), 48-54 (1995).
- Nakayama, S., Brading, A. F. Interaction of Ca2+ agonist and depolarization on Ca2+ channel current in guinea pig detrusor cells. Journal of General Physiology. 106 (6), 1211-1224 (1995).
- Gallegos, C. R., Fry, C. H. Alterations to the electrophysiology of isolated human detrusor smooth muscle cells in bladder disease. Journal of Urology. 151 (3), 754-758 (1994).
- JournalFry, C. H., Gallegos, C. R., Montgomery, B. S. The actions of extracellular H+ on the electrophysiological properties of isolated human detrusor smooth muscle cells. Journal of Physiology. 480, 71-80 (1994).
- Sui, G. P., Wu, C., Fry, C. H. A description of Ca2+ channels in human detrusor smooth muscle. BJU International Journal. 92 (4), 476 (2003).
- Wu, C., Sui, G., Fry, C. H. The role of the L-type Ca2+ channel in refilling functional intracellular Ca2+ stores in guinea-pig detrusor smooth muscle. Journal of Physiology. 538, 357-369 (2002).
- Bonev, A. D., Nelson, M. T. Muscarinic inhibition of ATP-sensitive K+ channels by protein kinase C in urinary bladder smooth muscle. American Journal of Physiology - Cell Physiology. 265 (6), 1723-1728 (1993).
- Bonev, A. D., Nelson, M. T. ATP-sensitive potassium channels in smooth muscle cells from guinea pig urinary bladder. American Journal of Physiology - Cell Physiology. 264 (5), 1190-1200 (1993).
- Petkov, G. V., Heppner, T. J., Bonev, A. D., Herrera, G. M., Nelson, M. T. Low levels of KATP channel activation decrease excitability and contractility of urinary bladder. American Journal of Physiology - Regulatory Integrative Comparative Physiology. 280 (5), 1427-1433 (2001).
- Shieh, C. C., et al. Functional implication of spare ATP-sensitive K+ channels in bladder smooth muscle cells. Journal of Pharmacology and Experimental Therapeutics. 296 (3), 669-675 (2001).
- Shieh, C. C., et al. Characterization of a novel ATP-sensitive K+ channel opener, A-251179, on urinary bladder relaxation and cystometric parameters. British Journal of Pharmacology. 151 (4), 467-475 (2007).
- Petkov, G. V., et al. Beta1-subunit of the Ca2+-activated K+ channel regulates contractile activity of mouse urinary bladder smooth muscle. Journal of Physiology. 537, 443-452 (2001).
- Thorneloe, K. S., Nelson, M. T. Properties and molecular basis of the mouse urinary bladder voltage-gated K+ current. Journal of Physiology. 549, 65-74 (2003).
- Hristov, K. L., et al. Stimulation of beta3-adrenoceptors relaxes rat urinary bladder smooth muscle via activation of the large-conductance Ca2+-activated K+ channels. American Journal of Physiology - Cell Physiology. 295 (5), 1344-1353 (2008).
- Layne, J. J., Nausch, B., Olesen, S. P., Nelson, M. T. BK channel activation by NS11021 decreases excitability and contractility of urinary bladder smooth muscle. American Journal of Physiology - Regulatory Integrative Comparative Physiology. 298 (2), 378-384 (2010).
- Lee, H., Koh, B. H., Peri, L. E., Sanders, K. M., Koh, S. D. Functional expression of SK channels in murine detrusor PDGFRalpha+ cells. Journal of Physiology. 591 (2), 503-513 (2013).
- Lee, H., et al. Premature contractions of the bladder are suppressed by interactions between TRPV4 and SK3 channels in murine detrusor PDGFRalpha+ cells. Scientific Reports. 7 (1), 12245 (2017).
- Yarotskyy, V., Malysz, J., Petkov, G. V. Properties of single channel and whole-cell Cl- currents in guinea pig detrusor smooth muscle cells. American Journal of Physiology - Cell Physiology. 316 (5), 698-710 (2019).
- Driska, S. P., Porter, R. Isolation of smooth muscle cells from swine carotid artery by digestion with papain. American Journal of Physiology - Cell Physiology. 251 (3), 474-481 (1986).
- Seltzer, J. L., Welgus, H. G., Jeffrey, J. J., Eisen, A. Z. The function of Ca2+ in the action of mammalian collagenases. Archives of Biochemistry and Biophysics. 173 (1), 355-361 (1976).
- Skelton, G. S. Papaya proteinases. I. Temperature-and pH-stability curves. Enzymologia. 35 (5), 270-274 (1968).
- Petrova, D., Derekova, A., Vlahov, S. Purification and properties of individual collagenases from Streptomyces sp. strain 3B. Folia Microbiologica (Praha). 51 (2), 93-98 (2006).
- Sharpe, E. J., St Clair, J. R., Proenza, C. Methods for the isolation, culture, and functional characterization of sinoatrial node myocytes from adult mice. Journal of Visualized Experiments. (116), (2016).
- Brueggemann, L. I., Mani, B. K., Haick, J., Byron, K. L. Exploring arterial smooth muscle Kv7 potassium channel function using patch clamp electrophysiology and pressure myography. Journal of Visualized Experiments. (67), e4263 (2012).
- Jarriault, D., Grosmaitre, X. Perforated patch-clamp recording of mouse olfactory sensory neurons in intact neuroepithelium: functional analysis of neurons expressing an identified odorant receptor. Journal of Visualized Experiments. (101), e52652 (2015).
- Rae, J., Cooper, K., Gates, P., Watsky, M. Low access resistance perforated patch recordings using amphotericin B. Journal of Neuroscience Methods. 37 (1), 15-26 (1991).
- Knutson, K., et al. Whole cell electrophysiology of primary cultured murine enterochromaffin cells. Journal of Visualized Experiments. (139), (2018).
- Devienne, G., Le Gac, B., Piquet, J., Cauli, B. Single cell multiplex reverse transcription polymerase chain reaction after patch-clamp. Journal of Visualized Experiments. (136), (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved