Method Article
Configuración de Espectrometría de Masas De Plasma Acoplada Inductivamente Electroforesistiva (CE-ICP-MS) para Cuantificación de Especies redox de Hierro (Fe(II), Fe(III))
En este artículo
Resumen
Este método de especiación redox de hierro se basa en la espectrometría de masas plasmáticas acoplada inductivamente por electroforesis capilar con apilamiento de muestras combinada con análisis cortos en una sola ejecución. El método analiza rápidamente y proporciona bajos límites de cuantificación para las especies de redox de hierro en una amplia gama de tejidos y muestras de biofluidos.
Resumen
La disosostasis del metabolismo del hierro se cuenta en el marco fisiopatológico de numerosas enfermedades, incluyendo el cáncer y varias condiciones neurodegenerativas. El hierro excesivo produce Fe(II) libre de redox-activo y puede causar efectos devastadores dentro de la célula como el estrés oxidativo (OS) y la muerte por peroxidación lipídica conocida como ferroptosis (FPT). Por lo tanto, las mediciones cuantitativas del hierro ferroso (Fe(II)) y férrico (Fe(III)) en lugar de la total de la fe-determinación son la clave para una visión más detallada de estos procesos perjudiciales. Dado que las determinaciones de Fe(II)/(III) pueden verse obstaculizadas por cambios rápidos en estado redox y bajas concentraciones en muestras relevantes, como el líquido cefalorraquídeo (LCR), deben estar disponibles métodos que analicen rápidamente y proporcionen bajos límites de cuantificación (LOQ). La electroforesis capilar (CE) ofrece la ventaja de la separación rápida Fe(II)/Fe(III) y funciona sin una fase estacionaria, lo que podría interferir con el equilibrio redox o causar adherencia de analito. CE combinado con espectrometría de masas plasmáticas acoplada inductivamente (ICP-MS) como detector ofrece una mejora adicional de la sensibilidad de detección y la selectividad. El método presentado utiliza 20 mM HCl como electrolito de fondo y una tensión de +25 kV. Las formas de pico y los límites de detección de concentración se mejoran mediante el apilamiento por conductividad pH. Para la reducción de 56[ArO]+, ICP-MS fue operado en el modo de célula de reacción dinámica (DRC) con NH3 como gas de reacción. El método logra un límite de detección (LOD) de 3 g/L. Debido al apilamiento, los volúmenes de inyección más altos fueron posibles sin obstaculizar la separación, pero mejorando el LOD. Las calibraciones relacionadas con el área de pico fueron lineales de hasta 150 g/L. La precisión de la medición fue del 2,2% (Fe(III)) a 3,5% (Fe(II)). La precisión del tiempo de migración fue de <3% para ambas especies, determinada en 1:2 lysatos diluidos de células de neuroblastoma humano (SH-SY5Y). Los experimentos de recuperación con adición estándar revelaron precisión de 97% Fe(III) y 105 % Fe(II). En las bio-muestras de la vida real como el CSF, el tiempo de migración puede variar según la conductividad variable (es decir, la salinidad). Por lo tanto, la identificación de picos se confirma mediante la adición estándar.
Introducción
Hoy en día, es más evidente que el estrés oxidativo mediado por hierro (OS) juega un papel crucial en múltiples trastornos específicamente en trastornos cerebrales neurodegenerativos, como la enfermedad de Alzheimer y Parkinson, así como en el cáncer1,2,3,4. El sistema operativo está estrechamente relacionado con el estado y el equilibrio de la redox-pareja Fe(II)/Fe(III). Mientras que Fe(III) es redox-inactivo, Fe(II) genera poderosamente especies reactivas de oxígeno (ROS) mediante la catalización de H2O2 de descomposición seguida de la producción de radicales hidroxilo y la peroxidación lipídica de membrana5,6. A nivel molecular, ROS generados por Fe(II) y fosfolípidos peroxidizados son un fuerte ataque a la integridad de proteínas, lípidos y ADN7,,8. Se demostró que tal disfunción celular perjudicial induce disfunción mitocondrial con disminución del contenido de ATP9 e incluso puede desencadenar una muerte celular necrótica programada, conocida como ferroptosis (FPT)10,,11. Por lo tanto, la especiación cuantitativa de redox Fe(II)/(III) es de importancia eminente en un amplio espectro de trastornos relacionados con redox.
La especiación química es una herramienta bien establecida para el estudio de oligoelementos de papel biológico y metabolismo en general7,,8 así como en condiciones neurodegenerativas12,,13,14,15,16,17. Los métodos para la especiación Fe-redox que se encuentran en la literatura se basan típicamente en la separación de cromatografía líquida (LC). Parte de la literatura utiliza espectrometría de masas plasmáticas acoplada inductivamente (ICP-MS) como detector selectivo de elementos. Sin embargo, en el trabajo de rutina LC, se necesitaban tiempos de purga excesivos entre las corridas. La variación de lote a lote aún más problemática de las columnas LC obligó a la reo optimization de las condiciones de elución después de cada cambio de columna. Estos problemas están obstaculizando el alto rendimiento. Se requiere tiempo adicional para obtener una fiabilidad aceptable y evaluar minuciosamente el método de nuevo.
Para eludir estos inconvenientes, aquí se presenta un método para la espectrometría redox Fe(II)/Fe(III) basada en la espectrometría de masas plasmáticas acoplada inductivamente por electroforesis capilar (CE-ICP-MS). CE ofrece varias ventajas en comparación con LC18. Los capilares no tienen fase estacionaria y, por lo tanto, no dependen (casi) de la identidad del lote. Cuando se envejecen o se bloquean, se reemplazan rápidamente, mostrando un rendimiento generalmente sin cambios. Los pasos de purga y limpieza entre las muestras son efectivos y cortos, y el tiempo de análisis por muestra también es corto.
El método presentado es fiable con buenas cifras de mérito. Como prueba de principio, el método se aplica al lisato celular del neuroblastoma dopaminérgico humano (SH-SY5Y), un tipo de muestra importante en la neurodegeneración, así como la investigación del cáncer19.
Protocolo
ADVERTENCIA: El método utiliza ácido clorhídrico (HCl, diluciones iniciales de ultrapura, concentración 1 M) y tetramemememoniumhydróxido (TMAH, comenzando diluciones de ultrapura, concentración 25%). Ambas sustancias son fuertemente corrosivas. Use protección para la piel y los ojos.
1. Preparación de electrolitos
- Preparación de HCl-electrolitos: electrolito de fondo (20 mM HCl), electrolito de salida (5 mM HCl) y electrolito de terminación (0,05 mM HCl)
- Preparar 20 mM HCl en un matraz de 100 ml: Pipetear 2 mL de 1 M HCl en el matraz, llenar hasta la marca con agua ultrapura y agitar suavemente.
- Preparar 5 mM HCl en un matraz de 100 ml: Pipetear 500 l de 1 M HCl en el matraz, llenar hasta la marca con agua ultrapura y agitar suavemente.
- Preparar 0,05 mM HCl en dos pasos: Pipetear 1 mL de 20 mM HCl en un matraz de 100 ml, y luego llenar hasta la marca con agua ultrapura y agitar suavemente. Posteriormente, pipetear 2,5 ml de esta última solución en un tubo cónico de 15 ml(Tabla de materiales)y añadir 7,5 ml de agua ultrapura, luego agitar suavemente.
- Preparación del electrolito líder 12% TMAH en un tubo cónico de 15 ml: Pipetear 4,8 ml de 25% TMAH en el tubo, añadir 5,2 ml de agua ultrapura y agitar suavemente.
NOTA: El 12% de TMAH se utiliza para purgar y limpiar el capilar antes de cada carrera y como un electrolito líder delante de la muestra inyectada).
2. Preparación y almacenamiento de normas y muestras
- Estándares
- Para Fe(II), pesar 35,61 mg de Fe(II)Cl2a 4H2O en un matraz de 100 ml y llenar hasta la marca de 100 ml con agua ultrapura para una concentración de 100 mg de Fe(II)/L. Agitar suavemente hasta la disolución completa.
- Para Fe(III), pesar 29,04 mg de Fe(III)Cl3 en un matraz de 100 ml y llenar hasta la marca de 100 ml con agua ultrapura para una concentración de 100 mg de Fe(III)/L en stock. Agitar suavemente hasta la disolución completa.
- Diluir cada solución estándar según la Tabla 1 para preparar las soluciones estándar de trabajo.
NOTA: Después de preparar las soluciones diarias de stock a partir de la solución de stock de 100 mg/L, esta última debe almacenarse congelada. Después de preparar las normas diarias de acuerdo con la Tabla 1, la solución de 1 mg/L debe ser alícuota en volúmenes de 1,5 ml y almacenada congelada (mejor sin aire en la parte superior) en tubos de 1,5 ml. Para cada nuevo día, se descongela un tope diario para la preparación de las normas diarias y se retira después de su uso.
| Inicio de la concentración | Volumen de pipeteo | Llenar con agua Milli-Q | Concentración resultante | Volumen final | Uso de la solución |
| 100 mg/L | 50 l | 4950 l | 1 mg/L | 50 mL | Solución de stock diario |
| 1 mg/L | 200 l | 1800 l | 100 g/L | 2 mL | Estándar |
| 100 g/L | |||||
| 1 mg/L | 100 l | 1900 l | 50 g/L | 2 mL | Estándar |
| 50 g/L | |||||
| 1 mg/L | 50 l | 1950 l | 25 g/L | 2 mL | Estándar |
| 25 g/L | |||||
| 1 mg/L | 25 l | 1975-L | 12,5 g/L | 2 mL | Estándar |
| 12,5 g/l | |||||
| 1 mg/L | 20 l | 1980-L | 10 g/L | 2 mL | Estándar |
| 10 g/L | |||||
| 0 | 2000 l | 0 g/L | 2 mL | Blanco |
Cuadro 1: Esquema de pipeteo para la preparación de las normas.
- Lito de celda SH-SY5Y
NOTA: El lysate celular (SH-SY5Y) sirvió como biomatriz relevante para Fe(II)/(III) para mostrar el rendimiento y la fiabilidad del método.- Utilice el lysate de los experimentos que se estaban ejecutando anteriormente16. Siga esta preparación de izado celular evitando cambios en el pH o productos químicos que podrían afectar el equilibrio redox. Utilice un tampón de lysica de ensayo de radioinmunoprecipitación modificado (RIPA) (PH PBS 7.4, 0,5% desoxicolato de sodio, 1% NP-40), evitando quelantes metálicos (como EDTA), agentes reductores (como TDT, 2-Mercaptoetanol) y detergentes tensioactivos aniónicos y agentes metalantes (como SDS) para minimizar las alteraciones posteriores a la recolección de la relación Fe(II)/Fe(III).
- Trabajar bajo una N2-atmósfera inhibida oxidación por O2 del aire ambiente y trabajar en hielo para minimizar cualquier autoxidación hasta que el izado se almacenó tan pronto como sea posible a -80 oC bajo la atmósfera de nitrógeno.
3. Configuración de instrumentos para la separación de sílabas de CE a ICP-MS
- Configure el instrumento de electroforesis capilar.
NOTA: Para esta sección, el lector se refiere principalmente al manual del instrumento respectivo disponible en el laboratorio.- Instale un capilar con una longitud adecuada para llegar desde el vial de entrada del instrumento CE hasta el nebulizador de ICP-MS. Instale el capilar solamente en el lado de entrada y lléelo fuera del instrumento hacia la interfaz CE-ICP-MS.
NOTA: Para la separación por sílabas CE a ICP-MS, en este protocolo se instaló un capilar de sílice fusionado de 90 cm (ID 50 m) de acuerdo con la descripción general de la configuración instrumental. Típicamente, se necesitarán tamaños capilares de 70 a 100 cm, dependiendo de la posición de los instrumentos en el laboratorio. - Desactive el elevador de salida del instrumento CE en el software para un funcionamiento suave, ya que no está en uso cuando el capilar se dirige fuera a la interfaz CE-ICP-MS.
- Instale un cable de disparo desde el activador-OUT del instrumento CE para el activador-IN del instrumento ICP-MS.
- Seleccione posiciones para todas las soluciones necesarias (20 mM HCl, 0,05 mM HCl, 12% TMAH), estándares y muestras en el rotor de muestras y soluciones del instrumento y defina sus posiciones en el software de instrumentos como de costumbre (consulte el manual del instrumento).
- Seleccione la temperatura del rotor y del capilar para que sean idénticas a 20 oC, por ser idénticas a la temperatura controlada del laboratorio.
NOTA: No se produce gradiente de temperatura a las partes capilares dentro y fuera del instrumento CE.
- Instale un capilar con una longitud adecuada para llegar desde el vial de entrada del instrumento CE hasta el nebulizador de ICP-MS. Instale el capilar solamente en el lado de entrada y lléelo fuera del instrumento hacia la interfaz CE-ICP-MS.
- Configurar el instrumento ICP-MS
- Optimice el instrumento ICP-MS de acuerdo con los procedimientos diarios de configuración y operación estándar instrumental. Utilice el protocolo del fabricante.
- Utilice la tecnología de celda de reacción dinámica (DRC) con NH3 como gas DRC, con 0,6 ml/min NH3–flujo y valor RPq a 0,45.
NOTA: Para la especiación de hierro, un método se programa con 56Fe, siendo el isótopo Fe más abundante (91.754% de abundancia relativa), sin embargo, siendo severamente interferido desde el [40Ar16O]+ cluster. Un ICP-MS basado en cuadrúpedo en modo estándar es prácticamente ciego y el detector en desbordamiento en este isótopo. Con los ajustes anteriores (ver paso 3.2.2), se logran líneas de base bajas y alta sensibilidad (para la determinación total regular del hierro LOD en el rango bajo de ng/L se logra). - Elija un ajuste de tiempo de permanencia por isótopo a 50 ms para monitorear incluso los picos agudos y cortos que aparecen durante la separación CE.
- Programe el método ICP-MS para que el instrumento CE inicie el disparador.
- Configure la interfaz CE-ICP-MS
NOTA: Hay principalmente dos opciones para conectar el CE-capilar al ICP-MS. Siga las descripciones proporcionadas sobre la configuración si se utiliza una interfaz comercial. Este protocolo utiliza una interfaz sencilla y casera basada en una publicación anterior después de modificaciones20. Los problemas clave son una nebulización eficiente con posiblemente menos dilución del eflujo capilar, además de la adopción del caudal general al nebulizador para una mejor nebulización. Además, la minimización de un flujo de aspiración a través de la separación del capilar causada por la autoexación del nebulizador, y la conexión eléctrica del electrodo de salida a tierra al extremo capilar son obligatorios.- Selección de nebulizadores
- Utilice un nebulizador concéntrico con bajo volumen de autoa aspiración (p. ej., 100 l/min) que se ajuste a una cámara de pulverización de bajo volumen.
NOTA: La baja absorción causará sólo una dilución moderada del eflujo capilar paralelo a la nebulización aún optimizada. La conexión eléctrica del electrodo de salida se realiza mediante un flujo de electrolitos alrededor del electrodo de salida y alrededor del extremo capilar. - Utilice la autoexación del nebulizador para minimizar la succión a través del capilar separador y para la adopción del caudal al valor óptimo que necesita el nebulizador.
- Prepare las siguientes piezas de la Tabla 2 para montar esta interfaz casera.
- Utilice un nebulizador concéntrico con bajo volumen de autoa aspiración (p. ej., 100 l/min) que se ajuste a una cámara de pulverización de bajo volumen.
- Configuración de la interfaz simple
NOTA: Utilice la Figura 1 para seguir la descripción del montaje de la pieza para la interfaz simple. Los números de la Figura 1 y del texto siguiente se refieren a los números del Cuadro 2.- Comience a montar la interfaz conectando los dos conectores Luer hembra de 3 vías (No 3) con un conector Luer de cono macho (No 4). Conecte el extremo izquierdo de la barra Luer inferior de 3 vías al conector macho y eso a la conexión central del Luer superior de 3 vías.
- Coloque un tubo de 1 cm (No 1) sobre el cable Pt (No 7) y un tubo de silicona de 1 cm (No 5) sobre este último y la boquilla de un conector Luer macho (no 2). Fije el ensamblaje a la conexión central del conector Luer inferior de 3 vías (No 3) mediante la rotación de tornillo típica de Luer.
- Empuje un tubo de 1 cm (No.1) sobre el extremo de salida del capilar CE y colótelo a unos 8-9 cm del extremo.
- Coloque un tubo de silicona de 1 cm (No 5) sobre este último y la boquilla de un conector Luer macho (No 2).
- Coloque todo el conjunto desde la izquierda a través de la barra del conector superior de 3 vías-T y fije el conector Luer macho y el extremo izquierdo del conector Luer hembra de 3 vías (No. 3) por rotación de tornillo típica de Luer.
- Fije el tubo de silicona de 25 cm (No 5) en la boquilla de un conector Luer macho (No 2) y fije todo el conjunto en el extremo inferior (derecho) de la barra desde el conector Luer inferior de 3 vías (No.3) mediante la rotación de tornillo típica de Luer.
- Tome el tubo de silicona de 1 cm (No.6) y empújelo 5 mm sobre el extremo del nebulizador firmemente mientras que el segundo conector de cono Luer macho (No. 4) está firmemente conectado a la parte saliente del tubo de silicona.
- Mueva la parte de la interfaz montada anteriormente posteriormente con el capilar CE saliente al cono macho en el nebulizador. Inserte el capilar CE cuidadosamente a través del cono masculino y más a través de la parte más ancha del capilar del nebulizador hasta que este último se estreche. Dado que la longitud sobresaliente del capilar fue elegida adecuadamente, el conector Luer hembra superior de 3 vías ahora también se ajusta firmemente al cono macho.
- Corrija la longitud de la longitud capilar saliente si es necesario, moviendo el capilar (hacia adelante/hacia atrás) en el tubo (no 1) donde entra en la interfaz auto-hecha.
NOTA: La posición óptima del capilar CE al principio del capilar del nebulizador no es demasiado crítica. Sin embargo, no empuje el capilar CE demasiado cerca de la parte estrecha del capilar nebulizador. Esto podría obstaculizar o bloquear el flujo de electrolitos de salida. Además, esto interrumpiría la conexión eléctrica al electrodo de salida y aumentaría la succión a través del capilar CE, lo que resultaría en una separación perturbada. A su vez, no mantenga el extremo capilar CE demasiado lejos del capilar nebulizador, ya que entonces los picos separados afilados se ampliarían y la resolución se perderá. - Utilice una lente para identificar la mejor posición.
NOTA: La Figura 1 (abajo a la derecha) muestra la posición óptima del CE-capilar dentro del nebulizador.
- Selección de nebulizadores

Figura 1: Esquema y montaje de la interfaz CE-ICP-MS. El esquema identifica las piezas individuales para el montaje escalonado de la interfaz CE-ICP-MS simple y barata. La ventana muestra una foto de posicionamiento óptimo del CE-capilar en el nebulizador. Haga clic aquí para ver una versión más grande de esta figura.
| No. | Parte | utilizado para |
| 1 | Tubo (código de color verde-naranja), 2 x aprox. 1 cm | fijación del electrodo capilar y de salida CE en las piezas de Luer y mantener apretado |
| 2 | Luer, macho, 3 x, adecuado para tubos de silicona ID de 1,6 mm | conexión del tubo de silicona al electrolito de salida y como ayuda para la fijación del capilar CE y el electrodo de pt-alambre |
| 3 | 3 vías-Luer, hembra, 2 x | Piezas en T para conectar el electrodo, el flujo capilar y el flujo de salida aspirado |
| 4 | Cono Luer, macho, 2 x | conectar Luers hembra entre sí y con el nebulizador |
| 5 | Tubo de silicona, ID de 1,6 mm, pared de 0,8 mm, 2 x 1 cm, 1x ca. 25 cm | a) 1cm; estrechamiento CE capilar a interfaz, b) 1cm; apretando Pt-wire a la interfaz c) 25 cm; conexión desde el matraz de electrolito de salida a la interfaz |
| 6 | Tubo de silicona, ID de 3 mm, pared de 1,2 mm, aprox.1 cm | estrechamiento del cono luer al nebulizador |
| 7 | Alambre de platino | Electrodo de salida |
Tabla 2: Piezas para construir la interfaz CE-ICP-MS simple y auto-hecha. Los números se refieren también a la Figura 1 y a la descripción en el texto.
4. Preparación para la medición
NOTA: Antes de la medición, el capilar debe lavarse con una solución alcalina fuerte (aquí: 12% TMAH) para la limpieza y luego llenarse con electrolito de fondo. Para una mejor separación, se construye un sándwich de búfer de apilamiento alrededor de la muestra en función de los gradientes de conductividad y pH. El Cuadro 3 resume los pasos de preparación consecutivos del capilar, que son procesados automáticamente por el instrumento según el método programado:
| Paso-No | Paso | Química | Condición |
| Preparación de la columna CE | |||
| Preparación 1 | Limpieza capilar | 12 % TMAH | 4 bar, 1 min. |
| Preparación 2 | Purga capilar con electrolito de fondo | 20 mM HCl | 4 bar, 1 min. |
| Preparación 3 | Apilamiento: electrolito líder | 12 % TMAH | 150 mbar, 3 s |
| Preparación 4 | Inyección | Muestra | 150 mbar, 3 s |
| Preparación 5 | Apilamiento: terminación de electrolito | 0.05 mM HCl | 150 mbar, 3 s |
Tabla 3: Pasos de preparación capilar antes de la medición. Estos pasos se programan con el software del sistema CE en el método CE e incluyen la inyección de muestra presurizada y la acumulación de un "sándwich de apilamiento" alrededor de la muestra.
- Programe un método CE, que está ejecutando consecutivamente los pasos indicados en el Cuadro 3.
- Defina una tabla de muestra y una secuencia en el software CE y copie esta secuencia también en el software ICP-MS.
5. Medición y evaluación de datos
- Inicie el método en el instrumento CE. Después de la preparación programada y el llenado del capilar, la medición comienza automáticamente tan pronto como el vial de entrada, que contiene 20 mM HCl, está en posición en la entrada capilar. El "Start-trigger" se envía al ICP-MS, que inicia el monitoreo en línea de los Fe-isótopos.
NOTA: La separación utiliza una tensión de +25 kV. La longitud extendida del capilar, necesaria para conectar el instrumento CE a ICP-MS, hace que el tiempo de separación se incremente innecesariamente. Por lo tanto, la separación está soportada por una baja presión de 250 mbar en la entrada. El electrolito auto-aspirado en la salida es de 5 mM HCl. El análisis total dura 3 minutos para muestras con conductividad moderada. En la ventana de señal del software ICP-MS se puede observar el electroferograma durante la ejecución. Al final de cada muestra, se generan automáticamente dos archivos de datos, uno al que solo se puede acceder desde el software de instrumentos desde el banco de datos interno, uno segundo en la carpeta de exportación en formato ".xl" o ".txt", al que se puede acceder mediante la función de importación desde el software de cromatografía regular. - Consulte el manual de software del instrumento ICP-MS para exportar los archivos al software de cromatografía.
Resultados
Mediciones de normas y calibración
Los tiempos de migración fueron aclarados por inyecciones estándar únicas: el estándar Fe(III) fue monitoreado a 118 s del tiempo de migración y el estándar Fe(II) a 136 s de tiempo de migración. Los límites de detección se calcularon utilizando un criterio de 3o en referencia al ruido basal y una concentración estándar de 50 g/L. LOD(Fe(II) fue de 3,1 g/L y LOD(Fe(III) fue de 3,2 g/L. La calibración basada en el área de pico para ambas especies de hierro fue lineal desde el LOD hasta 150 g/L. Mientras que la linealidad de Fe(III) se demostró también para una mayor concentración, la pendiente de la curva de calibración para Fe(II) disminuyó. Se consideró que un límite de concentración superior de 150 g/l era suficiente, ya que las biogenesuciones pertinentes para la determinación de Fe(II)/(III) suelen tener una concentración de Fe más baja. En caso de mayor concentración, las muestras pueden diluirse en consecuencia. La calibración de altura de pico se comprobó hasta 600 g/L y mostró linealidad en todo el rango probado. Esto se muestra en la figura 2.
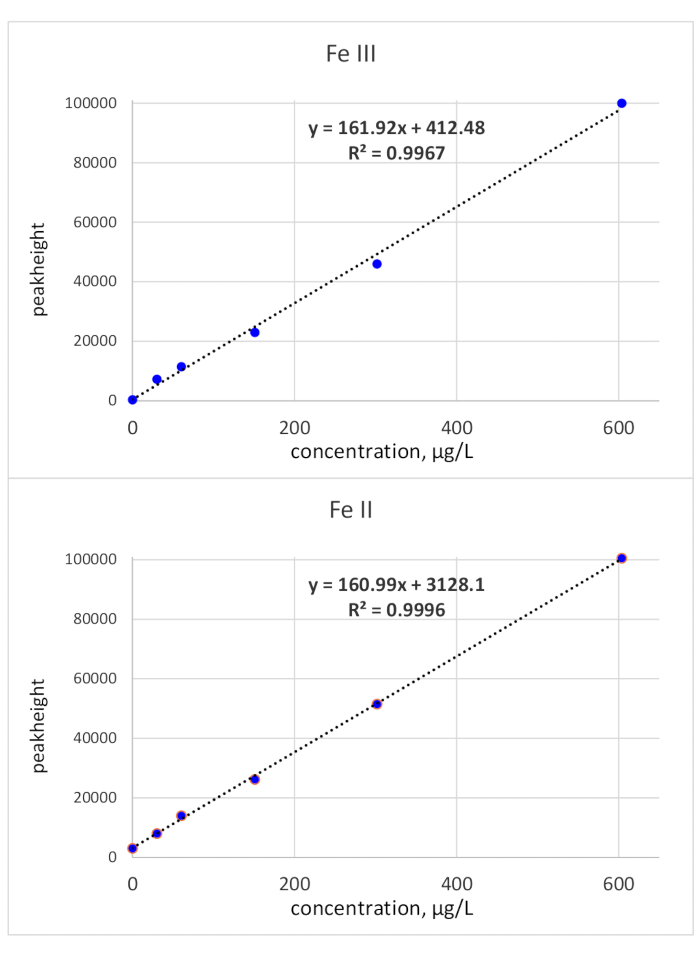
Figura 2: Curvas de calibración (altura máxima) de Fe(III) y Fe(II). Las calibraciones relacionadas con la altura máxima de ambas especies de Redox Fe son lineales con una pendiente de aproximadamente 161 *X Haga clic aquí para ver una versión más grande de esta figura.
Análisis del lito de célula SH-SY5Y
El análisis del lito celular SH-SY5Y mostró una migración ligeramente más lenta para las especies de redox de hierro debido a la conductividad algo mayor. Fe(III) fue monitoreado a 124 s del tiempo de migración, Fe(II) a 158 s del tiempo de migración. La precisión del tiempo de migración en el lito de celda SH-SY5Y fue del 2% para Fe(III) y del 3% para Fe(II). Las mediciones cuantitativas Fe(II) y Fe(III) utilizando este método revelaron una concentración Fe(III) de 330 g/L y fe(II) concentración de 84 g/L, que resultó en una relación Fe(II)/Fe(III) de 0,25. El electroferograma fe selectivo respectivo 56se muestra en la Figura 3.
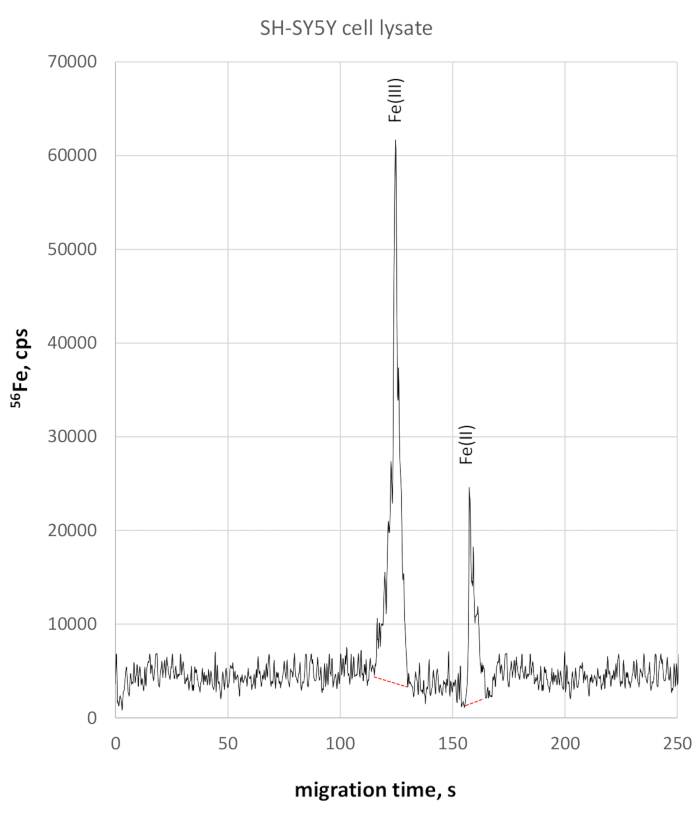
Figura 3: 56Electroferograma fe-específico de lito de célula SH-SY5Y. Fe(III) es monitoreado a 123 s alcanzando 58025 cps altura pico, estando claramente separado de Fe(II) a 158 s, alcanzando 22800 cps Por favor haga clic aquí para ver una versión más grande de esta figura.
Discusión
Dado que el hierro desempeña un papel destacado en la progresión del sistema operativo, facilitando así la disfunción mitocondrial o FTP, en este artículo se presenta un método cuantitativo versátil basado en CE-ICP-MS para la especiación simultánea Fe(II)/Fe(III) y su aplicación se demuestra ejemplarmente en los linsatos celulares. El método proporcionó un breve tiempo de análisis y las cifras de mérito (LOQ, precisión, recuperación) son adecuados para muestras relevantes para la especiación de redox de hierro específicamente en la investigación neurodegenerativa y el cáncer. En comparación con los métodos anteriores basados en LC, este método basado en CE es prácticamente independiente de los lotes de columnas y los problemas de reproducibilidad observados anteriormente después del cambio de columna LC. La preparación capilar antes de cada carrera es de <4 minutos y el tiempo de análisis por muestra con salinidad moderada hasta 3 min. Aparte de la carga y el tamaño de las moléculas, el tiempo de migración en CZE depende de la conductividad en el tapón de la muestra, lo que provoca variaciones o cambios en el tiempo de migración cuando las propias muestras influyen considerablemente en la conductividad. Tales cambios en el tiempo de migración son bien conocidos en la electroforesis capilar. Este es un problema inmanente de CZE, conocido de la literatura21,22. Las normas y los licatos celulares SH-SY5Y tenían una conductividad moderada y homogénea. En consecuencia, los tiempos de migración mostraron pocos cambios con buena precisión. Sin embargo, para muestras con alta conductividad, se pueden observar tiempos de migración prolongados hasta 5 min. Por lo tanto, se recomiendan adiciones estándar para la identificación clara de especies.
Un problema crítico en la especiación de redox de hierro es la estabilidad de la especie (es decir, el mantenimiento de los equilibrios Fe(II)/(III) durante la preparación de la muestra8,13. El pH inapropiado o los productos químicos quelantes, así como las condiciones de almacenamiento inadecuadas, como el oxígeno (aire) en contacto con la muestra o una rotura en el almacenamiento congelado en profundidad, pueden cambiar fácilmente el equilibrio Fe(II)/(III). Por lo tanto, para la preparación de los lissatos celulares SH-SY5Y, se eligió un tampón de lysis sin ningún producto químico quelante, pH fisiológico, pero se aplicó una recubrimiento de gas inerte durante la preparación de la muestra, en recipientes de muestra y congelación profunda inmediata para estas muestras.
En la literatura, se pueden encontrar enfoques semicuantitativos para monitorear Fe(II). Para una mejor comprensión del papel del hierro en el estrés oxidativo, varios grupos de investigación desarrollaron sondas específicas de Fe(II) para monitorear y visualizar semicuantitativamente la elevación aberrante del hierro ferroso in vitro. Sin embargo, es importante tener en cuenta que estas sondas no consideran Fe(III) y no cuantifican sino que informan sólo "más" o "menos" Fe(II)). Hasta la fecha, sólo unos pocos biomarcadores están disponibles para determinar el sistema operativo y el FPT, debido a la falta de métodos fiables para cuantificar simultáneamente las especies de redox Fe(II)/Fe(III)23,,24. Teniendo esto en cuenta, el método presentado -facilitando la cuantificación rápida de ambos, Fe(III) y Fe(II) en una sola ejecución - puede convertirse en una herramienta prometedora para profundizar la visión de los procesos moleculares dependientes del hierro.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
VV fue apoyado por la beca de investigación intramuros (Forschungsf-rderung) del Centro Médico Universitario de Gotinga y el programa de investigación Else Kr'ner del Else Kr'ner-Fresenius-Stiftung.
Materiales
| Name | Company | Catalog Number | Comments |
| CE capillary | CS-Chromatographie Service, Langerwehe, Germany | 105180-25 | |
| CE system | PrinCe technolgies | 0005.263 | model PrinCe 760 |
| Conical Superclear Tubes 15 ml | Analytics-shop.com by Altmann Analytik | PEN0777704 | |
| Conical Superclear Tubes 50 ml | Analytics-shop.com by Altmann Analytik | PEN0777694 | |
| FeCl2 * 4H2O | Merck | 103861 | |
| FeCl3 | Merck | 803945 | |
| Fluidflex Silikon HG-Schlauch | ProLiquid | 4001106HG | |
| Fused silica capillary OD 360 µm, ID 50 µm | Chromatographie Service GmbH | 105180-25 | |
| hydrochloric acid, 1 M | Merck | 1101652500 | corrosive |
| ICP-MS | Perkin Elmer | N814003 | |
| Luer, 3-way female | BioRad | 7318229 | |
| Luer, cone male | neoLab Migge | 2-1895 | |
| Luer, male | neoLab Migge | 2-1880 | |
| Peakfit peak evaluation software | Systat | PeakFit 4.12 | |
| Pt-wire | Carl Roth | 0737.1 | |
| PVC tube | ProLiquid | 6000002 | |
| RIPA buffer | Abcam | ab156034 | |
| Tetramethylammoniumhydroxide, 25 % | Merck | 814748 | corrosive |
| TYGON-tube R-3607 | ProLiquid | 3700203A |
Referencias
- Hare, D. J., et al. Is early-life iron exposure critical in neurodegeneration. Nature Reviews Neurology. 11 (9), 536-544 (2015).
- Ashraf, A., Clark, M., So, P. W. The Aging of Iron Man. Frontiers in Aging Neuroscience. 10, (2018).
- Hare, D. J., Cardoso, B. R., Szymlek-Gay, E. A., Biggs, B. A. Neurological effects of iron supplementation in infancy: finding the balance between health and harm in iron-replete infants. Lancet Child Adolesc Health. 2 (2), 144-156 (2018).
- Torti, S. V., Torti, F. M. Iron and cancer: more ore to be mined. Nature Reviews Cancer. 13 (5), 342-355 (2013).
- Kehrer, J. P. The Haber-Weiss reaction and mechanisms of toxicity. Toxicology. 149 (1), 43-50 (2000).
- Gaschler, M. M., Stockwell, B. R. Lipid peroxidation in cell death. Biochemical and Biophysical Research Communications. 482 (3), 419-425 (2017).
- Michalke, B., Halbach, S., Nischwitz, V. JEM Spotlight: Metal speciation related to neurotoxicity in humans. Journal of Environmental Monitoring. 11 (5), 939-954 (2009).
- Solovyev, N., Vinceti, M., Grill, P., Mandrioli, J., Michalke, B. Redox speciation of iron, manganese, and copper in cerebrospinal fluid by strong cation exchange chromatography - sector field inductively coupled plasma mass spectrometry. Analytica Chimica Acta. 973, 25-33 (2017).
- Lee, H. J., et al. Effect of excess iron on oxidative stress and gluconeogenesis through hepcidin during mitochondrial dysfunction. Journal of Nutritional Biochemistry. 26 (12), 1414-1423 (2015).
- Dixon, S. J., Lemberg, K. M., Lamprecht, M. R., Skouta, R., Zaitsev, E. M., Gleason, C. E., et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death. Cell. 149 (5), 1060-1072 (2012).
- Stockwell, B. R., et al. Ferroptosis: A Regulated Cell Death Nexus Linking Metabolism, Redox Biology, and Disease. Cell. 171 (2), 273-285 (2017).
- Michalke, B., Berthele, A., Mistriotis, P., Ochsenkuhn-Petropoulou, M., Halbach, S. Manganese speciation in human cerebrospinal fluid using CZE coupled to inductively coupled plasma MS. Electrophoresis. 28 (9), 1380-1386 (2007).
- Fernsebner, K., Zorn, J., Kanawati, B., Walker, A., Michalke, B. Manganese leads to an increase in markers of oxidative stress as well as to a shift in the ratio of Fe(II)/(III) in rat brain tissue. Metallomics. 6 (4), 921-931 (2014).
- Neth, K. . Manganese: Species Pattern and Mechanisms of Brain Injury. , (2015).
- Neth, K., et al. Changes in Brain Metallome/Metabolome Pattern due to a Single i.v. Injection of Manganese in Rats. Plos One. 10 (9), (2015).
- Venkataramani, V., et al. Manganese causes neurotoxic iron accumulation via translational repression of Amyloid Precursor Protein (APP) and H-Ferritin. Journal of Neurochemistry. 147 (6), 831-848 (2018).
- Willkommen, D., Lucio, M., Schmitt-Kopplin, P., Gazzaz, M., Schroeter, M., Sigaroudi, A., Michalke, B. Species fractionation in a case-control study concerning Parkinson's disease: Cu-amino acids discriminate CSF of PD from controls. Journal of Trace Elements in Medicine and Biology. 49, 164-170 (2018).
- Thibault, P., Dovichi, N. J., Camilleri, P. General instrumentation and detection systems including mass spectrometry. Capillary Electrophoresis - Theory and Practice. , 23-89 (1998).
- Iliff, J. J., et al. A Paravascular Pathway Facilitates CSF Flow Through the Brain Parenchyma and the Clearance of Interstitial Solutes, Including Amyloid beta. Science Translational Medicine. 4 (147), (2012).
- Michalke, B. Manganese speciation using capillary electrophoresis-ICP-mass spectrometry. Journal of Chromatography A. 1050 (1), 69-76 (2004).
- Kuhn, R., Hofstetter-Kuhn, S. . Capillary electrophoresis: Principles and practice. , (1993).
- Michalke, B. Capillary electrophoretic methods for a clear identification of selenoamino acids in complex matrices such as human milk. Journal of Chromatography A. 716 (1-2), 323-329 (1995).
- Yang, W. S., et al. Regulation of ferroptotic cancer cell death by GPX4. Cell. 156 (1-2), 317-331 (2014).
- Shimada, K., Hayano, M., Pagano, N. C., Stockwell, B. R. Cell-Line Selectivity Improves the Predictive Power of Pharmacogenomic Analyses and Helps Identify NADPH as Biomarker for Ferroptosis Sensitivity. Cell Chemical Biology. 23 (2), 225-235 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados