Method Article
Aufbau der Kapillarelektrophorese-Induktiv gekoppelte Plasmamassenspektrometrie (CE-ICP-MS) zur Quantifizierung von Eisenredoxarten (Fe(II), Fe(III))
In diesem Artikel
Zusammenfassung
Diese Eisen-Redox-Speziation methode basiert auf kapillarer Elektrophorese-induktiv gekoppelte Plasma-Massenspektrometrie mit Probenstapelung kombiniert mit kurzer Analyse in einem Durchlauf. Die Methode analysiert schnell und bietet niedrige Quantifizierungsgrenzen für Eisen-Redox-Arten in einer Vielzahl von Geweben und Biofluidproben.
Zusammenfassung
Dyshomöostase des Eisenstoffwechsels wird im pathophysiologischen Rahmen zahlreicher Krankheiten, einschließlich Krebs und mehrerer neurodegenerativer Erkrankungen, berücksichtigt. Übermäßiges Eisen führt zu freier Redox-aktiver Fe(II) und kann verheerende Auswirkungen innerhalb der Zelle wie oxidativen Stress (OS) und Tod durch Lipidperoxidation, bekannt als Ferroptose (FPT), verursachen. Daher sind quantitative Messungen von Eiseneisen (Fe(II)) und Eisen aus Eisen (Fe(III)) anstelle der vollständigen Fe-Bestimmung der Schlüssel für einen genaueren Einblick in diese schädlichen Prozesse. Da Fe(II)/(III)-Bestimmungen durch schnelle Redox-Zustandsverschiebungen und niedrige Konzentrationen in relevanten Proben wie Zerebrospinalflüssigkeit (CSF) behindert werden können, sollten Methoden zur Verfügung stehen, die schnell analysieren und niedrige Quantifizierungsgrenzwerte (LOQ) liefern. Die Kapillarelektrophorese (CE) bietet den Vorteil einer schnellen Fe(II)/Fe(III)-Trennung und arbeitet ohne stationäre Phase, die das Redoxgleichgewicht stören oder anlytzum Haften der Analytverursachen kann. CE in Kombination mit induktiv gekoppelter Plasma-Massenspektrometrie (ICP-MS) als Detektor bietet eine weitere Verbesserung der Erkennungsempfindlichkeit und Selektivität. Das vorgestellte Verfahren verwendet 20 mM HCl als Hintergrundelektrolyt und eine Spannung von +25 kV. Spitzenformen und Konzentrationsdetektionsgrenzwerte werden durch Leitfähigkeits-pH-Stacking verbessert. Zur Reduktion von 56[ArO]+wurde ICP-MS im dynamischen Reaktionszellmodus (DRC) mit NH3 als Reaktionsgas betrieben. Das Verfahren erreicht eine Nachweisgrenze (LOD) von 3 g/L. Durch Stapeln waren höhere Injektionsvolumina möglich, ohne die Trennung zu behindern, aber die LOD zu verbessern. Die Kalibrierungen im Zusammenhang mit der Spitzenfläche waren linear bis zu 150 g/L. Die Messgenauigkeit betrug 2,2% (Fe(III)) bis 3,5% (Fe(II)). Die Migrationszeitgenauigkeit betrug <3% für beide Arten, bestimmt in 1:2 verdünnten Lysaten menschlicher Neuroblastomzellen (SH-SY5Y). Wiederherstellungsexperimente mit Standardzusatz ergaben eine Genauigkeit von 97 % Fe(III) und 105 % Fe(II). In realen Bioproben wie CSF kann die Migrationszeit je nach unterschiedlicher Leitfähigkeit (d. h. Salzgehalt) variieren. Somit wird die Spitzenidentifikation durch Standardaddition bestätigt.
Einleitung
Heute ist es am deutlichsten, dass eisenvermittelter oxidativer Stress (OS) eine entscheidende Rolle bei mehreren Erkrankungen spielt, insbesondere bei neurodegenerativen Hirnerkrankungen, wie Alzheimer und Parkinson sowie bei Krebs1,2,3,4. OS ist eng mit dem Zustand und dem Gleichgewicht des Redox-Paares Fe(II)/Fe(III) verwandt. Während Fe(III) Redox-inaktiv ist, erzeugt Fe(II) potent reaktive Sauerstoffspezies (ROS) durch Katalysierung der Zersetzung von H2O2, gefolgt von Hydroxylradikalproduktion und Membranlipidperoxidation5,6. Auf molekularer Ebene sind Fe(II)-generierte ROS und peroxidierte Phospholipide ein starker Angriff auf die Integrität von Proteinen, Lipiden und DNA7,8. Eine solche schädliche zelluläre Dysfunktion wurde gezeigt, um mitochondriale Dysfunktion mit vermindertem ATP-Gehalt9 zu induzieren und kann sogar einen programmierten nekrotischen Zelltod auslösen, bekannt als Ferroptose (FPT)10,11. Daher ist die quantitative Fe(II)/(III)-Redox-Speziation bei einem breiten Spektrum von Redox-bedingten Störungen von herausragender Bedeutung.
Chemische Speziation ist ein etabliertes Werkzeug für die Untersuchung von Spurenelementen biologische Rolle und Stoffwechsel im Allgemeinen7,8 sowie in neurodegenerativen Bedingungen12,13,14,15,16,17. Methoden zur Fe-Redox-Speziation, die in der Literatur gefunden werden, basieren in der Regel auf der Flüssigkeitschromatographie (LC) Trennung. Einige der Literatur verwenden induktiv gekoppelte Plasma-Massenspektrometrie (ICP-MS) als Element selektiven Detektor. Bei routinemäßigen LC-Arbeiten waren jedoch zwischen den Läufen übermäßige Reinigungszeiten erforderlich. Noch problematischer ist, dass batch-to-batch Variation von LC-Spalten eine Erneutoptimierung der Elutionsbedingungen nach jedem Spaltenwechsel erzwungen. Diese Probleme behindern den hohen Durchsatz. Zusätzliche Zeit ist erforderlich, um akzeptable Zuverlässigkeit zu gewinnen und die Methode erneut gründlich zu bewerten.
Um diese Nachteile zu umgehen, wird hier eine Methode für fe(II)/Fe(III)-Redox-Speziation auf der Grundlage der kapillaren Elektrophorese induktiv gekoppelten Plasmamassenspektrometrie (CE-ICP-MS) vorgestellt. CE bietet im Vergleich zu LC18verschiedene Vorteile. Kapillaren haben keine stationäre Phase und hängen daher (fast) nicht von der Chargenidentität ab. Wenn sie älter oder blockiert sind, werden sie schnell ersetzt, was in der Regel eine unveränderte Leistung zeigt. Die Reinigungs- und Reinigungsschritte zwischen den Proben sind wirksam und kurz, und auch die Analysezeit pro Probe ist kurz.
Die vorgestellte Methode ist zuverlässig mit guten Verdienstzahlen. Als Proof-of-Prinzip wird die Methode auf humanes dopaminerges Neuroblastom (SH-SY5Y) Zelllysat angewendet, ein Probentyp, der für die Neurodegeneration sowie die Krebsforschung wichtig ist19.
Protokoll
VORSICHT: Das Verfahren verwendet Salzsäure (HCl, beginnende Verdünnungen aus Reinst, Konzentration 1 M) und Tetramethylammoniumhydroxid (TMAH, beginnende Verdünnungen aus Reinst, Konzentration 25%). Beide Substanzen sind stark ätzend. Verwenden Sie Haut- und Augenschutz.
1. Vorbereitung von Elektrolyten
- Vorbereitung von HCl-Elektrolyten: Hintergrundelektrolyt (20 mM HCl), Ausgangselektrolyt (5 mM HCl) und Abschlusselektrolyt (0,05 mM HCl)
- 20 mM HCl in einem 100 mL Kolben vorbereiten: Pipette 2 ml von 1 M HCl in den Kolben geben, bis zur Markierung mit Reinstwasser füllen und sanft schütteln.
- 5 mM HCl in einem 100 ml Kolben vorbereiten: Pipette 500 l von 1 M HCl in den Kolben geben, bis zur Markierung mit reinem Wasser füllen und sanft schütteln.
- 0,05 mM HCl in zwei Schritten vorbereiten: Pipette 1 ml 20 mM HCl in einen 100 mL Kolben geben und dann mit Reinstwasser bis zur Markierung füllen und sanft schütteln. Anschließend 2,5 ml der letztgenannten Lösung in ein 15 ml kegelförmiges Rohr (Materialtabelle) geben und 7,5 ml Reinstwasser hinzufügen, dann sanft schütteln.
- Vorbereiten des führenden Elektrolyts 12% TMAH in einem 15 ml kegelförmigen Rohr: Pipette 4,8 ml von 25% TMAH in die Röhre, 5,2 ml Reinstwasser hinzufügen und sanft schütteln.
HINWEIS: Der 12% TMAH wird verwendet, um die Kapillare vor jedem Lauf zu reinigen und als führender Elektrolyt vor der injizierten Probe).
2. Vorbereitung und Lagerung von Normen und Proben
- Standards
- Wiegen Sie für Fe(II) 35,61 mg Fe(II)Cl24H2O in einen 100 ml Kolben und füllen Sie bis zur 100 ml-Marke mit Reinstwasser für eine Lagerkonzentration von 100 mg Fe(II)/L. Schütteln Sie sanft bis zur vollständigen Auflösung.
- Wiegen Sie für Fe(III) 29,04 mg Fe(III)Cl3 in einen 100 ml Kolben und füllen Sie bis zur 100 ml-Marke mit Reinstwasser für eine Lagerkonzentration von 100 mg Fe(III)/L. Schütteln Sie sanft bis zur vollständigen Auflösung.
- Verdünnen Sie jede Standardlösung gemäß Tabelle 1, um die funktionierenden Standardlösungen vorzubereiten.
HINWEIS: Nach der Vorbereitung der täglichen Lagerlösungen aus der 100 mg/L-Stammlösung muss diese gefroren gelagert werden. Nach der Vorbereitung der Tagesnormen gemäß Tabelle 1muss die 1 mg/L-Stammlösung in 1,5 ml Volumen eingeflossen und gefroren (am besten ohne Luft oben) in 1,5 ml-Rohren gelagert werden. Für jeden neuen Tag wird eine tägliche Lagerkappe zur Vorbereitung der tagesnormen aufgetaut und nach Gebrauch zurückgezogen.
| Beginnen der Konzentration | Pipettiervolumen | Mit Milli-Q-Wasser auffüllen | Resultierende Konzentration | Endvolumen | Einsatz der Lösung |
| 100 mg/L | 50 l | 4950 l | 1 mg/L | 50 ml | Tägliche Lagerlösung |
| 1 mg/L | 200 l | 1800 l | 100 g/L | 2 mL | Standard |
| 100 g/L | |||||
| 1 mg/L | 100 l | 1900 'L | 50 g/L | 2 mL | Standard |
| 50 g/L | |||||
| 1 mg/L | 50 l | 1950 | 25 g/L | 2 mL | Standard |
| 25 g/L | |||||
| 1 mg/L | 25 l | 1975 | 12,5 g/L | 2 mL | Standard |
| 12,5 g/l | |||||
| 1 mg/L | 20 l | 1980-L | 10 g/L | 2 mL | Standard |
| 10 g/L | |||||
| 0 | 2000 'L | 0 g/L | 2 mL | leer |
Tabelle 1: Pipettiersystem zur Vorbereitung der Normen.
- SH-SY5Y Zelllysat
HINWEIS: Das Zelllysat (SH-SY5Y) diente als Fe(II)/(III)-relevante Biomatrix, um die Leistung und Zuverlässigkeit der Methode zu zeigen.- Verwenden Sie Lysat aus zuvor ausgeführten Experimenten16. Folgen Sie dieser Zelllysat-Präparation, um pH-Änderungen oder Chemikalien zu vermeiden, die das Redox-Gleichgewicht beeinflussen könnten. Verwenden Sie einen modifizierten Radioimmunozipier-Assay(RIPA)-Lysepuffer (PBS pH 7.4, 0,5 % Natriumdeoxycholat, 1 % NP-40), Vermeidung von Metallchelatoren (wie EDTA), Reduktionsmitteln (wie DTT, 2-Mercaptoethanol) und anionischen Tensidwaschmitteln und Metallkomplexierungsmitteln (z. B. SDS) zur Minimierung von Veränderungen nach der Sammlung des Fe(II)/Fe(III)-Verhältnisses.
- Arbeiten Sie unter einerN2-Atmosphäre,die die Oxidation durchO2 aus der Umgebungsluft hemmte, und arbeiten Sie auf Eis, um jegliche Autoxidation zu minimieren, bis das Lysat so schnell wie möglich bei -80 °C unter der Stickstoffatmosphäre gelagert wurde.
3. Einrichten von Instrumenten für die Silbentrennung von CE auf ICP-MS
- Richten Sie das Kapillarelektrophorese-Instrument ein.
HINWEIS: In diesem Abschnitt wird der Leser hauptsächlich auf das Handbuch des jeweiligen Im Labor verfügbaren Instruments verwiesen.- Installieren Sie eine Kapillare mit einer geeigneten Länge, um vom Einlassdurchstecher des CE-Instruments bis zum Vernebler von ICP-MS zu gelangen. Installieren Sie die Kapillare nur an der Einlassseite und führen Sie sie außerhalb des Instruments in Richtung CE-ICP-MS-Schnittstelle.
HINWEIS: Für die Bindestriche CE zu ICP-MS wurde in diesem Protokoll eine 90 cm geschmolzene Kieselsäurekapillare (ID 50 m) gemäß der allgemeinen Beschreibung des instrumentellen Setups installiert. In der Regel werden Kapillargrößen von 70 bis 100 cm benötigt, abhängig von der Position der Instrumente im Labor. - Deaktivieren Sie den Auslassheber des CE-Instruments in der Software für einen reibungslosen Betrieb, da er nicht in Gebrauch ist, wenn die Kapillare nach außen zur CE-ICP-MS-Schnittstelle geleitet wird.
- Installieren Sie ein Triggerkabel vom CE-Instrument trigger-OUT zum Trigger-IN des ICP-MS-Instruments.
- Wählen Sie Positionen für alle notwendigen Lösungen (20 mM HCl, 0,05 mM HCl, 12% TMAH), Standards und Proben im Proben- und Lösungsrotor des Instruments und definieren Sie deren Positionen in der Gerätesoftware wie gewohnt (siehe Handbuch des Instruments).
- Wählen Sie Rotor- und Kapillartemperatur so aus, dass sie bei 20 °C identisch ist und mit der kontrollierten Labortemperatur identisch ist.
HINWEIS: Es tritt kein Temperaturgradient zu den Kapillarteilen innerhalb und außerhalb des CE-Instruments auf.
- Installieren Sie eine Kapillare mit einer geeigneten Länge, um vom Einlassdurchstecher des CE-Instruments bis zum Vernebler von ICP-MS zu gelangen. Installieren Sie die Kapillare nur an der Einlassseite und führen Sie sie außerhalb des Instruments in Richtung CE-ICP-MS-Schnittstelle.
- Einrichten des ICP-MS-Instruments
- Optimieren Sie das ICP-MS-Instrument entsprechend den täglichen instrumentellen Standard-Setup- und Betriebsverfahren. Verwenden Sie das Protokoll des Herstellers.
- Verwenden Sie die Dynamic Reaction Cell (DRC)-Technologie mit NH3 als DRC-Gas, mit 0,6 ml/min NH3-Durchflussund RPq-Wert = 0,45.
ANMERKUNG: Für die Eisenspeziation ist eine Methode mit 56Fe programmiert, da es das am häufigsten vorkommende Fe-Isotop ist (91,754% relative Häufigkeit), jedoch stark vom [40Ar16O]+ Cluster gestört wird. Ein Quadrupol-basiertes ICP-MS im Standardmodus ist praktisch blind und der Detektor im Überlauf an diesem Isotop. Mit den obigen Einstellungen (siehe Schritt 3.2.2) werden niedrige Ausgangswerte und eine hohe Empfindlichkeit erreicht (für eine regelmäßige Gesamteisenbestimmung wird LOD im niedrigen ng/L-Bereich erreicht). - Wählen Sie eine Verweilzeiteinstellung pro Isotop bei 50 ms, um selbst scharfe und kurze Spitzen während der CE-Trennung zu überwachen.
- Programmieren Sie die ICP-MS-Methode, die vom CE-Instrument ausgelöst wird.
- Einrichten der CE-ICP-MS-Schnittstelle
HINWEIS: Es gibt hauptsächlich zwei Möglichkeiten, die CE-Kapillare an das ICP-MS anzuschließen. Befolgen Sie die bereitgestellten Beschreibungen zum Setup, wenn eine kommerzielle Schnittstelle verwendet wird. Dieses Protokoll verwendet eine einfache, hausgemachte Schnittstelle, die auf einer früheren Publikation nach Änderungen basiert.20. Schlüsselthemen sind eine effiziente Vernebelung mit möglicherweise weniger Verdünnung des Kapillarausflusses, abgesehen von der Annahme des Gesamtflusses zum Vernebler für die beste Vernebelung. Auch die Minimierung eines Saugflusses durch trennende Kapillare, die durch die Selbstaspiration vom Vernebler verursacht wird, und der elektrische Anschluss der geerdeten Auslasselektrode an das Kapillarende sind obligatorisch.- Nebulizer-Auswahl
- Verwenden Sie einen konzentrischen Vernebler mit geringem selbstaufsorlösenden Volumen (z. B. 100 l/min), der in eine Sprühkammer mit geringem Volumen passt.
HINWEIS: Die geringe Aufnahme führt nur zu einer moderaten Verdünnung des Kapillarausflusses, die parallel zur noch optimierten Vernebelung erfolgt. Der elektrische Anschluss der Auslasselektrode erfolgt durch einen Elektrolytstrom um die Auslasselektrode und um das Kapillarende. - Verwenden Sie die Selbstaspiration des Verneblers, um die Absaugung durch die trennende Kapillare zu minimieren und die Durchflussmenge auf den optimalen Wert zu bringen, den der Vernebler benötigt.
- Bereiten Sie die folgenden Teile aus Tabelle 2 vor, um diese hausgemachte Schnittstelle zu montieren.
- Verwenden Sie einen konzentrischen Vernebler mit geringem selbstaufsorlösenden Volumen (z. B. 100 l/min), der in eine Sprühkammer mit geringem Volumen passt.
- Einrichtung der einfachen Schnittstelle
HINWEIS: Verwenden Sie Abbildung 1, um der Beschreibung der Teilemontage für die einfache Schnittstelle zu folgen. Die Zahlen in Abbildung 1 und im folgenden Text beziehen sich auf die Zahlen in Tabelle 2.- Beginnen Sie mit der Montage der Schnittstelle, indem Sie die beiden 3-Wege-Buchsen Luer-Steckverbinder (Nr. 3) mit einem männlichen Kegel Luer-Stecker (Nr. 4) verbinden. Schließen Sie das linke Ende der unteren 3-Wege-Luer-Leiste an den Stecker an und das an die mittlere Verbindung des oberen 3-Wege-Luers an.
- Legen Sie ein 1 cm langes Rohr (Nr. 1) über den Pt-Draht (Nr. 7) und ein 1 cm Silikonrohr (Nr. 5) über das letztere und die Düse eines männlichen Luer-Steckers (Nr. 2). Befestigen Sie die Baugruppe an der mittleren Verbindung des unteren 3-Wege-Luer-Steckers (Nr. 3) durch Luer-typische Schneckendrehung.
- Schieben Sie ein 1 cm langes Rohr (Nr.1) über das Auslassende der CE-Kapillare und positionieren Sie es etwa 8-9 cm vom Ende entfernt.
- Legen Sie ein 1 cm großes Silikonrohr (Nr. 5) über das letztere und die Düse eines männlichen Luer-Steckers (Nr. 2).
- Legen Sie die gesamte Baugruppe von links durch die Leiste des oberen 3-Wege-T-Steckers und fixieren Sie den männlichen Luer-Stecker und das linke Ende des weiblichen 3-Wege-Luer-Steckers (Nr. 3) durch Luer-typische Schraubendrehung.
- Befestigen Sie das 25 cm lange Silikonrohr (Nr. 5) an der Düse eines männlichen Luer-Steckers (Nr. 2) und fixieren Sie die gesamte Baugruppe am unteren (rechten) Ende der Stange vom unteren 3-Wege-Luer-Stecker (Nr.3) durch Luer-typische Schraubendrehung.
- Nehmen Sie das 1 cm Silikonrohr (Nr.6) und schieben Sie es 5 mm über das Ende des Verneblers, während der zweite männliche Luer-Kegelstecker (Nr. 4) fest in den hervorstehenden Teil des Silikonrohres gesteckt wird.
- Bewegen Sie das oben montierte Interfaceteil anschließend mit der hervorstehenden CE-Kapillare an den männlichen Kegel am Vernebler. Setzen Sie die CE-Kapillare vorsichtig durch den männlichen Kegel und weiter durch den breiteren Teil der Verneblerkapillare, bis diese sich verengen. Da die hervorstehende Länge der Kapillare passend gewählt wurde, passt nun auch der obere weibliche 3-Wege-Luer-Stecker eng an den männlichen Kegel.
- Korrigieren Sie ggf. die Länge der hervorstehenden Kapillarlänge, indem Sie die Kapillare (vorwärts/rückwärts) am Rohr (Nr. 1) bewegen, wo Sie die selbstgebaute Schnittstelle betreten.
HINWEIS: Die optimale Position der CE-Kapillare am Anfang der Verneblerkapillare ist nicht allzu kritisch. Schieben Sie die CE-Kapillare jedoch nicht zu nahe an den schmalen Teil der Verneblerkapillare. Dies könnte den Auslasselektrolytfluss behindern oder blockieren. Dies würde auch den elektrischen Anschluss an die Auslasselektrode unterbrechen und die Absaugung durch CE-Kapillare erhöhen, was zu einer gestörten Trennung führen würde. Im Gegenzug halten Sie das CE Kapillarende nicht zu weit weg von der Verneblerkapillare, da dann scharfe getrennte Spitzen verbreitert würden und die Auflösung verloren ginge. - Verwenden Sie eine Linse, um die beste Position zu identifizieren.
ANMERKUNG: Abbildung 1 (unten rechts) zeigt die optimale Position der CE-Kapillare im Vernebler.
- Nebulizer-Auswahl

Abbildung 1: Schemaund und Montage der CE-ICP-MS-Schnittstelle. Der Schaltplan identifiziert die Einzelteile für die schrittweise Montage der einfachen und kostengünstigen CE-ICP-MS-Schnittstelle. Das Fenster zeigt ein Foto der optimalen Positionierung der CE-Kapillare im Vernebler. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Nein. | Teil | verwendet für |
| 1 | Schläuche (grün-orange Farbcode), 2 x ca. 1 cm | Befestigung der CE-Kapillar- und Auslasselektrode an Luer-Teilen und |
| 2 | Luer, männlich, 3 x, passend für 1,6 mm ID Silikonschläuche | Anschluss von Silikonrohr an Auslasselektrolyt und als Hilfsmittel zur Befestigung von CE-Kapillar- und Pt-Draht-Elektrode |
| 3 | 3-Wege-Luer, weiblich, 2 x | T-Stücke zum Anschluss von Elektroden-, Kapillar- und Saugaustrittsstrom |
| 4 | Luerkegel, männlich, 2 x | weibliche Luers miteinander und mit Vernebler in Verbindung zu setzen |
| 5 | Silikonrohr, 1,6 mm ID, 0,8 mm Wandleuchte, 2 x 1 cm, 1x ca. 25 cm | a) 1cm; Anschnen CE-Kapillare an Schnittstelle, b) 1cm; Anziehen von Pt-Draht an Schnittstelle c) 25 cm; Anschluss vom Auslasselektrolytkolben zur Schnittstelle |
| 6 | Silikonrohr, 3 mm ID, 1,2 mm Wandleuchte, ca.1 cm | Anziehen des Luer-Kegels zum Vernebler |
| 7 | Platindraht | Ausgangselektrode |
Tabelle 2: Teile zum Aufbau der einfachen, selbst gebauten CE-ICP-MS-Schnittstelle. Die Zahlen beziehen sich auch auf Abbildung 1 und Beschreibung im Text.
4. Vorbereitung für die Messung
HINWEIS: Vor der Messung sollte die Kapillare zur Reinigung mit einer starken alkalischen Lösung (hier: 12% TMAH) gespült und dann mit Hintergrundelektrolyt gefüllt werden. Zur verbesserungsorientierten Trennung wird ein Stapelpuffer-Sandwich um die Probe herum aufgebaut, basierend auf Leitfähigkeits- und pH-Gradienten. Tabelle 3 fasst die aufeinanderfolgenden Vorbereitungsschritte der Kapillare zusammen, die vom Instrument automatisch nach programmierter Methode verarbeitet werden:
| Step-Nein | Schritt | Chemische | Zustand |
| Vorbereitung der CE-Säule | |||
| Vorbereitung 1 | Kapillarreinigung | 12 % TMAH | 4 bar, 1 Min. |
| Prep 2 | Kapillarspülung mit Hintergrundelektrolyt | 20 mM HCl | 4 bar, 1 Min. |
| Prep 3 | Stapeln: führender Elektrolyt | 12 % TMAH | 150 mbar, 3 s |
| Prep 4 | Injektion | Beispiel | 150 mbar, 3 s |
| Prep 5 | Stapeln: Beenden des Elektrolyten | 0,05 mM HCl | 150 mbar, 3 s |
Tabelle 3: Kapillarvorbereitungsschritte vor der Messung. Diese Schritte sind mit der CE-Systemsoftware in der CE-Methode programmiert und umfassen die druckbedruckte Probeninjektion und den Aufbau eines "Stacking-Sandwiches" um die Probe herum.
- Programmieren Sie eine CE-Methode, die die in Tabelle 3angegebenen Schritte fortlaufend ausführt.
- Definieren Sie eine Beispieltabelle und -sequenz in ce-Software und kopieren Sie diese Sequenz auch in die ICP-MS-Software.
5. Messung und Datenauswertung
- Starten Sie die Methode am CE-Instrument. Nach der programmierten Vorbereitung und Befüllung der Kapillare beginnt die Messung automatisch, sobald die Einlassflasche mit 20 mM HCl am Kapillareinlass in Position ist. Der "Start-Trigger" wird an das ICP-MS gesendet, das die Online-Überwachung von Fe-Isotopen startet.
HINWEIS: Die Trennung verwendet eine Spannung von +25 kV. Die verlängerte Länge der Kapillare, die notwendig ist, um das CE-Instrument mit ICP-MS zu verbinden, führt zu einer unnötigen Erhöhung der Trennzeit. Daher wird die Trennung durch einen niedrigen Druck von 250 mbar am Einlass unterstützt. Der selbstsaugende Elektrolyt am Ausgang beträgt 5 mM HCl. Die Gesamtanalyse dauert 3 Minuten für Proben mit mäßiger Leitfähigkeit. Im Signalfenster der ICP-MS Software kann das Elektropherogramm während des Laufs beobachtet werden. Am Ende jedes Samples werden automatisch zwei Datendateien generiert, eine nur über Diegerätesoftware aus der internen Datenbank, eine zweite im Exportordner als ".xl" oder ".txt"-Format, zugänglich durch Importfunktion aus regulärer Chromatographie-Software. - Lesen Sie das Softwarehandbuch des ICP-MS-Instruments zum Exportieren der Dateien in Chromatographie-Software.
Ergebnisse
Messungen von Normen und Kalibrierungen
Die Migrationszeiten wurden durch einzelne Standardinjektionen aufgeklärt: Der Fe(III)-Standard wurde mit 118 s Migrationszeit und der Fe(II)-Standard bei 136 s Migrationszeit überwacht. Die Nachweisgrenzen wurden anhand des 3-Kriteriums berechnet, das sich auf das Ausgangsrauschen bezieht, und eine Standardkonzentration von 50 g/l. LOD(Fe(II) betrug 3,1 g/l undLOD (Fe(III) 3,2 g/l. Die Spitzenflächenkalibrierung für beide Eisenarten war linear von der LOD bis 150 g/l. Während die Linearität von Fe(III) auch für eine höhere Konzentration nachgewiesen wurde, verringerte sich die Steigung der Kalibrierkurve für Fe(II). Eine obere Konzentrationsgrenze von 150 g/l wurde als ausreichend angesehen, da Bioproben, die für die Fe(II)/(III)-Bestimmung relevant sind, in der Regel eine niedrigere Fe-Konzentration haben. Bei höherer Konzentration können die Proben entsprechend verdünnt werden. Die Spitzenhöhenkalibrierung wurde bis zu 600 g/l überprüft und zeigte Linearität über den gesamten getesteten Bereich. Dies ist in Abbildung 2dargestellt.
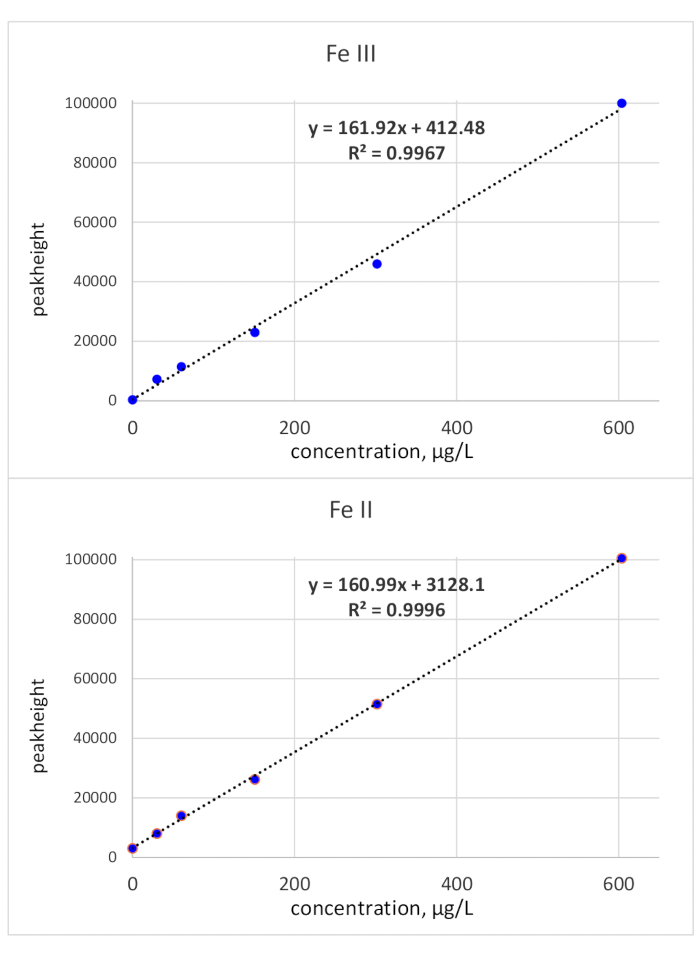
Abbildung 2: Kalibrierkurven (Spitzenhöhe) von Fe(III) und Fe(II). Spitzenhöhenbezogene Kalibrierungen beider Fe-Redox-Arten sind linear mit einer Neigung von ca. 161 *X Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Analyse von SH-SY5Y Zelllysat
Die Analyse des SH-SY5Y-Zelllysats zeigte aufgrund der etwas höheren Leitfähigkeit eine etwas langsamere Migration bei Eisenredoxarten. Fe(III) wurde mit 124 s Migrationszeit überwacht, Fe(II) mit 158 s Migrationszeit. Die Migrationszeitgenauigkeit im SH-SY5Y-Zelllysat betrug 2 % für Fe(III) und 3 % für Fe(II). Quantitative Fe(II) und Fe(III)-Messungen nach diesem Verfahren ergaben eine Fe(III)-Konzentration von 330 g/L und eine Fe(II)-Konzentration von 84 g/l, die beide zu einem Fe(II)/Fe(III)-Verhältnis von 0,25 führten. Das jeweilige 56Fe-selektive Elektropherogramm ist in Abbildung 3dargestellt.
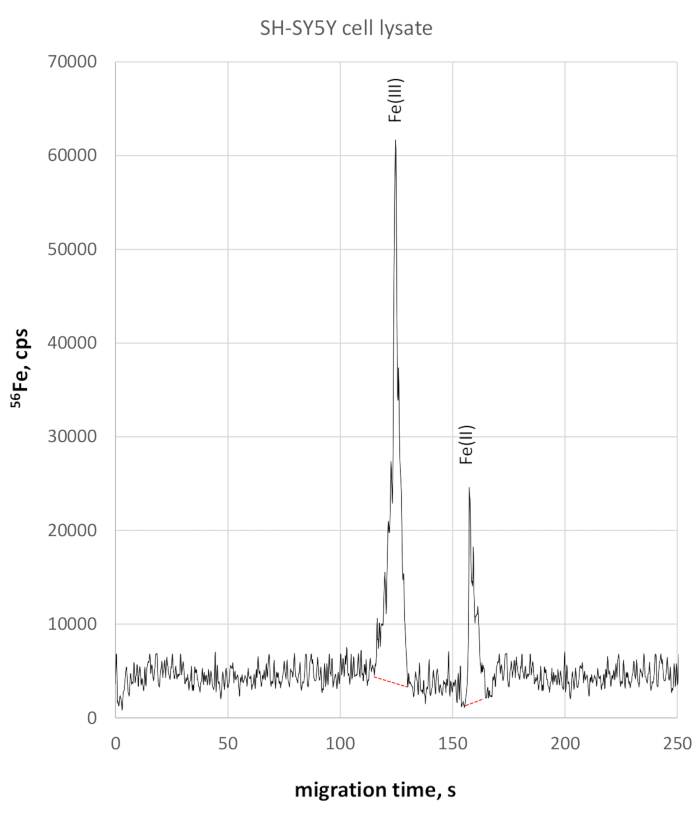
Abbildung 3: 56Fe-spezifisches Elektropherogramm des SH-SY5Y-Zelllysats. Fe(III) wird bei 123 s mit einer Spitzenhöhe von 58025 cps überwacht, wobei sie bei 158 s deutlich von Fe(II) getrennt ist und 22800 cps erreicht. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Da Eisen eine herausragende Rolle bei der OS-Progression spielt und somit die mitochondriale Dysfunktion oder FTP erleichtert, wird in diesem Artikel eine vielseitige CE-ICP-MS-basierte quantitative Methode zur gleichzeitigen Fe(II)/Fe(III)-Speziation vorgestellt und ihre Anwendung wird exemplarisch in Zelllysaten demonstriert. Die Methode lieferte kurze Analysezeit und die Leistungszahlen (LOQ, Präzision, Erholung) eignen sich für Proben, die für die Eisenredox-Speziation insbesondere in der neurodegenerativen und Krebsforschung relevant sind. Im Vergleich zu früheren Methoden, die auf LC basieren, ist diese CE-basierte Methode praktisch unabhängig von Säulenchargen und zuvor beobachteten Reproduzierbarkeitsproblemen nach LC-Spaltenwechsel. Kapillarpräparation vor jedem Lauf beträgt <4 Minuten und Analysezeit pro Probe mit moderatem Salzgehalt bis zu 3 min. Abgesehen von der Ladung und Größe des Moleküls hängt die Migrationszeit in CZE von der Leitfähigkeit am Probenstecker ab, was zu Migrationszeitschwankungen oder Verschiebungen führt, wenn Proben selbst die Leitfähigkeit erheblich beeinflussen. Solche Verschiebungen der Migrationszeit sind in der Kapillarelektrophorese bekannt. Dies ist ein CZE-immanent Problem, bekannt aus der Literatur21,22. Standards und SH-SY5Y-Zelllysate hatten eine moderate und homogene Leitfähigkeit. Folglich zeigten die Migrationszeiten nur geringe Veränderungen mit guter Präzision. Bei Proben mit hoher Leitfähigkeit können jedoch längere Migrationszeiten bis zu 5 min beobachtet werden. Daher werden Standardzusätze für eine klare Artenidentifikation empfohlen.
Ein kritisches Problem bei der Eisenredox-Speziation ist die Artenstabilität (d. h. die Aufrechterhaltung von Fe(II)/III)-Gleichgewichten) während der Probenvorbereitung8,13. Ungeeignete pH- oder Chelatchemikalien sowie ungeeignete Lagerbedingungen wie Sauerstoff (Luft) in Kontakt mit Proben oder ein Bruch der tiefgefrorenen Lagerung können das Fe(II)/(III)-Gleichgewicht leicht verändern. Daher wurde für die Herstellung von SH-SY5Y-Zelllysaten ein Lysepuffer gewählt, ohne dass cheating chemicals, physiologischer pH, aber Inertgasüberlagerung während der Probenvorbereitung, in Probenbehältern und sofortiges Tiefkühlen für diese Proben angewendet wurde.
In der Literatur findet man semiquantitative Ansätze zur Überwachung von Fe(II). Um die Rolle von Eisen im oxidativen Stress besser zu verstehen, entwickelten mehrere Forschungsgruppen Fe(II)-spezifische Sonden, um die abnorme Erhöhung von Eisen in vitro semiquantitativ zu überwachen und zu visualisieren. Wichtig zu beachten ist jedoch, dass solche Sonden Fe(III) nicht berücksichtigen und nicht quantifizieren, sondern nur "mehr" oder "weniger" Fe(II)) melden. Bis heute stehen nur wenige Biomarker zur Verfügung, um OS und FPT zu bestimmen, da es an zuverlässigen Methoden zur gleichzeitigen Quantifizierung der Rotoxarten Fe(II)/Fe(III)23,24liegt. Vor diesem Hintergrund könnte die vorgestellte Methode - die eine schnelle Quantifizierung von Fe(III) und Fe(II) in einem Durchlauf ermöglicht - zu einem vielversprechenden Instrument werden, um die Einsicht in eisenabhängige molekulare Prozesse zu vertiefen.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Unterstützt wurde vv durch das Forschungsstipendium des Universitätsklinikums Göttingen und das Else Kröner Forschungsprogramm der Else Kröner-Fresenius-Stiftung.
Materialien
| Name | Company | Catalog Number | Comments |
| CE capillary | CS-Chromatographie Service, Langerwehe, Germany | 105180-25 | |
| CE system | PrinCe technolgies | 0005.263 | model PrinCe 760 |
| Conical Superclear Tubes 15 ml | Analytics-shop.com by Altmann Analytik | PEN0777704 | |
| Conical Superclear Tubes 50 ml | Analytics-shop.com by Altmann Analytik | PEN0777694 | |
| FeCl2 * 4H2O | Merck | 103861 | |
| FeCl3 | Merck | 803945 | |
| Fluidflex Silikon HG-Schlauch | ProLiquid | 4001106HG | |
| Fused silica capillary OD 360 µm, ID 50 µm | Chromatographie Service GmbH | 105180-25 | |
| hydrochloric acid, 1 M | Merck | 1101652500 | corrosive |
| ICP-MS | Perkin Elmer | N814003 | |
| Luer, 3-way female | BioRad | 7318229 | |
| Luer, cone male | neoLab Migge | 2-1895 | |
| Luer, male | neoLab Migge | 2-1880 | |
| Peakfit peak evaluation software | Systat | PeakFit 4.12 | |
| Pt-wire | Carl Roth | 0737.1 | |
| PVC tube | ProLiquid | 6000002 | |
| RIPA buffer | Abcam | ab156034 | |
| Tetramethylammoniumhydroxide, 25 % | Merck | 814748 | corrosive |
| TYGON-tube R-3607 | ProLiquid | 3700203A |
Referenzen
- Hare, D. J., et al. Is early-life iron exposure critical in neurodegeneration. Nature Reviews Neurology. 11 (9), 536-544 (2015).
- Ashraf, A., Clark, M., So, P. W. The Aging of Iron Man. Frontiers in Aging Neuroscience. 10, (2018).
- Hare, D. J., Cardoso, B. R., Szymlek-Gay, E. A., Biggs, B. A. Neurological effects of iron supplementation in infancy: finding the balance between health and harm in iron-replete infants. Lancet Child Adolesc Health. 2 (2), 144-156 (2018).
- Torti, S. V., Torti, F. M. Iron and cancer: more ore to be mined. Nature Reviews Cancer. 13 (5), 342-355 (2013).
- Kehrer, J. P. The Haber-Weiss reaction and mechanisms of toxicity. Toxicology. 149 (1), 43-50 (2000).
- Gaschler, M. M., Stockwell, B. R. Lipid peroxidation in cell death. Biochemical and Biophysical Research Communications. 482 (3), 419-425 (2017).
- Michalke, B., Halbach, S., Nischwitz, V. JEM Spotlight: Metal speciation related to neurotoxicity in humans. Journal of Environmental Monitoring. 11 (5), 939-954 (2009).
- Solovyev, N., Vinceti, M., Grill, P., Mandrioli, J., Michalke, B. Redox speciation of iron, manganese, and copper in cerebrospinal fluid by strong cation exchange chromatography - sector field inductively coupled plasma mass spectrometry. Analytica Chimica Acta. 973, 25-33 (2017).
- Lee, H. J., et al. Effect of excess iron on oxidative stress and gluconeogenesis through hepcidin during mitochondrial dysfunction. Journal of Nutritional Biochemistry. 26 (12), 1414-1423 (2015).
- Dixon, S. J., Lemberg, K. M., Lamprecht, M. R., Skouta, R., Zaitsev, E. M., Gleason, C. E., et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death. Cell. 149 (5), 1060-1072 (2012).
- Stockwell, B. R., et al. Ferroptosis: A Regulated Cell Death Nexus Linking Metabolism, Redox Biology, and Disease. Cell. 171 (2), 273-285 (2017).
- Michalke, B., Berthele, A., Mistriotis, P., Ochsenkuhn-Petropoulou, M., Halbach, S. Manganese speciation in human cerebrospinal fluid using CZE coupled to inductively coupled plasma MS. Electrophoresis. 28 (9), 1380-1386 (2007).
- Fernsebner, K., Zorn, J., Kanawati, B., Walker, A., Michalke, B. Manganese leads to an increase in markers of oxidative stress as well as to a shift in the ratio of Fe(II)/(III) in rat brain tissue. Metallomics. 6 (4), 921-931 (2014).
- Neth, K. Manganese: Species Pattern and Mechanisms of Brain Injury. , Technical University of Munich, Analytical Food Chemistry. Doctoral Dissertation (2015).
- Neth, K., et al. Changes in Brain Metallome/Metabolome Pattern due to a Single i.v. Injection of Manganese in Rats. Plos One. 10 (9), (2015).
- Venkataramani, V., et al. Manganese causes neurotoxic iron accumulation via translational repression of Amyloid Precursor Protein (APP) and H-Ferritin. Journal of Neurochemistry. 147 (6), 831-848 (2018).
- Willkommen, D., Lucio, M., Schmitt-Kopplin, P., Gazzaz, M., Schroeter, M., Sigaroudi, A., Michalke, B. Species fractionation in a case-control study concerning Parkinson's disease: Cu-amino acids discriminate CSF of PD from controls. Journal of Trace Elements in Medicine and Biology. 49, 164-170 (2018).
- Thibault, P., Dovichi, N. J. General instrumentation and detection systems including mass spectrometry. Capillary Electrophoresis - Theory and Practice. Camilleri, P. , CRC Press. Boca Raton, Boston, New York, Washington D.C., London. 23-89 (1998).
- Iliff, J. J., et al. A Paravascular Pathway Facilitates CSF Flow Through the Brain Parenchyma and the Clearance of Interstitial Solutes, Including Amyloid beta. Science Translational Medicine. 4 (147), (2012).
- Michalke, B. Manganese speciation using capillary electrophoresis-ICP-mass spectrometry. Journal of Chromatography A. 1050 (1), 69-76 (2004).
- Kuhn, R., Hofstetter-Kuhn, S. Capillary electrophoresis: Principles and practice. , Springer. Berlin, Heidelberg. (1993).
- Michalke, B. Capillary electrophoretic methods for a clear identification of selenoamino acids in complex matrices such as human milk. Journal of Chromatography A. 716 (1-2), 323-329 (1995).
- Yang, W. S., et al. Regulation of ferroptotic cancer cell death by GPX4. Cell. 156 (1-2), 317-331 (2014).
- Shimada, K., Hayano, M., Pagano, N. C., Stockwell, B. R. Cell-Line Selectivity Improves the Predictive Power of Pharmacogenomic Analyses and Helps Identify NADPH as Biomarker for Ferroptosis Sensitivity. Cell Chemical Biology. 23 (2), 225-235 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten