Method Article
Impostazione della spettrometria di massa al plasma accoppiata capillare (CE-ICP-MS) per la quantificazione delle specie di iron Redox (Fe(II), Fe(III))
In questo articolo
Riepilogo
Questo metodo di speciazione di redox di ferro si basa sulla spettrometria di massa plasmatica accoppiata con elettroforesi capillare con impilamento del campione combinato con analisi breve in una sola esecuzione. Il metodo analizza rapidamente e fornisce bassi limiti di quantificazione per le specie di redox di ferro in una vasta gamma di tessuti e campioni di biofluidi.
Abstract
La dishomeostasi del metabolismo del ferro è contabiliggiata nel quadro fisiofisiologico di numerose malattie, tra cui il cancro e diverse condizioni neurodegenerative. Il ferro eccessivo provoca fe(II) rosso-attivo libero e può causare effetti devastanti all'interno della cellula come lo stress ossidativo (OS) e la morte per perossidazione lipiante nota come ferroptosi (FPT). Pertanto, le misurazioni quantitative del ferro (Fe(II)) e del ferro ferrico (Fe(III)) piuttosto che della fe-determinazione totale sono la chiave per una visione più approfondita di questi processi dannosi. Poiché le determinazioni Fe(II)/III possono essere ostacolate da veloci spostamenti dello stato rosso e da basse concentrazioni in campioni pertinenti, come il liquido cerebrospinale (CSF), dovrebbero essere disponibili metodi che analizzino rapidamente e forniscano bassi limiti di quantificazione (LOQ). L'elettroforesi capillare (CE) offre il vantaggio della rapida separazione Fe(II)/Fe(III) e funziona senza una fase stazionaria, che potrebbe interferire con l'equilibrio rosso o causare attacchi di analita. CE combinato con spettrometria di massa plasmatica accoppiata induttivamente (ICP-MS) come rivelatore offre un ulteriore miglioramento della sensibilità di rilevamento e selettività. Il metodo presentato utilizza 20 mM HCl come elettrolita di fondo e una tensione di 25 kV. Le forme di picco e i limiti di rilevamento della concentrazione sono migliorati mediante la conduttività-pH-stacking. Per la riduzione di 56[ArO]+, ICP-MS è stato operato in modalità cella di reazione dinamica (DRC) con NH3 come gas di reazione. Il metodo raggiunge un limite di rilevamento (LOD) di 3 g/L. A causa dell'impilamento, sono stati possibili volumi di iniezione più elevati senza ostacolare la separazione ma migliorando loD. Le calibrazioni relative all'area di picco erano lineari fino a 150 g/L. La precisione di misurazione era del 2,2% (Fe(III)) al 3,5% (Fe(II)). La precisione del tempo di migrazione era <3% per entrambe le specie, determinata in 1:2 diluiti di del neuroblastoma umano (SH-SY5Y). Gli esperimenti di recupero con aggiunta standard hanno rivelato una precisione del 97% Di Fe(III) e del 105 % Fe(II). Nei bio-campioni reali come il CSF, il tempo di migrazione può variare a seconda della conduttività variabile (cioè la salinità). Pertanto, l'identificazione di picco è confermata dall'aggiunta standard.
Introduzione
Oggi, è più evidente che lo stress ossidativo (OS) mediato dal ferro svolge un ruolo cruciale nei disturbi multipli specificamente nei disturbi neurodegenerativi del cervello, come l'Alzheimer e il morbo diParkinson,nonché nel cancro1,2,3,4. OS è strettamente correlato allo stato e all'equilibrio del redox-couple Fe(II)/Fe(III). Mentre Fe(III) è redox-inattivo, Fe(II) genera potentemente specie reattive di ossigeno (ROS) catalizzando ladecomposizioneH2 O 2 seguita dalla produzione radicale idrossile e dalla perossidazione dei lipidi della membrana5,6. A livello molecolare, i ROS e i fosfopidi perossidati generati da Fe(II) sono un forte attacco all'integrità di proteine, lipidi e DNA7,8. Tale disfunzione cellulare dannosa è stata dimostrata per indurre disfunzione mitocondriale con diminuzione DEL contenuto ATP9 e può anche innescare una morte delle cellule necrotiche programmate, nota come ferroptosi (FPT)10,11. Pertanto, la speciazione quantitativa Fe(II)/(III) redox è di eminente importanza in un ampio spettro di disturbi legati al redox.
La speciazione chimica è uno strumento ben consolidato per lo studio degli elementi di traccia ruolo biologico e metabolismo ingenerale 7,8 così come in condizioni neurodegenerative12,13,14,15,16,17. I metodi per la speciazione di Fe-redox trovati nella letteratura sono tipicamente basati sulla separazione della cromatografia liquida (LC). Alcuni della letteratura utilizzano la spettrometria di massa al plasma accoppiata induttivamente (ICP-MS) come rilevatore selettivo di elementi. Tuttavia, nel lavoro di routine LC, erano necessari tempi di spurgo eccessivi tra le esecuzioni. Ancora più problematica, la variazione batch-to-batch delle colonne LC ha forzato la ri-ottimizzazione delle condizioni di eluizione dopo ogni modifica di colonna. Questi problemi ostacolano l'elevata velocità effettiva. È necessario ulteriore tempo per ottenere un'affidabilità accettabile e valutare di nuovo il metodo.
Per aggirare questi inconvenienti, viene presentato un metodo qui per la speciazione di semi di rosso Fe(II)/Fe(III) basata sulla spettrometria capillare di massa al plasma accoppiata induttivamente (CE-ICP-MS). CE offre vari vantaggi rispetto alla LC18. I capillari non hanno una fase stazionaria e quindi dipendono (quasi) dall'identità batch. Quando invecchiati o bloccati, vengono sostituiti rapidamente, mostrando in genere prestazioni invariate. I passaggi di eliminazione e pulizia tra i campioni sono efficaci e brevi e anche il tempo di analisi per campione è breve.
Il metodo presentato è affidabile con buone cifre di merito. Come prova di principio, il metodo viene applicato al lichene cellulare del neuroblastoma dopaminergico umano (SH-SY5Y), un tipo di campione importante nella neurodegenerazione e nella ricerca sul cancro19.
Protocollo
CAUTION: Il metodo utilizza acido cloridrico (HCl, diluizioni di partenza da ultrapure, concentrazione 1 M) e tetrametilammoniumhydrossido (TMAH, diluizioni di partenza da ultrapure, concentrazione 25%). Entrambe le sostanze sono fortemente corrosive. Utilizzare la protezione della pelle e degli occhi.
1. Preparazione degli elettroliti
- Preparazione degli elettroliti HCl: elettrolita di fondo (20 mM HCl), elettrolita di uscita (5 mM HCl) ed elettrolita di terminazione (0,05 mM HCl)
- Preparare 20 mM HCl in un pallone da 100 mL: Pipette 2 mL di 1 M HCl nel pallone, riempire fino al segno con acqua ultrapura e agitare delicatamente.
- Preparare 5 mM HCl in un pallone da 100 mL: Pipette 500 L di 1 M HCl nel pallone, riempire fino al segno con acqua ultrapura e agitare delicatamente.
- Preparare 0,05 mM HCl in due fasi: Pipette 1 mL di 20 mM HCl in una fiaschetta da 100 mL, quindi riempire fino al marchio con acqua ultrapura e agitare delicatamente. Successivamente, pipetta 2,5 mL di quest'ultima soluzione in un tubo conico da 15 mL(Tabella dei materiali)e aggiungere 7,5 mL di acqua ultrapura, quindi agitare delicatamente.
- Preparazione dell'elettrolita 12% TMAH in un tubo conico da 15 mL: Pipette 4,8 mL del 25% TMAH nel tubo, aggiungere 5,2 mL di acqua ultrapura e agitare delicatamente.
NOTA: Il 12% TMAH viene utilizzato per eliminare e pulire il capillare prima di ogni corsa e come elettrolita iniziale davanti al campione iniettato).
2. Preparazione e conservazione di norme e campioni
- Standard
- Per Fe(II), pesare 35,61 mg di Fe(II)Cl2 4H2O in un pallone da 100 mL e riempire fino al marchio di 100 mL con acqua ultrapura per una concentrazione di stock 100 mg Fe(II)/L. Agitare delicatamente fino alla completa dissoluzione.
- Per Fe(III), pesare 29,04 mg di Fe(III)Cl3 in un pallone da 100 mL e riempire fino alla marca di 100 mL con acqua ultrapura per una concentrazione di stock fe(III)/L di 100 mg. Agitare delicatamente fino alla completa dissoluzione.
- Diluire ogni soluzione standard secondo la tabella 1 per preparare le soluzioni standard di lavoro.
NOTA: Dopo aver preparato le soluzioni di stock giornaliere dalla soluzione di stock da 100 mg/L, quest'ultima deve essere conservata congelata. Dopo aver preparato gli standard giornalieri secondo la tabella 1, la soluzione di stock da 1 mg/L deve essere congelata in volumi da 1,5 mL e congelata (con aria lasciata in cima) in tubi da 1,5 mL. Per ogni nuovo giorno, un limite di stock giornaliero viene scongelato per la preparazione degli standard giornalieri e ritirato dopo l'uso.
| Concentrazione iniziale | Volume di tubazione | Riempire con acqua Milli-Q | Concentrazione risultante | Volume finale | Uso della soluzione |
| 100 mg/L | 50 L | 4950 L | 1 mg/L | 50 mL | Soluzione di stock giornaliera |
| 1 mg/L | 200 L | 1800 L | 100 g/L | 2 mL | Standard |
| 100 g/L | |||||
| 1 mg/L | 100 L | 1900 L | 50 g/L | 2 mL | Standard |
| 50 g/L | |||||
| 1 mg/L | 50 L | 1950 L | 25 g/L | 2 mL | Standard |
| 25 g/L | |||||
| 1 mg/L | 25 L | 1975L | 12,5 g/L | 2 mL | Standard |
| 12,5 g/l | |||||
| 1 mg/L | 20 L | 1980L | 10 g/L | 2 mL | Standard |
| 10 g/L | |||||
| 0 | 2000 L | 0 g/L | 2 mL | Vuoto |
Tabella 1: Schema di tubazione per la preparazione delle norme.
- Lysate cella SH-SY5Y
NOTA: la cella lysate (SH-SY5Y) è servita come Fe(II)/(III)-rilevante bio-matrice per mostrare le prestazioni e l'affidabilità del metodo.- Utilizzare lysate da esperimenti precedentemente in esecuzione16. Seguire questa preparazione lisate cella evitando cambiamenti di pH o sostanze chimiche che potrebbero influenzare l'equilibrio di redox. Utilizzare un buffer di analisi radioimmunoprecipimento (RIPA) modificato (PBS pH 7.4, 0,5% deossicholate di sodio, 1% NP-40), evitando chelatori metallici (come EDTA), agenti riducenti (come DTT, 2-Mercaptoethanol) e detergenti surfactant anionici e agenti di complesso metallico (come SDS) per ridurre al minimo le alterazioni post-raccolta del rapporto Fe(II)/Fe(III).
- Lavorare sotto un'ossidazione inibita N2da O2 dall'aria ambiente e lavorare sul ghiaccio per ridurre al minimo qualsiasi autossidazione fino a quando il lisato non è stato immagazzinato il più presto possibile a -80 gradi centigradi sotto l'atmosfera di azoto.
3. Creazione di strumenti per la sillabazione della CE in ICP-MS
- Impostare lo strumento di elettroforesi capillare.
NOTA: Per questa sezione, il lettore è principalmente riferito al manuale del rispettivo strumento disponibile in laboratorio.- Installare un capillare con una lunghezza adeguata per raggiungere dalla fiala di ingresso dello strumento CE al nebulizzatore di ICP-MS. Installare il capillare solo sul lato dell'ingresso e condurlo all'esterno dello strumento verso l'interfaccia CE-ICP-MS.
NOTA: per la sillabazione da CE a ICP-MS, in questo protocollo è stato installato un capillare di silice fusa di 90 cm (ID 50 m) in base alla descrizione generale dell'installazione strumentale. Tipicamente, saranno necessarie dimensioni capillari di 70-100 cm, a seconda della posizione degli strumenti in laboratorio. - Disattivare l'ascensore di uscita dello strumento CE nel software per un funzionamento regolare in quanto non è in uso quando il capillare è diretto all'esterno dell'interfaccia CE-ICP-MS.
- Installare un cavo di attivazione da CE-instrument trigger-OUT al trigger-IN dello strumento ICP-MS.
- Selezionare le posizioni per tutte le soluzioni necessarie (20 mM HCl, 0,05 mM HCl, 12% TMAH), standard e campioni nel rotore campione e soluzioni dello strumento e definire le loro posizioni nel software dello strumento come di consueto (fare riferimento al manuale dello strumento).
- Selezionare la temperatura del rotore e del capillare in modo che siano identiche a 20 gradi centigradi, come identiche alla temperatura di laboratorio controllata.
NOTA: non si verifica alcun gradiente di temperatura per le parti capillari all'interno e all'esterno dello strumento CE.
- Installare un capillare con una lunghezza adeguata per raggiungere dalla fiala di ingresso dello strumento CE al nebulizzatore di ICP-MS. Installare il capillare solo sul lato dell'ingresso e condurlo all'esterno dello strumento verso l'interfaccia CE-ICP-MS.
- Impostare lo strumento ICP-MS
- Ottimizzare lo strumento ICP-MS in base alle procedure di configurazione e funzionamento standard strumentali quotidiane. Utilizzare il protocollo del produttore.
- Utilizzare la tecnologia DRC (Dynamic Reaction Cell) con NH3 come gas DRC, con 0,6 mL/min NH3–flowrate e RPq value 0,45.
NOTA: Per la speciazione del ferro, un metodo è programmato con 56Fe, essendo l'isotopo Fe più abbondante (91,754% di abbondanza relativa), tuttavia, essendo gravemente interferito dalcluster [40Ar16O]. Un quadrupole basato ICP-MS in modalità standard è praticamente cieco e il rilevatore in overflow a questo isotopo. Con le impostazioni di cui sopra (vedi punto 3.2.2), vengono raggiunte linee di base basse e sensibilità elevata (per la determinazione totale regolare del ferro LOD nella gamma ng/L bassa). - Scegliere un'impostazione del tempo di dimora per isotopo a 50 ms per il monitoraggio anche i picchi di visualizzazione nitidi e brevi durante la separazione CE.
- Programmare il metodo ICP-MS per essere attivato dallo strumento CE.
- Configurare l'interfaccia CE-ICP-MS
NOTA: Ci sono principalmente due opzioni per collegare il CE-capillare all'ICP-MS. Seguire le descrizioni fornite sulla configurazione se viene utilizzata un'interfaccia commerciale. Questo protocollo utilizza un'interfaccia semplice e fatta in casa basata su una pubblicazione precedente dopo le modifiche20. Le questioni chiave sono una nebulizzazione efficiente con forse meno diluizione dell'efflusso capillare a parte l'adozione del flusso complessivo al nebulizzatore per la migliore nebulizzazione. Inoltre, la minimizzazione di un flusso di aspirazione attraverso la separazione capillare causata dall'autoaspirazione dal nebulizzatore, e la connessione elettrica dell'elettrodo di uscita a terra all'estremità capillare sono obbligatorie.- Selezione nebulizzatore
- Utilizzare un nebulizzatore concentrico con basso volume autoaspirante (ad esempio, 100 L/min) che si inserisce in una camera spray a basso volume.
NOTA: Il basso assorbimento causerà solo una diluizione moderata dell'efflusso capillare parallelo alla nebulizzazione ancora ottimizzata. La connessione elettrica dell'elettrodo di uscita è eseguita da un flusso di elettroliti intorno all'elettrodo di uscita e intorno all'estremità capillare. - Utilizzare l'autoaspirazione del nebulizzatore per ridurre al minimo l'aspirazione attraverso il capillare di separazione e per l'adozione della velocità di flusso al valore ottimale necessario per il nebulizzatore.
- Preparare le seguenti parti della tabella 2 per montare questa interfaccia fatta in casa.
- Utilizzare un nebulizzatore concentrico con basso volume autoaspirante (ad esempio, 100 L/min) che si inserisce in una camera spray a basso volume.
- Configurazione dell'interfaccia semplice
NOTA: utilizzare la Figura 1 per seguire la descrizione del montaggio di parti per l'interfaccia semplice. I numeri nella Figura 1 e nel testo seguente si riferiscono ai numeri della tabella 2.- Iniziare a montare l'interfaccia collegando i due connettori Luer femminili a 3 way (n. 3) con un connettore Luer cono maschio (n. 4). Collegare l'estremità sinistra della barra Luer a 3 way inferiore al connettore maschile e alla connessione centrale dell'Luer a 3 way superiore.
- Mettere un tubo di 1 cm (n. 1) sopra il filo Pt (n. 7) e un tubo di silicone da 1 cm (n. 5) su quest'ultimo e l'ugello di un connettore Luer maschio (n. 2). Fissare l'assieme alla connessione centrale del connettore Luer a 3 way inferiore (n. 3) mediante la rotazione della vite tipica di Luer.
- Spingere un tubo di 1 cm (n.1) sopra l'estremità di uscita del capillare CE e posizionarlo a circa 8-9 cm dalla fine.
- Mettere un tubo di silicone di 1 cm (n. 5) su quest'ultimo e l'ugello di un connettore Luer maschio (n. 2).
- Mettere l'intero assieme da sinistra attraverso la barra del connettore superiore a 3-way-T e fissare il connettore Luer maschio e l'estremità sinistra del connettore Luer a 3 di direzione femminile (n. 3) dalla rotazione a vite tipica di Luer.
- Fissare il tubo di silicone da 25 cm (n. 5) all'ugello di un connettore Luer maschio (n. 2) e fissare l'intero assieme all'estremità inferiore (destra) della barra dal connettore Luer a 3 way inferiore (n.3) mediante la rotazione della vite tipica di Luer.
- Prendere il tubo di silicone da 1 cm (n.6) e spingerlo 5 mm sopra l'estremità del nebulizzatore, mentre il secondo connettore cono Luer maschio (n. 4) è collegato saldamente alla parte sporgente del tubo di silicone.
- Spostare successivamente la parte dell'interfaccia montata sopra con il capillare CE sporgente nel cono maschio al nebulizzatore. Inserire il ce capillare con attenzione attraverso il cono maschio e più avanti attraverso la parte più ampia del nebulizzatore capillare fino a quando quest'ultimo si restringe. Dato che la lunghezza sporgente del capillare è stata scelta opportunamente, il connettore Luer a 3 way femmina superiore ora si adatta anche strettamente al cono maschile.
- Correggere la lunghezza della lunghezza capillare sporgente, se necessario, spostando il capillare (avanti/indietro) nel tubo (n. 1) dove si entra nell'interfaccia self-made.
NOTA: La posizione ottimale del capillare CE all'inizio del nebulizzatore capillare non è troppo critica. Tuttavia, non spingere il capillare CE troppo vicino alla parte stretta del nebulizzatore capillare. Ciò potrebbe ostacolare o bloccare il flusso dell'elettrolita di uscita. Inoltre, ciò interromperebbe la connessione elettrica all'elettrodo di uscita e aumenterebbe l'aspirazione attraverso il capillare CE, con conseguente separazione disturbata. A sua volta, non tenere l'estremità capillare CE troppo lontana dal nebulizzatore capillare da allora si allargherebbero picchi separati taglienti e la risoluzione andrà persa. - Utilizzare un obiettivo per identificare la posizione migliore.
NOTA: Figura 1 (in basso a destra) mostra la posizione ottimale di CE-capillare all'interno del nebulizzatore.
- Selezione nebulizzatore

Figura 1: Schema e montaggio dell'interfaccia CE-ICP-MS. Lo schema identifica le singole parti per il montaggio graduale dell'interfaccia CE-ICP-MS semplice ed economica. La finestra mostra una foto di posizionamento ottimale del CE-capillare nel nebulizzatore. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
| No. | Parte | utilizzato per |
| 1 | Tubo (codice colore verde-arancio), 2 x ca. 1 cm | fissaggio dell'elettrodo capillare e di uscita CE a parti Luer e |
| 2 | Luer, maschio, 3 x, adatto per tubi in silicone ID 1,6 mm | collegamento del tubo di silicone all'elettrolita di uscita e come aiuto per fissare l'elettrodo capillare CE e il filo Pt |
| 3 | 3-way-Luer, femmina, 2 x | Pezzi a T per collegare il flusso di uscita di elettrodo, capillare e aspirato |
| 4 | Cono Luer, maschio, 2 x | collegando Luers femmina tra loro e al nebulizzatore |
| 5 | Tubo di silicone, 1,6 mm ID, parete 0,8 mm, 2 x 1 cm, 1x ca. 25 cm | a) 1cm; tenuta CE capillare all'interfaccia, b) 1 cm; tenuta Pt-wire all'interfaccia c) 25 cm; collegamento dal flacone dell'elettrolita di uscita all'interfaccia |
| 6 | Tubo di silicone, 3 mm ID, parete 1,2 mm, ca.1 cm | serraggio cono Luer al nebulizzatore |
| 7 | Filo di platino | Elettrodo di uscita |
Tabella 2: Parti per la creazione dell'interfaccia CE-ICP-MS semplice ed autoprodo. I numeri si riferiscono anche alla figura 1 e alla descrizione nel testo.
4. Preparazione per la misurazione
NOTA: Prima della misurazione, il capillare deve essere lavato con una forte soluzione alcalina (qui: 12% TMAH) per la pulizia e poi riempito con elettrolita di fondo. Per una migliore separazione, un sandwich buffer di impilamento viene costruito intorno al campione in base ai gradienti di conduttività e pH. La tabella 3 riassume le fasi di preparazione consecutive del capillare, che vengono elaborate automaticamente dallo strumento secondo il metodo programmato:
| Fase n. | Passo | Chimica | Condizione |
| Preparazione della colonna CE | |||
| Preparazione 1 | Pulizia capillare | 12 % TMAH | 4 bar, 1 min. |
| Preparazione 2 | Eliminazione capillare con elettrolita di fondo | 20 mM HCl | 4 bar, 1 min. |
| Preparazione 3 | Impilamento: elettrolita iniziale | 12 % TMAH | 150 mbar, 3 s |
| Preparazione 4 | Iniezione | Esempio | 150 mbar, 3 s |
| Preparazione 5 | Impilamento: elettrolita di terminazione | 0,05 mM HCl | 150 mbar, 3 s |
Tabella 3: Fasi di preparazione capillare prima della misurazione. Questi passaggi sono programmati con il software del sistema CE nel metodo CE e includono l'iniezione di campioni pressurizzati e l'accumulo di un "panino impilamento" intorno al campione.
- Programmare un metodo CE, che esegue consecutivamente i passaggi riportati nella tabella 3.
- Definire una tabella di esempio e una sequenza nel software CE e copiare questa sequenza anche nel software ICP-MS.
5. Misurazione e valutazione dei dati
- Avviare il metodo presso lo strumento CE. Dopo la preparazione programmata e il riempimento del capillare, la misurazione inizia automaticamente non appena la fiala di ingresso, contenente 20 mM HCl, è in posizione all'ingresso capillare. Il "Start-trigger" viene inviato all'ICP-MS, che avvia il monitoraggio on-line dei Fe-isotopi.
NOTA: La separazione utilizza una tensione di 25 kV. La lunghezza estesa del capillare, necessaria per collegare lo strumento CE all'ICP-MS, fa sì che il tempo di separazione sia inutilmente aumentato. Pertanto, la separazione è supportata da una bassa pressione di 250 mbar all'ingresso. L'elettrolita autoaspirato all'uscita è di 5 mM HCl. L'analisi totale dura 3 minuti per i campioni con conduttività moderata. Nella finestra del segnale del software ICP-MS l'elettrofrastogramma può essere osservato durante la corsa. Alla fine di ogni campione, vengono generati automaticamente due file di dati, uno accessibile solo dal software strumentale della banca dati interna, un secondo nella cartella di esportazione in formato ".xl" o ".txt", accessibile dalla funzione di importazione dal normale software di cromatografia. - Fare riferimento al manuale software dello strumento ICP-MS per esportare i file in software di cromatografia.
Risultati
Misure di standard e calibrazione
I tempi di migrazione sono stati chiariti da singole iniezioni standard: lo standard Fe(III) è stato monitorato a 118 s di tempo di migrazione e lo standard Fe(II) a 136 s di tempo di migrazione. I limiti di rilevazione sono stati calcolati utilizzando un criterio che si riferisce al rumore di base e una concentrazione standard di 50 g/L. LoD(Fe(II) era di 3,1 g/L e loD(Fe(III) era di 3,2 g/L. La calibrazione basata sull'area di picco per entrambe le specie di ferro era lineare dal LOD 3σ 150 g/L. Mentre la linearità di Fe(III) è stata dimostrata anche per una maggiore concentrazione, la pendenza della curva di taratura per Fe(II) è diminuita. Un limite massimo di concentrazione di 150 g/L è stato ritenuto sufficiente poiché i campioni di bio-campioni rilevanti per la determinazione Fe(II)/III hanno tipicamente una concentrazione di Fe inferiore. In caso di maggiore concentrazione, i campioni possono essere diluiti di conseguenza. La calibrazione dell'altezza di picco è stata controllata fino a 600 g/L e ha mostrato linearità sull'intera gamma testata. Ciò è illustrato nella Figura 2.
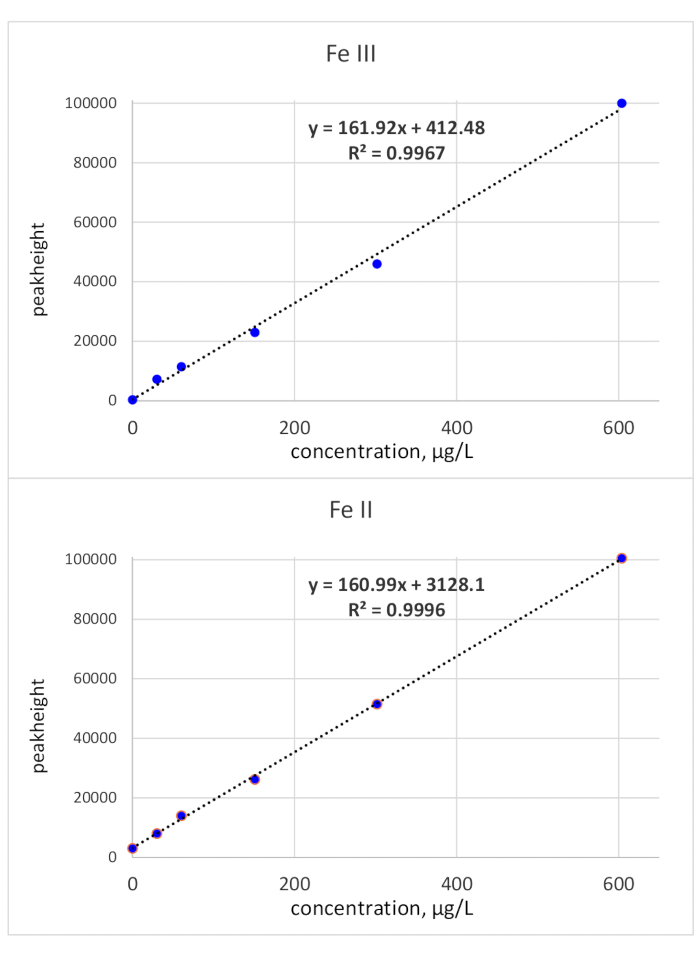
Figura 2: Curve di calibrazione (altezza di picco) di Fe(III) e Fe(II). Le calibrazioni relative all'altezza di picco di entrambe le specie Dio rosso sono lineari con una pendenza di ca. 161 - X Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
Analisi della cella SH-SY5Y lysate
L'analisi del lisato cellulare SH-SY5Y ha mostrato una migrazione leggermente più lenta per le specie di redox di ferro a causa della conduttività leggermente più elevata. Fe(III) è stato monitorato a 124 s di tempo di migrazione, Fe(II) a 158 s di tempo di migrazione. La precisione del tempo di migrazione nella cella SH-SY5Y è stata del 2% per Fe(III) e del 3% per Fe(II). Le misurazioni quantitative Fe(II) e Fe(III) con questo metodo hanno rivelato una concentrazione Di 330 g/L e Fe(II) di concentrazione 84 g/L, entrambe risultanti in un rapporto Fe(II)/Fe(III) di 0,25. Il rispettivo elettropherogramma 56Fe-selettivo è illustrato nella Figura 3.
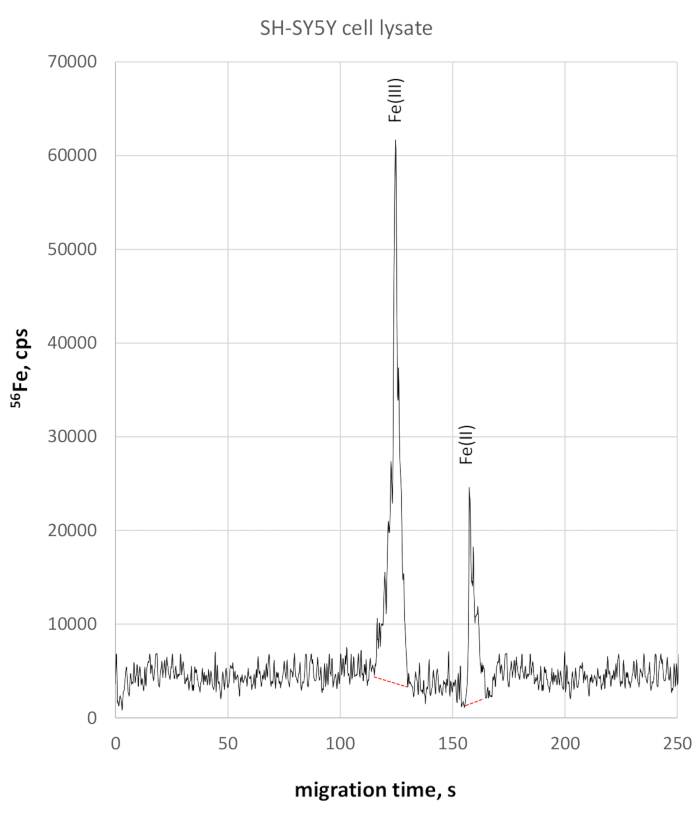
Figura 3: 56elettropherogramma specifico di Fe di lysate a cellule SH-SY5Y. Fe(III) è monitorato a 123 s raggiungendo 58025 cps altezza di picco, essendo chiaramente separato da Fe(II) a 158 s, raggiungendo 2280 cps Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Poiché il ferro svolge un ruolo di primo piano nella progressione del sistema operativo, facilitando così la disfunzione mitocondriale o FTP, un versatile metodo quantitativo basato su CE-ICP per la speciazione simultanea Fe(II)/Fe(III) è presentato in questo articolo e la sua applicazione è esemplariamente dimostrata nei licheni cellulari. Il metodo ha fornito tempi di analisi brevi e le cifre di merito (LOQ, precisione, recupero) sono adatte per i campioni rilevanti per la speciazione di redox di ferro specificamente nella ricerca neurodegenerativa e sul cancro. Rispetto ai metodi precedenti basati su LC, questo metodo basato su CE è praticamente indipendente dai batch di colonne e dai problemi di riproducibilità osservati in precedenza dopo la modifica della colonna LC. La preparazione capillare prima di ogni esecuzione è <4 minuti e il tempo di analisi per campione con salinità moderata fino a 3 min. Oltre alla carica e alle dimensioni delle molecole, il tempo di migrazione in C-E dipende dalla conduttività alla spina del campione, che causa variazioni del tempo di migrazione o spostamenti quando i campioni stessi influenzano considerevolmente la conduttività. Tali cambiamenti nel tempo di migrazione sono ben noti nell'elettroforesi capillare. Si tratta di un problema di C-immanent, noto dalla letteratura21,22. Gli standard e i lisati cellulari SH-SY5Y avevano una conduttività moderata e omogenea. Di conseguenza, i tempi di migrazione hanno mostrato solo pochi cambiamenti con buona precisione. Per i campioni con elevata conduttività, tuttavia, i tempi di migrazione prolungati possono essere osservati fino a 5 min. Pertanto, sono raccomandate aggiunte standard per l'identificazione chiara delle specie.
Un problema critico nella speciazione di redox di ferro è la stabilità delle specie (ad esempio, la manutenzione degli equilibri Fe(II)/(III) durante la preparazione delcampione 8,13. Il pH o le sostanze chimiche inadeguate, nonché le condizioni di conservazione inadeguate come l'ossigeno (aria) a contatto con il campione o una rottura nello stoccaggio congelato in profondità possono facilmente modificare l'equilibrio Fe(II)/(III). Pertanto, per la preparazione dei lysati cellulari SH-SY5Y, è stato scelto un tampone di lisi senza sostanze chimiche, pH fisiologico, ma sovrapposizione di gas inerte durante la preparazione del campione, in contenitori campione e per questi campioni è stato applicato un cuscinetto di lisi senza sostanze chimiche, pH fisiologico, ma sovrapposizione di gas inerte durante la preparazione del campione, in contenitori campione e congelamento profondo immediato.
Nella letteratura, si possono trovare approcci semi-quantitativi per monitorare Fe(II). Per una migliore comprensione del ruolo del ferro nello stress ossidativo, diversi gruppi di ricerca hanno sviluppato sonde specifiche di Fe(II) per monitorare e visualizzare l'elevazione aberrante del ferro ferroso in vitro. Tuttavia, è importante notare, tali sonde non considerano Fe(III) e non quantificano, ma riportano solo "più" o "meno" Fe(II)). Ad oggi, solo pochi biomarcatori sono disponibili per determinare OS e FPT, essendo dovuti alla mancanza di metodi affidabili per quantificare contemporaneamente la specie Fe(II)/Fe(III) redox23,24. Avendo questo in mente, il metodo presentato - facilitando la quantificazione rapida di entrambi, Fe(III) e Fe(II) in una sola esecuzione - può diventare uno strumento promettente per approfondire la comprensione dei processi molecolari dipendenti dal ferro.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Il VV è stato sostenuto dalla borsa di ricerca intramurale (Forschungsf'rderung) dell'University Medical Center di Gottinga e dal programma di ricerca Else Kroner-Fresenius-Stiftung.
Materiali
| Name | Company | Catalog Number | Comments |
| CE capillary | CS-Chromatographie Service, Langerwehe, Germany | 105180-25 | |
| CE system | PrinCe technolgies | 0005.263 | model PrinCe 760 |
| Conical Superclear Tubes 15 ml | Analytics-shop.com by Altmann Analytik | PEN0777704 | |
| Conical Superclear Tubes 50 ml | Analytics-shop.com by Altmann Analytik | PEN0777694 | |
| FeCl2 * 4H2O | Merck | 103861 | |
| FeCl3 | Merck | 803945 | |
| Fluidflex Silikon HG-Schlauch | ProLiquid | 4001106HG | |
| Fused silica capillary OD 360 µm, ID 50 µm | Chromatographie Service GmbH | 105180-25 | |
| hydrochloric acid, 1 M | Merck | 1101652500 | corrosive |
| ICP-MS | Perkin Elmer | N814003 | |
| Luer, 3-way female | BioRad | 7318229 | |
| Luer, cone male | neoLab Migge | 2-1895 | |
| Luer, male | neoLab Migge | 2-1880 | |
| Peakfit peak evaluation software | Systat | PeakFit 4.12 | |
| Pt-wire | Carl Roth | 0737.1 | |
| PVC tube | ProLiquid | 6000002 | |
| RIPA buffer | Abcam | ab156034 | |
| Tetramethylammoniumhydroxide, 25 % | Merck | 814748 | corrosive |
| TYGON-tube R-3607 | ProLiquid | 3700203A |
Riferimenti
- Hare, D. J., et al. Is early-life iron exposure critical in neurodegeneration. Nature Reviews Neurology. 11 (9), 536-544 (2015).
- Ashraf, A., Clark, M., So, P. W. The Aging of Iron Man. Frontiers in Aging Neuroscience. 10, (2018).
- Hare, D. J., Cardoso, B. R., Szymlek-Gay, E. A., Biggs, B. A. Neurological effects of iron supplementation in infancy: finding the balance between health and harm in iron-replete infants. Lancet Child Adolesc Health. 2 (2), 144-156 (2018).
- Torti, S. V., Torti, F. M. Iron and cancer: more ore to be mined. Nature Reviews Cancer. 13 (5), 342-355 (2013).
- Kehrer, J. P. The Haber-Weiss reaction and mechanisms of toxicity. Toxicology. 149 (1), 43-50 (2000).
- Gaschler, M. M., Stockwell, B. R. Lipid peroxidation in cell death. Biochemical and Biophysical Research Communications. 482 (3), 419-425 (2017).
- Michalke, B., Halbach, S., Nischwitz, V. JEM Spotlight: Metal speciation related to neurotoxicity in humans. Journal of Environmental Monitoring. 11 (5), 939-954 (2009).
- Solovyev, N., Vinceti, M., Grill, P., Mandrioli, J., Michalke, B. Redox speciation of iron, manganese, and copper in cerebrospinal fluid by strong cation exchange chromatography - sector field inductively coupled plasma mass spectrometry. Analytica Chimica Acta. 973, 25-33 (2017).
- Lee, H. J., et al. Effect of excess iron on oxidative stress and gluconeogenesis through hepcidin during mitochondrial dysfunction. Journal of Nutritional Biochemistry. 26 (12), 1414-1423 (2015).
- Dixon, S. J., Lemberg, K. M., Lamprecht, M. R., Skouta, R., Zaitsev, E. M., Gleason, C. E., et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death. Cell. 149 (5), 1060-1072 (2012).
- Stockwell, B. R., et al. Ferroptosis: A Regulated Cell Death Nexus Linking Metabolism, Redox Biology, and Disease. Cell. 171 (2), 273-285 (2017).
- Michalke, B., Berthele, A., Mistriotis, P., Ochsenkuhn-Petropoulou, M., Halbach, S. Manganese speciation in human cerebrospinal fluid using CZE coupled to inductively coupled plasma MS. Electrophoresis. 28 (9), 1380-1386 (2007).
- Fernsebner, K., Zorn, J., Kanawati, B., Walker, A., Michalke, B. Manganese leads to an increase in markers of oxidative stress as well as to a shift in the ratio of Fe(II)/(III) in rat brain tissue. Metallomics. 6 (4), 921-931 (2014).
- Neth, K. . Manganese: Species Pattern and Mechanisms of Brain Injury. , (2015).
- Neth, K., et al. Changes in Brain Metallome/Metabolome Pattern due to a Single i.v. Injection of Manganese in Rats. Plos One. 10 (9), (2015).
- Venkataramani, V., et al. Manganese causes neurotoxic iron accumulation via translational repression of Amyloid Precursor Protein (APP) and H-Ferritin. Journal of Neurochemistry. 147 (6), 831-848 (2018).
- Willkommen, D., Lucio, M., Schmitt-Kopplin, P., Gazzaz, M., Schroeter, M., Sigaroudi, A., Michalke, B. Species fractionation in a case-control study concerning Parkinson's disease: Cu-amino acids discriminate CSF of PD from controls. Journal of Trace Elements in Medicine and Biology. 49, 164-170 (2018).
- Thibault, P., Dovichi, N. J., Camilleri, P. General instrumentation and detection systems including mass spectrometry. Capillary Electrophoresis - Theory and Practice. , 23-89 (1998).
- Iliff, J. J., et al. A Paravascular Pathway Facilitates CSF Flow Through the Brain Parenchyma and the Clearance of Interstitial Solutes, Including Amyloid beta. Science Translational Medicine. 4 (147), (2012).
- Michalke, B. Manganese speciation using capillary electrophoresis-ICP-mass spectrometry. Journal of Chromatography A. 1050 (1), 69-76 (2004).
- Kuhn, R., Hofstetter-Kuhn, S. . Capillary electrophoresis: Principles and practice. , (1993).
- Michalke, B. Capillary electrophoretic methods for a clear identification of selenoamino acids in complex matrices such as human milk. Journal of Chromatography A. 716 (1-2), 323-329 (1995).
- Yang, W. S., et al. Regulation of ferroptotic cancer cell death by GPX4. Cell. 156 (1-2), 317-331 (2014).
- Shimada, K., Hayano, M., Pagano, N. C., Stockwell, B. R. Cell-Line Selectivity Improves the Predictive Power of Pharmacogenomic Analyses and Helps Identify NADPH as Biomarker for Ferroptosis Sensitivity. Cell Chemical Biology. 23 (2), 225-235 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon