Method Article
鉄レドックス種(Fe(II)、Fe(III)の定量化のためのキャピラリー電気泳動誘導結合プラズマ質量分析(CE-ICP-MS)のセットアップ
要約
この鉄の酸化還元の種分法は、毛細管電気泳動誘導結合プラズマ質量分析とサンプルスタッキングを1回の実行で短い分析と組み合わせることに基づいています。この方法は、多様な組織および生体流体サンプルにわたる鉄の酸化還元種を迅速に分析し、定量の低い制限を提供します。
要約
鉄代謝のジホメオスタシスは、癌およびいくつかの神経変性状態を含む多数の疾患の病態生理学的枠組みに説明される。過剰な鉄は遊離酸化活性Fe(II)をもたらし、酸化ストレス(OS)やフェロプト(FPT)として知られている脂質過酸化による死のような細胞内の壊滅的な効果を引き起こす可能性があります。したがって、Feの全定量ではなく鉄鉄(Fe(II))と鉄(Fe(III))の定量的測定が、これらの有害なプロセスをより詳しく調べるための鍵となります。Fe(II)/(III)の決定は、脳脊髄液(CSF)のような関連するサンプルの速いレドックス状態シフトと低濃度によって妨げられる可能性があるため、迅速に分析し、定量(LOQ)の低限界を提供する方法が利用可能であるべきです。キャピラリー電気泳動(CE)は、高速Fe(II)/Fe(III)分離の利点を提供し、酸化還元バランスを妨げるか、または検体の固着を引き起こす可能性のある静止相なしで動作します。CEは、検出器として誘導結合プラズマ質量分析(ICP-MS)と組み合わせることで、検出感度と選択性をさらに向上させます。提示された方法は、バックグラウンド電解質として20 mM HClを使用し、+25 kVの電圧を使用します。ピーク形状と濃度検出限界は、導電率-pHスタッキングによって改善される。56[ArO]+の還元+のために、ICP-MSは反応ガスとしてNH3で動的反応セル(DRC)モードで動作させた。 56この方法は、3 μg/Lの検出(LOD)の限界を達成し、積層のために、分離を妨げることなく、LODを改善することなく、より高い注入量が可能であった。ピーク面積に関するキャリブレーションは、最大150μg/Lのリニアで、測定精度は2.2%(Fe(III))~3.5%(Fe(II))であった。移動時間精度は両方の種について<3%であり、ヒト神経芽細胞腫(SH-SY5Y)細胞の1:2希釈ライセートで決定された。標準添加による回収実験では、97%のFe(III)と105%のFe(II)の精度が明らかになりました。CSFのような実際のバイオサンプルでは、移動時間は様々な導電率(すなわち、生理性)によって変化する可能性があります。これにより、ピーク識別は標準添加により確認される。
概要
今日では、鉄媒介酸化ストレス(OS)が、アルツハイマー病やパーキンソン病、癌,1、2、3、42などの神経変性脳障害において特に複数の疾患において重要な役割3を4果たすことが最も1明らかである。OSはレドックス・カップルのFe(II)/Fe(III)の状態とバランスと密接に関連しています。Fe(III)は酸化還元不活性である一方、Fe(II)は、ヒドロキシルラジカル産生および膜脂質過酸化反応から続く5,H2O2分解を触媒することによって強力に活性酸素種(ROS)を生成する。2分子レベルでは、Fe(II)生成ROSおよびペルオキシドリン脂質は、タンパク質、脂質およびDNA7、8,8の完全性に対する強力な攻撃である。このような有害な細胞機能障害は、ATP含有量9の低下を伴うミトコンドリア機能不全を誘導し、フェロプトシス(FPT)10,11として知られるプログラムされた壊死10,11細胞死を引き起こすことさえできることが実証された。従って、定量的Fe(II)/(III)酸化還元種分化は、広い範囲の酸化還元関連疾患において重要である。
化学種分化は、一般的に生物学的役割および代謝の微量元素の研究のための確立されたツールであり、一般的な77、88だけでなく、神経変性状態12、13、14、15、16、17で。12,13,14,15,16,17文献に含まれるFe-Redox種分化法は、典型的には液体クロマトグラフィー(LC)分離に基づく。文献の一部は、誘導結合プラズマ質量分析(ICP-MS)を要素選択的検出器として使用している。ただし、通常の LC 作業では、実行の間に過度のパージ時間が必要でした。さらに問題となるのは、LC カラムのバッチ間の変動により、各カラム変更後に溶出条件の再最適化を余儀なくされた。これらの問題は、ハイスループットを妨げている。許容できる信頼性を得るためには、さらに時間が必要であり、メソッドを再び徹底的に評価します。
これらの欠点を回避するために、毛細血管電気泳動誘導結合プラズマ質量分析法(CE-ICP-MS)に基づくFe(II)/Fe(III)酸化還元法の方法をここで提示します。CEはLC18と比較して様々な利点を提供しています。毛細血管には定常段階がないため、バッチ ID に依存しません(ほぼ)。エージまたはブロックされると、それらはすぐに置き換えられ、通常は変更されないパフォーマンスを示します。サンプル間のパージとクリーニングのステップは効果的で短く、サンプルごとの分析時間も短いです。
提示された方法は、メリットの良い数字と信頼性があります。原理の証明として、この方法はヒトドーパミン作動性神経芽細胞腫(SH-SY5Y)細胞リセートに適用され、癌研究19と同様に神経変性において重要なサンプルタイプである。
プロトコル
注意:この方法は塩酸(HCl、超純粋、濃度1Mからの希釈開始)およびテトラメチルアンモニウム水酸化(TMAH、超純粋、濃度25%)から希釈を開始する。両方の物質は強く腐食性です。皮膚と目の保護を使用してください。
1. 電解質の準備
- HCl-電解質の調製:バックグラウンド電解質(20 mM HCl)、出口電解質(5 mM HCl)および末流電(0.05 mM HCl)
- 100 mL フラスコに20 mM HClを準備する:1 M HClのピペット2 mLをフラスコに入れ、超純水でマークまで満たし、穏やかに振ります。
- 100 mL フラスコに 5 mM HCl を準備する: 1 M HCl のピペット 500 μL をフラスコに入れ、超純水でマークまで満たし、穏やかに振ります。
- 0.05 mM HClを2つのステップで準備します:ピペット1 mLの20mM HClを100 mLフラスコに入れ、超純水でマークまで満たして穏やかに振ります。その後、ピペット2.5mLの後者の溶液を15mL円錐形チューブ(材料表)に入れ、7.5mLの超純水を加え、穏やかに振ります。
- 15 mL円錐管に導く電解質12%TMAHを準備する:管に25%TMAHのピペット4.8 mL、超純水の5.2 mLを加え、穏やかに振る。
注:12%TMAHは、各実行前に毛細管をパージして洗浄し、注入されたサンプルの前に導く電解質として使用されます)。
2. 標準およびサンプルの準備と保管
- 基準
- Fe(II)の場合、35.61 mgのFe(II)Cl2·4H2Oを100 mLフラスコに計量し、100mg Fe(II)/Lストック濃度の超純水で100 mLマークまで満たします。完全に溶解するまでそっと振ります。
- Fe(III)の場合、29.04 mgのFe(III)Cl3 を100 mLフラスコに計量し、100 mg Fe(III)/Lストック濃度の超純水で100 mLマークまで満たします。完全に溶解するまでそっと振ります。
- 表1に従って各標準溶液を希釈し、作業標準溶液を調製します。
注:100 mg/Lストック溶液から毎日のストックソリューションを準備した後、後者は凍結して保存する必要があります。 表1に従って毎日の基準を準備した後、1mg/Lストック溶液を1.5 mLの体積に入れ、1.5mLチューブに凍結(最高の空気を残さない)を保存する必要があります。新しい日ごとに、1日の在庫上限は、毎日の基準の準備のために解凍され、使用後に撤回されます。
| 開始濃度 | ピペットボリューム | ミリQ水でいっぱいにする | 結果として得られる濃度 | 最終巻 | ソリューションの使用 |
| 100 mg/L | 50 μL | 4950 μL | 1 mg/L | 50 mL | 毎日のストックソリューション |
| 1 mg/L | 200 μL | 1800 μL | 100 μg/L | 2 mL | 標準 |
| 100 μg/L | |||||
| 1 mg/L | 100 μL | 1900 μL | 50 μg/L | 2 mL | 標準 |
| 50 μg/L | |||||
| 1 mg/L | 50 μL | 1950 μL | 25 μg/L | 2 mL | 標準 |
| 25 μg/L | |||||
| 1 mg/L | 25 μL | 1975μL | 12.5μg/L | 2 mL | 標準 |
| 12.5 μg/l | |||||
| 1 mg/L | 20 μL | 1980μL | 10 μg/L | 2 mL | 標準 |
| 10 μg/L | |||||
| 0 | 2000 μL | 0 μg/L | 2 mL | 空白 |
表1:標準を準備するためのピペット方式。
- SH-SY5Y細胞ライセート
注:細胞ライセート(SH-SY5Y)は、この方法の性能と信頼性を示すために、Fe(II)/(III)関連のバイオマトリックスとして機能しました。- 以前に実行した実験16からライセートを使用する。pHの変化や酸化還元バランスに影響を与える可能性のある化学物質を避けて、この細胞ライセート調製に従ってください。修飾された放射性免疫沈降アッセイ(RIPA)の溶出バッファー(PBS pH 7.4、 0.5%デオキシコール酸ナトリウム、1%NP-40、金属キレート剤(EDTAなど)を回避し、還元剤(DTT、2-メルカプトエタノールなど)、アニオン界面活性剤および金属錯化剤(SDSなど)を使用して、Fe(II)/Fe(III)比の回収後の変化を最小限に抑える。
- N2-大気下での作業は、周囲の空気からのO2による酸化を阻害し、窒素雰囲気下で-80°Cで溶質ができるだけ早く貯蔵されるまで、任意の自閉症を最小限に抑えるために氷上で作業する。
3. CE から ICP-MS へのハイフネーションのためのインストゥルメントの設定
- キャピラリー電気泳動器を設置します。
注:このセクションでは、読者は主に研究室で利用可能なそれぞれの機器のマニュアルを参照しています。- CE機器の入口バイアルからICP-MSのネブライザーに到達するために適切な長さの毛細管を取り付けます。入口側にのみキャピラリーを取り付け、装置の外をCE-ICP-MSインターフェースに向けて導きます。
注:CEからICP-MSへのハイフネーションのために、このプロトコルでは90 cmの融合シリカキャピラリー(ID 50 μm)が一般的な器械のセットアップの記述に従って取付けられていた。通常、70-100 cmのキャピラリーサイズは、実験室での機器の位置に応じて必要になります。 - ソフトウェアのCE機器のコンセントリフトを取り外して、キャピラリーがCE-ICP-MSインターフェイスの外部に向けられているときには使用されていないので、スムーズな操作を行います。
- CE計測器のトリガOUTからICP-MS計測器のトリガインにトリガケーブルを取り付ける。
- すべての必要なソリューション(20 mM HCl、0.05 mM HCl、12%TMAH)、標準およびサンプルの測定器のローターを選択し、通常通り機器ソフトウェアでの位置を定義します(機器のマニュアルを参照)。
- ロータとキャピラリー温度を20°Cで同一にし、制御された実験室温度と同一にします。
メモ:CE機器の内側と外側の毛細血管部分に温度勾配は発生しません。
- CE機器の入口バイアルからICP-MSのネブライザーに到達するために適切な長さの毛細管を取り付けます。入口側にのみキャピラリーを取り付け、装置の外をCE-ICP-MSインターフェースに向けて導きます。
- ICP-MS 計測器のセットアップ
- 毎日の器械の標準的なセットアップおよび操作プロシージャに従ってICP-MSの器械を最大限に活用する。製造元のプロトコルを使用します。
- NH3 を使用した動的反応セル (DRC) 技術を DRC ガスとして使用し、0.6 mL/min NH3-流量と RPq 値 = 0.45 を使用します。
注:鉄分化の場合、方法は56Feでプログラムされ、最も豊富なFe同位体(91.754%相対量)ですが、[40Ar16O]+クラスタから深刻な+干渉を受けます。標準モードの四極面ベースのICP-MSは実質的に盲目であり、検出器はこの同位体でオーバーフローします。上記の設定(ステップ3.2.2を参照)を使用すると、低いベースラインと高感度が達成されます(低ng/L範囲の通常の全鉄決定LODが達成されるため)。 - CE分離中にシャープで短いピークを監視するために、50ミリ秒で同位体ごとに位取り時間設定を選択します。
- CE-計測器で起動する ICP-MS メソッドをプログラムします。
- CE-ICP-MS インターフェイスのセットアップ
注: CE-キャピラリーを ICP-MS に接続するには、主に 2 つのオプションがあります。商用インターフェイスを使用する場合は、セットアップに関する説明に従ってください。このプロトコルは、変更後の以前のパブリケーションに基づいて、シンプルな、自家製のインターフェイスを使用します20.主な問題は、最良のネビュレーションのためのネブライザーへの全体的な流量の採用とは別に、おそらくより少ない毛細管流出の希釈を伴う効率的なネビュレーションである。また、自己吸引によって生じるキャピラリーをネブライザーから分離する吸引流の最小化、および接地された出口電極とキャピラリー端への電気的接続が必須である。- ネブライザーの選択
- 低い自己吸気容積(例えば、100 μL/min)が少量のスプレー室に収まる同心円型ネブライザーを使用してください。
注:低取り込みでは、まだ最適化されたネビュレーションから平行にキャピラリー流出の中程度の希釈のみが発生します。出口電極の電気的接続は、出口電極の周りおよび毛管端の周りの電解質流によって達成される。 - ネブライザーの自己吸引を使用して、分離キャピラリーを通して吸引を最小限に抑え、ネブライザーが必要とする最適な値に流量を採用します。
- 表 2から以下のパーツを準備して、このホームメイドのインターフェイスをマウントします。
- 低い自己吸気容積(例えば、100 μL/min)が少量のスプレー室に収まる同心円型ネブライザーを使用してください。
- シンプルなインターフェイスのセットアップ
注: シンプルなインターフェイスの部品取り付けの説明に従う 場合は、図 1 を使用します。 図 1 および次のテキストの数値は 、表 2の数値を参照してください。- 2 つの 3 ウェイ メス Luer コネクタ (3) をオスコーン Luer コネクタ (No. 4) に接続して、インターフェイスの取り付けを開始します。下段 3 ウェイ ルアー バーの左端をオス コネクタに接続し、上部 3-way Luer の中間接続に接続します。
- 1cmチューブ(No.1)をPt-wire(7番)の上に、1cmのシリコーンチューブ(5番)を後者の管とオスのルアーコネクタ(2番)のノズルに置きます。Luer標準のねじ回転により、下部3方向ルアーコネクタ(No.3)の中間接続にアセンブリを固定します。
- CE毛細管の出口の端に1cmの管(No.1)を押し、端から約8-9 cmの位置に置いてください。
- 1cmのシリコンチューブ(5本)を後者の管とオスのルアーコネクタ(No.2)のノズルに置きます。
- 上部 3-way-T コネクタのバーを通して左からアセンブリ全体を置き、オス の Luer コネクタとメスの 3 方向 Luer コネクタ (No. 3) の左端を Luer 標準のねじ回転で固定します。
- オスのルアーコネクタ(No.2)のノズルで25cmシリコーンチューブ(No.5)を固定し、ルアー標準のねじ回転により、下部3方向ルアーコネクタ(No.3)からバーの下端(右)にアセンブリ全体を固定します。
- 1 cmのシリコンチューブ(No.6)を取り、ネブライザーの端部に5mmしっかりと押し込み、2番目のオスのルアーコーンコネクタ(No.4)をシリコンチューブの突出部分にしっかりと差し込みます。
- ネブライザーでオスのコーンに突き出たCEキャピラリーで、その後に上記の取り付けられたインターフェイス部分を移動します。CE毛細管をオスコーンを通して慎重に挿入し、後者が狭くなるまでネブライザー毛細血管のより広い部分を通してさらに。毛細管の突出長が適切に選択されたことを考えると、上の女性3方向ルアーコネクタは現在、男性のコーンにもしっかりとフィットします。
- 自作のインターフェースに入る管(No.1)で毛細管(前方/後方)を動かして、必要に応じて突出した毛細管の長さの長さを修正します。
注:ネブライザー毛細血管の始まりにおけるCE毛細管の最適な位置はあまり重要ではありません。ただし、CEキャピラリーをネブライザーキャピラリーの狭い部分に近づけないでください。これは、出口電解質の流れを妨げるか、またはブロックする可能性があります。また、これは出口電極への電気的接続を中断し、CE毛細管を介して吸引を増加させ、分離を乱す結果となる。その後、CE毛細管の端をネブライザー毛細血管からあまり遠くに保たないで、その後急激に分離されたピークが広がり、解像度が失われるので。 - レンズを使用して最適な位置を特定します。
注: 図 1 (右下) は、ネブライザー内部の CE キャピラリーの最適な位置を示しています。
- ネブライザーの選択

図 1: CE-ICP-MS インターフェイスの概略と取り付けこの回路図は、シンプルで安価なCE-ICP-MSインターフェースの段階的な取り付けのための単一部品を特定します。窓には、ネブライザーにおけるCEキャピラリーの最適位置の写真が表示されます。 この図の大きなバージョンを表示するには、ここをクリックしてください。
| いいえ。 | 一部 | に使用 |
| 1 | チューブ(緑オレンジ色コード)、2 x ca. 1 cm | LUER部品でCEキャピラリーと出口電極を固定し、しっかりと保つ |
| 2 | ルアー、男性、3 x、1.6 mm IDシリコーンチューブに適しています | シリコンチューブと出口電解質への接続と、CEキャピラリーおよびPt線電極の固定のための補助として |
| 3 | 3ウェイルアー、女性、2 x | 電極、毛細管、吸気流れをつなぐTピース |
| 4 | ルエルコーン、男性、2 x | 女性ルエルを互いに接続し、ネブライザーに |
| 5 | シリコンチューブ、1.6 mm ID、0.8 mm壁、2 x 1 cm、1x ca. 25 cm | a) 1cm;インターフェイスにCE毛細管を締め付け、 b) 1cm;インターフェイスへのタイト化 Pt-wire c) 25 cm;出口電解質フラスコから界面への接続 |
| 6 | シリコンチューブ、3 mm ID、1.2 mm壁、ca.1 cm | ネブライザーにルアーコーンを締める |
| 7 | プラチナワイヤー | 出口電極 |
表 2: シンプルで自作の CE-ICP-MS インターフェイスを構築するためのパーツ。 数字は図 1 とテキストの説明も示しています。
4. 測定の準備
注:測定前に、毛細管は、クリーニングのための強力なアルカリ溶液(ここでは:12%TMAH)で洗い流し、その後、バックグラウンド電解質で満たされるべきです。分離を改善するために、積層バッファーサンドイッチは、導電率とpH勾配に基づいてサンプルの周りに構築されています。 表3 は、プログラムされた方法に従って機器によって自動的に処理される毛細管の連続した準備ステップを要約します。
| ステップなし | ステップ | 化学 | 条件 |
| CEカラムの作成 | |||
| 準備1 | キャピラリークリーニング | 12% TMAH | 4バー、1分。 |
| 準備2 | 背景電解質を用いたキャピラリーパージ | 20 mM HCl | 4バー、1分。 |
| 準備3 | スタッキング:一流電解質 | 12% TMAH | 150 mbar,3 s |
| 準備4 | 射出 | サンプル | 150 mbar,3 s |
| 準備 5 | スタッキング:電解質を終端する | 0.05 mM HCl | 150 mbar,3 s |
表3:測定前の毛細血管調製ステップ。 これらのステップはCE方法のCEシステムソフトウェアとプログラムされ、加圧サンプル注入およびサンプルのまわりの「積み重ねサンドイッチ」の蓄積を含んでいる。
- 表 3に示したステップを連続して実行する CE メソッドをプログラムします。
- CE ソフトウェアでサンプル テーブルとシーケンスを定義し、このシーケンスを ICP-MS ソフトウェアにもコピーします。
5. 測定とデータの評価
- CE計測器でメソッドを開始します。キャピラリーのプログラムされた準備および充填の後、測定は、20 mM HClを含む入口バイアルがキャピラリー入口の位置に入るとすぐに自動的に開始する。「開始トリガ」は、Fe-同位体のオンライン監視を開始するICP-MSに送信されます。
注: 分離には+25 kVの電圧が使用されます。CE-機器をICP-MSに接続するために必要なキャピラリーの延長長さは、分離時間が不必要に増加する原因となります。したがって、分離は、入口で250mbarの低圧で支持される。出口の自己吸引電解質は5 mM HClである。中程度の導電性を持つサンプルの合計分析は3分間続きます。ICP-MSソフトウェアの信号ウィンドウでは、実行中にエレクトロフェログラムを観察することができます。各サンプルの最後に、2つのデータファイルが自動的に生成され、1つは内部データバンクからインストルメントソフトウェアからアクセス可能であり、エクスポートフォルダ内の2つ目は「.xl」または「.txt」形式で、通常のクロマトグラフィーソフトウェアからインポート機能でアクセス可能です。 - ファイルをクロマトグラフィーソフトウェアにエクスポートするには、ICP-MS計測器のソフトウェアマニュアルを参照してください。
結果
標準およびキャリブレーションの測定
移行時間は、単一の標準注入によって解明された:Fe(III)標準は、移行時間の118 sで監視され、Fe(II)標準は136 sの移行時間で監視された。検出限界は、ベースラインノイズを基準とする3σ基準を用いて計算し、標準濃度の50μg/L.LOD(Fe(II)は 3.1μg/L、LOD(Fe(III)は 3.2μg/Lであった。Fe(III)の直線性は高濃度でも証明されたが、Fe(II)の較正曲線の傾きは減少した。Fe(II)/(III)の測定に関連するバイオサンプルは通常Fe濃度が低いため、150 μg/Lの上限値で十分であると考えられました。より高濃度の場合には、サンプルをそれに応じて希釈してもよい。ピーク高さの口径測定は600 μg/Lまで点検され、テストされた範囲全体に線形性を示した。これは図 2に示します。
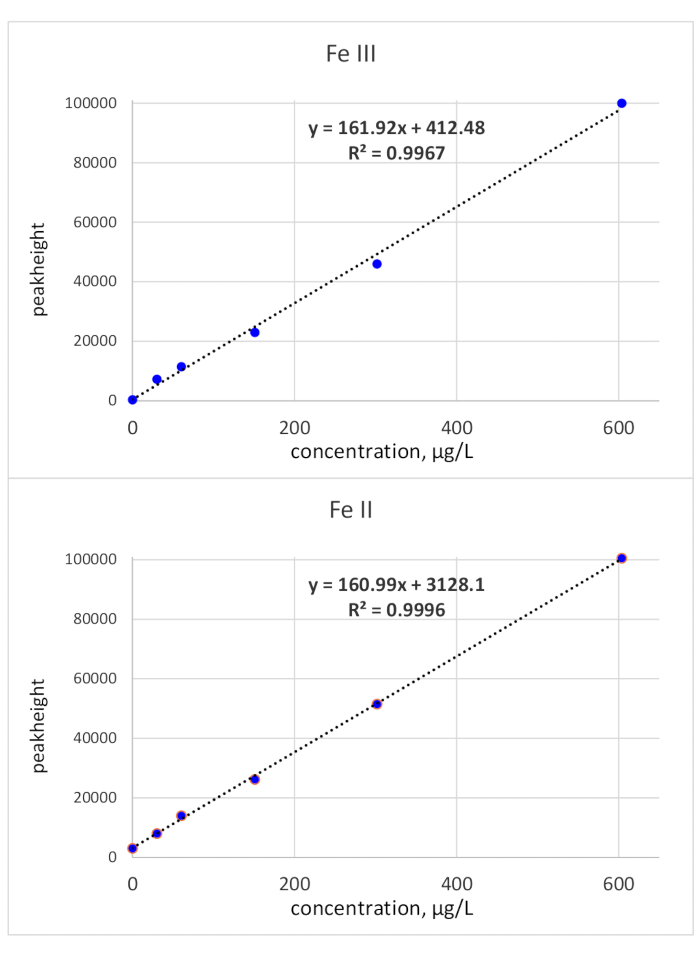
図2:Fe(III)とFe(II)のキャリブレーション曲線(ピーク高さ)を示します。両方のFeレドックス種のピーク高さ関連キャリブレーションは、ca.161 *Xの傾きに線状です この 図のより大きなバージョンを表示するには、ここをクリックしてください。
SH-SY5Y細胞ライセートの解析
SH-SY5Y細胞リセートの分析は、幾分高い導電性のために鉄の酸化還元種のわずかに遅い移動を示した。Fe(III) は移行時間の 124 s で監視され、Fe(II) は移行時間の 158 s で監視されました。SH-SY5Y細胞ライセートの移動時間精度は、Fe(III)の場合は2%、Fe(II)では3%であった。この方法を用いた定量的Fe(II)およびFe(III)測定では、Fe(III)濃度が330μg/L、Fe(II)濃度が84μg/Lで、Fe(II)/Fe(III)比は0.25になります。図3に、それぞれ56のFe選択的電フェログラムが示されている。
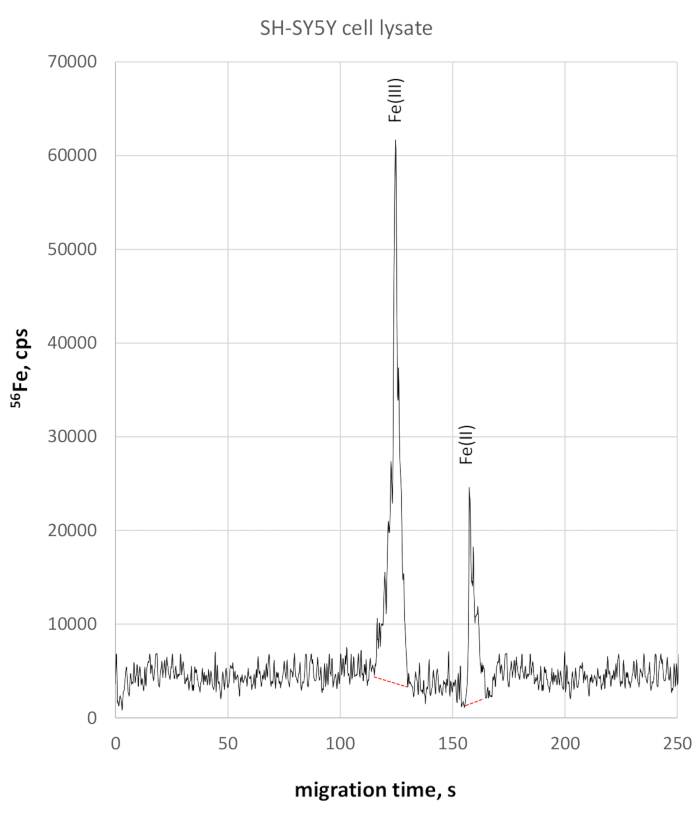
図3:SH-SY5Y細胞ライセートのFe特異的電解液56。Fe(III)は、123 sが58025 cpsのピーク高さに達し、158 sでFe(II)から明確に分離され、22800 cpsに達すると、この図のより大きなバージョンを見るにはここをクリックしてください。
ディスカッション
鉄はOSの進行において顕著な役割を果たすため、ミトコンドリア機能障害やFTPを促進するため、Ce-ICP-MSベースの同時Fe(II)/Fe(III)の種分化法が本稿で紹介され、その応用は細胞のライゼで例示されています。この方法は、短い分析時間とメリットの数値(LOQ、精度、回復)は、特に神経変性および癌研究において鉄酸化還元種化に関連するサンプルに適しています。LCに基づく以前の方法と比較して、このCEベースの方法は、カラムバッチとLCカラム変更後に以前に観察された再現性の問題から実質的に独立しています。各実行前のキャピラリー調製は<4分で、サンプルあたりの分析時間は3分まで適度な食分です。CZEの移動時間は、分子の電荷とサイズとは別に、サンプルプラグの導電率に依存し、サンプル自体が伝導率に大きく影響する場合に移動時間の変動やシフトを引き起こします。このような移行時間の変化は、毛細管電気泳動においてよく知られている。これはCZE-immanentの問題であり、文献21、22,22から知られている。標準およびSH-SY5Y細胞ライセートは、中程度で均質な導電性を有していた。その結果、移行時間は、精度の高い変更しか示さなかった。しかし、高い導電性を有するサンプルの場合、長時間の移動時間は最大5分観察される可能性がある。したがって、明確な種の識別には標準の追加が推奨されます。
鉄酸化還元の種分化における重要な問題は、サンプル調製88,13の間の種の安定性(すなわち、Fe(II)/(III)平衡の維持)である。不適切なpHやキレート性の化学物質、サンプルに接触する酸素(空気)や深い冷凍貯蔵の中断などの不適切な貯蔵条件は、Fe(II)/(III)バランスを容易に変更することができます。そこで、SH-SY5Y細胞ライセートの調製のために、キレート剤を一切含まないリシス緩衝液を選択し、生理学的pH、サンプル調製中の不活性ガスオーバーレイ、サンプル容器内および即時深凍結でこれらのサンプルに適用した。
文献では、Fe(II)を監視する半定量的アプローチを見つけることができます。酸化ストレスにおける鉄の役割を理解しやすくするために、いくつかの研究グループは、Fe(II)特異的プローブを開発し、鉄鉄の異常な上昇を半定量的に監視し、可視化しました。ただし、重要なのは、このようなプローブは Fe(III) を考慮せず、定量化せず、単に "もっと" または "より少ない" Fe(II)を報告します。現在までに、少数のバイオマーカーのみが、OSとFPTを決定するために利用可能であり、同時にFe(II)/Fe(III)レドックス種23、24,24を定量する信頼性の高い方法の欠如のためである。これを念頭に置いて、提示された方法は、Fe(III)とFe(II)の両方を1回の実行で迅速に定量化することを促進するものであり、鉄依存分子プロセスに関する洞察を深める有望なツールになるかもしれない。
開示事項
著者らは開示するものは何もない。
謝辞
VVは、ゲッティンゲン大学医療センターの壁内研究助成金(フォルシュングスフェルデルン)とエルゼ・クレナー・フレゼニウス・スティフトゥンのエルゼ・クレナー研究プログラムによって支えられた。
資料
| Name | Company | Catalog Number | Comments |
| CE capillary | CS-Chromatographie Service, Langerwehe, Germany | 105180-25 | |
| CE system | PrinCe technolgies | 0005.263 | model PrinCe 760 |
| Conical Superclear Tubes 15 ml | Analytics-shop.com by Altmann Analytik | PEN0777704 | |
| Conical Superclear Tubes 50 ml | Analytics-shop.com by Altmann Analytik | PEN0777694 | |
| FeCl2 * 4H2O | Merck | 103861 | |
| FeCl3 | Merck | 803945 | |
| Fluidflex Silikon HG-Schlauch | ProLiquid | 4001106HG | |
| Fused silica capillary OD 360 µm, ID 50 µm | Chromatographie Service GmbH | 105180-25 | |
| hydrochloric acid, 1 M | Merck | 1101652500 | corrosive |
| ICP-MS | Perkin Elmer | N814003 | |
| Luer, 3-way female | BioRad | 7318229 | |
| Luer, cone male | neoLab Migge | 2-1895 | |
| Luer, male | neoLab Migge | 2-1880 | |
| Peakfit peak evaluation software | Systat | PeakFit 4.12 | |
| Pt-wire | Carl Roth | 0737.1 | |
| PVC tube | ProLiquid | 6000002 | |
| RIPA buffer | Abcam | ab156034 | |
| Tetramethylammoniumhydroxide, 25 % | Merck | 814748 | corrosive |
| TYGON-tube R-3607 | ProLiquid | 3700203A |
参考文献
- Hare, D. J., et al. Is early-life iron exposure critical in neurodegeneration. Nature Reviews Neurology. 11 (9), 536-544 (2015).
- Ashraf, A., Clark, M., So, P. W. The Aging of Iron Man. Frontiers in Aging Neuroscience. 10, (2018).
- Hare, D. J., Cardoso, B. R., Szymlek-Gay, E. A., Biggs, B. A. Neurological effects of iron supplementation in infancy: finding the balance between health and harm in iron-replete infants. Lancet Child Adolesc Health. 2 (2), 144-156 (2018).
- Torti, S. V., Torti, F. M. Iron and cancer: more ore to be mined. Nature Reviews Cancer. 13 (5), 342-355 (2013).
- Kehrer, J. P. The Haber-Weiss reaction and mechanisms of toxicity. Toxicology. 149 (1), 43-50 (2000).
- Gaschler, M. M., Stockwell, B. R. Lipid peroxidation in cell death. Biochemical and Biophysical Research Communications. 482 (3), 419-425 (2017).
- Michalke, B., Halbach, S., Nischwitz, V. JEM Spotlight: Metal speciation related to neurotoxicity in humans. Journal of Environmental Monitoring. 11 (5), 939-954 (2009).
- Solovyev, N., Vinceti, M., Grill, P., Mandrioli, J., Michalke, B. Redox speciation of iron, manganese, and copper in cerebrospinal fluid by strong cation exchange chromatography - sector field inductively coupled plasma mass spectrometry. Analytica Chimica Acta. 973, 25-33 (2017).
- Lee, H. J., et al. Effect of excess iron on oxidative stress and gluconeogenesis through hepcidin during mitochondrial dysfunction. Journal of Nutritional Biochemistry. 26 (12), 1414-1423 (2015).
- Dixon, S. J., Lemberg, K. M., Lamprecht, M. R., Skouta, R., Zaitsev, E. M., Gleason, C. E., et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death. Cell. 149 (5), 1060-1072 (2012).
- Stockwell, B. R., et al. Ferroptosis: A Regulated Cell Death Nexus Linking Metabolism, Redox Biology, and Disease. Cell. 171 (2), 273-285 (2017).
- Michalke, B., Berthele, A., Mistriotis, P., Ochsenkuhn-Petropoulou, M., Halbach, S. Manganese speciation in human cerebrospinal fluid using CZE coupled to inductively coupled plasma MS. Electrophoresis. 28 (9), 1380-1386 (2007).
- Fernsebner, K., Zorn, J., Kanawati, B., Walker, A., Michalke, B. Manganese leads to an increase in markers of oxidative stress as well as to a shift in the ratio of Fe(II)/(III) in rat brain tissue. Metallomics. 6 (4), 921-931 (2014).
- Neth, K. Manganese: Species Pattern and Mechanisms of Brain Injury. , Technical University of Munich, Analytical Food Chemistry. Doctoral Dissertation (2015).
- Neth, K., et al. Changes in Brain Metallome/Metabolome Pattern due to a Single i.v. Injection of Manganese in Rats. Plos One. 10 (9), (2015).
- Venkataramani, V., et al. Manganese causes neurotoxic iron accumulation via translational repression of Amyloid Precursor Protein (APP) and H-Ferritin. Journal of Neurochemistry. 147 (6), 831-848 (2018).
- Willkommen, D., Lucio, M., Schmitt-Kopplin, P., Gazzaz, M., Schroeter, M., Sigaroudi, A., Michalke, B. Species fractionation in a case-control study concerning Parkinson's disease: Cu-amino acids discriminate CSF of PD from controls. Journal of Trace Elements in Medicine and Biology. 49, 164-170 (2018).
- Thibault, P., Dovichi, N. J. General instrumentation and detection systems including mass spectrometry. Capillary Electrophoresis - Theory and Practice. Camilleri, P. , CRC Press. Boca Raton, Boston, New York, Washington D.C., London. 23-89 (1998).
- Iliff, J. J., et al. A Paravascular Pathway Facilitates CSF Flow Through the Brain Parenchyma and the Clearance of Interstitial Solutes, Including Amyloid beta. Science Translational Medicine. 4 (147), (2012).
- Michalke, B. Manganese speciation using capillary electrophoresis-ICP-mass spectrometry. Journal of Chromatography A. 1050 (1), 69-76 (2004).
- Kuhn, R., Hofstetter-Kuhn, S. Capillary electrophoresis: Principles and practice. , Springer. Berlin, Heidelberg. (1993).
- Michalke, B. Capillary electrophoretic methods for a clear identification of selenoamino acids in complex matrices such as human milk. Journal of Chromatography A. 716 (1-2), 323-329 (1995).
- Yang, W. S., et al. Regulation of ferroptotic cancer cell death by GPX4. Cell. 156 (1-2), 317-331 (2014).
- Shimada, K., Hayano, M., Pagano, N. C., Stockwell, B. R. Cell-Line Selectivity Improves the Predictive Power of Pharmacogenomic Analyses and Helps Identify NADPH as Biomarker for Ferroptosis Sensitivity. Cell Chemical Biology. 23 (2), 225-235 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved