Method Article
Установка капиллярной электрофорезной индуктивно соединенной плазменной масс-спектрометрии (CE-ICP-MS) для количественной оценки видов железного редокса (Fe (II), Fe (III))
В этой статье
Резюме
Этот метод видообразования редокса железа основан на капиллярной электрофорез-индуктивно соединенной плазменной масс-спектрометрии с укладкой образца в сочетании с коротким анализом за один запуск. Метод быстро анализирует и обеспечивает низкие пределы количественной оценки для видов красного железа в различных тканях и биофлюидных образцах.
Аннотация
Дисгеостаз метаболизма железа учитывается в патофизиологических рамках многочисленных заболеваний, в том числе онкологических и нескольких нейродегенеративных состояний. Чрезмерное железо приводит к свободному редокс-активному Fe (II) и может вызвать разрушительные последствия в клетке, такие как окислительный стресс (ОС) и смерть от перекисного окисления липидов, известного как ферроптоз (FPT). Таким образом, количественные измерения железа ферроса (Fe(II)) и железа феррика (Fe(III)) вместо полного определения Fe является ключом к более внимательному пониманию этих пагубных процессов. Поскольку определения Fe (II)/(III) могут быть затруднены быстрыми сдвигами редокс-состояния и низкими концентрациями в соответствующих образцах, таких как спинномозговая жидкость (CSF), должны быть доступны методы, которые быстро анализируют и обеспечивают низкие пределы количественной оценки (ЛОЗ). Капиллярный электрофорез (CE) предлагает преимущество быстрого разделения Fe (II)/Fe(III) и работает без стационарной фазы, которая может помешать балансу редокса или вызвать прилипание аналита. CE в сочетании с индуктивно соединенной плазменной масс-спектрометрией (ICP-MS) в качестве детектора предлагает дальнейшее улучшение чувствительности и избирательности обнаружения. Представленный метод использует 20 мМВ HCl в качестве фонового электролита и напряжения 25 кВ. Пиковые формы и пределы обнаружения концентрации улучшаются путем укладки проводимости рН. Для уменьшения на 56«ArO» ICP-MS работал в режиме динамической реакционной ячейки (ДРК) с NH+3 в качестве реакционной реакции газа. Метод достигает предела обнаружения (LOD) в 3 мкг/л. Благодаря укладке, более высокие объемы инъекций были возможны без затруднения разделения, но улучшения LOD. Калибровки, связанные с пиковой областью, были линейными до 150 мкг/л. Точность измерений составила 2,2% (Fe(III)) до 3,5% (Fe(II)). Точность времени миграции составила lt;3% для обоих видов, определяемых в 1:2 разбавленных лизатах клеток нейробластомы человека (SH-SY5Y). Эксперименты по восстановлению со стандартным добавлением показали точность 97% Fe (III) и 105% Fe (II). В реальных био-образцах, таких как CSF, время миграции может варьироваться в зависимости от различной проводимости (т.е. солености). Таким образом, пик идентификации подтверждается стандартным добавлением.
Введение
Сегодня наиболее очевидно, что железо-опосредованное окислительное напряжение (ОС) играет решающую роль в многочисленныхрасстройств,в частности, в нейродегенеративных расстройств мозга, как болезнь Альцгеймера и Паркинсона, атакже в рак 1,2,3,4. ОС тесно связана с состоянием и балансом редокс-пары Fe (II)/Fe (III). В то время как Fe (III) является redox-неактивным, Fe (II) мощно генерирует реактивный вид кислорода (ROS) путем катализации H2O2 разложения следуют из гидроксилового радикала производства и мембраны перекисногоокисления липидов 5,6. На молекулярном уровне, Fe (II)-генерируемых ROS и пероксидированных фосфолипидов являются сильным нападением на целостность белков, липидов иДНК 7,8. Такая вредопроизвольная клеточная дисфункция была продемонстрирована, чтобы вызвать митохондриальнуюдисфункцию с уменьшенным содержанием АТФ 9 и может даже вызвать запрограммированную смерть некротических клеток, известный какферроптоз(FPT) 10,11. Таким образом, количественное Фе (II)/(III) видообразование редокса имеет большое значение в широком спектре расстройств, связанных с редоксом.
Химическая спецификация является устоявшимся инструментом для изучения микроэлементов биологическойроли и обмена веществ в целом 7,8, а также внейродегенеративных состояниях 12,,13,,14,,15,,16,,17., Методы видообразования Фе-редокса, найденные в литературе, как правило, основаны на разделении жидкой хроматографии (LC). Некоторые литературы используют индуктивно соединенную плазменную масс-спектрометрию (ICP-MS) в качестве элемента селективного детектора. Однако, в обычной работе LC, чрезмерное время чистки было необходимо между бегами. Еще более проблематичным является то, что пакетная вариация столбцов LC заставила пере оптимизацию условий elution после каждого изменения столбца. Эти проблемы препятствуют высокой пропускной способности. Требуется дополнительное время, чтобы получить приемлемую надежность и тщательно оценить метод еще раз.
Чтобы обойти эти недостатки, метод представлен здесь для Fe (II)/Fe (III) redox speciation на основе капиллярного электрофореза индуктивно соединенной плазменной масс-спектрометрии (CE-ICP-MS). CE предлагает различные преимущества по сравнению с LC18. Капилляры не имеют стационарной фазы и, таким образом, зависят (почти) не от личности партии. Когда они в возрасте или заблокированы, они быстро заменяются, показывая, как правило, неизменную производительность. Шаги очистки и очистки между образцами являются эффективными и короткими, и время анализа на выборку тоже короткое.
Представленный метод надежен с хорошими цифрами заслуг. В качестве доказательства принципа, метод применяется к человеку дофаминергической нейробластомы (SH-SY5Y) клеток ликат, образец типа важно в нейродегенерации, а также исследованиярака 19.
протокол
ВНИМАНИЕ: Метод использует соляную кислоту (HCl, начиная разбавления от ультрапура, концентрация 1 M) и тетраметиламмониумогидроксида (TMAH, начиная разбавления от ультрапура, концентрация 25%). Оба вещества сильно коррозионные. Используйте защиту кожи и глаз.
1. Подготовка электролитов
- Подготовка HCl-электролитов: фоновый электролит (20 мМВ HCl), розетка электролита (5 мМ HCl) и прекращение электролита (0,05 мММ HCl)
- Приготовьте 20 мМ HCl в колбе 100 мл: Pipette 2 мл 1 М HCl в колбу, заполните до отметки ультрачистой водой и встряхните осторожно.
- Приготовьте 5 мМХЛ в колбе 100 мл: Пипетка 500 МКЛ 1 МХЛ в колбу, заполните до отметки ультрачистой водой и осторожно встряхните.
- Подготовка 0,05 мММ HCl в два этапа: Pipette 1 мл 20 мМ HCl в 100 мл колбы, а затем заполнить до отметки с ультрапурной водой и встряхнуть осторожно. Впоследствии пипетку 2,5 мл последнего раствора в коническую трубку 15 мл(таблица материалов)и добавить 7,5 мл ультрачистой воды, затем аккуратно встряхнуть.
- Подготовка ведущего электролита 12% TMAH в конической трубке 15 мл: Pipette 4.8 мл 25% TMAH в трубку, добавить 5,2 мл ультрачистой воды и встряхнуть осторожно.
ПРИМЕЧАНИЕ: 12% TMAH используется для очистки и очистки капилляров перед каждым запуском и в качестве ведущего электролита перед вводили образца).
2. Подготовка и хранение стандартов и образцов
- Стандарты
- Для Fe (II), весят 35,61 мг Fe (II)Cl2 х4H 2O в 100 мл колбы и заполнить до 100 мл знака с ультрапурной водой для 100 мг Fe (II)/L концентрации запасов. Встряхните осторожно до полного растворения.
- Для Fe (III), весят 29,04 мг Fe(III)Cl3 в колбу 100 мл и заполнить до 100 мл марки с ультрапурной водой для 100 мг Fe (III)/L концентрации запасов. Встряхните осторожно до полного растворения.
- Разбавить каждое стандартное решение в соответствии с таблицей 1 для подготовки рабочих стандартных решений.
ПРИМЕЧАНИЕ: После подготовки ежедневных фондовых растворов из 100 мг / л фондового раствора, последний должен храниться замороженным. После подготовки суточных стандартов в соответствии с таблицей 1, 1 мг / л фондовый раствор должен быть aliquoted в 1,5 мл томов и хранятся замороженные (лучше всего без воздуха осталось на вершине) в 1,5 мл труб. На каждый новый день один ежедневный лимит акций размороживается для подготовки суточных стандартов и снимается после использования.
| Начальная концентрация | Объем труб | Заполните с водой Милли-З | Результирующая концентрация | Окончательный том | Использование решения |
| 100 мг/л | 50 мкл | 4950 мкл | 1 мг/л | 50 мл | Ежедневное решение по акциям |
| 1 мг/л | 200 мкл | 1800 мкл | 100 мкг/л | 2 мл | Стандартный |
| 100 мкг/л | |||||
| 1 мг/л | 100 мкл | 1900 мкл | 50 мкг/л | 2 мл | Стандартный |
| 50 мкг/л | |||||
| 1 мг/л | 50 мкл | 1950 мкл | 25 мкг/л | 2 мл | Стандартный |
| 25 мкг/л | |||||
| 1 мг/л | 25 мкл | 1975 г. | 12,5 мкг/л | 2 мл | Стандартный |
| 12,5 мкг/л | |||||
| 1 мг/л | 20 мкл | 1980 мл | 10 мкг/л | 2 мл | Стандартный |
| 10 мкг/л | |||||
| 0 | 2000 мкл | 0 мкг/л | 2 мл | Пустой |
Таблица 1: Схема пипетки для подготовки стандартов.
- Sh-SY5Y ячейка лисировать
ПРИМЕЧАНИЕ: Лисат клетки (SH-SY5Y) служил Fe (II)/(III) - соответствующая био-матрица, чтобы показать производительность и надежность метода.- Используйте лисейт из ранее запуска экспериментов16. Следуйте этой клетки лисат подготовки избегая изменения рН или химических веществ, которые могут повлиять на баланс редокса. Используйте модифицированный буфер анализа радиоиммунопреципиетации (RIPA) (PBS pH 7.4, 0,5% деоксихолата натрия, 1% NP-40), избегая металлических хелаторов (таких как EDTA), снижающих агентов (таких как DTT, 2-Mercaptoethanol) и анионических сурфактантных моющих средств и металлических сложных агентов (таких как SDS) для минимизации после сбора изменений Fe(II)/Fe(III).
- Работа под N2-атмосферапрепятствует окислению O2 из окружающего воздуха и работать на льду, чтобы свести к минимуму любое аутоксидирование до тех пор, пока лизат не будет храниться как можно скорее при -80 градусов по Цельсию под азотной атмосферой.
3. Настройка инструментов для дефиса СЕ на МСП-МС
- Настройка капиллярного электрофорезного инструмента.
ПРИМЕЧАНИЕ: Для этого раздела, читатель в основном относится к руководству соответствующего инструмента, доступного в лаборатории.- Установите капилляр с подходящей длиной, чтобы добраться от флакона ce до небулайзера ICP-MS. Установите капилляр только на стороне входе и привести его за пределы инструмента к CE-ICP-MS интерфейса.
ПРИМЕЧАНИЕ: Для дефиса CE к ICP-MS, в этом протоколе 90 см сплавленного силика капилляр (ID 50 мкм) был установлен в соответствии с общим инструментальным описанием установки. Как правило, капиллярные размеры 70-100 см будут необходимы, в зависимости от положения приборов в лаборатории. - Де-активировать выход лифт CE-инструмент в программном обеспечении для бесперебойной работы, как это не используется, когда капилляр направлен за пределы интерфейса CE-ICP-MS.
- Установите триггерный кабель от CE-инструмента триггер-OUT для запуска-IN инструмента ICP-MS.
- Выберите позиции для всех необходимых решений (20 мМВ HCl, 0,05 мМВ HCl, 12% TMAH), стандарты и образцы в образце и решения ротора прибора и определить свои позиции в программном обеспечении прибора, как обычно (ссылка на руководство инструмента).
- Выберите температуру ротора и капилляра, чтобы быть идентичной при температуре 20 градусов по Цельсию, как идентичную контролируемой лабораторной температуре.
ПРИМЕЧАНИЕ: Нет градиента температуры капиллярных частей внутри и снаружи инструмента CE происходит.
- Установите капилляр с подходящей длиной, чтобы добраться от флакона ce до небулайзера ICP-MS. Установите капилляр только на стороне входе и привести его за пределы инструмента к CE-ICP-MS интерфейса.
- Настройка инструмента ICP-MS
- Оптимизация инструмента ICP-MS в соответствии с ежедневными инструментальными стандартными процедурами настройки и эксплуатации. Используйте протокол производителя.
- Используйте технологию динамических реакционной ячейки (ДРК) с NH3 в качестве газа ДРК, с значением 0,6 мл/мин NH3-flowrate и RPq 0,45.
ПРИМЕЧАНИЕ: Для спецификации железа, метод запрограммирован с 56Fe, будучи наиболее распространенным изотопом Fe (91,754% относительного изобилия),+ однако, будучи серьезно мешаетиз кластера No 40Ar16O. Четырехугольник на основе ICP-MS в стандартном режиме практически слеп и детектор в переполнении на этом изотопе. С настройками выше (см. шаг 3.2.2), низкие базовые показатели и высокая чувствительность достигаются (для регулярного общего определения железа LOD в низком диапазоне нг/л достигается). - Выберите параметр времени проживания на изотоп в 50 мс для мониторинга даже резких и коротких пиков появления во время разделения CE.
- Запрограммировать метод ICP-MS, который будет запущен CE-инструментом.
- Настройка интерфейса CE-ICP-MS
ПРИМЕЧАНИЕ: Есть в основном два варианта подключения CE-капилляр к МСП-МС. Следуйте предоставленным описаниям об установке, если используется коммерческий интерфейс. Этот протокол использует простой, домашний интерфейс, основанный на предыдущей публикации после модификаций20. Ключевыми вопросами являются эффективная небулизация с, возможно, меньше разбавления капиллярного эффлюкса в стороне от принятия общей ставки потока в небулайзер для лучшей небулизации. Кроме того, минимизация всасывающего потока через разделение капилляров, вызванных самоустремлением от небулайзера, и электрическое соединение заземленного электрода розетки с капиллярным концом являются обязательными.- Выбор небулайзера
- Используйте концентрический небулайзер с низким самооспирирующим объемом (например, 100 МКЛ/мин), который помещается в малообъемную камеру спрея.
ПРИМЕЧАНИЕ: Низкое поглощение вызовет лишь умеренное разбавление капиллярного эффлюкса параллельно с все еще оптимизированной небулизацией. Электрическое соединение электрода выхода выполнено потоком электролита вокруг электрода выхода и вокруг конца капилляра. - Используйте самоустремление небулайзера, чтобы свести к минимуму всасывание через отделяющий капилляр и для принятия скорости потока к оптимальному значению, необходимому небулайзеру.
- Подготовь следующие части из таблицы 2, чтобы смонтировать этот самодельный интерфейс.
- Используйте концентрический небулайзер с низким самооспирирующим объемом (например, 100 МКЛ/мин), который помещается в малообъемную камеру спрея.
- Настройка простого интерфейса
ПРИМЕЧАНИЕ: Используйте рисунок 1, чтобы следовать описанию части монтажа для простого интерфейса. Цифры на рисунке 1 и в следующем тексте относятся к цифрам в таблице 2.- Начните монтаж интерфейса, подключив два 3-путь женских разъемов Luer (No 3) с мужским конусом Luer разъем (No 4). Подключите левый конец нижней 3-й полосы Luer к мужскому разъему, а также к среднему соединению верхнего 3-го пути Luer.
- Положите 1 см трубки (No 1) над Pt-провода (No 7) и 1 см силиконовой трубки (No 5) над последним и сопла мужской разъем Luer (No 2). Исправьте сборку к среднему соединению нижнего 3-го разъема Luer (No 3) с помощью обычного вращения винта Luer.
- Нажмите 1 см трубки (No 1) над выходом конце CE капилляров и распоистить его около 8-9 см от конца.
- Положите 1 см силиконовой трубки (No 5) над последним и сопло мужского разъема Luer (No 2).
- Положите всю сборку слева через бар верхнего 3-путь-T разъем и исправить мужской разъем Luer и левый конец женского 3-путь Luer разъем (No 3) по Luer-типичный винт вращения.
- Зафиксировать 25-сантиметровую силиконовую трубку (No 5) на сопле мужского разъема Luer (No 2) и зафиксировать всю сборку в нижнем (правом) конце бара от нижнего 3-го разъема Luer (No.3) с помощью обычного вращения винта Luer.
- Возьмите 1 см силиконовой трубки (No 6) и нажмите его 5 мм над концом небулайзера плотно в то время как второй мужской разъем конуса Luer (No 4) плотно подключен к выступающей части силиконовой трубки.
- Переместив выше установленную часть интерфейса впоследствии с выступающим ce капилляром к мужскому конусу на небулайзере. Вставьте CE капилляр тщательно через мужской конус и далее через более широкую часть капилляра небулайзера, пока последний не станет узким. Учитывая, что выступающая длина капилляра была выбрана соответствующим образом, верхний женский 3-путь Luer разъем теперь также плотно вписывается в мужской конус.
- При необходимости исправляй длину выступающей капиллярной длины, перемещая капилляр (вперед/назад) в трубку (No 1) при входе в самодельный интерфейс.
ПРИМЕЧАНИЕ: Оптимальное положение капилляра CE в начале капилляра небулайзера не слишком критично. Тем не менее, не толкать CE капилляров слишком близко к узкой части капилляра небулайзера. Это может помешать или заблокировать поток электролита розетки. Кроме того, это будет прерывать электрическое подключение к розетке электрода и увеличит всасывания через CE капилляров, в результате чего нарушено разделение. В свою очередь, не держите CE капиллярный конец слишком далеко от капилляров небулайзера с тех пор резкие разделенные пики будут расширены и разрешение будет потеряно. - Используйте объектив, чтобы определить наилучшее положение.
ПРИМЕЧАНИЕ: Рисунок 1 (внизу справа) показывает оптимальное положение CE-капилляров внутри небулайзера.
- Выбор небулайзера

Рисунок 1: Схема и монтаж интерфейса CE-ICP-MS. Схема определяет отдельные части для пошагового монтажа простого и дешевого интерфейса CE-ICP-MS. На окне показана фотография оптимального позиционирования CE-капилляра в небулайзере. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
| Нет. | Часть | используется для |
| 1 | Трубка (зелено-оранжевый цветовой код), 2 x. 1 см | фиксация CE капиллярных и розетки электрода на Luer-частей и поддержанию жесткой |
| 2 | Luer, мужчина, 3 x, подходит для 1,6 мм ID силиконовые трубки | подключение силиконовой трубки к розетке электролита и в качестве помощи для фиксации CE капилляров и Pt-провода электрода |
| 3 | 3-путь-Luer, женщина, 2 x | T-части для подключения электрода, капиллярного и аспирированного потока розетки |
| 4 | Конус Luer, мужчина, 2 x | подключение женщин Luers друг к другу и небулайзер |
| 5 | Силиконовая трубка, 1,6 мм ID, 0,8 мм стенка, 2 x 1 см, 1x ca. 25 см | а) 1см; ужесточение CE капилляров к интерфейсу, б) 1см; затякое Pt-провода к интерфейсу в) 25 см; подключение от розетки электролитной колбы к интерфейсу |
| 6 | Силиконовая трубка, 3 мм ID, 1,2 мм стенка, около 1 см | затяжевание конуса Luer к небулайзеру |
| 7 | Платиновый провод | Выход электрода |
Таблица 2: Части для построения простого, самостоятельного интерфейса CE-ICP-MS. Цифры также относятся к рисунку 1 и описанию в тексте.
4. Подготовка к измерению
ПРИМЕЧАНИЕ: Перед измерением капилляр должен быть промыт сильным щелочным раствором (здесь: 12% TMAH) для очистки, а затем заполнен фоновым электролитом. Для улучшения разделения вокруг образца строится сэндвич с буфером укладки на основе проводимости и градиентов рН. В таблице 3 кратко излагаются последовательные этапы подготовки капилляра, которые автоматически обрабатываются инструментом в соответствии с запрограммированным методом:
| Шаг-Нет | Шаг | Химических | Состояние |
| Подготовка колонки CE | |||
| Подготовка 1 | Капиллярная чистка | 12% TMAH | 4 бар, 1 мин. |
| Подготовка 2 | Капиллярная чистка с помощью фонового электролита | 20 мМВ HCl | 4 бар, 1 мин. |
| Подготовка 3 | Укладка: ведущий электролит | 12% TMAH | 150 мбар, 3 с |
| Подготовка 4 | Инъекций | Образец | 150 мбар, 3 с |
| Подготовка 5 | Укладка: прекращение электролита | 0.05 mM HCl | 150 мбар, 3 с |
Таблица 3: Шаги капиллярной подготовки перед измерением. Эти шаги запрограммированы с программным обеспечением CE-системы в CE-методе и включают инъекцию образца под давлением и наращивание «сэндвича укладки» вокруг образца.
- Программа метода CE, который выполняет последовательно шаги, данные в таблице 3.
- Определите образец таблицы и последовательности в программном обеспечении CE и скопировать эту последовательность также в программное обеспечение ICP-MS.
5. Измерение и оценка данных
- Запустите метод на инструменте CE. После запрограммированной подготовки и заполнения капилляра, измерение начинается автоматически, как только входной флакон, содержащий 20 мМ HCl, находится в положении на капиллярном входе. "Старт-триггер" отправляется в ICP-MS, который начинает он-лайн мониторинг Fe-изотопов.
ПРИМЕЧАНИЕ: Разделение использует напряжение 25 кВ. Расширенная длина капилляра, необходимая для подключения CE-инструмента к МСП-МС, приводит к неоправданному увеличению времени разделения. Таким образом, разделение поддерживается низким давлением 250 мбар на входе. Самооспирированный электролит в розетке составляет 5 мМВ HCl. Общий анализ составляет 3 минуты для образцов с умеренной проводимостью. В окне сигнала программного обеспечения ICP-MS электроферограмма может наблюдаться во время запуска. В конце каждого образца автоматически генерируются два файла данных, один из которых доступен только из программного обеспечения приборов из внутреннего банка данных, второй — в экспортной папке как формат ".xl" или ".txt", доступный по функции импорта из обычного хроматографического программного обеспечения. - Обратитесь к программному пособию инструмента ICP-MS для экспорта файлов в хроматографическое программное обеспечение.
Результаты
Измерения стандартов и калибровки
Время миграции было выяснено с помощью одно стандартных инъекций: стандарт Fe (III) отслеживался на уровне 118 с времени миграции и стандарт Fe (II) в 136 с времени миграции. Пределы обнаружения были рассчитаны с использованием критерия 3 "со ссылкой на базовый шум, и стандартная концентрация 50 мкг/л.LOD (Fe(II) составила 3,1 мкг/ли LOD (Fe(III) составила 3,2 мкг/л. Пиковая калибровка для обоих видов железа была линейной от LOD до 150 мкг/л. В то время как линейность Fe (III) была доказана также для более высокой концентрации, наклон кривой калибровки для Fe (II) уменьшился. Верхний предел концентрации в 150 мкг/л был сочтен достаточным, поскольку био-образцы, имеющие отношение к определению Fe (II)/(III), как правило, имеют более низкую концентрацию Fe. В случае более высокой концентрации образцы могут быть разбавлены соответствующим образом. Калибровка пиковой высоты была проверена до 600 мкг/л и показала линейность по всему испытанного диапазону. Это показано на рисунке 2.
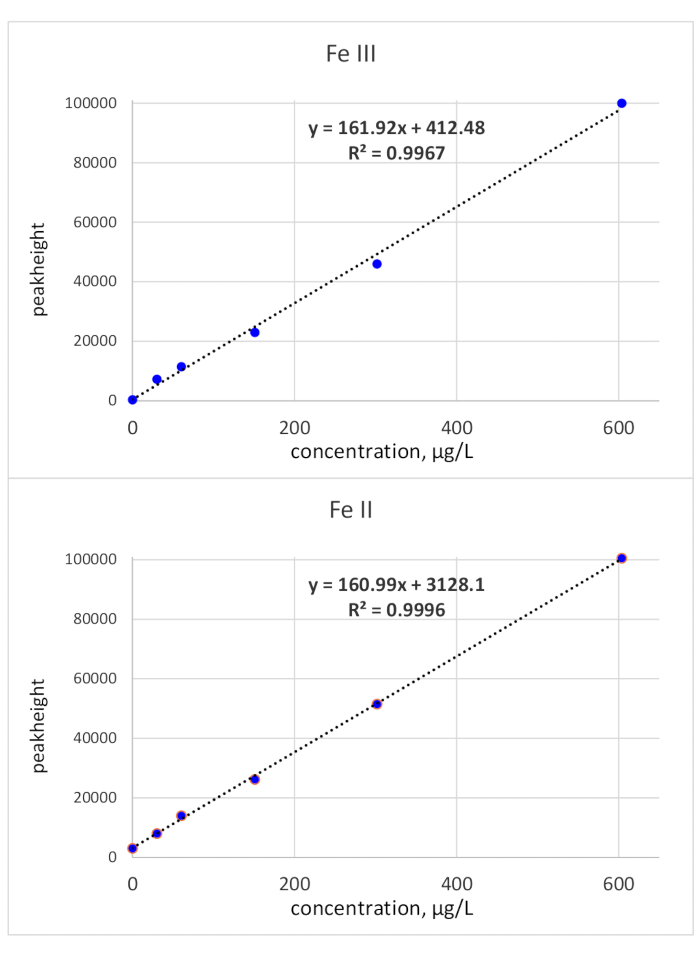
Рисунок 2: Кривые калибровки (пиковая высота) Fe (III) и Fe (II). Пик высоты, связанных калибровки обоих видов Fe redox являются линейными со склоном около 161 "X Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.
Анализ лисяя клеток SH-SY5Y
Анализ лисата клеток SH-SY5Y показал несколько более медленный миграцию видов редокса железа из-за несколько более высокой проводимости. Fe (III) отслеживался в 124 с миграционного времени, Fe (II) в 158 с миграционного времени. Точность времени миграции в ликате ячейки SH-SY5Y составила 2% для Fe (III) и 3% для Fe (II). Количественные измерения Fe (II) и Fe (III) с использованием этого метода показали концентрацию Fe (III) концентрации 330 мкг/л и fe (II) концентрации 84 мкг/л, что привело к соотношению Fe(II)/Fe (III) 0,25. Соответствующая 56 Фе-селективнаяэлектроферограмма продемонстрирована на рисунке 3.
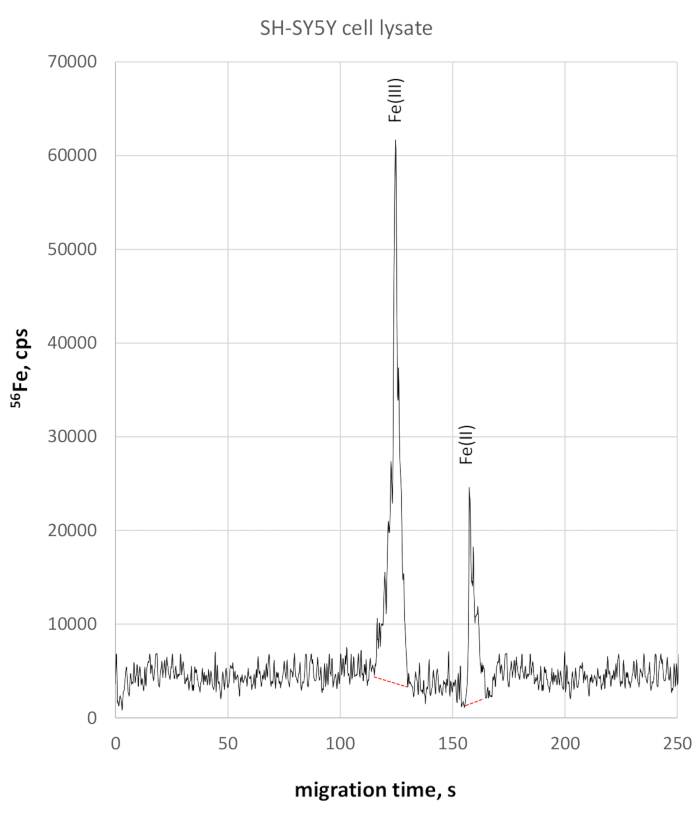
Рисунок 3: 56Fe-специфической электроферограммы SH-SY5Y ячейки лисации. Fe (III) контролируется на 123 с достижения 58025 CPS пик высоты, будучи четко отделены от Fe (II) на 158 с, достигнув 22800 CPS Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Так как железо играет заметную роль в прогрессировании ОС, тем самым облегчая митохондриальную дисфункцию или FTP, универсальный количественный метод на основе CE-ICP-MS для одновременного fe (II)/Fe (III) видообразования представлен в этой статье, и его применение образцово продемонстрировано в лизированиях клеток. Метод при условии короткого времени анализа и цифры заслуг (ЛОЗ, точность, восстановление) подходят для образцов, имеющих отношение к спецификации редокс железа конкретно в нейродегенеративных и онкологических исследований. По сравнению с предыдущими методами, основанными на LC, этот метод на основе CE практически не зависит от пакетов столбца и ранее наблюдались проблемы воспроизводимости после изменения LC-столбца. Капиллярная подготовка перед каждым запуском составляет 4 минуты и время анализа на образец с умеренной соленостью до 3 мин. Помимо заряда и размера молекулы, время миграции в СЗЕ зависит от проводимости в пробной пробке, что приводит к изменению времени миграции или сдвигам, когда сами образцы оказывают значительное влияние на проводимость. Такие сдвиги во времени миграции хорошо известны в капиллярных электрофорез. Это проблема, известная из литературы21,22. Стандарты и лизаты клеток SH-SY5Y имели умеренную и однородную проводимость. Следовательно, время миграции показало лишь небольшое изменение с хорошей точностью. Однако для образцов с высокой проводимостью продолжительное время миграции может наблюдаться до 5 минут. Поэтому для четкой идентификации видов рекомендуются стандартные дополнения.
Критическим вопросом в спецификации красного железа является стабильность видов (т.е. поддержание Fe (II)/(III) эквилибрии) во времяподготовки образца 8,13. Неуместные рН или хелатирующие химические вещества, а также ненадлежащие условия хранения, такие как кислород (воздух) при контакте с образцом или разрыв в глубоко замороженном хранилище, могут легко изменить баланс Fe (II)/(III). Поэтому для подготовки лизатов клеток SH-SY5Y для этих образцов был выбран лизизный буфер без каких-либо хелатирующих химических веществ, физиологических рН, но инертная накладка газа при подготовке образца, в пробных контейнерах и немедленной глубокой заморозке.
В литературе можно найти полуколиченые подходы к мониторингу Fe (II). Для улучшения понимания роли железа в окислительном стрессе несколько исследовательских групп разработали специальные зонды Fe(II) для полуколичественного мониторинга и визуализации аномальной высоты железа в пробирке. Однако, важно отметить, такие зонды не считают Fe (III) и не количественно, но доклад просто "больше" или "менее" Fe (II)). На сегодняшний день, только несколько биомаркеров доступны для определения ОС и FPT, будучи из-за отсутствия надежных методов для одновременной количественной оценки Fe (II)/Fe (III) redoxвидов 23,24. Имея это в виду, представленный метод - содействие быстрой количественной оценки как Fe (III) и Fe (II) в одном запуске - может стать перспективным инструментом для углубления понимания железозависимых молекулярных процессов.
Раскрытие информации
Авторов нечего раскрывать.
Благодарности
VV была поддержана интрамуральным исследовательским грантом (Forschungsf'rderung) Университетского медицинского центра Гёттингена и исследовательской программой Else Kr'ner-Fresenius-Stiftung.
Материалы
| Name | Company | Catalog Number | Comments |
| CE capillary | CS-Chromatographie Service, Langerwehe, Germany | 105180-25 | |
| CE system | PrinCe technolgies | 0005.263 | model PrinCe 760 |
| Conical Superclear Tubes 15 ml | Analytics-shop.com by Altmann Analytik | PEN0777704 | |
| Conical Superclear Tubes 50 ml | Analytics-shop.com by Altmann Analytik | PEN0777694 | |
| FeCl2 * 4H2O | Merck | 103861 | |
| FeCl3 | Merck | 803945 | |
| Fluidflex Silikon HG-Schlauch | ProLiquid | 4001106HG | |
| Fused silica capillary OD 360 µm, ID 50 µm | Chromatographie Service GmbH | 105180-25 | |
| hydrochloric acid, 1 M | Merck | 1101652500 | corrosive |
| ICP-MS | Perkin Elmer | N814003 | |
| Luer, 3-way female | BioRad | 7318229 | |
| Luer, cone male | neoLab Migge | 2-1895 | |
| Luer, male | neoLab Migge | 2-1880 | |
| Peakfit peak evaluation software | Systat | PeakFit 4.12 | |
| Pt-wire | Carl Roth | 0737.1 | |
| PVC tube | ProLiquid | 6000002 | |
| RIPA buffer | Abcam | ab156034 | |
| Tetramethylammoniumhydroxide, 25 % | Merck | 814748 | corrosive |
| TYGON-tube R-3607 | ProLiquid | 3700203A |
Ссылки
- Hare, D. J., et al. Is early-life iron exposure critical in neurodegeneration. Nature Reviews Neurology. 11 (9), 536-544 (2015).
- Ashraf, A., Clark, M., So, P. W. The Aging of Iron Man. Frontiers in Aging Neuroscience. 10, (2018).
- Hare, D. J., Cardoso, B. R., Szymlek-Gay, E. A., Biggs, B. A. Neurological effects of iron supplementation in infancy: finding the balance between health and harm in iron-replete infants. Lancet Child Adolesc Health. 2 (2), 144-156 (2018).
- Torti, S. V., Torti, F. M. Iron and cancer: more ore to be mined. Nature Reviews Cancer. 13 (5), 342-355 (2013).
- Kehrer, J. P. The Haber-Weiss reaction and mechanisms of toxicity. Toxicology. 149 (1), 43-50 (2000).
- Gaschler, M. M., Stockwell, B. R. Lipid peroxidation in cell death. Biochemical and Biophysical Research Communications. 482 (3), 419-425 (2017).
- Michalke, B., Halbach, S., Nischwitz, V. JEM Spotlight: Metal speciation related to neurotoxicity in humans. Journal of Environmental Monitoring. 11 (5), 939-954 (2009).
- Solovyev, N., Vinceti, M., Grill, P., Mandrioli, J., Michalke, B. Redox speciation of iron, manganese, and copper in cerebrospinal fluid by strong cation exchange chromatography - sector field inductively coupled plasma mass spectrometry. Analytica Chimica Acta. 973, 25-33 (2017).
- Lee, H. J., et al. Effect of excess iron on oxidative stress and gluconeogenesis through hepcidin during mitochondrial dysfunction. Journal of Nutritional Biochemistry. 26 (12), 1414-1423 (2015).
- Dixon, S. J., Lemberg, K. M., Lamprecht, M. R., Skouta, R., Zaitsev, E. M., Gleason, C. E., et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death. Cell. 149 (5), 1060-1072 (2012).
- Stockwell, B. R., et al. Ferroptosis: A Regulated Cell Death Nexus Linking Metabolism, Redox Biology, and Disease. Cell. 171 (2), 273-285 (2017).
- Michalke, B., Berthele, A., Mistriotis, P., Ochsenkuhn-Petropoulou, M., Halbach, S. Manganese speciation in human cerebrospinal fluid using CZE coupled to inductively coupled plasma MS. Electrophoresis. 28 (9), 1380-1386 (2007).
- Fernsebner, K., Zorn, J., Kanawati, B., Walker, A., Michalke, B. Manganese leads to an increase in markers of oxidative stress as well as to a shift in the ratio of Fe(II)/(III) in rat brain tissue. Metallomics. 6 (4), 921-931 (2014).
- Neth, K. . Manganese: Species Pattern and Mechanisms of Brain Injury. , (2015).
- Neth, K., et al. Changes in Brain Metallome/Metabolome Pattern due to a Single i.v. Injection of Manganese in Rats. Plos One. 10 (9), (2015).
- Venkataramani, V., et al. Manganese causes neurotoxic iron accumulation via translational repression of Amyloid Precursor Protein (APP) and H-Ferritin. Journal of Neurochemistry. 147 (6), 831-848 (2018).
- Willkommen, D., Lucio, M., Schmitt-Kopplin, P., Gazzaz, M., Schroeter, M., Sigaroudi, A., Michalke, B. Species fractionation in a case-control study concerning Parkinson's disease: Cu-amino acids discriminate CSF of PD from controls. Journal of Trace Elements in Medicine and Biology. 49, 164-170 (2018).
- Thibault, P., Dovichi, N. J., Camilleri, P. General instrumentation and detection systems including mass spectrometry. Capillary Electrophoresis - Theory and Practice. , 23-89 (1998).
- Iliff, J. J., et al. A Paravascular Pathway Facilitates CSF Flow Through the Brain Parenchyma and the Clearance of Interstitial Solutes, Including Amyloid beta. Science Translational Medicine. 4 (147), (2012).
- Michalke, B. Manganese speciation using capillary electrophoresis-ICP-mass spectrometry. Journal of Chromatography A. 1050 (1), 69-76 (2004).
- Kuhn, R., Hofstetter-Kuhn, S. . Capillary electrophoresis: Principles and practice. , (1993).
- Michalke, B. Capillary electrophoretic methods for a clear identification of selenoamino acids in complex matrices such as human milk. Journal of Chromatography A. 716 (1-2), 323-329 (1995).
- Yang, W. S., et al. Regulation of ferroptotic cancer cell death by GPX4. Cell. 156 (1-2), 317-331 (2014).
- Shimada, K., Hayano, M., Pagano, N. C., Stockwell, B. R. Cell-Line Selectivity Improves the Predictive Power of Pharmacogenomic Analyses and Helps Identify NADPH as Biomarker for Ferroptosis Sensitivity. Cell Chemical Biology. 23 (2), 225-235 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены