Method Article
Configuração da Espectrometria de Massa de Plasma Acoplada de Eletroforese Capilar (CE-ICP-MS) para quantificação de espécies de redox de ferro (Fe(II), Fe(III))
Neste Artigo
Resumo
Este método de especiação de redox de ferro é baseado na espectrometria de massa de plasma capilar indutivamente acoplada com empilhamento de amostras combinado com análise curta em uma corrida. O método analisa rapidamente e fornece baixos limites de quantificação para espécies de redox de ferro em uma variedade diversificada de tecidos e amostras biofluidas.
Resumo
A dishomeostase do metabolismo do ferro é contabilizada no quadro fisiopatológico de inúmeras doenças, incluindo câncer e várias condições neurodegenerativas. O ferro excessivo resulta em fe(II) livremente ativo e pode causar efeitos devastadores dentro da célula como estresse oxidativo (OS) e morte por peroxidação lipídica conhecida como ferroptose (TF). Portanto, as medições quantitativas de ferro (Fe(II)) e ferrílico (Fe(III)) em vez de determinação fe total é a chave para uma visão mais aprofundada desses processos prejudiciais. Uma vez que as determinações fe(II)/(III) podem ser dificultadas por rápidas mudanças de estado redox e baixas concentrações em amostras relevantes, como o fluido cefalorraquidiano (CSF), devem estar disponíveis métodos que analisem rapidamente e forneçam baixos limites de quantificação (LOQ). A eletroforese capilar (CE) oferece a vantagem da separação rápida fe(II)/Fe(III) e funciona sem uma fase estacionária, o que poderia interferir no equilíbrio redox ou causar aderência de analito. CE combinado com espectrometria de massa plasmática indutivamente acoplada (ICP-MS) como detector oferece uma melhoria adicional da sensibilidade de detecção e seletividade. O método apresentado utiliza 20 mM HCl como eletrólito de fundo e tensão de +25 kV. As formas de pico e os limites de detecção de concentração são melhorados pelo empilhamento de condutividade-pH. Para redução de 56[ArO]+, O ICP-MS foi operado no modo de célula de reação dinâmica (DRC) com NH3 como gás de reação. O método atinge um limite de detecção (LOD) de 3 μg/L. Devido ao empilhamento, maiores volumes de injeção foram possíveis sem dificultar a separação, mas melhorando o LOD. As calibrações relacionadas à área de pico foram lineares até 150 μg/L. A precisão de medição foi de 2,2% (Fe(III)) a 3,5% (Fe(II)). A precisão do tempo de migração foi <3% para ambas as espécies, determinada em 1:2 diluídos lysates de células neuroblastoma humana (SH-SY5Y). Experimentos de recuperação com adição padrão revelaram precisão de 97% Fe(III) e 105 % Fe(II). Em bio-amostras reais como CSF, o tempo de migração pode variar de acordo com a condutividade variada (ou seja, salinidade). Assim, o pico de identificação é confirmado pela adição padrão.
Introdução
Hoje, é mais evidente que o estresse oxidativo mediado por ferro (OS) desempenha um papel crucial em múltiplos distúrbios especificamente em distúrbios cerebrais neurodegenerativos, como Alzheimer e Mal de Parkinson, bem como no câncer1,,2,,3,4. Os OS estão intimamente relacionados com o estado e o equilíbrio do casal redox Fe(II)/Fe(III). Enquanto fe(III) é reativo de redox, Fe(II) potentemente gera espécies reativas de oxigênio (ROS) catalisando a decomposição H2O2 seguida da produção radical hidroxíl e da peroxidação lipídica da membrana5,6. Em nível molecular, ros(II) gerado por Fe(II) e fosfolipídios peroxidizados são um forte ataque à integridade de proteínas, lipídios e DNA7,,8. Tal disfunção celular prejudicial foi demonstrada para induzir disfunção mitocondrial com diminuição do teor de ATP9 e pode até desencadear uma morte celular necrosada programada, conhecida como ferroptose (FPT)10,11. Portanto, a especiação quantitativa de Fe(II)/(III) é de importância eminente em um amplo espectro de distúrbios relacionados com redox.
A especiação química é uma ferramenta bem estabelecida para o estudo de traços de traços papel biológico e metabolismo em geral7,8, bem como em condições neurodegenerativas12,13,,14,,15,,16,17. Os métodos para especiação fe-redox encontrados na literatura são tipicamente baseados na separação da cromatografia líquida (LC). Parte da literatura usa espectrometria de massa plasmática indutivamente acoplado (ICP-MS) como um detector seletivo de elementos. No entanto, no trabalho de rotina da LC, eram necessários tempos excessivos de expurgo entre as corridas. Ainda mais problemática, a variação em lote das colunas LC forçou a ree otimização das condições de elução após a alteração de cada coluna. Esses problemas estão dificultando o alto rendimento. Tempo adicional é necessário para obter confiabilidade aceitável e avaliar completamente o método novamente.
Para contornar essas desvantagens, um método é apresentado aqui para a especiação de redox Fe(II)/Fe(III) baseada na eletroforese capilar acoplada indutivamente espectrometria de massa plasmática (CE-ICP-MS). CE oferece várias vantagens em comparação com a LC18. Os capilares não têm fase estacionária e, portanto, não dependem (quase) da identidade do lote. Quando envelhecidas ou bloqueadas, são substituídas rapidamente, mostrando desempenho geralmente inalterado. As etapas de limpeza e limpeza entre as amostras são eficazes e curtas, e o tempo de análise por amostra também é curto.
O método apresentado é confiável com bons números de mérito. Como prova de princípio, o método é aplicado ao lisato celular dopaminérgico humano (SH-SY5Y), um tipo de amostra importante na neurodegeneração, bem como na pesquisa do câncer19.
Protocolo
ATENÇÃO: O método utiliza ácido clorídrico (HCl, diluições iniciais de ultrapura, concentração 1 M) e tetrametamimeniumhidroxida (TMAH, diluições iniciais de ultrapura, concentração de 25%). Ambas as substâncias são fortemente corrosivas. Use proteção de pele e olhos.
1. Preparação de eletrólitos
- Preparação de HCl-eletrólitos: eletrólito de fundo (20 mM HCl), eletrólito de tomada (5 mM HCl) e eletrólito terminante (0,05 mM HCl)
- Prepare 20 mM HCl em um frasco de 100 mL: Pipette 2 mL de 1 M HCl no frasco, encha até a marca com água ultrapura e agite suavemente.
- Prepare 5 mM HCl em um frasco de 100 mL: Pipeta 500 μL de 1 M HCl no frasco, encha até a marca com água ultrauso e agite suavemente.
- Prepare 0,05 mM HCl em duas etapas: Pipeta 1 mL de 20 mM HCl em um frasco de 100 mL e, em seguida, encha até a marca com água ultrauso e agite suavemente. Posteriormente, pipeta 2,5 mL da última solução em um tubo cônico de 15 mL(Tabela de Materiais) e adicionar 7,5 mL de água ultrapura, em seguida, agitar suavemente.
- Preparando o líder eletrólito 12% TMAH em um tubo cônico de 15 mL: Pipeta 4,8 mL de 25% TMAH no tubo, adicione 5,2 mL de água ultrapura e agite suavemente.
NOTA: O TMAH de 12% é usado para limpar e limpar o capilar antes de cada execução e como um eletrólito líder na frente da amostra injetada).
2. Preparação e armazenamento de normas e amostras
- Padrões
- Para Fe(II), pese 35,61 mgs de Fe(II)Cl2·4H2O em um frasco de 100 mL e encha até a marca de 100 mL com água ultrapura para uma concentração de estoque fe(II)/L de 100 mgs. Agite suavemente até a dissolução completa.
- Para Fe(III), pese 29,04 mgs de Fe(III)Cl3 em um frasco de 100 mL e encha até a marca de 100 mL com água ultrauso para uma concentração de estoque fe(III)/L de 100 mgs. Agite suavemente até a dissolução completa.
- Diluir cada solução padrão de acordo com a Tabela 1 para preparar as soluções padrão de trabalho.
NOTA: Após a preparação das soluções diárias de estoque a partir da solução de estoque de 100 mg/L, esta última deve ser armazenada congelada. Após a preparação das normas diárias de acordo com a Tabela 1,a solução de estoque de 1 mg/L deve ser alitada em volumes de 1,5 mL e armazenada congelada (melhor sem ar no topo) em tubos de 1,5 mL. Para cada novo dia, uma tampa diária de estoque é descongelada para elaboração de padrões diários e retirada após o uso.
| Concentração inicial | Volume de pipetação | Encha com água Milli-Q | Concentração resultante | Volume final | Uso de solução |
| 100 mg/L | 50 μL | 4950 μL | 1 mg/L | 50 mL | Solução diária de ações |
| 1 mg/L | 200 μL | 1800 μL | 100 μg/L | 2 mL | Padrão |
| 100 μg/L | |||||
| 1 mg/L | 100 μL | 1900 μL | 50 μg/L | 2 mL | Padrão |
| 50 μg/L | |||||
| 1 mg/L | 50 μL | 1950 μL | 25 μg/L | 2 mL | Padrão |
| 25 μg/L | |||||
| 1 mg/L | 25 μL | 1975μL | 12,5μg/L | 2 mL | Padrão |
| 12,5 μg/l | |||||
| 1 mg/L | 20 μL | 1980μL | 10 μg/L | 2 mL | Padrão |
| 10 μg/L | |||||
| 0 | 2000 μL | 0 μg/L | 2 mL | Vazio |
Tabela 1: Esquema de pipetação para a elaboração das normas.
- Lise de células SH-SY5Y
NOTA: O lisato celular (SH-SY5Y) serviu como bio matricial fe(II)/(III)relevante para mostrar o desempenho e a confiabilidade do método.- Use lysate de experimentos anteriormente executados16. Siga esta preparação de lise celular evitando alterações de pH ou produtos químicos que possam afetar o equilíbrio redox. Use um tampão de lise de radioimunoprecipitação modificada (RIPA) (PBS pH 7.4, 0,5% de desoxicolato de sódio, 1% NP-40), evitando queladores metálicos (como EDTA), agentes redutores (como DTT, 2-Mercaptoetanol) e detergentes surfactantes aniônicos e agentes de complexo metálico (como SDS) minimizassem alterações pós-coleta da razão Fe(II)/Fe(III).
- Trabalhe sob uma atmosfera N2inibida oxidação por O2 do ar ambiente e trabalhe no gelo para minimizar qualquer autoxidação até que o lysato seja armazenado o mais rápido possível a -80 °C sob a atmosfera de nitrogênio.
3. Criação de instrumentos para hifenização da CE ao ICP-MS
- Configure o instrumento de eletroforese capilar.
NOTA: Para esta seção, o leitor é referido principalmente ao manual do respectivo instrumento disponível em laboratório.- Instale um capilar com comprimento adequado para alcançar desde o frasco de entrada do instrumento CE até o nebulizador do ICP-MS. Instale o capilar apenas no lado da entrada e leve-o para fora do instrumento em direção à interface CE-ICP-MS.
NOTA: Para hifenizar CE para ICP-MS, neste protocolo foi instalada uma capilaridade de sílica fundida de 90 cm (ID 50 μm) de acordo com a descrição geral da configuração instrumental. Normalmente, serão necessários tamanhos capilares de 70-100 cm, dependendo da posição dos instrumentos em laboratório. - Desativar o elevador de saída do instrumento CE no software para uma operação suave, pois não está em uso quando o capilar é direcionado para fora para a interface CE-ICP-MS.
- Instale um cabo de gatilho a partir do gatilho do instrumento CE para acionar o instrumento ICP-MS.
- Selecione posições para todas as soluções necessárias (20 mM HCl, 0,05 mM HCl, 12% TMAH), normas e amostras no rotor de amostras e soluções do instrumento e defina suas posições no software de instrumentos como de costume (consulte o manual do instrumento).
- Selecione rotor e temperatura capilar idêntica a 20 °C, por ser idêntico à temperatura de laboratório controlada.
NOTA: Não ocorre gradiente de temperatura para as partes capilares dentro e fora do instrumento CE.
- Instale um capilar com comprimento adequado para alcançar desde o frasco de entrada do instrumento CE até o nebulizador do ICP-MS. Instale o capilar apenas no lado da entrada e leve-o para fora do instrumento em direção à interface CE-ICP-MS.
- Configurar o instrumento ICP-MS
- Otimize o instrumento ICP-MS de acordo com os procedimentos diários de configuração e operação padrão instrumental. Use o protocolo do fabricante.
- Use a tecnologia de célula de reação dinâmica (RDC) com NH3 como gás RDC, com 0,6 mL/min NH3–flowrate e valor de RPq = 0,45.
NOTA: Para a especiação do ferro, um método é programado com 56Fe, sendo o isótopo fe mais abundante (91,754% de abundância relativa), no entanto, sendo severamente interferido do [40Ar16O]+ cluster. Um quadrupole baseado em ICP-MS no modo padrão é praticamente cego e o detector em transbordamento neste isótopo. Com as configurações acima (ver passo 3.2.2), linhas de base baixas e alta sensibilidade são alcançadas (para determinação total regular de ferro LOD na faixa ng/L baixa é alcançada). - Escolha uma configuração de tempo de permanência por isótopo a 50 ms para monitorar picos de aparecimento ainda nítidos e curtos durante a separação de CE.
- Programe o método ICP-MS a ser iniciado pelo instrumento CE.
- Configure a interface CE-ICP-MS
NOTA: Há principalmente duas opções para conectar o CE-capilar ao ICP-MS. Siga as descrições fornecidas sobre a configuração se uma interface comercial for usada. Este protocolo usa uma interface simples e caseira com base em uma publicação anterior após modificações20. As principais questões são uma nebulização eficiente com possivelmente menos diluição do efflux capilar, além da adoção do fluxo global para nebulizador para melhor nebulização. Além disso, a minimização de um fluxo de sucção através da separação capilar causada pela auto-aspiração do nebulizador, e a conexão elétrica do eletrodo de tomada aterrada até a extremidade capilar são obrigatórias.- Seleção de nebulizadores
- Use um nebulizador concêntrico com baixo volume de auto-aspiração (por exemplo, 100 μL/min) que se encaixa em uma câmara de pulverização de baixo volume.
NOTA: A baixa absorção causará apenas diluição moderada do efflux capilar paralelo à nebulização ainda otimizada. A conexão elétrica do eletrodo de saída é realizada por um fluxo de eletrólitos ao redor do eletrodo de saída e ao redor da extremidade capilar. - Use a autoss aspiração do nebulizador para minimizar a sucção através da capilarização de separação e para adoção da taxa de fluxo ao valor ideal necessário pelo nebulizador.
- Prepare as seguintes partes da Tabela 2 para montar esta interface caseira.
- Use um nebulizador concêntrico com baixo volume de auto-aspiração (por exemplo, 100 μL/min) que se encaixa em uma câmara de pulverização de baixo volume.
- Configuração da interface simples
NOTA: Use a Figura 1 para seguir a descrição da montagem da peça para a interface simples. Os números na Figura 1 e no texto a seguir referem-se aos números na Tabela 2.- Comece a montar a interface conectando os dois conectores Luer femininos de 3 vias (nº 3) com um conector Luer de cone masculino (nº 4). Conecte a extremidade esquerda da barra luer inferior de 3 vias ao conector masculino e à conexão média do Luer superior de 3 vias.
- Coloque um tubo de 1 cm (nº 1) sobre o fio Pt (nº 7) e um tubo de silicone de 1 cm (nº 5) sobre o último e o bico de um conector Luer masculino (nº 2). Fixar o conjunto à conexão média do conector Luer inferior de 3 vias (nº 3) pela rotação típica do parafuso Luer.
- Empurre um tubo de 1 cm (nº 1) sobre a extremidade de saída do capilar CE e posicione-o cerca de 8-9 cm do final.
- Coloque um tubo de silicone de 1 cm (nº 5) sobre o último e o bocal de um conector Luer masculino (nº 2).
- Coloque todo o conjunto da esquerda através da barra do conector superior de 3 vias T e fixe o conector Luer masculino e a extremidade esquerda do conector Luer feminino de 3 vias (nº 3) pela rotação típica do parafuso Luer.
- Fixar o tubo de silicone de 25 cm (nº 5) no bocal de um conector Luer masculino (nº 2) e fixar todo o conjunto na extremidade inferior (direita) da barra do conector Luer inferior de 3 vias (No.3) pela rotação típica do parafuso Luer.
- Pegue o tubo de silicone de 1 cm (No.6) e empurre-o 5 mm sobre a extremidade do nebulizador firmemente enquanto o segundo conector de cone Luer masculino (nº 4) está conectado firmemente na parte saliente do tubo de silicone.
- Mova a parte da interface montada acima posteriormente com o capilar ce salientes para o cone masculino no nebulizador. Insira o capilar CE cuidadosamente através do cone masculino e mais através da parte mais larga do capilar nebulizador até que este fique estreito. Dado que o comprimento saliente do capilar foi escolhido adequadamente, o conector Luer feminino superior de 3 vias agora também se encaixa firmemente no cone masculino.
- Corrija o comprimento do comprimento capilar salientes, se necessário, movendo o capilar (para frente/para trás) no tubo (nº 1) ao entrar na interface auto-feita.
NOTA: A posição ideal do capilar CE no início do capilar nebulizador não é muito crítica. No entanto, não empurre o capilar CE muito perto da parte estreita do capilar nebulizador. Isso pode dificultar ou bloquear o fluxo de eletrólitos de saída. Além disso, isso interromperia a conexão elétrica com o eletrodo de saída e aumentaria a sucção através da capilaridade CE, resultando em separação perturbada. Por sua vez, não mantenha o fim capilar ce muito longe do capilar nebulizador desde então picos separados acentuados seriam ampliados e a resolução será perdida. - Use uma lente para identificar a melhor posição.
NOTA: A figura 1 (inferior direita) mostra a posição ideal do ce-capilar dentro do nebulizador.
- Seleção de nebulizadores

Figura 1: Esquema e montagem da interface CE-ICP-MS. O esquema identifica as peças únicas para a montagem stepwise da interface CE-ICP-MS simples e barata. A janela mostra uma foto de posicionamento ideal do ce-capilar no nebulizador. Clique aqui para ver uma versão maior desta figura.
| Não. | Parte | usado para |
| 1 | Tubos (código de cor verde-laranja), 2 x ca. 1 cm | fixação CE capilar e eletrodo de saída em Luer-parts e manter apertado |
| 2 | Luer, masculino, 3 x, adequado para tubos de silicone de 1,6 mm ID | conexão do tubo de silicone à saída de eletrólito e como auxílio para fixação de eletrodo capilar e de fio pt |
| 3 | 3-way-Luer, feminino, 2 x | Peças T para conectar o fluxo de saída eletrodo, capilar e aspirado |
| 4 | Luer cone, masculino, 2 x | conectando luers fêmeas uns aos outros e ao nebulizador |
| 5 | Tubo de silicone, 1,6 mm ID, parede de 0,8 mm, 2 x 1 cm, 1x ca. 25 cm | a) 1cm; apertando o capilar CE para interface, b) 1cm; apertando pt-wire para interface c) 25 cm; conexão de frasco de eletrólito de saída para interface |
| 6 | Tubo de silicone, 3 mm ID, parede de 1,2 mm, ca.1 cm | apertando cone Luer para nebulizador |
| 7 | Fio de platina | Eletrodo de saída |
Tabela 2: Peças para a construção da interface CE-ICP-MS simples e auto-fabricada. Os números referem-se também à Figura 1 e à descrição do texto.
4. Preparação para medição
NOTA: Antes da medição, o capilar deve ser lavado com solução alcalina forte (aqui: 12% TMAH) para limpeza e, em seguida, preenchido com eletrólito de fundo. Para uma separação melhorada, um sanduíche tampão de empilhamento é construído em torno da amostra com base na condutividade e gradientes de pH. A Tabela 3 resume as etapas de preparação consecutivas do capilar, que são processadas automaticamente pelo instrumento de acordo com o método programado:
| Passo-Não | Passo | Química | Condição |
| Elaboração da coluna CE | |||
| Prep 1 | Limpeza capilar | 12 % TMAH | 4 bar, 1 min. |
| Prep 2 | Purga capilar com eletrólito de fundo | 20 mM HCl | 4 bar, 1 min. |
| Prep 3 | Empilhamento: eletrólito líder | 12 % TMAH | 150 mbar, 3 s |
| Prep 4 | Injeção | Amostra | 150 mbar, 3 s |
| Prep 5 | Empilhamento: terminando eletrólito | 0,05 mM HCl | 150 mbar, 3 s |
Tabela 3: Etapas de preparação capilar antes da medição. Essas etapas são programadas com o software do sistema CE no método CE e incluem injeção de amostra pressurizada e o acúmulo de um "sanduíche de empilhamento" em torno da amostra.
- Programar um método CE, que está executando consecutivamente as etapas dadas na Tabela 3.
- Defina uma tabela de amostra e sequência no software CE e copie essa sequência também no software ICP-MS.
5. Medição e avaliação de dados
- Inicie o método no instrumento CE. Após a preparação programada e o preenchimento do capilar, a medição começa automaticamente assim que o frasco de entrada, contendo 20 mM HCl, estiver em posição na entrada capilar. O "Start-trigger" é enviado ao ICP-MS, que inicia o monitoramento on-line dos fe-isótopos.
NOTA: A separação utiliza uma tensão de +25 kV. O comprimento estendido do capilar, necessário para conectar o instrumento CE ao ICP-MS, faz com que o tempo de separação seja desnecessariamente aumentado. Portanto, a separação é suportada por uma baixa pressão de 250 mbar na entrada. O eletrólito auto-aspirado na tomada é de 5 mM HCL. A análise total dura 3 minutos para amostras com condutividade moderada. Na janela de sinal do software ICP-MS, o eletroferograma pode ser observado durante a execução. Ao final de cada amostra, dois arquivos de dados são gerados automaticamente, um único acessível a partir de software de instrumentos do banco de dados interno, um segundo na pasta de exportação como formato ".xl" ou ".txt", acessível pela função de importação do software regular de cromatografia. - Consulte o manual de software do instrumento ICP-MS para exportar os arquivos para o software de cromatografia.
Resultados
Medições de padrões e calibração
Os tempos de migração foram elucidados por injeções padrão única: o padrão Fe(III) foi monitorado aos 118 anos do tempo de migração e o padrão Fe(II) aos 136 s do tempo de migração. Os limites de detecção foram calculados utilizando-se o critério de 3σ referente ao ruído da linha de base e uma concentração padrão de 50 μg/L. LOD(Fe(II) foi de 3,1 μg/L e LOD(Fe(III) foi de 3,2 μg/L. A calibração da área de pico para ambas as espécies de ferro foi linear do LOD para 150 μg/L. Enquanto a linearidade de Fe(III) foi comprovada também para maior concentração, a inclinação da curva de calibração para Fe(II) diminuiu. Um limite de concentração superior de 150 μg/L foi considerado suficiente, uma vez que as bio-amostras relevantes para a determinação de Fe(II)/(III) tipicamente têm menor concentração de Fe. Em caso de maior concentração, as amostras podem ser diluídas em conformidade. A calibração de altura máxima foi verificada até 600 μg/L e mostrou linearidade sobre toda a faixa testada. Isso é mostrado na Figura 2.
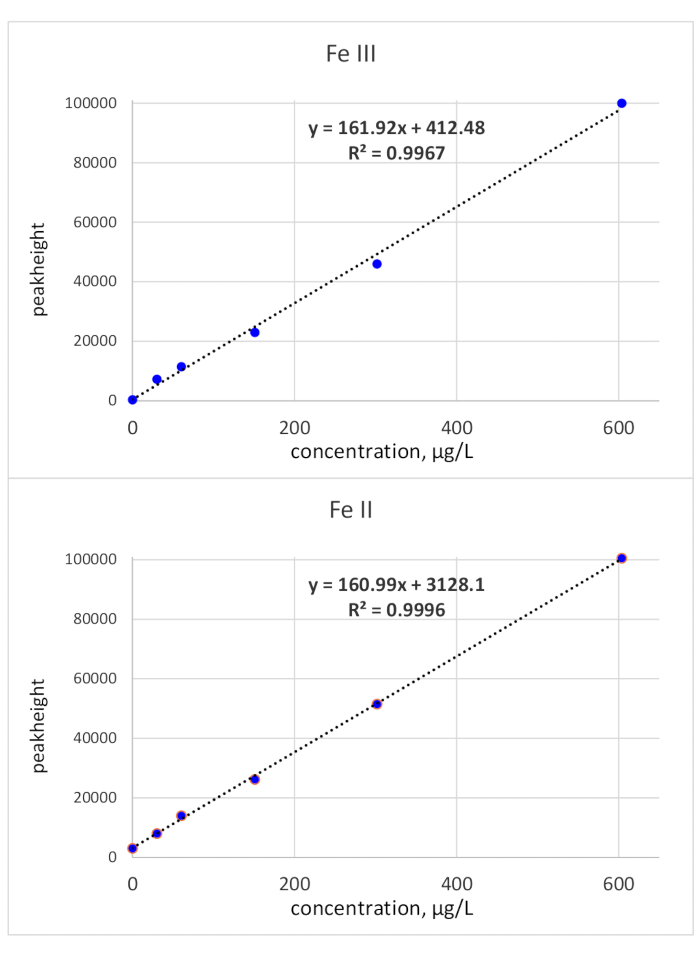
Figura 2: Curvas de calibração (altura máxima) de Fe(III) e Fe(II). Calibrações relacionadas ao pico de altura de ambas as espécies de Redox Fe são lineares com uma inclinação de ca. 161 *X Clique aqui para ver uma versão maior desta figura.
Análise do liseto celular SH-SY5Y
A análise do lysato celular SH-SY5Y mostrou uma migração ligeiramente mais lenta para espécies de redox de ferro devido à condutividade um pouco maior. O FE(III) foi monitorado aos 124 anos de tempo de migração, Fe(II) aos 158 anos de tempo de migração. A precisão do tempo de migração no lisato celular SH-SY5Y foi de 2% para Fe(III) e 3% para Fe(II). As medidas quantitativas fe(II) e fe(III) utilizando este método revelaram concentração fe(III) de 330 μg/L e fe(II) de concentração de 84 μg/L, ambos resultando em uma razão Fe(II)/Fe(III) de 0,25. O respectivo eletroferograma fe-seletivo de 56é demonstrado na Figura 3.
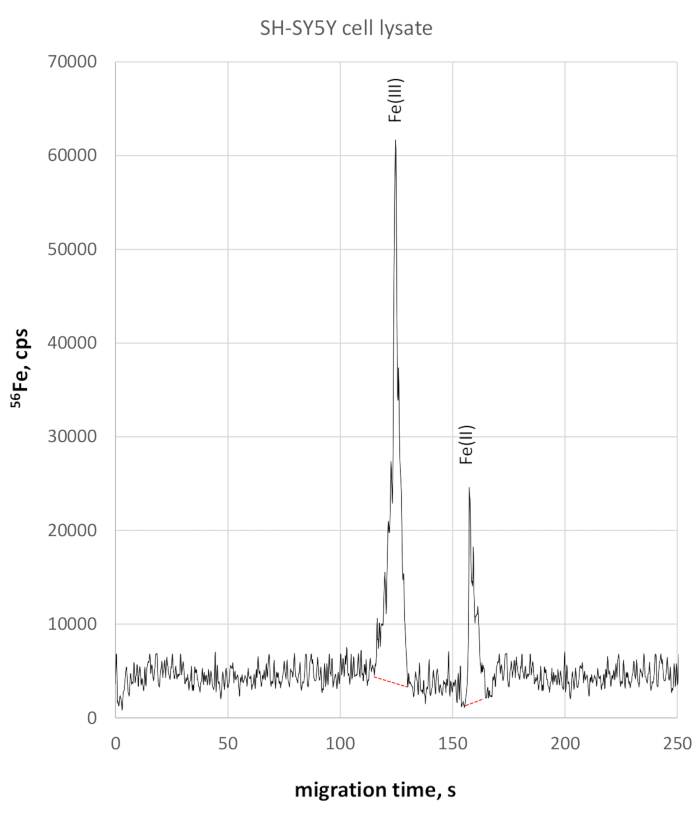
Figura 3: 56Eletroferograma fe-específico de lise celular SH-SY5Y. Fe(III) é monitorado a 123 s atingindo 58025 cps altura máxima, sendo claramente separado de Fe(II) em 158 s, atingindo 22800 cps Clique aqui para ver uma versão maior deste número.
Discussão
Uma vez que o ferro desempenha um papel proeminente na progressão do SO, facilitando assim a disfunção mitocondrial ou FTP, um versátil método quantitativo baseado em CE-ICP-MS para especiação simultânea fe(II)/Fe(III) é apresentado neste artigo e sua aplicação é exemplarmente demonstrada em lisatos celulares. O método proporcionou pouco tempo de análise e os números de mérito (LOQ, precisão, recuperação) são adequados para amostras relevantes para especiação de redox de ferro especificamente em pesquisa neurodegenerativa e cancerígena. Comparado com os métodos anteriores baseados na LC, este método baseado em CE é praticamente independente dos lotes das colunas e problemas de reprodutibilidade observados anteriormente após a alteração da coluna LC. A preparação capilar antes de cada corrida é de <4 minutos e tempo de análise por amostra com salinidade moderada até 3 min. Além da carga e tamanho da molécula, o tempo de migração no CZE depende da condutividade no plugue amostral, o que causa variação de tempo de migração ou mudanças quando as próprias amostras influenciam consideravelmente a condutividade. Tais mudanças no tempo de migração são bem conhecidas na eletroforese capilar. Trata-se de um problema CZE-immanent, conhecido pela literatura21,22. Os padrões e as células SH-SY5Y apresentaram condutividade moderada e homogênea. Consequentemente, os tempos de migração mostraram apenas pequenas mudanças com boa precisão. Para amostras com alta condutividade, no entanto, podem ser observados tempos de migração prolongados até 5 minutos. Portanto, as adições padrão são recomendadas para identificação clara de espécies.
Uma questão crítica na especiação de redox de ferro é a estabilidade das espécies (ou seja, manutenção do equilíbrio fe(II)/(III) durante a preparação da amostra8,13. Produtos químicos de pH ou quesalante inadequados, bem como condições inadequadas de armazenamento, como oxigênio (ar) em contato com a amostra ou uma quebra no armazenamento congelado profundo podem facilmente alterar o equilíbrio Fe(II)/(III). Portanto, para a preparação de licosatos de células SH-SY5Y, foi escolhido um tampão de lise sem qualquer produto químico quelaante, pH fisiológico, mas sobreposição de gás inerte durante a preparação da amostra, em recipientes de amostra e congelamento profundo imediato foi aplicado para essas amostras.
Na literatura, pode-se encontrar abordagens semi-quantitativas para monitorar o Fe(II). Para uma melhor compreensão do papel do ferro no estresse oxidativo, vários grupos de pesquisa desenvolveram sondas específicas fe(II) para monitorar semi-quantitativamente e visualizar a elevação aberrante do ferro ferro in vitro. No entanto, é importante notar que tais sondas não consideram Fe(III) e não quantificam, mas relatam apenas "mais" ou "menos" Fe(II)). Até o momento, apenas alguns biomarcadores estão disponíveis para determinar o SO e o FPT, devido à falta de métodos confiáveis para quantificar simultaneamente as espécies de redox Fe(II)/Fe(III)23,24. Tendo isso em mente, o método apresentado - facilitando a quantificação rápida de ambos, Fe(III) e Fe(II) em uma corrida - pode se tornar uma ferramenta promissora para aprofundar a visão sobre processos moleculares dependentes de ferro.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
A VV foi apoiada pela bolsa de pesquisa intramuros (Forschungsförderung) do University Medical Center Göttingen e pelo programa de pesquisa Else Kröner do Else Kröner-Fresenius-Stiftung.
Materiais
| Name | Company | Catalog Number | Comments |
| CE capillary | CS-Chromatographie Service, Langerwehe, Germany | 105180-25 | |
| CE system | PrinCe technolgies | 0005.263 | model PrinCe 760 |
| Conical Superclear Tubes 15 ml | Analytics-shop.com by Altmann Analytik | PEN0777704 | |
| Conical Superclear Tubes 50 ml | Analytics-shop.com by Altmann Analytik | PEN0777694 | |
| FeCl2 * 4H2O | Merck | 103861 | |
| FeCl3 | Merck | 803945 | |
| Fluidflex Silikon HG-Schlauch | ProLiquid | 4001106HG | |
| Fused silica capillary OD 360 µm, ID 50 µm | Chromatographie Service GmbH | 105180-25 | |
| hydrochloric acid, 1 M | Merck | 1101652500 | corrosive |
| ICP-MS | Perkin Elmer | N814003 | |
| Luer, 3-way female | BioRad | 7318229 | |
| Luer, cone male | neoLab Migge | 2-1895 | |
| Luer, male | neoLab Migge | 2-1880 | |
| Peakfit peak evaluation software | Systat | PeakFit 4.12 | |
| Pt-wire | Carl Roth | 0737.1 | |
| PVC tube | ProLiquid | 6000002 | |
| RIPA buffer | Abcam | ab156034 | |
| Tetramethylammoniumhydroxide, 25 % | Merck | 814748 | corrosive |
| TYGON-tube R-3607 | ProLiquid | 3700203A |
Referências
- Hare, D. J., et al. Is early-life iron exposure critical in neurodegeneration. Nature Reviews Neurology. 11 (9), 536-544 (2015).
- Ashraf, A., Clark, M., So, P. W. The Aging of Iron Man. Frontiers in Aging Neuroscience. 10, (2018).
- Hare, D. J., Cardoso, B. R., Szymlek-Gay, E. A., Biggs, B. A. Neurological effects of iron supplementation in infancy: finding the balance between health and harm in iron-replete infants. Lancet Child Adolesc Health. 2 (2), 144-156 (2018).
- Torti, S. V., Torti, F. M. Iron and cancer: more ore to be mined. Nature Reviews Cancer. 13 (5), 342-355 (2013).
- Kehrer, J. P. The Haber-Weiss reaction and mechanisms of toxicity. Toxicology. 149 (1), 43-50 (2000).
- Gaschler, M. M., Stockwell, B. R. Lipid peroxidation in cell death. Biochemical and Biophysical Research Communications. 482 (3), 419-425 (2017).
- Michalke, B., Halbach, S., Nischwitz, V. JEM Spotlight: Metal speciation related to neurotoxicity in humans. Journal of Environmental Monitoring. 11 (5), 939-954 (2009).
- Solovyev, N., Vinceti, M., Grill, P., Mandrioli, J., Michalke, B. Redox speciation of iron, manganese, and copper in cerebrospinal fluid by strong cation exchange chromatography - sector field inductively coupled plasma mass spectrometry. Analytica Chimica Acta. 973, 25-33 (2017).
- Lee, H. J., et al. Effect of excess iron on oxidative stress and gluconeogenesis through hepcidin during mitochondrial dysfunction. Journal of Nutritional Biochemistry. 26 (12), 1414-1423 (2015).
- Dixon, S. J., Lemberg, K. M., Lamprecht, M. R., Skouta, R., Zaitsev, E. M., Gleason, C. E., et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death. Cell. 149 (5), 1060-1072 (2012).
- Stockwell, B. R., et al. Ferroptosis: A Regulated Cell Death Nexus Linking Metabolism, Redox Biology, and Disease. Cell. 171 (2), 273-285 (2017).
- Michalke, B., Berthele, A., Mistriotis, P., Ochsenkuhn-Petropoulou, M., Halbach, S. Manganese speciation in human cerebrospinal fluid using CZE coupled to inductively coupled plasma MS. Electrophoresis. 28 (9), 1380-1386 (2007).
- Fernsebner, K., Zorn, J., Kanawati, B., Walker, A., Michalke, B. Manganese leads to an increase in markers of oxidative stress as well as to a shift in the ratio of Fe(II)/(III) in rat brain tissue. Metallomics. 6 (4), 921-931 (2014).
- Neth, K. . Manganese: Species Pattern and Mechanisms of Brain Injury. , (2015).
- Neth, K., et al. Changes in Brain Metallome/Metabolome Pattern due to a Single i.v. Injection of Manganese in Rats. Plos One. 10 (9), (2015).
- Venkataramani, V., et al. Manganese causes neurotoxic iron accumulation via translational repression of Amyloid Precursor Protein (APP) and H-Ferritin. Journal of Neurochemistry. 147 (6), 831-848 (2018).
- Willkommen, D., Lucio, M., Schmitt-Kopplin, P., Gazzaz, M., Schroeter, M., Sigaroudi, A., Michalke, B. Species fractionation in a case-control study concerning Parkinson's disease: Cu-amino acids discriminate CSF of PD from controls. Journal of Trace Elements in Medicine and Biology. 49, 164-170 (2018).
- Thibault, P., Dovichi, N. J., Camilleri, P. General instrumentation and detection systems including mass spectrometry. Capillary Electrophoresis - Theory and Practice. , 23-89 (1998).
- Iliff, J. J., et al. A Paravascular Pathway Facilitates CSF Flow Through the Brain Parenchyma and the Clearance of Interstitial Solutes, Including Amyloid beta. Science Translational Medicine. 4 (147), (2012).
- Michalke, B. Manganese speciation using capillary electrophoresis-ICP-mass spectrometry. Journal of Chromatography A. 1050 (1), 69-76 (2004).
- Kuhn, R., Hofstetter-Kuhn, S. . Capillary electrophoresis: Principles and practice. , (1993).
- Michalke, B. Capillary electrophoretic methods for a clear identification of selenoamino acids in complex matrices such as human milk. Journal of Chromatography A. 716 (1-2), 323-329 (1995).
- Yang, W. S., et al. Regulation of ferroptotic cancer cell death by GPX4. Cell. 156 (1-2), 317-331 (2014).
- Shimada, K., Hayano, M., Pagano, N. C., Stockwell, B. R. Cell-Line Selectivity Improves the Predictive Power of Pharmacogenomic Analyses and Helps Identify NADPH as Biomarker for Ferroptosis Sensitivity. Cell Chemical Biology. 23 (2), 225-235 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados