Method Article
Configuration de la spectrométrie de masse plasmatique capillaire couplée à l’électrophorèse (CE-ICP-MS) pour la quantification des espèces de redox de fer (Fe(II), Fe(III))
Dans cet article
Résumé
Cette méthode de spéciation de redox de fer est basée sur la spectrométrie de masse plasmatique capillaire couplée à l’électrophorèse-inductivement couplée avec l’empilage d’échantillon combiné avec l’analyse courte dans une course. La méthode analyse rapidement et fournit de faibles limites de quantification pour les espèces de redox de fer à travers une gamme variée de tissus et d’échantillons de biofluides.
Résumé
La dyshomeostasie du métabolisme du fer est prise en compte dans le cadre pathophysiologique de nombreuses maladies, y compris le cancer et plusieurs conditions neurodégénératives. Les résultats excessifs de fer dans le redox-actif libre fe(II) et peuvent causer des effets dévastateurs dans la cellule comme le stress oxydatif (OS) et la mort par peroxydation lipidique connue sous le nom de ferroptose (FPT). Par conséquent, les mesures quantitatives du fer ferreux (Fe(II)) et du ferrique (Fe(III)) plutôt que de la détermination totale du fe sont la clé pour mieux comprendre ces processus préjudiciables. Étant donné que les déterminations de Fe(II)/(III) peuvent être entravées par des changements rapides à l’état redox et de faibles concentrations dans les échantillons pertinents, comme le liquide céphalo-rachidien (CSF), des méthodes doivent être disponibles qui analysent rapidement et fournissent de faibles limites de quantification (LOQ). L’électrophorèse capillaire (CE) offre l’avantage d’une séparation rapide de Fe(II)/Fe(III) et fonctionne sans phase stationnaire, ce qui pourrait interférer avec l’équilibre redox ou provoquer un collage d’analyte. Ce combiné avec la spectrométrie de masse plasmatique couplée indutivement (ICP-MS) comme détecteur offre une amélioration supplémentaire de la sensibilité de détection et de la sélectivité. La méthode présentée utilise 20 mM HCl comme électrolyte de fond et une tension de +25 kV. Les formes de pointe et les limites de détection de concentration sont améliorées par conductivité-pH-empilage. Pour la réduction de 56[ArO]+, ICP-MS a été actionné en mode cellule de réaction dynamique (RDC) avec NH3 comme gaz de réaction. La méthode atteint une limite de détection (LOD) de 3 μg/L. En raison de l’empilement, des volumes d’injection plus élevés ont été possibles sans entraver la séparation, mais améliorer la LOD. Les étalonnages liés à la surface de pointe étaient linéaires jusqu’à 150 μg/L. La précision de mesure était de 2,2 % (Fe(III)) à 3,5 % (Fe(II)). La précision du temps de migration était de 3%, déterminée dans les lysates dilués de 1:2 des cellules du neuroblastome humain (SH-SY5Y). Les expériences de récupération avec l’addition standard ont indiqué l’exactitude de 97% fe(III) et 105 % fe(II). Dans les bio-échantillons réels comme le FSC, le temps de migration peut varier en fonction de la conductivité variable (c.-à-d. la salinité). Ainsi, l’identification maximale est confirmée par l’addition standard.
Introduction
Aujourd’hui, il est plus évident que le stress oxydatif (OS) à médiation de fer joue un rôle crucial dans les troubles multiples spécifiquement dans les troubles neurodégénératifs du cerveau, comme la maladie d’Alzheimer et la maladie de Parkinson ainsi que dans le cancer1,2,3,4. L’OS est étroitement liée à l’état et à l’équilibre du couple redox Fe(II)/Fe(III). Alors que Fe(III) est redox-inactive, Fe(II) génère efficacement des espèces réactives d’oxygène (ROS) en catalysant la décomposition H2O2 suivie de la production radicale hydroxyle et de la peroxydation lipidique membranaire5,6. Sur le plan moléculaire, le ROS généré par Fe(II) et les phospholipides peroxydés sont une attaque forte à l’intégrité des protéines, des lipides et de l’ADN7,8. Un tel dysfonctionnement cellulaire préjudiciable a été démontré pour induire le dysfonctionnement mitochondrial avec la diminution de la teneur en ATP9 et peut même déclencher une mort cellulaire nécrotique programmée, connue sous le nom de ferroptose (FPT)10,11. Par conséquent, la spéciation quantitative de Fe(II)/(III) redox est d’une importance éminente dans un large éventail de désordres redox-connexes.
La spéciation chimique est un outil bien établi pour l’étude des oligo-éléments rôle biologique et le métabolisme en général7,8 ainsi que dans les conditions neurodégénératives12,13,14,15,16,17. Les méthodes de spéciation de Fe-redox trouvées dans la littérature sont typiquement basées sur la séparation de chromatographie liquide (LC). Une partie de la littérature utilise la spectrométrie de masse de plasma (ICP-MS) associée indutivement couplée comme détecteur sélectif d’élément. Cependant, dans le travail courant de LC, des temps de purge excessifs étaient nécessaires entre les courses. Encore plus problématique, la variation par lot à lot des colonnes LC a forcé la ré-optimisation des conditions d’élution après chaque changement de colonne. Ces problèmes entravent le haut débit. Un délai supplémentaire est nécessaire pour obtenir une fiabilité acceptable et évaluer à nouveau la méthode.
Pour contourner ces inconvénients, une méthode est présentée ici pour fe(II)/Fe(III) spéciation redox basée sur l’électrophorèse capillaire inductivement couplé spectrométrie de masse plasmatique (CE-ICP-MS). CE offre divers avantages par rapport à LC18. Les capillaires n’ont pas de phase stationnaire et dépendent donc (presque) de l’identité du lot. Lorsqu’ils sont vieillis ou bloqués, ils sont remplacés rapidement, montrant généralement des performances inchangées. Les étapes de purge et de nettoyage entre les échantillons sont efficaces et courtes, et le temps d’analyse par échantillon est court, aussi.
La méthode présentée est fiable avec de bonnes figures de mérite. Comme preuve de principe, la méthode est appliquée au lysate de cellules neuroblastomes dopaminergiques humains (SH-SY5Y), un type d’échantillon important en neurodégénérescence ainsi que dans la recherche sur le cancer19.
Protocole
ATTENTION : La méthode utilise de l’acide chlorhydrique (HCl, dilutions de départ de l’ultrapure, concentration 1 M) et du tétraméthylammoniumhydroxyde (TMAH, dilutions de départ de l’ultrapure, concentration 25%). Les deux substances sont fortement corrosives. Utilisez la protection de la peau et des yeux.
1. Préparation d’électrolytes
- Préparation des électrolytes HCl : électrolyte de fond (20 mM HCl), électrolyte de sortie (5 mM HCl) et électrolyte de terminaison (0,05 mM HCl)
- Préparer 20 mM HCl dans une fiole de 100 mL : Pipette 2 ml de 1 M HCl dans la fiole, remplir jusqu’à la marque avec de l’eau ultrapure et secouer doucement.
- Préparer 5 mM HCl dans une fiole de 100 mL : Pipette 500 μL de 1 M HCl dans la fiole, remplir jusqu’à la marque avec de l’eau ultrapure et secouer doucement.
- Préparer 0,05 mM HCl en deux étapes: Pipette 1 mL de 20 mM HCl dans une fiole de 100 mL, puis remplir jusqu’à la marque avec de l’eau ultrapure et secouer doucement. Par la suite, la pipette 2,5 ml de cette dernière solution dans un tube conique de 15 mL(Table des Matériaux)et ajouter 7,5 ml d’eau ultrapure, puis secouer doucement.
- Préparation d’électrolytes de premier plan 12% TMAH dans un tube conique de 15 mL : Pipette 4,8 mL de 25% de TMAH dans le tube, ajouter 5,2 ml d’eau ultrapure et secouer doucement.
REMARQUE : Le TMAH à 12 % est utilisé pour purger et nettoyer le capillaire avant chaque course et comme électrolyte de premier plan devant l’échantillon injecté).
2. Préparation et stockage des normes et des échantillons
- Normes
- Pour Fe(II), peser 35,61 mg de Fe(II)Cl2·4H2O dans une fiole de 100 ml et remplir jusqu’à la marque de 100 ml avec de l’eau ultrapure pour une concentration de 100 mg fe(II)/L. Agiter doucement jusqu’à la dissolution complète.
- Pour Fe(III), peser 29,04 mg de Fe(III)Cl3 dans une fiole de 100 mL et remplir jusqu’à la marque de 100 ml avec de l’eau ultrapure pour une concentration de 100 mg fe(III)/L. Agiter doucement jusqu’à la dissolution complète.
- Diluer chaque solution standard selon le tableau 1 pour préparer les solutions standard de travail.
REMARQUE : Après avoir préparé les solutions quotidiennes de stock à partir de la solution de stock de 100 mg/L, ces dernières doivent être conservées congelées. Après avoir préparé les normes quotidiennes conformément au tableau 1, la solution de stock de 1 mg/L doit être aliquée en volumes de 1,5 mL et stockée congelée (meilleure sans air laissé sur le dessus) dans des tubes de 1,5 mL. Pour chaque nouveau jour, un plafond quotidien de stock est décongelé pour la préparation des normes quotidiennes et retiré après utilisation.
| Concentration de départ | Volume de pipetage | Remplissez-le d’eau Milli-Q | Concentration résultante | Volume final | Utilisation de la solution |
| 100 mg/L | 50 μL | 4950 μL | 1 mg/L | 50 mL | Solution quotidienne de stock |
| 1 mg/L | 200 μL | 1800 μL | 100 μg/L | 2 mL | Standard |
| 100 μg/L | |||||
| 1 mg/L | 100 μL | 1900 μL | 50 μg/L | 2 mL | Standard |
| 50 μg/L | |||||
| 1 mg/L | 50 μL | 1950 μL | 25 μg/L | 2 mL | Standard |
| 25 μg/L | |||||
| 1 mg/L | 25 μL | 1975μL | 12,5μg/L | 2 mL | Standard |
| 12,5 μg/l | |||||
| 1 mg/L | 20 μL | 1980μL | 10 μg/L | 2 mL | Standard |
| 10 μg/L | |||||
| 0 | 2000 μL | 0 μg/L | 2 mL | Blanc |
Tableau 1 : Schéma de distribution pour la préparation des normes.
- Lysate de cellule SH-SY5Y
REMARQUE : Le lysate cellulaire (SH-SY5Y) a servi de biomatricy pertinente fe(II)/(III) pour montrer la performance et la fiabilité de la méthode.- Utilisez le lysate à partir d’expériences précédemment en cours d’exécution16. Suivez cette préparation de lysate de cellules en évitant les changements de pH ou les produits chimiques qui pourraient affecter l’équilibre redox. Utiliser un tampon de lyse par radioimmunoprécipitation (RIPA) modifié (PBS pH 7.4, 0,5 % de désoxycholate de sodium, 1 % de NP-40), en évitant les chélateurs métalliques (tels que l’EDTA), les agents réducteurs (tels que la TNT, 2-Mercaptoéthanol) et les détergents anéoniques et les agents de complexage métallique (tels que le SDS) pour minimiser les altérations post-collecte du ratio Fe(II)/Fe(III).
- Travailler sous un N2-atmosphère inhibé l’oxydation par O2 de l’air ambiant et travailler sur la glace pour minimiser toute autoxidation jusqu’à ce que le lysate a été stocké dès que possible à -80 °C sous l’atmosphère d’azote.
3. Mise en place d’instruments de trait d’union de CE à ICP-MS
- Mettre en place l’instrument d’électrophorèse capillaire.
REMARQUE : Pour cette section, le lecteur est principalement référé au manuel de l’instrument respectif disponible en laboratoire.- Installez un capillaire d’une longueur appropriée pour atteindre de la fiole d’entrée de l’instrument CE au nébuliseur de l’ICP-MS. Installez le capillaire uniquement du côté de l’entrée et conduisez-le à l’extérieur de l’instrument vers l’interface CE-ICP-MS.
REMARQUE : Pour le trait d’union CE à ICP-MS, dans ce protocole, un capillaire de silice fusionné de 90 cm (ID 50 μm) a été installé selon la description générale de configuration instrumentale. En règle générale, des tailles capillaires de 70 à 100 cm seront nécessaires, selon la position des instruments en laboratoire. - Désactiver le levage de sortie de l’instrument CE dans le logiciel pour un fonctionnement en douceur car il n’est pas utilisé lorsque le capillaire est dirigé à l’extérieur vers l’interface CE-ICP-MS.
- Installez un câble de déclenchement à partir du déclencheur de l’instrument CE pour déclencher l’instrument ICP-MS.
- Sélectionnez les positions pour toutes les solutions nécessaires (20 mM HCl, 0,05 mM HCl, 12% TMAH), les normes et les échantillons dans l’échantillon et les solutions rotor de l’instrument et définissez leurs positions dans le logiciel d’instrument comme d’habitude (voir le manuel de l’instrument).
- Choisissez la température du rotor et du capillaire à identique à 20 °C, comme étant identique à la température contrôlée du laboratoire.
REMARQUE : Il n’y a pas de gradient de température aux parties capillaires à l’intérieur et à l’extérieur de l’instrument CE.
- Installez un capillaire d’une longueur appropriée pour atteindre de la fiole d’entrée de l’instrument CE au nébuliseur de l’ICP-MS. Installez le capillaire uniquement du côté de l’entrée et conduisez-le à l’extérieur de l’instrument vers l’interface CE-ICP-MS.
- Configurer l’instrument ICP-MS
- Optimisez l’instrument ICP-MS selon les procédures quotidiennes d’installation et d’exploitation des normes instrumentales. Utilisez le protocole du fabricant.
- Utilisez la technologie des cellules de réaction dynamique (RDC) avec NH3 comme gaz de la RDC, avec 0,6 mL/min NH3–flurate et valeur RPq = 0,45.
NOTE: Pour la spéciation du fer, une méthode est programmée avec 56Fe, étant l’isotope fe le plus abondant (91,754% d’abondance relative), cependant, étant gravement interféré de la [40Ar16O]+ cluster. Un QUADRopole basé ICP-MS en mode standard est pratiquement aveugle et le détecteur en débordement à cet isotope. Avec les réglages ci-dessus (voir l’étape 3.2.2), des lignes de base basses et une sensibilité élevée sont atteintes (pour la détermination totale régulière du fer LOD dans la gamme faible ng/L est atteint). - Choisissez un réglage du temps d’habitation par isotope à 50 ms pour surveiller même les pics d’apparition pointus et courts pendant la séparation ce.
- Programmez la méthode ICP-MS qui sera lancée par l’instrument CE.
- Configurer l’interface CE-ICP-MS
REMARQUE : Il existe principalement deux options pour relier le ce-capillaire à l’ICP-MS. Suivez les descriptions fournies sur l’installation si une interface commerciale est utilisée. Ce protocole utilise une interface simple et maison basée sur une publication précédente après modifications20. Les questions clés sont une nébulisation efficace avec peut-être moins de dilution de l’efflux capillaire en dehors de l’adoption du flux global à nébuliseur pour la meilleure nébulisation. En outre, la minimisation d’un flux d’aspiration par la séparation capillaire causée par l’auto-aspiration du nébuliseur, et la connexion électrique de l’électrode de sortie à la terre à l’extrémité capillaire sont obligatoires.- Sélection des nébuliseurs
- Utilisez un nébuliseur concentrique à faible volume d’auto-aspiration (p. ex., 100 μL/min) qui s’inscrit dans une chambre de pulvérisation à faible volume.
REMARQUE : La faible absorption ne provoquera qu’une dilution modérée de l’efflux capillaire parallèle à la nébulisation encore optimisée. La connexion électrique de l’électrode de sortie est réalisée par un flux d’électrolyte autour de l’électrode de sortie et autour de l’extrémité capillaire. - Utilisez l’auto-aspiration du nébuliseur pour minimiser l’aspiration à travers le capillaire de séparation et pour l’adoption du débit à la valeur optimale requise par le nébuliseur.
- Préparez les pièces suivantes du tableau 2 pour monter cette interface maison.
- Utilisez un nébuliseur concentrique à faible volume d’auto-aspiration (p. ex., 100 μL/min) qui s’inscrit dans une chambre de pulvérisation à faible volume.
- Configuration de l’interface simple
REMARQUE : Utilisez la figure 1 pour suivre la description du montage de pièce pour l’interface simple. Les chiffres de la figure 1 et du texte suivant se réfèrent aux chiffres du tableau 2.- Commencez à monter l’interface en connectant les deux connecteurs Luer femelles à 3 voies (no 3) à un connecteur Luer à cône mâle (no 4). Connectez l’extrémité gauche de la barre Luer 3 voies inférieure au connecteur mâle et à la connexion médiane du Luer 3 voies supérieur.
- Placer un tube de 1 cm (no 1) sur le fil pt (no 7) et un tube de silicone de 1 cm (no 5) sur le dernier et la buse d’un connecteur Luer mâle (no 2). Fixez l’assemblage à la connexion moyenne du connecteur Luer 3 voies inférieur (no 3) par rotation de vis typique de Luer.
- Poussez un tube de 1 cm (No.1) sur l’extrémité de sortie du capillaire CE et placez-le à environ 8-9 cm de l’extrémité.
- Placer un tube de silicone de 1 cm (no 5) sur le dernier et la buse d’un connecteur Luer mâle (no 2).
- Placez l’ensemble de l’ensemble à partir de la gauche à travers la barre du connecteur 3 voies-T supérieur et fixez le connecteur Luer mâle et l’extrémité gauche du connecteur femelle 3 voies Luer (no 3) par rotation de vis typique de Luer.
- Fixer le tube de silicone de 25 cm (no 5) à la buse d’un connecteur Luer mâle (no 2) et fixer l’ensemble à l’extrémité inférieure (droite) de la barre à partir du connecteur Luer 3 voies inférieur (no 3) par rotation de vis typique de Luer.
- Prenez le tube de silicone de 1 cm (no 6) et poussez-le 5 mm sur l’extrémité du nébuliseur étroitement tandis que le deuxième connecteur mâle de cône de Luer (no 4) est étroitement branché dans la partie saillante du tube de silicone.
- Déplacez la partie d’interface montée ci-dessus par la suite avec le capillaire CE saillant au cône mâle au nébuliseur. Insérez soigneusement le capillaire CE à travers le cône mâle et plus loin à travers la partie plus large du capillaire nébuliseur jusqu’à ce que ce dernier se rétrécit. Étant donné que la longueur saillante du capillaire a été choisie convenablement, le connecteur femelle supérieur 3 voies Luer s’adapte maintenant étroitement au cône mâle.
- Corriger la longueur de la longueur capillaire saillante si nécessaire, en déplaçant le capillaire (avant/arrière) au tube (no 1) lorsque vous entrez dans l’interface auto-faite.
REMARQUE : La position optimale du capillaire CE au début du capillaire du nébuliseur n’est pas trop critique. Cependant, ne poussez pas le capillaire CE trop près de la partie étroite du capillaire nébuliseur. Cela pourrait entraver ou bloquer le flux d’électrolyte de sortie. En outre, cela interromprait la connexion électrique à l’électrode de sortie et augmenterait l’aspiration par le capillaire CE, ce qui entraînerait une séparation perturbée. À son tour, ne gardez pas l’extrémité capillaire CE trop loin du capillaire nébuliseur depuis lors, les pics séparés pointus seraient élargis et la résolution sera perdue. - Utilisez une lentille pour identifier la meilleure position.
REMARQUE : La figure 1 (en bas à droite) montre la position optimale du ce-capillaire à l’intérieur du nébuliseur.
- Sélection des nébuliseurs

Figure 1 : Schématique et montage de l’interface CE-ICP-MS. Le schéma identifie les pièces uniques pour le montage par étapes de l’interface CE-ICP-MS simple et bon marché. La fenêtre montre une photo du positionnement optimal du ce-capillaire dans le nébuliseur. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
| non. | Partie | utilisé pour |
| 1 | Tubes (code couleur vert-orange), 2 x ca. 1 cm | fixation de l’électrode capillaire et de sortie CE à Luer-pièces et de garder serré |
| 2 | Luer, mâle, 3 x, adapté pour les tubes en silicone ID de 1,6 mm | connexion du tube de silicone à l’électrolyte de sortie et comme aide pour fixer l’électrode capillaire ce et pt-fil |
| 3 | 3 voies-Luer, femelle, 2 x | T-pieces pour connecter l’électrode, le flux capillaire et de sortie aspirée |
| 4 | Cône de Luer, mâle, 2 x | reliant les femelles Luers les unes aux autres et à nébuliseur |
| 5 | Tube en silicone, ID de 1,6 mm, mur de 0,8 mm, 2 x 1 cm, 1x ca. 25 cm | a) 1 cm; collant ce capillaire à l’interface, b) 1 cm; collant Pt-wire à l’interface c) 25 cm; connexion de la fiole électrolyte de sortie à l’interface |
| 6 | Tube en silicone, ID de 3 mm, mur de 1,2 mm, ca.1 cm | collant cône Luer à nébuliseur |
| 7 | Fil de platine | Électrode de sortie |
Tableau 2 : Pièces pour la construction de l’interface CE-ICP-MS simple et auto-fabriquée. Les chiffres se réfèrent également à la figure 1 et à la description dans le texte.
4. Préparation à la mesure
REMARQUE : Avant la mesure, le capillaire doit être rincé avec une solution alcaline forte (ici : 12 % de TMAH) pour le nettoyage, puis rempli d’électrolyte de fond. Pour une meilleure séparation, un sandwich tampon d’empilage est construit autour de l’échantillon en fonction de la conductivité et des gradients de pH. Le tableau 3 résume les étapes de préparation consécutives du capillaire, qui sont traitées automatiquement par l’instrument selon la méthode programmée:
| Étape-Non | Étape | Chimique | Condition |
| Préparation de la colonne CE | |||
| Préparation 1 | Nettoyage capillaire | 12 % TMAH | 4 bar, 1 min. |
| Préparation 2 | Purge capillaire avec électrolyte de fond | 20 mM HCl | 4 bar, 1 min. |
| Préparation 3 | Empilage : électrolyte de premier plan | 12 % TMAH | 150 mbar, 3 s |
| Préparation 4 | Injection | Échantillon | 150 mbar, 3 s |
| Préparation 5 | Empilage : fin de l’électrolyte | 0,05 mM HCl | 150 mbar, 3 s |
Tableau 3 : Étapes de préparation capillaire avant la mesure. Ces étapes sont programmées avec le logiciel du système CE dans la méthode CE et comprennent l’injection d’échantillons pressurisés et l’accumulation d’un « sandwich d’empilage » autour de l’échantillon.
- Programmez une méthode CE, qui exécute consécutivement les étapes données au tableau 3.
- Définissez un exemple de table et de séquence dans le logiciel CE et copiez cette séquence également dans le logiciel ICP-MS.
5. Mesure et évaluation des données
- Démarrez la méthode à l’instrument CE. Après la préparation programmée et le remplissage du capillaire, la mesure commence automatiquement dès que le flacon d’entrée, contenant 20 mM HCl, est en position à l’entrée capillaire. Le « start-trigger » est envoyé à l’ICP-MS, qui commence la surveillance en ligne des isotopiques Fe.
REMARQUE : La séparation utilise une tension de +25 kV. La longueur prolongée du capillaire, nécessaire pour relier l’instrument CE à l’ICP-MS, entraîne une augmentation inutile du temps de séparation. Par conséquent, la séparation est soutenue par une basse pression de 250 mbar à l’entrée. L’électrolyte auto-aspiré à la sortie est de 5 mM HCl. L’analyse totale dure 3 minutes pour les échantillons ayant une conductivité modérée. Dans la fenêtre de signal du logiciel ICP-MS, l’électrophérogramme peut être observé pendant la course. À la fin de chaque échantillon, deux fichiers de données sont générés automatiquement, l’un uniquement accessible à partir d’un logiciel d’instrument à partir d’une banque de données interne, un second dans le dossier d’exportation sous le format « xl » ou « tx », accessible par fonction d’importation à partir d’un logiciel de chromatographie régulière. - Reportez-vous au manuel logiciel de l’instrument ICP-MS pour l’exportation des fichiers dans un logiciel de chromatographie.
Résultats
Mesures des normes et étalonnage
Les temps de migration ont été élucidés par des injections standard uniques : la norme Fe(III) a été surveillée à 118 s de temps de migration et la norme Fe(II) à 136 s de temps de migration. Les limites de détection ont été calculées à l’aide d’un critère 3σ se référant au bruit de base et une concentration standard de 50 μg/L. LOD(Fe(II) était de 3,1 μg/L et la LOD(Fe(III) était de 3,2 μg/L. L’étalonnage à base de zone de pointe pour les deux espèces de fer était linéaire de la LOD à 150 μg/L. Alors que la linéarité de Fe(III) a également été prouvée pour une concentration plus élevée, la pente de la courbe d’étalonnage pour Fe(II) a diminué. Une limite de concentration supérieure de 150 μg/L a été jugée suffisante puisque les bio-échantillons pertinents pour la détermination de Fe(II)/(III) ont généralement une concentration de Fe plus faible. En cas de concentration plus élevée, les échantillons peuvent être dilués en conséquence. L’étalonnage de hauteur maximale a été vérifié jusqu’à 600 μg/L et a montré une linéarité sur l’ensemble de la plage testée. Ceci est indiqué à la figure 2.
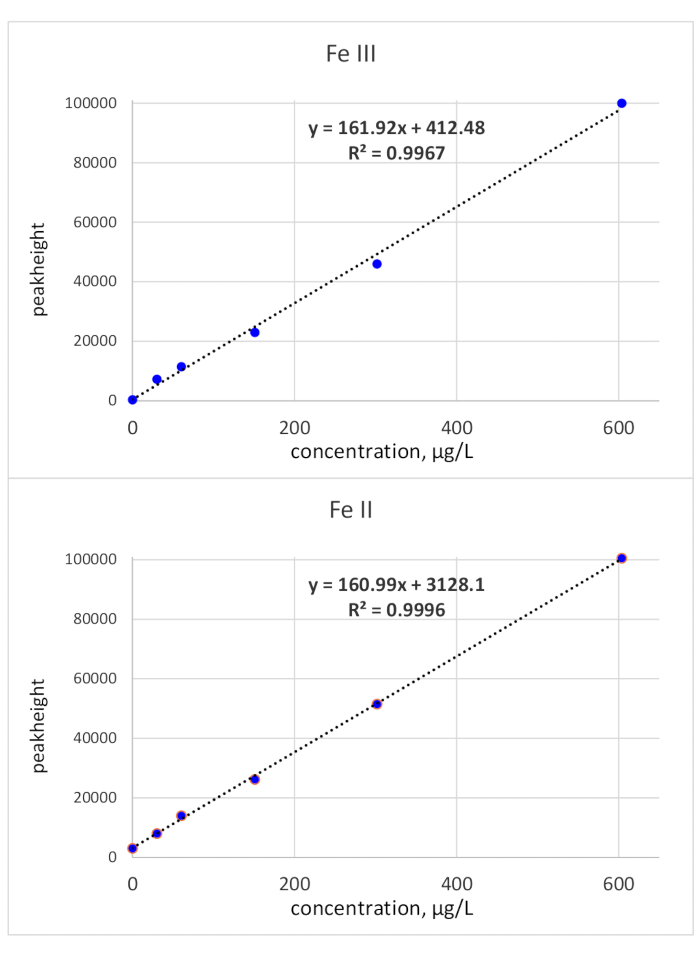
Figure 2 : Courbes d’étalonnage (hauteur maximale) de Fe(III) et fe(II). Les étalonnages liés à la hauteur maximale des deux espèces de Fe redox sont linéaires avec une pente de environ 161 *X Veuillez cliquer ici pour voir une version plus grande de cette figure.
Analyse du lysate cellulaire SH-SY5Y
L’analyse du lysate cellulaire SH-SY5Y a montré une migration légèrement plus lente pour les espèces de redox de fer en raison de la conductivité un peu plus élevée. Fe(III) a été surveillé à 124 s de temps de migration, Fe(II) à 158 s de temps de migration. La précision du temps de migration dans le lysate de cellules SH-SY5Y était de 2 % pour Fe(III) et de 3 % pour Fe(II). Les mesures quantitatives de Fe(II) et de Fe(III) utilisant cette méthode ont révélé une concentration de Fe(III) de 330 μg/L et de 84 μg/L de Fe(II), toutes deux ayant pour résultat un ratio Fe(II)/Fe(III) de 0,25. L’électrophérogramme fe-sélectif 56respectif est démontré à la figure 3.
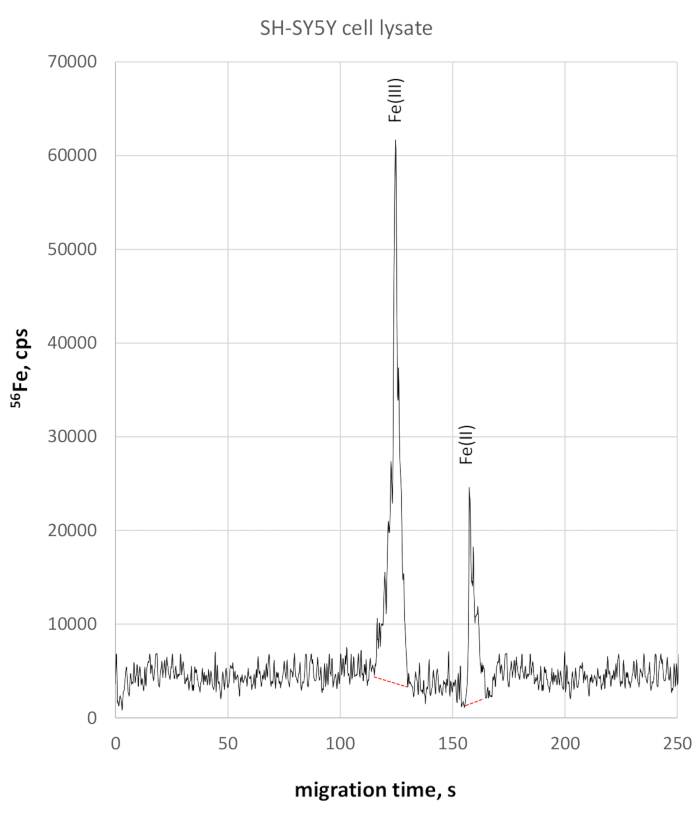
Figure 3 : 56électrophérogramme fe-spécifique du lysate de cellules SH-SY5Y. Fe(III) est surveillé à 123 s atteignant 58025 cps hauteur de pointe, étant clairement séparé de Fe(II) à 158 s, atteignant 22800 cps S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
Discussion
Puisque le fer joue un rôle important dans la progression d’OS, facilitant ainsi le dysfonctionnement mitochondrial ou FTP, une méthode quantitative polyvalente basée sur CE-ICP-MS pour la spéciation simultanée de Fe(II)/Fe(III) est présentée dans cet article et son application est exemplairement démontrée dans les lysates cellulaires. La méthode fournie à court temps d’analyse et les chiffres du mérite (LOQ, précision, récupération) conviennent aux échantillons étant pertinents pour la spéciation redox de fer spécifiquement dans la recherche neurodégénérative et de cancer. Par rapport aux méthodes précédentes basées sur LC, cette méthode basée sur le CE est pratiquement indépendante des lots de colonnes et a déjà observé des problèmes de reproductibilité après le changement de colonne LC. La préparation capillaire avant chaque course est de <4 minutes et le temps d’analyse par échantillon avec une salinité modérée jusqu’à 3 min. Outre la charge et la taille des molécules, le temps de migration dans la RTC dépend de la conductivité à la prise d’échantillon, ce qui provoque des variations de temps de migration ou des décalages lorsque les échantillons eux-mêmes influencent considérablement la conductivité. De tels changements dans le temps de migration sont bien connus dans l’électrophorèse capillaire. Il s’agit d’un problème CZE-immanent, connu de la littérature21,22. Les normes et les lysates de cellules SH-SY5Y ont eu la conductivité modérée et homogène. Par conséquent, les temps de migration n’ont montré que peu de changements avec une bonne précision. Toutefois, pour les échantillons à forte conductivité, des temps de migration prolongés peuvent être observés jusqu’à 5 min. Par conséquent, des ajouts standard sont recommandés pour l’identification claire des espèces.
Un problème critique dans la spéciation de redox de fer est la stabilité d’espèce (c.-à-d. le maintien des équilibres de Fe(II)/(III) ) pendant la préparation de l’échantillon8,13. Des produits chimiques inappropriés en pH ou en chélation ainsi que des conditions de stockage inappropriées telles que l’oxygène (air) en contact avec un échantillon ou une rupture dans le stockage gelé en profondeur peuvent facilement modifier l’équilibre Fe(II)/(III). Par conséquent, pour la préparation des lysates de cellules SH-SY5Y, un tampon de lyse a été choisi sans aucun produit chimique chélatateurs, pH physiologique, mais la superposition de gaz inerte pendant la préparation de l’échantillon, dans les récipients d’échantillon et la congélation profonde immédiate a été appliquée pour ces échantillons.
Dans la littérature, on peut trouver des approches semi-quantitatives pour surveiller Fe(II). Pour une meilleure compréhension du rôle du fer dans le stress oxydatif, plusieurs groupes de recherche ont mis au point des sondes spécifiques à Fe(II) pour surveiller et visualiser de façon semi-quantitative l’élévation aberrante du fer ferreux in vitro. Toutefois, il est important de noter que ces sondes ne considèrent pas Fe(III) et ne quantifient pas mais signalent juste « lu » ou « oin » Fe(II)). À ce jour, seuls quelques biomarqueurs sont disponibles pour déterminer l’OS et le FPT, étant dû à l’absence de méthodes fiables pour quantifier simultanément les espèces de redox Fe(II)/Fe(III)23,24. Ayant ceci à l’esprit, la méthode présentée - facilitant la quantification rapide des deux, Fe(III) et Fe(II) dans une course - peut devenir un outil prometteur pour approfondir la perspicacité dans les processus moléculaires dépendants du fer.
Déclarations de divulgation
Les auteurs n’ont rien à révéler.
Remerciements
Le VV a été soutenu par la subvention de recherche intra-muros (Forschungsförderung) du Centre médical universitaire de Göttingen et le programme de recherche Else Kröner de l’Else Kröner-Fresenius-Stiftung.
matériels
| Name | Company | Catalog Number | Comments |
| CE capillary | CS-Chromatographie Service, Langerwehe, Germany | 105180-25 | |
| CE system | PrinCe technolgies | 0005.263 | model PrinCe 760 |
| Conical Superclear Tubes 15 ml | Analytics-shop.com by Altmann Analytik | PEN0777704 | |
| Conical Superclear Tubes 50 ml | Analytics-shop.com by Altmann Analytik | PEN0777694 | |
| FeCl2 * 4H2O | Merck | 103861 | |
| FeCl3 | Merck | 803945 | |
| Fluidflex Silikon HG-Schlauch | ProLiquid | 4001106HG | |
| Fused silica capillary OD 360 µm, ID 50 µm | Chromatographie Service GmbH | 105180-25 | |
| hydrochloric acid, 1 M | Merck | 1101652500 | corrosive |
| ICP-MS | Perkin Elmer | N814003 | |
| Luer, 3-way female | BioRad | 7318229 | |
| Luer, cone male | neoLab Migge | 2-1895 | |
| Luer, male | neoLab Migge | 2-1880 | |
| Peakfit peak evaluation software | Systat | PeakFit 4.12 | |
| Pt-wire | Carl Roth | 0737.1 | |
| PVC tube | ProLiquid | 6000002 | |
| RIPA buffer | Abcam | ab156034 | |
| Tetramethylammoniumhydroxide, 25 % | Merck | 814748 | corrosive |
| TYGON-tube R-3607 | ProLiquid | 3700203A |
Références
- Hare, D. J., et al. Is early-life iron exposure critical in neurodegeneration. Nature Reviews Neurology. 11 (9), 536-544 (2015).
- Ashraf, A., Clark, M., So, P. W. The Aging of Iron Man. Frontiers in Aging Neuroscience. 10, (2018).
- Hare, D. J., Cardoso, B. R., Szymlek-Gay, E. A., Biggs, B. A. Neurological effects of iron supplementation in infancy: finding the balance between health and harm in iron-replete infants. Lancet Child Adolesc Health. 2 (2), 144-156 (2018).
- Torti, S. V., Torti, F. M. Iron and cancer: more ore to be mined. Nature Reviews Cancer. 13 (5), 342-355 (2013).
- Kehrer, J. P. The Haber-Weiss reaction and mechanisms of toxicity. Toxicology. 149 (1), 43-50 (2000).
- Gaschler, M. M., Stockwell, B. R. Lipid peroxidation in cell death. Biochemical and Biophysical Research Communications. 482 (3), 419-425 (2017).
- Michalke, B., Halbach, S., Nischwitz, V. JEM Spotlight: Metal speciation related to neurotoxicity in humans. Journal of Environmental Monitoring. 11 (5), 939-954 (2009).
- Solovyev, N., Vinceti, M., Grill, P., Mandrioli, J., Michalke, B. Redox speciation of iron, manganese, and copper in cerebrospinal fluid by strong cation exchange chromatography - sector field inductively coupled plasma mass spectrometry. Analytica Chimica Acta. 973, 25-33 (2017).
- Lee, H. J., et al. Effect of excess iron on oxidative stress and gluconeogenesis through hepcidin during mitochondrial dysfunction. Journal of Nutritional Biochemistry. 26 (12), 1414-1423 (2015).
- Dixon, S. J., Lemberg, K. M., Lamprecht, M. R., Skouta, R., Zaitsev, E. M., Gleason, C. E., et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death. Cell. 149 (5), 1060-1072 (2012).
- Stockwell, B. R., et al. Ferroptosis: A Regulated Cell Death Nexus Linking Metabolism, Redox Biology, and Disease. Cell. 171 (2), 273-285 (2017).
- Michalke, B., Berthele, A., Mistriotis, P., Ochsenkuhn-Petropoulou, M., Halbach, S. Manganese speciation in human cerebrospinal fluid using CZE coupled to inductively coupled plasma MS. Electrophoresis. 28 (9), 1380-1386 (2007).
- Fernsebner, K., Zorn, J., Kanawati, B., Walker, A., Michalke, B. Manganese leads to an increase in markers of oxidative stress as well as to a shift in the ratio of Fe(II)/(III) in rat brain tissue. Metallomics. 6 (4), 921-931 (2014).
- Neth, K. . Manganese: Species Pattern and Mechanisms of Brain Injury. , (2015).
- Neth, K., et al. Changes in Brain Metallome/Metabolome Pattern due to a Single i.v. Injection of Manganese in Rats. Plos One. 10 (9), (2015).
- Venkataramani, V., et al. Manganese causes neurotoxic iron accumulation via translational repression of Amyloid Precursor Protein (APP) and H-Ferritin. Journal of Neurochemistry. 147 (6), 831-848 (2018).
- Willkommen, D., Lucio, M., Schmitt-Kopplin, P., Gazzaz, M., Schroeter, M., Sigaroudi, A., Michalke, B. Species fractionation in a case-control study concerning Parkinson's disease: Cu-amino acids discriminate CSF of PD from controls. Journal of Trace Elements in Medicine and Biology. 49, 164-170 (2018).
- Thibault, P., Dovichi, N. J., Camilleri, P. General instrumentation and detection systems including mass spectrometry. Capillary Electrophoresis - Theory and Practice. , 23-89 (1998).
- Iliff, J. J., et al. A Paravascular Pathway Facilitates CSF Flow Through the Brain Parenchyma and the Clearance of Interstitial Solutes, Including Amyloid beta. Science Translational Medicine. 4 (147), (2012).
- Michalke, B. Manganese speciation using capillary electrophoresis-ICP-mass spectrometry. Journal of Chromatography A. 1050 (1), 69-76 (2004).
- Kuhn, R., Hofstetter-Kuhn, S. . Capillary electrophoresis: Principles and practice. , (1993).
- Michalke, B. Capillary electrophoretic methods for a clear identification of selenoamino acids in complex matrices such as human milk. Journal of Chromatography A. 716 (1-2), 323-329 (1995).
- Yang, W. S., et al. Regulation of ferroptotic cancer cell death by GPX4. Cell. 156 (1-2), 317-331 (2014).
- Shimada, K., Hayano, M., Pagano, N. C., Stockwell, B. R. Cell-Line Selectivity Improves the Predictive Power of Pharmacogenomic Analyses and Helps Identify NADPH as Biomarker for Ferroptosis Sensitivity. Cell Chemical Biology. 23 (2), 225-235 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon