Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Espectroscopia de resonancia magnética nuclear giratoria en ángulo mágico in situ de alta temperatura y alta presión
En este artículo
Resumen
Las estructuras moleculares y la dinámica de sólidos, líquidos, gases y mezclas son de interés crítico para diversos campos científicos. Mas NMR in situ de alta temperatura y alta presión permite la detección del entorno químico de los componentes en sistemas de fase mixta en entornos químicos estrictamente controlados.
Resumen
La espectroscopia de resonancia magnética nuclear (RMN) representa una técnica importante para entender la estructura y los entornos de unión de las moléculas. Existe un impulso para caracterizar materiales en condiciones relevantes para el proceso químico de interés. Para hacer frente a esto, se han desarrollado métodos MAS NMR in situ de alta temperatura y alta presión para permitir la observación de interacciones químicas sobre una gama de presiones (vacío a varios cientos de bar) y temperaturas (muy por debajo de 0 °C a 250 °C). Además, la identidad química de las muestras puede estar compuesta por sólidos, líquidos y gases o mezclas de los tres. El método incorpora rotores NMR de zirconia (soporte de muestra para MAS NMR) que se pueden sellar utilizando una tapa roscada para comprimir un anillo O. Este rotor exhibe una gran resistencia química, compatibilidad de temperatura, bajo fondo NMR, y puede soportar altas presiones. Estos factores combinados permiten su uso en una amplia gama de combinaciones de sistemas, que a su vez permiten su uso en diversos campos como secuestro de carbono, catálisis, ciencia de materiales, geoquímica y biología. La flexibilidad de esta técnica la convierte en una opción atractiva para científicos de numerosas disciplinas.
Introducción
El análisis espectroscópico de muestras es una herramienta analítica utilizada para obtener información valiosa sobre materiales de interés como su estado químico, estructura o reactividad. En una visión simplista, la resonancia magnética nuclear (RMN) es una de esas técnicas que utiliza un campo magnético fuerte para manipular el estado de giro de los núcleos atómicos para comprender mejor el entorno químico de las especies de interés. El estado de giro nuclear se refiere a la dirección relativa del momento magnético inducido por el movimiento del núcleo giratorio, una partícula cargada positivamente. En ausencia de un campo magnético, los giros nucleares están orientados aleatoriamente, pero en presencia de un campo magnético, los giros nucleares se alinean preferentemente con el campo externo del imán en un estado de giro de baja energía. Esta división de los estados de giro para discretos valores de energía se conoce como el efecto Zeeman. La diferencia entre estos niveles de energía (ΔE) se modela mediante la ecuación 1:
donde h es constante de Tablón, B0 es la fuerza del campo magnético externo y γ es la relación giromagnética del núcleo. El entorno químico de estos giros también aplica ligeras perturbaciones a estos niveles de energía. Las ondas de radio de las frecuencias correspondientes se pueden utilizar para excitar los núcleos, lo que genera una magnetización transversal debido a que los giros ganan coherencia de fase a medida que se reduce la magnetización longitudinal (basada en la población de giros en estados paralelos y anti-paralelos). A medida que los núcleos continúan precesando sobre el eje del campo magnético, el movimiento magnético giratorio crea un campo magnético que también está girando y generando un campo eléctrico. Este campo modula los electrones en la bobina de detección NMR, generando la señal NMR. Las ligeras diferencias en el entorno químico de los núcleos de la muestra afectan a las frecuencias detectadas en la bobina.
El análisis NMR de muestras sólidas introduce complejidades no encontradas en los fluidos. En los fluidos, las moléculas caen a velocidades rápidas, promediando el entorno químico espacialmente alrededor de los núcleos. En las muestras sólidas, no se produce tal efecto promedio, introduciendo un entorno químico dependiente de la orientación y líneas espectrales amplias en la señal NMR. Para mitigar estos desafíos, se emplea una técnica conocida como giro de ángulo mágico (MAS)1,2. En MAS NMR, las muestras se giran rápidamente (varios kilohercios) en un ángulo de 54.7356° con respecto al campo magnético externo utilizando un mecanismo de hilado externo para abordar las interacciones dependientes de la orientación (anisotrópicos) de NMR. Esto reduce sustancialmente las características nmr y mejora la resolución espectral promediando los términos dependientes de la orientación de la anisotropía de cambio químico, interacciones dipolares e interacciones cuadrúpedas. Dos excepciones notables dificultan las habilidades de estrechamiento de línea de MAS NMR. El primero es el acoplamiento homonuclear fuerte a veces presente en 1H NMR que requiere altas velocidades de giro (~ 70 kHz) para eliminar. Sin embargo, las temperaturas significativamente elevadas de las aplicaciones de alta temperatura suprimirán en gran medida la interacción homonuclear de 1H mediante la impartición de un movimiento térmico mejorado de modo que se pueda utilizar una tasa de hilado de muestra mucho menor para una resolución espectral significativamente mejorada. Además, con la tecnología en continua evolución, los rotores con diámetros más pequeños ahora se pueden fabricar para lograr velocidades de giro muy superiores a 5 kHz, lo que ayuda a suprimir aún más las interacciones dipolares homonucleares de 1H. La segunda excepción son las interacciones cuadrúpedas residuales de segundo orden para núcleos con giro que supera la mitad, ya que sólo el término de primer orden se elimina en el ángulo mágico, dejando formas de línea más complejas que sólo se pueden mejorar mediante campos magnéticos externos más fuertes. Cabe destacar que las técnicas MQMAS 2D se pueden incorporar fácilmente a la tecnología actual para que se pueda obtener un verdadero espectro de cambios químicos isotrópicos de manera similar a los experimentos MQMAS estándar3.
MAS NMR ha permitido la caracterización detallada de materiales sólidos, fortaleciendo la calidad de las observaciones. Sin embargo, la necesidad de hilar las muestras en rotores NMR (el soporte de la muestra) a altas tasas también impone desafíos en la realización de experimentos a temperaturas elevadas y presiones que pueden ser más relevantes para las condiciones de interés. A veces puede ser deseable examinar materiales en condiciones relativamente duras para los rotores NMR. Una serie de esfuerzos han adaptado con éxito las tecnologías NMR de estado líquido para llevar a cabo nmr de alta temperatura y alta presión4,5,6,7; sin embargo, las tapas de rotor comercial utilizadas para mas NMR de estado sólido pueden ser expulsadas del rotor a altas presiones, causando daños significativos en el equipo. Estos efectos pueden agravarse examinando una reacción de descomposición que aumenta en gran medida la presión en el soporte de la muestra. Como tal, se requieren nuevos diseños para llevar a cabo experimentos NMR in situ de manera efectiva y segura. Por ejemplo, el rotor debe adherirse a varias cualidades para un uso eficaz en MAS NMR, a saber, no magnético, ligero, duradero, resistente a la temperatura, material de fondo nmr bajo, sellable, de alta resistencia y resistente a los productos químicos. Las presiones que debe soportar el rotor son bastante grandes. El rotor no sólo debe soportar la presión de la muestra contenida en (por ejemplo, gas de alta presión), la rotación del dispositivo imparte fuerza centrífuga que tiene su propia contribución a la presión total del sistema8,PT, por la ecuación 2: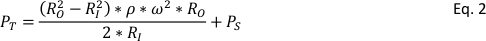
RI y RO son los radios del rotor interior y exterior, respectivamente, ω es la frecuencia de rotación en radianes por segundo, y P s es la presiónde la muestra.
Se han elaborado una serie de estrategias para abordar estas preocupaciones9. Los primeros ejemplos se asemejaban a tubos sellados por llama10,11,12 o inserciones de polímeros13,14, que eran insuficientes para un funcionamiento prolongado y de control fino a temperaturas y presiones elevadas. Las iteraciones a los diseños de rotores han sufrido limitaciones en la temperatura máxima de funcionamiento impartidas por el uso de epoxi o reducciones de volumen de muestra de plaquitas cerámicas8,15,16. Una tecnología reciente reduce los costos de producción unitaria mediante el empleo de características simples de ajuste en un manguito rotor comercial, pero ofrece relativamente menos control sobre las condiciones con las que puede operar17. El diseño empleado en este documento es una manga de rotor estilo caverna de zirconia fresada con un top18roscado. También se enhebra una tapa para permitir un sello seguro. El roscado inverso evita que la rotación de la muestra afloje la tapa de zirconia y una junta tórica constituye las superficies de sellado. Este diseño del rotor es visible en la Figura 1 y rotores e instrucciones similares para hacerlos han sido patentados19. Esta estrategia permite una alta resistencia mecánica, resistencia química y tolerancia a la temperatura.
Estos diseños son adecuados para temperaturas y presiones de al menos 250 °C y 100 bar, limitados en temperatura por la tecnología de sonda NMR fácilmente disponible. Cuando se combina con equipos especializados de preparación de muestras, representa una técnica verdaderamente potente que se ha empleado para aplicaciones de largo alcance como secuestro de carbono, catálisis, almacenamiento de energía y biomedicina20. Dicho equipo incluye una forma de pretratar los materiales sólidos para eliminar especies superficiales no deseadas como el agua. Un horno se emplea a menudo para este paso. Una caja seca se utiliza normalmente para cargar las muestras sólidas en el rotor NMR. A partir de ahí, el rotor se transfiere a un dispositivo de exposición que permite abrir el rotor bajo una atmósfera fuertemente controlada para cargar un gas o mezcla deseado en el rotor. Este dispositivo se representa en la Figura 2.
Protocolo
El protocolo se divide en cuatro secciones que especifican 1) la preparación de cualquier material sólido que se utilice en el sistema o activación o desbroce de especies adsorbidas no deseadas, 2) adición de los materiales sólidos y líquidos al rotor NMR, 3) adición de gases al rotor, y 4) la realización de los experimentos NMR en el espectrómetro. El procedimiento es representativo de una secuencia típica, pero puede modificarse para adaptarse a las necesidades específicas del experimento.
1. Pretratar muestras sólidas
- Pesar aproximadamente el doble de la masa de la muestra sólida que se desea para el experimento NMR (para un rotor de 7,5 mm, ~ 250 mg) y colocar la muestra sólida en un tubo de muestra de cuarzo utilizado para tratar materiales en un sistema de horno, conectando el tubo con lana de cuarzo para mantener el material en su lugar.
- Conecte las válvulas de aislamiento al sistema de vacío de tratamiento de sólidos 1) o 2) colocando el tubo en el horno frío y apretando las conexiones.
- Coloque los extremos del tubo de cuarzo en las válvulas de aislamiento de gas en posición abierta.
- Comience el tratamiento.
- Para sistemas de flujo:
- Coloque un termopar en el exterior del tubo, manteniéndolo en su lugar con un material resistente al calor.
- Comience el flujo del gas de tratamiento (por ejemplo, N2 a 100 sccm) para limpiar la superficie sólida o activar el material.
- Alternativamente, para sistemas de vacío:
- Cierre la válvula de aislamiento al sistema de vacío e inicie la bomba de vacío.
- Cuando se establece el vacío completo, abra muy lentamente la válvula de aislamiento para aplicar vacío a la muestra, haciendo una pausa periódica para permitir que el sistema se equilibre. Continúe hasta que la válvula esté abierta.
- Para sistemas de flujo:
- Encienda el controlador del horno y ajuste el programa de rampa de temperatura a la condición deseada (por ejemplo, 300 °C durante 4 horas a una velocidad de rampa de 5 °C/min).
- Inicie el programa de temperatura y déjelo funcionar.
- Cuando se complete, deje que la muestra se enfríe a una temperatura viable.
- Apague el controlador de temperatura y detenga el flujo/vacío.
- Selle rápidamente la muestra con las válvulas de aislamiento para mantener el entorno de muestra deseado.
- Desconecte el tubo de cuarzo del sistema de tratamiento y transfiera los tubos y las válvulas cerradas a la antesala de una guantera seca purgada N2.
- Vacíe y vuelva a llenar la antesala al menos 4 veces y transfiera el tubo dentro de la guantera.
2. Carga de muestras sólidas en el rotor NMR
- Pesar el rotor NMR de alta presión y alta temperatura vacío y limpio con la tapa del rotor.
- Coloque el rotor NMR en el soporte para mantener la direccionalidad.
- Coloque el embudo de muestra en el orificio del rotor.
- Retire las válvulas de aislamiento del tubo de muestra y vierta una pequeña cantidad de material sólido en el embudo.
- Toque el polvo hacia abajo en el embudo y dilícilo ligeramente hacia el rotor con la barra de embalaje según sea necesario.
- Repita la adición escalonada de material sólido hasta que se logre la cantidad deseada (por ejemplo, rotor 1/2).
- Pesar el rotor NMR (y tapa) con la muestra en su interior para determinar la cantidad de muestra añadida.
- Si lo desea, dibuje una cantidad especificada de cualquier muestra líquida e inyecte lentamente el líquido en el centro del rotor NMR con una jeringa micro.
- Selle el rotor colocando la tapa en la parte superior y volteándola en sentido contrario a las agujas del reloj con la broca del rotor para enganchar el juntato entre el rotor y la tapa. Tenga en cuenta que una nueva junta tórica puede ser requerida periódicamente para evitar fugas, especialmente si se utilizan mezclas químicamente abrasivas o gases pequeños como el hidrógeno.
- Pesar el rotor NMR para determinar la masa total de la muestra añadida.
3. Cargar el rotor NMR con los productos químicos deseados en las condiciones deseadas
- Coloque el rotor NMR sellado en la etapa del rotor, asegurándose de que el tamaño de la plaquita del escenario sea compatible con el tamaño del rotor, y apriete la tuerca a mano para fijarla en su lugar. Tenga en cuenta que la estanqueidad del rotor en el soporte en este paso determinará la estanqueidad del sello de la tapa.
- Baje la etapa del rotor en la sección inferior del dispositivo de exposición a alta presión.
- Utilice una llave Allen para girar uno de los tornillos 90° para fijar la etapa del rotor en la parte inferior del dispositivo de exposición.
- Coloque la sección superior del dispositivo de carga NMR en y en la parte superior de la sección inferior, alineando el bit de la tapa NMR hasta la parte superior del cabezal de la tapa del rotor NMR para asegurarse de que está activado.
- Coloque las 2 abrazaderas sobre la parte superior del labio donde las secciones superior e inferior del dispositivo de exposición se reúnan y las enganchen en su lugar.
- Apriete los 6 pernos en la parte superior de la sección superior del dispositivo de exposición para enganchar la superficie de sellado entre las secciones superior e inferior.
- Conecte la sección superior del dispositivo de exposición NMR a la entrada y salidas de la línea de gas.
- Conecte el termopar en la sección superior del dispositivo de exposición NMR al sensor de temperatura.
- Si lo desea, envuelva la cinta de calentamiento alrededor de las líneas de gas y las secciones superiores del dispositivo de exposición para permitir el calentamiento con el controlador respectivo. También se puede colocar un plato caliente.
- Asegurándose de que la toma de la cámara de exposición esté abierta y la válvula de gas de origen esté cerrada, encienda la bomba de vacío para extraer aire del dispositivo de exposición y las líneas asociadas.
- Purgar las líneas con el gas deseado o uno inerte, pedaleando entre el vacío y la presión atmosférica tres veces para asegurarse de que las líneas están despejadas de aire.
- Prepare la composición de gas deseada a partir de 1) un sistema de entrega de alta presión o 2) un sistema de flujo para introducir vapores a una presión especificada.
- Para preparación de muestras de alta presión o vacío:
- Cierre la salida de gas del dispositivo de exposición y ajuste las válvulas del colector de gas para eludir la línea de inyección líquida.
- Ajuste la presión deseada sobre la bomba de jeringa de alta presión del sistema de entrega de alta presión.
- Abra las válvulas de fuente de gas en la bomba de jeringa de alta presión y ejecute el programa establecido en la bomba, monitoreando la presión real dentro del dispositivo de exposición.
- Cuando se alcance la presión deseada dentro del dispositivo de exposición, detenga la bomba de jeringa y cierre las válvulas de gas de origen.
- Abra el rotor NMR girando en el sentido de las agujas del reloj el mecanismo de tornillo externo, que se acopla a la broca nmr interior.
- Permita que el gas de la presión deseada entre en el rotor NMR y el equilibrio.
- Vuelva a montar el rotor NMR girando el mecanismo de tornillo externo en sentido contrario a las agujas del reloj. Una ventana de visualización ayudará a determinar cuándo se cierra el rotor.
- Despresurice lentamente el sistema abriendo la válvula de salida de gas del dispositivo de exposición.
- Para la preparación de muestras de gas o vapor que fluyen:
- Asegúrese de que la salida de gas del dispositivo de exposición esté abierta para evitar la sobrepresión.
- Ajuste el caudal de gas deseado en el controlador de flujo de masa y comience el flujo de gas.
- Conecte la línea de suministro de líquidos de la bomba de jeringa líquida al colector de gas.
- Ajuste las válvulas colectoras de gas para permitir el flujo a la línea de inyección líquida.
- Ajuste el caudal de líquido en la bomba de jeringa líquida para lograr la presión de vapor deseada e iniciar la inyección de líquido.
- Abra el rotor NMR girando en el sentido de las agujas del reloj el mecanismo de tornillo externo que se acopla a la broca nmr interior.
- Permita que el sistema se equilible a las presiones de gas deseadas dentro del rotor NMR y vuelva a sealar el rotor NMR girando el mecanismo de tornillo externo en sentido contrario a las agujas del reloj. Una ventana de visualización ayudará a determinar cuándo se cierra el rotor.
- Detenga la inyección de la bomba de jeringa líquida y configure las válvulas para desviar la línea de inyección líquida, desconectando la bomba del sistema.
- Detenga el gas que fluye.
- Para preparación de muestras de alta presión o vacío:
- Purgue el sistema con un gas inerte para eliminar cualquier gas potencialmente tóxico o inflamable.
- Detenga cualquier calentamiento y deje que el sistema se enfríe.
- Desconecte cualquier cinta de calentamiento y el termopar.
- Desconecte las líneas de entrada y salida de gas.
- Afloje los 6 pernos en la parte superior del dispositivo de exposición para comprometer el sello.
- Desenroscar las 2 secciones de sujeción y retirarlas del dispositivo de exposición.
- Levante cuidadosamente la sección superior hacia arriba y hacia fuera de la sección inferior.
- Usa una llave Allen para aflojar la etapa del rotor y dibujarla con la varilla roscada.
- Afloje la tuerca en el escenario del rotor y retire el rotor del componente del dispositivo.
- Pesar el rotor para asegurar que las cantidades de gas deseadas estén presentes.
4. Realización del experimento MAS NMR
- Coloque el rotor NMR en la bobina NMR en la sonda NMR.
- Levante la sonda en el agujero del imán y enciérrela en su lugar.
- Inicie el giro de la muestra utilizando la caja de control MAS y ajústelo a la velocidad de giro del rotor deseada.
- Utilice el ordenador para iniciar la secuencia de ajuste/coincidencia en el canal deseado.
- Ajuste la configuración de ajuste/coincidencia en la sonda para optimizar la electrónica de la sonda.
- Salga de la secuencia de ajuste/coincidencia en el ordenador y configure los parámetros experimentales deseados (por ejemplo, secuencia de pulsos, matriz de experimentos, temperatura, etc.).
- Recoja los datos de MAS NMR.
Resultados
La salida del espectrómetro NMR toma la forma de una decaimiento de inducción libre (FID) que es la señal de dominio de tiempo de los giros excitados mientras se relajan de nuevo al equilibrio termodinámico. Tal FID se asemeja a la Figura 3. Cuando Fourier se transformó del dominio de tiempo al dominio de frecuencia (frecuencia a PPM por la ecuación 3, por la cual la diferencia de frecuencia absoluta y una referencia se divide por la frecuencia portadora del espectrómetro NMR), repres...
Discusión
El método de realización de mediciones espectroscópicas MAS NMR esbozadas en este documento representa el estado de la técnica para la realización de MAS NMR de alta temperatura y alta presión. Estos métodos permiten observar las interacciones que se producen en atmósferas de vacío de hasta varios cientos de bar y desde bajas temperaturas (muy por debajo de 0 °C a 250 °C) de una manera fiable y reproducible. La capacidad de sondear sistemas que contienen mezclas de sólidos, líquidos y gases en entornos quím...
Divulgaciones
Los autores declaran los siguientes intereses financieros competidores. J.Z.H y sus colegas poseen una patente sobre el diseño del rotor (US9151813B2). J.Z.H., N.R.J., et al. han presentado una solicitud de patente provisional en el dispositivo de exposición.
Agradecimientos
La revisión de las aplicaciones catalizadoras fue apoyada por el Departamento de Energía de los Estados Unidos, la Oficina de Ciencias, la Oficina de Ciencias Básicas de la Energía, la División de Ciencias Químicas, Biociencias y el Programa de Catalisis de Geociencias bajo contrato DE-AC05-RL01830 y FWP-47319. La revisión de las aplicaciones biomédicas fue apoyada por el Instituto Nacional de Salud, Instituto Nacional de Ciencias de la Salud Ambiental bajo la subvención R21ES029778. Los experimentos se llevaron a cabo en emsl (grid.436923.9), un Doe Office of Science User Facility patrocinado por la Oficina de Investigación Biológica y Ambiental y ubicado en el Laboratorio Nacional del Noroeste del Pacífico (PNNL). PNNL es un laboratorio nacional multiprograma operado por Battelle para el Departamento de Energía de los Estados Unidos bajo contrato DE-AC05-RL01830 y FWP-47319.
Materiales
| Name | Company | Catalog Number | Comments |
| 1) Preparation of Solids Samples | |||
| Gas maniforld | |||
| Gas Mass Flow Controllers | |||
| Vacuum Pump | |||
| Tube Furnace | |||
| Temperature Controller | |||
| Thermocouple | |||
| Quartz Tube | |||
| Isolation Valves | |||
| Quartz Wool | |||
| 2) Loading solid samples into the rotor | |||
| Dry glove box | |||
| High-temperature, high-pressure NMR rotor | |||
| Sample funnel | |||
| Sample packing rod | |||
| Rotor holder | |||
| Analytical Balance | |||
| Microsyringe | |||
| Rotor cap bit | |||
| 3) Addition of gases to the rotor | |||
| NMR loading chamber | |||
| Rotor stage and appropriately sized inserts | |||
| Vacuum Pump | |||
| Gas maniforld | |||
| Gas Mass Flow Controllers | |||
| Vacuum Pump | |||
| Heating Tape | |||
| Temperature Controller | |||
| Thermocouple | |||
| Allen wrench | |||
| Threaded rod | |||
| Wrenchs | |||
| Pressure Gauge | |||
| High-pressure syringe pump | |||
| Liquid syringe pump | |||
| 4) Conducting the NMR experiments | |||
| MAS NMR probe | |||
| NMR spectrometer | |||
| Computer to control the spectrometer |
Referencias
- Andrew, E. R., Bradbury, A., Eades, R. G. Nuclear Magnetic Resonance Spectra from a Crystal rotated at High Speed. Nature. 182 (4650), 1659 (1958).
- Lowe, I. J. Free Induction Decays of Rotating Solids. Physical Review Letters. 2 (7), 285-287 (1959).
- Frydman, L., Grant, D. M., Harris, R. K. Fundamentals of Multiple-Quantum Magic-Angle Spinning NMR on Half-Integer Quadrupolar Nuclei. Encyclopedia of Nuclear Magnetic Resonance. 9, 262-274 (2002).
- Khodov, I., Dyshin, A., Efimov, S., Ivlev, D., Kiselev, M. High-pressure NMR spectroscopy in studies of the conformational composition of small molecules in supercritical carbon dioxide. Journal of Molecular Liquids. 309, (2020).
- Kolbe, F. High-Pressure in situ 129Xe NMR Spectroscopy: Insights into Switching Mechanisms of Flexible Metal-Organic Frameworks Isoreticular to DUT-49. Chemistry of Materials. 31 (16), 6193-6201 (2019).
- Ochoa, G., et al. (2) H and (139) La NMR Spectroscopy in Aqueous Solutions at Geochemical Pressures. Angewandte Chemie International Edition. 54 (51), 15444-15447 (2015).
- Hoffmann, H. C., et al. High-pressure in situ 129Xe NMR spectroscopy and computer simulations of breathing transitions in the metal-organic framework Ni2(2,6-ndc)2(dabco) (DUT-8(Ni)). Journal of the American Chemical Society. 133 (22), 8681-8690 (2011).
- Turcu, R. V. F., et al. Rotor design for high pressure magic angle spinning nuclear magnetic resonance. Journal of Magnetic Resonance. 226, 64-69 (2013).
- Jaegers, N. R., Hu, M. Y., Hoyt, D. W., Wang, Y., Hu, J. Z. Development and Application of In situ High-Temperature, High-Pressure Magic Angle Spinning NMR. Modern Magnetic Resonance. , 1-19 (2017).
- Miyoshi, T., Takegoshi, K., Terao, T. 13C High-Pressure CPMAS NMR Characterization of the Molecular Motion of Polystyrene Plasticized by CO2 Gas. Macromolecules. 30 (21), 6582-6585 (1997).
- Miyoshi, T., Takegoshi, K., Terao, T. 129Xe n.m.r. study of free volume and phase separation of the polystyrene/poly(vinyl methyl ether) blend. Polymer. 38 (21), 5475-5480 (1997).
- Miyoshi, T., Takegoshi, K., Terao, T. Effects of Xe Gas on Segmental Motion in a Polymer Blend As Studied by 13C and 129Xe High-Pressure MAS NMR. Macromolecules. 35 (1), 151-154 (2002).
- Yonker, C. R., Linehan, J. C. The use of supercritical fluids as solvents for NMR spectroscopy. Progress in Nuclear Magnetic Resonance Spectroscopy. 47 (1), 95-109 (2005).
- Deuchande, T., Breton, O., Haedelt, J., Hughes, E. Design and performance of a high pressure insert for use in a standard magic angle spinning NMR probe. Journal of Magnetic Resonance. 183 (2), 178-182 (2006).
- Hoyt, D. W., et al. High-pressure magic angle spinning nuclear magnetic resonance. Journal of Magnetic Resonance. 212 (2), 378-385 (2011).
- Vjunov, A., et al. Following Solid-Acid-Catalyzed Reactions by MAS NMR Spectroscopy in Liquid Phase-Zeolite-Catalyzed Conversion of Cyclohexanol in Water. Angewandte Chemie International Edition. 53 (2), 479-482 (2014).
- Chamas, A., et al. High temperature/pressure MAS-NMR for the study of dynamic processes in mixed phase systems. Magnetic Resonance Imaging. 56, 37-44 (2019).
- Hu, J. Z., et al. Sealed rotors for in situ high temperature high pressure MAS NMR. ChemComm. 51 (70), 13458-13461 (2015).
- Hu, J. Z., Hu, M. Y., Townsend, M. R., Lercher, J. A., Peden, C. H. High-pressure, high-temperature magic angle spinning nuclear magnetic resonance devices and processes for making and using same. US patent. , (2015).
- Jaegers, N. R., Mueller, K. T., Wang, Y., Hu, J. Z. Variable Temperature and Pressure Operando MAS NMR for Catalysis Science and Related Materials. Accounts of Chemical Research. 53 (3), 611-619 (2020).
- Dagle, V., et al. Single-step Conversion of Ethanol to n-butenes over Ag-ZrO2/SiO2 catalysts. ACS Catalysis. 10 (18), 10602-10613 (2020).
- Jaegers, N. R., Wang, Y., Hu, J. Z. Thermal perturbation of NMR properties in small polar and non-polar molecules. Scientific Reports UK. 10 (1), 6097 (2020).
- Jaegers, N. R. . Applications of In situ Magnetic Resonance Spectroscopy for Structural Analysis of Oxide-supported Catalysts. , (2019).
- Mehta, H. S., et al. A novel high-temperature MAS probe with optimized temperature gradient across sample rotor for in-situ monitoring of high-temperature high-pressure chemical reactions. Solid State Nuclear Magnetic Resonance. 102, 31-35 (2019).
- Hu, J. Z., et al. A large sample volume magic angle spinning nuclear magnetic resonance probe for in situ investigations with constant flow of reactants. Physical Chemistry Chemical Physics. 14 (7), 2137-2143 (2012).
- Jiang, Y., et al. In situ MAS NMR-UV/Vis investigation of H-SAPO-34 catalysts partially coked in the methanol-to-olefin conversion under continuous-flow conditions and of their regeneration. Microporous and Mesoporous Materials. 105 (1-2), 132-139 (2007).
- Xu, S., Zhang, W., Liu, X., Han, X., Bao, X. Enhanced In situ Continuous-Flow MAS NMR for Reaction Kinetics in the Nanocages. Journal of the American Chemical Society. 131 (38), 13722-13727 (2009).
- Graham, T. R., et al. In situ Al-27 NMR Spectroscopy of Aluminate in Sodium Hydroxide Solutions above and below Saturation with Respect to Gibbsite. Inorganic Chemistry. 57 (19), 11864-11873 (2018).
- Zhang, X., et al. Boehmite and Gibbsite Nanoplates for the Synthesis of Advanced Alumina Products. ACS Applied Nano Materials. 1 (12), 7115-7128 (2018).
- Zhang, X., et al. Transformation of Gibbsite to Boehmite in Caustic Aqueous Solution at Hydrothermal Conditions. Crystal Growth & Design. 19 (10), 5557-5567 (2019).
- Hu, J. Z., Jaegers, N. R., Hu, M. Y., Mueller, K. T. In situ and ex situ NMR for battery research. Journal of Physics: Condensed Matter. 30 (46), (2018).
- Hu, J. Z., et al. Adsorption and Thermal Decomposition of Electrolytes on Nanometer Magnesium Oxide: An in situ C-13 MAS NMR Study. ACS Applied Materials & Interfaces. 11 (42), 38689-38696 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados