Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Análisis sistemático de puntuación para la inflamación intestinal en un modelo de colitis inducida por sulfato de sodio de dextrano de murina
En este artículo
Resumen
La puntuación sistemática de la inflamación intestinal utilizando un sistema asistido por computadora libre es una poderosa herramienta para comparar cuantitativamente los cambios histopatológicos en los modelos de colitis caracterizados por la presencia de úlceras y cambios inflamatorios. La evaluación de la puntuación de colitis histológica fortalece las observaciones clínicas y facilita la interpretación de los datos.
Resumen
Los modelos de colitis murina son herramientas que se emplean ampliamente en estudios centrados en la comprensión de la patobiología de los trastornos inflamatorios intestinales. Sin embargo, quedan por definir normas sólidas para la cuantificación objetiva y reproducible de la gravedad de la enfermedad. La mayoría de los métodos de análisis de colitis se basan en una puntuación histológica limitada de pequeños segmentos del intestino, lo que conduce a análisis parciales o sesgados. Aquí, combinamos la adquisición de imágenes de alta resolución y el análisis longitudinal de todo el colon para cuantificar la lesión intestinal y la ulceración en el modelo inducido de sulfato sódico dextrano (DSS) de colitis murina. Este protocolo permite la generación de resultados objetivos y reproducibles sin una amplia formación del usuario. Aquí, proporcionamos detalles completos sobre la preparación de muestras y el análisis de imágenes utilizando ejemplos de datos de colitis inducida por DSS. Este método se puede adaptar fácilmente a otros modelos de colitis murina que tienen inflamación significativa asociada con lesiones mucosa. Demostramos que la fracción de mucosa inflamada/lesionada y erosionada/ulcerada en relación con la longitud completa del colon es paralela a los hallazgos clínicos como la pérdida de peso en medio de la progresión de la enfermedad inducida por el SSD. Este protocolo histológico proporciona un tiempo fiable y una ayuda rentable para estandarizar los análisis de la actividad de la enfermedad de una manera imparcial en los experimentos de colitis del SDS.
Introducción
La barrera epitelial gastrointestinal desempeña un papel fundamental en la separación de antígenos luminales y patógenos de los compartimentos de tejido subyacentes1. Las lesiones epiteliales y las heridas mucosas observadas en condiciones patológicas como la enfermedad inflamatoria intestinal (EII), la isquemia o lesiones quirúrgicas están asociadas con síntomas clínicos que incluyen diarrea, pérdida de peso, sangre en las heces y dolor abdominal. En respuesta a lesiones, las células epiteliales migran y proliferan para volver a epitelializar y reparar defectos de barrera mucosa. La resolución de la inflamación y restitución de la integridad mucosa son cruciales para restablecer la homeostasis mucosa intestinal y la función2,3,4.
Se han empleado varios modelos animales para estudiar los mecanismos moleculares subyacentes que están asociados con el daño a la barrera epitelial intestinal. Modelos bien establecidos y fácilmente aplicables de colitis inducida químicamente son ampliamente utilizados, particularmente en estudios relacionados con lesiones inflamatorias como la EII. Un modelo de colitis de murina común, reproducible y confiable emplea sulfato de sodio dextrano (DSS) mediación de lesiones en colones e inflamación. La gravedad de la enfermedad varía dependiendo de la cepa del ratón, dosis de DSS, duración de la administración del SSD y peso molecular del DSS5,6,7.
El daño de la mucosa intestinal durante la colitis del SDS generalmente se evalúa utilizando el Índice de Actividad de la Enfermedad (DAI, por suspens), una puntuación compuesta determinada por la pérdida de peso, el contenido de sangre fecal y la consistencia de las heces. El contenido sanguíneo fecal puede ser microscópico (detectado usando una prueba de ácido guaiac de heces) o macroscópico; consistencia fecal se clasifica como dura, suave o líquida (es decir, diarrea)5,8. La puntuación de estos parámetros clínicos puede ser subjetiva y puede variar dependiendo de la experiencia y el sesgo del usuario, aunque en general, los datos proporcionan información fiable y por lo tanto es ampliamente utilizado por los investigadores del EII. Por el contrario, no existe un método generalmente aceptado para la evaluación histológica del daño mucoso. Más comúnmente, las áreas seleccionadas del colon son inspeccionadas por un patólogo entrenado y puntuadas en base a varios parámetros que generalmente incluyen lesión de cripta e infiltración de leucocitos9,10,11. Sin embargo, debido a que el número de parámetros investigados y la cantidad de tejido analizado varía considerablemente entre los informes individuales, la comparabilidad de muchos estudios publicados es limitada. Para reducir el sesgo de los observadores y mejorar la concordancia entre estudios, un protocolo de puntuación histológica ideal debe: 1) incluir toda la longitud del colon, ya que la inflamación de la mucosa intestinal es más a menudo variable y las lesiones de salto son comunes, 2) limitar el análisis a parámetros clave específicos y fácilmente interpretables para reducir la subjetividad, 3) facilitar el procesamiento rápido y consistente de un gran número de muestras, y 4) utilizar herramientas ampliamente disponibles y asequibles para la adquisición, análisis y presentación de datos.
Aquí describimos una técnica para procesar segmentos enteros de colon o largos del intestino delgado en una configuración de "rollo suizo" junto con el uso de un sistema gratuito de puntuación asistida por computadora para analizar la inflamación y el daño de la mucosa intestinal debido a la colitis inducida por el DSS.
Protocolo
Todos los experimentos con animales descritos fueron aprobados por el Comité de Uso y Cuidado de Animales de la Universidad de Michigan.
1. Cosecha de tejidos
- Eutanasia ratones humanamente usando anestesia isoflurano seguida de dislocación cervical, de acuerdo con los protocolos aprobados. Para todos los experimentos con animales, la aprobación fue obtenida por una junta de revisión certificada de acuerdo con las directrices nacionales e institucionales para el manejo de animales.
- Coloque el ratón en una almohadilla de disección en una posición supina. Inmovilizar las extremidades del ratón utilizando agujas G de 20 G x 1 1/2 pulgada G.
- Usando fórceps y tijeras, haz una pequeña incisión en la piel abdominal y tira de ella hacia un lado para exponer el peritoneo.
- Abra la cavidad abdominal con una incisión de línea media en el peritoneo desde el hueso púbico hasta los lados del abdomen.
- Retire cuidadosamente los tejidos y órganos hasta que se visualice el intestino grueso. Corte el hueso pélvico a ambos lados del colon para visualizar completamente el órgano, extendiéndose desde el ano hacia el cecum.
- Retire suavemente la grasa, las venas pequeñas y las arterias unidas al colon, mientras disecciona cuidadosamente el órgano, cortando sólo proximal al ano y simplemente distal al cecum.
NOTA: El colon diseccionado debe permanecer a temperatura ambiente mientras se completa el procedimiento de balanceo suizo. - Enjuague cuidadosamente el colon con 1x PBS, utilizando una aguja de gavage de plástico flexible insertada a través del ano para eliminar el contenido fecal.
- Coloque el colon en línea recta y abra longitudinalmente a lo largo de la arteria mesenterica. Bisect el colon longitudinalmente desde el distal hasta el extremo proximal (Figura 1A). La mitad del tejido se puede utilizar para el análisis histológico, mientras que el otro se puede procesar para la mancha occidental, PCR o enrollado en un segundo rollo suizo para la microscopía de inmunofluorescencia congelada fresca12.
2. Preparación de rollos suizos
- Recorte el tejido adicional del colon proximal usando una cuchilla de afeitar hasta que se obtenga aproximadamente la misma anchura a lo largo de la longitud de todo el colon.
- Alinee el colon para exponer el lúmenes de frente hacia arriba, y aplane el tejido completamente usando una aguja de gavage flexible. Agregue más PBS, si es necesario, para mantener el tejido húmedo durante todo el procedimiento.
- Retire el exceso de PBS con una toallita de papel. Con una aguja de jeringa y gavage, agregue una solución de formalina tamponada neutra al 10% sobre el tejido durante 2-3 minutos para arreglar y aplanar el tejido.
- Utilice fórceps rectos para agarrar el extremo del dos punto distal y girar el dos punto en círculos concéntricos desde el extremo distal hasta el proximal (Figura 1B).
NOTA: Es posible empujar hacia atrás el interior del rollo suizo mientras se enrolla usando el dedo índice para asegurarse de que el tejido está dentro del rollo. - Inserte una aguja de 27 G para fijar el colon en el medio para mantener su forma de rollo suizo (Figura 1C).
- Coloque el rollo suizo con la aguja en un casete de incrustación dentro de un recipiente histológico de la muestra.
NOTA: El tejido debe orientarse en paralelo con respecto al cassette antes de la fijación (Figura 1D). - Fijar el tejido en 10% solución de formalina amortiguada neutra durante la noche a 4 °C13.
- Después de la fijación durante la noche, lave el tejido 3 veces con PBS.
- Agregue un 70% de etanol al tejido antes del proceso de incrustación de parafina. Retire la aguja del rollo suizo antes de continuar. El tejido se puede almacenar en etanol a temperatura ambiente hasta la incrustación de parafina13.
- Coloque las muestras en el procesador de tejido, incrustadas en parafina, y prepare secciones de 4 μm, montadas en diapositivas de microscopía cargadas positivamente(Figura 1E). Esto puede ser un punto de parada opcional.
NOTA: La orientación adecuada del tejido es fundamental para lograr secciones adecuadas para el análisis de imágenes. La incrustación paralela del rollo suizo en el casete de parafina dará como resultado secciones completas apropiadas para el análisis de imágenes (Figura 1F-1H). Se deben evitar secciones oblicuas para evitar secciones incompletas (Figura 1I-1K). Para obtener más información, consulte la sección Discusión. - Mancha secciones con hematoxilina y eosina (H&E)13.
3. Escaneo y análisis digital
NOTA: Para una evaluación precisa de los cambios de la mucosa, seleccione solo las secciones que incluyan al menos el 90% de la longitud total del colon.
- Escanee secciones manchadas utilizando un escáner de diapositivas o un imager (consulte Tabla de materiales). Las imágenes producidas necesitan una resolución de 0,25 micras por píxel con un objetivo de 40x y una ampliación de 40x.
- Instale y descargue un software adecuado para el análisis digital de diapositivas escaneadas (consulte Tabla de materiales).
- Abra imágenes escaneadas en el software de procesamiento de imágenes (Figura 2A). Compruebe que todo el punto es visible y que no faltan áreas de la muestra.
- Active las herramientas de imager de etiquetas y barra de escala para identificar correctamente las diapositivas escaneadas haciendo clic en Label imager (Figura 2A).
- Abra la herramienta de anotaciones haciendo clic en Anotaciones(Figura 2A) y cree 3 capas diferentes haciendo clic en Nueva capa (Figura 2B) para cuantificar la longitud total del rollo suizo, inflamación / lesión, y erosión / ulceración. Elija un color diferente para cada capa haciendo clic en Color de capa ( Figura2B).
- Mida la longitud de cada capa/categoría haciendo clic en la herramienta Pluma(Figura 2A),utilizando la mucosa muscularis como referencia:
- Ver la imagen a 400 μm zoom (o más) para facilitar la visualización adecuada de la mucosa muscularis.
NOTA: La ampliación se controla fácilmente utilizando la rueda de desplazamiento del ratón y tendrá que ajustarse según sea necesario mientras se mueve a través de la sección para dibujar todas las líneas. - Haga clic en la herramienta Pluma para dibujar una línea siguiendo la mucosa muscularis(Figura 2A). Mueva el puntero según sea necesario para visualizar el área adyacente para su análisis.
NOTA: Cada vez que se detenga el lápiz, se generará una nueva región de capa pequeña. Se puede visualizar y editar con la pestaña Regiones de capa (seleccione el segmento deseado y haga clic en Eliminar capa en caso de errores o correcciones, Figura 2B).
- Ver la imagen a 400 μm zoom (o más) para facilitar la visualización adecuada de la mucosa muscularis.
- Una vez definidas todas las capas(Figura 2C),exporte los datos mediante el botón Exportar cuadrícula a archivo de texto dentro de las opciones de regiones de capa ( Figura2B).
NOTA: Guarde archivos a menudo mientras crea las capas para asegurarse de que los datos se almacenan correctamente. - Abra los archivos de texto y copie los datos con un software de hoja de cálculo. Totalizar todos los segmentos de cada región y calcular el porcentaje de lesiones y ulceración con respecto a la longitud total.
- Para calcular la Puntuación de Colitis Histológica (HCS) y evaluar la gravedad de la enfermedad, considere tres características principales como se detalla a continuación.
- Compruebe si hay mucosa intestinal saludable que se caracteriza por células epiteliales organizadas en el eje cripta-luminal, propria lamina con pocas células inmunes, y mucosa musculares subyacentes que interconecta la mucosa y la submucosa(Figura 3A).
- Compruebe si hay inflamación/lesión que se caracteriza por criptas epiteliales atenuadas o parcialmente faltantes de células epiteliales e inflamación mucosa con infiltración de neutrófilos en criptas (Figura 3B).
- Compruebe la presencia de erosión/ulceración que se caracteriza por áreas desprovistas de epitelio superficial o zonas completamente carentes de criptas epiteliales con o sin leucocitos asociados(Figura 3C).
- Calcule el HCS de las regiones lesionadas y ulceradas expresadas como porcentaje de la longitud total en la siguiente fórmula:
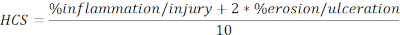
NOTA: El HCS combina el porcentaje de inflamación/lesión y erosión/ulceración añadiendo un factor de dos a este último, basado en una suposición razonable de que la pérdida completa del epitelio resulta en la pérdida máxima de la integridad de la barrera y, por lo tanto, en una enfermedad peor. El HCS representa constantemente los cambios morfológicos causados por la colitis experimental inducida por DSS. Curiosamente, no hemos visto una correlación clara entre el número de agregados linfoides colonicos o folículos y la gravedad de la enfermedad clínica en la colitis del SDS y, por lo tanto, no incluimos la cuantificación en este análisis. - Tome una instantánea de las imágenes representativas (haga clic en Instantánea, Figura 2A)y guárdela. Incluya barras de escala si es necesario haciendo clic en Mostrar u ocultar barra de escala ( Figura2A).
Resultados
Para ilustrar la fiabilidad de este análisis histológico de puntuación de colitis en el contexto de daño mucosa después del desafío DSS y posterior recuperación de la colitis, administramos 2.5% DSS en el agua potable de ocho ratones macho de 10 semanas C57BL6 tipo salvaje durante 5 días seguido de un período de recuperación con agua regular durante 5 días. No hubo ningún cambio en el peso corporal durante la administración aguda del DSS, desde el día 0 hasta el 5
Discusión
Nuestro sistema de puntuación de colitis histológica constituye una herramienta confiable para cuantificar la inflamación del tejido y el daño en el intestino. Este enfoque proporciona una mejor comprensión del estado histopatológico de todo el órgano sin el sesgo de seleccionar áreas pequeñas o secciones incompletas. Entre los pasos críticos para ejecutar con éxito este protocolo se encuentran la preparación adecuada de rollos suizos que permiten el análisis de al menos el 90% de la longitud del colon; orie...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores desean reconocer el apoyo de la financiación de los NIH DK055679, DK089763, DK079392, DK061739, DK072564 y los Servicios de Escaneo de Diapositivas patológicas de la Universidad de Michigan.
Materiales
| Name | Company | Catalog Number | Comments |
| Aperio AT2 – High Volume, Digital Whole Slide Scanning | Leica Biosystems | Aperio AT2 | |
| Absorbent Underpads with waterproof moisture barrier | VWR International | 56616-032 | |
| American Line 66-0089 Single Edge Blade, 100 per pkg | GT Midwest | TL5837 | |
| BD Luer-Lok Disposable Syringes without Needles | Fisher scientific | 14-823-2A | |
| Bonn Strabismus Scissors - ToughCut | Fine Science tools | 11103-09 | |
| Bonn Strabismus Scissors - ToughCut | Fine Science tools | 14084-09 | |
| Dumont #5 Forceps | Fine Science tools | 11251-20 | |
| Formalin solution, neutral buffered, 10% | Sigma | HT501640-19L | |
| HistoPrep 70% Ea | Fisherbran | 70% denatured ethyl alcohol | |
| ImageScope | Aperio | Version 12.3.3.5039 | http://www.leicabiosystems.com/pathology-imaging/aperio-epathology/integrate/imagescope/ |
| LeakBuster Specimen Containers: Sterile | Starplex Scientific | B120210 | |
| Phosphate-Buffere Saline, without calcium & magnesium | Corning | 21-040-CV | |
| Plastic Feeding tubes, 20 GA x 30 mm | Instech | FTP2030 | |
| PrecisionGlide Needle, Size: 20 G x 1 1/2 in | BD (Becton, Dickinson and Company) | 305176 | |
| PrecisionGlide Needle, Size: 27 G x 1/2 in | BD (Becton, Dickinson and Company) | 305109 | |
| Syringe, 10 ml | BD (Becton, Dickinson and Company) | 302995 | |
| Unisette Tissue Cassettes | Simport | M505-2 |
Referencias
- Kagnoff, M. F. The intestinal epithelium is an integral component of a communications network. Journal of Clinical Investigation. 124 (7), 2841-2843 (2014).
- Laukoetter, M. G., Nava, P., Nusrat, A. Role of the intestinal barrier in inflammatory bowel disease. World Journal of Gastroenterology. 14 (3), 401-407 (2008).
- Baumgart, D. C., Sandborn, W. J. Crohn's disease. Lancet. 380 (9853), 1590-1605 (2012).
- Ordas, I., Eckmann, L., Talamini, M., Baumgart, D. C., Sandborn, W. J. Ulcerative colitis. Lancet. 380 (9853), 1606-1619 (2012).
- Vowinkel, T., Kalogeris, T. J., Mori, M., Krieglstein, C. F., Granger, D. N. Impact of dextran sulfate sodium load on the severity of inflammation in experimental colitis. Digestive Diseases and Sciences. 49 (4), 556-564 (2004).
- Kitajima, S., Takuma, S., Morimoto, M. Histological analysis of murine colitis induced by dextran sulfate sodium of different molecular weights. Experimental Animals. 49 (1), 9-15 (2000).
- Mahler, M., et al. Differential susceptibility of inbred mouse strains to dextran sulfate sodium-induced colitis. American Journal of Physiology. 274 (3), 544-551 (1998).
- Wirtz, S., Neufert, C., Weigmann, B., Neurath, M. F. Chemically induced mouse models of intestinal inflammation. Nature Protocols. 2 (3), 541-546 (2007).
- Kozlowski, C., et al. An entirely automated method to score DSS-induced colitis in mice by digital image analysis of pathology slides. Disease Models & Mechanisms. 6 (3), 855-865 (2013).
- Perse, M., Cerar, A. Dextran sodium sulphate colitis mouse model: traps and tricks. Journal of Biomedicine and Biotechnology. 2012, 718617 (2012).
- Mizoguchi, A. Animal models of inflammatory bowel disease. Progress in Molecular Biology and Translational Science. 105, 263-320 (2012).
- Flemming, S., et al. Desmocollin-2 promotes intestinal mucosal repair by controlling integrin-dependent cell adhesion and migration. Molecular Biology of the Cell. 31 (6), 407-418 (2020).
- Luna, L. G. . Armed Forces Institute of Pathology (U.S) & Armed Forces Institute of Pathology (U.S.). Manual of Histologic Staining Methods of the Armed Forces Institute of Pathology. 3d edn. , (1968).
- Kelm, M., et al. Targeting epithelium-expressed sialyl Lewis glycans improves colonic mucosal wound healing and protects against colitis. The Journal of Clinical Investigation Insight. 5 (12), (2020).
- Reed, M., et al. Epithelial CD47 is critical for mucosal repair in the murine intestine in vivo. Nature Communications. 10 (1), 5004 (2019).
- Laukoetter, M. G., et al. JAM-A regulates permeability and inflammation in the intestine in vivo. Journal of Experimental Medicine. 204 (13), 3067-3076 (2007).
- Khounlotham, M., et al. Compromised intestinal epithelial barrier induces adaptive immune compensation that protects from colitis. Immunity. 37 (3), 563-573 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados