JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
뮤린 Dextran 나트륨 황산염 유도 대장염 모형에 있는 장 염증을 위한 체계적인 채점 분석
요약
무료 컴퓨터 보조 시스템을 사용하여 장 염증의 체계적인 점수는 궤양과 염증 변화의 존재를 특징으로 하는 대장염 모델의 조직 병리학적 변화를 정량적으로 비교할 수 있는 강력한 도구입니다. 조직학 대장염 점수 평가는 임상 관찰을 강화하고 데이터 해석을 용이하게합니다.
초록
뮤린 대장염 모델은 염증성 장 질환의 병리학을 이해하는 데 초점을 맞춘 연구에서 광범위하게 사용되는 도구입니다. 그러나 질병 심각도의 객관적이고 재현 가능한 정량화를 위한 강력한 표준은 정의되어야 합니다. 대부분의 대장염 분석 방법은 소장의 작은 세그먼트의 제한된 조직학 점수에 의존하여 부분적 또는 편향된 분석으로 이어집니다. 여기서, 우리는 전체 결장의 고해상도 영상 수집 및 세로 분석을 결합하여 뮤린 대장염의 유도된 탈파나트륨(DSS)에서 장 내 부상 및 궤양을 정량화한다. 이 프로토콜은 광범위한 사용자 교육 없이 객관적이고 재현 가능한 결과를 생성할 수 있도록 합니다. 여기서는 DSS 유도 대장염의 데이터 예를 사용하여 샘플 준비 및 이미지 분석에 대한 포괄적인 세부 정보를 제공합니다. 이 방법은 점막 손상과 관련된 중요한 염증이있는 뮤린 대장염의 다른 모델에 쉽게 적응 할 수 있습니다. 우리는 결장의 전체 길이에 비해 염증 / 부상 및 침식 / 궤양 점막의 분획이 DSS 유발 질병 진행 중 체중 감소와 같은 임상 연구 결과를 유사하게 한다는 것을 보여줍니다. 이 조직학적 프로토콜은 DSS 대장염 실험에서 편견없는 방식으로 질병 활동의 분석을 표준화하는 신뢰할 수있는 시간과 비용 효율적인 원조를 제공합니다.
서문
위장관 상피 장벽은 기본 조직 구획1에서발광 항원 및 병원균을 분리하는 데 중추적 인 역할을한다. 염증성 장 질환 (IBD), 허혈 또는 외과 적 부상과 같은 병리학 적 조건에서 볼 수있는 상피 손상 및 점막 상처는 설사, 체중 감소, 대변의 혈액 및 복통을 포함하는 임상 증상과 관련이 있습니다. 상해에 응하여, 상피 세포는 점막 결점을 다시 상형화하고 복구하기 위하여 이주하고 증식합니다. 점막 무결성의 염증 및 배상금의 해결은 장 점막 항상성 및 기능2,3,4를재확립하는 데 매우 중요합니다.
다양한 동물 모델은 장 상피 장벽의 손상과 관련된 기본 분자 메커니즘을 연구하기 위해 사용되었습니다. 화학적으로 유도된 대장염의 잘 확립되고 쉽게 적용 가능한 모델은 특히 IBD와 같은 염증성 손상과 관련된 연구에서 널리 사용됩니다. 일반적인 재현 가능하고 신뢰할 수 있는 뮤린 대장염 모델은 요염 나트륨(DSS)을 매개한 대장 상해와 염증을 사용합니다. 질병의 중증도는 마우스 변형, DSS 투여 량, DSS 투여 길이 및 DSS5,6,7의분자량에 따라 다릅니다.
DSS 대장염 중 장 점막 손상은 일반적으로 체중 감소, 대변 혈중 및 대변 일관성에 의해 결정되는 복합 점수인 질병 활동 지수(DAI)를 사용하여 평가됩니다. 대변 혈액 함량은 현미경 (대변 과이악 산 검사를 사용하여 검출) 또는 거시화 될 수 있습니다; 대변 일관성은 하드, 소프트 또는 액체 (즉, 설사) 5,8로분류된다. 이러한 임상 매개 변수의 점수는 주관적이고 사용자의 경험과 편견에 따라 달라질 수 있지만 전반적으로 데이터는 신뢰할 수있는 정보를 제공하고 IBD 연구원이 널리 사용됩니다. 대조적으로, 점막 손상의 조직학적 평가를 위한 일반적으로 허용되는 방법은 없습니다. 가장 일반적으로, 결장의 선택된 지역은 훈련된 병리학자에 의해 검사되고 일반적으로 토굴 손상 및 백혈구 침투9,10,11을포함하는 몇몇 매개변수를 기준으로 득점됩니다. 그러나, 조사된 파라미터의 수와 분석된 조직의 양은 개별 보고 사이에서 상당히 다르기 때문에, 많은 간행된 연구 결과의 비교는 제한됩니다. 관찰자 편향을 줄이고 연구 간 일치를 향상시키기 위해 이상적인 조직적 채점 프로토콜은 1) 대장의 전체 길이를 포함해야 한다: 장 점막 염증이 가장 자주 가변적이고 병변이 일반적이기 때문에, 2) 특정 키에 대한 분석을 제한하고 쉽게 해석 할 수있는 매개 변수로 주관성을 감소시키고, 3) 많은 수의 샘플 및 4) 널리 사용할 수있는 데이터 및 4) 사용 가능한 데이터 제공에 사용할 수 있습니다.
여기서우리는 DSS 유도 대장염으로 인해 장 점막 염증및 손상을 분석하기 위해 무료 컴퓨터 보조 점수 시스템의 사용과 함께 "스위스 롤"구성으로 소장의 전체 결장 또는 긴 세그먼트를 처리하는 기술을 설명합니다.
프로토콜
설명된 모든 동물 실험은 동물의 사용 및 배려에 미시간 대학의 위원회에 의해 승인되었습니다.
1. 조직 수확
- 승인된 프로토콜에 따라 자궁 경부 탈구다음에 이소플루란 마취를 사용하여 인간적으로 마우스를 안락사시. 모든 동물 실험에 대해 동물 취급에 대한 국가 및 기관의 지침에 따라 인증 된 검토 위원회에 의해 승인을 받았습니다.
- 마우스를 해부 패드에 양분 패드에 놓습니다. 20 G x 1/2 인치 G 바늘을 사용하여 마우스 사지를 고정합니다.
- 집게와 가위를 사용하여 복부 피부에 작은 절개를하고 옆으로 당겨 복막을 노출시합니다.
- 복막뼈에서 복부 의 측면에 이르기까지 복막에 중간개절로 복강을 엽니다.
- 내장이 시각화될 때까지 조직과 장기를 신중하게 제거합니다. 결장의 양쪽에 있는 골반 뼈를 잘라 내어 항문에서 cecum쪽으로 확장된 장기를 완전히 시각화합니다.
- 결장에 부착된 지방, 작은 정맥 및 동맥을 부드럽게 제거하고, 조심스럽게 장기를 해부하면서 항문과 근위를 자르고 cecum에 단면으로 절단하십시오.
참고: 해부된 결장은 스위스 롤 절차를 완료하는 동안 실온에 머물러야 합니다. - 항문을 통해 삽입된 유연한 플라스틱 개비지 바늘을 사용하여 대변 내용물을 제거하여 1배 PBS로 결장들을 조심스럽게 플러시합니다.
- 결장은 직선으로 배치하고, 간질 동맥을 따라 세로로 엽니다. 결장과 근위쪽 끝에 경구로 결장(도1A)을양분한다. 조직의 절반은 조직 학적 분석을 위해 사용될 수 있으며 다른 하나는 서부 블롯, PCR 또는 신선한 냉동 면역 형광 현미경 검사법(12)에대한 두 번째 스위스 롤로 압연 될 수 있습니다.
2. 스위스 롤 준비
- 전체 결장의 길이를 따라 거의 동일한 폭이 얻어질 때까지 면도날을 사용하여 근위 결장에서 여분의 조직을 다듬는다.
- 결장정렬하여 루멘을 향상에 노출시키고 유연한 개비지 바늘을 사용하여 조직을 완전히 평평하게 합니다. 더 많은 PBS를 추가, 필요한 경우, 절차 전반에 걸쳐 조직을 촉촉하게 유지 하기 위해.
- 종이 닦아 PBS의 초과를 제거합니다. 주사기 와 gavage 바늘로, 조직을 고치고 평평하게하기 위해 2-3 분 동안 조직에 10 % 중성 완충 포어틴 용액을 추가합니다.
- 직선 집게를 사용하여 결단결의 끝을 잡고 결장결을 원심 끝에서 근위 쪽 끝에 동심원으로 비틀어넣습니다(도1B).
참고: 에이핑거를 사용하여 압연하면서 스위스 롤 내부를 밀어낼 수 있어 조직이 롤 내부에 있는지 확인할 수 있습니다. - 27 G 바늘을 삽입하여 중간에 결장고정하여 스위스 롤모양(그림 1C)을고정합니다.
- 스위스 롤에 바늘을 넣은 카세트에 내장된 카세트에 넣습니다.
참고: 조직은 고정하기 전에 카세트에 대하여 병렬로 지향되어야합니다(도 1D). - 4°C13에서하룻밤 사이에 10% 중성 완충 포어틴 용액으로 조직을 고정한다.
- 하룻밤 고정 후, PBS로 조직을 3 배 세척합니다.
- 파라핀 포함 공정 전에 조직에 70% 에탄올을 추가합니다. 진행하기 전에 스위스 롤에서 바늘을 제거합니다. 조직은 파라핀임베디먼트(13)까지실온에서 에탄올에 보관할 수 있다.
- 샘플을 티슈 프로세서에 넣고 파라핀에 내장되어 있으며, 양전하 현미경슬라이드(그림 1E)에장착된 4μm 섹션을 준비합니다. 이는 선택적 정지 지점일 수 있습니다.
참고: 적절한 조직 배향은 이미지 분석에 적합한 섹션을 달성하는 데 중요합니다. 파라핀 카세트에 평행 스위스 롤 을 포함하면 이미지 분석에 적합한 전체 섹션이 생성됩니다(그림 1F-1H). 경사 섹션은 불완전한 섹션을 방지하기 위해 피해야합니다(그림 1I-1K). 자세한 내용은 토론 섹션을 참조하십시오. - 헤마톡시린과 에신(H&E)13을가진 스테인 섹션 .
3. 디지털 스캐닝 및 분석
참고: 점막 변경에 대한 정확한 평가를 위해 전체 결장 길이의 90% 이상을 포함하는 섹션만 선택합니다.
- 슬라이드 스캐너 또는 이미저를 사용하여 스테인드 섹션을 스캔합니다(재료 표참조). 생성된 이미지는 40배 목표와 40배 배율로 픽셀당 0.25 미크론의 해상도가 필요합니다.
- 스캔한 슬라이드의 디지털 분석을 위한 적절한 소프트웨어를 설치하고 다운로드합니다(자료 표참조).
- 이미지 프로세싱소프트웨어(그림 2A)에서스캔된 이미지를 엽니다. 전체 결장이 표시되고 샘플의 누락된 영역이 없는지 확인합니다.
- 레이블 이미저를 활성화하고 막대 도구를 조정하여 레이블 이미저(그림 2A)를클릭하여 스캔된 슬라이드를 올바르게 식별합니다.
- 주석 도구를 열고 주석 도구를열고(그림 2A)을클릭하여 3개의 상이다른 층(도 2B)을클릭하여 스위스 롤, 염증/부상 및 침식/궤양을 정량화한다. 레이어 색상(그림 2B)을클릭하여 각 레이어에 대해 다른 색상을 선택합니다.
- 각 층/범주의 길이를 펜도구(그림 2A)를클릭하여 근막 점막을 참고로 사용하여 측정합니다.
- 근육점막의 적절한 시각화를 용이하게 하기 위해 400 μm 줌(또는 그 이상)에서 이미지를 본다.
참고: 배율은 마우스 스크롤 휠을 사용하여 쉽게 제어되며 모든 선을 그리려면 섹션을 가로질러 이동하는 동안 필요에 따라 조정해야 합니다. - 펜 도구를 클릭하여 근육점막(그림2A)에따라 선을 그립니다. 필요에 따라 포인터를 이동하여 분석을 위해 인접한 영역을 시각화합니다.
참고: 펜이 중지될 때마다 작은 새 레이어 영역이 생성됩니다. 레이어 영역 탭으로 시각화하고 편집할 수 있습니다(원하는 세그먼트를 선택하고 실수 또는 수정시 레이어 삭제를 클릭합니다.
- 근육점막의 적절한 시각화를 용이하게 하기 위해 400 μm 줌(또는 그 이상)에서 이미지를 본다.
- 모든레이어(그림 2C)가정의되면, 레이어 영역 옵션(그림2B)내의 텍스트 파일 버튼으로 내보내기 그리드를 사용하여 데이터를 내보냅니다.
참고: 데이터가 제대로 저장되도록 레이어를 만드는 동안 파일을 자주 저장합니다. - 텍스트 파일을 열고 스프레드시트 소프트웨어로 데이터를 복사합니다. 각 지역의 모든 세그먼트를 합산하고 총 길이에 대한 부상 및 궤양의 백분율을 계산합니다.
- 조직학 대장염 점수(HCS)를 계산하고 질병의 심각성을 평가하기 위해 아래와 같이 세 가지 주요 특성을 고려하십시오.
- 폐구 발광축에서 조직된 상피 세포, 면역 세포가 적은 라미나 프로프리아, 점막과 아부코사(그림3A)를계면한 서브자센트 근육점막이 특징인 건강한 장점막을 확인한다.
- 소굴로 침투하여 감쇠또는 부분적으로 누락된 상피 세포 및 점막 염증을 특징으로 하는 염증/상해를 확인하십시오(그림3B).
- 표면 상피가 없는 영역또는 연관된 백혈구(도3C)의유무에 관계없이 상피 토굴이 완전히 결여된 영역을 특징으로 하는 침식/궤양의 존재를 확인한다.
- 다음 수식에서 총 길이의 백분율로 표현된 부상 및 궤양 영역의 HCS 계산:
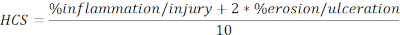
참고: HCS는 염증/부상 및 침식/궤양의 백분율을 결합하여 상피의 완전한 손실이 장벽 무결성의 최대 손실을 초래하고 따라서 더 나쁜 질병을 초래한다는 합리적인 가정에 근거하여 후자에 2의 요인을 추가합니다. HCS는 일관되게 DSS 유도된 실험 대장염에 기인한 형태학적 변화를 나타냅니다. 흥미롭게도, 우리는 DSS 대장염에 있는 결장 림프골 집계 또는 여포 및 임상 질병 엄격의 수 사이 명확한 상관관계를 보이지 않았고, 그러므로, 우리는 이 분석에 정량화를 포함하지 않았습니다. - 대표 이미지의 스냅샷을 찍고(스냅샷클릭, 그림 2A)을클릭하고 저장합니다. 표시/숨기기 스케일 표시 (그림 2A)를클릭하여 필요한 경우 스케일 막대를 포함합니다.
결과
DSS 도전 후 점막 손상의 맥락에서 이러한 조직학 대장염 점수 분석의 신뢰성을 설명하기 위해, 우리는 5 일 동안 일반 물로 회복 기간을 5 일 동안 8 10 주 된 남성 C57BL6 야생 형 마우스의 식수에 2.5 % DSS를 투여했습니다. DSS의 급성 투여 시 체중에 변화가 없었으며, 0일부터5일째(도 4A)까지. 쥐가 일반 수돗물을 마시기 시작했을 때 체중이 5일째 에 크게 ?...
토론
우리의 조직학 대장염 점수 시스템은 내장의 조직 염증과 손상을 정량화하는 신뢰할 수있는 도구를 구성합니다. 이 접근법은 작은 지역 또는 불완전한 단면도의 선택의 편견 없이 전체 기관의 조직 병리학 상태의 향상된 이해를 제공합니다. 이 프로토콜을 성공적으로 실행하는 중요한 단계 중에는 결장 길이의 90% 이상을 분석할 수 있는 스위스 롤을 적절히 준비하는 단계입니다. 파라핀 포함 및 ?...
공개
저자는 공개 할 것이 없습니다.
감사의 말
저자는 NIH 자금 DK055679, DK089763, DK079392, DK061739, DK072564 및 미시간 대학 병리학 슬라이드 스캐닝 서비스의 지원을 인정하고자합니다.
자료
| Name | Company | Catalog Number | Comments |
| Aperio AT2 – High Volume, Digital Whole Slide Scanning | Leica Biosystems | Aperio AT2 | |
| Absorbent Underpads with waterproof moisture barrier | VWR International | 56616-032 | |
| American Line 66-0089 Single Edge Blade, 100 per pkg | GT Midwest | TL5837 | |
| BD Luer-Lok Disposable Syringes without Needles | Fisher scientific | 14-823-2A | |
| Bonn Strabismus Scissors - ToughCut | Fine Science tools | 11103-09 | |
| Bonn Strabismus Scissors - ToughCut | Fine Science tools | 14084-09 | |
| Dumont #5 Forceps | Fine Science tools | 11251-20 | |
| Formalin solution, neutral buffered, 10% | Sigma | HT501640-19L | |
| HistoPrep 70% Ea | Fisherbran | 70% denatured ethyl alcohol | |
| ImageScope | Aperio | Version 12.3.3.5039 | http://www.leicabiosystems.com/pathology-imaging/aperio-epathology/integrate/imagescope/ |
| LeakBuster Specimen Containers: Sterile | Starplex Scientific | B120210 | |
| Phosphate-Buffere Saline, without calcium & magnesium | Corning | 21-040-CV | |
| Plastic Feeding tubes, 20 GA x 30 mm | Instech | FTP2030 | |
| PrecisionGlide Needle, Size: 20 G x 1 1/2 in | BD (Becton, Dickinson and Company) | 305176 | |
| PrecisionGlide Needle, Size: 27 G x 1/2 in | BD (Becton, Dickinson and Company) | 305109 | |
| Syringe, 10 ml | BD (Becton, Dickinson and Company) | 302995 | |
| Unisette Tissue Cassettes | Simport | M505-2 |
참고문헌
- Kagnoff, M. F. The intestinal epithelium is an integral component of a communications network. Journal of Clinical Investigation. 124 (7), 2841-2843 (2014).
- Laukoetter, M. G., Nava, P., Nusrat, A. Role of the intestinal barrier in inflammatory bowel disease. World Journal of Gastroenterology. 14 (3), 401-407 (2008).
- Baumgart, D. C., Sandborn, W. J. Crohn's disease. Lancet. 380 (9853), 1590-1605 (2012).
- Ordas, I., Eckmann, L., Talamini, M., Baumgart, D. C., Sandborn, W. J. Ulcerative colitis. Lancet. 380 (9853), 1606-1619 (2012).
- Vowinkel, T., Kalogeris, T. J., Mori, M., Krieglstein, C. F., Granger, D. N. Impact of dextran sulfate sodium load on the severity of inflammation in experimental colitis. Digestive Diseases and Sciences. 49 (4), 556-564 (2004).
- Kitajima, S., Takuma, S., Morimoto, M. Histological analysis of murine colitis induced by dextran sulfate sodium of different molecular weights. Experimental Animals. 49 (1), 9-15 (2000).
- Mahler, M., et al. Differential susceptibility of inbred mouse strains to dextran sulfate sodium-induced colitis. American Journal of Physiology. 274 (3), 544-551 (1998).
- Wirtz, S., Neufert, C., Weigmann, B., Neurath, M. F. Chemically induced mouse models of intestinal inflammation. Nature Protocols. 2 (3), 541-546 (2007).
- Kozlowski, C., et al. An entirely automated method to score DSS-induced colitis in mice by digital image analysis of pathology slides. Disease Models & Mechanisms. 6 (3), 855-865 (2013).
- Perse, M., Cerar, A. Dextran sodium sulphate colitis mouse model: traps and tricks. Journal of Biomedicine and Biotechnology. 2012, 718617 (2012).
- Mizoguchi, A. Animal models of inflammatory bowel disease. Progress in Molecular Biology and Translational Science. 105, 263-320 (2012).
- Flemming, S., et al. Desmocollin-2 promotes intestinal mucosal repair by controlling integrin-dependent cell adhesion and migration. Molecular Biology of the Cell. 31 (6), 407-418 (2020).
- Luna, L. G. . Armed Forces Institute of Pathology (U.S) & Armed Forces Institute of Pathology (U.S.). Manual of Histologic Staining Methods of the Armed Forces Institute of Pathology. 3d edn. , (1968).
- Kelm, M., et al. Targeting epithelium-expressed sialyl Lewis glycans improves colonic mucosal wound healing and protects against colitis. The Journal of Clinical Investigation Insight. 5 (12), (2020).
- Reed, M., et al. Epithelial CD47 is critical for mucosal repair in the murine intestine in vivo. Nature Communications. 10 (1), 5004 (2019).
- Laukoetter, M. G., et al. JAM-A regulates permeability and inflammation in the intestine in vivo. Journal of Experimental Medicine. 204 (13), 3067-3076 (2007).
- Khounlotham, M., et al. Compromised intestinal epithelial barrier induces adaptive immune compensation that protects from colitis. Immunity. 37 (3), 563-573 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유