Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Систематический анализ скоринга для воспаления кишечника в Murine Dextran Сульфат-индуцированных Колит модели
В этой статье
Резюме
Систематический скоринг воспаления кишечника с помощью бесплатной компьютерной системы является мощным инструментом для количественного сравнения гистопатологических изменений в моделях колита, характеризующихся наличием язв и воспалительных изменений. Оценка гистологического колита усиливает клинические наблюдения и облегчает интерпретацию данных.
Аннотация
Модели мурин-колита являются инструментами, которые широко используются в исследованиях, ориентированных на понимание патобиологии воспалительных кишечных расстройств. Однако еще не определены надежные стандарты объективной и воспроизводимой количественной оценки тяжести заболевания. Большинство методов анализа колита полагаются на ограниченный гистологический скоринг небольших сегментов кишечника, что приводит к частичному или предвзятому анализу. Здесь мы объединяем получение изображений с высоким разрешением и продольный анализ всей толстой кишки для количественной оценки кишечных повреждений и язв в декстране сульфата натрия (DSS) индуцированной модели мурин-колита. Этот протокол позволяет получать объективные и воспроизводимые результаты без тщательного обучения пользователей. Здесь мы предоставляем исчерпывающую информацию о подготовке образца и анализе изображений на примерах данных из индуцированного Колита DSS. Этот метод может быть легко адаптирован к другим моделям мурин-колита, которые имеют значительное воспаление, связанное с слизистой травмы. Мы демонстрируем, что доля воспаленных / раненых и эрозии / язвенной слизистой оболочки по отношению к полной длине толстой кишки тесно параллели клинических выводов, таких как потеря веса среди DSS-индуцированной прогрессии заболевания. Этот гистологический протокол обеспечивает надежное время и экономически эффективную помощь для стандартизации анализа активности болезни в беспристрастной манере в экспериментах DSS колита.
Введение
Эпителиальный барьер желудочно-кишечного тракта играет ключевую роль в отделении светящихся антигенов и патогенных микроорганизмов от основных отсековтканей 1. Эпителиальная травма и слизистые раны, замеченные в патологических состояниях, таких как воспалительные заболевания кишечника (IBD), ишемия, или хирургические травмы связаны с клиническими симптомами, которые включают диарею, потеря веса, кровь в стуле, и боли в животе. В ответ на травмы эпителиальные клетки мигрируют и размножаются для повторной эпителиализы и ремонта дефектов слизистой оболочки. Разрешение воспаления и восстановление слизистой целостности имеют решающее значение для восстановления кишечного слизистого гомеостазаи функции 2,3,4.
Различные модели животных были использованы для изучения основных молекулярных механизмов, которые связаны с повреждением кишечного эпителиального барьера. Широко используются хорошо известные и легко применимые модели химически индуцированного колита, особенно в исследованиях, связанных с воспалительными травмами, такими как IBD. Общие, воспроизводимые, и надежные модели мурин колит использует декстран сульфат натрия (DSS) опосредовано травмы толстой кишки и воспаление. Тяжесть заболевания варьируется в зависимости от штамма мыши, дозы DSS, длины Введения DSS, и молекулярного веса DSS5,6,7.
Повреждение слизистой оболочки кишечника во время DSS колита, как правило, оценивается с помощью индекса активности болезни (DAI), композитный балл определяется потеря веса, содержание фекальной крови, и консистенции стула. Содержание фекальной крови может быть микроскопическим (обнаружено с помощью теста на гуюаку стула) или макроскопическим; фекальная консистенция классифицируется как твердый, мягкий или жидкий (т.е.диарея) 5,8. Оценка этих клинических параметров может быть субъективной и может варьироваться в зависимости от опыта пользователя и предвзятости, хотя в целом, данные предоставляют достоверную информацию и, таким образом, широко используются исследователями IBD. В отличие от этого, не существует общепринятого метода гистологической оценки слизистой оболочки. Чаще всего, выбранные участки толстой кишки проверяются обученным патологоанатомом и забил на основе нескольких параметров, которые обычно включают травмы склепа и проникновениялейкоцитов 9,10,11. Однако, поскольку количество исследованных параметров и количество анализируемой ткани значительно варьируется между отдельными отчетами, сопоставимость многих опубликованных исследований ограничена. Чтобы уменьшить предвзятость наблюдателя и повысить межобученную согласие, идеальный гистологический протокол скоринга должен: 1) включать всю длину толстой кишки, так как воспаление слизистой оболочки кишечника чаще всего является переменным и пропускать поражения являются общими, 2) ограничить анализ конкретных ключевых и легко интерпретируемых параметров для снижения субъективности, 3) облегчить быструю, последовательную обработку большого количества образцов, и 4) использовать широко доступные и доступные инструменты для получения данных.
Здесь мы описываем технику обработки всей толстой кишки или длинные сегменты тонкой кишки в "швейцарский рулон" конфигурации наряду с использованием бесплатной компьютерной системы скоринга для анализа кишечных слизистых воспалений и повреждений из-за DSS-индуцированного колита.
Access restricted. Please log in or start a trial to view this content.
протокол
Все описанные эксперименты на животных были одобрены Комитетом Мичиганского университета по использованию и уходу за животными.
1. Урожай тканей
- Эвтанизировать мышей гуманно с помощью изофлюрановой анестезии с последующим вывихом шейки матки, в соответствии с утвержденными протоколами. Для всех экспериментов на животных одобрение было получено сертифицированным советом по обзору в соответствии с Национальными и Институциональными руководящими принципами обращения с животными.
- Поместите мышь на вскрытую площадку в положении лежа. Обездвижить конечности мыши с помощью 20 G х 1 1/2-дюймовый G иглы.
- Используя миппы и ножницы, сделайте небольшой разрез на брюшной коже и потяните его в сторону, чтобы разоблачить брюшной полости.
- Откройте брюшную полость с разрезом средней линии в брюшной полости от лобковой кости до боков живота.
- Тщательно удалите ткани и органы до визуализации толстой кишки. Вырезать тазовой кости по обе стороны толстой кишки, чтобы полностью визуализировать орган, простирающийся от ануса к cecum.
- Аккуратно удалить жир, маленькие вены и артерии, прикрепленные к толстой кишке, при тщательном вскрытии органа, резки только проксимальные к анусу и просто дистальной cecum.
ПРИМЕЧАНИЕ: Вскрытая толстая кишка должна оставаться при комнатной температуре при завершении швейцарской процедуры рулона. - Тщательно промыть толстой кишки с 1x PBS, используя гибкую пластиковую иглу гавейдж вставляется через анус для удаления фекального содержимого.
- Распоистите толстую кишку по прямой и откройте продольно вдоль мезентерической артерии. Раздвоить толстой кишки продольно от дистального до проксимального конца(рисунок 1A). Одна половина ткани может быть использована для гистологического анализа, а другая может быть обработана для западной помарки, ПЦР или свернута во второй швейцарский рулон для свежей замороженной микроскопии иммунофлюоресценции12.
2. Подготовка швейцарских рулонов
- Обрезать дополнительные ткани из проксимальной толстой кишки с помощью лезвия бритвы, пока примерно такой же ширины по длине всей толстой кишки получается.
- Выровнять толстой кишки подвергать люмен лицом вверх, и сгладить ткани полностью с помощью гибкой иглы гаважа. Добавить больше PBS, если это необходимо, чтобы сохранить ткань влажной на протяжении всей процедуры.
- Удалите избыток PBS с помощью бумажной салфетки. С помощью шприца и иглы гаважа добавьте 10% нейтральный буферный раствор формалина над тканью в течение 2-3 минут, чтобы исправить и сгладить ткань.
- Используйте прямые типсы, чтобы захватить конец дистальной толстой кишки и скрутить толстой кишки в концентрические круги от дистального до проксимального конца (Рисунок 1B).
ПРИМЕЧАНИЕ: Можно отодвинуть внутреннюю часть швейцарского рулона во время прокатки с помощью указательного пальца, чтобы обеспечить ткань внутри рулона. - Вставьте 27 G иглы, чтобы приколоть толстой кишки в середине, чтобы держать его швейцарской формырулона ( Рисунок 1C).
- Поместите швейцарский рулон с иглой в встраиваемую кассету внутри гистологического контейнера образца.
ПРИМЕЧАНИЕ: Ткань должна быть ориентирована параллельно с кассетой перед фиксацией(рисунок 1D). - Зафиксить ткань в 10% нейтральном буферном растворе формалина на ночь при 4 градусахпо Цельсию 13.
- После ночной фиксации, мыть ткани 3x с PBS.
- Добавьте 70% этанола в ткань до процесса встраивания парафина. Удалите иглу из швейцарского рулона, прежде чем продолжить. Ткань может храниться в этаноле при комнатной температуре до встраивания парафина13.
- Поместите образцы в процессор тканей, встраивайтесь в парафин и подготовьте 4 мкм секций, установленных на положительно заряженных слайдах микроскопии(рисунок 1E). Это может быть дополнительной точкой остановки.
ПРИМЕЧАНИЕ: Правильная ориентация тканей имеет решающее значение для достижения разделов, пригодных для анализа изображений. Параллельный швейцарский рулон встраивания в парафин кассеты приведет к полным разделам, присвоенным для анализа изображений(рисунок 1F-1H). Косые разделы следует избегать, чтобы предотвратить неполные разделы(рисунок 1I-1K). Для получения более подробной информации см. - Пятна разделов с гематоксилином и эозином (ХЗЕ)13.
3. Цифровое сканирование и анализ
ПРИМЕЧАНИЕ: Для точной оценки слизистых изменений, выберите только разделы, которые включают по крайней мере 90% от общей длины толстой кишки.
- Сканирование окрашенных секций с помощью сканера слайдов или изображения (см. Таблицу материалов). Изображения производятся необходимо разрешение 0,25 микрон на пиксель с 40x цели и 40x увеличение.
- Установка и загрузка соответствующего программного обеспечения для цифрового анализа отсканированных слайдов (см. таблицу материалов).
- Открытые отсканированные изображения в программном обеспечении обработки изображений(рисунок 2A). Убедитесь, что вся толстая кишка видна и что отсутствуют области образца.
- Активируйте изображение метки и инструменты масштаба бара, чтобы правильно идентифицировать отсканированные слайды, нажав на изображение Label (рисунок 2A).
- Откройте инструмент аннотации, нажав Аннотации, (Рисунок 2A) и создать 3 различных слоев, нажав новый слой (Рисунок 2B) для количественной общей длины швейцарский рулон, воспаление / травмы, и эрозии / язвы. Выберите другой цвет для каждого слоя, нажав цвет слоя (рисунок 2B).
- Измерьте длину каждого слоя/категории, нажав на инструмент Pen(рисунок 2A),используя слизистую оболочку мускулистых в качестве эталона:
- Просмотр изображения на 400 мкм зум (или более), чтобы облегчить адекватную визуализацию слизистой оболочки мускулистых.
ПРИМЕЧАНИЕ: Увеличение легко контролируется с помощью колеса прокрутки мыши и должны быть скорректированы по мере необходимости при перемещении по разделу, чтобы нарисовать все линии. - Нажмите на инструмент Pen, чтобы нарисовать линию после мышечной слизистой оболочки(рисунок 2A). Перемести указатель по мере необходимости, чтобы визуализировать прилегающую область для анализа.
ПРИМЕЧАНИЕ: Каждый раз, когда перо остановлено, будет генерироваться небольшой новый слой. Его можно визуализировать и редактировать с помощью вкладки области слоя (выберите нужный сегмент и нажмите Удалите слой в случае ошибок или исправлений, рисунок 2B).
- Просмотр изображения на 400 мкм зум (или более), чтобы облегчить адекватную визуализацию слизистой оболочки мускулистых.
- После того, как всеслои (рисунок 2C) определены, экспортировать данные с помощью кнопки Export Grid to Text File внутри вариантов регионов слоя(рисунок 2B).
ПРИМЕЧАНИЕ: Сохранить файлы часто при создании слоев для обеспечения правильного хранения данных. - Откройте текстовые файлы и копируйте данные с помощью программного обеспечения электронной таблицы. Итого все сегменты из каждого региона и рассчитать процент травмы и язвы по отношению к общей длине.
- Для расчета гистологического колита Оценка (HCS) и оценить тяжесть заболевания, рассмотреть три основные характеристики, как подробно ниже.
- Проверьте здоровую слизистую оболочку кишечника, которая характеризуется организованными эпителиальными клетками в склепе-люминальной оси, ламина проприя с несколькими иммунными клетками и субджацентной мышечной слизистой оболочкой, которая взаимодействует слизистой оболочки и субмукосы(рисунок 3A).
- Проверьте на воспаление / травмы, которая характеризуется эпителиальных склепов, которые затуманены или частично отсутствует эпителиальных клеток и слизистой оболочки воспаление с нейтрофилом проникновения в склепы (Рисунок 3B).
- Проверьте наличие эрозии/ язвы, которая характеризуется областями, лишенными поверхностного эпителия или областями, полностью не имеющими эпителиальных склепов с или без связанных с ними лейкоцитов(рисунок 3C).
- Рассчитайте HCS травмированных и язвенных регионов, выраженных в процентах от общей длины в следующей формуле:
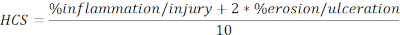
ПРИМЕЧАНИЕ: HCS сочетает в себе процент воспаления / травмы и эрозии / язвы добавив в два фактора к последнему, на основе разумного предположения, что полная потеря эпителия приводит к максимальной потере барьерной целостности и, следовательно, хуже болезни. HCS последовательно представляет морфологические изменения, вызванные DSS индуцированного экспериментального колита. Интересно, что мы не видели четкой корреляции между числами толстой лимфоидных агрегатов или фолликулов и клинической тяжести заболевания при DSS-колите, и поэтому мы не учитывали количественную оценку в этом анализе. - Сделайте снимок репрезентативных изображений (нажмите Снимок, Рисунок 2A), и сохраните. Включите полосы масштаба, если это необходимо, нажав на Show/Hide Scale Bar (рисунок 2A).
Access restricted. Please log in or start a trial to view this content.
Результаты
Чтобы проиллюстрировать надежность этого гистологического анализа оценки колита в контексте слизистой оболочки после вызова DSS и последующего восстановления от колита, мы ввели 2,5% DSS в питьевой воде восьми 10 недель самца C57BL6 диких мышей типа в течение 5 дней с последу?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Наша гистологическая система оценки колита представляет собой надежный инструмент для количественной оценки воспаления тканей и повреждений кишечника. Такой подход обеспечивает лучшее понимание гистопатологического состояния всего органа без смещения выбора небольших участков ил...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторов нечего раскрывать.
Благодарности
Авторы хотели бы отметить поддержку со стороны NIH финансирования DK055679, DK089763, DK079392, DK061739, DK072564 и Мичиганского университета патологии слайд сканирования услуг.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Aperio AT2 – High Volume, Digital Whole Slide Scanning | Leica Biosystems | Aperio AT2 | |
| Absorbent Underpads with waterproof moisture barrier | VWR International | 56616-032 | |
| American Line 66-0089 Single Edge Blade, 100 per pkg | GT Midwest | TL5837 | |
| BD Luer-Lok Disposable Syringes without Needles | Fisher scientific | 14-823-2A | |
| Bonn Strabismus Scissors - ToughCut | Fine Science tools | 11103-09 | |
| Bonn Strabismus Scissors - ToughCut | Fine Science tools | 14084-09 | |
| Dumont #5 Forceps | Fine Science tools | 11251-20 | |
| Formalin solution, neutral buffered, 10% | Sigma | HT501640-19L | |
| HistoPrep 70% Ea | Fisherbran | 70% denatured ethyl alcohol | |
| ImageScope | Aperio | Version 12.3.3.5039 | http://www.leicabiosystems.com/pathology-imaging/aperio-epathology/integrate/imagescope/ |
| LeakBuster Specimen Containers: Sterile | Starplex Scientific | B120210 | |
| Phosphate-Buffere Saline, without calcium & magnesium | Corning | 21-040-CV | |
| Plastic Feeding tubes, 20 GA x 30 mm | Instech | FTP2030 | |
| PrecisionGlide Needle, Size: 20 G x 1 1/2 in | BD (Becton, Dickinson and Company) | 305176 | |
| PrecisionGlide Needle, Size: 27 G x 1/2 in | BD (Becton, Dickinson and Company) | 305109 | |
| Syringe, 10 ml | BD (Becton, Dickinson and Company) | 302995 | |
| Unisette Tissue Cassettes | Simport | M505-2 |
Ссылки
- Kagnoff, M. F. The intestinal epithelium is an integral component of a communications network. Journal of Clinical Investigation. 124 (7), 2841-2843 (2014).
- Laukoetter, M. G., Nava, P., Nusrat, A. Role of the intestinal barrier in inflammatory bowel disease. World Journal of Gastroenterology. 14 (3), 401-407 (2008).
- Baumgart, D. C., Sandborn, W. J. Crohn's disease. Lancet. 380 (9853), 1590-1605 (2012).
- Ordas, I., Eckmann, L., Talamini, M., Baumgart, D. C., Sandborn, W. J. Ulcerative colitis. Lancet. 380 (9853), 1606-1619 (2012).
- Vowinkel, T., Kalogeris, T. J., Mori, M., Krieglstein, C. F., Granger, D. N. Impact of dextran sulfate sodium load on the severity of inflammation in experimental colitis. Digestive Diseases and Sciences. 49 (4), 556-564 (2004).
- Kitajima, S., Takuma, S., Morimoto, M. Histological analysis of murine colitis induced by dextran sulfate sodium of different molecular weights. Experimental Animals. 49 (1), 9-15 (2000).
- Mahler, M., et al. Differential susceptibility of inbred mouse strains to dextran sulfate sodium-induced colitis. American Journal of Physiology. 274 (3), 544-551 (1998).
- Wirtz, S., Neufert, C., Weigmann, B., Neurath, M. F. Chemically induced mouse models of intestinal inflammation. Nature Protocols. 2 (3), 541-546 (2007).
- Kozlowski, C., et al. An entirely automated method to score DSS-induced colitis in mice by digital image analysis of pathology slides. Disease Models & Mechanisms. 6 (3), 855-865 (2013).
- Perse, M., Cerar, A. Dextran sodium sulphate colitis mouse model: traps and tricks. Journal of Biomedicine and Biotechnology. 2012, 718617(2012).
- Mizoguchi, A. Animal models of inflammatory bowel disease. Progress in Molecular Biology and Translational Science. 105, 263-320 (2012).
- Flemming, S., et al. Desmocollin-2 promotes intestinal mucosal repair by controlling integrin-dependent cell adhesion and migration. Molecular Biology of the Cell. 31 (6), 407-418 (2020).
- Luna, L. G. Armed Forces Institute of Pathology (U.S) & Armed Forces Institute of Pathology (U.S.). Manual of Histologic Staining Methods of the Armed Forces Institute of Pathology. 3d edn. , Blakiston Division. (1968).
- Kelm, M., et al. Targeting epithelium-expressed sialyl Lewis glycans improves colonic mucosal wound healing and protects against colitis. The Journal of Clinical Investigation Insight. 5 (12), (2020).
- Reed, M., et al. Epithelial CD47 is critical for mucosal repair in the murine intestine in vivo. Nature Communications. 10 (1), 5004(2019).
- Laukoetter, M. G., et al. JAM-A regulates permeability and inflammation in the intestine in vivo. Journal of Experimental Medicine. 204 (13), 3067-3076 (2007).
- Khounlotham, M., et al. Compromised intestinal epithelial barrier induces adaptive immune compensation that protects from colitis. Immunity. 37 (3), 563-573 (2012).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены