È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Analisi sistematica del punteggio per l'infiammazione intestinale in un modello di colite indotta da solfato di sodio di Murine
In questo articolo
Riepilogo
Il punteggio sistematico dell'infiammazione intestinale utilizzando un sistema assistito da computer gratuito è un potente strumento per confrontare quantitativamente i cambiamenti istopatologici nei modelli di colite caratterizzati dalla presenza di ulcere e cambiamenti infiammatori. La valutazione del punteggio della colite istologica rafforza le osservazioni cliniche e facilita l'interpretazione dei dati.
Abstract
I modelli di colite murina sono strumenti ampiamente utilizzati in studi incentrati sulla comprensione della patobiologia dei disturbi intestinali infiammatori. Tuttavia, restano da definire standard solidi per una quantificazione obiettiva e riproducibile della gravità della malattia. La maggior parte dei metodi di analisi della colite si basano su un punteggio istologico limitato di piccoli segmenti dell'intestino, portando ad analisi parziali o parziali. Qui, combiniamo l'acquisizione di immagini ad alta risoluzione e l'analisi longitudinale dell'intero colon per quantificare la lesione intestinale e l'ulcerazione nel modello indotto dal solfato di sodio di dextran (DSS) della colite murina. Questo protocollo consente la generazione di risultati oggettivi e riproducibili senza un'ampia formazione degli utenti. Qui, forniamo dettagli completi sulla preparazione del campione e sull'analisi delle immagini utilizzando esempi di dati della colite indotta da DSS. Questo metodo può essere facilmente adattato ad altri modelli di colite murina che hanno un'infiammazione significativa associata a lesioni della mucosa. Dimostriamo che la frazione di mucosa infiammata/ ferita e erosa / ulcerata rispetto alla lunghezza completa del colon è strettamente parallela ai risultati clinici come la perdita di peso in mezzo alla progressione della malattia indotta dal DSS. Questo protocollo istologico fornisce un aiuto affidabile in termini di tempo ed economico per standardizzare le analisi dell'attività della malattia in modo imparziale negli esperimenti di colite DSS.
Introduzione
La barriera epiteliale gastrointestinale svolge un ruolo fondamentale nel separare gli antigeni luminali e gli agenti patogeni dai compartimenti tissutalisottostanti 1. Lesioni epiteliali e ferite mucose osservate in condizioni patologiche come malattia infiammatoria intestinale (IBD), ischemia o lesioni chirurgiche sono associate a sintomi clinici che includono diarrea, perdita di peso, sangue nelle feci e dolore addominale. In risposta alle lesioni, le cellule epiteliali migrano e proliferano per er epitelializzare e riparare i difetti della barriera della mucosa. La risoluzione dell'infiammazione e la restituzione dell'integrità della mucosa sono fondamentali per ristabiliscono l'omeostasi della mucosa intestinalee la funzione 2,3,4.
Vari modelli animali sono stati utilizzati per studiare i meccanismi molecolari sottostanti associati al danno alla barriera epiteliale intestinale. Modelli consolidati e facilmente applicabili di colite indotta chimicamente sono ampiamente utilizzati, in particolare negli studi relativi a lesioni infiammatorie come l'IBD. Un modello comune, riproducibile e affidabile di colite murina utilizza lesioni e infiammazioni del solfato di sodio di dextran (DSS). La gravità della malattia varia a seconda dello sforzo del topo, della dose di DSS, della lunghezza della somministrazione di DSS e del peso molecolare di DSS5,6,7.
Il danno mucoso intestinale durante la colite DSS viene solitamente valutato utilizzando l'indice di attività della malattia (DAI), un punteggio composito determinato dalla perdita di peso, dal contenuto di sangue fecale e dalla consistenza delle feci. Il contenuto di sangue fecale può essere microscopico (rilevato utilizzando un test dell'acido guaiaco delle feci) o macroscopico; la consistenza fecale è classificata come dura, morbida o liquida (cioè diarrea)5,8. Il punteggio di questi parametri clinici può essere soggettivo e può variare a seconda dell'esperienza e della distorsione dell'utente, anche se nel complesso, i dati forniscono informazioni affidabili ed è quindi ampiamente utilizzato dai ricercatori IBD. Al contrario, non esiste un metodo generalmente accettato per la valutazione istologica dei danni alla mucosa. Più comunemente, le aree selezionate del colon vengono ispezionate da un patologo addestrato e valutate sulla base di diversi parametri che di solito includono lesioni alla cripta e infiltrazione di leucociti9,10,11. Tuttavia, poiché il numero di parametri studiati e la quantità di tessuto analizzato variano considerevolmente tra i singoli rapporti, la comparabilità di molti studi pubblicati è limitata. Per ridurre la distorsione dell'osservatore e migliorare la concordanza inter-studio, un protocollo di punteggio istologico ideale dovrebbe: 1) includere l'intera lunghezza del colon, poiché l'infiammazione della mucosa intestinale è più spesso variabile e le lesioni skip sono comuni, 2) limitare l'analisi a parametri chiave specifici e facilmente interpretabili per ridurre la soggettività, 3) facilitare un'elaborazione rapida e coerente di un gran numero di campioni e 4) utilizzare strumenti ampiamente disponibili e convenienti per l'acquisizione, l'analisi e la presentazione dei dati.
Qui descriviamo una tecnica per elaborare l'intero colon o i segmenti lunghi dell'intestino tenue in una configurazione "swiss roll" insieme all'uso di un sistema di punteggio assistito da computer gratuito per analizzare l'infiammazione e i danni della mucosa intestinale a causa della colite indotta da DSS.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Tutti gli esperimenti sugli animali descritti sono stati approvati dal Comitato per l'uso e la cura degli animali dell'Università del Michigan.
1. Raccolta dei tessuti
- Eutanasia dei topi umanamente usando l'anestesia isoflurana seguita da lussazione cervicale, in conformità con i protocolli approvati. Per tutti gli esperimenti sugli animali, l'approvazione è stata ottenuta da un comitato di revisione certificato in conformità con le linee guida nazionali e istituzionali per la manipolazione degli animali.
- Posizionare il mouse su un cuscinetto di sezionamento in posizione supina. Immobilizzare le estremità del mouse utilizzando aghi G da 20 G x 1 1/2 pollice.
- Usando forcep e forbici, fare una piccola incisione sulla pelle addominale e tirarla di lato per esporre il peritoneo.
- Aprire la cavità addominale con un'incisione della linea mediana nel peritoneo dall'osso pubico ai lati dell'addome.
- Rimuovere con cura tessuti e organi fino a visualizzare l'intestino crasso. Tagliare l'osso pelvico su entrambi i lati del colon per visualizzare completamente l'organo, estendendosi dall'ano verso il cieco.
- Rimuovere delicatamente grasso, piccole vene e arterie attaccate al colon, sezionando attentamente l'organo, tagliando solo prossimale all'ano e appena distale al cieco.
NOTA: Il colon sezionato deve rimanere a temperatura ambiente durante il completamento della procedura di rollio svizzero. - Sciacquare con cura i due punti con 1x PBS, utilizzando un ago flessibile di gavage in plastica inserito attraverso l'ano per rimuovere il contenuto fecale.
- Posizionare i due punti in linea retta e aprirlo longitudinalmente lungo l'arteria mesenterica. Bisect il colon longitudinalmente dal distale all'estremità prossimale (Figura 1A). Una metà del tessuto può essere utilizzata per l'analisi istologica, mentre l'altra può essere lavorata per macchia occidentale, PCR o arrotolata in un secondo rotolo svizzero per microscopia ad immunofluorescenza congelatafresca 12.
2. Preparazione di rotoli svizzeri
- Tagliare il tessuto extra dal colon prossimale usando una lama di rasoio fino a ottenere approssimativamente la stessa larghezza lungo la lunghezza dell'intero colon.
- Allineare i due punti per esporre il lume rivolto verso l'alto e appiattire completamente il tessuto utilizzando un ago di gavage flessibile. Aggiungere più PBS, se necessario, per mantenere il tessuto umido durante tutta la procedura.
- Rimuovere l'eccesso di PBS utilizzando una salvietta di carta. Con una siringa e un ago di gavage, aggiungere una soluzione di formalina tamponata neutra al 10% sul tessuto per 2-3 minuti per fissare e appiattire il tessuto.
- Utilizzare le forcette dritte per afferrare l'estremità del colon distale e ruotare il colon in cerchi concentrici dall'estremità distatale a quella prossimale (Figura 1B).
NOTA: È possibile spingere indietro l'interno del rotolo svizzero mentre si rotola utilizzando l'indice per assicurarsi che il tessuto sia all'interno del rotolo. - Inserire un ago da 27 G per fissare i due punti al centro per mantenere la forma del rotolo svizzero (Figura 1C).
- Posizionare il rotolo svizzero con l'ago in una cassetta di incorporamento all'interno di un contenitore di campioni istologici.
NOTA: Il tessuto deve essere orientato in parallelo rispetto alla cassetta prima della fissazione (Figura 1D). - Fissare il tessuto in soluzione di formalina tamponata neutra al 10% durante la notte a 4 °C13.
- Dopo la fissazione notturna, lavare il tessuto 3 volte con PBS.
- Aggiungere il 70% di etanolo al tessuto prima del processo di incorporamento della paraffina. Rimuovere l'ago dal rotolo svizzero prima di procedere. I tessuti possono essere conservati in etanolo a temperatura ambiente fino all'incorporamento di paraffina13.
- Posizionare i campioni nel processore tissutale, incorporare in paraffina e preparare sezioni da 4 μm, montate su diapositive di microscopia cariche positivamente (Figura 1E). Questo può essere un punto di arresto opzionale.
NOTA: Un corretto orientamento tissutale è fondamentale per ottenere sezioni adatte per l'analisi delle immagini. L'incorporamento parallelo svizzero del rotolo nella cassetta di paraffina si tradurrà in sezioni complete appropriate per l'analisi delle immagini (Figura 1F-1H). Le sezioni oblique devono essere evitate per evitare sezioni incomplete(figura 1I-1K). Per ulteriori dettagli, vedere la sezione Discussione. - Sezioni di macchie con ematossilina ed eosina (H&E)13.
3. Scansione e analisi digitali
NOTA: per una valutazione accurata delle modifiche della mucosa, selezionare solo le sezioni che includono almeno il 90% della lunghezza totale dei due punti.
- Digitalizzare sezioni macchiate utilizzando uno scanner diapositiva o un dispositivo di immagini (vedere Tabella dei materiali). Le immagini prodotte necessitano di una risoluzione di 0,25 micron per pixel con obiettivo 40x e ingrandimento 40x.
- Installare e scaricare un software appropriato per l'analisi digitale delle diapositive digitalizzate (vedere Table of Materials).
- Aprire le immagini digitalizzate nel software di elaborazione delle immagini (Figura 2A). Verificare che l'intero colon sia visibile e che non vi siano aree mancanti del campione.
- Attivare l'imager dell'etichetta e gli strumenti della barra di ridimensiona per identificare correttamente le diapositive digitalizzate facendo clic su Imager etichette (Figura 2A).
- Aprire lo strumento annotazioni facendo clic su Annotazioni(Figura 2A) e creare 3 livelli diversi facendo clic su Nuovo livello (Figura 2B) per quantificare la lunghezza totale del rotolo svizzero, infiammazione/lesione ed erosione/ulcerazione. Scegliere un colore diverso per ogni livello facendo clic su Colore livello (Figura 2B).
- Misurare la lunghezza di ogni livello/categoria facendo clic sull'utensile Penna (Figura 2A), utilizzando la mucosa muscolare come riferimento:
- Visualizza l'immagine con uno zoom di 400 μm (o più) per facilitare un'adeguata visualizzazione della mucosa muscolare.
NOTA: l'ingrandimento è facilmente controllabile utilizzando la rotellina di scorrimento del mouse e dovrà essere regolato se necessario mentre ci si sposta attraverso la sezione per disegnare tutte le linee. - Clicca sullo strumento Penna per tracciare una linea seguendo la mucosa muscolare (Figura 2A). Spostare il puntatore in base alle esigenze per visualizzare l'area adiacente per l'analisi.
NOTA: ogni volta che la penna viene arrestata, verrà generata una nuova piccola area di livello. Può essere visualizzato e modificato con la scheda Aree livello (selezionare il segmento desiderato e fare clic su Elimina livello in caso di errori o correzioni, Figura 2B).
- Visualizza l'immagine con uno zoom di 400 μm (o più) per facilitare un'adeguata visualizzazione della mucosa muscolare.
- Una volta definiti tutti i livelli (Figura 2C), esportare i dati utilizzando il pulsante Esporta griglia in file di testo all'interno delle opzioni delle aree del livello ( Figura2B).
NOTA: salva spesso i file durante la creazione dei livelli per assicurarti che i dati siano archiviati correttamente. - Aprire i file di testo e copiare i dati con un software per fogli di calcolo. Totale tutti i segmenti di ciascuna regione e calcolare la percentuale di lesioni e ulcerazioni rispetto alla lunghezza totale.
- Per calcolare il punteggio di colite istologica (HCS) e valutare la gravità della malattia, considerare tre caratteristiche principali come descritto di seguito.
- Verificare la presenza di mucosa intestinale sana caratterizzata da cellule epiteliali organizzate nell'asse cripto-luminale, lamina propria con poche cellule immunitarie e mucosa muscolare subjacente che interfaccia la mucosa e la sottomucosa (Figura 3A).
- Verificare la presenza di infiammazione/lesione caratterizzata da cripte epiteliali attenuate o parzialmente mancanti e infiammazione della mucosa con infiltrazione di neutrofili nelle cripte(Figura 3B).
- Verificare la presenza di erosione/ulcerazione caratterizzata da aree prive di epitelio superficiale o da aree completamente prive di cripte epiteliali con o senza leucociti associati (Figura 3C).
- Calcolare l'HCS delle regioni lese e ulcerate espresso in percentuale della lunghezza totale nella seguente formula:
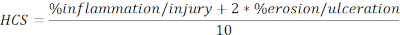
NOTA: HCS combina la percentuale di infiammazione/ lesione ed erosione / ulcerazione aggiungendo un fattore due a quest'ultimo, sulla base di un ragionevole presupposto che la completa perdita dell'epitelio si traduce nella massima perdita di integrità della barriera e quindi in una malattia peggiore. HCS rappresenta costantemente i cambiamenti morfologici causati dalla colite sperimentale indotta da DSS. È interessante notare che non abbiamo visto una chiara correlazione tra il numero di aggregati linfoidi colonici o follicoli e la gravità clinica della malattia nella colite DSS e, pertanto, non abbiamo includeto la quantificazione in questa analisi. - Scattare un'istantanea delle immagini rappresentative (fare clic su Snapshot, Figura 2A) e salvare. Se necessario, includere le barre di scala facendo clic su Mostra/Nascondi barra scala ( Figura2A).
Access restricted. Please log in or start a trial to view this content.
Risultati
Per illustrare l'affidabilità di questa analisi del punteggio della colite istologica nel contesto dei danni alla mucosa dopo la sfida DSS e il successivo recupero dalla colite, abbiamo somministrato il 2,5% di DSS nell'acqua potabile di otto topi maschi di tipo C57BL6 di 10 settimane per 5 giorni seguiti da un periodo di recupero con acqua regolare per 5 giorni. Non vi è stato alcun cambiamento nel peso corporeo durante la somministrazione acuta di DSS, dal giorno 0 al 5 (
Access restricted. Please log in or start a trial to view this content.
Discussione
Il nostro sistema di punteggio di colite istologica costituisce uno strumento affidabile per quantificare l'infiammazione e i danni dei tessuti nell'intestino. Questo approccio fornisce una migliore comprensione dello stato istopatologico dell'intero organo senza la tendenza a selezionare piccole aree o sezioni incomplete. Tra le fasi critiche per eseguire con successo questo protocollo ci sono la corretta preparazione dei rotoli svizzeri che consentono l'analisi di almeno il 90% della lunghezza dei due punti; orientamen...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori desiderano riconoscere il supporto del finanziamento NIH DK055679, DK089763, DK079392, DK061739, DK072564 e dell'Università del Michigan Pathology Slide Scanning Services.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Aperio AT2 – High Volume, Digital Whole Slide Scanning | Leica Biosystems | Aperio AT2 | |
| Absorbent Underpads with waterproof moisture barrier | VWR International | 56616-032 | |
| American Line 66-0089 Single Edge Blade, 100 per pkg | GT Midwest | TL5837 | |
| BD Luer-Lok Disposable Syringes without Needles | Fisher scientific | 14-823-2A | |
| Bonn Strabismus Scissors - ToughCut | Fine Science tools | 11103-09 | |
| Bonn Strabismus Scissors - ToughCut | Fine Science tools | 14084-09 | |
| Dumont #5 Forceps | Fine Science tools | 11251-20 | |
| Formalin solution, neutral buffered, 10% | Sigma | HT501640-19L | |
| HistoPrep 70% Ea | Fisherbran | 70% denatured ethyl alcohol | |
| ImageScope | Aperio | Version 12.3.3.5039 | http://www.leicabiosystems.com/pathology-imaging/aperio-epathology/integrate/imagescope/ |
| LeakBuster Specimen Containers: Sterile | Starplex Scientific | B120210 | |
| Phosphate-Buffere Saline, without calcium & magnesium | Corning | 21-040-CV | |
| Plastic Feeding tubes, 20 GA x 30 mm | Instech | FTP2030 | |
| PrecisionGlide Needle, Size: 20 G x 1 1/2 in | BD (Becton, Dickinson and Company) | 305176 | |
| PrecisionGlide Needle, Size: 27 G x 1/2 in | BD (Becton, Dickinson and Company) | 305109 | |
| Syringe, 10 ml | BD (Becton, Dickinson and Company) | 302995 | |
| Unisette Tissue Cassettes | Simport | M505-2 |
Riferimenti
- Kagnoff, M. F. The intestinal epithelium is an integral component of a communications network. Journal of Clinical Investigation. 124 (7), 2841-2843 (2014).
- Laukoetter, M. G., Nava, P., Nusrat, A. Role of the intestinal barrier in inflammatory bowel disease. World Journal of Gastroenterology. 14 (3), 401-407 (2008).
- Baumgart, D. C., Sandborn, W. J. Crohn's disease. Lancet. 380 (9853), 1590-1605 (2012).
- Ordas, I., Eckmann, L., Talamini, M., Baumgart, D. C., Sandborn, W. J. Ulcerative colitis. Lancet. 380 (9853), 1606-1619 (2012).
- Vowinkel, T., Kalogeris, T. J., Mori, M., Krieglstein, C. F., Granger, D. N. Impact of dextran sulfate sodium load on the severity of inflammation in experimental colitis. Digestive Diseases and Sciences. 49 (4), 556-564 (2004).
- Kitajima, S., Takuma, S., Morimoto, M. Histological analysis of murine colitis induced by dextran sulfate sodium of different molecular weights. Experimental Animals. 49 (1), 9-15 (2000).
- Mahler, M., et al. Differential susceptibility of inbred mouse strains to dextran sulfate sodium-induced colitis. American Journal of Physiology. 274 (3), 544-551 (1998).
- Wirtz, S., Neufert, C., Weigmann, B., Neurath, M. F. Chemically induced mouse models of intestinal inflammation. Nature Protocols. 2 (3), 541-546 (2007).
- Kozlowski, C., et al. An entirely automated method to score DSS-induced colitis in mice by digital image analysis of pathology slides. Disease Models & Mechanisms. 6 (3), 855-865 (2013).
- Perse, M., Cerar, A. Dextran sodium sulphate colitis mouse model: traps and tricks. Journal of Biomedicine and Biotechnology. 2012, 718617(2012).
- Mizoguchi, A. Animal models of inflammatory bowel disease. Progress in Molecular Biology and Translational Science. 105, 263-320 (2012).
- Flemming, S., et al. Desmocollin-2 promotes intestinal mucosal repair by controlling integrin-dependent cell adhesion and migration. Molecular Biology of the Cell. 31 (6), 407-418 (2020).
- Luna, L. G. Armed Forces Institute of Pathology (U.S) & Armed Forces Institute of Pathology (U.S.). Manual of Histologic Staining Methods of the Armed Forces Institute of Pathology. 3d edn. , Blakiston Division. (1968).
- Kelm, M., et al. Targeting epithelium-expressed sialyl Lewis glycans improves colonic mucosal wound healing and protects against colitis. The Journal of Clinical Investigation Insight. 5 (12), (2020).
- Reed, M., et al. Epithelial CD47 is critical for mucosal repair in the murine intestine in vivo. Nature Communications. 10 (1), 5004(2019).
- Laukoetter, M. G., et al. JAM-A regulates permeability and inflammation in the intestine in vivo. Journal of Experimental Medicine. 204 (13), 3067-3076 (2007).
- Khounlotham, M., et al. Compromised intestinal epithelial barrier induces adaptive immune compensation that protects from colitis. Immunity. 37 (3), 563-573 (2012).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon