Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Analyse systématique de notation pour l’inflammation intestinale dans un modèle de colite induite par le sulfate de sodium murine dextran
Dans cet article
Résumé
La notation systématique de l’inflammation intestinale utilisant un système informatique-aidé libre est un outil puissant pour comparer quantitativement des changements histopathologiques dans des modèles de colite caractérisés par la présence des ulcères et des changements inflammatoires. L’évaluation histologique de score de colite renforce des observations cliniques et facilite l’interprétation de données.
Résumé
Les modèles murins de colite sont des outils qui sont largement employés dans des études concentrées sur la compréhension de la pathobiologie des désordres intestinaux inflammatoires. Toutefois, des normes robustes pour la quantification objective et reproductible de la gravité de la maladie restent à définir. La plupart des méthodes d’analyse de la colite reposent sur une notation histologique limitée de petits segments de l’intestin, conduisant à des analyses partielles ou biaisées. Ici, nous combinons l’acquisition d’image à haute résolution et l’analyse longitudinale de l’ensemble du côlon pour quantifier les lésions intestinales et l’ulcération dans le modèle induit par le sulfate de sodium de dextran (DSS) de colite murine. Ce protocole permet la génération de résultats objectifs et reproductibles sans formation approfondie des utilisateurs. Ici, nous fournissons des détails complets sur la préparation de l’échantillon et l’analyse d’image à l’aide d’exemples de données de colite induite par le MAS. Cette méthode peut être facilement adaptée à d’autres modèles de colite murine qui ont une inflammation significative associée à des lésions muqueales. Nous démontrons que la fraction de la muqueuse enflammée/blessée et érodée/ulcérée par rapport à la longueur complète du côlon est étroitement parallèle aux résultats cliniques tels que la perte de poids au milieu de la progression induite par le DSS. Ce protocole histologique fournit un temps fiable et une aide rentable pour normaliser les analyses de l’activité de la maladie d’une manière impartiale dans les expériences de colite DSS.
Introduction
La barrière épithéliale gastro-intestinale joue un rôle central dans la séparation des antigènes luminaires et des agents pathogènes des compartiments tissulairessous-jacents 1. Les dommages épithéliales et les blessures muqueuses vus dans des conditions pathologiques telles que la maladie intestinale inflammatoire (IBD), l’ischémie, ou les dommages chirurgicaux sont associés aux symptômes cliniques qui incluent la diarrhée, la perte de poids, le sang dans les selles, et la douleur abdominale. En réponse aux dommages, les cellules épithéliales migrent et prolifèrent pour rééthéthélialiser et réparer les défauts muqueux de barrière. La résolution de l’inflammation et la restitution de l’intégrité muqueuse sont cruciales pour rétablir l’homéostasie muqueuse intestinaleet la fonction 2,3,4.
Divers modèles animaux ont été utilisés pour étudier les mécanismes moléculaires sous-jacents qui sont associés aux dommages à la barrière épithéliale intestinale. Des modèles bien établis et facilement applicables de colite induite chimiquement sont largement utilisés, particulièrement dans les études liées aux dommages inflammatoires tels que IBD. Un modèle commun, reproductible, et fiable de colite murine emploie le sulfate de sodium dextran (DSS) a 2gé des dommages coloniques et l’inflammation. La gravité de la maladie varie selon la souche de souris, la dose de DSS, la longueur de l’administration de DSS, et le poids moléculaire de DSS5,6,7.
Les dommages muqueux intestinaux pendant la colite de DSS sont habituellement évalués utilisant l’indice d’activité de la maladie (DAI), un score composite déterminé par la perte de poids, la teneur en sang fécale, et la consistance de selles. La teneur en sang fécal peut être microscopique (détectée à l’aide d’un test d’acide guaiac selles) ou macroscopique; la consistance fécale est classée comme dure, molle ou liquide (c.-à-d. diarrhée)5,8. La notation de ces paramètres cliniques peut être subjective et peut varier en fonction de l’expérience et du parti pris de l’utilisateur, bien que dans l’ensemble, les données fournissent des informations fiables et sont donc largement utilisées par les chercheurs en MII. En revanche, il n’y a aucune méthode généralement acceptée pour l’évaluation histologique des dommages muqueux. Le plus souvent, certaines zones du côlon sont inspectées par un pathologiste formé et notées en fonction de plusieurs paramètres qui incluent habituellement des dommages de crypte et l’infiltration de leucocyte9,10,11. Toutefois, comme le nombre de paramètres étudiés et la quantité de tissu analysé varient considérablement d’un rapport à l’autre, la comparabilité de nombreuses études publiées est limitée. Pour réduire le biais des observateurs et améliorer la concordance inter-études, un protocole de notation histologique idéal devrait : 1) inclure toute la longueur du côlon, car l’inflammation muqueuse intestinale est le plus souvent variable et les lésions de saut sont courantes, 2) limiter l’analyse à des paramètres clés et facilement interprétables spécifiques pour réduire la subjectivité, 3) faciliter le traitement rapide et cohérent d’un grand nombre d’échantillons, et 4) utiliser des outils largement disponibles et abordables pour l’acquisition, l’analyse et la présentation de données.
Ici, nous décrivons une technique pour traiter l’ensemble du côlon ou de longs segments de l’intestin grêle dans une configuration « rouleau suisse » avec l’utilisation d’un système de notation assisté par ordinateur gratuit pour analyser l’inflammation muqueuse intestinale et les dommages causés par la colite induite par le DSS.
Access restricted. Please log in or start a trial to view this content.
Protocole
Toutes les expériences sur les animaux décrites ont été approuvées par le Comité sur l’utilisation et l’œur des animaux de l’Université du Michigan.
1. Récolte de tissus
- Euthanasier les souris humainement à l’aide d’une anesthésie isoflurane suivie d’une dislocation cervicale, conformément aux protocoles approuvés. Pour toutes les expériences sur les animaux, l’approbation a été obtenue par un comité d’examen certifié conformément aux lignes directrices nationales et institutionnelles sur la manipulation des animaux.
- Placez la souris sur un tampon disséquant dans une position supine. Immobiliser les extrémités de la souris à l’aide d’aiguilles G de 20 G x 1 1/2 po.
- À l’aide de forceps et de ciseaux, faire une petite incision sur la peau abdominale et la tirer sur le côté pour exposer le péritoine.
- Ouvrez la cavité abdominale avec une incision médiane dans le péritoine de l’os pubien aux côtés de l’abdomen.
- Retirer soigneusement les tissus et les organes jusqu’à ce que le gros intestin soit visualisé. Couper l’os pelvien des deux côtés du côlon pour visualiser complètement l’organe, s’étendant de l’anus vers le cécu.
- Retirez doucement la graisse, les petites veines et les artères attachées au côlon, tout en disséquant soigneusement l’organe, en coupant juste proximal à l’anus et juste distal au cecum.
REMARQUE : Les deux points disséqués doivent rester à température ambiante pendant la procédure de roulis suisse. - Rincer soigneusement le côlon avec 1x PBS, à l’aide d’une aiguille de gavage en plastique souple insérée dans l’anus pour enlever le contenu fécal.
- Placez le côlon en ligne droite et ouvrez longitudilement le long de l’artère mésentérique. Couper le côlon en deux longitudilement du distal à l’extrémité proximale (Figure 1A). La moitié du tissu peut être utilisée pour l’analyse histologique tandis que l’autre peut être traitée pour la tache occidentale, PCR ou roulée dans un deuxième rouleau suisse pour la microscopie fraîchement congelée d’immunofluorescence12.
2. Préparation de rouleaux suisses
- Couper les tissus supplémentaires du côlon proximal à l’aide d’une lame de rasoir jusqu’à ce qu’environ la même largeur le long de la longueur du côlon entier soit obtenue.
- Alignez le côlon pour exposer le lumen face vers le haut, et aplatissez le tissu complètement à l’aide d’une aiguille de gavage flexible. Ajouter plus de PBS, si nécessaire, pour garder le tissu humide tout au long de la procédure.
- Retirer l’excès de PBS à l’aide d’un lingette en papier. À l’aide d’une seringue et d’une aiguille de gavage, ajouter une solution formaline tamponnée neutre de 10 % sur le tissu pendant 2 à 3 minutes pour fixer et aplatir le tissu.
- Utilisez des forceps droits pour saisir l’extrémité du côlon distal et tordre le côlon en cercles concentriques de l’extrémité distale à proximale (Figure 1B).
REMARQUE : Il est possible de repousser l’intérieur du rouleau suisse tout en roulant à l’aide de l’index pour s’assurer que le tissu est à l’intérieur du rouleau. - Insérez une aiguille de 27 G pour épingler le côlon au milieu pour maintenir sa forme de rouleau suisse( Figure 1C).
- Placez le rouleau suisse avec l’aiguille dans une cassette d’intégration à l’intérieur d’un récipient de spécimen histologique.
REMARQUE : Les tissus doivent être orientés parallèlement à la cassette avant la fixation (Figure 1D). - Fixer le tissu dans 10% neutre tamponné solution formaline pendant la nuit à 4 °C13.
- Après la fixation de nuit, laver le tissu 3x avec PBS.
- Ajouter 70 % d’éthanol au tissu avant le processus d’intégration de la paraffine. Retirer l’aiguille du rouleau suisse avant de procéder. Les tissus peuvent être stockés dans de l’éthanol à température ambiante jusqu’à ce que la paraffine intègre13.
- Placer les échantillons dans le robot tissulaire, les intégrer dans la paraffine et préparer des sections de 4 μm, montées sur des diapositives de microscopie chargées positivement (figure 1E). Il peut s’agir d’un point d’arrêt optionnel.
REMARQUE : Une bonne orientation tissulaire est essentielle pour obtenir des sections adaptées à l’analyse d’images. L’intégration parallèle du rouleau suisse dans la cassette de paraffine se traduira par des sections complètes appropriées pour l’analyse d’images(figure 1F-1H). Les sections obliques doivent être évitées pour éviter les sectionsincomplètes ( figure 1I-1K). Pour plus de détails, consultez la section Discussion. - Sections de taches avec hématoxyline et éosine (H&E)13.
3. Numérisation et analyse numériques
REMARQUE : Pour une évaluation précise des changements muqueux, sélectionnez uniquement les sections qui comprennent au moins 90 % de la longueur totale du côlon.
- Numériser les sections tachées à l’aide d’un scanner de diapositives ou d’un imageur (voir tableau des matériaux). Les images produites ont besoin d’une résolution de 0,25 microns par pixel avec objectif 40x et grossissement 40x.
- Installer et télécharger un logiciel approprié pour l’analyse numérique des diapositives numérisées (voir tableau des matériaux).
- Ouvrez les images numérisées dans le logiciel de traitementd’image ( Figure 2A). Vérifiez que tout le côlon est visible et qu’il n’y a pas de zones manquantes de l’échantillon.
- Activez l’imageur d’étiquettes et les outils de barre d’échelle pour identifier correctement les diapositives numérisées en cliquant sur l’imageur d’étiquette (Figure 2A).
- Ouvrez l’outil annotations en cliquant sur Annotations, (Figure 2A) et de créer 3 couches différentes en cliquant sur Nouvelle couche (Figure 2B) pour quantifier la longueur totale du rouleau suisse, inflammation / blessure, et l’érosion / ulcération. Choisissez une couleur différente pour chaque couche en cliquant sur la couleur de la couche ( Figure2B).
- Mesurez la longueur de chaque couche/catégorie en cliquant sur l’outil Pen (Figure 2A), en utilisant la muqueuse muscularis comme référence :
- Visualisez l’image à 400 μm zoom (ou plus) pour faciliter une visualisation adéquate de la muqueuse muscularis.
REMARQUE : Le grossissement est facilement contrôlé à l’aide de la roue de défilement de la souris et devra être ajusté au besoin lors du déplacement à travers la section pour dessiner toutes les lignes. - Cliquez sur l’outil Pen pour tracer une ligne suivant la muqueuse muscularis (Figure 2A). Déplacez le pointeur au besoin pour visualiser la zone adjacente pour analyse.
REMARQUE : Chaque fois que le stylet est arrêté, une petite nouvelle couche de région sera générée. Il peut être visualisé et modifié avec l’onglet Régions de couche (sélectionnez segment désiré et cliquez sur Supprimer la couche en cas d’erreurs ou de corrections, figure 2B).
- Visualisez l’image à 400 μm zoom (ou plus) pour faciliter une visualisation adéquate de la muqueuse muscularis.
- Une fois que toutes les couches (figure 2C) sont définies, exportez les données à l’aide du bouton Export Grid to Text File à l’intérieur des options de régions de couche ( figure2B).
REMARQUE : Enregistrez souvent les fichiers tout en créant les couches pour vous assurer que les données sont correctement stockées. - Ouvrez les fichiers texte et copiez les données à l’aide d’un logiciel de feuille de calcul. Totalez tous les segments de chaque région et calculez le pourcentage de blessures et d’ulcération par rapport à la longueur totale.
- Pour calculer le score histologique de colite (HCS) et pour évaluer la sévérité de la maladie, considérez trois caractéristiques principales comme détaillées ci-dessous.
- Vérifiez la muqueuse intestinale saine qui se caractérise par des cellules épithéliales organisées dans l’axe cryptique-luminal, propria lamina avec peu de cellules immunitaires, et muqueuse muscularis sous-jacques qui interface la muqueuse et la submucosa (Figure 3A).
- Vérifiez l’inflammation/blessure caractérisée par des cryptes épithéliales atténuées ou partiellement manquantes et une inflammation muqueuse avec infiltration de neutrophiles dans les cryptes (figure 3B).
- Vérifiez la présence d’érosion/ulcération caractérisée par des zones dépourvues d’épithélium de surface ou des zones dépourvues complètement de cryptes épithéliales avec ou sans leucocytes associés (figure 3C).
- Calculer le SCS des régions blessées et ulcérées exprimées en pourcentage de la longueur totale de la formule suivante :
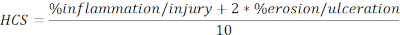
REMARQUE : Le SHC combine le pourcentage d’inflammation/blessure et d’érosion/ulcération en ajoutant un facteur de deux à ce dernier, en se fondant sur une hypothèse raisonnable selon laquelle la perte complète de l’épithélium entraîne une perte maximale de l’intégrité de la barrière et, par conséquent, une maladie pire. HCS représente uniformément les changements morphologiques provoqués par la colite expérimentale induite par DSS. Fait intéressant, nous n’avons pas vu de corrélation claire entre le nombre d’agrégats lymphoïdes du côlon ou de follicules et la gravité clinique de la maladie dans la colite du MAS et, par conséquent, nous n’avons pas inclus la quantification dans cette analyse. - Prenez un instantané des images représentatives (cliquez sur Instantané, Figure 2A), et enregistrer. Incluez des barres d’échelle si nécessaire en cliquant sur Afficher/Masquer la barre d’échelle ( figure 2A).
Access restricted. Please log in or start a trial to view this content.
Résultats
Pour illustrer la fiabilité de cette analyse histologique de score de colite dans le contexte des dommages muqueux après défi de DSS et rétablissement suivant de la colite, nous avons administré 2.5% DSS dans l’eau potable de huit souris mâles de type C57BL6 mâles de 10 semaines pendant 5 jours suivies d’une période de rétablissement avec l’eau régulière pendant 5 jours. Il n’y a eu aucun changement dans le poids corporel pendant l’administration aiguë de DSS, du jou...
Access restricted. Please log in or start a trial to view this content.
Discussion
Notre système histologique de score de colite constitue un outil fiable pour quantifier l’inflammation des tissus et les dommages dans l’intestin. Cette approche permet de mieux comprendre l’état histopathologique de l’organe tout entier sans biais de sélection de petites zones ou de sections incomplètes. Parmi les étapes critiques pour exécuter avec succès ce protocole figurent la préparation appropriée des rouleaux suisses qui permettent d’analyser au moins 90% de la longueur du côlon; orientation p...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs souhaitent souligner le soutien du financement des NIH DK055679, DK089763, DK079392, DK061739, DK072564 et les Services de numérisation des diapositives de pathologie de l’Université du Michigan.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Aperio AT2 – High Volume, Digital Whole Slide Scanning | Leica Biosystems | Aperio AT2 | |
| Absorbent Underpads with waterproof moisture barrier | VWR International | 56616-032 | |
| American Line 66-0089 Single Edge Blade, 100 per pkg | GT Midwest | TL5837 | |
| BD Luer-Lok Disposable Syringes without Needles | Fisher scientific | 14-823-2A | |
| Bonn Strabismus Scissors - ToughCut | Fine Science tools | 11103-09 | |
| Bonn Strabismus Scissors - ToughCut | Fine Science tools | 14084-09 | |
| Dumont #5 Forceps | Fine Science tools | 11251-20 | |
| Formalin solution, neutral buffered, 10% | Sigma | HT501640-19L | |
| HistoPrep 70% Ea | Fisherbran | 70% denatured ethyl alcohol | |
| ImageScope | Aperio | Version 12.3.3.5039 | http://www.leicabiosystems.com/pathology-imaging/aperio-epathology/integrate/imagescope/ |
| LeakBuster Specimen Containers: Sterile | Starplex Scientific | B120210 | |
| Phosphate-Buffere Saline, without calcium & magnesium | Corning | 21-040-CV | |
| Plastic Feeding tubes, 20 GA x 30 mm | Instech | FTP2030 | |
| PrecisionGlide Needle, Size: 20 G x 1 1/2 in | BD (Becton, Dickinson and Company) | 305176 | |
| PrecisionGlide Needle, Size: 27 G x 1/2 in | BD (Becton, Dickinson and Company) | 305109 | |
| Syringe, 10 ml | BD (Becton, Dickinson and Company) | 302995 | |
| Unisette Tissue Cassettes | Simport | M505-2 |
Références
- Kagnoff, M. F. The intestinal epithelium is an integral component of a communications network. Journal of Clinical Investigation. 124 (7), 2841-2843 (2014).
- Laukoetter, M. G., Nava, P., Nusrat, A. Role of the intestinal barrier in inflammatory bowel disease. World Journal of Gastroenterology. 14 (3), 401-407 (2008).
- Baumgart, D. C., Sandborn, W. J. Crohn's disease. Lancet. 380 (9853), 1590-1605 (2012).
- Ordas, I., Eckmann, L., Talamini, M., Baumgart, D. C., Sandborn, W. J. Ulcerative colitis. Lancet. 380 (9853), 1606-1619 (2012).
- Vowinkel, T., Kalogeris, T. J., Mori, M., Krieglstein, C. F., Granger, D. N. Impact of dextran sulfate sodium load on the severity of inflammation in experimental colitis. Digestive Diseases and Sciences. 49 (4), 556-564 (2004).
- Kitajima, S., Takuma, S., Morimoto, M. Histological analysis of murine colitis induced by dextran sulfate sodium of different molecular weights. Experimental Animals. 49 (1), 9-15 (2000).
- Mahler, M., et al. Differential susceptibility of inbred mouse strains to dextran sulfate sodium-induced colitis. American Journal of Physiology. 274 (3), 544-551 (1998).
- Wirtz, S., Neufert, C., Weigmann, B., Neurath, M. F. Chemically induced mouse models of intestinal inflammation. Nature Protocols. 2 (3), 541-546 (2007).
- Kozlowski, C., et al. An entirely automated method to score DSS-induced colitis in mice by digital image analysis of pathology slides. Disease Models & Mechanisms. 6 (3), 855-865 (2013).
- Perse, M., Cerar, A. Dextran sodium sulphate colitis mouse model: traps and tricks. Journal of Biomedicine and Biotechnology. 2012, 718617(2012).
- Mizoguchi, A. Animal models of inflammatory bowel disease. Progress in Molecular Biology and Translational Science. 105, 263-320 (2012).
- Flemming, S., et al. Desmocollin-2 promotes intestinal mucosal repair by controlling integrin-dependent cell adhesion and migration. Molecular Biology of the Cell. 31 (6), 407-418 (2020).
- Luna, L. G. Armed Forces Institute of Pathology (U.S) & Armed Forces Institute of Pathology (U.S.). Manual of Histologic Staining Methods of the Armed Forces Institute of Pathology. 3d edn. , Blakiston Division. (1968).
- Kelm, M., et al. Targeting epithelium-expressed sialyl Lewis glycans improves colonic mucosal wound healing and protects against colitis. The Journal of Clinical Investigation Insight. 5 (12), (2020).
- Reed, M., et al. Epithelial CD47 is critical for mucosal repair in the murine intestine in vivo. Nature Communications. 10 (1), 5004(2019).
- Laukoetter, M. G., et al. JAM-A regulates permeability and inflammation in the intestine in vivo. Journal of Experimental Medicine. 204 (13), 3067-3076 (2007).
- Khounlotham, M., et al. Compromised intestinal epithelial barrier induces adaptive immune compensation that protects from colitis. Immunity. 37 (3), 563-573 (2012).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon