Method Article
Lograr un cribado eficiente de fragmentos en las instalaciones de XChem en Diamond Light Source
* Estos autores han contribuido por igual
En este artículo
Resumen
Este artículo describe el proceso completo de XChem para el cribado de fragmentos basados en cristales, desde la solicitud de acceso y todos los pasos posteriores hasta la difusión de los datos.
Resumen
En el descubrimiento de fármacos basados en fragmentos, cientos o, a menudo, miles de compuestos de menos de ~300 Da se prueban contra la proteína de interés para identificar entidades químicas que puedan convertirse en potentes candidatos a fármacos. Dado que los compuestos son pequeños, las interacciones son débiles y, por lo tanto, el método de cribado debe ser muy sensible; Además, la información estructural tiende a ser crucial para elaborar estos golpes en compuestos similares al plomo. Por lo tanto, la cristalografía de proteínas siempre ha sido una técnica de referencia, pero históricamente ha sido demasiado difícil para encontrar un uso generalizado como cribado primario.
Los experimentos iniciales de XChem se demostraron en 2014 y luego se probaron con colaboradores académicos e industriales para validar el proceso. Desde entonces, un gran esfuerzo de investigación y un tiempo de haz significativo han simplificado la preparación de muestras, desarrollado una biblioteca de fragmentos con posibilidades de seguimiento rápido, automatizado y mejorado la capacidad de la línea de luz I04-1 para la recopilación de datos desatendidos, e implementado nuevas herramientas para la gestión de datos, el análisis y la identificación de impactos.
XChem es ahora una instalación para el cribado de fragmentos cristalográficos a gran escala, que apoya todo el proceso de deposición de cristales y es accesible para usuarios académicos e industriales de todo el mundo. El programa de usuarios académicos revisados por pares se ha desarrollado activamente desde 2016, para dar cabida a proyectos de un alcance científico lo más amplio posible, incluidos proyectos bien validados y exploratorios. El acceso académico se asigna a través de convocatorias semestrales para propuestas revisadas por pares, y el trabajo propio es organizado por el grupo de Enlace Industrial de Diamond. Este flujo de trabajo ya se ha aplicado de forma rutinaria a más de cien dianas de diversas áreas terapéuticas, e identifica eficazmente los aglutinantes débiles (tasa de aciertos del 1 % al 30 %), que sirven como puntos de partida de alta calidad para el diseño de compuestos y proporcionan una amplia información estructural sobre los sitios de unión. La resiliencia del proceso quedó demostrada por la detección continua de los objetivos del SARS-CoV-2 durante la pandemia de COVID-19, incluido un tiempo de respuesta de 3 semanas para la proteasa principal.
Introducción
El descubrimiento de fármacos basado en fragmentos (FBDD, por sus siglas en inglés) es una estrategia ampliamente utilizada para el descubrimiento de plomo, y desde su aparición hace 25 años, ha entregado cuatro fármacos para uso clínico y más de 40 moléculas han avanzado a ensayos clínicos 1,2,3. Los fragmentos son pequeñas entidades químicas, generalmente con un peso molecular de 300 Da o menos. Se seleccionan por su baja complejidad química, lo que proporciona buenos puntos de partida para el desarrollo de inhibidores altamente eficientes en ligandos con excelentes propiedades fisicoquímicas. Su tamaño significa que muestrean el paisaje de unión de las proteínas más a fondo que las bibliotecas de compuestos más grandes similares a los fármacos o al plomo y, por lo tanto, también revelan puntos calientes y sitios alostéricos putativos. Combinados con información estructural, los fragmentos proporcionan un mapa detallado de las posibles interacciones moleculares entre la proteína y el ligando. Sin embargo, la detección y validación fiables de estas entidades, que tienden a unirse débilmente a la proteína diana, requiere una serie de métodos de cribado biofísico robustos y sensibles, como la resonancia de plasmón de superficie (SPR), la resonancia magnética nuclear (RMN) o la calorimetría de titulación isotérmica (ITC)4,5.
La cristalografía de rayos X es una parte esencial del conjunto de herramientas FBDD: es lo suficientemente sensible como para identificar aglutinantes débiles y proporciona directamente información estructural sobre las interacciones a nivel molecular. Es complementario a otros cribados biofísicos y, por lo general, es esencial para progresar los golpes de fragmentos a compuestos principales; requiere sistemas cristalinos de alta calidad, lo que significa que la cristalización es altamente reproducible, y los cristales idealmente se difractan a una resolución superior a 2,8 Å.
Históricamente, ha sido muy difícil utilizar la cristalografía como cribado de fragmentos primarios 6,7,8, ya sea en el ámbito académico o en la industria. Por el contrario, los sincrotrones lograron mejoras de orden de magnitud en robótica, automatización 9,10,11 y tecnología de detectores 12,13, y combinados con una potencia de cálculo igualmente acelerada y algoritmos de procesamiento de datos14,15,16, los conjuntos de datos de difracción completos se pueden medir en segundos y un gran número de ellos completamente desatendidos, como se inició en LillyCAT7 y más tarde MASSIF17,18 (Instalación Europea de Radiación Sincrotrón (ESRF)). Esto llevó a los sincrotrones a desarrollar plataformas altamente optimizadas para hacer que el cribado de fragmentos basado en cristales como pantalla principal fuera accesible para una amplia comunidad de usuarios (XChem en Diamond; CrystalDirect en EMBL/ESRF19; BESSY en el Helmholtz-Zentrum Berlin20; FragMax en MaxIV21).
Este artículo documenta los protocolos que constituyen la plataforma XChem para el cribado de fragmentos mediante cristalografía de rayos X, desde la preparación de la muestra hasta los resultados estructurales finales de los resultados de los resultados modelados en 3D. La tubería (Figura 1) requirió el desarrollo de nuevos enfoques para la identificación de cristales 22, el remojo 23 y la recolección 24, así como un software de gestión de datos25 y un enfoque algorítmico para identificar fragmentos 26 que ahora se usa ampliamente en la comunidad. La tecnología de recolección de cristales ahora es vendida por un proveedor (ver Tabla de Materiales), y la disponibilidad abierta de las herramientas ha permitido que otros sincrotrones las adapten para establecer plataformas equivalentes21. Los proyectos en curso abordan el análisis de datos, la finalización de modelos y la difusión de datos a través de la plataforma Fragalysis27. El laboratorio de preparación de muestras se encuentra junto a la línea de luz I04-1, lo que simplifica la logística de transferir cientos de muestras congeladas a la línea de luz y el tiempo de haz dedicado en I04-1 permite una rápida retroalimentación de rayos X para guiar la campaña.
XChem es una parte integral del programa de usuarios de Diamond, con dos llamadas al año (principios de abril y octubre). El proceso de revisión por pares se ha perfeccionado en consulta con expertos en el descubrimiento de fármacos del mundo académico y la industria. Junto con un caso científico sólido, el proceso de propuesta28 requiere que los solicitantes autoevalúen no solo la preparación del sistema cristalino, sino también su experiencia en métodos bioquímicos y biofísicos ortogonales y su capacidad para avanzar en los resultados de detección a través de la química de seguimiento. Los modos de acceso también han evolucionado para dar cabida a la comunidad multidisciplinaria de usuarios:
El nivel 1 (proyecto único ) es para proyectos en fase exploratoria y no es necesario que existan herramientas de validación de resultados positivos (herramientas biofísicas o bioquímicas) ni estrategias de seguimiento. Si se acepta, al proyecto se le concede un número reducido de turnos de tiempo de haz, suficiente para la prueba de concepto.
El Nivel 2 (proyecto único) es para proyectos bien validados y requiere que se implementen herramientas posteriores y estrategias de seguimiento. Si se acepta, al proyecto se le asigna suficiente tiempo de haz para una campaña completa de cribado de fragmentos. Los proyectos individuales (Nivel 1 o Nivel 2) deben completarse dentro de los 6 meses del período de asignación (ya sea de abril a septiembre o de octubre a marzo).
El Grupo de Asignación de Bloques ( BAG, por sus siglas en inglés) es para un consorcio de grupos y proyectos, en el que existe un sólido proceso de selección y priorización de objetivos dentro del BAG, junto con una línea de seguimiento clara. Los BAG deben tener al menos un experto (superusuario) totalmente capacitado en XChem, que coordine sus actividades con el personal de Diamond y capacite a los miembros del BAG. El número asignado de desplazamientos de tiempo de haz se define por el número de proyectos científicamente sólidos en el BAG y se reevalúa por período de asignación sobre la base del informe del BAG. El acceso está disponible durante 2 años.
El experimento XChem se divide en tres etapas, con un punto de decisión para cada una de ellas: prueba de tolerancia a disolventes, preselección y pantalla principal (Figura 2). La prueba de tolerancia al disolvente ayuda a definir los parámetros de remojo, la cantidad de disolvente (DMSO, etilenglicol u otros crioprotectores si es necesario) que el sistema de cristal puede tolerar y durante cuánto tiempo. Las concentraciones de disolventes suelen oscilar entre el 5% y el 30% en al menos dos puntos temporales. Los datos de difracción se recopilan y se comparan con la difracción base del sistema cristalino; Esto determinará los parámetros de remojo para la siguiente etapa. Para la pre-selección, se empapan entre 100 y 150 compuestos utilizando las condiciones determinadas en la prueba de disolvente, y su propósito es confirmar que los cristales pueden tolerar los compuestos en esas condiciones. Si es necesario, el crioprotector se añade posteriormente a las gotas que ya contienen los fragmentos. Los criterios de éxito son que el 80% o más de los cristales sobrevivan lo suficientemente bien como para producir datos de difracción de buena y consistente calidad; Si esto falla, las condiciones de remojo generalmente se revisan alterando el tiempo de remojo o la concentración de solvente. Tras un pre-screening exitoso, el resto de los compuestos elegidos para el experimento pueden ser configurados utilizando los parámetros finales.
La biblioteca preparada para DSI (ver Tabla de Materiales) fue diseñada a propósito para permitir una rápida progresión de seguimiento utilizando la química equilibrada29 y ha sido la biblioteca de caballo de batalla de la instalación. Está disponible para los usuarios en una concentración de 500 mM en DMSO. Los usuarios académicos también pueden acceder a otras bibliotecas proporcionadas por colaboradores (más de 2.000 compuestos en total) en concentraciones de 100-500 mM en DMSO (se puede encontrar una lista completa en el sitio web28). Gran parte de la colección general también está disponible en etilenglicol, para sistemas cristalinos que no toleran el DMSO. Los usuarios también pueden traer sus propias bibliotecas, siempre que estén en placas compatibles con el sistema acústico de manejo de líquidos (ver Tabla de Materiales).
Para los tres pasos del experimento (caracterización del disolvente, preselección o cribado completo), los siguientes procedimientos de preparación de la muestra son idénticos (Figura 3): selección del lugar de dispensación del compuesto a través de la obtención de imágenes y la orientación de las gotas de cristalización con TeXRank22; dispensación en gotas utilizando el sistema acústico de dispensación de líquidos tanto para disolventes como para compuestos23; recolección eficiente de los cristales utilizando el Crystal shifter24; y la carga de la información de la muestra en la base de datos de la línea de luz (ISPyB). La interfaz actual para el diseño y ejecución de experimentos es una aplicación basada en Excel (SoakDB), que genera los archivos de entrada necesarios para los diferentes equipos de la plataforma, y rastrea y registra todos los resultados en una base de datos SQLite. Los escáneres de códigos de barras se utilizan en varias etapas a lo largo del proceso para ayudar a rastrear las muestras y estos datos se agregan a la base de datos.
Los datos de difracción se recogen en modo desatendido utilizando un tiempo de haz dedicado en la línea de luz I04-1. Hay dos modos de centrado disponibles, a saber, óptico y basado en rayos X17. Para los cristales en forma de aguja y varilla, se recomienda el centrado de rayos X, mientras que los cristales más gruesos generalmente admiten el modo óptico, que es más rápido y, por lo tanto, permite recolectar más muestras en el tiempo de haz asignado. Dependiendo de la resolución de los cristales (establecida antes de entrar en la plataforma) la recogida de datos puede ser de 60 s o 15 s de exposición total. La recopilación de datos durante la etapa de prueba de solvente generalmente informa qué combinación funcionará mejor con el rendimiento de la línea de luz I04-1.
El gran volumen de análisis de datos se gestiona a través de XChemExplorer (XCE)25, que también se puede utilizar para iniciar el paso de identificación de visitas utilizando PanDDA26. XCE es una herramienta de gestión de datos y flujo de trabajo que admite el análisis a gran escala de estructuras proteína-ligando (Figura 4); lee cualquiera de los resultados de procesamiento automático de los datos recopilados en Diamond Light Source (DIALS16, Xia214, AutoPROC30 y STARANISO31) y selecciona automáticamente uno de los resultados en función de la calidad de los datos y la similitud con un modelo de referencia. Es importante que el modelo sea representativo del sistema cristalino utilizado para el cribado XChem y debe incluir todas las aguas u otras moléculas de disolvente, así como todos los cofactores, ligandos y conformaciones alternativas visibles en cristales empapados únicamente con disolvente. La calidad de este modelo de referencia tendrá un impacto directo en la cantidad de trabajo requerido durante la etapa de construcción y refinamiento del modelo. PanDDA se utiliza para analizar todos los datos e identificar los sitios de unión. Alinea las estructuras con una estructura de referencia, calcula los mapas estadísticos, identifica eventos y calcula mapas de eventos26,32. En el paradigma PanDDA, no es necesario ni deseable construir el modelo cristalográfico completo; Lo que se debe modelar es solo la vista de la proteína donde se une un fragmento (el modelo de estado ligado), por lo que el enfoque debe estar solo en la construcción del ligando y los residuos circundantes/moléculas de solvente de acuerdo con el mapa de eventos32.
Protocolo
1. Presentación de propuestas de proyecto
- Contenido de la propuesta: dado que el programa XChem tiene un exceso de solicitudes, la información exhaustiva y completa en la propuesta es fundamental para pasar la revisión por pares.
- ¡Presenta el caso! Presenta la importancia del objetivo y ponlo en un contexto más amplio.
- Articular la estrategia después de la campaña de cribado de fragmentos: los métodos ortogonales implementados para validar los resultados y cómo progresarlos. Alinea las colaboraciones, si es necesario.
- Debido a la intensa parte de laboratorio y análisis de datos, se recomienda encarecidamente asignar un cristalógrafo experimentado por adelantado.
- Un sistema de cristal robusto es clave para eliminar la variación técnica y los usuarios deben abordar esos puntos esenciales.
- Asegúrese de que las condiciones de cristalización produzcan gotas reproducibles con cristales de calidad difractante similar en placas adecuadas para su uso en la plataforma con un volumen de depósito de 30 μL (o menos) y un tamaño de gota entre 200-500 nL. Idealmente, más del 50% de las gotas en una placa tendrán cristales de al menos 35 μm de tamaño33.
- Asegurar una calidad de difracción constante de los cristales (2,6 Å o mejor).
- Verifique la idoneidad del sistema de cristales para el cribado de fragmentos, incluido el empaquetamiento de cristales y la accesibilidad de sitios conocidos. La evidencia previa de una molécula unida a esos sitios es a menudo tranquilizadora.
- ¡Presenta el caso! Presenta la importancia del objetivo y ponlo en un contexto más amplio.
2. Preparación de la visita
- Transferencia de protocolos de cristalización para cristalización in situ.
- Proporcione 2 x 50 ml de solución de depósito, lista para usar.
- Proporcionar la solución proteica a la concentración necesaria para la cristalización, lista para usar en alícuotas de 30-50 μL.
- Proporcione 10 ml de la solución tampón proteica.
- Proporcione stock de semillas (incluso si no es necesario en el protocolo de cristalización).
NOTA: La siembra favorece la reproducibilidad de la cristalización y acelera el tiempo de nucleación33. - Complete el formulario de información de cristalización disponible en el sitio web de XChem28.
- Proporcione la información de almacenamiento en el formulario de envío disponible en el sitio web de XChem28.
- Instale NoMachine y configure un escritorio remoto en Diamond (https://www.diamond.ac.uk/Users/Experiment-at-Diamond/IT-User-Guide/Not-at-DLS/Nomachine.html).
- Genere y transfiera un buen modelo de referencia, en consulta con un cristalógrafo experto o personal de soporte de XChem.
3. Experimento de cribado de fragmentos
- Definición de la ubicación de dispensación del compuesto.
- Obtención de imágenes de placas de cristalización.
- Imagine todas las placas de cristal (ver Tabla de Materiales) necesarias para el experimento en los generadores de imágenes de placas de cristal (ver Tabla de Materiales). Con el software de generación de imágenes, genere los nombres de las placas en el directorio correcto para el tipo de placa en el siguiente formato: Número de Number_Plate de propuesta.
- Imprima los códigos de barras (haga clic con el botón derecho en el nombre de la placa y seleccione en el menú), colóquelos en el lado opuesto de la placa de las letras de la fila, coloque la(s) placa(s) en el puerto de carga con el código de barras en dirección opuesta al usuario.
- Utilice el software de control del generador de imágenes, escanee el puerto de carga, haga clic con el botón derecho en las placas y, a continuación, seleccione Placas de imagen.
- Una vez que se haya completado la obtención de imágenes, retire las placas del generador de imágenes.
- Elección de los cristales y la ubicación del compuesto
NOTA: Las imágenes de las gotas de cristalización se procesan dentro de la tubería Luigi utilizando el algoritmo basado en textones Ranker de TexRank para clasificar las gotas por la probable presencia de cristales22. Esto toma aproximadamente 10 minutos y las imágenes estarán disponibles en TexRank.- Abra TeXRank desde una PC y seleccione la bandeja de cristal de la lista en la parte inferior derecha o escribiendo el código de barras en el cuadro en la parte superior izquierda.
- Seleccione el formato correcto del generador de imágenes y la vista de un solo pozo. Muévase a través de las imágenes de la gota y cuando haya un cristal que sea adecuado para usar en un experimento, haga clic derecho lejos del cristal pero dentro de la gota: el objetivo es apuntar a dónde en la gota para agregar solvente / compuestos, por lo que no desea golpear directamente el cristal23.
- Continúe por toda la placa y, una vez que haya terminado, seleccione el botón Echo 1 Target ; Guarde en el directorio de Crystal Targets en la visita correspondiente. No cambie el nombre del archivo.
- Repita el procedimiento para cualquier plato adicional.
- Obtención de imágenes de placas de cristalización.
- Dispensación de compuestos
- Generación de archivos para la dispensación de compuestos
- En SoakDB, introduzca la selección de bibliotecas o la información de disolventes en la tabla de bibliotecas/disolventes.
- Introduzca el volumen de caída y la carga en la lista de cristales de destino.
- Genere los lotes necesarios.
- Introduzca los parámetros de remojo. Haga clic en Calcular y luego en el botón Exportar pendiente . En el caso del disolvente, agregue las distintas concentraciones a la tabla. Esto genera los archivos para su uso en el dispensador acústico.
- Si usa crioprotector, ingrese la concentración y cree los archivos de la misma manera.
- Dispensación de soluciones mediante el dispensador acústico (ver Tabla de Materiales)
- Tome la placa fuente (compuestos o disolvente/crioprotector) y haga girar la placa en la centrífuga durante 2 min a 1.000 x g.
- Si dispensa disolvente o crioprotector, pipetee 30 μL en el pocillo correspondiente en una placa de 384PP; Cubra con una película de microsellado y luego centrifugue como se indicó anteriormente.
- Abra el software; seleccione Nuevo y elija la placa de pocillo de origen correcta (384PP, 384LDV o 1536LDV) y la clase de líquido (DMSO, CP, BP o GP). Asegúrese de seleccionar el tipo de placa correcto como placa de destino. A continuación, marque la casilla Personalizado y continúe.
- Seleccione Importar y elija el archivo por lotes correspondiente. Complete los pasos de importación según lo solicite el software.
- Utilice los mapas de placas para comprobar la solución a dispensar y las ubicaciones de destino.
- Ejecute el protocolo, siguiendo las indicaciones a medida que surjan. La(s) solución(es) de la placa fuente se dispensará en las gotas de cristal elegidas.
- Guarde la placa en la incubadora durante el tiempo requerido.
NOTA: Estos parámetros se determinan en el paso de caracterización del disolvente, la temperatura será de 4 °C o 20 °C dependiendo de la temperatura de crecimiento del cristal y los tiempos suelen estar entre 1 h y 3 h.
- Generación de archivos para la dispensación de compuestos
- Recolección de cristales mediante el dispositivo semiautomático de recolección de cristales (ver Tabla de materiales).
NOTA: Si se requiere crioprotección, repita el paso 3.2.2 para agregar soluciones crioprotectoras sobre las gotas de cristal antes de recolectar las muestras.- Preparación para la cosecha
- Prepare los archivos necesarios para la recolección en SoakDB. Cuando se le solicite, confirme que los remojos estén listos y que los lotes se hayan completado.
- Escanee el número de discos necesarios para el experimento con el número de propuesta correcto.
- Seleccione una bandeja de bucles del tamaño adecuado para los cristales (35 μm, 75 μm o 150 μm). Es importante elegir un tamaño de bucle que coincida con el tamaño del cristal lo más cerca posible para permitir que el centrado automático en la línea de luz sea más preciso, mejorar la calidad de los datos al reducir el fondo y eliminar la necesidad de crioprotector.
- Abra el software correspondiente y abra la pestaña de flujo de trabajo.
- Escanee los discos en el software y desplácese hacia atrás hasta la parte superior de la lista, resaltando el primer disco.
- Coloque los discos en un dewar de espuma y enfríelos con nitrógeno líquido.
- Elija Importar archivo desde SoakDB y seleccione el lote que desea cosechar; Compruebe si el lote está asignado al soporte izquierdo. Aparece un pool de trabajo.
- Tome la placa de cristal, retire el sello y colóquela en el soporte izquierdo; Mueva la placa a la posición de estacionamiento.
- Recolección de cristales
- Póngase cómodo y presione el botón Iniciar flujo de trabajo (la pantalla es táctil) para moverse a la primera posición de pozo seleccionada.
- Si el cristal ha sobrevivido, monta el cristal en el bucle y sumérgelo en el nitrógeno líquido colocándolo en la posición 1 del primer disco de la lista.
- Seleccione la descripción apropiada para el cristal de la interfaz (normal, derretido, agrietado, gelatinoso o coloreado).
- Si la gota es un remojo compuesto, registre la descripción del estado del compuesto (claro, cristalino, precipitado, mala dispensación o separación de fases).
- Si el cristal se ha montado correctamente, seleccione Montado , de lo contrario, seleccione Fallar.
- La placa se moverá al siguiente pocillo seleccionado. Rellena todas las posiciones del disco de forma consecutiva (no dejes un hueco si ha fallado un cristal). Continúe hasta el final del flujo de trabajo.
- Al final del flujo de trabajo, cargue los lotes adicionales y continúe llenando los discos en orden. No es necesario comenzar un nuevo disco para un nuevo lote.
- Seguimiento de los resultados de la cosecha con código de barras
- Una vez que se hayan recolectado todos los cristales, lleve los discos al escáner de código de barras, colóquelos uno a la vez en el soporte para escanear el disco y los códigos de barras de los pines.
- Cuando esto esté completo, coloque las tapas en los discos y guárdelos en un depósito de nitrógeno líquido.
- Cargue el archivo de salida en la interfaz de SoakDB.
- Registro de la información de la muestra en ISPyB34,35,36
- Cargar datos de muestra en ISPyB
- En SoakDB, actualice la línea de luz, visite Actualizar para ISPyB y haga clic en Exportar para crear el archivo que se cargará en ISPyB.
- Masilla abierta. Inicie sesión y vaya al siguiente directorio: dls/labxchem/data/year/lbXXXX-1/processing/lab36/ispyb.
- Ejecute el script csv2ispyb (csv2ispyb lbXXXX-1-date.csv)
NOTA: Las muestras ahora se cargan en ISPyB.
- Registre la ubicación del disco y la estrategia de recopilación de datos.
- Registre los detalles y la ubicación de los discos
NOTA: Es importante registrar los detalles y la ubicación de los discos para que puedan localizarse y cargarse en la línea de luz.- En SoakDB, abra la segunda pestaña etiquetada como Discos.
- Rellena los datos en las casillas de la parte superior. En concreto, la ubicación de los discos (dewar de almacenamiento y cañas), los parámetros de recogida de datos, incluida la resolución prevista y el número de propuesta.
- Haga clic en el botón Guardar y aparecerá una lista de todos los discos en la tabla. Copia los discos recién llenos.
- Abra la hoja de cálculo de la cola XChem (acceso directo en el escritorio) y pegue la información. Complete cualquier información adicional relevante.
- Registre los detalles y la ubicación de los discos
- Cargar datos de muestra en ISPyB
- Preparación para la cosecha
4. Recopilación de datos
NOTA: Los datos se recopilan en modo desatendido y son administrados por el equipo de XChem/línea de luz.
- Recolección de muestras mal centradas.
NOTA: Estos son necesarios cuando ha habido problemas con la recopilación de datos para ciertas muestras, muy probablemente causados por los pines no se han centrado correctamente.- Mire la vista del cambiador de muestras en ISPyB, seleccione Clasificar por AP para clasificar las muestras por resolución procesada automáticamente en una graduación de color de verde a rojo.
- Haga clic en las muestras para comprobar si hay muestras rojas o amarillas.
NOTA: Esto abrirá la recopilación de datos. - Revisa las instantáneas del cristal para ver si el cristal se ha centrado.
- Tome nota de todos los que no se han centrado y envíelos al contacto local que recogerá las muestras que faltan.
5. Análisis de datos
- Recuperación y análisis de los resultados del procesamiento automático de Diamond a través de XChemExplorer (XCE)25.
- En un terminal, vaya a la subcarpeta Processing: cd /dls/labxchem/data/year/visit/processing o para XChem BAG: cd /dls/labxchem/data/year/visit/processing/project/processing/.
- Utilice el alias xce para abrir XChemExplorer.
- Seleccione el botón Actualizar tablas desde origen de datos .
- En la pestaña Descripción general , hay un resumen de los datos experimentales. Agregue categorías adicionales con la opción Seleccionar columnas para mostrar en el menú Fuente de datos .
- En la pestaña Configuración , seleccione el directorio de recopilación de datos (/dls/i04-1/data/year/visit/).
- Abra la pestaña Conjuntos de datos, elija el destino en el menú desplegable Seleccionar destino, seleccioneNuevos resultados del procesamiento automático en el menú desplegable Conjuntos de datos y haga clic en Ejecutar.
NOTA: XCE ahora analizará la visita de recopilación de datos para obtener resultados de procesamiento automático. Esto puede tardar algún tiempo la primera vez que se ejecuta, dependiendo del número de conjuntos de datos o directorios que se estén analizando. - Compruebe la coherencia y la calidad de los datos comprobando la resolución, el grupo de espacios y Rmerge. Excluya los datos con una resolución inferior a 2,8 Å.
NOTA: De forma predeterminada, la selección del conjunto de datos se basa en una puntuación calculada a partir de I/sigI, la integridad y el número de reflexiones únicas, pero se pueden seleccionar otros resultados de procesamiento para su uso25. - Para seleccionar un resultado de procesamiento diferente para conjuntos de datos individuales, si lo prefiere, haga clic en ID de muestra y elija el programa/ejecución deseado. Para cambiar la canalización de procesamiento de todos los conjuntos de datos, seleccione Editar preferencias en el menú Preferencias y cambie Mecanismo de selección de conjuntos de datos.
- Si es necesario, vuelva a procesar los datos a través de ISPyB37.
- Si no se acepta ningún dato procesado para una muestra, etiquételo como Error para excluirlo del análisis posterior.
- Cuando haya terminado, haga clic en Actualizar tablas desde la fuente de datos para agregar datos a las tablas posteriores.
- Cálculo de mapas iniciales con DIMPLE38.
- Abra la pestaña Mapas , elija el modelo de referencia en el menú desplegable y seleccione los conjuntos de datos deseados seguidos de Ejecutar DIMPLE en los archivos MTZ seleccionados.
- XCE ejecuta numerosos trabajos DIMPLE simultáneamente en el clúster de Diamond. Busque el estado de estos trabajos en la columna Estado de hoyuelos y actualícelos con el botón Actualizar tablas desde la fuente de datos o con el comando qstat en Linux.
- Una vez completado, compruebe si los valores Dimple Rcryst, Dimple Rfree y Space Group son aceptables. Si es necesario (Rfree alto/grupo de espacio incorrecto/gran diferencia en el volumen de celda unitaria), cambie los resultados del procesamiento automático como se describió anteriormente y repita la generación de mapas para estos conjuntos de datos.
- Generación de restricciones de ligandos utilizando Grado39, AceDRG40 o phenix.eLBOW41.
- Seleccione el programa deseado (Preferencias, Editar preferencias, Programa de generación de restricciones) y, a continuación, seleccione datasets en la pestaña Mapas y, a continuación, ejecute Crear archivo CIF/PDB/PNG de compuestos SELECCIONADOS en el menú desplegable Mapas y restricciones .
- Actualice el estado de estos trabajos que se encuentran en la columna Estado compuesto mediante el botón Actualizar tablas desde origen de datos .
- Creación del modelo de estado fundamental (previa a la ejecución)
NOTA: El término modelo de estado fundamental representa la estructura de la proteína en su forma libre de ligandos, como se observa en 100 conjuntos de datos (este número se elige arbitrariamente). Dado que el modelo del estado fundamental se utiliza como referencia para construir el estado unido al ligando, es fundamental construir un modelo preciso del estado fundamental, que incluya todas las moléculas de disolvente y agua, antes del análisis de toda la campaña de cribado de fragmentos. En este paso, los cien primeros conjuntos de datos de mayor resolución marcados por PanDDA como carentes de eventos interesantes (y, por lo tanto, probablemente libres de ligandos) se utilizan para generar el mapa medio del estado fundamental, mientras que el conjunto de datos con Rlibre más bajo se selecciona para el refinamiento. El mapa de la media del estado fundamental no es un mapa cristalográfico, sin embargo, es importante utilizar este mapa solo para la construcción del modelo del estado fundamental.- Abra la pestaña PanDDAs y actualice las tablas desde la fuente de datos si es necesario.
- Defina el directorio de salida (/dls/labxchem/data/year/visit/processing/analysis/panddas).
- Seleccione Pre-run para Ground State Model y haga clic en Run.
NOTA: Los conjuntos de datos con un alto Rfree y grupos de espacios inesperados deben excluirse automáticamente del análisis. - Para excluir manualmente conjuntos de datos con grupos de espacio inesperados y con un alto nivel de Rfree, seleccione Ignorar por completo.
- Compruebe el estado del trabajo de ejecución previa mediante qstat en una ventana de terminal.
- Una vez completado, seleccione Construir modelo de estado fundamental y haga clic en Ejecutar.
NOTA: Esto abrirá Coot con el mapa de la media de PanDDA y un modelo de referencia/mapas 2Fo-Fc/Fo-Fc del conjunto de datos de mejor calidad para volver a modelar y refinar usando Coot. Es de suma importancia que solo se utilice el mapa de medias PanDDA para el modelado.
- Identificación de aciertos mediante PanDDA26
- Análisis PanDDA
NOTA: Puede tardar algún tiempo en ejecutarse en el clúster si hay muchos conjuntos de datos, la celda unitaria es grande y hay varias copias de la proteína en la unidad asimétrica.- Repita los pasos descritos anteriormente para Analizar los resultados del procesamiento automático de DLS y el cálculo del mapa inicial. Para el cálculo del mapa, utilice el modelo de estado fundamental como referencia: Actualizar lista de archivos de referencia > Establecer nueva referencia y genere restricciones de ligandos según sea necesario para los nuevos datos (pasos 6.1-6.3).
- En la pestaña PanDDAs , asegúrese de que el directorio de salida esté configurado como antes y ejecute pandda.analyse desde el menú desplegable Hit Identification .
- Compruebe el estado del trabajo en el terminal de Linux mediante el comando qstat.
- Inspección de PanDDA: comprobación/creación de eventos de enlace
- En la pestaña PanDDAs en XCE, ejecute pandda.inspect desde el menú desplegable Hit Identification para abrir Coot42 con el panel de control de PanDDA.
NOTA: El panel de control pandda.inspect proporciona un resumen de las estadísticas de PanDDA y permite a los usuarios navegar a través de eventos/sitios de enlace. También se genera un archivo HTML de resumen de los resultados que se puede actualizar durante la inspección seleccionando Actualizar HTML. - Para modelar un ligando, haga clic en Fusionar ligando con modelo y Guardar modelo antes de navegar a otro evento para evitar perder cualquier cambio en el modelo de estado ligado.
NOTA: Solo los modelos que se hayan actualizado y guardado se exportarán para su perfeccionamiento en una etapa posterior. - Use el campo Comentario de evento para anotar el evento de enlace y la Información del sitio de registro para anotar los sitios de enlace.
- Promedio de carga y mapas 2mFo-DFc (de DIMPLE) para la comparación con el mapa de eventos y el modelo.
- Una vez que todos los ligandos viables se hayan modelado, fusionado y guardado en función del mapa de eventos, cierre pandda.inspect.
- En la pestaña PanDDAs en XCE, ejecute pandda.inspect desde el menú desplegable Hit Identification para abrir Coot42 con el panel de control de PanDDA.
- Exportación y perfeccionamiento de PanDDA
NOTA: Los siguientes modelos de inspección de PanDDA se exportan de nuevo al directorio del proyecto y se inicia una ronda inicial de refinamiento. Actualmente hay dos canalizaciones disponibles para hacerlo en la pestaña PANDA en XCE.- Exportar modelos NUEVO/TODOS/SELECCIONADOS PANDDA genera un conjunto de los modelos enlazados y no enlazados para su refinamiento y genera parámetros de restricción de ocupación para la Refmac43.
NOTA: El modelo de conjunto se usará para el refinamiento, pero solo el modelo de estado enlazado se actualizará en Coot y se depositará en la PDB. Esta canalización se utiliza mejor para conjuntos de datos con fragmentos de baja ocupación y cambios significativos en el modelo de proteínas. - Refinar los modelos de estado enlazado NEW/ALL con BUSTER refina el estado enlazado solo con Buster44.
NOTA: Esto se utiliza mejor con ligandos/conjuntos de datos de alta ocupación con cambios mínimos en el modelo de proteína.
- Exportar modelos NUEVO/TODOS/SELECCIONADOS PANDDA genera un conjunto de los modelos enlazados y no enlazados para su refinamiento y genera parámetros de restricción de ocupación para la Refmac43.
- Análisis PanDDA
- Refinar los resultados (todos los conjuntos de datos seleccionados para el refinamiento ahora serán visibles en la pestaña Refinamiento). Seleccione Open COOT - BUSTER Refinement o Open COOT - REFMAC Refinement en el menú desplegable Refinamiento para abrir Coot con el panel de control XCE Refinement.
- Seleccione el estado de las muestras que se van a refinar en el menú desplegable Seleccionar muestras (normalmente 3 - en refinamiento) y haga clic en IR.
NOTA: El panel de control XCE proporciona un resumen del número de conjuntos de datos para esa categoría y permite la navegación entre conjuntos de datos, al tiempo que proporciona un resumen de las estadísticas de refinamiento. - Anote la confianza del ligando en el panel de control XCE: 0 - no hay ligando presente - El fragmento no se ha enlazado; 1 - Baja confianza: el fragmento posiblemente se ha unido, pero no es particularmente convincente; 2 - ligando correcto, densidad débil: el usuario confía en que el fragmento se ha unido, pero es de baja ocupación/hay algunos problemas con los mapas; 3 - Densidad clara, ligando inesperado: los mapas indican claramente la unión del ligando que no se correlaciona con la estructura química proporcionada; 4 - Alta confianza: el ligando se une sin ambigüedades.
- Realice los cambios necesarios en el modelo en esta etapa e inicie un mayor refinamiento con el botón Perfeccionar .
- Utilice el botón Mostrar lista de tareas pendientes de MolProbity para acceder a la ejecución del análisis de MolProbity45 en todos los ciclos de refinamiento.
- Si es necesario, agregue parámetros de refinamiento, por ejemplo, para factores de temperatura anisotrópicos, datos gemelos o refinamiento de ocupación seleccionando el botón Parámetros de refinamiento .
NOTA: Las estadísticas de procesamiento de datos también se proporcionan en XCE en la pestaña Refinamiento y, si el refinamiento se realiza con la canalización de Buster, se proporcionan informes de Buster, incluido el análisis MOGUL46. - Cambie el estado de un conjunto de datos a medida que avanza a través del refinamiento tanto en la ventana principal de XCE en la pestaña Refinamiento como en el panel de control de Coot XCE . Cuando esté satisfecho de que el modelo es preciso alrededor del ligando y adecuado para ser compartido para un análisis posterior, cambie el estado a CompChem Ready. Cuando se complete el refinamiento y el modelo esté listo para cargarse en la PDB, cambie el estado a Listo para depositar.
- Seleccione el estado de las muestras que se van a refinar en el menú desplegable Seleccionar muestras (normalmente 3 - en refinamiento) y haga clic en IR.
6. Depósito de los datos
NOTA: Todos los datasets de una pantalla de fragmentos y el modelo de estado fundamental utilizado para generar los mapas de eventos PanDDA se pueden depositar en el PDB utilizando deposiciones de grupo.
- Convierta todos los mapas de eventos de PanDDA al formato MTZ ejecutando Event Map ->SF desde el menú Hit Identification .
- Proporcione metadatos adicionales, como autores y métodos, seleccionando Deposición > Editar información. Complete todos los elementos requeridos y haga clic en Guardar en la base de datos y luego guarde esta información para la deposición del modelo de estado fundamental. Haga esto después de que el estado del modelo se haya cambiado a Deposition Ready.
- En la pestaña Deposición , seleccione el botón Preparar mmcif para generar archivos mmcif de factor de estructura para todos los datasets listos para deposición . El siguiente mensaje aparecerá en la ventana del terminal cuando esto se haya completado: Terminado Preparación de archivos mmcif para la deposición wwPDB.
- Seleccione el botón Copiar mmcif para copiar todos estos archivos en un único archivo tar comprimido en el Directorio de deposición de grupo de la visita.
- Ir a https://deposit-group-1.rcsb.rutgers.edu/groupdeposit; Inicie sesión con nombre de usuario: GroupTester y contraseña: !2016RCSBPDB. Cree una sesión y cargue el archivo ligand-bound.tar.bz2 desde el directorio de deposición de grupo.
- Después de enviar con éxito las estructuras unidas al ligando, se envía un correo electrónico con los códigos PDB. Seleccione Actualizar DB con códigos PDB en el menú Deposición ; copie y pegue la información de este correo electrónico en la ventana emergente y haga clic en Actualizar base de datos para agregar ID de PDB.
- Para depositar el modelo de estado fundamental utilizado por PanDDA, seleccione el directorio PanDDA correspondiente en XCE y ejecute apo->mmcif desde el menú Hit Identification .
NOTA: XCE seleccionará arbitrariamente una estructura de alta resolución con Rfree bajo como modelo para el haz de deposición y luego compilará todos los archivos mmcif de factor de estructura en un solo archivo. - En la pestaña Deposición , seleccione el botón Agregar a la base de datos debajo de la sección Agrupar deposición del modelo de estado fundamental .
- Introduzca los metadatos para el modelo de estado fundamental (de nuevo seleccionando Deposición > Editar información), cargue el archivo anterior y Guardar en la base de datos.
- Prepare el archivo mmcif de estado fundamental ejecutando Preparar mmcif desde la sección Deposición de grupo del modelo de estado fundamental y, cuando haya terminado, copie el mmcif en el directorio de deposición de grupo seleccionando el botón Copiar mmcif de la misma sección.
- Como antes, vaya a https://deposit-group-1.rcsb.rutgers.edu/groupdeposit; Inicie sesión con nombre de usuario: GroupTester y contraseña: !2016RCSBPDB. Cree una sesión y cargue el archivo ground_state_structures.tar.bz2 desde el directorio de deposición de grupo.
Resultados
La línea XChem para el cribado de fragmentos mediante cristalografía de rayos X se ha simplificado ampliamente, lo que ha permitido su adopción por parte de la comunidad científica (Figura 5). Este proceso ha sido validado en más de 150 campañas de cribado con una tasa de aciertos que varía entre el 1% y el 30%47,48,49,50,51,52 y por muchos usuarios habituales. Los sistemas de cristal que no son adecuados (baja resolución, inconsistentes en la cristalización o en la calidad de la difracción) o que no pueden tolerar el DMSO o el etilenglicol se eliminan al principio del proceso, ahorrando tiempo, esfuerzo y recursos. Las campañas exitosas proporcionan un mapa tridimensional de los posibles sitios de interacción en la proteína diana; un resultado típico es el cribado XChem de la proteasa principal del SARS-CoV-2 (Figura 6). Típicamente, los resultados de los fragmentos se encuentran en: (a) sitios de interés conocidos, como sitios activos enzimáticos y subbolsas48; b) sitios alostéricos putativos, por ejemplo, en las interacciones proteína-proteína53; (c) interfaces de empaquetamiento de cristal, generalmente consideradas como falsos positivos (Figura 6). Estos datos estructurales generalmente proporcionan una base para fusionar, unir o hacer crecer fragmentos en pequeñas moléculas similares al plomo 1,3.
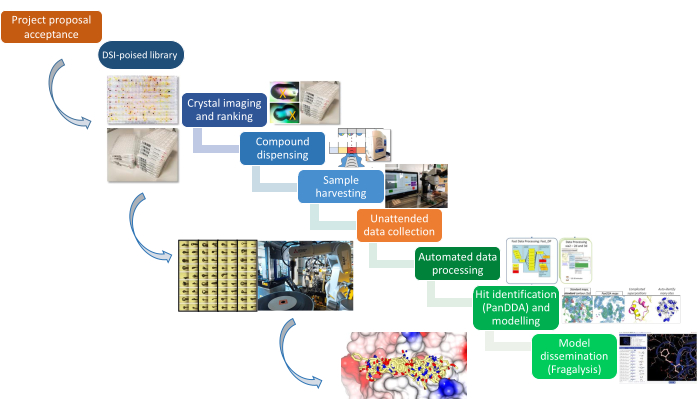
Figura 1: La canalización de XChem. La plataforma se representa esquemáticamente desde la propuesta del proyecto hasta la preparación de muestras, la recopilación de datos y la identificación de impactos. Haga clic aquí para ver una versión más grande de esta figura.
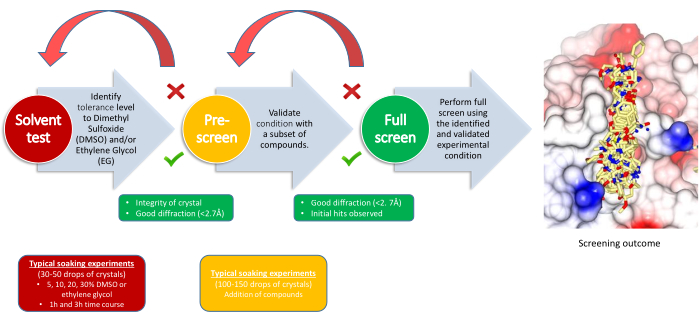
Figura 2: Estrategia de cribado. El flujo de trabajo indica el propósito de cada hito, los requisitos del experimento y los puntos de decisión. Haga clic aquí para ver una versión más grande de esta figura.
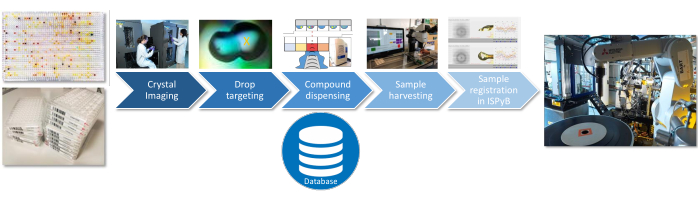
Figura 3: Flujo de trabajo de preparación de muestras. Los pasos críticos para la preparación de la muestra se representan con información de cada paso que se registra en una base de datos SQLite. Haga clic aquí para ver una versión más grande de esta figura.
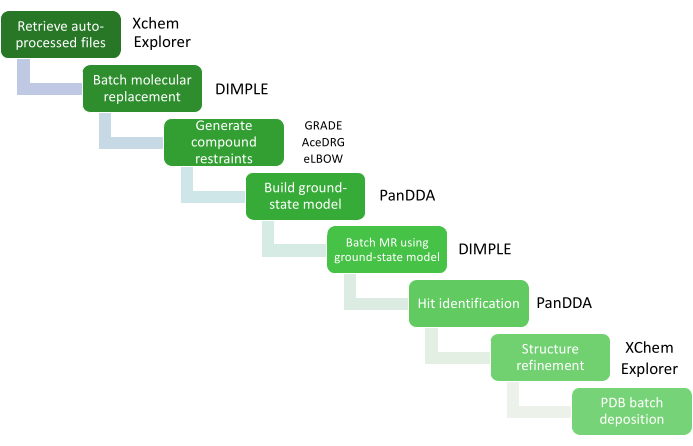
Figura 4: Análisis de datos con XCE. Los pasos críticos en el análisis de datos están representados por un diagrama de flujo de trabajo con los paquetes de software relevantes. Haga clic aquí para ver una versión más grande de esta figura.
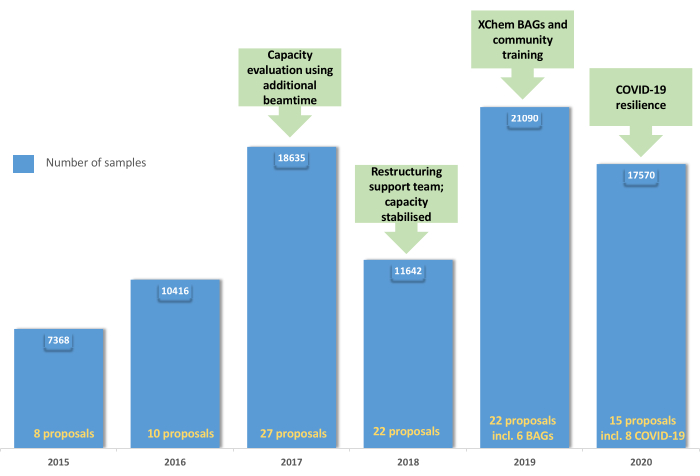
Figura 5: Evolución del programa de usuarios de XChem: El gráfico muestra la adopción y consolidación del programa de usuarios desde 2015 hasta 2019 con la creación de BAG en 2019 y la resiliencia de la plataforma durante la pandemia de COVID-19 en 2020. Haga clic aquí para ver una versión más grande de esta figura.
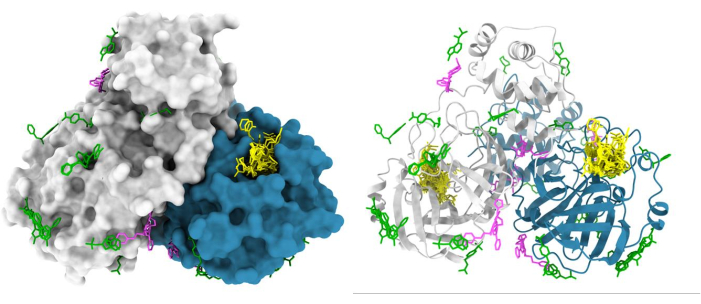
Figura 6: Resultados representativos de la pantalla de fragmentos XChem. El dímero de la proteasa principal del SARS-CoV2 (Mpro) se representa en la superficie con los impactos del sitio activo que se muestran en amarillo, los golpes alostéricos putativos que se muestran en magenta y los artefactos de superficie/empaque de cristales que se muestran en verde. La figura se realizó utilizando las entradas de Chimera y Mpro PDB de la deposición grupal G_1002156. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El proceso descrito en este documento ha sido ampliamente probado por la comunidad de usuarios y la adaptabilidad de los protocolos descritos aquí es clave para manejar la amplia variedad de proyectos que normalmente se encuentran en la plataforma. Sin embargo, son necesarios algunos requisitos previos del sistema cristalino.
Para cualquier campaña de cribado de fragmentos llevada a cabo mediante cristalografía de rayos X, es fundamental contar con un sistema cristalino reproducible y robusto. Como el protocolo estándar XChem implica la adición del fragmento directamente a la gota de cristal, la optimización debe centrarse en el número de gotas que contienen cristales de alta calidad en lugar del número total de cristales. Si las gotas contienen varios cristales, entonces son efectivamente redundantes, aunque pueden aliviar el proceso de recolección. Además, transferir el protocolo de cristalización del instituto de origen a las instalaciones in situ puede ser un reto. Por lo general, esto se logra mejor utilizando la siembra de cristales para promover la nucleación reproducible54 y, por lo tanto, una buena práctica es que los usuarios proporcionen existencias de semillas junto con sus soluciones de proteínas y cristalización.
Para garantizar una buena solubilidad y soporte de los compuestos, las altas concentraciones de remojo destinadas a impulsar la unión de fragmentos débiles, las bibliotecas de fragmentos se proporcionan en disolventes orgánicos, específicamente DMSO y etilenglicol. El suministro de dos disolventes diferentes ofrece a los usuarios una alternativa para los cristales que no toleran el DMSO en absoluto, o cuando ocluye la unión de fragmentos en un sitio de interés. Los usuarios pueden suministrar bibliotecas alternativas en tampón acuoso: los compuestos se dispensarán bien siempre que estén completamente disueltos y formateados en placas compatibles con el robot dispensador de líquidos.
Para los proyectos en los que no es posible encontrar un disolvente orgánico apropiado que solubilice la biblioteca y sea tolerado por el sistema cristalino, un procedimiento alternativo es utilizar compuestos secos como se establece en BESSY55.
En la comunidad, existe una pregunta de larga data sobre la capacidad de remojar compuestos en cristales cultivados en condiciones de cristalización que contienen altas concentraciones de sal. Prácticamente, se observa una mayor precipitación de los compuestos y una rápida formación de cristales de sal en la etapa de recolección, que se reduce mediante la aplicación de un ambiente húmedo alrededor del área de recolección. En general, las campañas de cribado en sistemas cristalinos de condiciones de alta cristalización salina dan una tasa de aciertos comparable a la de condiciones de baja salinidad.
Las etapas iniciales del proceso XChem (pruebas de tolerancia a disolventes y pre-selección) son experimentos relativamente pequeños y rápidos, pero permiten una decisión clara de ir o no ir para el proyecto. Lo más doloroso es que será necesario encontrar sistemas de cristal alternativos si no se tolera ninguno de los dos disolventes, o si la preselección da como resultado una tasa de aciertos muy baja. Por el contrario, si tienen éxito, los resultados informan directamente la condición de remojo que se utilizará para el experimento de detección y la mejor estrategia para la recopilación de datos. Dado que la calidad de los datos, especialmente la resolución, afectará a la calidad de la densidad de electrones para la identificación y el análisis de los resultados, el objetivo es remojar a la concentración de compuestos más alta posible que no tenga un efecto perjudicial sobre la calidad de la difracción (con la mayoría de los conjuntos de datos (~80%) difractando a una resolución de 2,8 Å o mejor).
El proceso de análisis de datos se agiliza dentro de XChemExplorer, que se basa en el software PanDDA para la detección de aglutinantes débiles y permite a los usuarios visualizar y revisar rápidamente los resultados de la campaña de detección. XChemExplorer importa los resultados del procesamiento de datos de los paquetes disponibles en Diamond (DIALS16, autoPROC30, STARANISO31 y Xia214) con límites de resolución determinados por el método estándar para cada paquete (es decir, CC1/2 = 0,3). De forma predeterminada, la selección del conjunto de datos se basa en una puntuación calculada a partir de I/sigI, completitud y una serie de reflexiones únicas, pero se pueden seleccionar resultados de procesamiento específicos para su uso tanto globalmente como para muestras individuales25. Los datos también se excluyen del análisis de PanDDA en función de criterios que incluyen la resolución, laR libre y la diferencia en el volumen de celda unitaria entre los datos de referencia y los de destino (los valores predeterminados son 3,5 Å, 0,4 y 12% respectivamente), de modo que los cristales mal difractados, mal centrados o mal indexados no afectan al análisis.
El algoritmo PanDDA aprovecha el número sustancial de conjuntos de datos recopilados durante una campaña de fragmentos para detectar ligandos de ocupación parcial que no son visibles en los mapas cristalográficos estándar. Inicialmente, PanDDA utiliza los datos recopilados durante las pruebas de tolerancia al solvente y los pasos previos a la selección para preparar un mapa de densidad promedio que luego se utiliza para crear un modelo de estado fundamental. Dado que este modelo se utilizará para todos los pasos de análisis posteriores, es vital que represente con precisión la proteína no ligada en las condiciones utilizadas para el cribado de fragmentos. A continuación, PanDDA utiliza un análisis estadístico para identificar los ligandos unidos, generando un mapa de eventos para el estado unido del cristal. Se genera un mapa de eventos restando la fracción no unida del cristal del conjunto de datos de ocupación parcial y presenta lo que se observaría si el ligando estuviera unido a plena ocupación. Incluso los fragmentos que aparecen claros en los mapas convencionales de 2mFo-DF c pueden ser erróneos si no se consultan los mapas de eventos32. Si bien PanDDA es un método poderoso para identificar conjuntos de datos que difieren de los mapas promedio (que generalmente es indicativo de la unión de fragmentos) y se proporcionan métricas como RSCC, RSZD, relación de factor B y RMSD durante el refinamiento para el beneficio del usuario, el usuario es responsable en última instancia de decidir si la densidad observada representa con precisión el ligando esperado y la conformación más adecuada.
Tras el análisis y el refinamiento de los datos, es posible que todos los usuarios depositen simultáneamente varias estructuras en el Banco de Datos de Proteínas (PDB) utilizando XChemExplorer. Para cada fragmento-pantalla, se realizan dos deposiciones grupales. La primera deposición contiene todos los modelos enlazados a fragmentos, con coeficientes para calcular mapas de eventos PanDDA incluidos en archivos MMCIF. La segunda deposición proporciona el modelo de estado fundamental que lo acompaña, junto con los factores de estructura medidos de todos los conjuntos de datos del experimento: estos datos se pueden utilizar para reproducir el análisis PanDDA y para desarrollar algoritmos futuros. En cuanto a las estructuras de los hits, cuando la ocupación de fragmentos es baja, el refinamiento se comporta mejor si los modelos son un compuesto de las estructuras de estado fundamental unidas al ligando y confusas32; Sin embargo, la práctica es depositar solo las fracciones de estado ligado, ya que los modelos compuestos completos son en general complejos y difíciles de interpretar. Como resultado, algunos indicadores de calidad recalculados por el AP (en particular, R/Rfree) a veces son ligeramente elevados. También es posible proporcionar todos los datos en bruto utilizando plataformas como Zenodo56, aunque actualmente no es compatible con el pipeline XChem.
En general, desde su funcionamiento en 2016, se han podido identificar ligandos fragmentados en más del 95% de las dianas mediante este procedimiento. La experiencia de los muchos proyectos que XChem ha apoyado se destiló en las mejores prácticas para la preparación de cristales33, mientras que se desarrolló una biblioteca de fragmentos que implementó el concepto equilibrado para ayudar a la progresión de fragmentos29, lo que también ayudó a establecer la práctica de hacer pública la composición de la biblioteca. La plataforma ha demostrado la importancia de una infraestructura bien mantenida y procesos documentados, que se detallan aquí, y ha permitido evaluar otras bibliotecas de fragmentos 57,58, comparar bibliotecas48 e informar el diseño de la biblioteca colaborativa EUOpenscreen-DRIVE 59,60.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Este trabajo representa un gran esfuerzo conjunto entre la Fuente de Luz de Diamante y el Consorcio Genómico de Estructuras. Los autores desean agradecer a los diversos grupos de apoyo de Diamond y al grupo MX por su contribución a la automatización de la línea de luz i04-1 y por proporcionar una recopilación de datos optimizada y canalizaciones de procesamiento automático, que se ejecutan comúnmente en todas las líneas de luz MX. También les gustaría agradecer al grupo SGC PX por su resiliencia al ser los primeros usuarios en probar la configuración y a Evotec por ser el primer usuario industrial serio. Este trabajo contó con el apoyo de iNEXT-Discovery (Grant 871037) financiado por el programa Horizonte 2020 de la Comisión Europea.
Materiales
| Name | Company | Catalog Number | Comments |
| DSI-poised library | Enamine | DSI-896 | fragment library |
| Echo 550 and 650 series | Beckman-Coulter | acoustic dispensing system | |
| Echo microplates | Beckman-Coulter | 001-12380; 001-8768; 001-6025 | 1536-well and 384-well microplates |
| Shifter | Oxford Lab Technology | harvesting device | |
| Microplate centrifuge with a swing-out rotor | Sigma | model 11121 | microplate centrifuge |
| 3-drops crystallisation plates | Swissci | 3W96T-UVP | Crystallisation plates |
| Formulatrix plate imager and Rockmaker software | Formulatrix | Crystallisation plates imaging device |
Referencias
- Erlanson, D. A., Fesik, S. W., Hubbard, R. E., Jahnke, W., Jhoti, H. Twenty years on: The impact of fragments on drug discovery. Nature Reviews Drug Discovery. 15 (9), 605-619 (2016).
- Jacquemard, C., Kellenberger, E. A bright future for fragment-based drug discovery: what does it hold. Expert Opinion on Drug Discovery. 14 (5), 413-416 (2019).
- Jahnke, W., et al. Fragment-to-lead medicinal chemistry publications in 2019. Journal of Medicinal Chemistry. 63 (24), 15494-15507 (2019).
- Li, Q. Application of fragment-based drug discovery to versatile targets. Frontiers in Molecular Biosciences. 7, 180 (2020).
- Kirsch, P., Hartman, A. M., Hirsch, A. K. H., Empting, M. Concepts and core principles of fragment-based drug design. Molecules. 24 (23), 4309 (2019).
- Patel, D., Bauman, J. D., Arnold, E. Advantages of crystallographic fragment screening: functional and mechanistic insights from a powerful platform for efficient drug discovery. Progress in Biophysics and Molecular Biology. 116 (2-3), 92-100 (2014).
- Wasserman, S., et al. Automated synchrotron crystallography for drug discovery: the LRL-CAT beamline at the APS. Acta Crystallographica Section A Foundations of Crystallography. 67 (1), 46-47 (2011).
- Hartshorn, M. J. Fragment-based lead discovery using X-ray crystallography. Journal of Medicinal Chemistry. 48 (2), 403-413 (2005).
- Arzt, S., et al. Automation of macromolecular crystallography beamlines. Progress in Biophysics and Molecular Biology. 89 (2), 124-152 (2005).
- Beteva, A. High-throughput sample handling and data collection at synchrotrons: Embedding the ESRF into the high-throughput gene-to-structure pipeline. Acta Crystallographica Section D, Biological Crystallography. 62, 1162-1169 (2006).
- Papp, G., et al. FlexED8: The first member of a fast and flexible sample-changer family for macromolecular crystallography. Acta Crystallographica. Section D, Structural Biology. 73, 841-851 (2017).
- Casanas, A., et al. EIGER detector: Application in macromolecular crystallography. Acta Crystallographica Section D, Structural Biology. 72, 1036-1048 (2016).
- Henrich, B., et al. PILATUS: A single photon counting pixel detector for X-ray applications. Nuclear Instruments and Methods in Physics Research, Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 607 (1), 247-249 (2009).
- Winter, G., Lobley, C. M. C., Prince, S. M. Decision making in xia2. Acta Crystallographica Section D, Biological Crystallography. 69, 1260-1273 (2013).
- Winter, G., McAuley, K. E. Automated data collection for macromolecular crystallography. Methods. 55 (1), 81-93 (2011).
- Winter, G., et al. DIALS: Implementation and evaluation of a new integration package. Acta Crystallographica Section D, Structural Biology. 74, 85-97 (2018).
- Bowler, M. W. MASSIF-1: A beamline dedicated to the fully automatic characterization and data collection from crystals of biological macromolecules. Journal of Synchrotron Radiation. 22 (6), 1540-1547 (2015).
- Von Stetten, D., et al. ID30A-3 (MASSIF-3) - A beamline for macromolecular crystallography at the ESRF with a small intense beam. Journal of Synchrotron Radiation. 27, 844-851 (2020).
- Cipriani, F., et al. CrystalDirect: a new method for automated crystal harvesting based on laser-induced photoablation of thin films. Acta Crystallographica. Section D, Biological Crystallography. 68, 1393-1399 (2012).
- . Helmholtz Zentrum Berlin Available from: https://www.helmholtzberlin.de/forschung/oe/np/gmx/fragment-screening/index_en.html (2021)
- Lima, G. M. A., et al. FragMAX: the fragment-screening platform at the MAX IV Laboratory. Acta crystallographica. Section D, Structural biology. 76 (8), 771-777 (2020).
- Ng, J. T., Dekker, C., Kroemer, M., Osborne, M., Von Delft, F. Using textons to rank crystallization droplets by the likely presence of crystals. Acta Crystallographica. Section D, Biological Crystallography. 70, 2702-2718 (2014).
- Collins, P. M., et al. Gentle, fast and effective crystal soaking by acoustic dispensing. Acta Crystallographica. Section D, Structural Biology. 73, 246-255 (2017).
- Wright, N. D., et al. The low-cost Shifter microscope stage transforms the speed and robustness of protein crystal harvesting. Acta Crystallographica. Section D, Structural Biology. 77, 62-74 (2021).
- Krojer, T., et al. The XChemExplorer graphical workflow tool for routine or large-scale protein-ligand structure determination. Acta Crystallographica. Section D, Structural Biology. 73, 267-278 (2017).
- Pearce, N. M., et al. A multi-crystal method for extracting obscured crystallographic states from conventionally uninterpretable electron density. Nature Communications. 8, 15123 (2017).
- . Fragalysis Available from: https://fragalysis.diamond.ac.uk (2021)
- . Diamond Light Source Ltd Available from: https://www.diamond.ac.uk/Instruments/Mx/Fragment-Screening.html (2021)
- Cox, O. B., et al. A poised fragment library enables rapid synthetic expansion yielding the first reported inhibitors of PHIP(2), an atypical bromodomain. Chemical Science. 7 (3), 2322-2330 (2016).
- Vonrhein, C., et al. Data processing and analysis with the autoPROC toolbox. Acta Crystallographica. Section D, Biological Crystallography. 67, 293-302 (2011).
- Vonrhein, C., et al. Advances in automated data analysis and processing within autoPROC , combined with improved characterisation, mitigation and visualisation of the anisotropy of diffraction limits using STARANISO. Acta Crystallographica Section A: Foundations and Advances. 74 (1), 360 (2018).
- Pearce, N. M., Krojer, T., Von Delft, F. Proper modelling of ligand binding requires an ensemble of bound and unbound states. Acta Crystallographica. Section D, Structural Biology. 73, 265-266 (2017).
- Collins, P. M., et al. Achieving a good crystal system for crystallographic x-ray fragment screening. Methods in Enzymology. 610, 251-264 (2018).
- Delageniere, S., et al. ISPyB: an information management system for synchrotron macromolecular crystallography. Bioinformatics. 27 (22), 3186-3192 (2011).
- Fisher, S. J., Levik, K. E., Williams, M. A., Ashton, A. W., McAuley, K. E. SynchWeb: a modern interface for ISPyB. Journal of Applied Crystallography. 48, 927-932 (2015).
- Ginn, H. M., et al. SynchLink: an iOS app for ISPyB. Journal of Applied Crystallography. 47, 1781-1783 (2014).
- . Diamond Light Source Ltd Available from: https://www.diamond.ac.uk/Instruments/Mx/Common/Common-Manual/Data-Analysis/Reprocessing-in-ISPyB.html (2021)
- Wojdyr, M., Keegan, R., Winter, G., Ashton, A. DIMPLE - a pipeline for the rapid generation of difference maps from protein crystals with putatively bound ligands. Acta Crystallographica. Section A, Foundations of Crystallography. 69, 299 (2013).
- Long, F., et al. AceDRG: A stereochemical description generator for ligands. Acta Crystallographica. Section D, Structural Biology. 73, 112-122 (2017).
- Moriarty, N. W., Grosse-Kunstleve, R. W., Adams, P. D. Electronic ligand builder and optimization workbench (eLBOW): A tool for ligand coordinate and restraint generation. Acta Crystallographica. Section D, Biological Crystallography. 65, 1074-1080 (2009).
- Emsley, P., Lohkamp, B., Scott, W. G., Cowtan, K. Features and development of Coot. Acta Crystallographica. Section D, Biological Crystallography. 66, 486-501 (2010).
- Murshudov, G. N., Vagin, A. A., Dodson, E. J. Refinement of macromolecular structures by the maximum-likelihood method. Acta Crystallographica. Section D, Biological Crystallography. 53, 240-255 (1997).
- Bricogne, G., et al. Buster version 2.10.3. Global Phasing Ltd. , (2017).
- Chen, V. B., et al. MolProbity: All-atom structure validation for macromolecular crystallography. Acta Crystallographica. Section D, Biological Crystallography. 66, 12-21 (2010).
- Bruno, I. J., et al. Retrieval of crystallographically-derived molecular geometry information. Journal of Chemical Information and Computer Sciences. 44 (6), 2133-2144 (2004).
- Delbart, F., et al. An allosteric binding site of the α7 nicotinic acetylcholine receptor revealed in a humanized acetylcholine-binding protein. TheJournal of Biological Chemistry. 293, 2534-2545 (2018).
- Douangamath, A., et al. Crystallographic and electrophilic fragment screening of the SARS-CoV-2 main protease. Nature Communications. 11 (1), 5047 (2020).
- Guo, J., et al. In crystallo-screening for discovery of human norovirus 3C-like protease inhibitors. Journal of Structural Biology: X. 4, 100031 (2020).
- Keedy, D. A., et al. An expanded allosteric network in PTP1B by multitemperature crystallography, fragment screening, and covalent tethering. eLife. 7, 36307 (2018).
- McIntyre, P. J., et al. Characterization of three druggable hot-spots in the aurora-a/tpx2 interaction using biochemical, biophysical, and fragment-based approaches. ACS Chemical Biology. 12 (11), 2906-2914 (2017).
- Thomas, S. E., et al. Structure-guided fragmentbased drug discovery at the synchrotron: Screening binding sites and correlations with hotspot mapping. Philosophical Transactions. Series A, Mathematical, Physical and Engineering Sciences. 377 (2147), 20180422 (2019).
- Nichols, C., et al. Mining the PDB for tractable cases where x-ray crystallography combined with fragment screens can be used to systematically design protein-protein inhibitors: Two test cases illustrated by IL1β-IL1R and p38α-TAB1 complexes. Journal of Medicinal Chemistry. 63 (14), 7559-7568 (2020).
- D'Arcy, A., Bergfors, T., Cowan-Jacob, S. W., Marsh, M. Microseed matrix screening for optimization in protein crystallization: What have we learned. Acta Crystallographica. Section F, Structural Biology Communications. 70, 1117-1126 (2014).
- Wollenhaupt, J., et al. F2X-Universal and F2X-Entry: Structurally diverse compound libraries for crystallographic fragment screening. Structure. 28 (6), 694-706 (2020).
- . Zenodo Available from: https://zenodo.org (2021)
- Foley, D. J., et al. Synthesis and demonstration of the biological relevance of sp(3) -rich scaffolds distantly related to natural product frameworks. Chemistry. 23 (60), 15227-15232 (2017).
- Kidd, S. L., et al. Demonstration of the utility of DOS-derived fragment libraries for rapid hit derivatisation in a multidirectional fashion. Chemical Science. 11 (39), 10792-10801 (2020).
- . EU-openscreen ERIC Available from: https://www.eu-openscreen.eu/ (2021)
- Schuller, M., et al. Fragment binding to the Nsp3 macrodomain of SARS-CoV-2 identified through crystallographic screening and computational docking. bioRxiv. 393405, (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados