Method Article
Ottenere uno screening efficiente dei frammenti presso l'impianto XChem di Diamond Light Source
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo articolo descrive l'intero processo XChem per lo screening dei frammenti a base di cristalli, a partire dalla richiesta di accesso e da tutte le fasi successive alla diffusione dei dati.
Abstract
Nella scoperta di farmaci basati su frammenti, centinaia o spesso migliaia di composti più piccoli di ~300 Da vengono testati contro la proteina di interesse per identificare entità chimiche che possono essere sviluppate in potenti candidati farmaci. Poiché i composti sono piccoli, le interazioni sono deboli e il metodo di screening deve quindi essere altamente sensibile; Inoltre, le informazioni strutturali tendono ad essere cruciali per l'elaborazione di questi colpi in composti simili al piombo. Pertanto, la cristallografia proteica è sempre stata una tecnica gold standard, ma storicamente troppo impegnativa per trovare un uso diffuso come screening primario.
Gli esperimenti iniziali di XChem sono stati dimostrati nel 2014 e poi testati con collaboratori accademici e industriali per convalidare il processo. Da allora, un grande sforzo di ricerca e un significativo tempo di trasmissione hanno semplificato la preparazione dei campioni, sviluppato una libreria di frammenti con possibilità di follow-up rapido, automatizzato e migliorato la capacità della linea di luce I04-1 per la raccolta di dati non presidiati e implementato nuovi strumenti per la gestione dei dati, l'analisi e l'identificazione dei risultati.
XChem è ora una struttura per lo screening di frammenti cristallografici su larga scala, che supporta l'intero processo di deposizione dei cristalli ed è accessibile agli utenti accademici e industriali di tutto il mondo. Dal 2016 il programma accademico peer-reviewed è stato sviluppato attivamente per accogliere progetti di portata scientifica il più ampia possibile, compresi progetti ben convalidati ed esplorativi. L'accesso accademico è assegnato attraverso inviti semestrali per proposte sottoposte a revisione paritaria e il lavoro proprietario è organizzato dal gruppo di collegamento industriale di Diamond. Questo flusso di lavoro è già stato applicato di routine a oltre un centinaio di bersagli provenienti da diverse aree terapeutiche e identifica efficacemente i leganti deboli (tasso di successo dell'1%-30%), che fungono sia da punti di partenza di alta qualità per la progettazione di composti che forniscono ampie informazioni strutturali sui siti di legame. La resilienza del processo è stata dimostrata dal continuo screening dei bersagli di SARS-CoV-2 durante la pandemia di COVID-19, compreso un turn-around di 3 settimane per la proteasi principale.
Introduzione
La Fragment-Based Drug Discovery (FBDD) è una strategia ampiamente utilizzata per la scoperta di piombi e, dalla sua comparsa 25 anni fa, ha fornito quattro farmaci per uso clinico e più di 40 molecole sono state avanzate agli studi clinici 1,2,3. I frammenti sono piccole entità chimiche di solito con un peso molecolare di 300 Da o meno. Sono selezionati per la loro bassa complessità chimica, che fornisce buoni punti di partenza per lo sviluppo di inibitori altamente efficienti dal ligando con eccellenti proprietà fisico-chimiche. Le loro dimensioni significano che campionano il paesaggio di legame delle proteine in modo più completo rispetto alle librerie di composti più grandi simili a farmaci o piombo, e quindi rivelano anche punti caldi e siti allosterici putativi. In combinazione con le informazioni strutturali, i frammenti forniscono una mappa dettagliata delle potenziali interazioni molecolari tra proteina e ligando. Tuttavia, rilevare e convalidare in modo affidabile tali entità, che tendono a legarsi debolmente alla proteina bersaglio, richiede una serie di metodi di screening biofisico robusti e sensibili come la risonanza plasmonica di superficie (SPR), la risonanza magnetica nucleare (NMR) o la calorimetria di titolazione isotermica (ITC)4,5.
La cristallografia a raggi X è una parte essenziale del toolkit FBDD: è abbastanza sensibile da identificare i leganti deboli e fornisce direttamente informazioni strutturali sulle interazioni a livello molecolare. È complementare ad altri screening biofisici e di solito è essenziale per far progredire i frammenti in composti di piombo; richiede sistemi cristallini di alta qualità, il che significa che la cristallizzazione è altamente riproducibile e i cristalli si diffrattano idealmente con una risoluzione migliore di 2,8 Å.
Storicamente, è stato molto difficile utilizzare la cristallografia come screening del frammento primario 6,7,8, sia nel mondo accademico che nell'industria. Al contrario, i sincrotroni hanno ottenuto miglioramenti dell'ordine di grandezza nella robotica, nell'automazione 9,10,11 e nella tecnologia dei rivelatori 12,13 e, combinati con una potenza di calcolo e algoritmi di elaborazione dei dati altrettanto accelerati14,15,16, i set di dati di diffrazione completi possono essere misurati in pochi secondi e un gran numero di essi completamente incustoditi, come sperimentato da LillyCAT7 e successivamente MASSIF17,18 (European Synchrotron Radiation Facility (ESRF)). Ciò ha portato i sincrotroni a sviluppare piattaforme altamente semplificate per rendere accessibile a un'ampia comunità di utenti lo screening dei frammenti a base di cristalli come schermo primario (XChem at Diamond; CrystalDirect presso EMBL/ESRF19; BESSY all'Helmholtz-Zentrum di Berlino20; FragMax a MaxIV21).
Questo articolo documenta i protocolli che costituiscono la piattaforma XChem per lo screening dei frammenti mediante cristallografia a raggi X, dalla preparazione del campione ai risultati strutturali finali degli hit modellati in 3D. La pipeline (Figura 1) ha richiesto lo sviluppo di nuovi approcci per l'identificazione dei cristalli 22, l'ammollo 23 e la raccolta 24, nonché un software di gestione dei dati25 e un approccio algoritmico per l'identificazione dei frammenti 26 che è ora ampiamente utilizzato nella comunità. La tecnologia di raccolta dei cristalli è ora venduta da un fornitore (vedi Tabella dei materiali), e la disponibilità aperta degli strumenti ha permesso ad altri sincrotroni di adattarli per creare piattaforme equivalenti21. I progetti in corso riguardano l'analisi dei dati, il completamento del modello e la diffusione dei dati attraverso la piattaforma Fragalysis27. Il laboratorio di preparazione dei campioni è adiacente alla linea di luce I04-1, semplificando la logistica del trasferimento di centinaia di campioni congelati alla linea di luce e il tempo di trasmissione dedicato su I04-1 consente un rapido feedback a raggi X per guidare la campagna.
XChem è parte integrante del programma utente di Diamond, con due chiamate all'anno (inizio aprile e ottobre). Il processo di revisione paritaria è stato perfezionato in consultazione con esperti nella scoperta di farmaci provenienti dal mondo accademico e industriale. Insieme a un forte caso scientifico, il processo di proposta28 richiede ai candidati di autovalutare non solo la prontezza del sistema cristallino, ma anche la loro esperienza nei metodi biochimici e biofisici ortogonali e la capacità di far progredire i risultati di screening attraverso la chimica di follow-up. Anche le modalità di accesso si sono evolute per accogliere la comunità multidisciplinare degli utenti:
Il livello 1 (progetto singolo ) riguarda i progetti in fase esplorativa e non è necessario che siano in atto strumenti di convalida dei riscontri positivi (strumenti biofisici o biochimici) e strategie di follow-up. Se accettato, al progetto viene concesso un numero ridotto di turni di beamtime, sufficienti per la prova di concetto.
Il livello 2 (progetto singolo) è per progetti ben convalidati e richiede l'adozione di strumenti a valle e strategie di follow-up. Se accettato, al progetto viene assegnato un tempo di trasmissione sufficiente per una campagna di screening completo dei frammenti. I singoli progetti (Tier 1 o Tier 2) devono essere completati entro i 6 mesi del periodo di assegnazione (da aprile a settembre o da ottobre a marzo).
Il Block Allocation Group (BAG) è per un consorzio di gruppi e progetti, in cui è in atto un solido processo di selezione degli obiettivi e di definizione delle priorità all'interno del BAG, insieme a una chiara pipeline di follow-up. I BAG devono avere almeno un esperto (superuser) completamente formato XChem, che coordini le loro attività con lo staff Diamond e formi i membri del BAG. Il numero assegnato di turni di beamtime è definito dal numero di progetti scientificamente solidi nel BAG e viene rivalutato per periodo di assegnazione sulla base del rapporto del BAG. L'accesso è disponibile per 2 anni.
L'esperimento XChem è diviso in tre fasi, con un punto di decisione per ciascuna di esse: test di tolleranza al solvente, pre-screening e schermata principale (Figura 2). Il test di tolleranza al solvente aiuta a definire i parametri di ammollo, la quantità di solvente (DMSO, glicole etilenico o altri crioprotettori se necessario) che il sistema cristallino può tollerare e per quanto tempo. Le concentrazioni di solvente variano in genere dal 5% al 30% in almeno due punti temporali. I dati di diffrazione vengono raccolti e confrontati con la diffrazione di base del sistema cristallino; Questo determinerà i parametri di ammollo per la fase successiva. Per il pre-screening, 100-150 composti vengono immersi utilizzando le condizioni determinate nel test del solvente e il suo scopo è confermare che i cristalli possono tollerare i composti in tali condizioni. Se necessario, il crioprotettore viene successivamente aggiunto alle gocce già contenenti i frammenti. I criteri di successo sono che l'80% o più dei cristalli sopravviva abbastanza bene da produrre dati di diffrazione di buona e costante qualità; Se questo fallisce, le condizioni di ammollo vengono solitamente riviste modificando il tempo di ammollo o la concentrazione del solvente. Dopo un pre-screening di successo, il resto dei composti scelti per l'esperimento può essere impostato utilizzando i parametri finali.
La libreria DSI-poised (vedi Tabella dei Materiali) è stata appositamente progettata per consentire una rapida progressione di follow-up utilizzando la chimica in bilico29 ed è stata la libreria di punta della struttura. È disponibile per gli utenti a una concentrazione di 500 mM in DMSO. Gli utenti accademici possono anche accedere ad altre biblioteche fornite dai collaboratori (oltre 2.000 composti in totale) a concentrazioni di 100-500 mM in DMSO (un elenco completo può essere trovato sul sito web28). Gran parte della collezione complessiva è disponibile anche in glicole etilenico, per sistemi cristallini che non tollerano il DMSO. Gli utenti possono anche portare le proprie librerie, purché in piastre compatibili con il sistema di gestione dei liquidi acustici (vedi Tabella dei materiali).
Per tutte e tre le fasi dell'esperimento (caratterizzazione del solvente, pre-screening o schermo intero), le seguenti procedure di preparazione del campione sono identiche (Figura 3): selezione del luogo di erogazione del composto attraverso l'imaging e il targeting delle gocce di cristallizzazione con TeXRank22; dosaggio in gocce utilizzando il sistema di erogazione acustica del liquido sia per il solvente che per i composti23; raccolta efficiente dei cristalli con il Crystal shifter24; e caricamento delle informazioni sui campioni nel database delle linee di luce (ISPyB). L'interfaccia corrente per la progettazione e l'esecuzione degli esperimenti è un'applicazione basata su Excel (SoakDB), che genera i file di input necessari per le diverse apparecchiature della piattaforma e tiene traccia e registra tutti i risultati in un database SQLite. Gli scanner di codici a barre vengono utilizzati in varie fasi del processo per aiutare a tracciare i campioni e questi dati vengono aggiunti al database.
I dati di diffrazione vengono raccolti in modalità non presidiata utilizzando un tempo di fascio dedicato sulla linea di luce I04-1. Sono disponibili due modalità di centraggio, vale a dire ottica e basata sui raggi X17. Per i cristalli a forma di ago e bastoncino, si consiglia la centratura dei raggi X, mentre i cristalli più grossi generalmente supportano la modalità ottica, che è più veloce e, quindi, consente di raccogliere più campioni nel tempo di fascio assegnato. A seconda della risoluzione dei cristalli (stabilita prima di entrare nella piattaforma) la raccolta dei dati può essere di 60 s o 15 s di esposizione totale. La raccolta dei dati durante la fase di test del solvente di solito informa quale combinazione funzionerà meglio con le prestazioni della linea di luce I04-1.
Il grande volume di analisi dei dati viene gestito tramite XChemExplorer (XCE)25, che può essere utilizzato anche per avviare la fase di identificazione dei risultati utilizzando PanDDA26. XCE è uno strumento per la gestione dei dati e il flusso di lavoro che supporta l'analisi su larga scala delle strutture proteina-ligando (Figura 4); legge tutti i risultati dell'elaborazione automatica dai dati raccolti presso Diamond Light Source (DIALS16, Xia214, AutoPROC30 e STARANISO31) e seleziona automaticamente uno dei risultati in base alla qualità dei dati e alla somiglianza con un modello di riferimento. È importante che il modello sia rappresentativo del sistema cristallino utilizzato per lo screening XChem e che includa tutte le acque o altre molecole di solvente, nonché tutti i cofattori, i ligandi e le conformazioni alternative visibili nei cristalli imbevuti solo di solvente. La qualità di questo modello di riferimento avrà un impatto diretto sulla quantità di lavoro necessaria durante la fase di costruzione e perfezionamento del modello. PanDDA viene utilizzato per analizzare tutti i dati e identificare i siti di associazione. Allinea le strutture a una struttura di riferimento, calcola le mappe statistiche, identifica gli eventi e calcola le mappe degli eventi26,32. Nel paradigma PanDDA, non è né necessario né auspicabile costruire il modello cristallografico completo; Ciò che deve essere modellato è solo la vista della proteina in cui un frammento è legato (il modello dello stato legato), quindi l'attenzione deve essere solo sulla costruzione del ligando e dei residui circostanti/molecole di solvente secondo la mappa degli eventi32.
Protocollo
1. Presentazione della proposta progettuale
- Contenuto della proposta: dal momento che il programma XChem è in eccesso, le informazioni approfondite e complete nella proposta sono fondamentali per superare la revisione paritaria.
- Fai il caso! Presentare l'importanza dell'obiettivo e inserirlo in un contesto più ampio.
- Articolare la strategia dopo la campagna di screening dei frammenti: i metodi ortogonali in atto per convalidare i risultati e come farli progredire. Metti in fila le collaborazioni, se necessario.
- A causa dell'intensa parte di laboratorio e di analisi dei dati, si consiglia vivamente di assegnare in anticipo un cristallografo esperto.
- Un robusto sistema di cristalli è la chiave per eliminare le variazioni tecniche e gli utenti dovrebbero affrontare questi punti essenziali.
- Assicurarsi che le condizioni di cristallizzazione producano gocce riproducibili con cristalli di qualità diffratta simile in piastre adatte per l'uso sulla piattaforma con un volume del serbatoio di 30 μL (o meno) e una dimensione della goccia compresa tra 200-500 nL. Idealmente, più del 50% delle gocce in una piastra avrà cristalli di almeno 35 μm di dimensione33.
- Garantire una qualità di diffrazione costante dei cristalli (2,6 Å o superiore).
- Verificare l'idoneità del sistema cristallino per lo screening dei frammenti, compreso l'impacchettamento dei cristalli e l'accessibilità dei siti noti. L'evidenza precedente di una molecola legata in quei siti è spesso rassicurante.
- Fai il caso! Presentare l'importanza dell'obiettivo e inserirlo in un contesto più ampio.
2. Preparazione alla visita
- Trasferimento dei protocolli di cristallizzazione per la cristallizzazione in loco.
- Fornire 2 x 50 mL di soluzione del serbatoio, pronta per l'uso.
- Fornire la soluzione proteica alla concentrazione necessaria per la cristallizzazione, pronta all'uso in aliquote di 30-50 μL.
- Fornire 10 mL della soluzione tampone proteica.
- Fornire lo stock di semi (anche se non necessario nel protocollo di cristallizzazione).
NOTA: La semina favorisce la riproducibilità della cristallizzazione e accelera il tempo di nucleazione33. - Compilare il modulo informativo sulla cristallizzazione disponibile sul sito web di XChem28.
- Fornisci le informazioni di stoccaggio nel modulo di spedizione disponibile sul sito web di XChem28.
- Installa NoMachine e configura un desktop remoto su Diamond (https://www.diamond.ac.uk/Users/Experiment-at-Diamond/IT-User-Guide/Not-at-DLS/Nomachine.html).
- Genera e trasferisci un buon modello di riferimento, in consultazione con un cristallografo esperto o con il personale di supporto di XChem.
3. Esperimento di screening dei frammenti
- Definizione della posizione di erogazione del composto.
- Imaging di lastre di cristallizzazione.
- Immagine di tutte le lastre di cristallo (vedi Tabella dei materiali) necessarie per l'esperimento negli imager di lastre di cristallo (vedi Tabella dei materiali). Utilizzando il software imager, generare i nomi delle piastre nella directory corretta per il tipo di targa nel seguente formato: Proposta Number_Plate numero.
- Stampare i codici a barre (fare clic con il pulsante destro del mouse sul nome della targa e selezionarli dal menu), posizionarli sul lato opposto della targa rispetto alle lettere della riga, inserire le piastre nella porta di carico con il codice a barre rivolto lontano dall'utente.
- Utilizzare il software di controllo dell'imager, eseguire la scansione della porta di caricamento, fare clic con il pulsante destro del mouse sulle lastre, quindi selezionare Lastre immagine.
- Una volta completata l'imaging, rimuovere le piastre dall'imager.
- Scelta dei cristalli e della posizione del composto
NOTA: Le immagini delle goccioline di cristallizzazione vengono elaborate all'interno della pipeline Luigi utilizzando l'algoritmo Ranker basato sui testi di TexRank per classificare le goccioline in base alla probabile presenza di cristalli22. Questo richiede circa 10 minuti e le immagini saranno quindi disponibili in TexRank.- Apri TeXRank da un PC e seleziona il vassoio di cristallo dall'elenco in basso a destra o digitando il codice a barre nella casella in alto a sinistra.
- Selezionare il formato corretto dell'imager e la vista a pozzetto singolo. Muoviti attraverso le immagini della goccia e quando c'è un cristallo adatto per l'uso in un esperimento, fai clic con il pulsante destro del mouse lontano dal cristallo ma all'interno della goccia: l'obiettivo è quello di mirare a dove nella goccia aggiungere solvente / composti, quindi non vuoi colpire direttamente il cristallo23.
- Continuare attraverso l'intera piastra e una volta terminato selezionare il pulsante Echo 1 Target ; Salvare nella directory Crystal Targets sotto la visita pertinente. Non modificare il nome del file.
- Ripetere l'operazione per eventuali piastre aggiuntive.
- Imaging di lastre di cristallizzazione.
- Dosaggio di composti
- Generazione di file per l'erogazione di composti
- In SoakDB, immettere la selezione della libreria o le informazioni sul solvente nella tabella libreria/solvente.
- Immettere il volume di rilascio e il carico nell'elenco dei cristalli mirati.
- Generare i batch richiesti.
- Immettere i parametri di assorbimento. Fare clic su Calcola e quindi sul pulsante Esporta in sospeso . Per il solvente, aggiungere le varie concentrazioni alla tabella. In questo modo vengono generati i file da utilizzare nell'erogatore acustico.
- Se si utilizza il crioprotettore, inserire la concentrazione e creare i file allo stesso modo.
- Erogazione di soluzioni utilizzando l'erogatore acustico (vedi Tabella dei materiali)
- Prendere la piastra di origine (composti o solvente/crioprotettore) e far girare la piastra nella centrifuga per 2 minuti a 1.000 x g.
- Se si eroga solvente o crioprotettore, pipettare 30 μL nel relativo pozzetto su una piastra 384PP; Coprire con una pellicola microsigillante, quindi centrifugare come sopra.
- Aprire il software; selezionare Nuovo e scegliere la piastra del pozzetto sorgente corretta (384PP, 384LDV o 1536LDV) e la classe del liquido (DMSO, CP, BP o GP). Assicurarsi che sia selezionato il tipo di piastra corretto come piastra di destinazione. Quindi seleziona la casella Personalizzato e continua.
- Selezionare Importa e scegliere il file batch pertinente. Completare i passaggi di importazione come richiesto dal software.
- Utilizzare le mappe delle piastre per controllare la soluzione da erogare e le posizioni di destinazione.
- Eseguire il protocollo, seguendo le istruzioni man mano che vengono visualizzate. La soluzione (o le soluzioni) della piastra di origine verranno erogate nelle gocce di cristallo scelte.
- Conservare la piastra nell'incubatrice per il tempo necessario.
NOTA: Questi parametri sono determinati nella fase di caratterizzazione del solvente, la temperatura sarà di 4 °C o 20 °C a seconda della temperatura di crescita del cristallo e i tempi sono tipicamente compresi tra 1 ora e 3 ore.
- Generazione di file per l'erogazione di composti
- Raccolta dei cristalli con il dispositivo semiautomatico di raccolta dei cristalli (cfr. Tabella dei materiali).
NOTA: Se è necessaria la crioprotezione, ripetere il passaggio 3.2.2 per l'aggiunta di soluzioni crioprotettive sulle gocce di cristallo prima di raccogliere i campioni.- Preparazione per la raccolta
- Preparare i file necessari per la raccolta in SoakDB. Quando richiesto, verificare che gli ammolli siano terminati e che i lotti siano stati completati.
- Scansiona il numero di dischi necessari per l'esperimento con il numero di proposta corretto.
- Selezionare un vassoio delle anse di dimensioni appropriate per i cristalli (35 μm, 75 μm o 150 μm). È importante scegliere una dimensione dell'anello che corrisponda il più possibile alla dimensione del cristallo per consentire alla centratura automatica sulla linea di luce di essere più accurata, migliorare la qualità dei dati riducendo lo sfondo ed eliminare la necessità di crioprotettore.
- Apri il software pertinente e apri la scheda del flusso di lavoro.
- Scansiona i dischi nel software e scorri fino all'inizio dell'elenco, evidenziando il primo disco.
- Mettere i dischi in un dewar di schiuma e raffreddarli con azoto liquido.
- Scegli Importa file da SoakDB e seleziona il batch da raccogliere; Verificare se il lotto è assegnato al supporto sinistro. Viene visualizzato un elenco di lavoro.
- Prendi la piastra di cristallo, rimuovi il sigillo e inserisci il supporto sinistro; Spostare la piastra in posizione di parcheggio.
- Raccolta dei cristalli
- Mettiti comodo e premi il pulsante Avvia flusso di lavoro (lo schermo è un touch screen) per spostarti nella prima posizione del pozzetto selezionata.
- Se il cristallo è sopravvissuto, montare il cristallo nell'anello e immergerlo nell'azoto liquido posizionandolo in posizione 1 nel primo disco della lista.
- Selezionare la descrizione appropriata per il cristallo dall'interfaccia (normale, fuso, incrinato, gelatinoso o colorato).
- Se la goccia è un ammollo composto, registrare la descrizione dello stato del composto (limpido, cristallino, precipitato, cattiva erogazione o separazione di fase).
- Se il cristallo è stato montato correttamente, selezionare Montato , altrimenti selezionare Fallito.
- La piastra si sposterà al successivo pozzetto selezionato. Riempi tutte le posizioni del disco consecutivamente (non lasciare uno spazio vuoto se un cristallo si è guastato). Continua fino alla fine del flusso di lavoro.
- Al termine del flusso di lavoro, carica eventuali lotti aggiuntivi e continua a riempire i dischi in ordine. Non c'è bisogno di iniziare un nuovo disco per un nuovo lotto.
- Tracciamento con codice a barre dei risultati della raccolta
- Una volta che tutti i cristalli sono stati raccolti, porta i dischi allo scanner di codici a barre, posizionali uno alla volta nel supporto per scansionare i codici a barre del disco e del pin.
- Al termine, mettere i coperchi sui dischi e conservare in un contenitore di azoto liquido.
- Caricare il file di output nell'interfaccia di SoakDB.
- Registrazione delle informazioni di esempio in ISPyB34,35,36
- Caricare i dati di esempio in ISPyB
- In SoakDB, aggiorna la beamline, visita Aggiorna per ISPyB e fai clic su Esporta per creare il file da caricare in ISPyB.
- Stucco aperto. Accedere e passare alla seguente directory dls/labxchem/data/year/lbXXXX-1/processing/lab36/ispyb.
- Eseguire lo script csv2ispyb (csv2ispyb lbXXXX-1-date.csv)
NOTA: gli esempi vengono ora caricati in ISPyB.
- Registra la posizione del disco e la strategia di raccolta dei dati.
- Registra i dettagli e la posizione dei dischi
NOTA: È importante registrare i dettagli e la posizione dei dischi in modo che possano essere localizzati e caricati sulla linea di luce.- In SoakDB, apri la seconda scheda denominata Pucks.
- Compila i dettagli nelle caselle in alto. In particolare, l'ubicazione dei dischi (stoccaggio dewar e canne), i parametri di raccolta dei dati, compresa la risoluzione prevista e il numero di proposta.
- Fare clic sul pulsante Salva e nella tabella apparirà un elenco di tutti i dischi. Copia i dischi riempiti di recente.
- Apri il foglio di calcolo della coda XChem (collegamento sul desktop) e incolla le informazioni. Compila tutte le informazioni aggiuntive pertinenti.
- Registra i dettagli e la posizione dei dischi
- Caricare i dati di esempio in ISPyB
- Preparazione per la raccolta
4. Raccolta dei dati
NOTA: I dati vengono raccolti in modalità non presidiata e gestiti dal team XChem/beamline.
- Ricordare campioni centrati in modo errato.
NOTA: Questi sono necessari quando si sono verificati problemi con la raccolta dei dati per determinati campioni, molto probabilmente causati da pin non centrati correttamente.- Guardare la vista del cambio di campione in ISPyB, selezionare Classifica per punto di accesso per classificare i campioni in base alla risoluzione elaborata automaticamente in una gradazione di colore dal verde al rosso.
- Fare clic sui campioni per verificare la presenza di eventuali campioni rossi o gialli.
NOTA: Verrà visualizzata la raccolta dei dati. - Controlla le istantanee del cristallo per vedere se il cristallo è centrato.
- Prendi nota di tutti quelli che non sono stati centrati e inviali al contatto locale che ritirerà i campioni mancanti.
5. Analisi dei dati
- Recupero e analisi dei risultati dell'elaborazione automatica di Diamond tramite XChemExplorer (XCE)25.
- In un terminale, vai alla sottocartella Processing: cd /dls/labxchem/data/year/visit/processing o per XChem BAGs: cd /dls/labxchem/data/year/visit/processing/project/processing/.
- Utilizzare l'alias xce per aprire XChemExplorer.
- Selezionare il pulsante Aggiorna tabelle dall'origine dati .
- Nella scheda Panoramica è presente un riepilogo dei dati sperimentali. Per aggiungere altre categorie, selezionare le colonne da visualizzare nel menu Origine dati .
- Nella scheda Impostazioni , selezionare la directory di raccolta dati (/dls/i04-1/data/year/visit/).
- Apri la scheda Set di dati, scegli la destinazione dal menu a discesa Seleziona destinazione, seleziona G eNuovi risultati dall'elaborazione automatica dal menu a discesa Set di dati e fai clic su Esegui.
NOTA: XCE analizzerà ora la visita di raccolta dei dati per i risultati dell'elaborazione automatica. Questa operazione potrebbe richiedere un po' di tempo la prima volta che viene eseguita, a seconda del numero di set di dati/directory che vengono analizzati. - Verificare la coerenza e la qualità dei dati controllando la risoluzione, il gruppo di spazi e Rmerge. Escludere i dati con risoluzione inferiore a 2,8 Å.
NOTA: per impostazione predefinita, la selezione del set di dati si basa su un punteggio calcolato da I/sigI, completezza e numero di riflessioni univoche, ma è possibile selezionare altri risultati di elaborazione per l'uso25. - Per selezionare un risultato di elaborazione diverso per i singoli set di dati, se si preferisce, fare clic su ID campione e scegliere il programma/esecuzione desiderato. Per modificare la pipeline di elaborazione per tutti i set di dati, selezionare Modifica preferenze dal menu Preferenze e modificare Meccanismo di selezione del set di dati.
- Se necessario, rielaborare i dati tramite ISPyB37.
- Se non sono accettabili dati elaborati per un campione, etichettare come Impossibile escludere da ulteriori analisi.
- Al termine, fare clic su Aggiorna tabelle dall'origine dati per aggiungere dati alle tabelle successive.
- Calcolo delle mappe iniziali con DIMPLE38.
- Apri la scheda Mappe , scegli il modello di riferimento dal menu a discesa e seleziona i set di dati desiderati seguiti da Esegui DIMPLE sui file MTZ selezionati.
- XCE esegue numerosi processi DIMPLE contemporaneamente sul cluster di Diamond. Trova lo stato di questi processi nella colonna Stato fossette e aggiorna utilizzando il pulsante Aggiorna tabelle da origine dati o utilizzando il comando qstat in Linux.
- Al termine, controlla se i valori Dimple Rcryst, Dimple Rfree e Space Group sono accettabili. Se necessario (Rfree elevato/gruppo di spazio errato/grande differenza nel volume della cella unitaria), modificare i risultati dell'elaborazione automatica come descritto in precedenza e ripetere la generazione della mappa per questi set di dati.
- Generazione di vincoli del ligando utilizzando il grado39, AceDRG40 o phenix.eLBOW41.
- Selezionare il programma desiderato (Preferenze, Modificare preferenze, Programma di generazione vincoli) e quindi selezionare i set di dati nella scheda Mappe, quindi eseguire Crea file CIF/PDB/PNG di composti SELEZIONATI dal menu a discesa Mappe e restrizioni.
- Aggiornare lo stato di questi processi trovati nella colonna Stato composto utilizzando il pulsante Aggiorna tabelle da origine dati .
- Creazione del modello dello stato fondamentale (pre-esecuzione)
NOTA: Il termine modello dello stato fondamentale rappresenta la struttura della proteina nella sua forma ligando-free, come osservato in 100 set di dati (questo numero è scelto arbitrariamente). Poiché il modello dello stato fondamentale viene utilizzato come riferimento per la costruzione dello stato legato al ligando, è fondamentale costruire un modello accurato dello stato fondamentale, che includa tutte le molecole di solvente e acqua, prima dell'analisi dell'intera campagna di screening dei frammenti. In questa fase, i primi cento set di dati a più alta risoluzione contrassegnati da PanDDA come privi di eventi interessanti (e quindi probabilmente privi di ligando) vengono utilizzati per generare la mappa media dello stato fondamentale, mentre il set di dati con Rpiù basso libero viene selezionato per il perfezionamento. La mappa media dello stato fondamentale non è una mappa cristallografica, tuttavia, è importante utilizzare questa mappa solo per la costruzione del modello dello stato fondamentale.- Aprire la scheda PanDDA e, se necessario, aggiornare le tabelle dall'origine dati.
- Definire la directory di output (/dls/labxchem/data/year/visit/processing/analysis/panddas).
- Selezionare Pre-run per Ground State Model (Modello allo stato fondamentale ) e fare clic su Run (Esegui).
NOTA: i set di dati con Rfree elevato e gruppi di spazi imprevisti devono essere automaticamente esclusi dall'analisi. - Per escludere manualmente i set di dati con Rfree elevato e gruppi di spazi imprevisti, selezionare Ignora completamente.
- Controllare lo stato del processo di pre-esecuzione utilizzando qstat in una finestra del terminale.
- Al termine, selezionare Crea modello dello stato fondamentale e fare clic su Esegui.
NOTA: In questo modo si aprirà Coot con la mappa media PanDDA e un modello di riferimento/mappe 2Fo-Fc/Fo-Fc dal set di dati della migliore qualità per la rimodellazione e il perfezionamento utilizzando Coot. È della massima importanza che per la modellazione venga utilizzata solo la mappa media PanDDA.
- Identificazione dei riscontri con PanDDA26
- Analisi – PanDDA
NOTA: l'esecuzione sul cluster può richiedere del tempo se sono presenti molti set di dati, la cella unitaria è grande e sono presenti più copie della proteina nell'unità asimmetrica.- Ripetere i passaggi descritti in precedenza per Analizza i risultati dell'elaborazione automatica DLS e Calcolo iniziale della mappa. Per il calcolo della mappa, utilizzare il modello dello stato fondamentale come riferimento: Aggiorna elenco file di riferimento > Imposta nuovo riferimento e generare vincoli del ligando come necessario per i nuovi dati (passaggi 6.1-6.3).
- Nella scheda PanDDAs assicurarsi che la directory di output sia impostata come prima ed eseguire pandda.analyse dal menu a discesa Hit Identification .
- Controllare lo stato del lavoro nel terminale Linux utilizzando il comando qstat.
- PanDDA inspect - controllo/creazione di eventi di associazione
- Nella scheda PanDDAs in XCE, esegui pandda.inspect dal menu a discesa Hit Identification per aprire Coot42 con il pannello di controllo PanDDA.
NOTA: Il pannello di controllo pandda.inspect fornisce un riepilogo delle statistiche di PanDDA e consente agli utenti di navigare tra eventi/siti di associazione. Viene inoltre generato un file HTML di riepilogo dei risultati che può essere aggiornato durante l'ispezione selezionando Aggiorna HTML. - Per modellare un ligando, fare clic su Unisci ligando con modello e Salva modello prima di passare a un altro evento per evitare di perdere le modifiche apportate al modello dello stato associato.
NOTA: solo i modelli che sono stati aggiornati e salvati verranno esportati per essere perfezionati in una fase successiva. - Utilizzare il campo Commento evento per annotare l'evento di associazione e il campo Registra informazioni sito per annotare i siti di associazione.
- Mappa media del carico e 2mFo-DFc (da DIMPLE) per il confronto con la mappa degli eventi e il modello.
- Una volta che tutti i ligandi vitali sono stati modellati, uniti e salvati in base alla mappa degli eventi, chiudere pandda.inspect.
- Nella scheda PanDDAs in XCE, esegui pandda.inspect dal menu a discesa Hit Identification per aprire Coot42 con il pannello di controllo PanDDA.
- Esportazione e perfezionamento di PanDDA
NOTA: I seguenti modelli di ispezione PanDDA vengono esportati nuovamente nella directory del progetto e viene avviato un primo ciclo di perfezionamento. Attualmente sono disponibili due pipeline per eseguire questa operazione nella scheda PANDDA in XCE.- Esporta modelli NEW/ALL/SELECTED PANDDA genera un insieme dei modelli associati e non associati per la rifinitura e genera i parametri di limitazione dell'occupazione per Refmac43.
NOTA: il modello di ensemble verrà utilizzato per il perfezionamento, ma solo il modello di stato limite verrà aggiornato in Coot e depositato nel PDB. Questa pipeline viene utilizzata al meglio per set di dati con frammenti a bassa occupazione e modifiche significative al modello proteico. - Perfeziona i modelli di stato limitato NEW/ALL con BUSTER perfeziona lo stato limitato solo con Buster44.
NOTA: Questo è meglio utilizzato con ligandi/set di dati ad alta occupazione con modifiche minime al modello proteico.
- Esporta modelli NEW/ALL/SELECTED PANDDA genera un insieme dei modelli associati e non associati per la rifinitura e genera i parametri di limitazione dell'occupazione per Refmac43.
- Analisi – PanDDA
- Perfezionamento degli hit (tutti i set di dati selezionati per il perfezionamento saranno ora visibili nella scheda Perfezionamento). Selezionare Apri COOT - BUSTER Refinement o Apri COOT - REFMAC Refinement dal menu a discesa Affinamento per aprire Coot con il pannello di controllo XCE Refinement.
- Selezionare lo stato dei campioni da rifinire dal menu a discesa Seleziona campioni (di solito 3 - in affinamento) e fare clic su VAI.
NOTA: il pannello di controllo XCE fornisce un riepilogo del numero di set di dati per tale categoria e consente la navigazione tra i set di dati, fornendo al contempo un riepilogo delle statistiche di perfezionamento. - Annotare l'attendibilità del ligando nel pannello di controllo XCE: 0 - nessun ligando presente- Il frammento non è legato; 1 - Bassa confidenza- Il frammento si è forse legato ma non è particolarmente convincente; 2 - Ligando corretto, densità debole - L'utente è sicuro che il frammento si sia legato ma è a bassa occupazione/ci sono alcuni problemi con le mappe; 3 - Densità chiara, ligando inaspettato - Le mappe indicano chiaramente il legame del ligando che non è correlato alla struttura chimica fornita; 4 - Confidenza elevata: il ligando è legato in modo inequivocabile.
- Apportare le modifiche necessarie al modello in questa fase e avviare un ulteriore perfezionamento utilizzando il pulsante Perfeziona .
- Utilizzare il pulsante Mostra elenco cose da fare MolProbity per accedere all'analisi MolProbity45 eseguita su tutti i cicli di affinamento.
- Se necessario, aggiungere i parametri di affinamento, ad esempio per i fattori di temperatura anisotropi, i dati gemellati o l'affinamento dell'occupazione selezionando il pulsante Parametri di perfezionamento .
NOTA: le statistiche sull'elaborazione dei dati vengono fornite anche in XCE nella scheda Perfezionamento e, se il perfezionamento viene eseguito con la pipeline Buster, vengono forniti i report Buster, inclusa l'analisi MOGUL46. - Modificare lo stato di un set di dati durante l'affinamento nella finestra XCE principale nella scheda Perfezionamento o nel pannello di controllo Coot XCE . Quando si è certi che il modello sia accurato intorno al ligando e adatto per essere condiviso per ulteriori analisi, modificare lo stato in CompChem Ready. Al termine del perfezionamento e il modello è pronto per il caricamento nel file PDB, modificare lo stato in Deposizione pronta.
- Selezionare lo stato dei campioni da rifinire dal menu a discesa Seleziona campioni (di solito 3 - in affinamento) e fare clic su VAI.
6. Deposito dei dati
NOTA: tutti i set di dati provenienti da una schermata di frammento e il modello dello stato fondamentale utilizzato per generare le mappe degli eventi PanDDA possono essere depositati nel PDB utilizzando le deposizioni di gruppo.
- Converti tutte le mappe degli eventi PanDDA in formato MTZ eseguendo Event Map ->SF dal menu Hit Identification .
- Fornisci metadati aggiuntivi, ad esempio autori e metodi, selezionando Deposizione > Modifica informazioni. Compila tutti gli elementi richiesti e fai clic su Salva nel database , quindi salva queste informazioni per la deposizione del modello dello stato fondamentale. Eseguire questa operazione dopo che lo stato del modello è stato modificato in Pronto per la deposizione.
- Nella scheda Deposizione , selezionare il pulsante Prepara mmcif per generare file mmcif del fattore di struttura per tutti i set di dati pronti per la deposizione . Al termine dell'operazione, nella finestra del terminale verrà visualizzato il seguente messaggio: Terminata la preparazione dei file mmcif per la deposizione wwPDB.
- Selezionare il pulsante Copia mmcif per copiare tutti questi file in un singolo archivio tar compresso nella directory di deposizione del gruppo della visita.
- Vai a https://deposit-group-1.rcsb.rutgers.edu/groupdeposit; Accedi con nome utente: Grouptester e password: !2016rcsbpdb. Creare una sessione e caricare il file ligand-bound.tar.bz2 dalla directory di deposizione del gruppo.
- Dopo l'invio delle strutture legate al ligando, viene inviata un'e-mail con i codici PDB. Selezionare Aggiorna DB con codici PDB dal menu Deposizione ; copiare e incollare le informazioni contenute nell'e-mail nella finestra pop-up e fare clic su Aggiorna database per aggiungere gli ID PDB.
- Per depositare il modello dello stato fondamentale utilizzato da PanDDA, selezionare la directory PanDDA pertinente in XCE ed eseguire apo->mmcif dal menu Hit Identification .
NOTA: XCE selezionerà arbitrariamente una struttura ad alta risoluzione con un basso Rfree come modello per il fascio di deposizione e quindi compilerà tutti i file mmcif del fattore di struttura in un unico file. - Nella scheda Deposizione, selezionare il pulsante Aggiungi al database sotto la sezione Deposizione gruppo del modello allo stato fondamentale.
- Immettere i metadati per il modello dello stato fondamentale (sempre selezionando Deposizione > Modifica informazioni), caricare il file precedente e Salva nel database.
- Preparare il file mmcif dello stato fondamentale eseguendo Preparare mmcif dalla sezione Deposizione gruppo del modello allo stato fondamentale e, al termine, copiare l'mmcif nella directory Deposizione gruppo selezionando il pulsante Copia mmcif dalla stessa sezione.
- Come prima, vai a https://deposit-group-1.rcsb.rutgers.edu/groupdeposit; Accedi con nome utente: Grouptester e password: !2016rcsbpdb. Creare una sessione e caricare il file ground_state_structures.tar.bz2 dalla directory di deposizione del gruppo.
Risultati
La pipeline XChem per lo screening dei frammenti mediante cristallografia a raggi X è stata ampiamente semplificata, consentendone l'adozione da parte della comunità scientifica (Figura 5). Questo processo è stato validato su oltre 150 campagne di screening con un tasso di successo variabile tra l'1% e il 30%47,48,49,50,51,52 e da molti utenti abituali. I sistemi cristallini che non sono adatti (bassa risoluzione, incoerenti nella cristallizzazione o nella qualità della diffrazione) o che non tollerano né il DMSO né il glicole etilenico vengono eliminati all'inizio del processo, risparmiando tempo, fatica e risorse. Le campagne di successo forniscono una mappa tridimensionale dei potenziali siti di interazione sulla proteina bersaglio; un risultato tipico è lo screening XChem della proteasi principale di SARS-CoV-2 (Figura 6). Tipicamente, i frammenti si trovano in: (a) siti di interesse noti, come siti enzimatici attivi e sottotasche48; (b) siti allosterici putativi, ad esempio, nelle interazioni proteina-proteina53; (c) interfacce di impacchettamento a cristalli, generalmente considerate come falsi positivi (Figura 6). Questi dati strutturali forniscono generalmente una base per la fusione, il collegamento o la crescita di frammenti in piccole molecole simili al piombo 1,3.
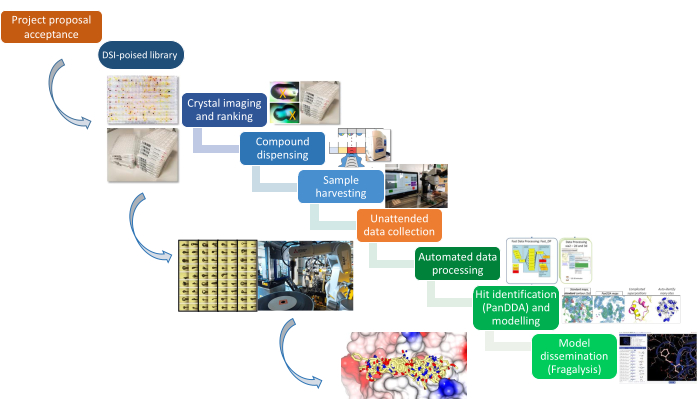
Figura 1: Pipeline XChem. La piattaforma è rappresentata schematicamente dalla proposta di progetto attraverso la preparazione del campione, la raccolta dei dati e l'identificazione dei risultati. Fare clic qui per visualizzare una versione più grande di questa figura.
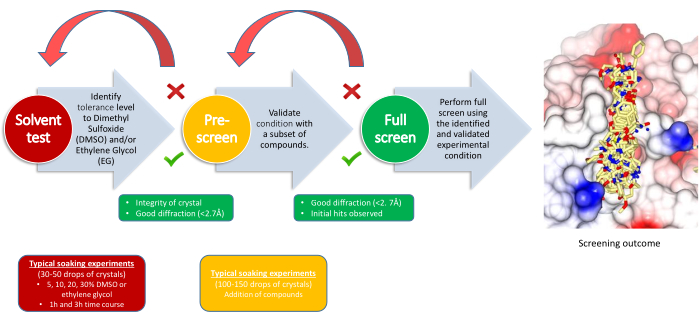
Figura 2: Strategia di screening. Il flusso di lavoro indica lo scopo di ogni attività cardine, i requisiti dell'esperimento e i punti decisionali. Fare clic qui per visualizzare una versione più grande di questa figura.
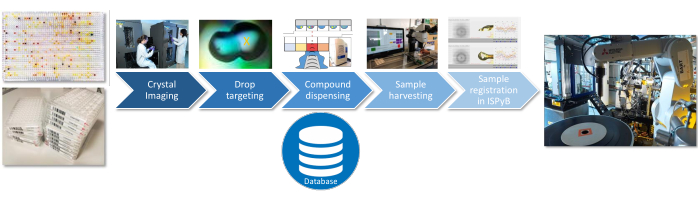
Figura 3: Flusso di lavoro per la preparazione dei campioni. I passaggi critici per la preparazione del campione sono rappresentati con le informazioni di ogni passaggio registrate in un database SQLite. Fare clic qui per visualizzare una versione più grande di questa figura.
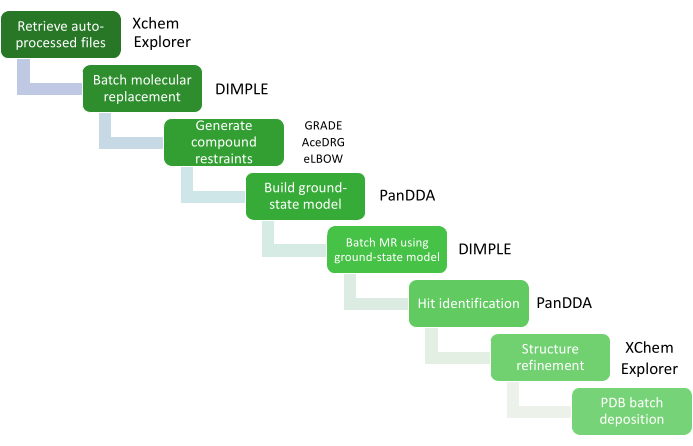
Figura 4: Analisi dei dati con XCE. Le fasi critiche dell'analisi dei dati sono rappresentate da un diagramma del flusso di lavoro con i relativi pacchetti software. Fare clic qui per visualizzare una versione più grande di questa figura.
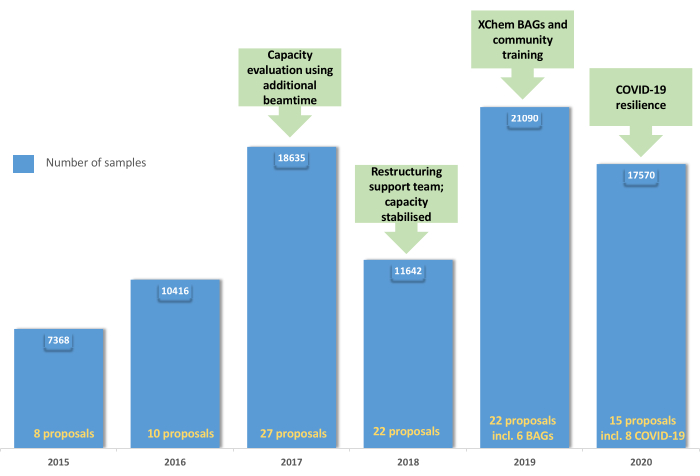
Figura 5: Evoluzione del programma utente XChem : il grafico mostra l'adozione e il consolidamento del programma utente dal 2015 al 2019 con la creazione di BAG nel 2019 e la resilienza della piattaforma durante la pandemia di COVID-19 nel 2020. Fare clic qui per visualizzare una versione più grande di questa figura.
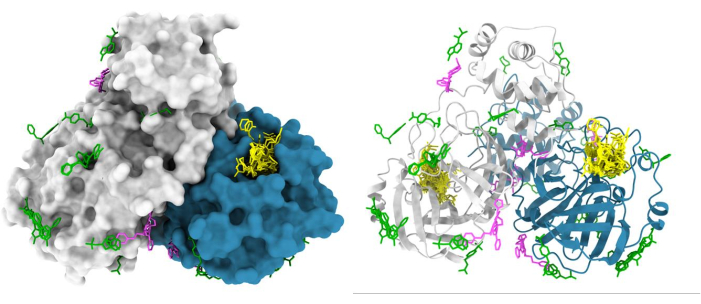
Figura 6: Risultati rappresentativi dello screening dei frammenti XChem. Il dimero principale della proteasi (Mpro) di SARS-CoV2 è rappresentato in superficie con i punti di contatto attivi mostrati in giallo, i presunti punti allosterici mostrati in magenta e gli artefatti di impacchettamento di superficie/cristallo mostrati in verde. La figura è stata realizzata utilizzando le voci di Chimera e Mpro PDB dalla deposizione di gruppo G_1002156. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Il processo descritto in questo documento è stato ampiamente testato dalla comunità degli utenti e l'adattabilità dei protocolli qui descritti è fondamentale per gestire l'ampia varietà di progetti tipicamente incontrati sulla piattaforma. Tuttavia, sono necessari alcuni prerequisiti del sistema cristallino.
Per qualsiasi campagna di screening dei frammenti effettuata utilizzando la cristallografia a raggi X, è fondamentale un sistema cristallino riproducibile e robusto. Poiché il protocollo XChem standard prevede l'aggiunta del frammento direttamente alla goccia di cristallo, l'ottimizzazione dovrebbe concentrarsi sul numero di gocce contenenti cristalli di alta qualità piuttosto che sul numero totale di cristalli. Se le gocce contengono più cristalli, sono effettivamente ridondanti anche se possono alleviare il processo di raccolta. Inoltre, il trasferimento del protocollo di cristallizzazione dall'istituto di provenienza alle strutture in loco può essere difficile. Ciò si ottiene generalmente al meglio utilizzando la semina dei cristalli per promuovere la nucleazione riproducibile54 e, pertanto, una buona pratica è che gli utenti forniscano scorte di semi insieme alle loro proteine e soluzioni di cristallizzazione.
Per garantire una buona solubilità e supporto del composto, le elevate concentrazioni di ammollo destinate a guidare il legame di frammenti deboli, librerie di frammenti sono fornite in solventi organici, in particolare DMSO e glicole etilenico. La fornitura di due diversi solventi offre agli utenti un'alternativa per i cristalli che non tollerano affatto il DMSO, o in cui occlude il legame dei frammenti in un sito di interesse. Gli utenti possono fornire librerie alternative in tampone acquoso: i composti erogheranno bene a condizione che siano completamente disciolti e formattati in piastre compatibili con il robot di erogazione del liquido.
Per i progetti in cui non è possibile trovare un solvente organico appropriato che solubilizzi la libreria e sia tollerato dal sistema cristallino, una procedura alternativa consiste nell'utilizzare composti essiccati come stabilito in BESSY55.
Nella comunità, c'è una questione di lunga data sulla possibilità di immergere i composti in cristalli cresciuti in condizioni di cristallizzazione contenenti alte concentrazioni di sale. In pratica, si osserva una maggiore precipitazione dei composti e una rapida formazione di cristalli di sale nella fase di raccolta, che viene ridotta applicando un ambiente umido intorno all'area di raccolta. Generalmente, le campagne di screening in sistemi cristallini da condizioni di cristallizzazione ad alto contenuto salino danno un tasso di successo paragonabile a quello in condizioni di basso sale.
Le fasi iniziali del processo XChem (test di tolleranza ai solventi e pre-screening) sono esperimenti relativamente rapidi e su piccola scala, ma consentono di prendere una chiara decisione di scelta o di non scelta per il progetto. La cosa più dolorosa è che sarà necessario trovare sistemi cristallini alternativi se nessuno dei due solventi è tollerato o se il pre-screening si traduce in un tasso di successo molto basso. Al contrario, se hanno successo, i risultati informano direttamente la condizione di ammollo da utilizzare per l'esperimento di screening e la migliore strategia per la raccolta dei dati. Poiché la qualità dei dati, in particolare la risoluzione, influenzerà la qualità della densità elettronica per l'identificazione e l'analisi dei colpi, l'obiettivo è quello di immergere alla massima concentrazione possibile di composti che non abbia un effetto deleterio sulla qualità della diffrazione (con la maggior parte dei set di dati (~80%) che diffragisce a una risoluzione di 2,8 Å o superiore).
Il processo di analisi dei dati è semplificato all'interno di XChemExplorer, che si basa sul software PanDDA per il rilevamento di leganti deboli e consente agli utenti di visualizzare e rivedere rapidamente i risultati della campagna di screening. XChemExplorer importa i risultati dell'elaborazione dei dati dai pacchetti disponibili su Diamond (DIALS 16, autoPROC30, STARANISO31 e Xia214) con limiti di risoluzione determinati dal metodo standard per ciascun pacchetto (ad esempio, CC1/2 = 0.3). Per impostazione predefinita, la selezione del set di dati si basa su un punteggio calcolato da I/sigI, completezza e una serie di riflessioni univoche, ma è possibile selezionare risultati di elaborazione specifici per l'uso sia a livello globale che per singoli campioni25. I dati sono inoltre esclusi dall'analisi da parte di PanDDA in base a criteri quali la risoluzione,l'assenza di R e la differenza nel volume unitario della cella tra i dati di riferimento e quelli di destinazione (i valori predefiniti sono rispettivamente 3,5 Å, 0,4 e 12%), in modo che i cristalli scarsamente diffranti, centrati o indicizzati in modo errato non influiscano sull'analisi.
L'algoritmo PanDDA sfrutta il numero considerevole di set di dati raccolti durante una campagna di frammento per rilevare ligandi di occupazione parziale che non sono visibili nelle mappe cristallografiche standard. Inizialmente, PanDDA utilizza i dati raccolti durante i test di tolleranza al solvente e le fasi di pre-screening per preparare una mappa di densità media che viene poi utilizzata per creare un modello dello stato fondamentale. Poiché questo modello verrà utilizzato per tutte le fasi successive dell'analisi, è fondamentale che rappresenti accuratamente la proteina non ligata nelle condizioni utilizzate per lo screening dei frammenti. PanDDA utilizza quindi un'analisi statistica per identificare i ligandi legati, generando una mappa degli eventi per lo stato legato del cristallo. Una mappa degli eventi viene generata sottraendo la frazione non legata del cristallo dal set di dati di occupazione parziale e presenta ciò che verrebbe osservato se il ligando fosse legato a piena occupazione. Anche i frammenti che appaiono chiari nelle mappe convenzionali2mF o-DF c potrebbero essere modellati in modo errato se le mappe degli eventi non vengono consultate32. Sebbene PanDDA sia un metodo potente per identificare i set di dati che differiscono dalle mappe medie (che di solito è indicativo dell'associazione dei frammenti) e vengano fornite metriche come RSCC, RSZD, rapporto del fattore B e RMSD durante il perfezionamento a vantaggio dell'utente, l'utente è in ultima analisi responsabile di decidere se la densità osservata rappresenta accuratamente il ligando atteso e la conformazione più adatta.
A seguito dell'analisi e del perfezionamento dei dati, è possibile per tutti gli utenti depositare contemporaneamente più strutture nella Protein Data Bank (PDB) utilizzando XChemExplorer. Per ogni frammento-schermo, vengono effettuate due deposizioni di gruppo. La prima deposizione contiene tutti i modelli associati a frammenti, con coefficienti per il calcolo delle mappe degli eventi PanDDA inclusi nei file MMCIF. La seconda deposizione fornisce il modello di stato fondamentale che lo accompagna, insieme ai fattori di struttura misurati di tutti i set di dati dell'esperimento: questi dati possono essere utilizzati per riprodurre l'analisi PanDDA e per sviluppare algoritmi futuri. Per quanto riguarda le strutture degli hit, quando l'occupazione dei frammenti è bassa, l'affinamento è meglio comportato se i modelli sono un composito delle strutture dello stato fondamentale legate al ligando e confondenti32; Ciononostante, la pratica è quella di depositare solo le frazioni dello stato limitato, poiché i modelli compositi completi sono in generale complessi e difficili da interpretare. Di conseguenza, alcuni indicatori di qualità ricalcolati dal PPB (in particolare, R/Rfree) sono talvolta leggermente elevati. È anche possibile fornire tutti i dati grezzi utilizzando piattaforme come Zenodo56, anche se questo non è attualmente supportato dalla pipeline XChem.
Nel complesso, dalla sua entrata in funzione nel 2016, i ligandi di frammento sono stati identificati in oltre il 95% dei bersagli utilizzando questa procedura. L'esperienza dei numerosi progetti che XChem ha sostenuto è stata distillata nelle migliori pratiche per la preparazione dei cristalli33, mentre è stata sviluppata una libreria di frammenti che ha implementato il concetto di equilibrio per aiutare la progressione dei frammenti29, contribuendo anche a stabilire la pratica di rendere pubblica la composizione della libreria. La piattaforma ha dimostrato l'importanza di un'infrastruttura ben mantenuta e di processi documentati, descritti in dettaglio qui, e ha permesso di valutare altre librerie di frammenti57,58, di confrontare le librerie48 e di informare la progettazione della libreria collaborativa EUOpenscreen-DRIVE 59,60.
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Questo lavoro rappresenta un grande sforzo congiunto tra il Diamond Light Source e lo Structure Genomic Consortium. Gli autori desiderano ringraziare i vari gruppi di supporto di Diamond e il gruppo MX per il loro contributo all'automazione della linea di luce i04-1 e per aver fornito pipeline di raccolta dati e di elaborazione automatica semplificate, che sono comunemente eseguite su tutte le linee di luce MX. Vorrebbero anche ringraziare il gruppo SGC PX per la loro resilienza essendo i primi utenti a testare la configurazione ed Evotec per essere stato il primo serio utente industriale. Questo lavoro è stato supportato da iNEXT-Discovery (Grant 871037) finanziato dal programma Horizon 2020 della Commissione Europea.
Materiali
| Name | Company | Catalog Number | Comments |
| DSI-poised library | Enamine | DSI-896 | fragment library |
| Echo 550 and 650 series | Beckman-Coulter | acoustic dispensing system | |
| Echo microplates | Beckman-Coulter | 001-12380; 001-8768; 001-6025 | 1536-well and 384-well microplates |
| Shifter | Oxford Lab Technology | harvesting device | |
| Microplate centrifuge with a swing-out rotor | Sigma | model 11121 | microplate centrifuge |
| 3-drops crystallisation plates | Swissci | 3W96T-UVP | Crystallisation plates |
| Formulatrix plate imager and Rockmaker software | Formulatrix | Crystallisation plates imaging device |
Riferimenti
- Erlanson, D. A., Fesik, S. W., Hubbard, R. E., Jahnke, W., Jhoti, H. Twenty years on: The impact of fragments on drug discovery. Nature Reviews Drug Discovery. 15 (9), 605-619 (2016).
- Jacquemard, C., Kellenberger, E. A bright future for fragment-based drug discovery: what does it hold. Expert Opinion on Drug Discovery. 14 (5), 413-416 (2019).
- Jahnke, W., et al. Fragment-to-lead medicinal chemistry publications in 2019. Journal of Medicinal Chemistry. 63 (24), 15494-15507 (2019).
- Li, Q. Application of fragment-based drug discovery to versatile targets. Frontiers in Molecular Biosciences. 7, 180 (2020).
- Kirsch, P., Hartman, A. M., Hirsch, A. K. H., Empting, M. Concepts and core principles of fragment-based drug design. Molecules. 24 (23), 4309 (2019).
- Patel, D., Bauman, J. D., Arnold, E. Advantages of crystallographic fragment screening: functional and mechanistic insights from a powerful platform for efficient drug discovery. Progress in Biophysics and Molecular Biology. 116 (2-3), 92-100 (2014).
- Wasserman, S., et al. Automated synchrotron crystallography for drug discovery: the LRL-CAT beamline at the APS. Acta Crystallographica Section A Foundations of Crystallography. 67 (1), 46-47 (2011).
- Hartshorn, M. J. Fragment-based lead discovery using X-ray crystallography. Journal of Medicinal Chemistry. 48 (2), 403-413 (2005).
- Arzt, S., et al. Automation of macromolecular crystallography beamlines. Progress in Biophysics and Molecular Biology. 89 (2), 124-152 (2005).
- Beteva, A. High-throughput sample handling and data collection at synchrotrons: Embedding the ESRF into the high-throughput gene-to-structure pipeline. Acta Crystallographica Section D, Biological Crystallography. 62, 1162-1169 (2006).
- Papp, G., et al. FlexED8: The first member of a fast and flexible sample-changer family for macromolecular crystallography. Acta Crystallographica. Section D, Structural Biology. 73, 841-851 (2017).
- Casanas, A., et al. EIGER detector: Application in macromolecular crystallography. Acta Crystallographica Section D, Structural Biology. 72, 1036-1048 (2016).
- Henrich, B., et al. PILATUS: A single photon counting pixel detector for X-ray applications. Nuclear Instruments and Methods in Physics Research, Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 607 (1), 247-249 (2009).
- Winter, G., Lobley, C. M. C., Prince, S. M. Decision making in xia2. Acta Crystallographica Section D, Biological Crystallography. 69, 1260-1273 (2013).
- Winter, G., McAuley, K. E. Automated data collection for macromolecular crystallography. Methods. 55 (1), 81-93 (2011).
- Winter, G., et al. DIALS: Implementation and evaluation of a new integration package. Acta Crystallographica Section D, Structural Biology. 74, 85-97 (2018).
- Bowler, M. W. MASSIF-1: A beamline dedicated to the fully automatic characterization and data collection from crystals of biological macromolecules. Journal of Synchrotron Radiation. 22 (6), 1540-1547 (2015).
- Von Stetten, D., et al. ID30A-3 (MASSIF-3) - A beamline for macromolecular crystallography at the ESRF with a small intense beam. Journal of Synchrotron Radiation. 27, 844-851 (2020).
- Cipriani, F., et al. CrystalDirect: a new method for automated crystal harvesting based on laser-induced photoablation of thin films. Acta Crystallographica. Section D, Biological Crystallography. 68, 1393-1399 (2012).
- . Helmholtz Zentrum Berlin Available from: https://www.helmholtzberlin.de/forschung/oe/np/gmx/fragment-screening/index_en.html (2021)
- Lima, G. M. A., et al. FragMAX: the fragment-screening platform at the MAX IV Laboratory. Acta crystallographica. Section D, Structural biology. 76 (8), 771-777 (2020).
- Ng, J. T., Dekker, C., Kroemer, M., Osborne, M., Von Delft, F. Using textons to rank crystallization droplets by the likely presence of crystals. Acta Crystallographica. Section D, Biological Crystallography. 70, 2702-2718 (2014).
- Collins, P. M., et al. Gentle, fast and effective crystal soaking by acoustic dispensing. Acta Crystallographica. Section D, Structural Biology. 73, 246-255 (2017).
- Wright, N. D., et al. The low-cost Shifter microscope stage transforms the speed and robustness of protein crystal harvesting. Acta Crystallographica. Section D, Structural Biology. 77, 62-74 (2021).
- Krojer, T., et al. The XChemExplorer graphical workflow tool for routine or large-scale protein-ligand structure determination. Acta Crystallographica. Section D, Structural Biology. 73, 267-278 (2017).
- Pearce, N. M., et al. A multi-crystal method for extracting obscured crystallographic states from conventionally uninterpretable electron density. Nature Communications. 8, 15123 (2017).
- . Fragalysis Available from: https://fragalysis.diamond.ac.uk (2021)
- . Diamond Light Source Ltd Available from: https://www.diamond.ac.uk/Instruments/Mx/Fragment-Screening.html (2021)
- Cox, O. B., et al. A poised fragment library enables rapid synthetic expansion yielding the first reported inhibitors of PHIP(2), an atypical bromodomain. Chemical Science. 7 (3), 2322-2330 (2016).
- Vonrhein, C., et al. Data processing and analysis with the autoPROC toolbox. Acta Crystallographica. Section D, Biological Crystallography. 67, 293-302 (2011).
- Vonrhein, C., et al. Advances in automated data analysis and processing within autoPROC , combined with improved characterisation, mitigation and visualisation of the anisotropy of diffraction limits using STARANISO. Acta Crystallographica Section A: Foundations and Advances. 74 (1), 360 (2018).
- Pearce, N. M., Krojer, T., Von Delft, F. Proper modelling of ligand binding requires an ensemble of bound and unbound states. Acta Crystallographica. Section D, Structural Biology. 73, 265-266 (2017).
- Collins, P. M., et al. Achieving a good crystal system for crystallographic x-ray fragment screening. Methods in Enzymology. 610, 251-264 (2018).
- Delageniere, S., et al. ISPyB: an information management system for synchrotron macromolecular crystallography. Bioinformatics. 27 (22), 3186-3192 (2011).
- Fisher, S. J., Levik, K. E., Williams, M. A., Ashton, A. W., McAuley, K. E. SynchWeb: a modern interface for ISPyB. Journal of Applied Crystallography. 48, 927-932 (2015).
- Ginn, H. M., et al. SynchLink: an iOS app for ISPyB. Journal of Applied Crystallography. 47, 1781-1783 (2014).
- . Diamond Light Source Ltd Available from: https://www.diamond.ac.uk/Instruments/Mx/Common/Common-Manual/Data-Analysis/Reprocessing-in-ISPyB.html (2021)
- Wojdyr, M., Keegan, R., Winter, G., Ashton, A. DIMPLE - a pipeline for the rapid generation of difference maps from protein crystals with putatively bound ligands. Acta Crystallographica. Section A, Foundations of Crystallography. 69, 299 (2013).
- Long, F., et al. AceDRG: A stereochemical description generator for ligands. Acta Crystallographica. Section D, Structural Biology. 73, 112-122 (2017).
- Moriarty, N. W., Grosse-Kunstleve, R. W., Adams, P. D. Electronic ligand builder and optimization workbench (eLBOW): A tool for ligand coordinate and restraint generation. Acta Crystallographica. Section D, Biological Crystallography. 65, 1074-1080 (2009).
- Emsley, P., Lohkamp, B., Scott, W. G., Cowtan, K. Features and development of Coot. Acta Crystallographica. Section D, Biological Crystallography. 66, 486-501 (2010).
- Murshudov, G. N., Vagin, A. A., Dodson, E. J. Refinement of macromolecular structures by the maximum-likelihood method. Acta Crystallographica. Section D, Biological Crystallography. 53, 240-255 (1997).
- Bricogne, G., et al. Buster version 2.10.3. Global Phasing Ltd. , (2017).
- Chen, V. B., et al. MolProbity: All-atom structure validation for macromolecular crystallography. Acta Crystallographica. Section D, Biological Crystallography. 66, 12-21 (2010).
- Bruno, I. J., et al. Retrieval of crystallographically-derived molecular geometry information. Journal of Chemical Information and Computer Sciences. 44 (6), 2133-2144 (2004).
- Delbart, F., et al. An allosteric binding site of the α7 nicotinic acetylcholine receptor revealed in a humanized acetylcholine-binding protein. TheJournal of Biological Chemistry. 293, 2534-2545 (2018).
- Douangamath, A., et al. Crystallographic and electrophilic fragment screening of the SARS-CoV-2 main protease. Nature Communications. 11 (1), 5047 (2020).
- Guo, J., et al. In crystallo-screening for discovery of human norovirus 3C-like protease inhibitors. Journal of Structural Biology: X. 4, 100031 (2020).
- Keedy, D. A., et al. An expanded allosteric network in PTP1B by multitemperature crystallography, fragment screening, and covalent tethering. eLife. 7, 36307 (2018).
- McIntyre, P. J., et al. Characterization of three druggable hot-spots in the aurora-a/tpx2 interaction using biochemical, biophysical, and fragment-based approaches. ACS Chemical Biology. 12 (11), 2906-2914 (2017).
- Thomas, S. E., et al. Structure-guided fragmentbased drug discovery at the synchrotron: Screening binding sites and correlations with hotspot mapping. Philosophical Transactions. Series A, Mathematical, Physical and Engineering Sciences. 377 (2147), 20180422 (2019).
- Nichols, C., et al. Mining the PDB for tractable cases where x-ray crystallography combined with fragment screens can be used to systematically design protein-protein inhibitors: Two test cases illustrated by IL1β-IL1R and p38α-TAB1 complexes. Journal of Medicinal Chemistry. 63 (14), 7559-7568 (2020).
- D'Arcy, A., Bergfors, T., Cowan-Jacob, S. W., Marsh, M. Microseed matrix screening for optimization in protein crystallization: What have we learned. Acta Crystallographica. Section F, Structural Biology Communications. 70, 1117-1126 (2014).
- Wollenhaupt, J., et al. F2X-Universal and F2X-Entry: Structurally diverse compound libraries for crystallographic fragment screening. Structure. 28 (6), 694-706 (2020).
- . Zenodo Available from: https://zenodo.org (2021)
- Foley, D. J., et al. Synthesis and demonstration of the biological relevance of sp(3) -rich scaffolds distantly related to natural product frameworks. Chemistry. 23 (60), 15227-15232 (2017).
- Kidd, S. L., et al. Demonstration of the utility of DOS-derived fragment libraries for rapid hit derivatisation in a multidirectional fashion. Chemical Science. 11 (39), 10792-10801 (2020).
- . EU-openscreen ERIC Available from: https://www.eu-openscreen.eu/ (2021)
- Schuller, M., et al. Fragment binding to the Nsp3 macrodomain of SARS-CoV-2 identified through crystallographic screening and computational docking. bioRxiv. 393405, (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon