Method Article
Alcançando a triagem eficiente de fragmentos nas instalações da XChem na Diamond Light Source
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este artigo descreve o processo completo do XChem para triagem de fragmentos à base de cristal, desde a solicitação de acesso e todas as etapas subsequentes até a disseminação dos dados.
Resumo
Na descoberta de drogas baseadas em fragmentos, centenas ou muitas vezes milhares de compostos menores que ~300 Da são testados contra a proteína de interesse para identificar entidades químicas que podem ser desenvolvidas em potentes candidatos a fármacos. Como os compostos são pequenos, as interações são fracas e, portanto, o método de triagem deve ser altamente sensível; Além disso, informações estruturais tendem a ser cruciais para a elaboração desses acertos em compostos semelhantes a chumbo. Portanto, a cristalografia de proteínas sempre foi uma técnica padrão-ouro, mas historicamente muito desafiadora para encontrar uso generalizado como tela primária.
Experimentos iniciais do XChem foram demonstrados em 2014 e, em seguida, testados com colaboradores acadêmicos e industriais para validar o processo. Desde então, um grande esforço de pesquisa e um tempo de feixe significativo simplificaram a preparação de amostras, desenvolveram uma biblioteca de fragmentos com possibilidades de acompanhamento rápido, automatizaram e melhoraram a capacidade da linha de luz I04-1 para coleta autônoma de dados e implementaram novas ferramentas para gerenciamento de dados, análise e identificação de acertos.
O XChem é agora uma instalação para triagem de fragmentos cristalográficos em larga escala, suportando todo o processo de deposição de cristais e acessível a usuários acadêmicos e industriais em todo o mundo. O programa de usuários acadêmicos revisado por pares tem sido ativamente desenvolvido desde 2016, para acomodar projetos de um escopo científico o mais amplo possível, incluindo projetos bem validados e exploratórios. O acesso acadêmico é alocado por meio de chamadas semestrais para propostas revisadas por pares, e o trabalho proprietário é organizado pelo grupo de Ligação Industrial da Diamond. Esse fluxo de trabalho já foi aplicado rotineiramente a mais de uma centena de alvos de diversas áreas terapêuticas e identifica efetivamente ligantes fracos (1%-30% de taxa de acerto), que servem como pontos de partida de alta qualidade para o projeto de compostos e fornecem informações estruturais extensas sobre locais de ligação. A resiliência do processo foi demonstrada pela triagem contínua dos alvos SARS-CoV-2 durante a pandemia COVID-19, incluindo uma reviravolta de 3 semanas para a protease principal.
Introdução
O Fragment-Based Drug Discovery (FBDD) é uma estratégia amplamente utilizada para a descoberta de chumbo e, desde seu surgimento, há 25 anos, já entregou quatro fármacos para uso clínico e mais de 40 moléculas foram avançadas para ensaios clínicos 1,2,3. Fragmentos são pequenas entidades químicas geralmente com peso molecular de 300 Da ou menos. São selecionados por sua baixa complexidade química, que fornecem bons pontos de partida para o desenvolvimento de inibidores altamente eficientes em ligantes e com excelentes propriedades físico-químicas. Seu tamanho significa que eles amostram a paisagem de ligação de proteínas mais completamente do que bibliotecas de compostos maiores semelhantes a drogas ou chumbo e, portanto, também revelam pontos quentes e supostos sítios alostéricos. Combinados com informações estruturais, fragmentos fornecem um mapa detalhado das potenciais interações moleculares entre proteína e ligante. No entanto, detectar e validar de forma confiável essas entidades, que tendem a se ligar fracamente à proteína-alvo, requer uma série de métodos de triagem biofísica robustos e sensíveis, como a Ressonância de Plasmon de Superfície (SPR), a Ressonância Magnética Nuclear (RMN) ou a Calorimetria de Titulação Isotérmica (ITC)4,5.
A cristalografia de raios X é uma parte essencial do kit de ferramentas FBDD: é sensível o suficiente para identificar ligantes fracos e produz diretamente informações estruturais sobre as interações em nível molecular. É complementar a outras telas biofísicas e geralmente essencial para o progresso de fragmentos atingidos por compostos de chumbo; requer sistemas de cristal de alta qualidade, o que significa que a cristalização é altamente reprodutível, e os cristais idealmente difratam para uma resolução melhor do que 2,8 Å.
Historicamente, tem sido muito difícil utilizar a cristalografia como tela de fragmentos primários6,7,8, seja na academia ou na indústria. Em contraste, os síncrotrons alcançaram melhorias de ordem de magnitude em robótica, automação 9,10,11 e tecnologia de detectores 12,13, e combinados com poder computacional igualmente acelerado e algoritmos de processamento de dados14,15,16, conjuntos de dados completos de difração podem ser medidos em segundos e grande número deles totalmente autônomos, como pioneiro no LillyCAT7 e posteriormente MASSIF17,18 (European Synchrotron Radiation Facility (ESRF)). Isso levou os síncrotrons a desenvolver plataformas altamente simplificadas para tornar a triagem de fragmentos baseada em cristais como tela primária acessível a uma ampla comunidade de usuários (XChem at Diamond; CrystalDirect na EMBL/ESRF19; BESSY em Helmholtz-Zentrum Berlin20; FragMax no MaxIV21).
Este trabalho documenta os protocolos que constituem a plataforma XChem para triagem de fragmentos por cristalografia de raios X, desde a preparação da amostra até os resultados estruturais finais de golpes modelados em 3D. O pipeline (Figura 1) exigiu o desenvolvimento de novas abordagens para identificação de cristais 22, embebição 23 e colheita 24, bem como software de gerenciamento de dados25 e uma abordagem algorítmica para identificar fragmentos 26 que agora é amplamente utilizada na comunidade. A tecnologia de colheita de cristais agora é vendida por um fornecedor (ver Tabela de Materiais), e a disponibilidade aberta das ferramentas permitiu que outros síncrotrons as adaptassem para montar plataformas equivalentes21. Os projetos em andamento abordam a análise de dados, a conclusão do modelo e a disseminação de dados por meio da plataforma Fragalysis27. O laboratório de preparação de amostras é adjacente à linha de luz I04-1, simplificando a logística de transferência de centenas de amostras congeladas para a linha de luz e o tempo de luz dedicado em I04-1 permite um rápido feedback de raios-X para guiar a campanha.
O XChem é parte integrante do programa de usuários do Diamond, com duas chamadas por ano (início de abril e outubro). O processo de revisão por pares foi aperfeiçoado em consulta com especialistas em descoberta de medicamentos da Academia e da Indústria. Juntamente com um forte caso científico, o processo de proposta28 exige que os candidatos autoavaliem não apenas a prontidão do sistema cristalino, mas também sua experiência em métodos bioquímicos e ortogonais biofísicos e capacidade de progredir acertos de triagem por meio de química de acompanhamento. Os modos de acesso também evoluíram para acomodar a comunidade multidisciplinar de usuários:
O nível 1 (projeto único ) é para projetos na fase exploratória e ferramentas de validação de sucesso (ferramentas biofísicas ou bioquímicas) e estratégias de acompanhamento não precisam estar em vigor. Se aceito, o projeto recebe um número reduzido de turnos de tempo de feixe, o suficiente para prova de conceito.
O nível 2 (projeto único) é para projetos bem validados e requer ferramentas downstream e estratégias de acompanhamento para estar em vigor. Se aceito, o projeto recebe tempo de feixe suficiente para uma campanha de triagem completa de fragmentos. Os projetos individuais (Tier 1 ou Tier 2) devem ser concluídos dentro dos 6 meses do período de alocação (abril a setembro ou outubro a março).
O Block Allocation Group (BAG) é para um consórcio de grupos e projetos, onde um processo robusto de seleção e priorização de alvos está em vigor dentro do BAG, juntamente com um pipeline de acompanhamento claro. Os BAGs devem ter pelo menos um especialista totalmente treinado em XChem (superusuário), que coordene suas atividades com a equipe Diamond e treine os membros do BAG. O número alocado de turnos de tempo de feixe é definido pelo número de projetos cientificamente fortes no BAG e é reavaliado por período de alocação com base no relatório do BAG. O acesso está disponível por 2 anos.
O experimento XChem é dividido em três etapas, com um ponto de decisão para cada uma delas: teste de tolerância ao solvente, pré-tela e tela principal (Figura 2). O teste de tolerância ao solvente ajuda a definir os parâmetros de imersão, a quantidade de solvente (DMSO, etilenoglicol ou outros crioprotetores, se necessário) que o sistema de cristal pode tolerar e por quanto tempo. As concentrações de solventes normalmente variam de 5% a 30% em pelo menos dois pontos de tempo. Os dados de difração são coletados e comparados com a difração de base do sistema cristalino; Isso determinará os parâmetros de imersão para o estágio seguinte. Para a pré-peneira, 100-150 compostos são embebidos usando as condições determinadas no teste de solvente, e seu objetivo é confirmar que os cristais podem tolerar os compostos nessas condições. Se necessário, o crioprotetor é posteriormente adicionado às gotas que já contêm os fragmentos. Os critérios de sucesso são que 80% ou mais dos cristais sobrevivam bem o suficiente para produzir dados de difração de boa e consistente qualidade; Se isso falhar, as condições de imersão geralmente são revisadas alterando o tempo de imersão ou a concentração de solvente. Após uma pré-triagem bem-sucedida, o resto dos compostos escolhidos para o experimento pode ser configurado usando os parâmetros finais.
A biblioteca com equilíbrio DSI (ver Tabela de Materiais) foi projetada propositalmente para permitir uma rápida progressão de acompanhamento usando química equilibrada29 e tem sido a biblioteca de trabalho da instalação. Está disponível para usuários a uma concentração de 500 mM em DMSO. Os usuários acadêmicos também podem acessar outras bibliotecas fornecidas pelos colaboradores (mais de 2.000 compostos no total) em concentrações de 100-500 mM em DMSO (uma lista completa pode ser encontrada no site28). Grande parte da coleção global também está disponível em etilenoglicol, para sistemas de cristal que não toleram DMSO. Os usuários também podem trazer suas próprias bibliotecas, desde que estejam em placas compatíveis com o sistema de manuseio de líquidos acústicos (consulte Tabela de Materiais).
Para as três etapas do experimento (caracterização do solvente, pré-tela ou tela cheia), os seguintes procedimentos de preparação da amostra são idênticos (Figura 3): seleção do local de dispensação do composto através de imageamento e direcionamento das gotas de cristalização com TeXRank22; dosagem em gotas utilizando o sistema de dispensação de líquido acústico para solvente e compostos23; colheita eficiente dos cristais utilizando o shifter Crystal24; e upload de informações de amostras para o banco de dados de linhas de luz (ISPyB). A interface atual para projeto e execução de experimentos é uma aplicação baseada em Excel (SoakDB), que gera os arquivos de entrada necessários para os diferentes equipamentos da plataforma, e rastreia e registra todos os resultados em um banco de dados SQLite. Os scanners de código de barras são usados em vários estágios ao longo do processo para ajudar a rastrear amostras e esses dados são adicionados ao banco de dados.
Os dados de difração são coletados em modo autônomo usando tempo de feixe dedicado na linha de luz I04-1. Dois modos de centralização estão disponíveis, a saber, óptico e baseado em raios-X17. Para cristais em forma de agulha e haste, a centralização de raios X é aconselhada, enquanto cristais chunkier geralmente suportam o modo óptico, que é mais rápido e, portanto, permite que mais amostras sejam coletadas no tempo de feixe alocado. Dependendo da resolução dos cristais (estabelecida antes de entrar na plataforma) a coleta de dados pode ser de 60 s ou 15 s de exposição total. A coleta de dados durante a fase de teste de solvente geralmente informa qual combinação funcionará melhor com o desempenho da linha de luz I04-1.
O grande volume de análise de dados é gerenciado através do XChemExplorer (XCE)25, que também pode ser usado para iniciar a etapa de identificação de acertos usando o PanDDA26. O XCE é uma ferramenta de gerenciamento de dados e fluxo de trabalho que suporta a análise em larga escala de estruturas proteína-ligante (Figura 4); ele lê qualquer um dos resultados de processamento automático de dados coletados no Diamond Light Source (DIALS16, Xia214, AutoPROC30 e STARANISO31) e seleciona automaticamente um dos resultados com base na qualidade dos dados e similaridade com um modelo de referência. É importante que o modelo seja representativo do sistema cristalino usado para a triagem do XChem, e deve incluir todas as águas ou outras moléculas de solvente, bem como todos os cofatores, ligantes e conformações alternativas visíveis em cristais embebidos apenas com solvente. A qualidade deste modelo de referência impactará diretamente a quantidade de trabalho necessário durante a fase de construção e refinamento do modelo. O PanDDA é usado para analisar todos os dados e identificar locais de vinculação. Alinha estruturas a uma estrutura de referência, calcula os mapas estatísticos, identifica eventos e calcula mapas de eventos26,32. No paradigma PanDDA, não é necessário nem desejável construir o modelo cristalográfico completo; O que deve ser modelado é apenas a visão da proteína onde um fragmento está ligado (o modelo de estado ligado), de modo que o foco precisa ser apenas na construção do ligante e das moléculas de resíduos/solventes circundantes de acordo com o mapa de eventos32.
Protocolo
1. Submissão de propostas de projetos
- Conteúdo da proposta: uma vez que o programa XChem está com excesso de inscrições, informações completas e completas na proposta são fundamentais para passar na revisão por pares.
- Faça o caso! Apresentar a importância do alvo e colocá-lo no contexto mais amplo.
- Articular a estratégia após a campanha de triagem de fragmentos: os métodos ortogonais em vigor para validar os acertos e como progredi-los. Alinhe as colaborações, se necessário.
- Devido à intensa parte de laboratório e análise de dados, é altamente recomendável designar um cristalógrafo experiente com antecedência.
- Um sistema de cristal robusto é fundamental para eliminar a variação técnica e os usuários devem abordar esses pontos essenciais.
- Certifique-se de que as condições de cristalização produzam gotas reprodutíveis com cristais de qualidade difratante semelhante em placas adequadas para uso na plataforma com um volume de reservatório de 30 μL (ou menos) e um tamanho de gota entre 200-500 nL. O ideal é que mais de 50% das gotas de uma placa tenham cristais de pelo menos 35 μm de tamanho33.
- Garantir qualidade de difração consistente dos cristais (2,6 Å ou superior).
- Verificar a adequação do sistema de cristal para triagem de fragmentos, incluindo embalagem de cristais e acessibilidade de locais conhecidos. Evidências anteriores de uma molécula ligada nesses locais são muitas vezes tranquilizadoras.
- Faça o caso! Apresentar a importância do alvo e colocá-lo no contexto mais amplo.
2. Preparação para a visita
- Transferência de protocolos de cristalização para cristalização no local.
- Fornecer 2 x 50 mL de solução reservatório, pronto para uso.
- Fornecer a solução proteica na concentração necessária para cristalização, pronta para uso em alíquotas de 30-50 μL.
- Fornecer 10 ml da solução tampão proteica.
- Fornecer estoque de sementes (mesmo que não seja necessário no protocolo de cristalização).
OBS: A semeadura favorece a reprodutibilidade da cristalização e acelera o tempo de nucleação33. - Preencha o formulário de informações de cristalização disponível no site do XChem28.
- Forneça as informações de armazenamento no formulário de envio disponível no site da XChem28.
- Instale o NoMachine e configure uma área de trabalho remota para Diamond (https://www.diamond.ac.uk/Users/Experiment-at-Diamond/IT-User-Guide/Not-at-DLS/Nomachine.html).
- Gere e transfira um bom modelo de referência, em consulta com um cristalógrafo especializado ou equipe de suporte do XChem.
3. Experimento de triagem de fragmentos
- Definição do local de distribuição do composto.
- Placas de cristalização por imagem.
- Imagem de todas as placas de cristal (ver Tabela de Materiais) necessárias para o experimento nos imageadores de placas de cristal (veja Tabela de Materiais). Usando o software imageador, gere o(s) nome(s) da(s) chapa(s) no diretório correto para o tipo de chapa no seguinte formato: Proposta Number_Plate Número.
- Imprima os códigos de barras (clique com o botão direito do mouse no nome da chapa e selecione no menu), coloque-os no lado oposto da placa a partir das letras das linhas, coloque a(s) placa(s) na porta de carga com o código de barras voltado para longe do usuário.
- Use o software de controle do imageador, digitalize a porta de carga, clique com o botão direito do mouse nas placas e selecione Placas de imagem.
- Quando a imagem estiver completa, remova as placas do imageador.
- Escolhendo cristais e localização do composto
NOTA: As imagens das gotículas de cristalização são processadas dentro do pipeline Luigi usando o algoritmo Ranker baseado em textons da TexRank para classificar as gotículas pela provável presença de cristais22. Isso leva aproximadamente 10 minutos e as imagens estarão disponíveis no TexRank.- Abra o TeXRank a partir de um PC e selecione a bandeja de cristal na lista no canto inferior direito ou digitando o código de barras na caixa no canto superior esquerdo.
- Selecione o formato correto do imageador e a visualização de poço único. Mova-se através das imagens de gota e quando houver um cristal que é adequado para usar em um experimento, clique com o botão direito do mouse longe do cristal, mas dentro da gota - o objetivo é direcionar onde na gota para adicionar solvente/compostos, então não queira atingir diretamente o cristal23.
- Continue por toda a placa e, uma vez terminado, selecione o botão Echo 1 Target ; Salve no diretório Crystal Targets na visita relevante. Não altere o nome do arquivo.
- Repita para quaisquer placas adicionais.
- Placas de cristalização por imagem.
- Dispensação de compostos
- Geração de arquivos para dispensa composta
- No SoakDB, insira a seleção da biblioteca ou as informações sobre solventes na tabela biblioteca/solvente.
- Insira o volume de queda e carregue na lista de cristais alvo.
- Gere os lotes necessários.
- Insira os parâmetros de imersão. Clique em Calcular e, em seguida, no botão Exportar pendente . Para solvente, adicione as várias concentrações à mesa. Isso gera os arquivos para uso no dispensador acústico.
- Se estiver usando crioprotetor, insira a concentração e crie os arquivos da mesma forma.
- Soluções de dosagem usando o dispensador acústico (ver Tabela de Materiais)
- Pegue a placa de origem (compostos ou solvente/crioprotetor) e gire a placa na centrífuga por 2 min a 1.000 x g.
- Se dispensar solvente ou crioprotetor, pipetar 30 μL para o poço relevante em uma placa de 384PP; cubra com uma película de microselo e, em seguida, centrifugue como acima.
- Abra o software; selecione Novo e escolha a placa de poço de origem correta (384PP, 384LDV ou 1536LDV) e a classe líquida (DMSO, CP, BP ou GP). Verifique se o tipo de placa correto está selecionado como a placa de destino. Em seguida, marque a caixa Personalizar e continue.
- Selecione Importar e escolha o arquivo em lote relevante. Conclua as etapas de importação conforme solicitado pelo software.
- Use os mapas de placas para verificar a solução a ser dispensada e os locais de destino.
- Execute o protocolo, seguindo os prompts à medida que eles aparecem. A(s) solução(ões) da placa de origem será dispensada nas gotas de cristal escolhidas.
- Guarde o prato na incubadora pelo tempo necessário.
NOTA: Estes parâmetros são determinados na etapa de caracterização do solvente, a temperatura será de 4 °C ou 20 °C dependendo da temperatura de crescimento do cristal e os tempos são tipicamente entre 1 h e 3 h.
- Geração de arquivos para dispensa composta
- Colheita de cristais utilizando o dispositivo semiautomático de colheita de cristais (ver Tabela de Materiais).
NOTA: Se for necessária crioprotecção, repetir o passo 3.2.2 para a adição de soluções crioprotectoras nas gotas de cristal antes de colher as amostras.- Preparação para a colheita
- Prepare os arquivos necessários para a colheita no SoakDB. Quando solicitado, confirme se as imersões estão prontas e os lotes concluídos.
- Escaneie o número de pucks necessários para o experimento sob o número de proposta correto.
- Selecione uma bandeja das alças de tamanho adequado para os cristais (35 μm, 75 μm ou 150 μm). É importante escolher um tamanho de loop que corresponda ao tamanho do cristal o mais próximo possível para permitir que a centralização automática na linha de luz seja mais precisa, melhorar a qualidade dos dados reduzindo o fundo e eliminar a necessidade de crioprotetor.
- Abra o software relevante e abra a guia fluxo de trabalho.
- Escaneie os pucks no software e role de volta para o topo da lista, destacando o primeiro puck.
- Coloque os pucks em uma espuma e resfrie-os com nitrogênio líquido.
- Escolha Importar arquivo do SoakDB e selecione o lote a ser colhido; Verifique se o lote está atribuído ao suporte esquerdo. Uma lista de trabalho é exibida.
- Pegue a placa de cristal, retire o lacre e coloque no suporte esquerdo; mova a placa para a posição de estacionamento.
- Colheita de cristais
- Fique confortável e pressione o botão Iniciar fluxo de trabalho (a tela é sensível ao toque) para ir para a primeira posição de poço selecionada.
- Se o cristal sobreviveu, monte o cristal no laço e mergulhe no nitrogênio líquido colocando-o na posição 1 no primeiro puck da lista.
- Selecione a descrição apropriada para o cristal na interface (normal, derretido, rachado, gelatinoso ou colorido).
- Se a gota for um molho composto, registre a descrição do estado composto (claro, cristalino, precipitado, má distribuição ou separação de fases).
- Se o cristal tiver sido montado com êxito, selecione Montado , caso contrário, selecione Falhar.
- A chapa passará para o próximo poço selecionado. Preencha todas as posições do puck consecutivamente (não deixe uma lacuna se um cristal falhou). Continue até o final do fluxo de trabalho.
- No final do fluxo de trabalho, carregue quaisquer lotes adicionais e continue a preencher os pucks em ordem. Não há necessidade de iniciar um novo puck para um novo lote.
- Rastreamento por código de barras dos resultados da colheita
- Depois que todos os cristais tiverem sido colhidos, leve os pucks para o leitor de código de barras, coloque um de cada vez no suporte para escanear o puck e fixar códigos de barras.
- Quando isso estiver concluído, coloque as tampas nos pucks e armazene em um dewar de armazenamento de nitrogênio líquido.
- Carregue o arquivo de saída na interface do SoakDB.
- Registro de informações de amostra no ISPyB34,35,36
- Carregar dados de exemplo no ISPyB
- No SoakDB, atualize a linha de luz, visite Update for ISPyB e clique em Export para criar o arquivo a ser carregado no ISPyB.
- Massa aberta. Faça login e navegue até o seguinte diretório dls/labxchem/data/year/lbXXXX-1/processing/lab36/ispyb.
- Execute o script csv2ispyb (csv2ispyb lbXXXX-1-date.csv)
Observação : os exemplos agora são carregados no ISPyB.
- Registre a localização do puck e a estratégia de coleta de dados.
- Registre os detalhes e a localização dos pucks
NOTA: É importante registrar os detalhes e a localização dos pucks para que eles possam ser localizados e carregados na linha de luz.- No SoakDB, abra a segunda guia chamada Pucks.
- Preencha os dados nas caixas ao longo da parte superior. Especificamente, localização dos pucks (dewar de armazenamento e bengalas), parâmetros de coleta de dados, incluindo resolução esperada e número da proposta.
- Clique no botão Salvar e uma lista de todos os pucks aparecerá na tabela. Copie os pucks preenchidos recentemente.
- Abra a planilha de fila do XChem (atalho na área de trabalho) e cole as informações. Preencha qualquer informação adicional relevante.
- Registre os detalhes e a localização dos pucks
- Carregar dados de exemplo no ISPyB
- Preparação para a colheita
4. Coleta de dados
NOTA: Os dados são coletados em modo autônomo e gerenciados pela equipe do XChem/linha de luz.
- Coleta de amostras descentralizadas.
Observação : eles são necessários quando houve problemas com a coleta de dados para determinadas amostras, provavelmente causados quando os pinos não foram centralizados corretamente.- Observe a exibição do trocador de amostra no ISPyB, selecione Classificar por AP para classificar as amostras por resolução processada automaticamente em uma graduação de cores de verde para vermelho.
- Clique nas amostras para verificar se há amostras vermelhas ou amarelas.
NOTA: Isso abrirá a coleta de dados. - Verifique os instantâneos do cristal para ver se o cristal está centralizado.
- Anote todos aqueles que não centralizaram e envie para o contato local que irá recolher novamente as amostras faltantes.
5. Análise dos dados
- Recuperação e análise dos resultados de processamento automático do Diamond através do XChemExplorer (XCE)25.
- Em um terminal, vá para a subpasta Processing: cd /dls/labxchem/data/year/visit/processing ou para XChem BAGs: cd /dls/labxchem/data/year/visit/processing/project/processing/.
- Use o alias xce para abrir o XChemExplorer.
- Selecione o botão Atualizar tabelas da fonte de dados .
- Na guia Visão geral , há um resumo dos dados experimentais. Adicione categorias adicionais com a opção Selecionar colunas a serem exibidas no menu Fonte de dados .
- Na guia Configurações , selecione o diretório de coleta de dados (/dls/i04-1/data/year/visit/).
- Abra a guia Conjuntos de Dados, escolha o destino no menu suspenso Selecionar Destino, selecione Get Novos Resultados do Processamento Automático no menu suspenso Conjuntos de Dados e clique em Executar.
NOTA: O XCE agora analisará a visita de coleta de dados para obter resultados de processamento automático. Isso pode levar algum tempo na primeira vez que é executado, dependendo do número de conjuntos de dados/diretórios que estão sendo analisados. - Verifique a consistência e a qualidade dos dados verificando a resolução, o grupo de espaços e o Rmerge. Excluir dados com resolução inferior a 2,8 Å.
Observação : por padrão, a seleção do conjunto de dados é baseada em uma pontuação calculada a partir de I/sigI, completude e número de reflexões exclusivas, mas outros resultados de processamento podem ser selecionados para uso25. - Para selecionar um resultado de processamento diferente para conjuntos de dados individuais, se preferir, clique em ID de amostra e escolha o programa/execução desejado. Para alterar o pipeline de processamento de todos os conjuntos de dados, selecione Editar preferências no menu Preferências e altere Mecanismo de Seleção do Conjunto de Dados.
- Se necessário, reprocesse os dados através do ISPyB37.
- Se nenhum dado processado para uma amostra for aceitável, marque como Falha ao excluir da análise posterior.
- Quando terminar, clique em Atualizar tabelas da fonte de dados para adicionar dados às tabelas subsequentes.
- Calculando mapas iniciais usando DIMPLE38.
- Abra a guia Mapas , escolha o modelo de referência no menu suspenso e selecione os conjuntos de dados desejados seguido de Executar DIMPLE em arquivos MTZ selecionados.
- O XCE executa vários trabalhos DIMPLE simultaneamente no cluster no Diamond. Encontre o status desses trabalhos na coluna Status de Dimple e atualize usando o botão Atualizar Tabelas da Fonte de Dados ou usando o comando qstat no Linux.
- Depois de concluído, verifique se os valores Dimple Rcryst, Dimple Rfree e Space Group são aceitáveis. Se necessário (grupo de espaço Rfree alto/errado/grande diferença no volume de célula unitária), altere os resultados do processamento automático conforme descrito anteriormente e repita a geração de mapas para esses conjuntos de dados.
- Geração de restrições de ligantes usando Grau39, AceDRG40 ou phenix.eLBOW41.
- Selecione o programa desejado (Preferências, Editar preferências, Programa de geração de restrições) e, em seguida, selecione conjuntos de dados na guia Mapas seguido de executar Criar arquivo CIF/PDB/PNG de compostos SELECIONADOS no menu suspenso Mapas & Restrições.
- Atualize o status desses trabalhos encontrados na coluna Status Composto usando o botão Atualizar Tabelas da Fonte de Dados .
- Construindo o modelo de estado fundamental (Pré-execução)
NOTA: O termo modelo de estado fundamental representa a estrutura da proteína em sua forma livre de ligantes, como observado em 100 conjuntos de dados (este número é escolhido arbitrariamente). Uma vez que o modelo de estado fundamental é usado como referência para a construção do estado ligado ao ligante, é fundamental construir um modelo preciso de estado fundamental, incluindo todas as moléculas de solvente e água, antes da análise de toda a campanha de triagem de fragmentos. Nesta etapa, os cem primeiros conjuntos de dados de maior resolução marcados pelo PanDDA como sem eventos interessantes (e, portanto, provavelmente livres de ligantes) são usados para gerar o mapa médio do estado fundamental, enquanto o conjunto de dados com menor Rlivre é selecionado para o refinamento. O mapa médio do estado fundamental não é um mapa cristalográfico, no entanto, é importante usar este mapa apenas para a construção do modelo do estado fundamental.- Abra a guia PanDDAs e atualize tabelas da fonte de dados, se necessário.
- Defina o diretório de saída (/dls/labxchem/data/year/visit/processing/analysis/panddas).
- Selecione Pré-execução para Modelo de Estado Fundamental e clique em Executar.
NOTA: Conjuntos de dados com grupos de espaço Rfree e inesperados altos devem ser automaticamente excluídos da análise. - Para excluir manualmente conjuntos de dados com grupos de espaço inesperados e Rfree altos, selecione Ignorar completamente.
- Verifique o status do trabalho de pré-execução usando qstat em uma janela de terminal.
- Depois de concluído, selecione Construir modelo de estado fundamental e clique em Executar.
NOTA: Isso abrirá o Coot com o mapa médio do PanDDA e um modelo de referência/mapas 2Fo-Fc/Fo-Fc do conjunto de dados de melhor qualidade para remodelagem e refinamento usando o Coot. É de extrema importância que apenas o mapa médio do PanDDA seja usado para modelagem.
- Identificando acertos usando o PanDDA26
- Análise de PanDDA
Observação : pode levar algum tempo para executar no cluster se houver muitos conjuntos de dados, a célula unitária é grande e há várias cópias da proteína na unidade assimétrica.- Repita as etapas descritas anteriormente para Analisar resultados de processamento automático do DLS e Cálculo do mapa inicial. Para o cálculo do mapa, use o modelo de estado fundamental como referência: Atualizar Lista de Arquivos de Referência > Definir Nova Referência e gerar Restrições de Ligante conforme necessário para os novos dados (etapas 6.1-6.3).
- Na guia PanDDAs , verifique se o diretório de saída está definido como antes e execute pandda.analyse no menu suspenso Identificação de Visitas .
- Verifique o status do trabalho no terminal Linux usando o comando qstat.
- Inspeção do PanDDA - verificação/criação de eventos de vinculação
- Na guia PanDDAs no XCE, execute pandda.inspect no menu suspenso Identificação de visitas para abrir o Coot42 com o painel de controle PanDDA.
NOTA: O painel de controle pandda.inspect fornece um resumo das estatísticas do PanDDA e permite que os usuários naveguem por eventos/sites de vinculação. Um arquivo HTML de resumo dos resultados também é gerado e pode ser atualizado durante a inspeção selecionando Atualizar HTML. - Para modelar um ligante, clique em Mesclar ligante com modelo e Salvar modelo antes de navegar para outro evento para evitar perder quaisquer alterações no modelo de estado limite.
Observação : somente os modelos que foram atualizados e salvos serão exportados para refinamento em um estágio posterior. - Use o campo Comentário do Evento para anotar o evento de vinculação e as Informações do Site de Registro para anotar sites de vinculação.
- Carregar mapas de média e 2mFo-DFc (da DIMPLE) para comparação com o mapa e modelo de eventos.
- Depois que todos os ligantes viáveis tiverem sido modelados, mesclados e salvos com base no mapa de eventos, feche pandda.inspect.
- Na guia PanDDAs no XCE, execute pandda.inspect no menu suspenso Identificação de visitas para abrir o Coot42 com o painel de controle PanDDA.
- Exportação e refinamento do PanDDA
Observação : após PanDDA inspecionar modelos são exportados de volta para o diretório do projeto e uma rodada inicial de refinamento é iniciada. Atualmente, há dois pipelines disponíveis para fazer isso na guia PANDDAs no XCE.- Exportar modelos NEW/ALL/SELECTED PANDDA gera um conjunto de modelos encadernados e não encadernados para refinamento e gera parâmetros de contenção de ocupação para o Refmac43.
NOTA: O modelo de conjunto será usado para refinamento, mas somente o modelo de estado limite será atualizado no Coot e depositado no PDB. Esse pipeline é melhor usado para conjuntos de dados com fragmentos de baixa ocupação e mudanças significativas no modelo de proteína. - Refinar modelos de estado limite NOVO/TODOS com BUSTER refina o estado limite somente com Buster44.
NOTA: Isso é melhor usado com ligantes/conjuntos de dados de alta ocupação com alterações mínimas no modelo de proteína.
- Exportar modelos NEW/ALL/SELECTED PANDDA gera um conjunto de modelos encadernados e não encadernados para refinamento e gera parâmetros de contenção de ocupação para o Refmac43.
- Análise de PanDDA
- Refinando os acertos (todos os conjuntos de dados selecionados para refinamento agora estarão visíveis na guia Refinamento ). Selecione Abrir COOT - BUSTER Refinement ou Open COOT - REFMAC Refinement no menu suspenso Refinamento para abrir o Coot com o painel de controle XCE Refinement .
- Selecione o status das amostras a serem refinadas no menu suspenso Selecionar amostras (geralmente 3 - em refinamento) e clique em GO.
Observação : O painel de controle XCE fornece um resumo do número de conjuntos de dados para essa categoria e permite a navegação entre conjuntos de dados enquanto fornece um resumo das estatísticas de refinamento. - Anote a confiança do ligante no painel de controle XCE: 0 - nenhum ligante presente- Fragmento não ligado; 1 - Baixa Confiança - Fragmento possivelmente ligado, mas não é particularmente convincente; 2 - Ligante correto, densidade fraca- O usuário está confiante de que o fragmento se ligou, mas é de baixa ocupação/há alguns problemas com os mapas; 3 - Densidade clara, ligante inesperado - Os mapas indicam claramente a ligação do ligante que não se correlaciona com a estrutura química fornecida; 4 - Alta confiança- A Ligand está inequivocamente ligada.
- Faça as alterações necessárias no modelo neste estágio e inicie o refinamento adicional usando o botão Refinar .
- Use o botão Mostrar lista de tarefas pendentes do MolProbity para acessar a execução da análise do MolProbity45 em todos os ciclos de refinamento.
- Se necessário, adicione parâmetros de refinamento, por exemplo, para fatores de temperatura anisotrópicos, dados geminados ou refinamento de ocupação, selecionando o botão Parâmetros de refinamento .
NOTA: As estatísticas de processamento de dados também são fornecidas no XCE na guia Refinamento e, se o refinamento for executado com o pipeline Buster, os relatórios Buster, incluindo a análise MOGUL46, serão fornecidos. - Altere o status de um conjunto de dados à medida que ele progride pelo refinamento na janela XCE principal na guia Refinamento ou no painel de controle Coot XCE . Quando estiver satisfeito que o modelo é preciso em torno do ligante e adequado para ser compartilhado para análise posterior, altere o status para CompChem Ready. Quando o refinamento estiver concluído e o modelo pronto para upload no PDB, altere o status para Deposition ready.
- Selecione o status das amostras a serem refinadas no menu suspenso Selecionar amostras (geralmente 3 - em refinamento) e clique em GO.
6. Depósito dos dados
Observação : todos os conjuntos de dados de uma tela de fragmento e o modelo de estado fundamental usado para gerar os mapas de eventos PanDDA podem ser depositados no PDB usando deposições de grupo.
- Converta todos os mapas de eventos PanDDA para o formato MTZ executando Mapa de Eventos ->SF no menu Identificação de Ocorrências .
- Forneça metadados adicionais, como autores e métodos, selecionando Deposição > Editar informações. Preencha todos os itens necessários e clique em Salvar no Banco de Dados e, em seguida, salve essas informações para deposição do modelo de estado básico. Faça isso depois que o status do modelo for alterado para Pronto para Deposição.
- Na guia Deposição, selecione o botão Preparar mmcif para gerar arquivos mmcif de fator de estrutura para todos os conjuntos de dados Prontos para Deposição. A seguinte mensagem aparecerá na janela do terminal quando isso for concluído: Concluído Preparando arquivos mmcif para deposição wwPDB.
- Selecione o botão Copiar mmcif para copiar todos esses arquivos para um único arquivo tar compactado no Diretório de Deposição de Grupo da visita.
- Ir para https://deposit-group-1.rcsb.rutgers.edu/groupdeposit; Login com nome de usuário: Grouptester e senha: !2016rcsbpdb. Crie uma sessão e carregue o arquivo ligand-bound.tar.bz2 do diretório de deposição de grupo.
- Após o envio bem-sucedido das estruturas ligadas ao ligante, um e-mail é enviado com os códigos PDB. Selecione Atualizar banco de dados com códigos PDB no menu Deposição ; copie e cole as informações deste email na janela pop-up e clique em Atualizar Banco de Dados para adicionar IDs PDB.
- Para depositar o modelo de estado fundamental usado pelo PanDDA, selecione o diretório PanDDA relevante no XCE e execute apo->mmcif no menu Identificação de ocorrência .
NOTA: XCE irá arbitrariamente selecionar uma estrutura de alta resolução com baixo Rfree como o modelo para o pacote de deposição e, em seguida, compilar todos os arquivos mmcif fator de estrutura em um único arquivo. - Na guia Deposição , selecione o botão Adicionar ao Banco de Dados abaixo da seção Deposição de Grupo do Modelo de Estado Básico .
- Insira os metadados para o modelo de estado fundamental (novamente selecionando Deposição > Editar Informações), carregue o arquivo anterior e Salvar no Banco de Dados.
- Prepare o arquivo mmcif de estado fundamental executando Preparar mmcif da seção Deposição de Grupo do Modelo de Estado Terrestre e, quando concluído, copie o mmcif para o diretório de Deposição de Grupo selecionando o botão Copiar mmcif na mesma seção.
- Como antes, vá para https://deposit-group-1.rcsb.rutgers.edu/groupdeposit; Login com nome de usuário: Grouptester e senha: !2016rcsbpdb. Crie uma sessão e carregue o arquivo ground_state_structures.tar.bz2 do diretório de deposição de grupo.
Resultados
O pipeline do XChem para triagem de fragmentos por cristalografia de Raios-X foi amplamente simplificado, possibilitando sua absorção pela comunidade científica (Figura 5). Esse processo foi validado em mais de 150 campanhas de rastreamento com taxa de acerto variando entre 1% e 30%47,48,49,50,51,52 e por muitos usuários repetidos. Sistemas cristalinos que não são adequados (baixa resolução, inconsistentes na cristalização ou na qualidade da difração) ou não toleram DMSO ou etilenoglicol são eliminados no início do processo, economizando tempo, esforço e recursos. Campanhas bem-sucedidas fornecem um mapa tridimensional de potenciais locais de interação na proteína alvo; um resultado típico é a triagem XChem da protease principal do SARS-CoV-2 (Figura 6). Tipicamente, os acertos dos fragmentos são encontrados em: (a) locais de interesse conhecidos, como sítios ativos enzimáticos e subbolsas48; (b) sítios alostéricos putativos, por exemplo, nas interações proteína-proteína53; (c) interfaces de empacotamento de cristais, geralmente consideradas como falsos positivos (Figura 6). Esses dados estruturais geralmente fornecem uma base para a fusão, ligação ou crescimento de fragmentos em pequenas moléculas semelhantes a chumbo 1,3.
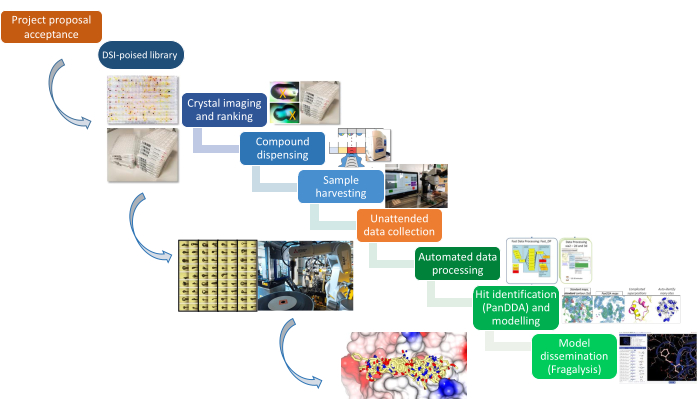
Figura 1: O pipeline do XChem. A plataforma é representada esquematicamente desde a proposta do projeto até a preparação da amostra, coleta de dados e identificação de acertos. Clique aqui para ver uma versão maior desta figura.
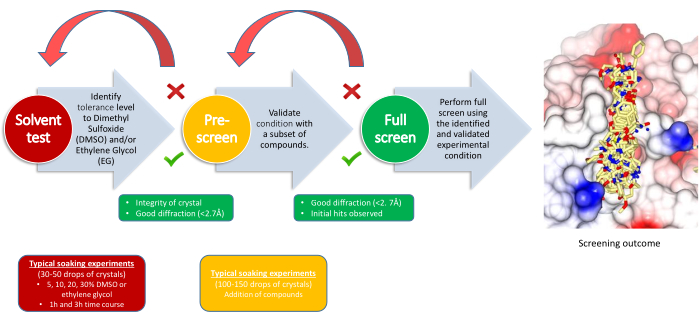
Figura 2: Estratégia de triagem. O fluxo de trabalho indica a finalidade de cada etapa, os requisitos do experimento e os pontos de decisão. Clique aqui para ver uma versão maior desta figura.
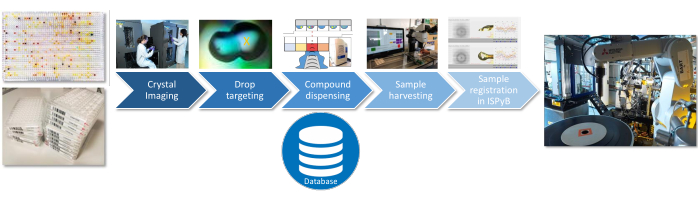
Figura 3: Fluxo de trabalho de preparação da amostra. As etapas críticas para a preparação da amostra são representadas com as informações de cada etapa sendo registradas em um banco de dados SQLite. Clique aqui para ver uma versão maior desta figura.
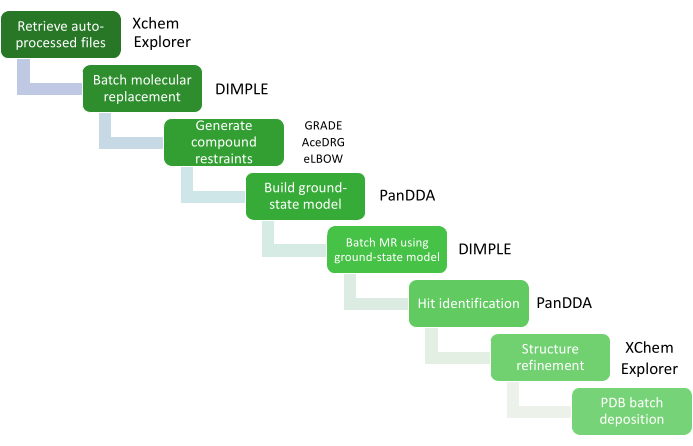
Figura 4: Análise dos dados utilizando XCE. As etapas críticas na análise de dados são representadas por um diagrama de fluxo de trabalho com os pacotes de software relevantes. Clique aqui para ver uma versão maior desta figura.
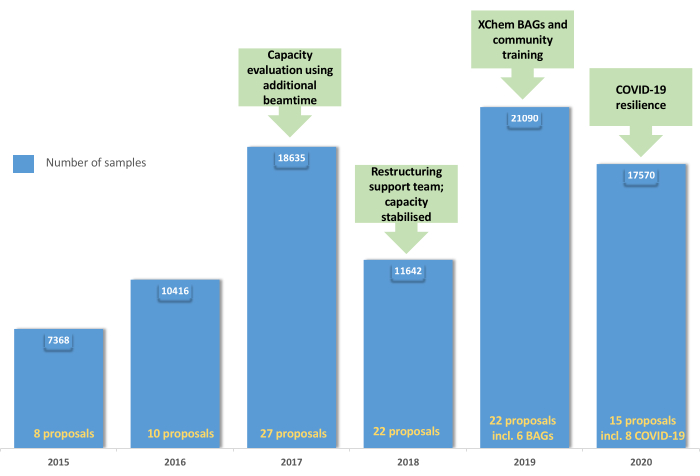
Figura 5: Evolução do programa de usuários do XChem: O gráfico demonstra a aceitação e consolidação do programa de usuários de 2015 a 2019 com a criação de BAGs em 2019 e a resiliência da plataforma durante a pandemia de COVID-19 em 2020. Clique aqui para ver uma versão maior desta figura.
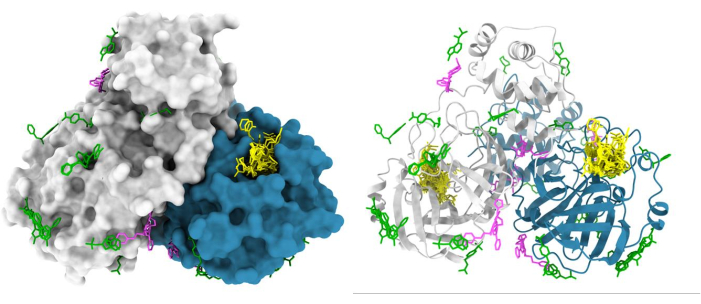
Figura 6: Resultados representativos da tela de fragmento do XChem. O dímero da protease principal do SARS-CoV2 (Mpro) é representado na superfície com os acertos do sítio ativo mostrados em amarelo, os possíveis hits alostéricos mostrados em magenta e os artefatos de superfície/empacotamento de cristais mostrados em verde. A figura foi feita usando entradas de quimera e Mpro PDB a partir de G_1002156 de deposição de grupo. Clique aqui para ver uma versão maior desta figura.
Discussão
O processo descrito neste artigo foi extensivamente testado pela comunidade de usuários e a adaptabilidade dos protocolos descritos aqui é fundamental para lidar com a ampla variedade de projetos normalmente encontrados na plataforma. No entanto, alguns pré-requisitos do sistema de cristal são necessários.
Para qualquer campanha de triagem de fragmentos realizada usando cristalografia de raios X, um sistema cristalino reprodutível e robusto é fundamental. Como o protocolo XChem padrão envolve a adição do fragmento diretamente à gota de cristal, a otimização deve se concentrar no número de gotas contendo cristais de alta qualidade em vez do número total de cristais. Se as gotas contêm vários cristais, então eles são efetivamente redundantes, embora possam aliviar o processo de colheita. Além disso, transferir o protocolo de cristalização do instituto de origem para as instalações no local pode ser um desafio. Isso geralmente é melhor alcançado usando semeadura de cristais para promover nucleação reprodutível54 e, portanto, uma boa prática é que os usuários forneçam estoques de sementes juntamente com suas soluções de proteína e cristalização.
Para garantir uma boa solubilidade e suporte dos compostos, as altas concentrações de embebição destinadas a conduzir a ligação de fragmentos fracos, bibliotecas de fragmentos são fornecidas em solventes orgânicos, especificamente DMSO e etilenoglicol. O fornecimento de dois solventes diferentes oferece aos utilizadores uma alternativa para cristais que não toleram DMSO, ou onde ocluem a ligação de fragmentos num local de interesse. Os usuários podem fornecer bibliotecas alternativas em tampão aquoso: os compostos serão bem dispensados desde que estejam completamente dissolvidos e formatados em placas compatíveis com o robô de distribuição de líquidos.
Para projetos em que não é possível encontrar um solvente orgânico apropriado que solubilize a biblioteca e seja tolerado pelo sistema cristalino, um procedimento alternativo é usar compostos secos, conforme estabelecido no BESSY55.
Na comunidade, há uma questão de longa data sobre ser capaz de mergulhar compostos em cristais cultivados em condições de cristalização contendo altas concentrações de sal. Na prática, observa-se maior precipitação dos compostos e rápida formação de cristais de sal na fase de colheita, que é reduzida com a aplicação de um ambiente úmido ao redor da área de colheita. Geralmente, campanhas de triagem em sistemas de cristal de condições de alta cristalização de sal dão uma taxa de acerto comparável a condições de baixo teor de sal.
Os estágios iniciais do processo XChem (teste de tolerância a solventes e pré-triagem) são experimentos rápidos e de escala relativamente pequena, mas permitem uma decisão clara de ir/não ir para o projeto. Mais dolorosamente, sistemas de cristal alternativos precisarão ser encontrados se nenhum solvente for tolerado, ou se a pré-tela resultar em uma taxa de acerto muito baixa. Por outro lado, se forem bem-sucedidos, os resultados informam diretamente a condição de embebição a ser utilizada para o experimento de triagem e a melhor estratégia para a coleta de dados. Uma vez que a qualidade dos dados, especialmente a resolução, afetará a qualidade da densidade eletrônica para identificação e análise de acertos, o objetivo é mergulhar na maior concentração possível de compostos que não tenham um efeito deletério na qualidade da difração (com a maioria dos conjuntos de dados (~80%) diferindo para uma resolução de 2,8 Å ou melhor).
O processo de análise de dados é simplificado dentro do XChemExplorer, que conta com o software PanDDA para a detecção de ligantes fracos e permite que os usuários visualizem e revisem rapidamente os resultados da campanha de triagem. O XChemExplorer importa resultados de processamento de dados dos pacotes disponíveis no Diamond (DIALS16, autoPROC 30, STARANISO31 e Xia214) com limites de resolução determinados pelo método padrão para cada pacote (ou seja,CC1/2 = 0,3). Por padrão, a seleção do conjunto de dados é baseada em uma pontuação calculada a partir de I/sigI, completude e um número de reflexões exclusivas, mas resultados de processamento específicos podem ser selecionados para uso global ou para amostras individuais25. Os dados também são excluídos da análise pelo PanDDA com base em critérios que incluem resolução, Rlivre e diferença no volume de célula unitária entre dados de referência e de destino (os padrões são 3,5 Å, 0,4 e 12%, respectivamente), de modo que cristais mal difratados, descentralizados ou indexados incorretamente não afetam a análise.
O algoritmo PanDDA aproveita o número substancial de conjuntos de dados coletados durante uma campanha de fragmentos para detectar ligantes de ocupação parcial que não são visíveis em mapas cristalográficos padrão. Inicialmente, o PanDDA usa dados coletados durante o teste de tolerância a solventes e etapas de pré-triagem para preparar um mapa de densidade média que é usado para criar um modelo de estado fundamental. Como este modelo será usado para todas as etapas subsequentes de análise, é vital que ele represente com precisão a proteína não ligada nas condições usadas para a tela de fragmento. O PanDDA então usa uma análise estatística para identificar ligantes ligados, gerando um mapa de eventos para o estado ligado do cristal. Um mapa de eventos é gerado subtraindo-se a fração não ligada do cristal do conjunto de dados de ocupação parcial e apresenta o que seria observado se o ligante estivesse ligado em plena ocupação. Mesmo fragmentos que aparecem claros em mapas convencionais de 2mFo-DF c podem ser mal modelados se os mapas de eventos não forem consultados32. Enquanto o PanDDA é um método poderoso para identificar conjuntos de dados que diferem dos mapas médios (o que geralmente é indicativo de ligação de fragmentos) e métricas como RSCC, RSZD, razão do fator B e RMSD durante o refinamento são fornecidas para o benefício do usuário, o usuário é responsável por decidir se a densidade observada representa com precisão o ligante esperado e a conformação mais adequada.
Após a análise e refinamento dos dados, é possível que todos os usuários depositem simultaneamente várias estruturas no Protein Data Bank (PDB) usando o XChemExplorer. Para cada fragmento-tela, são feitos dois depoimentos grupais. A primeira deposição contém todos os modelos vinculados a fragmentos, com coeficientes para calcular mapas de eventos PanDDA incluídos em arquivos MMCIF. A segunda deposição fornece o modelo de estado fundamental que acompanha, ao longo dos fatores de estrutura medidos de todos os conjuntos de dados do experimento: esses dados podem ser usados para reproduzir a análise do PanDDA e para desenvolver algoritmos futuros. Quanto às estruturas dos hits, quando a ocupação dos fragmentos é baixa, o refinamento é melhor comportado se os modelos forem um composto das estruturas ligantes e confundidoras do estado fundamental32; No entanto, a prática é depositar apenas as frações de estado-limite, uma vez que os modelos compostos completos são, em geral, complexos e difíceis de interpretar. Como resultado, alguns indicadores de qualidade recalculados pelo APO (em particular, R/Rfree) são por vezes ligeiramente elevados. Também é possível fornecer todos os dados brutos usando plataformas como o Zenodo56, embora isso não seja suportado atualmente pelo pipeline do XChem.
No geral, desde sua operação em 2016, os ligantes fragmentados puderam ser identificados em mais de 95% dos alvos usando esse procedimento. A experiência dos muitos projetos que o XChem apoiou foi destilada nas melhores práticas para a preparação de cristais33, enquanto uma biblioteca de fragmentos foi desenvolvida que implementou o conceito de equilíbrio para auxiliar a progressão de fragmentos29, ajudando também a estabelecer a prática de tornar pública a composição da biblioteca. A plataforma demonstrou a importância de uma infraestrutura bem mantida e de processos documentados, detalhados aqui, e tornou possível avaliar outras bibliotecas de fragmentos57,58, comparar bibliotecas48 e informar o projeto da biblioteca colaborativa EUOpenscreen-DRIVE 59,60.
Divulgações
Os autores não têm conflitos de interesse a declarar.
Agradecimentos
Este trabalho representa um grande esforço conjunto entre a Fonte de Luz Diamante e o Consórcio Genômico de Estrutura. Os autores gostariam de agradecer aos vários grupos de apoio e ao grupo MX da Diamond por sua contribuição para a automação da linha de luz i04-1 e por fornecer coleta de dados simplificada e pipelines de processamento automático, que são comumente executados em todas as linhas de luz MX. Eles também gostariam de agradecer ao grupo SGC PX por sua resiliência sendo os primeiros usuários a testar a configuração e à Evotec por ser o primeiro usuário industrial sério. Este trabalho foi apoiado pelo iNEXT-Discovery (Grant 871037) financiado pelo programa Horizonte 2020 da Comissão Europeia.
Materiais
| Name | Company | Catalog Number | Comments |
| DSI-poised library | Enamine | DSI-896 | fragment library |
| Echo 550 and 650 series | Beckman-Coulter | acoustic dispensing system | |
| Echo microplates | Beckman-Coulter | 001-12380; 001-8768; 001-6025 | 1536-well and 384-well microplates |
| Shifter | Oxford Lab Technology | harvesting device | |
| Microplate centrifuge with a swing-out rotor | Sigma | model 11121 | microplate centrifuge |
| 3-drops crystallisation plates | Swissci | 3W96T-UVP | Crystallisation plates |
| Formulatrix plate imager and Rockmaker software | Formulatrix | Crystallisation plates imaging device |
Referências
- Erlanson, D. A., Fesik, S. W., Hubbard, R. E., Jahnke, W., Jhoti, H. Twenty years on: The impact of fragments on drug discovery. Nature Reviews Drug Discovery. 15 (9), 605-619 (2016).
- Jacquemard, C., Kellenberger, E. A bright future for fragment-based drug discovery: what does it hold. Expert Opinion on Drug Discovery. 14 (5), 413-416 (2019).
- Jahnke, W., et al. Fragment-to-lead medicinal chemistry publications in 2019. Journal of Medicinal Chemistry. 63 (24), 15494-15507 (2019).
- Li, Q. Application of fragment-based drug discovery to versatile targets. Frontiers in Molecular Biosciences. 7, 180 (2020).
- Kirsch, P., Hartman, A. M., Hirsch, A. K. H., Empting, M. Concepts and core principles of fragment-based drug design. Molecules. 24 (23), 4309 (2019).
- Patel, D., Bauman, J. D., Arnold, E. Advantages of crystallographic fragment screening: functional and mechanistic insights from a powerful platform for efficient drug discovery. Progress in Biophysics and Molecular Biology. 116 (2-3), 92-100 (2014).
- Wasserman, S., et al. Automated synchrotron crystallography for drug discovery: the LRL-CAT beamline at the APS. Acta Crystallographica Section A Foundations of Crystallography. 67 (1), 46-47 (2011).
- Hartshorn, M. J. Fragment-based lead discovery using X-ray crystallography. Journal of Medicinal Chemistry. 48 (2), 403-413 (2005).
- Arzt, S., et al. Automation of macromolecular crystallography beamlines. Progress in Biophysics and Molecular Biology. 89 (2), 124-152 (2005).
- Beteva, A. High-throughput sample handling and data collection at synchrotrons: Embedding the ESRF into the high-throughput gene-to-structure pipeline. Acta Crystallographica Section D, Biological Crystallography. 62, 1162-1169 (2006).
- Papp, G., et al. FlexED8: The first member of a fast and flexible sample-changer family for macromolecular crystallography. Acta Crystallographica. Section D, Structural Biology. 73, 841-851 (2017).
- Casanas, A., et al. EIGER detector: Application in macromolecular crystallography. Acta Crystallographica Section D, Structural Biology. 72, 1036-1048 (2016).
- Henrich, B., et al. PILATUS: A single photon counting pixel detector for X-ray applications. Nuclear Instruments and Methods in Physics Research, Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 607 (1), 247-249 (2009).
- Winter, G., Lobley, C. M. C., Prince, S. M. Decision making in xia2. Acta Crystallographica Section D, Biological Crystallography. 69, 1260-1273 (2013).
- Winter, G., McAuley, K. E. Automated data collection for macromolecular crystallography. Methods. 55 (1), 81-93 (2011).
- Winter, G., et al. DIALS: Implementation and evaluation of a new integration package. Acta Crystallographica Section D, Structural Biology. 74, 85-97 (2018).
- Bowler, M. W. MASSIF-1: A beamline dedicated to the fully automatic characterization and data collection from crystals of biological macromolecules. Journal of Synchrotron Radiation. 22 (6), 1540-1547 (2015).
- Von Stetten, D., et al. ID30A-3 (MASSIF-3) - A beamline for macromolecular crystallography at the ESRF with a small intense beam. Journal of Synchrotron Radiation. 27, 844-851 (2020).
- Cipriani, F., et al. CrystalDirect: a new method for automated crystal harvesting based on laser-induced photoablation of thin films. Acta Crystallographica. Section D, Biological Crystallography. 68, 1393-1399 (2012).
- . Helmholtz Zentrum Berlin Available from: https://www.helmholtzberlin.de/forschung/oe/np/gmx/fragment-screening/index_en.html (2021)
- Lima, G. M. A., et al. FragMAX: the fragment-screening platform at the MAX IV Laboratory. Acta crystallographica. Section D, Structural biology. 76 (8), 771-777 (2020).
- Ng, J. T., Dekker, C., Kroemer, M., Osborne, M., Von Delft, F. Using textons to rank crystallization droplets by the likely presence of crystals. Acta Crystallographica. Section D, Biological Crystallography. 70, 2702-2718 (2014).
- Collins, P. M., et al. Gentle, fast and effective crystal soaking by acoustic dispensing. Acta Crystallographica. Section D, Structural Biology. 73, 246-255 (2017).
- Wright, N. D., et al. The low-cost Shifter microscope stage transforms the speed and robustness of protein crystal harvesting. Acta Crystallographica. Section D, Structural Biology. 77, 62-74 (2021).
- Krojer, T., et al. The XChemExplorer graphical workflow tool for routine or large-scale protein-ligand structure determination. Acta Crystallographica. Section D, Structural Biology. 73, 267-278 (2017).
- Pearce, N. M., et al. A multi-crystal method for extracting obscured crystallographic states from conventionally uninterpretable electron density. Nature Communications. 8, 15123 (2017).
- . Fragalysis Available from: https://fragalysis.diamond.ac.uk (2021)
- . Diamond Light Source Ltd Available from: https://www.diamond.ac.uk/Instruments/Mx/Fragment-Screening.html (2021)
- Cox, O. B., et al. A poised fragment library enables rapid synthetic expansion yielding the first reported inhibitors of PHIP(2), an atypical bromodomain. Chemical Science. 7 (3), 2322-2330 (2016).
- Vonrhein, C., et al. Data processing and analysis with the autoPROC toolbox. Acta Crystallographica. Section D, Biological Crystallography. 67, 293-302 (2011).
- Vonrhein, C., et al. Advances in automated data analysis and processing within autoPROC , combined with improved characterisation, mitigation and visualisation of the anisotropy of diffraction limits using STARANISO. Acta Crystallographica Section A: Foundations and Advances. 74 (1), 360 (2018).
- Pearce, N. M., Krojer, T., Von Delft, F. Proper modelling of ligand binding requires an ensemble of bound and unbound states. Acta Crystallographica. Section D, Structural Biology. 73, 265-266 (2017).
- Collins, P. M., et al. Achieving a good crystal system for crystallographic x-ray fragment screening. Methods in Enzymology. 610, 251-264 (2018).
- Delageniere, S., et al. ISPyB: an information management system for synchrotron macromolecular crystallography. Bioinformatics. 27 (22), 3186-3192 (2011).
- Fisher, S. J., Levik, K. E., Williams, M. A., Ashton, A. W., McAuley, K. E. SynchWeb: a modern interface for ISPyB. Journal of Applied Crystallography. 48, 927-932 (2015).
- Ginn, H. M., et al. SynchLink: an iOS app for ISPyB. Journal of Applied Crystallography. 47, 1781-1783 (2014).
- . Diamond Light Source Ltd Available from: https://www.diamond.ac.uk/Instruments/Mx/Common/Common-Manual/Data-Analysis/Reprocessing-in-ISPyB.html (2021)
- Wojdyr, M., Keegan, R., Winter, G., Ashton, A. DIMPLE - a pipeline for the rapid generation of difference maps from protein crystals with putatively bound ligands. Acta Crystallographica. Section A, Foundations of Crystallography. 69, 299 (2013).
- Long, F., et al. AceDRG: A stereochemical description generator for ligands. Acta Crystallographica. Section D, Structural Biology. 73, 112-122 (2017).
- Moriarty, N. W., Grosse-Kunstleve, R. W., Adams, P. D. Electronic ligand builder and optimization workbench (eLBOW): A tool for ligand coordinate and restraint generation. Acta Crystallographica. Section D, Biological Crystallography. 65, 1074-1080 (2009).
- Emsley, P., Lohkamp, B., Scott, W. G., Cowtan, K. Features and development of Coot. Acta Crystallographica. Section D, Biological Crystallography. 66, 486-501 (2010).
- Murshudov, G. N., Vagin, A. A., Dodson, E. J. Refinement of macromolecular structures by the maximum-likelihood method. Acta Crystallographica. Section D, Biological Crystallography. 53, 240-255 (1997).
- Bricogne, G., et al. Buster version 2.10.3. Global Phasing Ltd. , (2017).
- Chen, V. B., et al. MolProbity: All-atom structure validation for macromolecular crystallography. Acta Crystallographica. Section D, Biological Crystallography. 66, 12-21 (2010).
- Bruno, I. J., et al. Retrieval of crystallographically-derived molecular geometry information. Journal of Chemical Information and Computer Sciences. 44 (6), 2133-2144 (2004).
- Delbart, F., et al. An allosteric binding site of the α7 nicotinic acetylcholine receptor revealed in a humanized acetylcholine-binding protein. TheJournal of Biological Chemistry. 293, 2534-2545 (2018).
- Douangamath, A., et al. Crystallographic and electrophilic fragment screening of the SARS-CoV-2 main protease. Nature Communications. 11 (1), 5047 (2020).
- Guo, J., et al. In crystallo-screening for discovery of human norovirus 3C-like protease inhibitors. Journal of Structural Biology: X. 4, 100031 (2020).
- Keedy, D. A., et al. An expanded allosteric network in PTP1B by multitemperature crystallography, fragment screening, and covalent tethering. eLife. 7, 36307 (2018).
- McIntyre, P. J., et al. Characterization of three druggable hot-spots in the aurora-a/tpx2 interaction using biochemical, biophysical, and fragment-based approaches. ACS Chemical Biology. 12 (11), 2906-2914 (2017).
- Thomas, S. E., et al. Structure-guided fragmentbased drug discovery at the synchrotron: Screening binding sites and correlations with hotspot mapping. Philosophical Transactions. Series A, Mathematical, Physical and Engineering Sciences. 377 (2147), 20180422 (2019).
- Nichols, C., et al. Mining the PDB for tractable cases where x-ray crystallography combined with fragment screens can be used to systematically design protein-protein inhibitors: Two test cases illustrated by IL1β-IL1R and p38α-TAB1 complexes. Journal of Medicinal Chemistry. 63 (14), 7559-7568 (2020).
- D'Arcy, A., Bergfors, T., Cowan-Jacob, S. W., Marsh, M. Microseed matrix screening for optimization in protein crystallization: What have we learned. Acta Crystallographica. Section F, Structural Biology Communications. 70, 1117-1126 (2014).
- Wollenhaupt, J., et al. F2X-Universal and F2X-Entry: Structurally diverse compound libraries for crystallographic fragment screening. Structure. 28 (6), 694-706 (2020).
- . Zenodo Available from: https://zenodo.org (2021)
- Foley, D. J., et al. Synthesis and demonstration of the biological relevance of sp(3) -rich scaffolds distantly related to natural product frameworks. Chemistry. 23 (60), 15227-15232 (2017).
- Kidd, S. L., et al. Demonstration of the utility of DOS-derived fragment libraries for rapid hit derivatisation in a multidirectional fashion. Chemical Science. 11 (39), 10792-10801 (2020).
- . EU-openscreen ERIC Available from: https://www.eu-openscreen.eu/ (2021)
- Schuller, M., et al. Fragment binding to the Nsp3 macrodomain of SARS-CoV-2 identified through crystallographic screening and computational docking. bioRxiv. 393405, (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados