Method Article
Evaluación intraoperatoria de los márgenes de resección en el cáncer de cavidad oral: este es el camino
En este artículo
Resumen
El objetivo de este protocolo es proporcionar una visión general clara de la evaluación intraoperatoria impulsada por muestras de los márgenes de resección. Se recomienda implementar este protocolo para mejorar la atención al paciente en otros institutos.
Resumen
El objetivo de la cirugía oncológica de cabeza y cuello es la resección completa del tumor con márgenes de resección adecuados, preservando al mismo tiempo la función y la apariencia aceptables. Para el carcinoma de células escamosas de cavidad oral (OCSCC), diferentes estudios mostraron que solo el 15% -26% de todas las resecciones son adecuadas. Una de las principales razones del bajo número de resecciones adecuadas es la falta de información durante la cirugía; el estado del margen solo está disponible después de la evaluación histopatológica final, días después de la cirugía.
Los cirujanos y patólogos del Centro Médico de la Universidad Erasmus MC en Rotterdam comenzaron la implementación de la evaluación intraoperatoria impulsada por muestras de los márgenes de resección (IOARM) en 2013, que se convirtió en el estándar de atención en 2015. Este método permite al cirujano convertir una resección inadecuada en una resección adecuada mediante la realización de una resección adicional durante la cirugía inicial. La evaluación intraoperatoria está respaldada por un procedimiento de método de reubicación que permite la identificación precisa de márgenes inadecuados (encontrados en la muestra) en el lecho de la herida.
La implementación de este protocolo resultó en una mejora de las resecciones adecuadas del 15% al 40%. Sin embargo, el IOARM impulsado por muestras no se adopta ampliamente porque la obtención de tejido fresco es contraria a la intuición para los patólogos. Existe el temor de que la extracción de tejido fresco deteriore la orientación anatómica, la forma y el tamaño de la muestra y, por lo tanto, afecte la evaluación histopatológica final. Estos posibles efectos negativos son contrarrestados por el protocolo descrito. Aquí, el protocolo para IOARM impulsado por muestras se presenta en detalle, como se realizó en el instituto.
Introducción
Cada año, alrededor de 350.000 nuevos pacientes son diagnosticados en todo el mundo con cáncer en la cavidad oral; El 90% de los casos son carcinoma de células escamosas1. La tasa de mortalidad es de 175.000 en todo el mundo por año y la supervivencia a 5 años es del 50% al 64,8%1,2,3,4.
El tratamiento primario del carcinoma de células escamosas de cavidad oral (OCSCC) es la cirugía5. El objetivo de la cirugía es la extirpación completa del tumor con márgenes adecuados, según el Royal College of Pathologists6. Los márgenes >5 mm (claros) se consideran adecuados, mientras que los márgenes de 0-5 mm se consideran inadecuados.
Los márgenes de resección adecuados conducen a una mayor supervivencia y a una reducción de las tasas de recurrencia local de OCSCC7,8,9. Las resecciones tumorales con márgenes inadecuados dan lugar a la necesidad de terapia adyuvante (radioterapia postoperatoria y/o quimioterapia). Esto trae una carga adicional para el paciente, aumentando la morbilidad y reduciendo la calidad de vida10. El margen de resección es el único factor pronóstico oncológico en el que el cirujano y el patólogo pueden influir.
Informes recientes han demostrado que las resecciones adecuadas solo se logran en el 15%-26% de los casos7,8,11. Estos malos resultados son causados por la compleja anatomía de la cavidad oral y la falta de orientación intraoperatoria. Durante la cirugía, el cirujano solo puede confiar en la inspección, la palpación y las imágenes preoperatorias.
El estado final del margen sigue solo varios días después de la operación. Si se encuentra un margen inadecuado en la evaluación patológica final, una segunda operación generalmente no es una opción, porque la reconstrucción del lecho de la herida generalmente se ha curado en ese momento. Además, una segunda operación en su mayoría no es efectiva, porque la reubicación del margen inadecuado es aún más difícil en el entorno postoperatorio.
Para superar la falta de información intraoperatoria sobre el estado del margen, en 2013 se implementó la evaluación intraoperatoria de los márgenes de resección (IOARM) impulsada por muestras9. Se convirtió en el estándar de atención en el instituto en 2015. Aquí se describe el método IOARM en detalle para permitir que los colegas de otros institutos implementen este protocolo.
Protocolo
Este estudio fue aprobado por el Comité de Ética Médica institucional (MEC-2015-150).
NOTA: Toda la información del paciente y del personal en las figuras o ejemplos son ficticios (es decir, XXXXX y AAAA).
1. Antes de la cirugía
- Servicio de cirugía: Solicitud de IOARM durante la planificación de la cirugía.
- Departamento de Patología: Asegurar la logística/equipamiento (ver Tabla de Materiales)y la disponibilidad de personal (patólogo/patólogo residente y asistente).
2. Durante la cirugía
- Quirófano (OR)
- Asegúrese de que todo el personal involucrado esté familiarizado con el protocolo de reubicación12.
- Siga el protocolo de reubicación.
- Sumerja las etiquetas en clorhexidina durante al menos 30 minutos antes del inicio de la cirugía.
- Coloque las etiquetas emparejadas a cada lado de la línea de resección prevista (tanto superficial como profunda), de modo que una etiqueta esté en la muestra de resección y la otra permanezca en el punto correspondiente en el lecho de la herida(Figura 1A)como lo describen Van Lanschot et al.12.
- Corte entre cada par de etiquetas.
- Extraer la muestra con el tumor (queda una etiqueta de cada par en el lecho de la herida, Figura 1B).
- Complete el formulario de solicitud de patología con una indicación clara de la ubicación anatómica de las etiquetas (por ejemplo, etiqueta 1 = anterior, etiqueta 2 = superior).
- Registre los defectos relacionados con el procedimiento quirúrgico de la muestra y su ubicación en relación con las etiquetas, en el formulario de solicitud de patología.
NOTA: Los defectos relacionados con el procedimiento crean superficies de resección falsas y pueden conducir a una asignación incorrecta de márgenes inadecuados tanto durante el IOARM como en la patología final. - Llevar la muestra al servicio de patología.
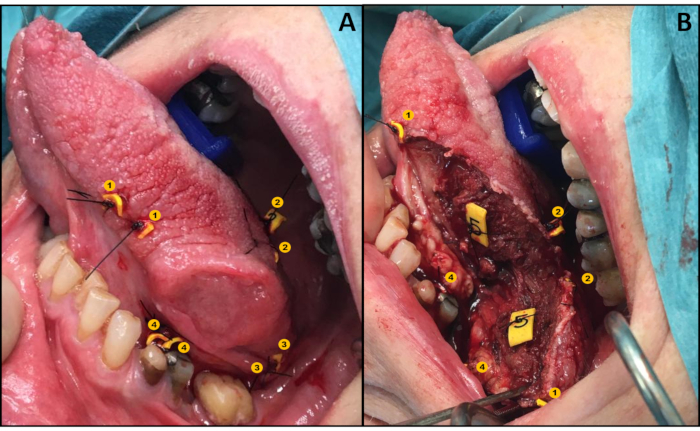
Figura 1: Ilustración del protocolo de reubicación. (A) Aplicación de etiquetas de forma por pares. (B) Lecho de herida y espécimen ambos con una etiqueta de cada par. Haga clic aquí para ver una versión más grande de esta figura.
- IOARM - Sala de recaudación (GR), departamento de patología
- Enjuague la muestra con agua y séquela suavemente con gasa o papel.
NOTA: Registre cada paso siguiente con fotografías y guárdelas en el Archivo Electrónico del Paciente (EPF). - Registre la información general (fecha, identificación del paciente, número de patología, cirujano, patólogo, tipo de muestra y etiquetas utilizadas) en la plantilla anatómica.
- Indique las ubicaciones de las etiquetas en la plantilla anatómica (Figura 2).
- Coloque la muestra en la plantilla anatómica.
- Enjuague la muestra con agua y séquela suavemente con gasa o papel.
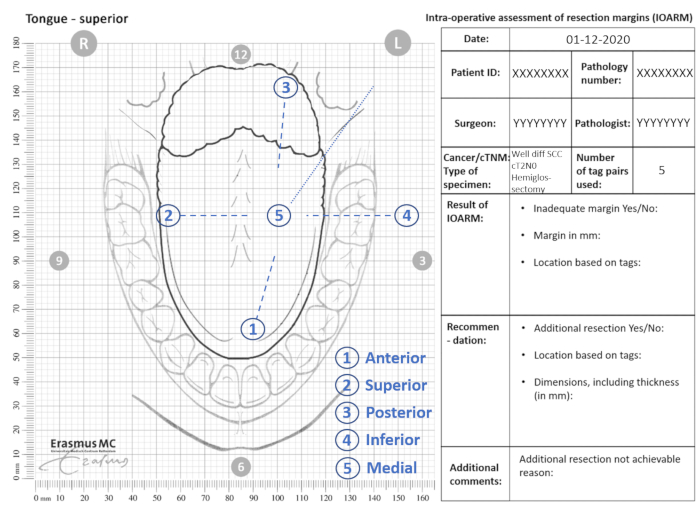
Figura 2: Ejemplo de plantilla anatómica para IOARM. Haga clic aquí para ver una versión más grande de esta figura.
- Entinte la superficie de resección de acuerdo con el protocolo estándar (por ejemplo, azul superior y verde inferior).
- Inspeccionar la muestra visualmente y por palpación (patólogo y cirujano).
- Indique la ubicación de cualquier región sospechosa (es decir, margen <5 mm) en la plantilla anatómica y relacionarla con las etiquetas numeradas (sección Resultado de IOARM, Figura 2).
- Realizar una incisión perpendicular a la superficie de resección en la región sospechosa (Figura 3A). Dependiendo del tamaño de la muestra y/o regiones sospechosas, realice una o más incisiones con una distancia de aproximadamente 5 mm. En caso de más de una incisión, numere las incisiones como IOA1, IOA2, etc.
- Mida los márgenes (es decir, la distancia entre la superficie de resección y el borde del tumor) en las secciones de tejido(Figura 3B)y registre los valores exactos en mm en la plantilla anatómica (sección Resultado de IOARM, Figura 3C).
NOTA: Si el borde del tumor no es macroscópicamente distinguible (por ejemplo, el tumor no se puede distinguir del tejido fibrótico o de las glándulas salivales circundantes), se indica el análisis microscópico por sección congelada.
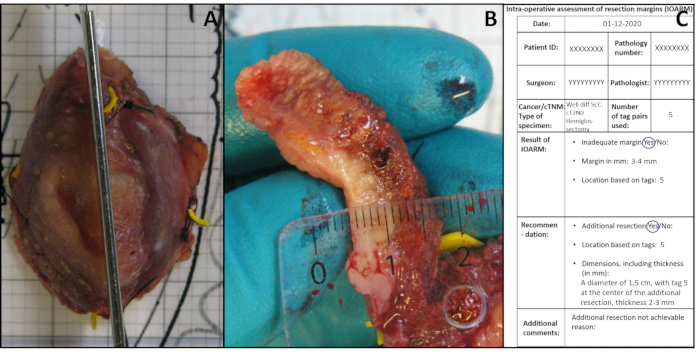
Figura 3: Ilustración de IOARM. (A) Incisión perpendicular realizada después de la identificación de la región sospechosa por palpación. (B) Se mide el margen. C)Se registran el resultado del IOARM y la recomendación. Haga clic aquí para ver una versión más grande de esta figura.
- Continúe con la finalización de la operación, paso 2.2.19. Si se detecta un margen adecuado (es decir, no se necesita una resección adicional).
- Indique la ubicación exacta en función de las etiquetas si se detecta un margen inadecuado y regístrelo en la plantilla. Proceda con una resección adicional si es quirúrgica / técnicamente alcanzable, paso 2.2.13.
- Anote el motivo en la plantilla, si no se puede lograr una resección adicional (sección Comentarios adicionales, Figura 2).
- Recomendar (patólogo/cirujano) la resección adicional en función de la ubicación exacta e indicar el grosor necesario para lograr una resección adecuada(Figura 3C).
NOTA: Si el margen inadecuado se refiere a un margen positivo, se debe recomendar un espesor mínimo de 6 mm para la resección adicional. - Mantenga (patólogo) la muestra de resección principal en el refrigerador hasta que se reciba la resección adicional.
- Reubicar (cirujano) el área de resección adicional en relación con las etiquetas, en el lecho de la herida, según el registro de IOARM(Figura 3C).
- Realice la resección adicional.
- Envíe la resección adicional al GR.
- Verificar (patólogo) la precisión de la resección adicional con respecto a su ubicación (basada en etiquetas) y su tamaño.
NOTA: Los pasos anteriores son aplicables en el caso de un margen cercano. En el caso de un margen positivo, es necesario un IOARM de la resección adicional (patólogo). El cirujano espera el resultado del segundo IOARM antes de completar la operación. - Retire (cirujano) las etiquetas restantes del lecho de la herida y complete la operación.
- Copie (patólogo) todos los datos de la plantilla anatómica a la EPF.
3. Después de IOARM - Sala de grossing (GR), departamento de patología
NOTA: Para preservar la orientación anatómica y la forma de la muestra se realizan los siguientes pasos.
- Vuelva a montar la muestra por la orientación correcta de todas las secciones de tejido (secciones transversales y los extremos polares) en función de las etiquetas y las fotografías registradas durante IOARM.
NOTA: Las secciones transversales están en el medio de la muestra y los extremos polares son las partes externas de la muestra. - Cortar los trozos de corcho ligeramente más grandes que las secciones de tejido.
- Coloque cada sección de tejido sobre un trozo de corcho.
- Dibuje una línea en el corcho alrededor de la sección de tejido con un marcador permanente y tome una fotografía(Figura 4A).
- Coloque otro trozo de corcho encima de todas las secciones de tejido excepto los extremos polares(Figura 4B).
- Mantenga el corcho superior e inferior juntos, con la sección de tejido en el medio, colocando alfileres a través de ambos corchos junto al borde de la sección de tejido, pero no a través de la sección de tejido (Figura 4B).

Figura 4: Ilustración del método para preservar la orientación anatómica y la forma de las secciones de tejido. (A) Las secciones de tejido se colocan en un trozo de corcho con una línea dibujada en el corcho alrededor de la sección de tejido con un marcador permanente. (B) Los pasadores se colocan oblicuamente sobre los extremos polares y se coloca otro trozo de corcho sobre la sección de tejido. (C) Ilustración de un ejemplar fresco reensamblado mantenido junto con alfileres que perforan los corchos adyacentes. (D) Ilustración de una muestra fija reensamblada mantenida junto con alfileres que perforan los corchos adyacentes. Haga clic aquí para ver una versión más grande de esta figura.
- Coloque los extremos polares sobre una pieza separada de corcho(Figura 4A).
- Mantenga los extremos polares unidos al corcho colocando oblicuamente alfileres sobre el tejido y perforando el corcho justo al lado del borde del tejido (Figura 4B).
PRECAUCIÓN: No perfore la muestra con los alfileres. - Vuelva a montar toda la muestra: coloque todas las secciones de tejido, incluidos los extremos polares, juntas en la orientación anatómica correcta.
- Mantenga todas las secciones de tejido juntas perforando los corchos adyacentes (Figura 4C).
- Coloque la muestra con la orientación correcta en la plantilla anatómica y tome una fotografía.
- Coloque la muestra en solución de formaldehído (formalina 4%).
NOTA: Para una fijación adecuada, se pueden colocar trozos de papel encima de la muestra para mantenerla sumergida en formalina. - Haga una nota de advertencia clara y visible en el recipiente con la muestra (por ejemplo, agujas / alfileres de precaución), para evitar accidentes.
- Almacene el recipiente con la muestra para su posterior procesamiento, de acuerdo con el protocolo de patología estándar.
4. Captación de la muestra fija después de IOARM
NOTA: Después de la fijación de formalina, la muestra debe ser recolectada preferiblemente por el patólogo / residente / asistente, que realizó el IOARM.
PRECAUCIÓN: Tenga cuidado con las agujas/alfileres al retirar la muestra del recipiente.
- Seguir el protocolo de recaudación institucional.
NOTA: Tomar medidas adicionales para garantizar la orientación correcta y facilitar la comparación del estado del margen entre IOARM y la evaluación patológica final.- Consulta las fotos del IOARM.
- Saque la muestra del recipiente.
- Compruebe si todas las secciones de tejido están presentes.
- Coloque la muestra con la orientación correcta en la plantilla anatómica y tome una fotografía(Figura 4D).
- Retire los pines.
- Separe las secciones de tejido individuales con el corcho correspondiente.
- Tome fotografías de cada sección de tejido con sus corchos correspondientes, centrándose en las líneas que se dibujaron alrededor de la sección de tejido para evaluar la posible contracción del tejido después de la fijación (Figura 5).

Figura 5: Ilustración de un extremo polar con la superficie cortada frente al corcho, sostenida contra el corcho por pasadores inclinados. ( A )Muestrafresca. (B) Después de la fijación. (C) La superficie cortada del extremo polar es plana después de la fijación. Haga clic aquí para ver una versión más grande de esta figura.
- Separe todas las secciones de tejido sistemáticamente del corcho (por ejemplo, comience de anterior a posterior o de izquierda a derecha).
- Satura de las secciones de tejido IOARM a las secciones de tejido final estándar (2-3 mm de espesor).
- Coloque todas las secciones finales de tejido, en la orientación anatómica correcta (por ejemplo, de anterior a posterior), en un papel en la mesa de grossing.
- Numere todas las secciones finales de tejido consecutivamente con un marcador permanente en el papel (Figura 6).
- Anote la ubicación de IOARM con un marcador permanente (Figura 6).
- Tome fotografías, incluidas todas las secciones finales de tejido y guárdelas en el EPF (Figura 6).
- Seleccione las secciones de tejido final relevantes y las secciones de IOARM que se procesarán posteriormente para la evaluación patológica final.

Figura 6: Espécimen bruto con la ubicación del IOARM marcada. Los números correspondientes 1-5 se refieren a las secciones de tejido de izquierda a derecha. A-E se corresponde con las secciones de tejido incluidas para la evaluación histopatológica. Tenga en cuenta que la pieza restante de tejido que se evaluó por sección congelada (FS) está indicada para permitir la comparación directa con la sección permanente teñida con HE. Haga clic aquí para ver una versión más grande de esta figura.
5. La evaluación patológica final - Impacto del IOARM en el estado final del margen
- Siga el protocolo estandarizado local. El protocolo seguido aquí es el protocolo nacional PALGA (Pathologisch-Anatomisch Landelijk Geautomatiseerd Archief, la red nacional y el registro de histopatología y citopatología en los Países Bajos) para el informe final estandarizado de patología estructurada.
NOTA: Este protocolo se basa en los estándares actualizados del American Joint Committee on Cancer (AJCC), la Unión para el Control Internacional del Cáncer (UICC) y la Organización Mundial de la Salud (OMS).- Evalúe todos los márgenes en milímetros, incluyendo mucosa, submucosa y hueso.
- Si se encuentra un margen inadecuado, anote su extensión (por ejemplo, el margen submucoso anterior es de 3,5 mm, extendiéndose sobre una trayectoria de 6 mm).
- Evaluar la presencia de displasia y su grado para los márgenes de resección mucosa.
- Indique el margen final agregando las dimensiones de la resección adicional (si se realiza) al margen medido en la muestra principal.
- Registre el número de patología único de la resección adicional en el informe de patología de la muestra principal (por ejemplo, Márgenes: anterior 6 mm, posterior 8 mm, superior 6 mm (incluidos 3 mm de la resección adicional, H20-2021), inferior 7 mm, medial 5,3 mm).
- Verifique los márgenes encontrados durante IOARM.
- Anote el resultado de esta verificación (por ejemplo, los márgenes NB encontrados durante la evaluación intraoperatoria están en concordancia con los márgenes basados en la patología final).
NOTA: El tiempo necesario para IOARM debe ser limitado para no interferir con el flujo de trabajo quirúrgico. En el instituto, el IOARM tarda unos 10 minutos. El cirujano y el patólogo realizan el IOARM juntos. Para el método de reubicación (colocación de las etiquetas durante la cirugía) se necesita un tiempo adicional de 5 minutos. Esto diferirá para cada instituto dependiendo de la logística.
Resultados
Ejemplo de IOARM que resulta en una resección adecuada
El paciente presenta un CCE cT2N0M0 del lado izquierdo de la lengua sin antecedentes médicos. El paciente se somete a una hemiglosectomía apoyada por IOARM. El espécimen es inspeccionado y palpado; los márgenes de la mucosa se miden como >5 mm. Un área en la superficie de resección submucosa es sospechosa por un margen inadecuado, ubicado alrededor de la etiqueta 5. El margen submucoso es de 3-4 mm en la etiqueta 5. Toda la información se registra en la plantilla y se copia en el EPF(Figura 7A).
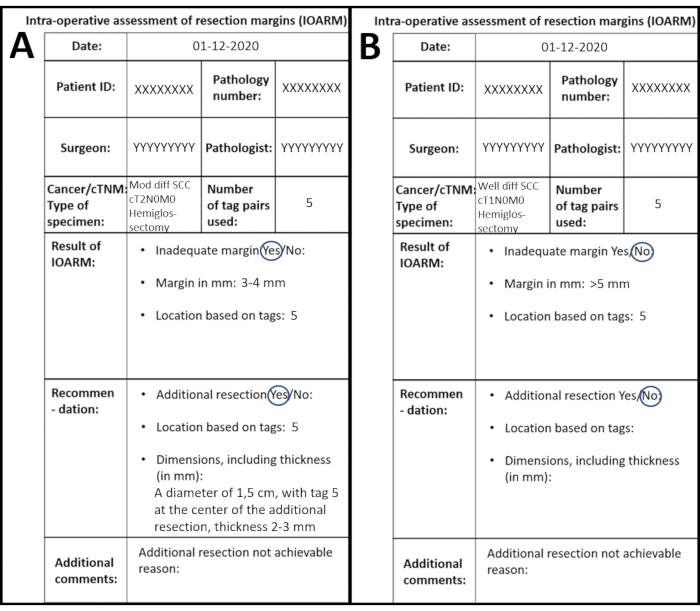
Figura 7: Ejemplos de dos IOARM diferentes registrados en la plantilla anatómica. (A) IOARM que resulta en una resección adecuada. (B) IOARM no resulta en una resección adecuada. Haga clic aquí para ver una versión más grande de esta figura.
El cirujano regresa al quirófano y realiza la resección adicional. El patólogo verifica la precisión y las dimensiones, incluido el grosor de la resección adicional.
El informe patológico final muestra la presencia de carcinoma de células escamosas pT2 moderadamente diferenciado en el lado izquierdo de la lengua. El diámetro del tumor es de 2,5 cm y la profundidad de invasión es de 6,0 mm. El peor patrón de invasión (WPOI) es la categoría 3. La invasión perineural (PNI) no está presente y la invasión linfovascular (LVI) está presente. Los márgenes mínimos (mucosa y submucosa) en la ubicación inferior, superior, anterior y posterior son 5,8 mm (incluida la resección adicional (número PA: XXXXX) de 3 mm de espesor), 6,2 mm (incluida la resección adicional (número PA: XXXXX) de 3 mm de espesor), 5,2 mm y 5,5 mm, respectivamente. IOARM está en concordancia con la patología final.
| Márgenes (mm) | |||
| Ubicación | Basado en IOARM | Después de una resección adicional | Basado en patología final |
| Inferior | 3-4 | 6-7 | 5.8 |
| Superior | 3-4 | 6-7 | 6.2 |
| Anterior | >5 | 5.2 | |
| Posterior | >5 | 5.5 | |
Tabla 1: Ejemplo de márgenes de resección durante IOARM que resultan en una resección adecuada en la patología final,después de una resección adicional.
Ejemplo de IOARM que no resulta en una resección adecuada
El paciente presenta un CCE cT1N0M0 del lado derecho de la lengua sin antecedentes médicos. La paciente se sometió a una resección apoyada por IOARM. El cirujano lleva la muestra al patólogo del departamento de patología. La mucosa se inspecciona visualmente, y los márgenes de la mucosa se miden con una regla transparente, todos los márgenes de la mucosa se >5 mm. Los márgenes submucosos se inspeccionan y palpan visualmente y todos los márgenes parecen >5 mm. Se encuentra un área sospechosa en la etiqueta 1 (superficie de resección anterior) y la etiqueta 3 (superficie de resección posterior). Se coloca un cuchillo grueso perpendicular a la superficie de resección de anterior a posterior (etiqueta 1 a etiqueta 3) y se realiza una incisión. El patólogo mide el margen en la sección transversal y los márgenes son >5 mm. Toda la información se registra en la plantilla y se copia en el EPF(Figura 7B).
El informe patológico final muestra un carcinoma de células escamosas pT1 bien diferenciado en el lado derecho de la lengua. El diámetro del tumor es de 1,8 cm y la profundidad de invasión es de 3,8 mm. El peor patrón de invasión (WPOI) es la categoría 2. La invasión perineural (PNI), la invasión linfovascular (LVI) y la displasia no están presentes. Los márgenes mínimos (mucosa y submucosa) en las ubicaciones inferior, superior, anterior y posterior son de 4,0 mm, 6,1 mm, 6,4 mm y 7,8 mm, respectivamente. IOARM no está en concordancia con la patología final, se perdió el margen inferior.
| Márgenes (mm) | |||
| Ubicación | Basado en IOARM | Después de una resección adicional | Basado en patología final |
| Inferior | >5 | No se recomiendan todos los márgenes > 5mm | 4.0 |
| Superior | >5 | 6.1 | |
| Anterior | 6 | 6.4 | |
| Posterior | 8 | 7.8 | |
Tabla 2: Ejemplo de márgenes de resección durante IOARM que no resultan en una resección adecuada en la patología final.
Discusión
El objetivo del tratamiento quirúrgico de los pacientes con OCSCC es la extirpación completa del tumor con márgenes adecuados. Con demasiada frecuencia, esto no se logra, lo que inspiró a diseñar un enfoque ajustado para la cirugía del cáncer oral con un enfoque en la evaluación intraoperatoria de los márgenes de resección. Además de los márgenes de resección, otros factores tumorales adversos como el patrón de invasión, la invasión perineural y la invasión linfovascular también afectan la recurrencia local. Sin embargo, de todos los factores tumorales adversos, los cirujanos y patólogos solo pueden influir en los márgenes de resección7,8,11.
El método IOARM impulsado por muestras se implementó en 2013; esto fue finalmente respaldado por la evidencia de que ioarm impulsado por muestras es superior a IOARM impulsado por defectos7,13,14,15,16,17. Esto dio lugar a su recomendación por parte de AJCC en 201718. Cabe destacar que el método IOARM impulsado por muestras se convirtió en el estándar de atención en el instituto en 2015. Desde 2013 hasta 2020, el IOARM se realizó en 304 casos con un fuerte aumento desde 2018.
Es importante darse cuenta de que el desarrollo e implementación de un método IOARM involucra a mucho personal (patólogos / cirujanos / asistentes / aprendices / investigadores), con el fin de convertirlo en un estándar de atención. Muchos profesionales estuvieron involucrados, durante muchos años, en el desarrollo de este protocolo, que en realidad es la fuerza del método. El desarrollo de este método comenzó en 2013 y alcanzó un consenso en 2015. Esto se logró en base a las reuniones de dos semanas durante las cuales se llevaron a cabo discusiones sobre todos los pacientes tratados con cirugía, incluido IOARM. De esta manera, fue posible ajustar y refinar oportunamente el procedimiento. Además, las reuniones de dos semanas permitieron la recolección prospectiva de datos, lo que proporciona la base para los estudios de desempeño y seguimiento9. Además, para cada caso, el equipo se aseguró de que la patología final no se viera comprometida debido a IOARM. Finalmente, es importante darse cuenta de que este tipo de evaluación es un proceso dinámico y siempre sufrirá cambios hacia la mejora.
Con el método IOARM impulsado por muestras, los márgenes se evalúan mediante inspección, palpación e incisiones perpendiculares (grossing). Este enfoque proporciona una estimación lo más precisa posible de los márgenes en milímetros y permite la retroalimentación sobre si se necesita una resección adicional y cuáles deberían ser las dimensiones. Kubik et al. describieron varias razones (por ejemplo, resección adicional en una ubicación incorrecta, la orientación incorrecta de la resección adicional, dimensiones incorrectas de la resección adicional) para que las resecciones adicionales sean inadecuadas17. El IOARM es un método valioso, pero solo cuando se acompaña de un método de reubicación lo más preciso posible de márgenes inadecuados para permitir al cirujano realizar una resección adicional adecuada. La relación espacial entre la resección adicional y el espécimen principal es el factor clave. Por lo tanto, un método de reubicación simple pero elegante como se muestra en la Figura 1 fue desarrollado y descrito en detalle por Van Lanschot et al.12. Este método permite al cirujano realizar una resección adicional basada en la reubicación del margen inadecuado definido por las etiquetas en el lecho de la herida. Por ejemplo, se encuentra un margen de 2 mm entre las etiquetas 1-2-3, el cirujano realiza una resección adicional alrededor de las etiquetas 1-2-3 con un grosor de 4 mm. Este método de reubicación ha demostrado ser eficaz por los resultados de Smits et al.9.
Este método IOARM es compatible con el procedimiento de sección congelada solo si el tumor no se puede distinguir macroscópicamente del tejido circundante (por ejemplo, fibrosis del tejido después de la radioterapia o formación de cicatrices después de una cirugía previa, o tejido de la glándula salival). Algunos institutos utilizan otro enfoque, en el que las secciones congeladas se toman de la muestra de todos los cuadrantes13,19. Este método permite un protocolo más estandarizado. Sin embargo, la exhaustividad de este método puede no ser siempre eficiente. Además, se necesitan múltiples secciones congeladas, lo que es costoso, requiere mucho tiempo y no es accesible para todos los institutos. El método descrito es más eficiente porque la región de interés está preseleccionada (es decir, la región de margen inadecuado sospechoso) y, por lo tanto, es más barata, más rápida y está disponible para todos los institutos. Esto está de acuerdo con los hallazgos anteriores de que el análisis de secciones congeladas no mejora la precisión del IOARM impulsado por muestras basado en la recaudación en la mayoría de los casos y no es rentable20,21,22.
Según la literatura >93% de todos los márgenes inadecuados se encuentran en los márgenes de resección submucosos23. Esto está en línea con los hallazgos del instituto. Las alteraciones de la mucosa con displasia / CIS de alto grado a menudo son fáciles de detectar durante IOARM, solo en unos pocos casos, se recomienda una sección congelada. Hasta ahora, en la cohorte IOARM, no se han encontrado márgenes positivos de la mucosa con respecto al cáncer o la displasia / CIS de alto grado.
A pesar de que el IOARM impulsado por muestras mejora significativamente la tasa de resecciones adecuadas en pacientes con OCSCC y, enconsecuencia,mejora el resultado del paciente7,9,22,21, su amplia implementación está rezagada. La causa principal de esto es el hecho de que la captación de tejido fresco es contraria a la intuición para los patólogos. Los patólogos temen que la extracción de tejido fresco deteriore la orientación anatómica, la forma y el tamaño de la muestra y, por lo tanto, afecte la evaluación histopatológica final24,25. Sin embargo, las medidas prescritas en el protocolo previenen estos posibles efectos negativos. Desde la implementación de este protocolo, la orientación anatómica, la forma y el tamaño de la muestra nunca se han alterado ni la evaluación patológica final se ha visto comprometida (manuscrito en preparación).
Aunque se requiere poco tiempo adicional para realizar IOARM, está claro que no existen obstáculos reales para implementar IOARM, pero debe haber una voluntad de pasar por una curva de aprendizaje, con respecto a la recaudación de tejido fresco y la identificación de márgenes inadecuados. El requisito previo más importante es un equipo dedicado y cooperativo de cirujanos y patólogos. En este estudio, se ha descrito un método IOARM para la cirugía del cáncer de cabeza y cuello, que se puede implementar fácilmente en todos los institutos y durante cualquier otra cirugía de cáncer. Este protocolo mejora significativamente la tasa de resecciones adecuadas al tiempo que reduce concomitantemente la necesidad de radioterapia postoperatoria y mejora el resultado del paciente. El método IOARM impulsado por muestras ayudará a los cirujanos a lograr una cirugía correcta por primera vez y los pacientes se beneficiarán.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a Bas J. van Brakel y Roxanna Haak por su ayuda en la realización de IOARM. Klara A. Bouman-Zevenbergen, Ian Overduin y Silvy L. Sabiran - Singoredjo por su asistencia y papel de apoyo para garantizar la logística, el equipo y la disponibilidad de personal en el departamento de patología.
Materiales
| Name | Company | Catalog Number | Comments |
| Anatomical templates | https://www.palga.nl/assets/uploads/Protocollen/HoofdHalstumoren.pdf | ||
| Anatomical tweezers | |||
| Brush | to apply the inc to the tissue | ||
| Bucket for formalin fixation | Size of the container depends on the size fo the tissue | ||
| Buffered formalin 4% | |||
| Camera | |||
| Computer | |||
| Cork | Thin plates of cork | ||
| Ethanol 70% | |||
| Examination gloves | |||
| Gauze or Paper | That wont leave particles on the specimen | ||
| Grossing knife 15cm | |||
| Grossing knife 30cm | |||
| Grossing tabel | |||
| Inc for tissue | 3 or more different colors | ||
| Labcoat | |||
| Long pins/Sewing pins | |||
| Paper | To place the tissue sections on during the grossing | ||
| Permanent markers | Different colors (black/blue/red/green) | ||
| Relocation tags | Premier Farnell Limited BV, Utrecht, The Netherlands | Numbered from 0-9, cut to a size of 5 mm x 7 mm x 2 mm | |
| Scalpel | |||
| Surgical tweezers | |||
| Sutures | Ethicon | Ethilon 3.0 | To suture in the tags |
| Tap water | |||
| Transparant ruler 30 cm | 2 rulers needed |
Referencias
- Bray, F., et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians. 68 (6), 394-424 (2018).
- Sharma, S. M., Prasad, B. R., Pushparaj, S., Poojary, D. Accuracy of intraoperative frozensection in assessing margins in oral cancer resection. Journal of Maxillofacial and Oral Surgery. 8 (4), 357-361 (2009).
- vander Ploeg, T., Datema, F., Baatenburg de Jong, R., Steyerberg, E. W. Prediction of survival with alternative modeling techniques using pseudo values. PLoS One. 9 (6), 100234 (2014).
- Chen, S. W., et al. Trends in clinical features and survival of oral cavity cancer: fifty years of experience with 3,362 consecutive cases from a single institution. Cancer Management and Research. 10, 4523-4535 (2018).
- Shah, J. P., Gil, Z. Current concepts in management of oral cancer--surgery. Oral Oncology. 45 (4-5), 394-401 (2009).
- Helliwell, T., Woolgar, J. Dataset for histopathology reporting of mucosal malignancies of the oral cavity. Royal College of Pathologists. , (2013).
- Varvares, M. A., Poti, S., Kenyon, B., Christopher, K., Walker, R. J. Surgical margins and primary site resection in achieving local control in oral cancer resections. The Laryngoscope. 125 (10), 2298-2307 (2015).
- Smits, R. W., et al. Resection margins in oral cancer surgery: Room for improvement. Head & Neck. 38, 2197-2203 (2016).
- Smits, R. W. H., et al. Intraoperative assessment of the resection specimen facilitates achievement of adequate margins in oral carcinoma. Frontiers in Oncology. 10, 614593 (2020).
- Lin, A. Radiation therapy for oral cavity and oropharyngeal cancers. Dental Clinics of North America. 62 (1), 99-109 (2018).
- Dik, E. A., et al. Resection of early oral squamous cell carcinoma with positive or close margins: relevance of adjuvant treatment in relation to local recurrence: margins of 3 mm as safe as 5 mm. Oral Oncology. 50 (6), 611-615 (2014).
- van Lanschot, C. G. F., et al. Relocation of inadequate resection margins in the wound bed during oral cavity oncological surgery: A feasibility study. Head & Neck. 41 (7), 2159-2166 (2019).
- Amit, M., et al. Improving the rate of negative margins after surgery for oral cavity squamous cell carcinoma: A prospective randomized controlled study. Head & Neck. 38, 1803-1809 (2016).
- Maxwell, J. H., et al. Early oral tongue squamous cell carcinoma: Sampling of margins from tumor bed and worse local control. JAMA Otolaryngology-- Head & Neck Surgery. 141 (12), 1104-1110 (2015).
- Hinni, M. L., Zarka, M. A., Hoxworth, J. M. Margin mapping in transoral surgery for head and neck cancer. Laryngoscope. 123 (5), 1190-1198 (2013).
- Kain, J. J., et al. Surgical margins in oral cavity squamous cell carcinoma: Current practices and future directions. Laryngoscope. 130 (1), 128-138 (2020).
- Kubik, M. W., et al. Intraoperative margin assessment in head and neck cancer: a case of misuse and abuse. Head and Neck Pathology. 14 (2), 291-302 (2020).
- Amin, M. B., et al. The Eighth edition AJCC cancer staging manual: Continuing to build a bridge from a population-based to a more "personalized" approach to cancer staging. CA: A Cancer Journal for Clinicians. 67 (2), 93-99 (2017).
- Gokavarapu, S., et al. Revision of margins under frozen section in oral cancer: a retrospective study of involved margins in pT1 and pT2 oral cancers. The British Journal of Oral & Maxillofacial Surgery. 53 (9), 875-879 (2015).
- Chaturvedi, P., et al. Gross examination by the surgeon as an alternative to frozen section for assessment of adequacy of surgical margin in head and neck squamous cell carcinoma. Head & Neck. 36 (4), 557-563 (2014).
- Mair, M., et al. Intraoperative gross examination vs frozen section for achievement of adequate margin in oral cancer surgery. Oral Surgery, Oral Medicine, Oral Pathology and Oral Radiology. 123 (5), 544-549 (2017).
- Datta, S., et al. Frozen section is not cost beneficial for the assessment of margins in oral cancer. Indian Journal of Cancer. 56 (1), 19-23 (2019).
- Woolgar, J. A., Triantafyllou, A. A histopathological appraisal of surgical margins in oral and oropharyngeal cancer resection specimens. Oral Oncology. 41 (10), 1034-1043 (2005).
- Umstattd, L. A., Mills, J. C., Critchlow, W. A., Renner, G. J., Zitsch, R. P. Shrinkage in oral squamous cell carcinoma: An analysis of tumor and margin measurements in vivo, post-resection, and post-formalin fixation. American Journal of Otolaryngology. 38 (6), 660-662 (2017).
- Pangare, T. B., et al. Effect of Formalin Fixation on Surgical Margins in Patients With Oral Squamous Cell Carcinoma. Journal of Oral Maxillofacial Surgery: Official Journal of the American Association of Oral and Maxillofacial Surgeons. 75 (6), 1293-1298 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados