Method Article
口腔癌における切除マージンの術中評価:これが方法です
要約
このプロトコルの目的は、切除マージンの検体駆動術中評価の明確な概要を提供することです。他の機関での患者ケアを改善するために、このプロトコルを実装することが奨励されています。
要約
頭頸部腫瘍学的手術の目標は、許容可能な機能と外観を維持しながら、十分な切除マージンを有する完全な腫瘍切除である。口腔扁平上皮癌(OCSCC)の場合、異なる研究は、すべての切片の15%-26%だけが十分であることを示した。十分な切除の数が少ない主な理由は、手術中の情報の欠如です。マージンの状態は、最終的な組織病理学的評価の数日後、手術後の数日後にのみ利用可能です。
ロッテルダムのエラスムスMC大学医療センターの外科医と病理学者は、2013年に検体駆動術中切除マージン(IOARM)の実施を開始し、2015年にケアの標準となりました。この方法により、外科医は最初の手術中に追加の切除を行うことによって、不十分な切除を適切な切除に変えることを可能にする。術中評価は、創傷床の不十分なマージン(標本に見られる)を正確に同定できる再配置方法手順によって支えられている。
このプロトコルの実装は、15%から40%の十分な切除の改善をもたらしました。しかし、新鮮な組織の粗化は病理学者にとって直感的ではないので、標本駆動のIOARMは広く採用されていません。新鮮な組織を粗引く方が解剖学的な向き、形、大きさを悪化させ、最終的な病理組織学的評価に影響を及ぼす恐れが存在する。これらの可能な負の影響は、説明されたプロトコルによって対抗される。ここでは、試験体駆動IOARMのプロトコルを、研究所で行うとおりに詳細に示します。
概要
毎年、約35万人の新しい患者が世界中で口腔内の癌と診断されています。症例の90%は扁平上皮癌1である。死亡率は年間175,000人で、5年生存率は50%から64.8%1、2、3、4である。
口腔扁平上皮癌(OCSCC)の主な治療は手術5である。手術の目的は、適切なマージンを持つ腫瘍の完全な除去です, 病理学者の王立大学によると 6.マージン>5mm(クリア)は十分であると見なされ、0〜5mmからのマージンは不十分とみなされます。
十分な切除マージンは、生存率の上昇とOCSCC7、8、9の局所再発率の低下につながります。不十分なマージンを有する腫瘍切片は、アジュバント療法(術後放射線療法および/または化学療法)の必要性をもたらす。これは患者にさらなる負担をもたらし、罹患率を増加させ、生活の質を低下させる10.切除マージンは、外科医および病理学者が影響を与えることができる唯一の骨上予後因子である。
最近の報告によると、十分な切り分けは症例7、8、11の15%-26%でしか達成されていない。これらの悪い結果は、口腔の複雑な解剖学と術中指導の欠如によって引き起こされる。手術中、外科医は検査、触診、術前画像に頼るだけです。
最終的なマージンステータスは、操作の数日後に続きます。最終的な病理評価で不十分なマージンが発生した場合、創傷床再建は通常その時間までに治癒しているため、第2の手術は通常選択肢ではない。また、術後の設定では不十分なマージンの再配置がさらに困難であるため、第2の操作はほとんど有効ではない。
マージン状態に関する術中情報の不足を克服するために、検体駆動術中切除マージン(IOARM)の評価が20139で実施された。それは2015年に研究所のケアの標準となりました。ここでは、他の機関の同僚がこのプロトコルを実装できるようにするためのIOARMメソッドについて詳しく説明します。
プロトコル
本研究は、医療倫理委員会(MEC-2015-150)によって承認されました。
注: 図または例のすべての患者および人事情報は架空のものです(すなわち、XXXXXとYYYY)。
1. 手術前
- 手術部門: 手術計画中のIOARMの要求。
- 病理学部門:ロジスティックス/機器( 材料表を参照)と人員(病理学者/病理学常駐およびアシスタント)の可用性を確保します。
2. 手術中
- 作業室(OR)
- 関係するすべての人員が再配置プロトコル12に精通していることを確認します。
- 再配置プロトコルに従います。
- 手術開始前に、少なくとも30分間、クロルヘキシジンにタグを沈めます。
- 意図した切除線の両側にタグを組み合わせ(表面的および深い)、一方のタグが切除標本にあり、もう一方のタグが創傷床の対応する場所(図1A)に残るように配置する( 図1A)、Van Lanschotらら。
- タグの各ペアの間で切り取ります。
- 腫瘍を有する検体を取り除く(各ペアから1つのタグが創傷床に残る、図1B)。
- タグの解剖学的位置を明確に示す病理要求フォームに記入してください(例えば、タグ1 = 前部、タグ2= 上位)。
- 病理要求フォームに、検査片の外科的処置関連の欠陥と、タグに関連するそれらの位置を記録する。
注: 手順に関連する欠陥は、誤った切除面を作成し、IOARMと最終病理の両方で不十分なマージンの不適切な割り当てにつながる可能性があります。 - 検体を病理部に持って行く。
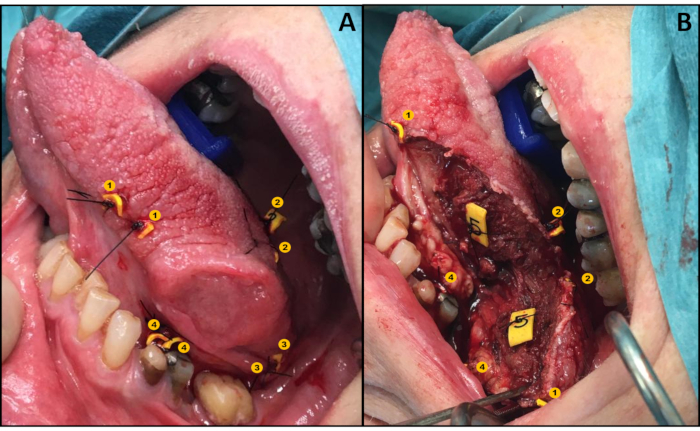
図1: 再配置プロトコルの図示( A) タグのペアワイズでの適用(B)創傷ベッドと標本の両方を各ペアの1つのタグで。 この図の大きなバージョンを表示するには、ここをクリックしてください。
- IOARM - グロスルーム(GR)、病理部門
- 試料を水ですすい、ガーゼや紙で軽く軽くたたきます。
注: 次のステップを写真で登録し、電子患者ファイル(EPF)に保存します。 - 解剖テンプレートに一般的な情報(日付、患者ID、病理番号、外科医、病理学者、標本の種類、および使用されたタグ)を記録します。
- 解剖用テンプレート上のタグの位置を示します (図 2)。
- 解剖テンプレート上に標本を置きます。
- 試料を水ですすい、ガーゼや紙で軽く軽くたたきます。
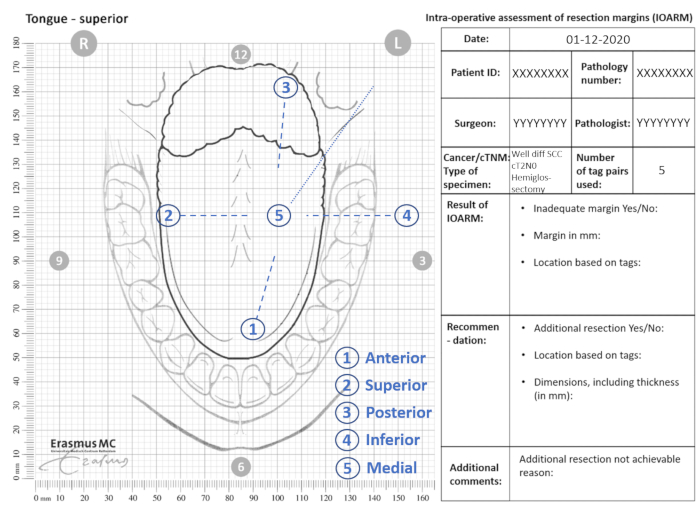
図2: IOARMの解剖テンプレートの例を参照してください 。
- 標準プロトコルに従って切除面をインク(例えば、優れた青と緑)
- 検体を目視で触診(病理学者および外科医)によって検査する。
- 解剖用テンプレート上の疑わしい領域の位置 (つまり、マージン <5 mm) を示し、番号付きタグに関連付けます(IOARM の結果、図 2)。
- 疑わしい領域で切除面に対して垂直な切開を行う(図3A)。標本の大きさや疑わしい領域に応じて、約5mmの距離で1つ以上の切開を行います。切開が複数ある場合は、切開をIOA1、IOA2などと数えます。
- 組織セクションの余白(すなわち、切除面と腫瘍境界の距離)を測定し、解剖テンプレート上で正確な値をmm単位で記録する(IOARMの結果、図3C)。
注:腫瘍境界がマクロ的に区別できない場合(例えば、腫瘍は、周囲の線維性または唾液腺組織と区別することができない)、凍結されたセクションによる顕微鏡的分析が示される。
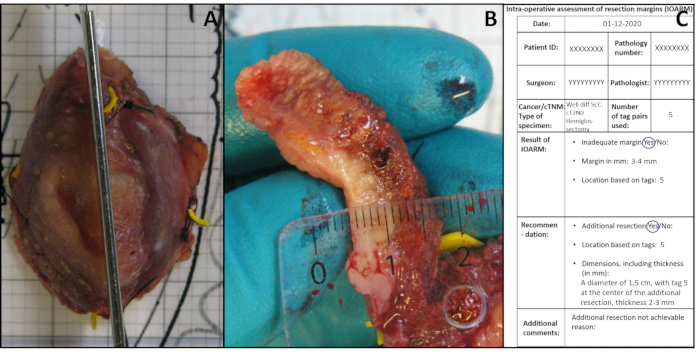
図3:IOARMの図 (A)触診により疑わしい領域を同定した後に行う垂直切開。(B) マージンが測定されます。(C) IOARM の結果と推奨内容が記録されます。 この図の大きなバージョンを表示するには、ここをクリックしてください。
- 操作の完了、ステップ 2.2.19 に進みます。十分なマージンが検出された場合(すなわち、追加の切除は必要ありません)。
- 不十分なマージンが検出された場合は、タグに基づいて正確な位置を示し、テンプレートに記録します。外科的または技術的に達成可能な場合は、追加の切除を進める、ステップ2.2.13。
- 追加の切除ができない場合は、テンプレートの理由に注釈を付けてください (セクション追加のコメント、図 2)。
- 正確な位置に基づいて追加の切除を推奨(病理学者/外科医)、十分な切除を達成するために必要な厚さを示す(図3C)。
注: マージンが不十分な場合は、正のマージンを使用する場合は、追加の切除に対して最小の厚さ 6 mm を推奨する必要があります。 - 追加の切除が受け取られるまで、主切除標本を冷蔵庫に保管してください。
- IOARMの記録に基づいて、タグに関連して追加の切除領域を(外科医)移動する(図3C)。
- 追加の切除を実行します。
- 追加の切除を GR に送信します。
- (病理学者)その場所(タグに基づく)とそのサイズに関する追加の切除の正確さを確認します。
注: 上記の手順は、近いマージンの場合に適用されます。プラスマージンの場合、追加の切除のIOARMが必要です(病理学者)。外科医は手術を完了する前に、第二のIOARMの結果を待つ。 - 残りのタグを傷床から取り除き(外科医)、手術を完了します。
- 解剖テンプレートからEPFにすべてのデータをコピー(病理学者)します。
3. IOARM後 - グロスルーム(GR)、病理部門
注:解剖学的な方位と標本の形状を維持するために、次の手順を実行します。
- IOARM中に記録されたタグと写真に基づいて、すべての組織断面(断面および極端)の正しい方向で標本を組み立て直します。
注:断面は標本の中央にあり、極端は標本の外側の部分です。 - コルクの部分を組織切片よりわずかに大きく切ります。
- コルクの一部に各組織セクションを置きます。
- 組織部の周りのコルクに永久的なマーカーで線を引き、写真を撮ります(図4A)。
- 極端を除くすべての組織セクションの上にコルクの別の部分を置く(図4B)。
- 上部と下のコルクを、組織セクションの間に、組織セクションの端の隣に両方のコルクを通してピンを配置することによって、組織セクションを通してではなく、組織セクションを通してピンを一緒に保つ(図4B)。

図4:解剖学的配向と組織切片の形状を維持する方法の図 示(A)組織セクションは、永久的なマーカーを有する組織セクションの周りにコルクに描かれた線を持つコルクの一部に置かれている。(B)ピンは極端の上に斜めに配置され、コルクの別の部分は、組織セクションの上に配置されます。(C)組み立て直された新鮮な標本のイラストは、隣接するコルクを穿刺するピンと一緒に保たれている。(D) 組み立て直しの固定標本の図は、隣接するコルクを穿刺するピンと一緒に保管されている。 この図の大きなバージョンを表示するには、ここをクリックしてください。
- 極端をコルクの別の部分に置きます(図4A)。
- 組織の上にピンを斜めに配置し、コルクを組織の端のすぐ横に突き刺すことによって、コルクに付けられた極端を保ちます(図4B)。
注意: ピンで検体を穿刺しないでください。 - 標本全体を組み立て直す:正しい解剖学的配向で一緒に極端を含むすべての組織切片を入れる。
- 隣接するコルクを穿刺して、すべての組織切片を一緒に保つ(図4C)。
- 解剖テンプレート上の正しい向きで標本を配置し、写真を撮ります。
- 試料をホルムアルデヒド溶液(ホルマリン4%)に入れる。
注:適切な固定のために、紙片を標本の上に置いてホルマリンに沈めておくことができます。 - 事故を避けるために、検体(例えば、注意針/ピン)を持つ容器に明確かつ目に見える警告ノートを作成します。
- 標準的な病理学の議定書に従って、さらなる処理のための標本と容器を貯える。
4. IOARM後の固定標本の総計
注:ホルマリン固定後、検体は、IOARMを実行した病理学者/常駐/助手によって好ましいグロス化されるべきである。
注意: 容器から試料を取り外す際は、針/ピンに注意してください。
- 制度的な総額プロトコルに従ってください。
注: 正しい方向を確認し、IOARM と最終病理評価間のマージン状態の比較を容易にするために追加の措置を講じてください。- IOARMの写真を参照してください。
- 容器から標本を取り出します。
- すべての組織切片が存在するかどうかを確認します。
- 解剖テンプレート上の正しい向きで標本を配置し、写真を撮ります(図4D)。
- ピンを取り外します。
- 個々の組織切片を対応するコルクで分離します。
- 各組織セクションの写真を、対応するコルクで撮影し、組織セクションの周りに描かれた線に焦点を当てて、固定後の組織の収縮の可能性を評価する(図5)。

図5:コルクに面した切断面を持つ極端の図は、ピンを傾けてコルクに対して保持されています。 (B) 固定後。(C)極端の切断面は、固定後に平坦化します。この図の大きなバージョンを表示するには、ここをクリックしてください。
- コルクから体系的にすべての組織切片を取り外します(例えば、前から後方へ、または左から右に開始します)。
- IOARM組織切片を標準の最終組織切片(厚さ2〜3mm)にグロスする。
- すべての最終的な組織切片を正しい解剖学的方向(例えば、前から後方へ)に、グロステーブルの上の紙の上に置きます。
- 紙の上に永久的なマーカーを付けて、すべての最終組織セクションに連続して番号を付けます(図6)。
- 永久マーカーを使用して IOARM の位置にアセトを付けます (図 6)。
- すべての最終的な組織セクションを含む写真を撮り、EPFに保存します(図6)。
- 関連する最終組織セクションとIOARMセクションを選択して、最終的な病理学的評価のためにさらに処理します。

図6: IOARMの位置が示されたグロス標本 対応する数字1-5は左から右への組織切片を指す。A-Eは、組織病理学的評価に含まれる組織切片に対応する。なお、凍結部(FS)により評価された残りの組織部分は、永久HE染色部と直接比較できるように指示される。 この図の大きなバージョンを表示するには、ここをクリックしてください。
5. 最終的な病理的評価 - 最終的なマージンステータスに対するIOARMの影響
- ローカルの標準化されたプロトコルに従ってください。ここで続くプロトコルは、PALGA(病理学的アナトミッシュ・ランドライク・ゲオートマチゼール・アーチーフ、オランダの組織および細胞病理学の全国的なネットワークとレジストリ)の国家ヘッドネックプロトコルで、最終的な標準化された構造化病理報告書の作成を行っています。
注:このプロトコルは、米国がん合同委員会(AJCC)、国際がん対策連合(UICC)、世界保健機関(WHO)の最新の基準に基づいています。- 粘膜、粘膜下、骨を含むすべてのマージンをミリメートルで評価します。
- 不十分なマージンが見つかった場合は、その範囲にアポイントニング(例えば、粘膜下マージン前部は3.5mm、6mmの軌道上に延びる)を付け出す。
- 異形成の存在と粘膜切除のマージンのその等級を評価する。
- メインの標本で測定されたマージンに、追加の切除(実行した場合)の寸法を追加して、最終的なマージンを示します。
- 主検体の病理報告に追加切除の固有の病理番号を記録する(例えば、マージン:前部6mm、後部8mm、上位6mm(3mmの追加切除、H20-2021を含む)、下7mm、内側5.3mm)。
- IOARM 中に見つかったマージンを確認します。
- この検証の結果にコメントを付ける(例えば、術中評価中に見つかったNBマージンは、最終的な病理に基づくマージンと一致している)。
注: IOARM に必要な時間は、手術のワークフローを妨げないように制限する必要があります。研究所では、IOARMは約10分かかります。外科医と病理学者はIOARMを一緒に行います。再配置方法(手術中にタグを配置する)には、追加の時間5分が必要です。これは、物流によって各研究所によって異なります。
結果
適切な切除を生じるIOARMの例
患者は、病歴のない舌の左側のcT2N0M0 SCCを提示する。患者は、IOARMによってサポートされるヘミグスロス切除術を受ける。検体は検査され、触診される;粘膜のマージンは>5mmとして測定されます。粘膜下切除面の1つの領域は、タグ5の周りに位置する不十分なマージンに対して疑わしい。粘膜下マージンはタグ5で3〜4mmです。すべての情報がテンプレートに記録され、EPF にコピーされます (図 7A)。
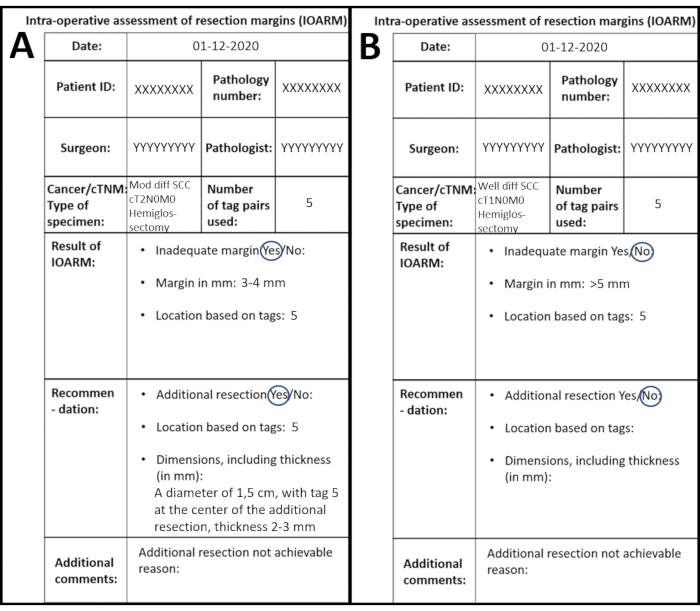
図7: 解剖学的テンプレートに記録された2つの異なるIAMの例( A)IOARMが適切な切除をもたらす。(B) IOARM が十分な切除を行わない。 この図の大きなバージョンを表示するには、ここをクリックしてください。
外科医はORに戻り、追加の切除を行う。病理学者は、追加の切除の厚さなど、精度と寸法を検証します。
最終的な病理報告は、舌の左側に適度に分化したpT2扁平上皮癌の存在を示す。腫瘍の直径は2.5cm、浸潤深度は6.0mmです。侵略の最悪のパターン(WPOI)はカテゴリ3です。周神経浸潤(PNI)は存在せず、リンパ管内侵入(LVI)が存在する。下、上方、前、後方の位置の最小マージン(粘膜および粘膜下)は、3mm厚さの5.8mm(追加切除(PA番号:XXXXXを含む)、6.2mm(3mm厚さの追加切除(PA番号:XXXXXを含む)、5.2mm、5.5mmです。IOARMは最終的な病理と一致しています。
| マージン (mm) | |||
| 場所 | IOARMに基づく | 追加の切除後 | 最終病理に基づく |
| 劣る | 3-4 | 6-7 | 5.8 |
| 目上 | 3-4 | 6-7 | 6.2 |
| 前 | >5 | 5.2 | |
| 後の | >5 | 5.5 | |
表1:IOARM中の切除マージンの例は、追加の切除後に、最終的な病理において十分な切除をもたらす。
IOARMの例では、十分な切除が得られなく
患者は、病歴のない舌の右側のcT1N0M0 SCCを提示する。患者はIOARMによってサポートされる切除を受けた。外科医は病理学部の病理学者に標本を取る。粘膜を目視で検査し、粘膜のマージンを透明な定規で測定し、すべての粘膜のマージンは5mm>。粘膜下のマージンは視覚的に検査され、触診され、すべてのマージンは>5 mmのように見えます。タグ1(前部切除面)とタグ3(後部切除面)に不審な領域があります。前部から後方(タグ1からタグ3)まで、切除面に垂直に入れ、切開を行います。病理学者は断面のマージンを測定し、マージンは>5 mmです。すべての情報がテンプレートに記録され、EPF にコピーされます (図 7B)。
最終的な病理報告は、舌の右側に十分に分化したpT1扁平上皮癌を示す。腫瘍の直径は1.8cm、浸潤深度は3.8mmです。侵入の最悪のパターン(WPOI)はカテゴリ2です。周神経浸潤(PNI)、リンパ管浸潤(LVI)、および異形成は存在しない。下、上、前、後方の位置の最小マージン(粘膜と粘膜下)は、それぞれ4.0mm、6.1mm、6.4mm、7.8mmです。IOARMは最終的な病理と一致しておらず、マージンが劣っていた。
| マージン (mm) | |||
| 場所 | IOARMに基づく | 追加の切除後 | 最終病理に基づく |
| 劣る | >5 | 5mm>すべてのマージンを推奨しない | 4.0 |
| 目上 | >5 | 6.1 | |
| 前 | 6 | 6.4 | |
| 後の | 8 | 7.8 | |
表2:IOARM中の切除マージンの例は、最終的な病理において十分な切除をもとにならなかった 。
ディスカッション
OCSCC患者の外科的治療の目標は、十分なマージンを有する腫瘍の完全な除去である。これはあまりにも頻繁に達成されず、切除マージンの術中評価に焦点を当てた口腔癌手術に対する調整されたアプローチを設計するインスピレーションを受けました。切除マージンとは別に、浸潤パターン、周神経浸潤、リンパ管浸潤などの他の有害な腫瘍因子も局所的な再発に影響を及ぼす。しかし、すべての有害な腫瘍因子のうち、外科医および病理学者は、切除マージン7、8、11にのみ影響を及ぼすことができる。
検体駆動のIOARM法は2013年に実施されました。これは最終的に、検体駆動IOARMが欠陥駆動IOARM7、13、14、15、16、17よりも優れているという証拠によって裏付けとなった。その結果、2017年18年にAJCCが勧告を受けました。注目すべきは、検体駆動のIOARM法は、2015年に研究所のケアの標準となりました。2013年から2020年にかけて、IOARMは304件で実施され、2018年から急激に増加しました。
IOARM法の開発と実装には、多くの人員(病理学者/外科医/助手/研修生/研究者)が必要であることを認識することが重要です。多くの専門家は、長年の間に、このプロトコルの開発に関与していましたが、これは実際には方法の強みです。この方法の開発は2013年に始まり、2015年に合意に達しました。これは、IOARMを含む手術を受けたすべての患者に関する議論が行われた2週間の会議に基づいて達成されました。このようにして、適時に調整し、調整することが可能であった。また、2週間の会議は、パフォーマンスとフォローアップ研究9の基礎を提供する将来のデータ収集を可能にしました。さらに、すべてのケースで、チームは最終的な病理がIOARMのために損なわれないことを保証しました。最後に、このような評価は動的なプロセスであり、常に改善に向けた変更を受けることを認識することが重要です。
検体駆動のIOARM法では、マージンは検査、触診、垂直切開(グロス)によって評価されます。このアプローチは、ミリメートル単位でマージンのできるだけ正確な推定を提供し、追加の切除が必要かどうか、および寸法が何であるかをフィードバックすることができます。Kubikらいくつかの理由(例えば、誤った場所での追加の切除、追加の切除の誤った方向、追加の切除の誤った寸法)について説明した17。IOARMは貴重な方法ですが、外科医が適切な追加の切除を行えるようにするために、不十分なマージンの可能な限り正確な移転方法を伴う場合にのみ行われます。追加の切除と主標本の間の空間的関係が重要な要因です。したがって、図1に示すようなシンプルでエレガントな再配置方法がVan Lanschotらららによって詳細に開発され、詳細に説明された。この方法により、外科医は創傷床のタグによって定義された不十分なマージンの再配置に基づいて追加の切除を行うことができます。例えば、タグ1-2-3の間に2mmのマージンが見つかり、外科医は4mmの厚さでタグ1-2-3の周りに追加の切除を行う。この再配置方法は、Smitsら 9の結果によって有効であることが示される。
このIOARM法は、腫瘍が周囲の組織(例えば、前の手術後の放射線治療後または瘢痕形成後の組織の線維症、または唾液腺組織)をマクロ的に区別できない場合にのみ、凍結セクション手順によって支持される。いくつかの機関は、凍結されたセクションがすべての象限13、19から標本から取られる別のアプローチを使用しています。この方法は、より標準化されたプロトコルを有効にします。ただし、この方法の包括的性は、常に効率的ではない可能性があります。さらに、複数の凍結されたセクションが必要であり、コストがかかり、時間がかかり、すべての機関でアクセスできません。記述された方法は、対象領域(すなわち、疑わしい不十分なマージンの領域)が事前に選択されているため、より効率的であり、すべての機関で安価で、より速く、利用可能である。これは、凍結断面解析は、ほとんどの場合、グロスに基づいて検体駆動IOARMの精度を向上させず、コスト効率の良い20、21、22ではないという以前の知見に従う。
文献によると>すべての不十分なマージンの93%が粘膜下切除マージン23で見られる。これは、研究所の調査結果に沿っています.高等度の異形成/CISを伴う粘膜の変化は、IOARM中に検出しやすいことが多く、少数のケースでのみ凍結されたセクションが推奨される。これまでIOARMコホートでは、がんまたは高級異形成/CISに関する粘膜陽性マージンは遭遇していなかった。
検体駆動IOARMはOCSCC患者における十分な切り離しの速度を著しく改善し、その結果、患者の転帰7、9、22、21を改善するが、その広い実施は遅れている。この主な原因は、新鮮な組織の総量が病理学者にとって直感的ではないという事実です。病理学者は、新鮮な組織を粗引きさせることが解剖学的指向、形状、および標本のサイズを悪化させ、したがって最終的な病理組織学的評価24,25に影響を及ぼすことを恐れている。しかし、プロトコルに規定されている措置は、これらの可能な悪影響を防ぎます。このプロトコルの実装以来、解剖学的指向、形状、および標本のサイズは改変されたことがなく、最終的な病理学的評価がこれまでに妥協されたこともなかった(準備中の原稿)。
IOARM を実行するのに時間は少しも必要とされませんが、IOARM を実装するための実際の障害は存在しませんが、新鮮な組織の総計と不十分なマージンの特定に関して、学習曲線を通る意欲が必要です。最も重要な前提条件は、外科医と病理学者の専用かつ協力的なチームです。本研究では、頭頸部癌手術のためのIOARM法が記載されており、あらゆる研究所および他の癌手術中に容易に実施することができる。このプロトコルは、術後放射線療法の必要性を軽減し、患者の転帰を改善しながら、十分な切り替えの速度を大幅に改善する。検体駆動のIOARM法は、外科医が初めて右の手術を達成するのに役立ち、患者は利益を得る。
開示事項
著者らは開示するものは何もない。
謝辞
バス・J・ファン・ブラーケルとロクサーナ・ハークがIOARMを実行してくれたことに感謝します。クララ・A・ブーマン=ゼヴェンベルゲン、イアン・オーバードゥイン、シルヴィ・L・サビラン - 病理学部門の人員の物流、設備、および可用性を確保する上での支援と支援の役割を果たしたシンゴレジョ。
資料
| Name | Company | Catalog Number | Comments |
| Anatomical templates | https://www.palga.nl/assets/uploads/Protocollen/HoofdHalstumoren.pdf | ||
| Anatomical tweezers | |||
| Brush | to apply the inc to the tissue | ||
| Bucket for formalin fixation | Size of the container depends on the size fo the tissue | ||
| Buffered formalin 4% | |||
| Camera | |||
| Computer | |||
| Cork | Thin plates of cork | ||
| Ethanol 70% | |||
| Examination gloves | |||
| Gauze or Paper | That wont leave particles on the specimen | ||
| Grossing knife 15cm | |||
| Grossing knife 30cm | |||
| Grossing tabel | |||
| Inc for tissue | 3 or more different colors | ||
| Labcoat | |||
| Long pins/Sewing pins | |||
| Paper | To place the tissue sections on during the grossing | ||
| Permanent markers | Different colors (black/blue/red/green) | ||
| Relocation tags | Premier Farnell Limited BV, Utrecht, The Netherlands | Numbered from 0-9, cut to a size of 5 mm x 7 mm x 2 mm | |
| Scalpel | |||
| Surgical tweezers | |||
| Sutures | Ethicon | Ethilon 3.0 | To suture in the tags |
| Tap water | |||
| Transparant ruler 30 cm | 2 rulers needed |
参考文献
- Bray, F., et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians. 68 (6), 394-424 (2018).
- Sharma, S. M., Prasad, B. R., Pushparaj, S., Poojary, D. Accuracy of intraoperative frozensection in assessing margins in oral cancer resection. Journal of Maxillofacial and Oral Surgery. 8 (4), 357-361 (2009).
- vander Ploeg, T., Datema, F., Baatenburg de Jong, R., Steyerberg, E. W. Prediction of survival with alternative modeling techniques using pseudo values. PLoS One. 9 (6), 100234(2014).
- Chen, S. W., et al. Trends in clinical features and survival of oral cavity cancer: fifty years of experience with 3,362 consecutive cases from a single institution. Cancer Management and Research. 10, 4523-4535 (2018).
- Shah, J. P., Gil, Z. Current concepts in management of oral cancer--surgery. Oral Oncology. 45 (4-5), 394-401 (2009).
- Helliwell, T., Woolgar, J. Dataset for histopathology reporting of mucosal malignancies of the oral cavity. Royal College of Pathologists. , London, UK. (2013).
- Varvares, M. A., Poti, S., Kenyon, B., Christopher, K., Walker, R. J. Surgical margins and primary site resection in achieving local control in oral cancer resections. The Laryngoscope. 125 (10), 2298-2307 (2015).
- Smits, R. W., et al. Resection margins in oral cancer surgery: Room for improvement. Head & Neck. 38, Suppl 1 2197-2203 (2016).
- Smits, R. W. H., et al. Intraoperative assessment of the resection specimen facilitates achievement of adequate margins in oral carcinoma. Frontiers in Oncology. 10, 614593(2020).
- Lin, A. Radiation therapy for oral cavity and oropharyngeal cancers. Dental Clinics of North America. 62 (1), 99-109 (2018).
- Dik, E. A., et al. Resection of early oral squamous cell carcinoma with positive or close margins: relevance of adjuvant treatment in relation to local recurrence: margins of 3 mm as safe as 5 mm. Oral Oncology. 50 (6), 611-615 (2014).
- van Lanschot, C. G. F., et al. Relocation of inadequate resection margins in the wound bed during oral cavity oncological surgery: A feasibility study. Head & Neck. 41 (7), 2159-2166 (2019).
- Amit, M., et al. Improving the rate of negative margins after surgery for oral cavity squamous cell carcinoma: A prospective randomized controlled study. Head & Neck. 38, Suppl 1 1803-1809 (2016).
- Maxwell, J. H., et al. Early oral tongue squamous cell carcinoma: Sampling of margins from tumor bed and worse local control. JAMA Otolaryngology-- Head & Neck Surgery. 141 (12), 1104-1110 (2015).
- Hinni, M. L., Zarka, M. A., Hoxworth, J. M. Margin mapping in transoral surgery for head and neck cancer. Laryngoscope. 123 (5), 1190-1198 (2013).
- Kain, J. J., et al. Surgical margins in oral cavity squamous cell carcinoma: Current practices and future directions. Laryngoscope. 130 (1), 128-138 (2020).
- Kubik, M. W., et al. Intraoperative margin assessment in head and neck cancer: a case of misuse and abuse. Head and Neck Pathology. 14 (2), 291-302 (2020).
- Amin, M. B., et al. The Eighth edition AJCC cancer staging manual: Continuing to build a bridge from a population-based to a more "personalized" approach to cancer staging. CA: A Cancer Journal for Clinicians. 67 (2), 93-99 (2017).
- Gokavarapu, S., et al. Revision of margins under frozen section in oral cancer: a retrospective study of involved margins in pT1 and pT2 oral cancers. The British Journal of Oral & Maxillofacial Surgery. 53 (9), 875-879 (2015).
- Chaturvedi, P., et al. Gross examination by the surgeon as an alternative to frozen section for assessment of adequacy of surgical margin in head and neck squamous cell carcinoma. Head & Neck. 36 (4), 557-563 (2014).
- Mair, M., et al. Intraoperative gross examination vs frozen section for achievement of adequate margin in oral cancer surgery. Oral Surgery, Oral Medicine, Oral Pathology and Oral Radiology. 123 (5), 544-549 (2017).
- Datta, S., et al. Frozen section is not cost beneficial for the assessment of margins in oral cancer. Indian Journal of Cancer. 56 (1), 19-23 (2019).
- Woolgar, J. A., Triantafyllou, A. A histopathological appraisal of surgical margins in oral and oropharyngeal cancer resection specimens. Oral Oncology. 41 (10), 1034-1043 (2005).
- Umstattd, L. A., Mills, J. C., Critchlow, W. A., Renner, G. J., Zitsch, R. P. Shrinkage in oral squamous cell carcinoma: An analysis of tumor and margin measurements in vivo, post-resection, and post-formalin fixation. American Journal of Otolaryngology. 38 (6), 660-662 (2017).
- Pangare, T. B., et al. Effect of Formalin Fixation on Surgical Margins in Patients With Oral Squamous Cell Carcinoma. Journal of Oral Maxillofacial Surgery: Official Journal of the American Association of Oral and Maxillofacial Surgeons. 75 (6), 1293-1298 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved