Method Article
Microscopía de hoja de luz de dinámica cardíaca rápida en embriones de pez cebra
En este artículo
Resumen
Describimos herramientas optimizadas para estudiar el corazón de pez cebra in vivo con microscopía de fluorescencia de lámina de luz. Específicamente, sugerimos líneas transgénicas cardíacas brillantes y presentamos nuevas técnicas suaves de incrustación e inmovilización que evitan defectos de desarrollo y cardíacos. También se proporciona una posible línea de adquisición y análisis de datos adaptada a las imágenes cardíacas.
Resumen
La investigación cardíaca embrionaria se ha beneficiado enormemente de los avances en la microscopía de fluorescencia de lámina de luz rápida in vivo (LSFM). Combinado con el rápido desarrollo externo, la genética tratable y la translucidez del pez cebra, Danio rerio, LSFM ha proporcionado información sobre la forma y función cardíaca a alta resolución espacial y temporal sin fototoxicidad significativa o fotoblanqueo. Las imágenes de corazones que laten desafían las técnicas existentes de preparación de muestras y microscopía. Uno necesita mantener una muestra saludable en un campo de visión restringido y adquirir imágenes ultrarrápidas para resolver los latidos del corazón. Aquí describimos herramientas y soluciones optimizadas para estudiar el corazón del pez cebra in vivo. Demostramos las aplicaciones de líneas transgénicas brillantes para etiquetar los componentes cardíacos y presentamos nuevas técnicas suaves de incrustación e inmovilización que evitan defectos de desarrollo y cambios en la frecuencia cardíaca. También proponemos una línea de adquisición y análisis de datos adaptada a la imagen cardíaca. Todo el flujo de trabajo presentado aquí se centra en las imágenes del corazón embrionario del pez cebra, pero también se puede aplicar a varias otras muestras y experimentos.
Introducción
Para descubrir los eventos complejos y las interacciones en el corazón que late temprano, se requieren imágenes in vivo de todo el órgano. Con su mínima fototoxicidad1,2,3, bajo fotoblanqueo4 y alta velocidad, la microscopía de lámina de luz ha evolucionado como la principal herramienta de imagen para el desarrollo embrionario y cardíaco5,6. Ha proporcionado información sobre la forma y la función cardíaca a una alta resolución espacial y temporal7,8,9 y ha permitido a los investigadores obtener imágenes y rastrear partes del corazón marcadas fluorescentemente a alta velocidad, estudiar las fuerzas hemodinámicas y seguir el desarrollo del corazón directamente dentro del cuerpo de los embriones en desarrollo6,10,11,12.
Para restringir de manera precisa y reproducible el pez cebra en el campo de visión, existen una variedad de protocolos de incrustación para láminas ligeras, a corto y largo plazo, así como una sola o múltiple muestra13,14,15,16,17,18,19. El protocolo más común implica la inmovilización de tricaína y el montaje de agarosa dentro de un tubo de vidrio o plástico. Sin embargo, como la frecuencia cardíaca puede cambiar debido a la temperatura, los anestésicos y el material de incrustación utilizado20,21,22, las imágenes cardíacas del pez cebra requieren protocolos específicos y suaves para garantizar la salud de la muestra6,8,11,12,20,21,22,23 . Para imágenes a corto plazo (hasta una hora), se puede anestesiar el pescado en 130 mg / L de tricaína e incrustarlo en tubos de etileno propileno fluorado (FEP) con solución de agarosa al 0.1% y un tapón, como se describe en Weber et al. 201416. Sin embargo, como la tricaína puede conducir a defectos de desarrollo20,22, se deben utilizar diferentes protocolos para la obtención de imágenes a largo plazo.
Aquí describimos una nueva estrategia para la obtención de imágenes cardíacas a largo plazo. Si bien existen muchas implementaciones de hojas de luz24, recomendamos usar una muestra colgante en un microscopio T-SPIM (una detección y dos lentes de iluminación en un plano horizontal con la muestra colgando verticalmente en el foco común). Esto proporciona la libertad de movimiento y rotación necesaria para el posicionamiento preciso de la muestra. Los peces se inmovilizan inyectando 30 pg α-bungarotoxin mRNA en la etapa de una o dos células. α-bungarotoxina es un veneno de serpiente que paraliza los músculos sin afectar el desarrollo cardiovascular ni la fisiología22. Para obtener imágenes precisas y sin distorsión, recomendamos montar peces en tubos hechos de FEP, un polímero con un índice de refracción casi idéntico al agua. Discutimos cómo preparar mejor los tubos FEP enderezándolos y limpiándolos antes de la toma de imágenes. Los peces se montan en estos tubos, con la cabeza hacia abajo, en medios, y la parte inferior del tubo se sella con un tapón de agarosa al 2%, sobre el que descansan las cabezas de los peces. Los orificios de corte en el tubo FEP facilitan el intercambio de gases y aseguran el crecimiento de los peces. El pez incrustado se puede mantener en medios hasta que se monta en un soporte de muestra justo antes de la toma de imágenes. También sugerimos una canalización de adquisición y análisis de datos para imágenes reproducibles de alta velocidad. Además, discutimos el uso de líneas transgénicas de marcadores citoplasmáticos versus marcadores de membrana para el etiquetado robusto de células cardíacas, así como diferentes opciones para detener el corazón. Estas técnicas de montaje aseguran la salud de la muestra al tiempo que permiten restringir el corazón de manera precisa y reproducible en el campo de visión.
Protocolo
Todos los adultos y embriones de pez cebra (Danio rerio) se manejaron de acuerdo con los protocolos aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC) de UW-Madison.
1. Preparación del pez cebra
- Manejar el pez cebra de acuerdo a los protocolos establecidos25,26 y lineamientos institucionales. Criar peces adultos de línea transgénica deseada (ver Discusión). Recoge los embriones y mantenlos a 28 °C en una placa de Petri llena de pescado medio, por ejemplo, E327.
- Elija un método de inmovilización (consulte Discusión).
- Si utiliza ARNm de α-bungarotoxina para inmovilizar a los peces, inyecte 30 pg mRNA22 en la yema de embriones en estadio de una o dos células utilizando una aguja de vidrio perforada montada en un micromanipulador y conectada a un picoinyector28.
- Si usa tricaína, haga una solución madre al 0.4% tamponada a pH 7.0-7.4 con 1 M de base Tris y guárdela a -20 ° C hasta la toma de imágenes.
- Mantenga los huevos en una placa de Petri llena de E3 a 28 ° C y transfiera los huevos cada 24 h a un plato nuevo con E3 fresco hasta la toma de imágenes.
- Para prevenir la formación de pigmentos, si el fondo del pez cebra no es albino, transfiera el pescado a las 24 h después de la fertilización (hpf) a un nuevo plato E3 con 0,2 mM inhibidor de la tirosinasa 1-fenil 2-tiourea (ver Discusión).
2. Preparación de tubos FEP
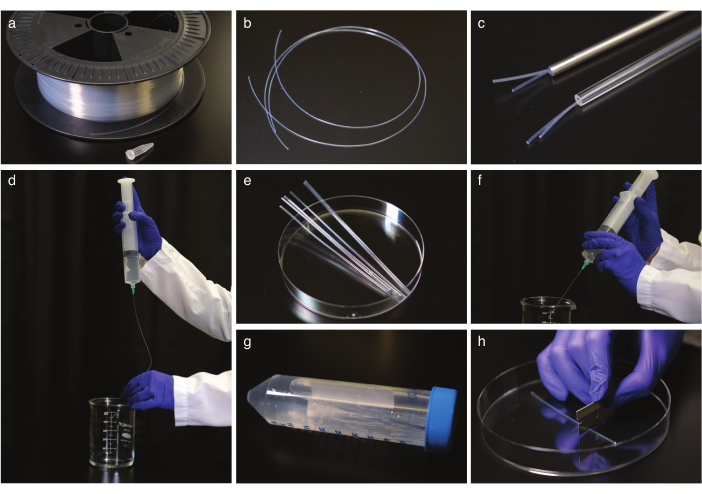
Figura 1: Limpieza y enderezamiento de tubos FEP. a) Tubos FEP en un tambor de cable. b) Tubos FEP antes de enderezarlos. c) Tubos FEP en tubos de vidrio y acero aptos para autoclaves. d) Enjuague de los tubos FEP después de enderezar y enfriar. e) Tubo FEP cortado al tamaño de un tubo centrífugo para sonicación. f) Lavado de tubos FEP después de la sonicación. g) Almacenamiento de los tubos FEP limpios y enderezados en un tubo de centrífuga. (h) Corte del tubo FEP antes de la toma de imágenes. Haga clic aquí para ver una versión más grande de esta figura.
- Endereza los tubos FEP (Figura 1a,b) colocándolos en un tubo de vidrio o acero seguro para autoclave (Figura 1c) con el diámetro interior correcto para adaptarse a los tubos FEP, generalmente 1.6 o 2.4 mm, y autoclave a 180 °C durante 2 h. Deje que los tubos se enfríen a temperatura ambiente durante al menos 5 h. Luego, retire de los tubos de enderezamiento.
NOTA: Use guantes al manipular los tubos y trabaje con tubos de 50 cm a la vez. - Limpie los tubos FEP.
NOTA: Se recomiendan jeringas con punta de aguja roma del tamaño del tubo FEP interno por seguridad, pero una aguja regular funcionará.- Enjuague los tubos con 1 M de NaOH dos veces con una jeringa de 50 ml (Figura 1d).
- Corte los tubos FEP al tamaño de un tubo centrífugo de 50 ml con una cuchilla de afeitar (Figura 1e), coloque los tubos cortados en tubos de centrífuga llenos de NaOH de 0,5 M y ultrasónico durante 10 minutos.
- Enjuague los tubos FEP con H2O de doble destilación, luego repita el lavado con etanol al 70% (Figura 1f).
- Transfiera los tubos al 70% de etanol y ultrasonido durante 10 min.
- Enjuague los tubos con H2O de doble destilación y guárdelos en tubos de centrífuga en H2O de doble destilación (Figura 1g).
3. Preparación del plato de agarosa al 2%
- En un matraz de vidrio, disuelva el polvo de agarosa de bajo punto de fusión en E3. Calentar la solución en un microondas y removerla cada 20 s, hasta que todo el polvo se disuelva.
- Vierta la agarosa en una placa de Petri de vidrio o plástico para hacer una capa de 1-2 mm. Espere hasta que la agarosa se solidifique.
- Para almacenar, vierta suavemente E3 en la parte superior del agar para evitar que se seque. Envolver en película de parafina y conservar a 4 °C.
4. Preparación de medios de inserción
- Prepare suficiente E3 para llenar la cámara de muestras.
NOTA: Evite el uso de azul de metilo si el medio está en contacto con lentes objetivas. - Si usa tricaína, descongele la solución madre y agregue 0.02% de tricaína a E3.
5. Montaje de la muestra
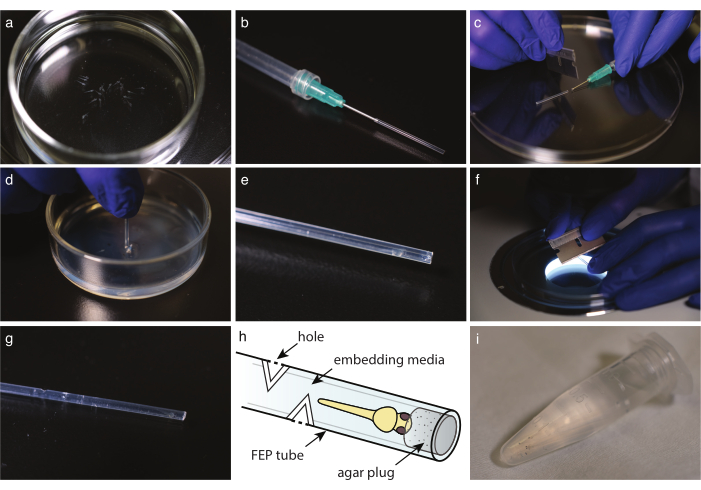
Figura 2: Montaje de embriones en tubo FEP. (a) Peces anestesiados sin pigmento en medios de montaje. b) Una jeringa con aguja de extremo romo y tubo FEP conectado. (c) Una vez que los medios y los peces estén recogidos en el tubo FEP, corte el tubo en el borde de la aguja. d) Sumergir el tubo cortado en un plato recubierto con agarosa al 2% para tapar su extremo. e) Un pez cebra en un tubo FEP enchufado. f) Cortar suavemente el tubo FEP a 30° para crear orificios de intercambio de gases. g) Tubo FEP con cuatro orificios por encima de un pez cebra incrustado. h) Esquema de un pez cebra incrustado en un tubo FEP. Se indican agujeros y tapón de agar. (i) Múltiples peces cebra incrustados listos para la obtención de imágenes. Haga clic aquí para ver una versión más grande de esta figura.
- Con una pipeta de vidrio desechable, transfiera el pescado a un medio de incrustación (Figura 2a). Si usa tricaína, transfiera el pescado a una placa de Petri llena de E3 que contenga tricaína, 10 minutos antes de la toma de imágenes. En ambos casos, vea bajo un estereomicroscopio para verificar que el pez dejó de moverse y que el corazón está latiendo a la misma velocidad en comparación con el control.
- Corte el tubo FEP a la longitud ideal con una cuchilla de afeitar (Figura 1h).
NOTA: La longitud debe ajustarse al soporte de la muestra del microscopio; la longitud típica es de unos 3 cm. - Prepare una jeringa con una cánula de extremo romo. Llene la jeringa con aire, luego monte el tubo FEP en la aguja y enjuague suavemente el agua restante vaciando la jeringa (Figura 2b).
NOTA: Evite hacer burbujas eliminando lentamente el aire. - Con el tubo FEP montado en la jeringa, primero, tome los medios para llenar el tubo FEP, luego tome una cabeza de embrión hacia abajo. Mantenga la cabeza del pez lo más cerca posible del extremo del tubo. Evite hacer burbujas; si hay una burbuja presente, deseche la muestra.
- Con una cuchilla de afeitar, corte cuidadosamente el tubo FEP en el borde de la cánula o aguja del extremo romo (Figura 2c).
- Deseche cualquier líquido en la parte superior del plato recubierto de agar. Sumerja el tubo FEP directamente en el agar (Figura 2d). Gire el tubo y sáquelo para liberar el tapón de la cama de agarosa.
- Debajo de un estereoscopio, verifique la presencia del tapón de agar en el extremo del tubo (Figura 2e).
- Para obtener imágenes a largo plazo, corte de 3 a 5 orificios en el tubo FEP en cada dirección cardinal, al menos 5 mm por encima del extremo del pez.
- Debajo de un estereoscopio, use una hoja de afeitar perpendicular al eje del tubo para hacer una incisión de 30 ° en el tubo FEP hasta llegar al medio de montaje (Figura 2f).
- Haga un segundo corte a 180° para crear un agujero (Figura 2g,h).
- Cabeza de embrión montada en transferencia hacia abajo en un tubo de microcentrífuga de 1,5 ml con medios de incrustación hasta que esté listo para la imagen (Figura 2i).
6. Posicionamiento de la muestra

Figura 3: Cámara de muestras. (a) Tubo FEP montado en un portamuestras. b) La cámara de muestra con etapas y objetivos. c) Vista superior de la cámara de muestras llena de medios, con objetivo de iluminación y detección en una configuración T-SPIM. d) Soporte de muestra montado en el microscopio, con la muestra en la cámara. Haga clic aquí para ver una versión más grande de esta figura.
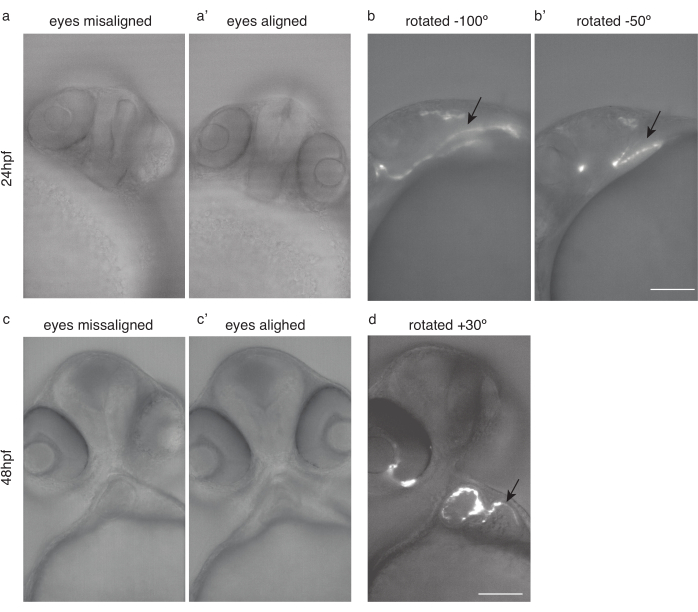
Figura 4: Posicionamiento embrionario para imágenes cardíacas. (a) Pez cebra 24 hpf Tg(kdrl:Hsa.HRAS-mCherry) con ojos desalineados. a') Mismo pez, con los ojos alineados. b) Los mismos peces giraron -100 ° y (b') -50 ° para obtener imágenes óptimas del corazón. c) pez cebra de 48 hpf con los ojos desalineados. c') Mismo pez, con los ojos alineados. (d) Mismo pez girado por 30° para una óptima imagen del corazón. Las flechas negras apuntan al corazón. Barra de escala 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
- En el microscopio, monte el tubo FEP en el soporte de la muestra (Figura 3a) y llene la cámara de imágenes con medios de incrustación (Figura 3b, c). A continuación, coloque el soporte de muestra en el escenario con la muestra sumergiéndose en la cámara (Figura 3d).
- Compruebe el estado de la muestra. Evalúe visualmente la frecuencia cardíaca para evaluar el bienestar general de los peces, ya que la frecuencia cardíaca específica depende de la etapa y la temperatura, comparándola con los peces de control no montados. Si los latidos del corazón son demasiado lentos, deseche el pescado.
NOTA: Asegure un manejo suave de los embriones, una transferencia cuidadosa a los medios de incrustación, la obtención de imágenes inmediatamente después de la incrustación, evite los cambios rápidos de temperatura, evite la tricaína y reduzca el tiempo de exposición a la tricaína. - Para obtener imágenes reproducibles, utilice siempre la misma posición de la muestra. Se recomienda alinear los ojos y obtener imágenes en ángulo.
- Gire el pez de modo que ambos ojos (Figura 4a,c) estén en el plano focal (Figura 4a',c')
- Desde esa posición, gire aún más el pez aproximadamente 50 ° -100 ° en el sentido de las agujas del reloj para imágenes de 24 hpf (Figura 4b, b'), y aproximadamente 20 ° -30 ° en sentido contrario a las agujas del reloj para imágenes de 48 hpf (Figura 4d).
NOTA: El corazón temprano, antes de 30 hpf, puede ser difícil de visualizar debido a su posición oculta (Figura 4b).
7. Adquisición de imágenes
- Elija el lado de iluminación que brinde la mejor calidad de imagen y adapte la potencia del láser a cada pez.
NOTA: Registre la potencia del láser utilizada para el análisis posterior de imágenes. - En cada plano z, grabe de 4 a 5 latidos cardíacos a 300 fotogramas por segundo (fps) o más.
NOTA: El campo de visión se puede recortar para aumentar la velocidad de adquisición. Por ejemplo, a 48 hpf el corazón del pez cebra late de dos a tres veces por segundo, por lo tanto, a 300 fps, se requieren entre 300 y 600 cuadros para adquirir de cuatro a seis latidos. - Para grabar el corazón que late, mueva la muestra paso a paso a través de la hoja de luz. Use un espaciado z de 1-2 μm, que cubra toda la profundidad del corazón.
8. Procesamiento de imágenes
- Sincronice la película grabada para reconstruir un corazón 4D (x, y, z, tiempo) utilizando un complemento de Fiji (Imagen J229,30) como se describió anteriormente6.
- Para explorar datos y generar películas del corazón de pez cebra renderizado, cargue el archivo 4D (x, y, z, tiempo) en un software de renderizado 3D.
Resultados
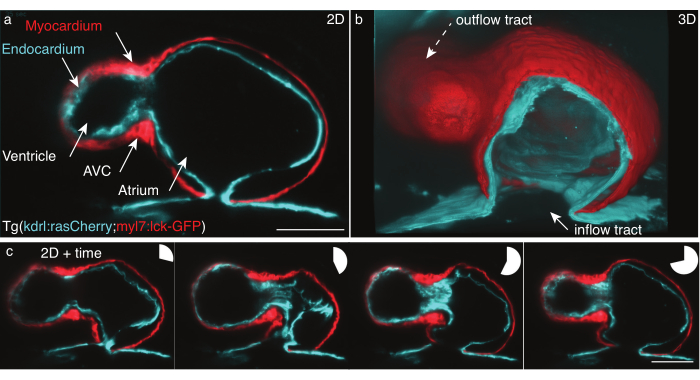
Figura 5: El corazón de pez cebra de 48 hpf. (a) Fotograma de un z-frame, vista ventral anterior de 48 hpf Tg(kdrl:Hsa.HRAS-mCherry; myl7:lck-EGFP) pez cebra, fotografiado con LSFM, (b) reconstrucción 3D de pilas de películas, vista cortada a través del atrio. c) Montaje de cuatro fotogramas sobre un latido cardíaco completo en un plano z. Los gráficos circulares indican el tiempo durante los latidos del corazón. Barra de escala 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
Hemos registrado el corazón palpitante de 48 hpf del pez cebra Tg(kdrl:Hsa.HRAS-mCherry; myl7:lck-EGFP) de acuerdo con el protocolo detallado anteriormente (Figura 5). Una hoja de luz láser de 488 nm y una de 561 nm iluminaron la muestra simultáneamente. La fluorescencia emitida se detectó perpendicularmente utilizando una lente de objetivo de 16x/0.8 W y una cámara científica de semiconductores de óxido metálico (sCMOS).
A 48 hpf, el corazón acaba de someterse a un bucle y tiene dos cámaras, el ventrículo y la aurícula, pero aún no ha desarrollado válvulas. En nuestras películas, las diferentes estructuras cardíacas como el tracto de entrada, el ventrículo, el canal auriculoventricular (AVC), la aurícula y la pista de salida son fácilmente distinguibles (Figura 5a, b). Estos datos muestran el latido preciso y revelan interacciones complejas entre las dos capas celulares del corazón: el miocardio, una capa muscular unicelular que se contrae y genera fuerza (Figura 5c, roja), y el endocardio, una capa de una sola célula que conecta el corazón con la vasculatura (Figura 5c, cian).
La reconstrucción del latido del corazón en x,y,z (3D) + tiempo (4D) + color (5D) se realizó según Mickoleit et al.6. La reconstrucción se basa en dos hipótesis: el movimiento del corazón es repetitivo y los datos deben adquirirse con un pequeño paso z. La salida es un latido único reconstruido en 5D, que mide de 30 GB a 80 GB por latido cardíaco. Para renderizar los datos, utilizamos la herramienta gratuita de código abierto FluoRender para la representación en profundidad31 , ya que fue diseñada para manejar conjuntos de datos multidimensionales y renderiza fácilmente películas 5D tanto de capas de celdas como de capas individuales (Figura 5b).
Discusión
Líneas transgénicas para obtener imágenes del corazón
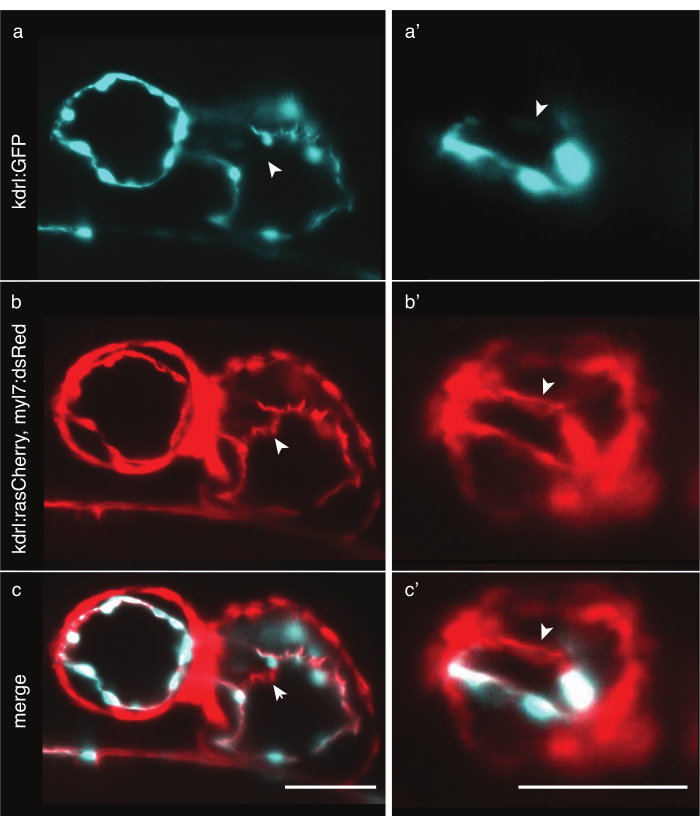
Figura 6: Comparación de líneas transgénicas de pez cebra marcadores citoplasmáticos y de membrana. Vista ventral anterior de corazones de pez cebra de 48 hpf fotografiados con LSFM. Las flechas blancas indican estructuras visibles solo con una línea transgénica marcadora de membrana. a) Señal Tg(kdrl:EGFP)32 en cian en el corazón y (a') en el ventrículo. (b) Señal Tg(kdrl:Hsa.HRAS-mCherry; myl7:dsRed)33 en rojo en el corazón y (b') en el ventrículo. ( c,c') fusión de la señal Tg(kdrl:Hsa.HRAS-mCherry; myl7:dsRed) y Tg(kdrl:EGFP). Barra de escala 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
La obtención de imágenes del corazón del pez cebra requiere un etiquetado preciso de las células cardíacas. Mientras que el grosor del miocardio es relativamente constante en todas las células, las células endocárdicas son gruesas alrededor del núcleo pero tienen protuberancias de membrana delgadas, en algunas regiones más delgadas que 2 μm. Las líneas transgénicas citoplasmáticas como Tg(kdrl:EGFP)32 etiquetan eficazmente las regiones alrededor de los núcleos endocárdicos, pero más lejos, el citoplasma delgado podría no emitir suficientes fotones para ser detectado con tiempos de exposición tan cortos, lo que lleva a agujeros artificiales en los datos (Figura 6a). Por el contrario, las líneas transgénicas de marcadores de membrana como Tg(kdrl:Hsa.HRAS-mCherry)33 pueden etiquetar eficazmente el endocardio y revelar más detalles (Figura 6b,c). Para cada experimento, elija cuidadosamente la línea transgénica más adecuada.
Inmovilización del pez cebra
La elección de la técnica de inmovilización depende de la duración del experimento y la edad del pez a fotografiar. La tricaína se ha utilizado comúnmente para la inmovilización del pez cebra, principalmente debido a su facilidad de uso. De hecho, simplemente agregando 130 mg / L de tricaína a los medios de peces da como resultado su anestesia en 10 min. Como puede conducir a defectos del desarrollo y afectar la fisiología del corazón20,22, recomendamos usar tricaína solo para experimentos cortos (menos de 30 min). Para imágenes más largas, las inyecciones de ARNm de α-bungarotoxina en la etapa de una o dos células paralizan a los peces hasta 3 días después de la fertilización (dpf) sin afectar el desarrollo cardiovascular o la fisiología22.
Elegir los tubos FEP adecuados
Los tubos FEP están disponibles en varios diámetros y espesores. Para obtener imágenes de peces de 0-5 dpf, 0.8 mm es un buen diámetro interior; elija tubos de pared gruesa de 0,8 x 1,6 mm o tubos de pared delgada de 0,8 x 1,2 mm. Recomendamos tubos de paredes delgadas; sin embargo, las paredes más gruesas ofrecen una mayor estabilidad y rigidez, lo que puede ser importante si la cámara de muestra tiene medios fluidos que podrían interrumpir y mover un tubo delgado. Para muestras más grandes, se pueden utilizar 1,6 x 2,4 mm y 2 x 3 mm.
Intercambios de temperatura y gases
Un aspecto esencial del bienestar del embrión de pez cebra es la temperatura. Idealmente, mantenga a los peces a 28.5 ° C mientras toma imágenes, ya que la temperatura del ambiente afecta el desarrollo y la frecuencia cardíaca34.
En nuestra experiencia, el intercambio de oxígeno a través del tapón de agarosa al 2% solo mantiene una frecuencia cardíaca estable hasta 3-4 dpf. Por lo tanto, cortar agujeros en el tubo asegura la difusión de oxígeno. También puede ser necesario para la administración de medicamentos a la muestra si se desea.
Suspensión de los latidos del corazón.
Las rápidas velocidades de adquisición de los microscopios de lámina de luz adecuadamente equipados permiten registrar el corazón latiendo in vivo. Sin embargo, para adquirir una pila z no perturbada, uno puede ralentizar o detener el corazón. Sin embargo, detener el corazón conduce a la relajación del músculo cardíaco y puede resultar en el colapso del corazón6. La suspensión de los latidos del corazón se puede hacer mediante el uso de morfolinos, bajas temperaturas, un inhibidor de la contracción muscular u optogenética. Cada uno de estos métodos tiene sus inconvenientes y debe evaluarse cuidadosamente para cada experimento.
La inyección de 4 ng de morfolino cardíaco silencioso (sih) en la etapa de una célula puede detener los latidos del corazón al dirigirse al gen tnnt2a crucial para la formación de sarcómeros35. El pez cebra sih no tiene latidos cardíacos y solo sobrevive hasta 7 dpf, cuando los embriones comienzan a depender de la sangre circulante para la oxigenación. Como la morfogénesis cardíaca es impulsada por fuerzas genéticas y biomecánicas36, estos peces presentan malformaciones cardíacas alrededor de 3 dpf.
Como el flujo de Ca2+ es sensible a la temperatura, la temperatura influye en la frecuencia cardíaca en el pez cebra embrionario21. En consecuencia, bajar la temperatura en la cámara de imágenes ralentiza los latidos del corazón. Detener los latidos del corazón requiere temperaturas inferiores a 15 °C. Como el pez cebra generalmente se mantiene a 28.5 ° C, tales temperaturas bajas solo se pueden mantener durante períodos breves (menos de 10 minutos).
Los fármacos como los inhibidores químicos de las contracciones musculares, la 2,3-Bu-tanediona 2-monoxima (BDM), se pueden añadir a los medios del pez cebra (50 nM37,38) para suspender temporalmente los latidos del corazón. BDM es conveniente de usar, ya que detiene la contracción del corazón en menos de 15 minutos y se puede lavar para restaurar la función cardíaca. Sin embargo, como la BDM altera el potencial de acción cardíaca, debe utilizarse con precaución37.
Finalmente, el corazón del pez cebra transgénico que expresa canales iónicos dependientes de luz o bombas como la canalrodopsina o la halorhodopsina en su miocardio puede manipularse y detenerse iluminando el marcapasos en el tracto de entrada con luz39,7,40,41,9.
Perspectiva
Las herramientas y soluciones optimizadas presentadas para estudiar el corazón del pez cebra in vivo permiten obtener imágenes suaves a largo plazo de la dinámica cardíaca ultrarrápida. La incrustación de la muestra se puede adaptar para adaptarse a diferentes modalidades de imagen, como la microscopía confocal, la microscopía de dos fotones o la tomografía de proyección óptica (OPT). La microscopía de hoja de luz, sin embargo, es probablemente la técnica preferida que ofrece seccionamiento óptico a una velocidad suficiente para capturar la dinámica del corazón. Si bien este protocolo se centra en las imágenes del corazón embrionario del pez cebra, creemos que también podría aplicarse a varias otras muestras y experimentos. Será interesante ver en el futuro si también se pueden usar técnicas similares de incrustación e imágenes en etapas posteriores durante el desarrollo, cuando el corazón está más oculto y la larva menos translúcida.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a Madelyn Neufeld por la ilustración de la Figura 2h. Este trabajo fue apoyado por la Sociedad Max Planck, el Instituto Morgridge para la Investigación, la Iniciativa Chan Zuckerberg y el Programa de Ciencia de frontera humana (HFSP).
Materiales
| Name | Company | Catalog Number | Comments |
| 1.5mL Eppendorf | Eppendorf | 22364111 | To carry embedded samples |
| 15mL Falcon tubes | Falcon | 352095 | To carry embedded samples |
| 50mL centrifuge tubes | Falcon | 352070 | 50ml tubes for sonication step, and storing cleaned, straightened FEP tubes |
| 50mL syringe | BD | 309654 | 50ml syringe for FEP cleaning |
| Agarose, low gelling temperature | Sigma Aldrich | 39346-81-1 | To make plug |
| Blunt Tip Needles, 21 gauge | VWR | 89500-304 | Blunt end needle for 0.8 inner diameter FEP tube |
| Borosilicate glass tube | McMaster-Carr | 8729K33 | Tubing for FEP tube straightening 9.5mm outer diameter, 5.6 inner diameter, 30cm long, other sizes available |
| Borosilicate glass tube | McMaster-Carr | 8729K31 | Tubing for FEP tube straightening 6.35mm outer diameter, 4mm inner diameter, 30cm long, other sizes available |
| Conventional needles, 21 Gauge | BD | 305165 | Conventional needle for 0.8 inner diameter FEP tube |
| Disposable glass pipette | Grainger | 52NK56 | To transfer fish, use with pipette pump |
| E3 medium for zebrafish embryos | |||
| Ethanol | Sigma Aldrich | 64-17-5 | Ethanol for FEP cleaning |
| FEP tube, 0.8 / 1.2 mm | ProLiquid | 2001048 | FEP tube with thin wall, other sizes available |
| FEP tube, 0.8 / 1.6 mm | Bola | S1815-04 | FEP tube with thick wall, other sizes available |
| FEP tube, 2/3mm | BGB | 211581 | Large FEP tube with thick wall, other sizes available |
| Hot Hand Rubber Mitt | Cole-Parmer | 691000 | To carry hot equipment after autoclaving |
| Omnifix 1mL Syringes | B Braun | 9161406V | 1ml syringe for embedding |
| Petri dish, small | Dot Scientific | PD-94050 | To make agarose plug |
| Pipette pumps | Argos Technologies | 04395-05 | To transfer fish, use with disposable glass pipette |
| PTU | Sigma Aldrich | 103-85-5 | Also known as: N-Phenylthiourea, 1-Phenyl-2-thiourea, Phenylthiocarbamide |
| Razor blades | Azpack | 11904325 | To cut FEP tubes |
| Sodium Hydroxide | Dot Scientific | DSS24000 | NaOH for FEP cleaning |
| Tricaine | Sigma Aldrich | E10521 | Also known as: MS-222, Ethyl 3-aminobenzoate methanesulfonate, Tricaine |
Referencias
- Hoebe, R. A., et al. Controlled light-exposure microscopy reduces photobleaching and phototoxicity in fluorescence live-cell imaging. Nature Biotechnology. 25 (2), 249-253 (2007).
- Jenielita, M., Taormina, M. J., Delaurier, A., Kimmel, C. B., Parthasarathy, R. Comparing phototoxicity during the development of a zebrafish craniofacial bone using confocal and light sheet fluorescence microscopy techniques. Journal of Biophotonics. 6 (11-12), 920-928 (2013).
- Icha, J., Weber, M., Waters, J. C., Norden, C. Phototoxicity in live fluorescence microscopy, and how to avoid it. BioEssays. 39 (8), 1700003 (2017).
- Reynaud, E. G., Kržič, U., Greger, K., Stelzer, E. H. K. Light sheet-based fluorescence microscopy: more dimensions, more photons, and less photodamage. Human Frontier Science Program Journal. 2 (5), 266-275 (2008).
- Weber, M., Huisken, J. Light sheet microscopy for real-time developmental biology. Current Opinion in Genetics & Development. 21 (5), 566-572 (2011).
- Mickoleit, M., et al. High-resolution reconstruction of the beating zebrafish heart. Nat Methods. 11 (9), 919-922 (2014).
- Arrenberg, A. B., Stainier, D. Y., Baier, H., Huisken, J. Optogenetic control of cardiac function. Science. 330 (6006), 971-974 (2010).
- Trivedi, V., et al. Dynamic structure and protein expression of the live embryonic heart captured by 2-photon light sheet microscopy and retrospective registration. Biomed Optics Express. 6 (6), 2056-2066 (2015).
- Weber, M., Yelon, D., et al. Cell-accurate optical mapping across the entire developing heart. eLife. 6, 28307 (2017).
- Weber, M., Huisken, J. In vivo imaging of cardiac development and function in zebrafish using light sheet microscopy. Swiss Medical Weekly. 145, 14227 (2015).
- Fei, P., et al. Cardiac light-sheet fluorescent microscopy for multi-scale and rapid imaging of architecture and function. Science Reports. 6 (1), 1-12 (2016).
- Felker, A., et al. Continuous addition of progenitors forms the cardiac ventricle in zebrafish. Nature Communication. 9 (1), 1-14 (2018).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. K. Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305 (5686), 1007-1009 (2004).
- Keller, P. J., Pampaloni, F., Stelzer, E. H. Life sciences require the third dimension. Current Opinion in Cell Biology. 18 (1), 117-124 (2006).
- Keller, P. J., Schmidt, A. D., Wittbrodt, J., Stelzer, E. H. K. Reconstruction of zebrafish early embryonic development by scanned light sheet microscopy. Science. 322 (5904), 1065-1069 (2008).
- Weber, M., Mickoleit, M., Huisken, J. Multilayer mounting for long-term light sheet microscopy of zebrafish. Journal of Visualized Experiments. (84), e51119 (2014).
- Berndt, F., Shah, G., Power, R. M., Brugués, J., Huisken, J. Dynamic and non-contact 3D sample rotation for microscopy. Nature Communications. 9 (1), 1-7 (2018).
- Daetwyler, S., Günther, U., Modes, C. D., Harrington, K., Huisken, J. Multi-sample SPIM image acquisition, processing. and analysis of vascular growth in zebrafish. Development. , 173757 (2019).
- Keomanee-Dizon, K., Fraser, S. E., Truong, T. V. A versatile, multi-laser twin-microscope system for light-sheet imaging. Review of Scientific Instruments. 91 (5), 053703 (2020).
- Kaufmann, A., Mickoleit, M., Weber, M., Huisken, J. Multilayer mounting enables long-term imaging of zebrafish development in a light sheet microscope. Development. 139 (17), 3242-3247 (2012).
- Gierten, J., et al. Automated high-throughput heartbeat quantification in medaka and zebrafish embryos under physiological conditions. Science Reports. 10 (1), 1-12 (2020).
- Swinburne, I. A., Mosaliganti, K. R., Green, A. A., Megason, S. G. Improved long-term imaging of embryos with genetically encoded α-bungarotoxin. PLOS ONE. 10 (8), 0134005-0134015 (2015).
- Taylor, J. M., et al. Adaptive prospective optical gating enables day-long 3D time-lapse imaging of the beating embryonic zebrafish heart. Nature Communication. 10 (1), 1-15 (2019).
- Power, R. M., Huisken, J. A guide to light-sheet fluorescence microscopy for multiscale imaging. Nature Methods. 14 (4), 360-373 (2017).
- Nüsslein-Volhard, C., Dahm, R. . Zebrafish: A Practical Approach. , (2002).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: An introduction. Journal of Visualized Experiments. (69), e4196 (2012).
- Cold Spring Harbor. E3 medium (for zebrafish embryos). Cold Spring Harbor Protocols. 2011, 66449 (2011).
- Yuan, S., Sun, Z. Microinjection of mRNA and morpholino antisense oligonucleotides in zebrafish embryos. Journal of Visualized Experiments. (27), e1113 (2009).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529 (2017).
- Jin, S. -. W., Beis, D., Mitchell, T., Chen, J. -. N., Stainier, D. Y. Cellular and molecular analyses of vascular tube and lumen formation in zebrafish. Development. 132 (23), 5199-5209 (2005).
- Chi, N. C., et al. Foxn4 directly regulates tbx2b expression and atrioventricular canal formation. Genes and Development. 22 (6), 734-739 (2008).
- Scott, G. R., Johnston, I. A. Temperature during embryonic development has persistent effects on thermal acclimation capacity in zebrafish. Proceedings of the National Academy of Sciences. 109 (35), 14247-14252 (2012).
- Sehnert, A. J., et al. Cardiac troponin T is essential in sarcomere assembly and cardiac contractility. Nature Genetics. 31 (1), 106-110 (2002).
- Sidhwani, P., Yelon, D., Wellik, D. M. Fluid forces shape the embryonic heart: Insights from zebrafish. Current Topics in Developmental Biology. 132, 395-416 (2019).
- Jou, C. J., Spitzer, K. W., Tristani-Firouzi, M. Blebbistatin effectively uncouples the excitation-contraction process in zebrafish embryonic heart. Cell Physiology and Biochemistry. 25 (4-5), 419-424 (2010).
- Chow, R. W. -. Y., Lamperti, P., Steed, E., Boselli, F., Vermot, J. following endocardial tissue movements via cell photoconversion in the zebrafish embryo. Journal of Visualized Experiments. (132), e57290 (2018).
- Nagel, G., et al. Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. Proccedings of the National Academy of Sciences. 100 (24), 13940-13945 (2003).
- Knollmann, B. C. Pacing lightly: optogenetics gets to the heart. Nature Methods. 7 (11), 889-891 (2010).
- Bruegmann, T., et al. Optogenetic control of heart muscle in vitro and in vivo. Nature Methods. 7 (11), 897-900 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados