Method Article
Microscopia light sheet di dinamiche cardiache veloci in embrioni zebrafish
In questo articolo
Riepilogo
Descriviamo strumenti ottimizzati per studiare il cuore di zebrafish in vivo con microscopia a fluorescenza a foglio leggero. In particolare, suggeriamo linee transgeniche cardiache luminose e presentiamo nuove delicate tecniche di incorporamento e immobilizzazione che evitano difetti dello sviluppo e cardiaci. Viene inoltre fornita una possibile pipeline di acquisizione e analisi dei dati adattata all'imaging cardiaco.
Abstract
La ricerca cardiaca embrionale ha tratto grandi benefici dai progressi nella microscopia a fluorescenza veloce in vivo a foglio di luce (LSFM). In combinazione con il rapido sviluppo esterno, la genetica trattabile e la traslucenza del pesce zebra, Danio rerio, LSFM ha fornito approfondimenti sulla forma e la funzione cardiaca ad alta risoluzione spaziale e temporale senza fototossicità o fotosbiancamento significativi. L'imaging di cuori pulsanti sfida le tecniche esistenti di preparazione dei campioni e microscopia. È necessario mantenere un campione sano in un campo visivo ristretto e acquisire immagini ultraveloci per risolvere il battito cardiaco. Qui descriviamo strumenti e soluzioni ottimizzati per studiare il cuore di zebrafish in vivo. Dimostriamo le applicazioni di linee transgeniche luminose per l'etichettatura dei costituenti cardiaci e presentiamo nuove tecniche di incorporamento e immobilizzazione delicate che evitano difetti dello sviluppo e cambiamenti nella frequenza cardiaca. Proponiamo anche una pipeline di acquisizione e analisi dei dati adattata all'imaging cardiaco. L'intero flusso di lavoro qui presentato si concentra sull'imaging cardiaco embrionale del pesce zebra, ma può anche essere applicato a vari altri campioni ed esperimenti.
Introduzione
Per scoprire gli eventi complessi e le interazioni nel cuore che batte precocemente, è necessaria l'imaging in vivo dell'intero organo. Con la sua fototossicità minima1,2,3, il basso fotosbiancamento4 e l'alta velocità, la microscopia a foglio luminoso si è evoluta come strumento di imaging primario per lo sviluppo embrionale e cardiaco5,6. Ha fornito approfondimenti sulla forma e la funzione cardiaca ad alta risoluzione spaziale e temporale7,8,9 e ha permesso ai ricercatori di visualizzare e tracciare parti del cuore etichettate fluorescentmente ad alta velocità, studiare le forze emodinamiche e seguire lo sviluppo del cuore direttamente all'interno del corpo degli embrioni in via di sviluppo6,10,11,12.
Per vincolare in modo preciso e riproducibile il pesce zebra nel campo visivo, esiste una varietà di protocolli di incorporamento per fogli luminosi, a breve e lungo termine, nonché campioni singoli o multipli13,14,15,16,17,18,19. Il protocollo più comune prevede l'immobilizzazione della tricaina e il montaggio dell'agarosio all'interno di un tubo di vetro o di plastica. Tuttavia, poiché la frequenza cardiaca può cambiare a causa della temperatura, degli anestetici e del materiale di incorporamento utilizzato20,21,22, l'imaging cardiaco del pesce zebra richiede protocolli specifici e delicati per garantire la salute del campione6,8,11,12,20,21,22,23 . Per l'imaging a breve termine (fino a un'ora), è possibile anestetizzare il pesce in tricaina da 130 mg / L e incorporarlo in tubi di etilene propilene fluorurato (FEP) con soluzione di agarosio allo 0,1% e una spina, come descritto in Weber et al. 201416. Tuttavia, poiché la tricaina può portare a difetti dello sviluppo20,22, è necessario utilizzare protocolli diversi per l'imaging a lungo termine.
Qui descriviamo una nuova strategia per l'imaging cardiaco a lungo termine. Sebbene esistano molte implementazioni di fogli luminosi24, si consiglia di utilizzare un campione sospeso in un microscopio T-SPIM (una lente di rilevamento e due lenti di illuminazione su un piano orizzontale con il campione appeso verticalmente nella messa a fuoco comune). Ciò offre la necessaria libertà di movimento e rotazione per il posizionamento preciso del campione. I pesci vengono immobilizzati iniettando 30 pg α-bungarotossina mRNA allo stadio a una o due cellule. α-bungarotossina è un veleno di serpente che paralizza i muscoli senza influenzare lo sviluppo cardiovascolare o la fisiologia22. Per un'imaging preciso e privo di distorsioni, si consiglia di montare i pesci in tubi fatti di FEP, un polimero con un indice di rifrazione quasi identico all'acqua. Discutiamo di come preparare al meglio i tubi FEP raddrizzandoli e pulendoli prima dell'imaging. I pesci vengono quindi montati in questi tubi, a testa in giù, nei media, e il fondo del tubo è sigillato con un tappo di agarosio al 2%, su cui poggiano le teste dei pesci. I fori di taglio nel tubo FEP facilitano lo scambio di gas e garantiscono la crescita dei pesci. Il pesce incorporato può essere conservato nei supporti fino a quando non viene montato su un portacampioni subito prima dell'imaging. Suggeriamo anche una pipeline di acquisizione e analisi dei dati per immagini riproducibili ad alta velocità. Inoltre, discutiamo l'uso di linee transgeniche citoplasmatiche rispetto a quelle marcatori di membrana per una robusta etichettatura delle cellule cardiache, nonché diverse opzioni per fermare il cuore. Queste tecniche di montaggio garantiscono la salute del campione consentendo al contempo di vincolare il cuore in modo preciso e riproducibile nel campo visivo.
Protocollo
Tutti gli adulti e gli embrioni di zebrafish (Danio rerio) sono stati gestiti in conformità con i protocolli approvati dall'UW-Madison Institutional Animal Care and Use Committee (IACUC).
1. Preparazione del pesce zebra
- Gestire il pesce zebra secondo i protocolli stabiliti25,26 e le linee guida istituzionali. Allevare pesci adulti della linea transgenica desiderata (vedi Discussione). Raccogliere gli embrioni e conservarli a 28 °C in una capsula di Petri piena di mezzo di pesce, ad esempio E327.
- Scegli un metodo di immobilizzazione (vedi Discussione).
- Se si utilizza α-bungarotossina mRNA per immobilizzare il pesce, iniettare 30 pg di mRNA22 nel tuorlo di embrioni a una o due cellule utilizzando un ago di vetro montato su un micromanipolatore e collegato a un picoiniettore28.
- Se si utilizza tricaina, preparare la soluzione madre allo 0,4% tamponata a pH 7,0-7,4 con base Tris da 1 M e conservare a -20 °C fino all'imaging.
- Conservare le uova in una capsula di Petri ripiena di E3 a 28 °C e trasferire le uova ogni 24 ore in un nuovo piatto con E3 fresco fino all'imaging.
- Per prevenire la formazione di pigmenti, se lo sfondo del pesce zebra non è albino, trasferire il pesce a 24 ore dopo la fecondazione (hpf) in un nuovo piatto E3 con inibitore della tirosinasi da 0,2 mM 1- fenil 2-tiourea (vedi Discussione).
2. Preparazione dei tubi FEP
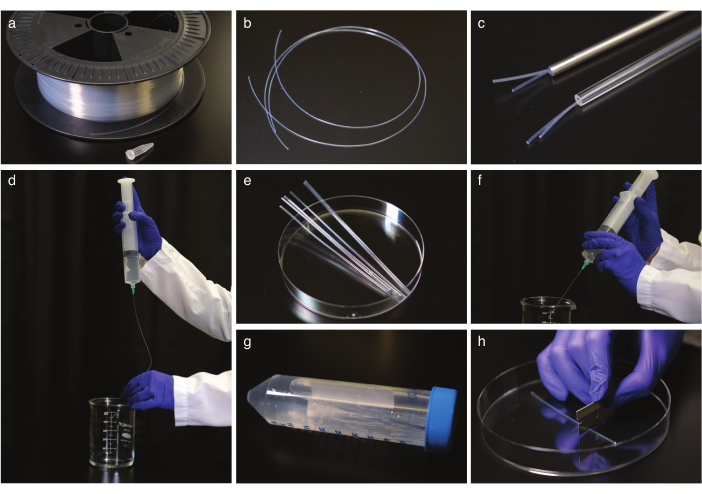
Figura 1: Pulizia e raddrizzamento dei tubi FEP. (a) Tubi FEP su un tamburo del cavo. b) Tubi FEP prima del raddrizzamento. c) tubi FEP in vetro e acciaio per tubi sicuri per autoclave. d) Lavaggio dei tubi FEP dopo il raddrizzamento e il raffreddamento. e) tubo FEP tagliato alle dimensioni di un tubo centrifugo per sonicazione. f) Lavaggio dei tubi FEP dopo sonicazione. g) Stoccaggio dei tubi FEP puliti e raddrizzati in un tubo centrifugo. h) Taglio del tubo FEP prima dell'imaging. Fare clic qui per visualizzare una versione più grande di questa figura.
- Raddrizzare i tubi FEP (Figura 1a,b) posizionandoli in un tubo di vetro o acciaio sicuro per autoclave (Figura 1c) con il diametro interno corretto per adattarsi ai tubi FEP, di solito 1,6 o 2,4 mm, e autoclave a 180 °C per 2 ore. Lasciare raffreddare i tubi a temperatura ambiente per almeno 5 ore. Quindi, rimuovere dai tubi di raddrizzamento.
NOTA: utilizzare i guanti quando si manipolano i tubi e lavorare con tubi da 50 cm alla volta. - Pulire i tubi FEP.
NOTA: le siringhe con punta dell'ago smussata della dimensione del tubo FEP interno sono raccomandate per sicurezza, ma un ago normale funzionerà.- Lavare i tubi con 1 M NaOH due volte con una siringa da 50 mL (Figura 1d).
- Tagliare i tubi FEP alle dimensioni di un tubo centrifugo da 50 mL con una lama di rasoio (Figura 1e), posizionare i tubi tagliati in tubi centrifuga riempiti naOH da 0,5 M e ultrasuoni per 10 minuti.
- Lavare i tubi FEP con H2O a doppio distillato, quindi ripetere il lavaggio con etanolo al 70% (Figura 1f).
- Trasferire i tubi al 70% di etanolo e ultrasuoni per 10 minuti.
- Lavare i tubi con H2O a doppio distillato e conservarli in tubi centrifughi in H2O a doppia distillazione (Figura 1g).
3. Preparazione del piatto di agarosio al 2%
- In un pallone di vetro, sciogliere la polvere di agarosio a basso punto di fusione in E3. Riscaldare la soluzione in un forno a microonde e mescolarla ogni 20 s, fino a quando tutta la polvere è sciolta.
- Versare l'agarosio in una capsula di Petri di vetro o plastica per ottenere un cappotto di 1-2 mm. Attendere che l'agarosio sia solidificato.
- Per conservare, versare delicatamente E3 sulla parte superiore dell'agar per evitare l'essiccazione. Avvolgere in pellicola di paraffina e conservare a 4 °C.
4. Preparazione dei supporti di incorporamento
- Preparare abbastanza E3 per riempire la camera del campione.
NOTA: Evitare l'uso del blu metilico se il supporto è a contatto con le lenti dell'obiettivo. - Se si utilizza tricaina, scongelare la soluzione madre e aggiungere lo 0,02% di tricaina all'E3.
5. Montaggio del campione
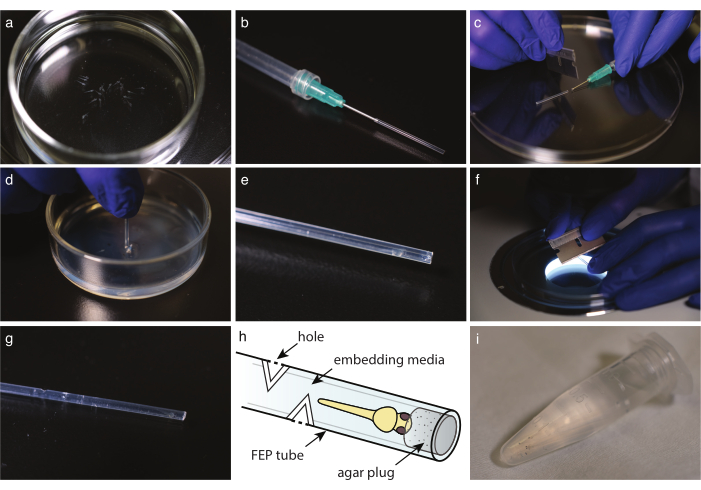
Figura 2: Montaggio di embrioni in tubo FEP. (a) Pesce anestetizzato privo di pigmenti in supporti di montaggio. b) Una siringa con ago terminale smussato e tubo FEP attaccati. c) Una volta che i mezzi e i pesci sono stati prelevati nel tubo FEP, tagliare il tubo sul bordo dell'ago. d) Immergere il tubo tagliato in un piatto rivestito di agarosio al 2% per tapparne l'estremità. e) Un pesce zebra in un tubo FEP tappato. (f) Tagliare delicatamente il tubo FEP a 30° per creare fori di scambio gassoso. g) tubo FEP con quattro fori sopra un pesce zebra incorporato. h) Schema di un pesce zebra incorporato in un tubo FEP. Sono indicati fori e tappo di agar. (i) Più pesci zebra incorporati pronti per l'imaging. Fare clic qui per visualizzare una versione più grande di questa figura.
- Con una pipetta di vetro usa e getta, trasferire il pesce ai supporti di incorporamento (Figura 2a). Se si utilizza la tricaina, trasferire il pesce nella capsula di Petri piena di E3 contenente tricaina, 10 minuti prima dell'imaging. In entrambi i casi, visualizzare sotto uno stereomicroscopio per verificare che il pesce abbia smesso di muoversi e che il cuore batta alla stessa velocità rispetto al controllo.
- Tagliare il tubo FEP alla lunghezza ideale con una lama di rasoio (Figura 1h).
NOTA: la lunghezza deve essere regolata sul portacampioni del microscopio; la lunghezza tipica è di circa 3 cm. - Preparare una siringa con una cannula smussata. Riempire la siringa con aria, quindi montare il tubo FEP sull'ago e sciacquare delicatamente l'acqua rimanente svuotando la siringa (Figura 2b).
NOTA: Evitare di fare bolle lavando lentamente l'aria. - Con il tubo FEP montato sulla siringa, in primo luogo, prendere il mezzo per riempire il tubo FEP, quindi prendere un embrione a testa in giù. Tenere la testa del pesce il più vicino possibile all'estremità del tubo. Evitare di fare bolle; se è presente una bolla, scartare il campione.
- Con una lama di rasoio, tagliare con cura il tubo FEP sul bordo della cannula o dell'ago contundente (Figura 2c).
- Scartare qualsiasi liquido sulla parte superiore del piatto rivestito di agar. Immergere il tubo FEP direttamente nell'agar (Figura 2d). Ruotare il tubo ed estrarlo per rilasciare la spina dal letto di agarosio.
- Sotto uno stereoscopio, verificare la presenza della spina di agar all'estremità del tubo (Figura 2e).
- Per l'imaging a lungo termine, tagliare 3-5 fori nel tubo FEP in ogni direzione cardinale, almeno 5 mm sopra l'estremità del pesce.
- Sotto uno stereoscopio, utilizzare una lama di rasoio perpendicolare all'asse del tubo per praticare un'incisione di 30° nel tubo FEP fino a raggiungere il supporto di montaggio (Figura 2f).
- Effettuare un secondo taglio a 180° per creare un foro (Figura 2g,h).
- Trasferire la testa dell'embrione montato in un tubo microcentrifuga da 1,5 ml con supporti incorporanti fino a quando non sarà pronto per l'immagine (Figura 2i).
6. Posizionamento del campione

Figura 3: Camera del campione. (a) Tubo FEP montato su un portacampioni. b) La camera campione con fasi e obiettivi. c) Vista dall'alto della camera campione riempita di supporti, con illuminazione e obiettivo di rilevamento in configurazione T-SPIM. d) Portacampioni montato sul microscopio, con il campione nella camera. Fare clic qui per visualizzare una versione più grande di questa figura.
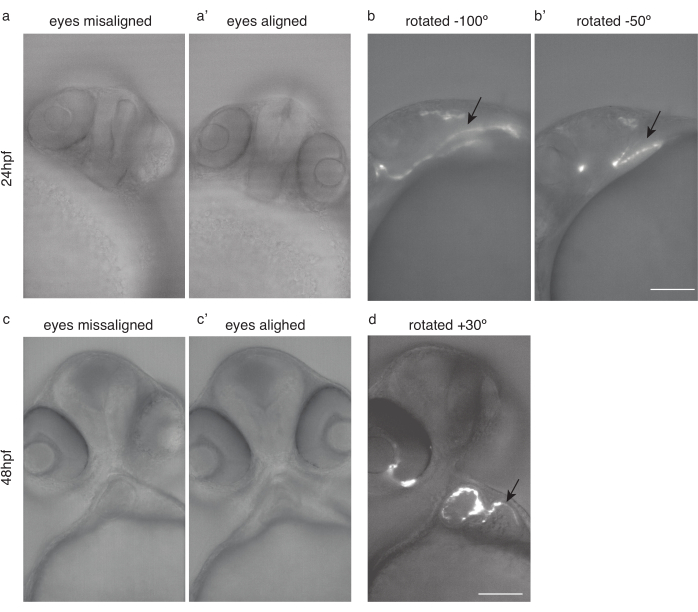
Figura 4: Posizionamento dell'embrione per l'imaging cardiaco. (a) 24 hpf Tg(kdrl:Hsa.HRAS-mCherry) zebrafish con gli occhi disallineati. a') Stesso pesce, con gli occhi allineati. b) Stesso pesce ruotato di -100 ° e (b') -50 ° per un'imaging cardiaco ottimale. c) pesce zebra da 48 HPF con gli occhi disallineati. c)) Stesso pesce, con gli occhi allineati. (d) Stesso pesce ruotato di 30° per un'imaging cardiaca ottimale. Le frecce nere puntano al cuore. Barra della scala 100 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
- Al microscopio, montare la provetta FEP nel portacampioni (Figura 3a) e riempire la camera di imaging con supporti incorporanti (Figura 3b,c). Quindi, posizionare il portacampioni sul palco con il campione che si immerge nella camera (Figura 3d).
- Controllare lo stato di salute del campione. Valuta visivamente la frequenza cardiaca per valutare il benessere generale dei pesci, poiché la frequenza cardiaca specifica dipende dallo stadio e dalla temperatura, confrontandola con i pesci di controllo non montati. Se il battito cardiaco è troppo lento, scartare il pesce.
NOTA: Garantire una manipolazione delicata degli embrioni, un attento trasferimento ai mezzi di incorporamento, l'imaging immediatamente dopo l'incorporamento, evitando rapidi cambiamenti di temperatura, evitando la tricaina e riducendo il tempo di esposizione alla tricaina. - Per immagini riproducibili, utilizzare sempre la stessa posizione del campione. Si consiglia di allineare gli occhi e l'imaging ad angolo.
- Ruotare il pesce in modo che entrambi gli occhi (Figura 4a,c) si trovino sul piano focale (Figura 4a',c')
- Da quella posizione, ruotare ulteriormente il pesce di circa 50 °-100 ° in senso orario per l'imaging a 24 hpf (Figura 4b, b') e di circa 20 °-30 ° in senso antiorario per l'imaging a 48 HPF (Figura 4d).
NOTA: il cuore precoce, prima di 30 hpf, può essere difficile da immaginare a causa della sua posizione nascosta (Figura 4b).
7. Acquisizione di immagini
- Scegli il lato di illuminazione che offre la migliore qualità dell'immagine e adatta la potenza del laser ad ogni pesce.
NOTA: Registrare la potenza laser utilizzata per la successiva analisi delle immagini. - A ogni piano z, registra 4-5 battiti cardiaci a 300 fotogrammi al secondo (fps) o più.
NOTA: il campo visivo può essere ritagliato per aumentare la velocità di acquisizione. Ad esempio, a 48 hpf il cuore del pesce zebra batte da due a tre volte al secondo, quindi, a 300 fps, sono necessari tra 300 e 600 fotogrammi per acquisire da quattro a sei battiti cardiaci. - Per registrare il cuore pulsante, spostare il campione gradualmente attraverso il foglio luminoso. Utilizzare una spaziatura z di 1-2 μm, che copre l'intera profondità del cuore.
8. Elaborazione delle immagini
- Sincronizza il filmato registrato per ricostruire un cuore 4D (x, y, z, tempo) utilizzando un plug-in Fiji (Immagine J229,30) come descritto in precedenza6.
- Per esplorare i dati e generare filmati del cuore di zebrafish renderizzato, carica il file 4D (x, y, z, tempo) in un software di rendering 3D.
Risultati
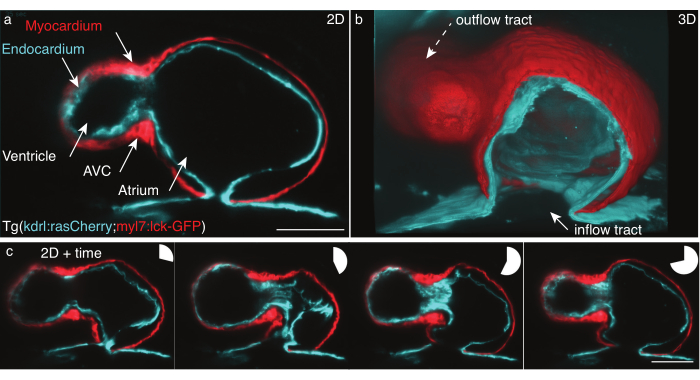
Figura 5: Il cuore di zebrafish da 48 hpf. (a) Ancora di uno z-frame, vista anteriore-ventrale di 48 hpf Tg(kdrl:Hsa.HRAS-mCherry; myl7:lck-EGFP) zebrafish, ripreso con LSFM, (b) ricostruzione 3D di pile di film, vista tagliata attraverso l'atrio. (c) Montaggio di quattro fotogrammi su un battito cardiaco completo su un piano z. I grafici a torta indicano il tempo durante il battito cardiaco. Scala a barre 50 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Abbiamo registrato il cuore pulsante da 48 hpf del pesce zebra Tg(kdrl:Hsa.HRAS-mCherry; myl7:lck-EGFP) secondo il protocollo sopra descritto (Figura 5). Un foglio di luce laser da 488 nm e un foglio di luce laser da 561 nm illuminavano il campione contemporaneamente. La fluorescenza emessa è stata rilevata perpendicolarmente utilizzando un obiettivo da 16x/0,8 W e una telecamera scientifica a semiconduttore di ossido di metallo (sCMOS).
A 48 hpf, il cuore ha appena subito un looping e ha due camere, il ventricolo e l'atrio, ma deve ancora sviluppare valvole. Nei nostri film, le diverse strutture cardiache come il tratto di afflusso, il ventricolo, il canale atrioventricolare (AVC), l'atrio e la traccia di deflusso sono facilmente distinguibili (Figura 5a,b). Questi dati mostrano il battito preciso e rivelano interazioni complesse tra i due strati cellulari del cuore: il miocardio, uno strato muscolare a singola cellula che si contrae e genera forza (Figura 5c, rosso) e l'endocardio, un singolo strato cellulare che collega il cuore alla vascolarizzazione (Figura 5c, ciano).
La ricostruzione del battito cardiaco in x,y,z (3D) + tempo (4D) + colore (5D) è stata eseguita secondo Mickoleit et al.6. La ricostruzione si basa su due ipotesi: il movimento del cuore è ripetitivo e i dati dovrebbero essere acquisiti con un piccolo z-step. L'output è un singolo battito cardiaco ricostruito in 5D, che misura da 30 GB a 80 GB per heartbeat. Per eseguire il rendering dei dati, abbiamo utilizzato lo strumento gratuito e open source FluoRender per il rendering approfondito31 in quanto è stato progettato per gestire set di dati multidimensionali e renderizzare facilmente filmati 5D di entrambi i livelli di cella e singoli livelli (Figura 5b).
Discussione
Linee transgeniche per immaginare il cuore
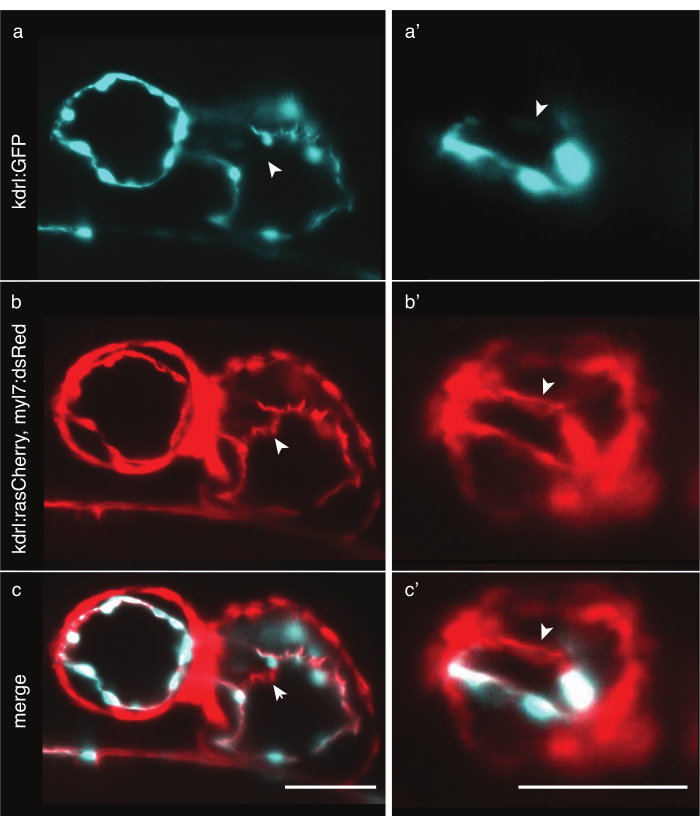
Figura 6: Confronto delle linee transgeniche di zebrafish citoplasmatiche e marcatori di membrana. Vista anteriore-ventrale di cuori di zebrafish da 48 hpf ripresi con LSFM. Le frecce bianche indicano strutture visibili solo con una linea transgenica marcatore di membrana. a) Segnale Tg(kdrl:EGFP)32 in ciano nel cuore e (a') nel ventricolo. b) Segnale Tg(kdrl:Hsa.HRAS-mCherry; segnale myl7:dsRed)33 in rosso nel cuore e (b') nel ventricolo. ( c,c') fusione del segnale Tg(kdrl:Hsa.HRAS-mCherry; myl7:dsRed) e Tg(kdrl:EGFP). Scala a barre 50 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
L'imaging del cuore del pesce zebra richiede un'etichettatura precisa delle cellule cardiache. Mentre lo spessore miocardico è relativamente costante in tutte le cellule, le cellule endocardiche sono spesse intorno al nucleo ma hanno sottili sporgenze di membrana, in alcune regioni più sottili di 2 μm. Le linee transgeniche citoplasmatiche come Tg(kdrl:EGFP)32 etichettano efficacemente le regioni intorno ai nuclei endocardici, ma più lontano, il citoplasma sottile potrebbe non emettere abbastanza fotoni da essere rilevato con tempi di esposizione così brevi, portando a buchi artificiali nei dati (Figura 6a). Al contrario, le linee transgeniche dei marcatori di membrana come Tg(kdrl:Hsa.HRAS-mCherry)33 possono etichettare efficacemente l'endocardio e rivelare maggiori dettagli (Figura 6b,c). Per ogni esperimento, scegli con cura la linea transgenica più appropriata.
Immobilizzazione del pesce zebra
La scelta della tecnica di immobilizzazione dipende dalla durata dell'esperimento e dall'età del pesce da immaginare. La tricaina è stata comunemente usata per l'immobilizzazione del pesce zebra, principalmente grazie alla sua facilità d'uso. Infatti, la semplice aggiunta di 130 mg / L di tricaina ai mezzi di pesce si traduce nella loro anestesia in 10 minuti. Poiché può portare a difetti dello sviluppo e influenzare la fisiologia del cuore20,22, si consiglia di utilizzare la tricaina solo per brevi esperimenti (meno di 30 min). Per l'imaging più lungo, le iniezioni di mRNA α-bungarotossina allo stadio a una o due cellule paralizzano i pesci fino a 3 giorni dopo la fecondazione (dpf) senza influire sullo sviluppo cardiovascolare o sulla fisiologia22.
Scegliere i tubi FEP giusti
I tubi FEP sono disponibili in vari diametri e spessori. Per l'immagine di pesci 0-5 dpf, 0,8 mm è un buon diametro interno; scegli tubi a parete spessa 0,8 x 1,6 mm o tubi a parete sottile 0,8 x 1,2 mm. Raccomandiamo tubi a parete sottile; tuttavia, le pareti più spesse offrono maggiore stabilità e rigidità, che possono essere importanti se la camera del campione ha fluidi fluenti che potrebbero interrompere e spostare un tubo sottile. Per campioni più grandi, è possibile utilizzare 1,6 x 2,4 mm e 2 x 3 mm.
Scambi di temperatura e gas
Un aspetto essenziale del benessere dell'embrione di zebrafish è la temperatura. Idealmente, mantenere il pesce a 28,5 °C durante l'imaging, poiché la temperatura dell'ambiente influisce sullo sviluppo e sulla frequenza cardiaca34.
Nella nostra esperienza, lo scambio di ossigeno attraverso il tappo di agarosio al 2% mantiene solo una frequenza cardiaca stabile fino a 3-4 dpf. Pertanto, i fori di taglio nel tubo garantiscono la diffusione dell'ossigeno. Può anche essere necessario per la consegna del farmaco al campione, se lo si desidera.
Sospensione del battito cardiaco.
Le elevate velocità di acquisizione dei microscopi a foglio luminoso opportunamente equipaggiati consentono la registrazione del cuore pulsante in vivo. Tuttavia, per acquisire uno z-stack indisturbato, si può rallentare o fermare il cuore. Tuttavia, fermare il cuore porta al rilassamento del muscolo cardiaco e potrebbe causare il collasso del cuore6. La sospensione del battito cardiaco può essere eseguita utilizzando morfolinos, basse temperature, un inibitore della contrazione muscolare o optogenetica. Questi metodi hanno ciascuno i loro svantaggi e devono essere attentamente valutati per ogni esperimento.
L'iniezione di 4 ng di morfolino cardiaco silenzioso (sih) allo stadio di una cellula può fermare il battito cardiaco prendendo di mira il gene tnnt2a cruciale per la formazione del sarcomero35. Sih zebrafish non hanno un battito cardiaco e sopravvivono solo fino a 7 dpf, quando gli embrioni iniziano a fare affidamento sul sangue circolante per l'ossigenazione. Poiché la morfogenesi cardiaca è guidata da forze sia genetiche che biomeccaniche36, questi pesci presentano malformazioni cardiache intorno a 3 dpf.
Poiché il flusso di Ca2+ è sensibile alla temperatura, la temperatura influenza la frequenza cardiaca nel pesce zebra embrionale21. Di conseguenza, l'abbassamento della temperatura nella camera di imaging rallenta il battito cardiaco. Fermare il battito cardiaco richiede temperature inferiori a 15 °C. Poiché i pesci zebra sono solitamente mantenuti a 28,5 ° C, tali basse temperature possono essere mantenute solo per brevi periodi (meno di 10 minuti).
Farmaci come gli inibitori chimici delle contrazioni muscolari, 2,3-Bu-tanedione 2-monoxime (BDM), possono essere aggiunti al mezzo zebrafish (50 nM37,38) per sospendere temporaneamente il battito cardiaco. BDM è comodo da usare in quanto ferma la contrazione cardiaca in meno di 15 minuti e può essere lavato via per ripristinare la funzione cardiaca. Tuttavia, poiché il BDM altera il potenziale d'azione cardiaco, deve essere usato con cautela37.
Infine, il cuore del pesce zebra transgenico che esprime canali ionici leggeri o pompe come channelrhodopsin o halorhodopsin nel loro miocardio può essere manipolato e fermato illuminando il pacemaker nel tratto di afflusso con luce39,7,40,41,9.
Prospettiva
Gli strumenti e le soluzioni ottimizzati presentati per studiare il cuore del pesce zebra in vivo consentono un'imaging delicato a lungo termine delle dinamiche cardiache ultraveloci. L'incorporamento del campione può essere adattato per adattarsi a diverse modalità di imaging, come la microscopia confocale, la microscopia a due fotoni o la tomografia a proiezione ottica (OPT). La microscopia a foglio luminoso, tuttavia, è probabilmente la tecnica preferita che offre il sezionamento ottico a una velocità sufficiente per catturare la dinamica del cuore. Mentre questo protocollo si concentra sull'imaging cardiaco embrionale del pesce zebra, riteniamo che potrebbe essere applicato anche a vari altri campioni ed esperimenti. Sarà interessante vedere in futuro se tecniche di incorporamento e imaging simili possono essere utilizzate anche in fasi successive durante lo sviluppo, quando il cuore è più nascosto e la larva meno traslucida.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo Madelyn Neufeld per l'illustrazione in Figura 2h. Questo lavoro è stato supportato dalla Max Planck Society, dal Morgridge Institute for Research, dalla Chan Zuckerberg Initiative e dallo Human Frontier Science Program (HFSP).
Materiali
| Name | Company | Catalog Number | Comments |
| 1.5mL Eppendorf | Eppendorf | 22364111 | To carry embedded samples |
| 15mL Falcon tubes | Falcon | 352095 | To carry embedded samples |
| 50mL centrifuge tubes | Falcon | 352070 | 50ml tubes for sonication step, and storing cleaned, straightened FEP tubes |
| 50mL syringe | BD | 309654 | 50ml syringe for FEP cleaning |
| Agarose, low gelling temperature | Sigma Aldrich | 39346-81-1 | To make plug |
| Blunt Tip Needles, 21 gauge | VWR | 89500-304 | Blunt end needle for 0.8 inner diameter FEP tube |
| Borosilicate glass tube | McMaster-Carr | 8729K33 | Tubing for FEP tube straightening 9.5mm outer diameter, 5.6 inner diameter, 30cm long, other sizes available |
| Borosilicate glass tube | McMaster-Carr | 8729K31 | Tubing for FEP tube straightening 6.35mm outer diameter, 4mm inner diameter, 30cm long, other sizes available |
| Conventional needles, 21 Gauge | BD | 305165 | Conventional needle for 0.8 inner diameter FEP tube |
| Disposable glass pipette | Grainger | 52NK56 | To transfer fish, use with pipette pump |
| E3 medium for zebrafish embryos | |||
| Ethanol | Sigma Aldrich | 64-17-5 | Ethanol for FEP cleaning |
| FEP tube, 0.8 / 1.2 mm | ProLiquid | 2001048 | FEP tube with thin wall, other sizes available |
| FEP tube, 0.8 / 1.6 mm | Bola | S1815-04 | FEP tube with thick wall, other sizes available |
| FEP tube, 2/3mm | BGB | 211581 | Large FEP tube with thick wall, other sizes available |
| Hot Hand Rubber Mitt | Cole-Parmer | 691000 | To carry hot equipment after autoclaving |
| Omnifix 1mL Syringes | B Braun | 9161406V | 1ml syringe for embedding |
| Petri dish, small | Dot Scientific | PD-94050 | To make agarose plug |
| Pipette pumps | Argos Technologies | 04395-05 | To transfer fish, use with disposable glass pipette |
| PTU | Sigma Aldrich | 103-85-5 | Also known as: N-Phenylthiourea, 1-Phenyl-2-thiourea, Phenylthiocarbamide |
| Razor blades | Azpack | 11904325 | To cut FEP tubes |
| Sodium Hydroxide | Dot Scientific | DSS24000 | NaOH for FEP cleaning |
| Tricaine | Sigma Aldrich | E10521 | Also known as: MS-222, Ethyl 3-aminobenzoate methanesulfonate, Tricaine |
Riferimenti
- Hoebe, R. A., et al. Controlled light-exposure microscopy reduces photobleaching and phototoxicity in fluorescence live-cell imaging. Nature Biotechnology. 25 (2), 249-253 (2007).
- Jenielita, M., Taormina, M. J., Delaurier, A., Kimmel, C. B., Parthasarathy, R. Comparing phototoxicity during the development of a zebrafish craniofacial bone using confocal and light sheet fluorescence microscopy techniques. Journal of Biophotonics. 6 (11-12), 920-928 (2013).
- Icha, J., Weber, M., Waters, J. C., Norden, C. Phototoxicity in live fluorescence microscopy, and how to avoid it. BioEssays. 39 (8), 1700003 (2017).
- Reynaud, E. G., Kržič, U., Greger, K., Stelzer, E. H. K. Light sheet-based fluorescence microscopy: more dimensions, more photons, and less photodamage. Human Frontier Science Program Journal. 2 (5), 266-275 (2008).
- Weber, M., Huisken, J. Light sheet microscopy for real-time developmental biology. Current Opinion in Genetics & Development. 21 (5), 566-572 (2011).
- Mickoleit, M., et al. High-resolution reconstruction of the beating zebrafish heart. Nat Methods. 11 (9), 919-922 (2014).
- Arrenberg, A. B., Stainier, D. Y., Baier, H., Huisken, J. Optogenetic control of cardiac function. Science. 330 (6006), 971-974 (2010).
- Trivedi, V., et al. Dynamic structure and protein expression of the live embryonic heart captured by 2-photon light sheet microscopy and retrospective registration. Biomed Optics Express. 6 (6), 2056-2066 (2015).
- Weber, M., Yelon, D., et al. Cell-accurate optical mapping across the entire developing heart. eLife. 6, 28307 (2017).
- Weber, M., Huisken, J. In vivo imaging of cardiac development and function in zebrafish using light sheet microscopy. Swiss Medical Weekly. 145, 14227 (2015).
- Fei, P., et al. Cardiac light-sheet fluorescent microscopy for multi-scale and rapid imaging of architecture and function. Science Reports. 6 (1), 1-12 (2016).
- Felker, A., et al. Continuous addition of progenitors forms the cardiac ventricle in zebrafish. Nature Communication. 9 (1), 1-14 (2018).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. K. Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305 (5686), 1007-1009 (2004).
- Keller, P. J., Pampaloni, F., Stelzer, E. H. Life sciences require the third dimension. Current Opinion in Cell Biology. 18 (1), 117-124 (2006).
- Keller, P. J., Schmidt, A. D., Wittbrodt, J., Stelzer, E. H. K. Reconstruction of zebrafish early embryonic development by scanned light sheet microscopy. Science. 322 (5904), 1065-1069 (2008).
- Weber, M., Mickoleit, M., Huisken, J. Multilayer mounting for long-term light sheet microscopy of zebrafish. Journal of Visualized Experiments. (84), e51119 (2014).
- Berndt, F., Shah, G., Power, R. M., Brugués, J., Huisken, J. Dynamic and non-contact 3D sample rotation for microscopy. Nature Communications. 9 (1), 1-7 (2018).
- Daetwyler, S., Günther, U., Modes, C. D., Harrington, K., Huisken, J. Multi-sample SPIM image acquisition, processing. and analysis of vascular growth in zebrafish. Development. , 173757 (2019).
- Keomanee-Dizon, K., Fraser, S. E., Truong, T. V. A versatile, multi-laser twin-microscope system for light-sheet imaging. Review of Scientific Instruments. 91 (5), 053703 (2020).
- Kaufmann, A., Mickoleit, M., Weber, M., Huisken, J. Multilayer mounting enables long-term imaging of zebrafish development in a light sheet microscope. Development. 139 (17), 3242-3247 (2012).
- Gierten, J., et al. Automated high-throughput heartbeat quantification in medaka and zebrafish embryos under physiological conditions. Science Reports. 10 (1), 1-12 (2020).
- Swinburne, I. A., Mosaliganti, K. R., Green, A. A., Megason, S. G. Improved long-term imaging of embryos with genetically encoded α-bungarotoxin. PLOS ONE. 10 (8), 0134005-0134015 (2015).
- Taylor, J. M., et al. Adaptive prospective optical gating enables day-long 3D time-lapse imaging of the beating embryonic zebrafish heart. Nature Communication. 10 (1), 1-15 (2019).
- Power, R. M., Huisken, J. A guide to light-sheet fluorescence microscopy for multiscale imaging. Nature Methods. 14 (4), 360-373 (2017).
- Nüsslein-Volhard, C., Dahm, R. . Zebrafish: A Practical Approach. , (2002).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: An introduction. Journal of Visualized Experiments. (69), e4196 (2012).
- Cold Spring Harbor. E3 medium (for zebrafish embryos). Cold Spring Harbor Protocols. 2011, 66449 (2011).
- Yuan, S., Sun, Z. Microinjection of mRNA and morpholino antisense oligonucleotides in zebrafish embryos. Journal of Visualized Experiments. (27), e1113 (2009).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529 (2017).
- Jin, S. -. W., Beis, D., Mitchell, T., Chen, J. -. N., Stainier, D. Y. Cellular and molecular analyses of vascular tube and lumen formation in zebrafish. Development. 132 (23), 5199-5209 (2005).
- Chi, N. C., et al. Foxn4 directly regulates tbx2b expression and atrioventricular canal formation. Genes and Development. 22 (6), 734-739 (2008).
- Scott, G. R., Johnston, I. A. Temperature during embryonic development has persistent effects on thermal acclimation capacity in zebrafish. Proceedings of the National Academy of Sciences. 109 (35), 14247-14252 (2012).
- Sehnert, A. J., et al. Cardiac troponin T is essential in sarcomere assembly and cardiac contractility. Nature Genetics. 31 (1), 106-110 (2002).
- Sidhwani, P., Yelon, D., Wellik, D. M. Fluid forces shape the embryonic heart: Insights from zebrafish. Current Topics in Developmental Biology. 132, 395-416 (2019).
- Jou, C. J., Spitzer, K. W., Tristani-Firouzi, M. Blebbistatin effectively uncouples the excitation-contraction process in zebrafish embryonic heart. Cell Physiology and Biochemistry. 25 (4-5), 419-424 (2010).
- Chow, R. W. -. Y., Lamperti, P., Steed, E., Boselli, F., Vermot, J. following endocardial tissue movements via cell photoconversion in the zebrafish embryo. Journal of Visualized Experiments. (132), e57290 (2018).
- Nagel, G., et al. Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. Proccedings of the National Academy of Sciences. 100 (24), 13940-13945 (2003).
- Knollmann, B. C. Pacing lightly: optogenetics gets to the heart. Nature Methods. 7 (11), 889-891 (2010).
- Bruegmann, T., et al. Optogenetic control of heart muscle in vitro and in vivo. Nature Methods. 7 (11), 897-900 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon