Method Article
Zebra Balığı Embriyolarında Hızlı Kardiyak Dinamiklerin Işık Tabakası Mikroskopisi
Bu Makalede
Özet
Zebra balığı kalbinin in vivo ışık tabakası floresan mikroskopisi ile incelenmesi için optimize edilmiş araçlar açıklıyoruz. Özellikle, parlak kardiyak transgenik çizgiler öneriyoruz ve gelişimsel ve kalp kusurlarını önleyen yeni nazik gömme ve hareketsizleştirme teknikleri sunuyoruz. Kardiyak görüntülemeye uyarlanmış olası bir veri toplama ve analiz boru hattı da sağlanmaktadır.
Özet
Embriyonik kardiyak araştırmalar, hızlı in vivo ışık tabakası floresan mikroskopislerindeki (LSFM) gelişmelerden büyük ölçüde yararlanmıştır. Zebra balığı Danio rerio'nun hızlı dış gelişimi, çekişli genetiği ve yarı saydamlığı ile birlikte LSFM, önemli bir fototoksiklik veya fotobleaching olmadan yüksek mekansal ve zamansal çözünürlükte kardiyak form ve işlev hakkında içgörüler sunmuştur. Atan kalplerin görüntülenmesi, mevcut numune hazırlama ve mikroskopi tekniklerine meydan okuyor. Kalp atışını çözmek için daralmış bir görüş alanında sağlıklı bir örnek elde etmek ve ultra hızlı görüntüler elde etmek gerekir. Burada zebra balığı kalbini vivo incelemek için optimize edilmiş araçları ve çözümleri açıklıyoruz. Kardiyak bileşenleri etiketlemek için parlak transgenik çizgilerin uygulamalarını gösteriyoruz ve gelişimsel kusurları ve kalp atış hızındaki değişiklikleri önleyen yeni nazik gömme ve hareketsizleştirme teknikleri sunuyoruz. Ayrıca kardiyak görüntülemeye uyarlanmış bir veri toplama ve analiz boru hattı öneriyoruz. Burada sunulan tüm iş akışı zebra balığı embriyonik kalp görüntülemesine odaklanır, ancak diğer çeşitli örneklere ve deneylere de uygulanabilir.
Giriş
Erken atan kalpteki karmaşık olayları ve etkileşimleri ortaya çıkarmak için tüm organın in vivo görüntülemesi gerekir. Minimal fototoksisitesi1,2,3, düşük fotobleaching4 ve yüksek hızı ile ışık tabakası mikroskopisi embriyonik ve kardiyak gelişim için birincil görüntüleme aracı olarak gelişti5,6. Yüksek uzamsal ve zamansal çözünürlükte kardiyak form ve işlev hakkında içgörüler sunmuştur7,8,9 ve araştırmacıların kalbin floresan etiketli kısımlarını yüksek hızda görüntülemelerine ve izlemelerine, hemodinamik kuvvetleri incelemelerine ve kalp gelişimini doğrudan gelişmekte olan embriyoların vücudunun içinde takip etmelerine izin verdi6,10,11,12.
Zebra balıklarını görüş alanında hassas ve tekrar tekrar kısıtlamak için, kısa ve uzun vadede ışık tabakası için çeşitli gömme protokollerinin yanı sıra tek veya çoklu örnek13,14,15,16,17,18,19 vardır. En yaygın protokol, trikain hareketsizleştirme ve bir cam veya plastik tüpün içine agarose montajını içerir. Bununla birlikte, kullanılan sıcaklık, anestezikler ve gömme malzemesi nedeniyle kalp atış hızı değişebildiği için zebra balığı kardiyak görüntüleme, numune sağlığını sağlamak için özel, nazik protokoller gerektirir6,8,11,12,20,21,22,23 . Kısa süreli görüntüleme için (bir saate kadar), bir 130 mg / L trikainde balığı uyuşturabilir ve Weber ve ark. 201416'da açıklandığı gibi% 0.1 agarose çözeltisi ve bir fiş ile Florlu Etilen Propilen (FEP) tüplerine gömebilir. Bununla birlikte, trikain gelişimsel kusurlara yol açabileceği için20,22, uzun süreli görüntüleme için farklı protokoller kullanılmalıdır.
Burada uzun süreli kardiyak görüntüleme için yeni bir strateji açıklıyoruz. Birçok ışık sayfası uygulaması mevcut24 olsa da, bir T-SPIM mikroskopunda asılı bir örnek kullanmanızı öneririz (numune ortak odakta dikey olarak asılıyken yatay bir düzlemde bir algılama ve iki aydınlatma lensi). Bu, hassas numune konumlandırması için gerekli hareket ve dönüş özgürlüğünü sağlar. Balıklar, bir veya iki hücreli aşamada 30 pg α-bungarotoxin mRNA enjekte ederek hareketsiz hale getirilir. α-bungarotoksin, kardiyovasküler gelişimi veya fizyolojiyi etkilemeden kasları felç eden bir yılan zehiridir22. Hassas, bozulmadan görüntüleme için, balıkların suyla neredeyse aynı kırma indeksine sahip bir polimer olan FEP'den yapılmış tüplere monte etmenizi öneririz. FEP tüplerini görüntülemeden önce düzleştirip temizleyerek en iyi şekilde nasıl hazırlayacağımızı tartışıyoruz. Balıklar daha sonra bu tüplere monte edilir, baş aşağı, medyada ve tüpün tabanı, balık kafalarının dayandığı% 2 agarose fişi ile kapatılır. FEP tüpündeki deliklerin kesilmesi gaz değişimini kolaylaştırır ve balık büyümesini sağlar. Gömülü balık, görüntülemeden hemen önce bir numune tutucuya monte edilene kadar medyada tutulabilir. Ayrıca, tekrarlanabilir yüksek hızlı görüntüleme için bir veri toplama ve analiz boru hattı öneriyoruz. Ayrıca, sağlam kalp hücresi etiketlemesi için sitoplazmik ve membran işaretleyici transgenik çizgilerin kullanımını ve kalbi durdurmak için farklı seçenekleri tartışıyoruz. Bu montaj teknikleri, kalbi görüş alanında hassas ve tekrarlanabilir bir şekilde kısıtlamaya izin verirken örnek sağlığı sağlar.
Protokol
Tüm zebra balıkları (Danio rerio) yetişkinleri ve embriyoları UW-Madison Kurumsal Hayvan Bakım ve Kullanım Komitesi (IACUC) tarafından onaylanan protokollere uygun olarak ele alındı.
1. Zebra balıklarının hazırlanması
- Zebra balıklarını belirlenen protokollere25,26 ve kurumsal yönergelere göre ele alın. İstenilen transgenik çizgide yetişkin balık yetiştirin (bkz. Tartışma). Embriyoları toplayın ve 28 °C'de balık ortamıyla dolu bir Petri kabında tutun, örneğin E327.
- Hareketsizleştirme yöntemi seçin (bkz. Tartışma).
- Balıkları hareketsiz hale getirmek için α-bungarotoxin mRNA kullanıyorsanız, bir mikromanipülatöre monte edilmiş ve bir picoinjector28'e bağlanmış delikli bir cam iğne kullanarak bir veya iki hücreli evre embriyoların sarısına 30 pg mRNA22 enjekte edin.
- Trikain kullanıyorsanız, 1 M Tris tabanı ile pH 7.0-7.4'e tamponlanmış % 0.4 stok çözeltisi yapın ve görüntülemeye kadar -20 °C'de saklayın.
- Yumurtaları 28 °C'de E3 dolu bir Petri kabında tutun ve yumurtaları görüntülemeye kadar taze E3 ile yeni bir tabağa her 24 saatte bir aktarın.
- Pigment oluşumunu önlemek için, zebra balığı arka planı albino değilse, gübreleme sonrası (hpf) 24 saatteki balıkları 0,2 mM tirozinaz inhibitörü 1- fenil 2-tiyotirea ile yeni bir E3 yemeğine aktarın (bkz. Tartışma).
2. FEP tüplerinin hazırlanması
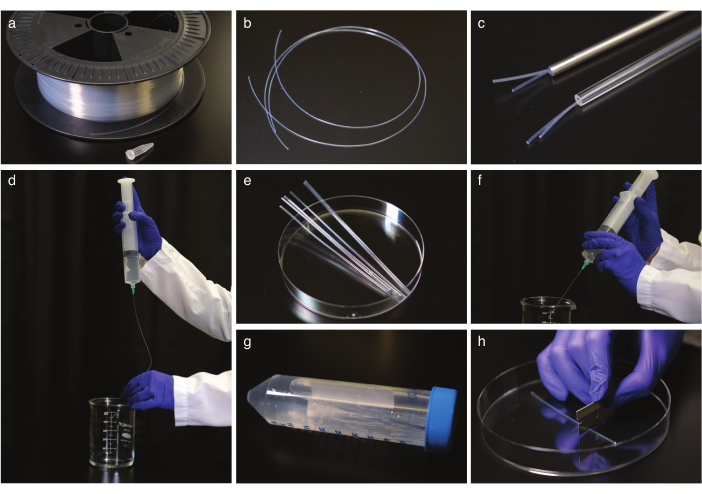
Şekil 1: FEP tüpü temizleme ve düzleştirme. (a) Kablo tamburu üzerindeki FEP tüpleri. (b) Düzleştirmeden önce FEP tüpleri. (c) Cam ve çelik otoklav güvenli borularda FEP tüpleri. (d) Fep tüplerinin düzleştirdikten ve soğutulduktan sonra yıkanır. (e) FEP tüpü sonication için bir santrifüj tüpü boyutunda kesilmiş. (f) Sonikasyondan sonra FEP tüplerinin yıkanması. (g) Temizlenmiş ve düzeltilmiş FEP tüplerinin bir santrifüj tüpünde depolanması. (h) Görüntülemeden önce FEP tüpünü kesmek. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- FEP tüplerini (Şekil 1a,b) genellikle 1,6 veya 2,4 mm'lik FEP tüplerine uyacak şekilde doğru iç çapa sahip bir cam veya çelik otoklav güvenli boruya (Şekil 1c) yerleştirerek düzleştirin ve 2 saat boyunca 180 °C'ye otoklavlayın. Tüpleri oda sıcaklığında en az 5 saat soğumaya bırakın. Ardından, düzleştirme tüplerinden çıkarın.
NOT: Tüpleri manipüle ederken eldiven kullanın ve bir seferde 50 cm boru ile çalışın. - FEP tüplerini temizleyin.
NOT: İç FEP tüpü büyüklüğünde künt iğne ucuna sahip şırıngalar güvenlik için tavsiye edilir, ancak normal bir iğne işe yacaktır.- Tüpleri 1 M NaOH ile iki kez 50 mL şırıng ile yıkayın (Şekil 1d).
- FEP tüplerini jiletle 50 mL santrifüj tüpü boyutuna kadar kesin (Şekil 1e), kesme tüplerini 0,5 M NaOH dolu santrifüj tüplerine yerleştirin ve 10 dakika ultrasonicate edin.
- FEP tüplerini çift damıtılmış H2O ile yıkayın, ardından% 70 etanol ile yıkamayı tekrarlayın (Şekil 1f).
- Tüpleri 10 dakika boyunca% 70 etanol ve ultrasonicate aktarın.
- Tüpleri çift damıtılmış H2O ile yıkayın ve çift damıtılmış H2O'da santrifüj tüplerinde saklayın (Şekil 1g).
3. % 2 agarose yemeğin hazırlanması
- Bir cam şişede, E3'te düşük erime noktası agarose tozlarını çözün. Çözeltiyi bir mikrodalga fırında ısıtın ve tüm toz çözünene kadar her 20 s'de bir karıştırın.
- 1-2 mm'lik bir ceket yapmak için bir cam veya plastik Petri kabına agarose dökün. Agarose katılanına kadar bekle.
- Saklamak için, kurumayı önlemek için agarın üzerine E3'ü hafifçe dökün. Parafin filmine sarın ve 4 °C'de tutun.
4. Gömme medyasının hazırlanması
- Numune odasını dolduracak kadar E3 hazırlayın.
NOT: Medya objektif lenslerle temas halindeyse metil mavisi kullanmaktan kaçının. - Trikain kullanıyorsanız, stok çözeltisini çözün ve E3'e% 0.02 trikain ekleyin.
5. Numune montajı
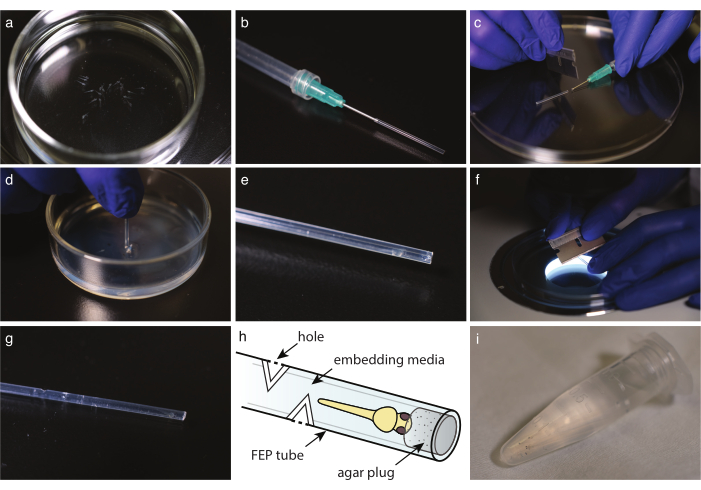
Şekil 2: FEP tüpünde embriyo montajı. (a) Montaj ortamlarında anestezi edilmiş pigmentsiz balık. (b) Künt uç iğnesi ve FEP tüpü takılı bir şırınga. (c) FEP tüpüne medya ve balık alındıktan sonra, iğnenin kenarındaki tüpü kesin. (d) Kesme tüpünü ucunu takmak için% 2 agarose ile kaplanmış bir tabağa daldırma. (e) Tıkalı fep tüpünde bir zebra balığı. (f) Gaz değişim delikleri oluşturmak için FEP tüpünü 30° olarak hafifçe kesin. (g) Gömülü zebra balığının üzerinde dört delikli FEP tüpü. (h) FEP tüpüne gömülü zebra balığı şeması. Delikler ve agar fişi belirtilir. (i) Görüntülemeye hazır birden fazla gömülü zebra balığı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Tek kullanımlık cam pipet ile balıkları gömme ortamına aktarın (Şekil 2a). Trikain kullanıyorsanız, balıkları görüntülemeden 10 dakika önce trikain içeren E3 ile dolu Petri kabına aktarın. Her iki durumda da, balığın hareket etmeyi bıraktığını ve kontrolle karşılaştırıldığında kalbin benzer hızda attığını doğrulamak için stereomikroskop altında görüntüleyin.
- FEP tüpünü jiletle ideal uzunlukta kesin (Şekil 1h).
NOT: Uzunluk mikroskopun numune tutucusuna ayarlanmalıdır; tipik uzunluk yaklaşık 3 cm'dir. - Künt uçlu bir kanonla şırınna hazırlayın. Şırıngayı hava ile doldurun, ardından FEP tüpünü iğneye monte edin ve şırıngayı boşaltarak kalan suyu hafifçe boşaltın (Şekil 2b).
NOT: Havayı yavaşça boşaltarak kabarcık yapmaktan kaçının. - Şırıngan monte FEP tüpü ile, önce FEP tüpünü doldurmak için medyayı alın, sonra bir embriyo başını aşağı alıp alın. Balık kafasını tüp ucuna mümkün olduğunca yakın tutun. Herhangi bir kabarcık yapmaktan kaçının; bir kabarcık varsa, örneği atın.
- Bir jiletle, FEP tüpünü künt uç kanül veya iğnenin kenarında dikkatlice kesin (Şekil 2c).
- Agar kaplı kabın üstüne herhangi bir sıvı atın. FEP tüpünü doğrudan ağar içine daldırın (Şekil 2d). Tüpü döndürün ve fişi agarose yatağından çıkarmak için dışarı alın.
- Stereoskop altında, tüpün ucundaki agar fişinin varlığını doğrulayın (Şekil 2e).
- Uzun süreli görüntüleme için, fep tüpüne her kardinal yönde, balığın ucundan en az 5 mm yukarıda 3-5 delik kesin.
- Stereoskop altında, montaj ortamına ulaşana kadar FEP tüpüne 30° kesi yapmak için tüpün eksenine dik bir jilet kullanın (Şekil 2f).
- Bir delik oluşturmak için 180 ° 'de ikinci bir kesim yapın (Şekil 2g, h).
- Monte edilmiş embriyo kafasını, görüntüye hazır olana kadar gömme ortamı ile 1,5 mL mikrosantrifüj tüpüne aktarın (Şekil 2i).
6. Örnek konumlandırma

Şekil 3: Numune haznesi. (a) Bir numune tutucuya monte edilmiş FEP tüpü. (b) Aşamaları ve hedefleri olan örnek oda. (c) T-SPIM konfigürasyonunda aydınlatma ve algılama hedefi olan ortam dolu numune odasının üst görünümü. (d) Numune tutucu, numune haznede olacak şekilde mikroskop üzerine monte edilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
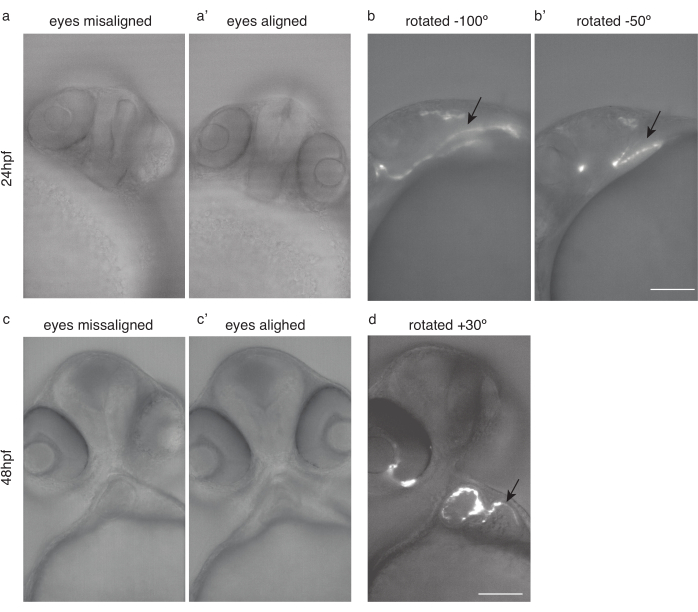
Şekil 4: Kalp görüntüleme için embriyo konumlandırma. (a) Gözleri yanlış hizalanmış 24 hpf Tg(kdrl:Hsa.HRAS-mCherry) zebra balığı. (a') Aynı balık, gözleri hizalı. (b) Aynı balık optimal kalp görüntüleme için -100 ° ve (b') -50 ° döndürüldü. (c) Gözleri yanlış hizalanmış 48 hpf zebra balığı. (c') Aynı balık, gözleri hizalı. (d) Aynı balık, optimum kalp görüntüleme için 30° döndürülür. Siyah oklar kalbi işaret eder. Ölçek çubuğu 100 μm. Bu rakamın daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
- Mikroskopta, FEP tüpünü numune tutucusuna monte edin (Şekil 3a) ve görüntüleme odasını gömme ortamı ile doldurun (Şekil 3b,c). Ardından, numune tutucuyu numunenin odaya daldırılmış olarak sahneye yerleştirin (Şekil 3d).
- Numunenin durumunu kontrol et. Genel balık sağlığını değerlendirmek için kalp atış hızını görsel olarak değerlendirin, çünkü belirli kalp atış hızı, monte edilmemiş kontrol balıklarına kıyasla aşamaya ve sıcaklığa bağlıdır. Kalp atışı çok yavaşsa, balığı atın.
NOT: Embriyoların nazik bir şekilde ele alınmasını, gömme ortamına dikkatli bir şekilde aktarılmasını, gömülmeden hemen sonra görüntülemeyi, hızlı sıcaklık değişimlerini önlemeyi, trikaini önlemeyi ve trikaine maruz kalma süresini azaltmayı sağlayın. - Tekrarlanabilir görüntüleme için her zaman aynı örnek konumunu kullanın. Gözlerin hizalaması ve görüntülemenin bir açıyla yapılması önerilir.
- Balığı, her iki gözün de odak düzleminde olacak şekilde döndürün (Şekil 4a',c')
- Bu konumdan, balığı 24 hpf görüntüleme için saat yönünde yaklaşık 50 °-100 ° ve 48 hpf görüntüleme için saat yönünün tersine yaklaşık 20 ° - 30 ° döndürün (Şekil 4d).
NOT: Erken kalp, 30 hpf'den önce, gizli konumu nedeniyle görüntülenebilir (Şekil 4b).
7. Görüntü alımı
- En iyi görüntü kalitesini veren aydınlatma tarafını seçin ve lazer gücünü her balığa uyarlayın.
NOT: Sonraki görüntü analizi için kullanılan lazer gücünü kaydedin. - Her z düzlemde, saniyede 300 kare (fps) veya daha fazla 4-5 kalp atışı kaydedin.
NOT: Görüş alanı, alım hızını artırmak için kırpılabilir. Örneğin, 48 hpf'de zebra balığı kalbi saniyede iki ila üç kez atar, bu nedenle 300 fps'de dört ila altı kalp atışı elde etmek için 300 ila 600 kare gerekir. - Atan kalbi kaydetmek için, örneği ışık tabakasında adım adım hareket ettinin. Kalbin tüm derinliğini kaplayan 1-2 μm'lik bir z aralığı kullanın.
8. Görüntü işleme
- Daha önce açıklandığı gibi bir Fiji (Image J229,30) eklentisi kullanarak 4D (x,y,z, zaman) kalbi yeniden oluşturmak için kaydedilen filmi senkronize edin6.
- Verileri keşfetmek ve işlenmiş zebra balığı kalbinin filmlerini oluşturmak için 4B dosyayı (x,y,z, zaman) bir 3B işleme yazılımına yükleyin.
Sonuçlar
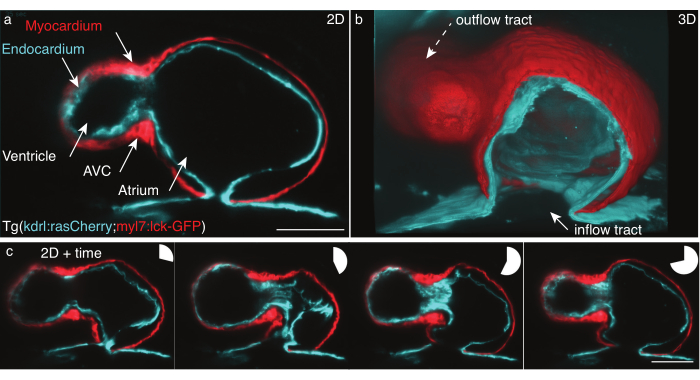
Şekil 5: 48 hpf zebra balığı kalbi. (a) LSFM ile görüntülenen 48 hpf Tg(kdrl:Hsa.HRAS-mCherry; myl7:lck-EGFP) zebra balığının hala bir z-çerçeve, ön-ventral görünümü, (b) film yığınlarının 3D rekonstrüksiyonu, atriyumdan görünümü kesin. (c) Bir z düzlem üzerinde tam bir kalp atışı üzerinde dört çerçeve montajı. Pasta grafikleri kalp atışı sırasındaki zamanı gösterir. Ölçek çubuğu 50 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Yukarıda ayrıntılı olarak açıklanan protokole göre Tg(kdrl:Hsa.HRAS-mCherry; myl7:lck-EGFP) zebra balığının 48 hpf atan kalbini kaydettik (Şekil 5). Bir 488 nm ve bir 561 nm lazer ışık levhası aynı anda numuneyi aydınlattı. Yayılan floresan, 16x/0.8 W objektif lens ve bilimsel metal oksit yarı iletken (sCMOS) kamera kullanılarak dik olarak tespit edildi.
48 hpf'de, kalp yeni döngüye girdi ve ventrikül ve atriyum olmak üzere iki odağa sahip, ancak henüz kapakçık geliştirmedi. Filmlerimizde giriş yolu, ventrikül, atriyoventriküler kanal (AVC), atriyum ve çıkış izi gibi farklı kalp yapıları kolayca ayırt edilebilir (Şekil 5a,b). Bu veriler kalbin iki hücre katmanı arasındaki kesin atmayı ve karmaşıklaşmaları gösterir: miyokard, tek hücreli kas tabakası kasışan ve üreten güç (Şekil 5c, kırmızı) ve kalbi vaskülasyona bağlayan tek bir hücre tabakası olan endokardyum (Şekil 5c, siyan).
x,y,z (3D) + zaman (4D) + renk (5D) kalp atışı rekonstrüksiyonu Mickoleit ve ark.6'ya göre gerçekleştirildi. Rekonstrüksiyon iki hipoteze dayanır: kalbin hareketi tekrarlayıcıdır ve veriler küçük bir z-adımla elde edilmelidir. Çıkış, kalp atışı başına 30 GB ila 80 GB ölçülerinde, 5D olarak yeniden yapılandırılmış tek bir kalp atışıdır. Verileri işlemek için, çok boyutlu veri kümelerini işlemek için tasarlandığı ve hem hücre katmanlarının hem de tek tek katmanların 5B filmlerini kolayca işlediği için derinlemesine işleme31 için ücretsiz, açık kaynaklı fluoRender aracını kullandık (Şekil 5b).
Tartışmalar
Kalbi görüntüleyen transgenik çizgiler
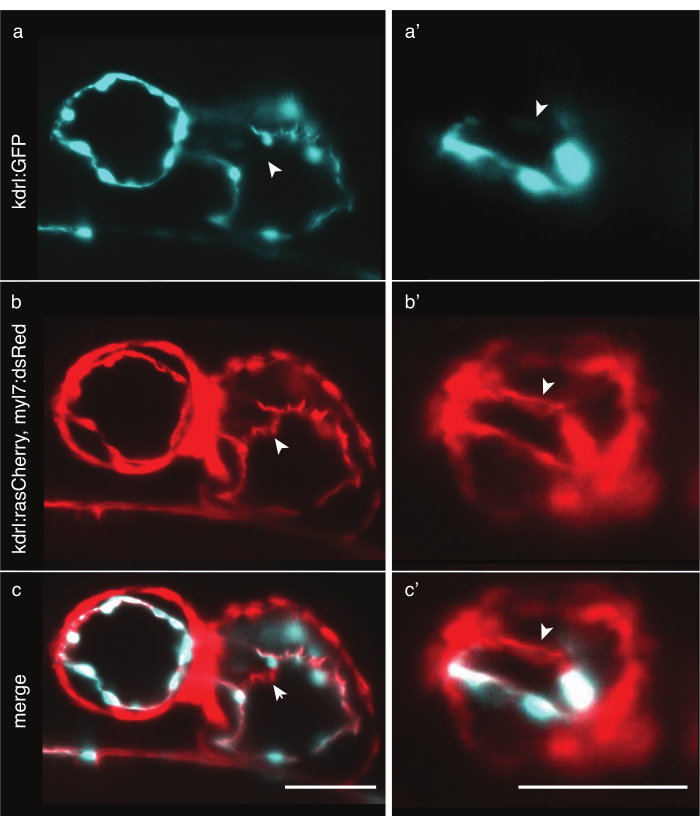
Şekil 6: Sitoplazmik ve membran işaretleyici zebra balığı transgenik çizgilerinin karşılaştırılması. LSFM ile görüntülenen 48 hpf zebra balığı kalbinin ön-ventral görünümü. Beyaz oklar, yalnızca membran işaretleyici transgenik çizgi ile görülebilen yapıları gösterir. (a) Tg(kdrl:EGFP)Kalpte siyanda 32 sinyali ve ventrikülde (a') . (b) Tg(kdrl:Hsa.HRAS-mCherry; myl7:dsRed)33 sinyal kalpte kırmızı ve (b') ventrikülde. ( c,c') hem Tg(kdrl:Hsa.HRAS-mCherry; myl7:dsRed) hem de Tg(kdrl:EGFP) sinyalinin birleştirilmesi. Ölçek çubuğu 50 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Zebra balığı kalbinin görüntülenmesi hassas kalp hücresi etiketlemesi gerektirir. Miyokard kalınlığı hücreler boyunca nispeten sabit olsa da, endokardiyal hücreler çekirdeğin etrafında kalındır, ancak bazı bölgelerde 2 μm'den daha ince ince membran çıkıntılarına sahiptir. Tg(kdrl:EGFP)32 gibi sitoplazmik transgenik çizgiler endokardiyal çekirdek çevresindeki bölgeleri etkili bir şekilde etiketlemektedir, ancak daha uzakta, ince sitoplazma bu kadar kısa maruz kalma süreleri ile tespit edilecek kadar foton yaymayabilir ve bu da verilerde yapay deliklere yol açabilir (Şekil 6a). Buna karşılık, Tg(kdrl:Hsa.HRAS-mCherry)33 gibi membran işaretleyici transgenik çizgiler endokardiumu etkili bir şekilde etiketleyebilir ve daha fazla ayrıntı ortaya çıkabilir (Şekil 6b,c). Her deney için en uygun transgenik çizgiyi dikkatlice seçin.
Zebra balığı hareketsizleştirme
Hareketsizleştirme tekniğinin seçimi, deneyin uzunluğuna ve balığın görüntülenme yaşına bağlıdır. Trikain, çoğunlukla kullanım kolaylığı nedeniyle zebra balığı hareketsizleştirme için yaygın olarak kullanılmıştır. Gerçekten de, balık medyasına sadece 130 mg / L trikain eklemek, 10 dakika içinde anestezi almalarıyla sonuçlanır. Gelişimsel kusurlara yol açabileceğinden ve kalp fizyolojisini etkileyebileceğinden20,22, trikaini sadece kısa deneyler için (30 dakikadan az) kullanmanızı öneririz. Daha uzun görüntüleme için, bir veya iki hücreli aşamada α-bungarotoxin mRNA enjeksiyonları, kardiyovasküler gelişimi veya fizyolojiyi etkilemeden döllenme sonrası (dpf) 3 güne kadar balıkları felç eder22.
Doğru FEP tüplerini seçme
FEP tüpleri çeşitli çap ve kalınlıklarda mevcuttur. Görüntü için 0-5 dpf balık, 0.8 mm iyi bir iç çaptır; kalın duvar 0,8 x 1,6 mm tüpler veya ince duvar 0,8 x 1,2 mm tüpler seçin. İnce duvarlı tüpler öneriyoruz; bununla birlikte, daha kalın duvarlar daha fazla stabilite ve sertlik sunar, bu da numune odasının ince bir tüpü bozabilecek ve hareket ettirebilecek akan ortama sahip olması durumunda önemli olabilir. Daha büyük numuneler için 1,6 x 2,4 mm ve 2 x 3 mm kullanılabilir.
Sıcaklık ve gaz değişimleri
Zebra balığı embriyosunun refahının önemli bir yönü sıcaklıktır. İdeal olarak, çevrenin sıcaklığı gelişimi ve kalp atış hızını etkilediği için görüntüleme sırasında balığı 28,5 °C'de tutun34.
Deneyimlerimize göre, % 2 agarose fişi ile oksijen değişimi sadece 3-4 dpf'ye kadar istikrarlı bir kalp atış hızını korur. Bu nedenle, tüpteki deliklerin kesilmesi oksijen difüzyonunu sağlar. İstenirse numuneye ilaç verilmesi için de gerekli olabilir.
Kalp atışının askıya alınması.
Uygun şekilde donatılmış ışık sac mikroskoplarının hızlı alım hızları, atan kalbin in vivo olarak kaydedilmesini sağlar. Bununla birlikte, bozulmamış bir z-yığını elde etmek için kalbi yavaşlatabilir veya durdurabilir. Bununla birlikte, kalbi durdurmak kalp kasının gevşemesine yol açar ve kalbin çökmesine neden olabilir6. Kalp atışı süspansiyonu morfolinolar, düşük sıcaklıklar, kas kasılmasının bir inhibitörü veya optogenetik kullanılarak yapılabilir. Bu yöntemlerin her birinin dezavantajları vardır ve her deney için dikkatlice değerlendirilmelidir.
Tek hücre aşamasında 4 ng sessiz kalp (sih) morfotin enjeksiyonu sarkom oluşumu için çok önemli olan tnnt2a genini hedef alarak kalp atışını durdurabilir35. sih zebra balığı kalp atışına sahip değildir ve embriyolar oksijenlenme için dolaşımdaki kanlara güvenmeye başladığında sadece 7 dpf'ye kadar hayatta kalır. Kalp morfogenezi hem genetik hem de biyomekanik kuvvetler tarafından yönlendirilirken36, bu balıklar 3 dpf civarında kalp malformasyonları sunar.
Ca2+'nın akışı sıcaklığa duyarlı olduğundan, sıcaklık embriyonik zebra balıklarında kalp atış hızını etkiler21. Sonuç olarak, görüntüleme odasındaki sıcaklığı düşürmek kalp atışını yavaşlatır. Kalp atışını durdurmak için 15 °C'nin altındaki sıcaklıklar gerekir. Zebra balıkları genellikle 28,5 °C'de tutulduğu için, bu tür düşük sıcaklıklar sadece kısa süreler boyunca (10 dakikadan az) tutulabilir.
Kalp atışını geçici olarak askıya almak için zebra balığı ortamına (50 nM37,38) 2,3-Bu-tanedione 2-monoxime (BDM) gibi kas kasılmalarının kimyasal inhibitörleri gibi ilaçlar eklenebilir. BDM, kalp kasılmalarını 15 dakikadan daha az bir sürede durdurduğu ve kalp fonksiyonunu geri kazanmak için yıkanabildiği için kullanımı uygundur. Bununla birlikte, BDM kardiyak etki potansiyelini değiştirdiğinden, dikkatli kullanılmalıdır37.
Son olarak, miyokardlarında ışık kapılı iyon kanallarını veya channelrhodopsin veya halorhodopsin gibi pompaları ifade eden transgenik zebra balıklarının kalbi, giriş kanalındaki kalp pili ışık39,7,40,41,9 ile aydınlatılarak manipüle edilebilir ve durdurulabilir.
Outlook
Zebra balığı kalp in vivo incelemek için sunulan optimize edilmiş araçlar ve çözümler, ultra hızlı kardiyak dinamiklerin uzun vadeli, nazik bir şekilde görüntülenmesini sağlar. Örnek gömme, konfokal mikroskopi, iki fotonlu mikroskopi veya optik projeksiyon tomografisi (OPT) gibi farklı görüntüleme yöntemlerine uyacak şekilde uyarlanabilir. Bununla birlikte, ışık tabakası mikroskopisi, muhtemelen kalbin dinamiklerini yakalamak için yeterli bir hızda optik kesit sunan tercih edilen tekniktir. Bu protokol zebra balığı embriyonik kalp görüntülemeye odaklanırken, diğer çeşitli örneklere ve deneylere de uygulanabileceğini inanıyoruz. Gelecekte, kalbin daha gizli ve larvaların daha az yarı saydam olduğu gelişim sırasında benzer gömme ve görüntüleme tekniklerinin de kullanılıp kullanılamayacağı ilginç olacaktır.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Şekil 2h'deki illüstrasyon için Madelyn Neufeld'e teşekkür ederiz. Bu çalışma Max Planck Society, Morgridge Araştırma Enstitüsü, Chan Zuckerberg Girişimi ve İnsan Sınırı Bilim Programı (HFSP) tarafından desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1.5mL Eppendorf | Eppendorf | 22364111 | To carry embedded samples |
| 15mL Falcon tubes | Falcon | 352095 | To carry embedded samples |
| 50mL centrifuge tubes | Falcon | 352070 | 50ml tubes for sonication step, and storing cleaned, straightened FEP tubes |
| 50mL syringe | BD | 309654 | 50ml syringe for FEP cleaning |
| Agarose, low gelling temperature | Sigma Aldrich | 39346-81-1 | To make plug |
| Blunt Tip Needles, 21 gauge | VWR | 89500-304 | Blunt end needle for 0.8 inner diameter FEP tube |
| Borosilicate glass tube | McMaster-Carr | 8729K33 | Tubing for FEP tube straightening 9.5mm outer diameter, 5.6 inner diameter, 30cm long, other sizes available |
| Borosilicate glass tube | McMaster-Carr | 8729K31 | Tubing for FEP tube straightening 6.35mm outer diameter, 4mm inner diameter, 30cm long, other sizes available |
| Conventional needles, 21 Gauge | BD | 305165 | Conventional needle for 0.8 inner diameter FEP tube |
| Disposable glass pipette | Grainger | 52NK56 | To transfer fish, use with pipette pump |
| E3 medium for zebrafish embryos | |||
| Ethanol | Sigma Aldrich | 64-17-5 | Ethanol for FEP cleaning |
| FEP tube, 0.8 / 1.2 mm | ProLiquid | 2001048 | FEP tube with thin wall, other sizes available |
| FEP tube, 0.8 / 1.6 mm | Bola | S1815-04 | FEP tube with thick wall, other sizes available |
| FEP tube, 2/3mm | BGB | 211581 | Large FEP tube with thick wall, other sizes available |
| Hot Hand Rubber Mitt | Cole-Parmer | 691000 | To carry hot equipment after autoclaving |
| Omnifix 1mL Syringes | B Braun | 9161406V | 1ml syringe for embedding |
| Petri dish, small | Dot Scientific | PD-94050 | To make agarose plug |
| Pipette pumps | Argos Technologies | 04395-05 | To transfer fish, use with disposable glass pipette |
| PTU | Sigma Aldrich | 103-85-5 | Also known as: N-Phenylthiourea, 1-Phenyl-2-thiourea, Phenylthiocarbamide |
| Razor blades | Azpack | 11904325 | To cut FEP tubes |
| Sodium Hydroxide | Dot Scientific | DSS24000 | NaOH for FEP cleaning |
| Tricaine | Sigma Aldrich | E10521 | Also known as: MS-222, Ethyl 3-aminobenzoate methanesulfonate, Tricaine |
Referanslar
- Hoebe, R. A., et al. Controlled light-exposure microscopy reduces photobleaching and phototoxicity in fluorescence live-cell imaging. Nature Biotechnology. 25 (2), 249-253 (2007).
- Jenielita, M., Taormina, M. J., Delaurier, A., Kimmel, C. B., Parthasarathy, R. Comparing phototoxicity during the development of a zebrafish craniofacial bone using confocal and light sheet fluorescence microscopy techniques. Journal of Biophotonics. 6 (11-12), 920-928 (2013).
- Icha, J., Weber, M., Waters, J. C., Norden, C. Phototoxicity in live fluorescence microscopy, and how to avoid it. BioEssays. 39 (8), 1700003 (2017).
- Reynaud, E. G., Kržič, U., Greger, K., Stelzer, E. H. K. Light sheet-based fluorescence microscopy: more dimensions, more photons, and less photodamage. Human Frontier Science Program Journal. 2 (5), 266-275 (2008).
- Weber, M., Huisken, J. Light sheet microscopy for real-time developmental biology. Current Opinion in Genetics & Development. 21 (5), 566-572 (2011).
- Mickoleit, M., et al. High-resolution reconstruction of the beating zebrafish heart. Nat Methods. 11 (9), 919-922 (2014).
- Arrenberg, A. B., Stainier, D. Y., Baier, H., Huisken, J. Optogenetic control of cardiac function. Science. 330 (6006), 971-974 (2010).
- Trivedi, V., et al. Dynamic structure and protein expression of the live embryonic heart captured by 2-photon light sheet microscopy and retrospective registration. Biomed Optics Express. 6 (6), 2056-2066 (2015).
- Weber, M., Yelon, D., et al. Cell-accurate optical mapping across the entire developing heart. eLife. 6, 28307 (2017).
- Weber, M., Huisken, J. In vivo imaging of cardiac development and function in zebrafish using light sheet microscopy. Swiss Medical Weekly. 145, 14227 (2015).
- Fei, P., et al. Cardiac light-sheet fluorescent microscopy for multi-scale and rapid imaging of architecture and function. Science Reports. 6 (1), 1-12 (2016).
- Felker, A., et al. Continuous addition of progenitors forms the cardiac ventricle in zebrafish. Nature Communication. 9 (1), 1-14 (2018).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. K. Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305 (5686), 1007-1009 (2004).
- Keller, P. J., Pampaloni, F., Stelzer, E. H. Life sciences require the third dimension. Current Opinion in Cell Biology. 18 (1), 117-124 (2006).
- Keller, P. J., Schmidt, A. D., Wittbrodt, J., Stelzer, E. H. K. Reconstruction of zebrafish early embryonic development by scanned light sheet microscopy. Science. 322 (5904), 1065-1069 (2008).
- Weber, M., Mickoleit, M., Huisken, J. Multilayer mounting for long-term light sheet microscopy of zebrafish. Journal of Visualized Experiments. (84), e51119 (2014).
- Berndt, F., Shah, G., Power, R. M., Brugués, J., Huisken, J. Dynamic and non-contact 3D sample rotation for microscopy. Nature Communications. 9 (1), 1-7 (2018).
- Daetwyler, S., Günther, U., Modes, C. D., Harrington, K., Huisken, J. Multi-sample SPIM image acquisition, processing. and analysis of vascular growth in zebrafish. Development. , 173757 (2019).
- Keomanee-Dizon, K., Fraser, S. E., Truong, T. V. A versatile, multi-laser twin-microscope system for light-sheet imaging. Review of Scientific Instruments. 91 (5), 053703 (2020).
- Kaufmann, A., Mickoleit, M., Weber, M., Huisken, J. Multilayer mounting enables long-term imaging of zebrafish development in a light sheet microscope. Development. 139 (17), 3242-3247 (2012).
- Gierten, J., et al. Automated high-throughput heartbeat quantification in medaka and zebrafish embryos under physiological conditions. Science Reports. 10 (1), 1-12 (2020).
- Swinburne, I. A., Mosaliganti, K. R., Green, A. A., Megason, S. G. Improved long-term imaging of embryos with genetically encoded α-bungarotoxin. PLOS ONE. 10 (8), 0134005-0134015 (2015).
- Taylor, J. M., et al. Adaptive prospective optical gating enables day-long 3D time-lapse imaging of the beating embryonic zebrafish heart. Nature Communication. 10 (1), 1-15 (2019).
- Power, R. M., Huisken, J. A guide to light-sheet fluorescence microscopy for multiscale imaging. Nature Methods. 14 (4), 360-373 (2017).
- Nüsslein-Volhard, C., Dahm, R. . Zebrafish: A Practical Approach. , (2002).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: An introduction. Journal of Visualized Experiments. (69), e4196 (2012).
- Cold Spring Harbor. E3 medium (for zebrafish embryos). Cold Spring Harbor Protocols. 2011, 66449 (2011).
- Yuan, S., Sun, Z. Microinjection of mRNA and morpholino antisense oligonucleotides in zebrafish embryos. Journal of Visualized Experiments. (27), e1113 (2009).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529 (2017).
- Jin, S. -. W., Beis, D., Mitchell, T., Chen, J. -. N., Stainier, D. Y. Cellular and molecular analyses of vascular tube and lumen formation in zebrafish. Development. 132 (23), 5199-5209 (2005).
- Chi, N. C., et al. Foxn4 directly regulates tbx2b expression and atrioventricular canal formation. Genes and Development. 22 (6), 734-739 (2008).
- Scott, G. R., Johnston, I. A. Temperature during embryonic development has persistent effects on thermal acclimation capacity in zebrafish. Proceedings of the National Academy of Sciences. 109 (35), 14247-14252 (2012).
- Sehnert, A. J., et al. Cardiac troponin T is essential in sarcomere assembly and cardiac contractility. Nature Genetics. 31 (1), 106-110 (2002).
- Sidhwani, P., Yelon, D., Wellik, D. M. Fluid forces shape the embryonic heart: Insights from zebrafish. Current Topics in Developmental Biology. 132, 395-416 (2019).
- Jou, C. J., Spitzer, K. W., Tristani-Firouzi, M. Blebbistatin effectively uncouples the excitation-contraction process in zebrafish embryonic heart. Cell Physiology and Biochemistry. 25 (4-5), 419-424 (2010).
- Chow, R. W. -. Y., Lamperti, P., Steed, E., Boselli, F., Vermot, J. following endocardial tissue movements via cell photoconversion in the zebrafish embryo. Journal of Visualized Experiments. (132), e57290 (2018).
- Nagel, G., et al. Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. Proccedings of the National Academy of Sciences. 100 (24), 13940-13945 (2003).
- Knollmann, B. C. Pacing lightly: optogenetics gets to the heart. Nature Methods. 7 (11), 889-891 (2010).
- Bruegmann, T., et al. Optogenetic control of heart muscle in vitro and in vivo. Nature Methods. 7 (11), 897-900 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır