Method Article
Microscopia de Folha de Luz da Dinâmica Cardíaca Rápida em Embriões de Zebrafish
Neste Artigo
Resumo
Descrevemos ferramentas otimizadas para estudar o coração de zebrafish in vivo com microscopia de fluorescência de folha de luz. Especificamente, sugerimos linhas transgênicas cardíacas brilhantes e apresentamos novas técnicas de incorporação e imobilização suaves que evitam defeitos de desenvolvimento e coração. Um possível pipeline de aquisição e análise de dados adaptado à imagem cardíaca também é fornecido.
Resumo
A pesquisa cardíaca embrionária tem se beneficiado muito dos avanços na microscopia de fluorescência de folha de luz in vivo rápida (LSFM). Combinada com o rápido desenvolvimento externo, genética tratável e translucência do zebrafish, Danio rerio, a LSFM forneceu insights sobre a forma cardíaca e função em alta resolução espacial e temporal sem fototoxicidade significativa ou fotobleaching. A imagem de corações batendo desafia as técnicas de preparação e microscopia da amostra existentes. É preciso manter uma amostra saudável em um campo de visão constrito e adquirir imagens ultrarrápidas para resolver os batimentos cardíacos. Aqui descrevemos ferramentas e soluções otimizadas para estudar o coração de zebrafish in vivo. Demonstramos as aplicações de linhas transgênicas brilhantes para rotular os constituintes cardíacos e apresentar novas técnicas de incorporação e imobilização suaves que evitam defeitos de desenvolvimento e alterações na frequência cardíaca. Também propomos um pipeline de aquisição e análise de dados adaptado à imagem cardíaca. Todo o fluxo de trabalho apresentado aqui se concentra na imagem cardíaca embrionária de zebrafish, mas também pode ser aplicado a várias outras amostras e experimentos.
Introdução
Para descobrir os eventos complexos e interações no coração pulsante precoce, é necessária uma imagem in vivo de todo o órgão. Com sua fototoxicidade mínima1,2,3, fotobleaching de baixa e alta velocidade, a microscopia de folha de luz evoluiu como a principal ferramenta de imagem para o desenvolvimento embrionário e cardíaco5,6. Ele forneceu insights sobre a forma cardíaca e a função em uma alta resolução espacial e temporal7,8,9 e permitiu aos pesquisadores imaginar e rastrear partes fluorescentes rotuladas do coração em alta velocidade, estudar forças hemodinâmicas e acompanhar o desenvolvimento cardíaco diretamente dentro do corpo de embriões em desenvolvimento6,10,11,12.
Para restringir precisamente e reprodutivelmente os zebrafish no campo de visão, existem uma variedade de protocolos de incorporação para folha de luz, a curto e longo prazo, bem como 13,14,15,16,17,18,19. O protocolo mais comum envolve a imobilização de tricaína e a montagem de agarose dentro de um tubo de vidro ou plástico. No entanto, como a frequência cardíaca pode mudar devido à temperatura, anestésicos e material de incorporação usado20,21,22, a imagem cardíaca de zebrafish requer protocolos específicos e suaves para garantir a saúde da amostra6,8,11,12,20,21,22,23 . Para imagens de curto prazo (até uma hora), pode-se anestesiar o peixe em 130 mg/L tricaine e incorporá-lo em tubos fluorados de propileno de etileno (FEP) com solução de 0,1% de agarose e um plugue, como descrito em Weber et al. 201416. No entanto, como o tricaine pode levar a defeitos de desenvolvimento20,22, diferentes protocolos devem ser usados para imagens de longo prazo.
Aqui descrevemos uma nova estratégia para imagens cardíacas de longo prazo. Embora existam muitas implementações de folhas de luz24, recomendamos o uso de uma amostra de suspensão em um microscópio T-SPIM (uma detecção e duas lentes de iluminação em um plano horizontal com a amostra pendurada verticalmente no foco comum). Isso dá a necessária liberdade de movimento e rotação para o posicionamento preciso da amostra. Os peixes são imobilizados injetando 30 pg α-bungarotoxin mRNA no estágio de uma ou duas células. α-bungarotoxina é um veneno de cobra que paralisa os músculos sem afetar o desenvolvimento cardiovascular ou a fisiologia22. Para imagens precisas e sem distorções, recomendamos a montagem de peixes em tubos feitos de FEP, um polímero com índice de refração quase idêntico à água. Discutimos como preparar melhor os tubos FEP endireitando-os e limpando-os antes da imagem. Os peixes são então montados nestes tubos, cabeça para baixo, na mídia, e o fundo do tubo é selado com um plugue de 2% de agarose, sobre o qual as cabeças de peixe repousam. O corte de furos no tubo FEP facilita a troca de gás e garante o crescimento dos peixes. O peixe embutido pode ser mantido em mídia até ser montado em um suporte de amostra logo antes da imagem. Sugerimos também um pipeline de aquisição e análise de dados para imagens reprodutíveis de alta velocidade. Além disso, discutimos o uso de linhas transgênicas de marcador citoplasmão versus membrana para rotulagem robusta de células cardíacas, bem como diferentes opções para parar o coração. Essas técnicas de montagem garantem a saúde da amostra, permitindo restringir o coração com precisão e reprodução no campo de visão.
Protocolo
Todos os adultos e embriões de zebrafish (Danio rerio) foram tratados de acordo com protocolos aprovados pelo Comitê Institucional de Cuidados e Uso de Animais da UW-Madison (IACUC).
1. Preparação de zebrafish
- Manuseie o zebrafish de acordo com protocolos estabelecidos25,26 e diretrizes institucionais. Criar peixes adultos da linha transgênica desejada (ver Discussão). Recolhe os embriões e mantenha-os a 28 °C em uma placa de Petri cheia de meio de peixe, por exemplo, E327.
- Escolha um método de imobilização (ver Discussão).
- Se usar α-bungarotoxin mRNA para imobilizar o peixe, injete 30 pg mRNA22 na gema de embriões de um ou dois estágios de células usando uma agulha de vidro de furo montada em um micromanipulador e conectada a um picoinjector28.
- Se usar tricaine, faça 0,4% de solução de estoque tamponada para pH 7.0-7.4 com base 1 M Tris e armazene a -20 °C até a imagem.
- Mantenha os ovos em uma placa de Petri preenchida E3 a 28 °C e transfira os ovos a cada 24 horas para uma nova placa com E3 fresco até a imagem.
- Para evitar a formação de pigmentos, se o fundo do zebrafish não for albino, transfira peixe a 24h pós-fertilização (hpf) para um novo prato E3 com inibidor de tyrosinase de 0,2 mM 1- fenil 2-thiourea (ver Discussão).
2. Preparação de tubos FEP
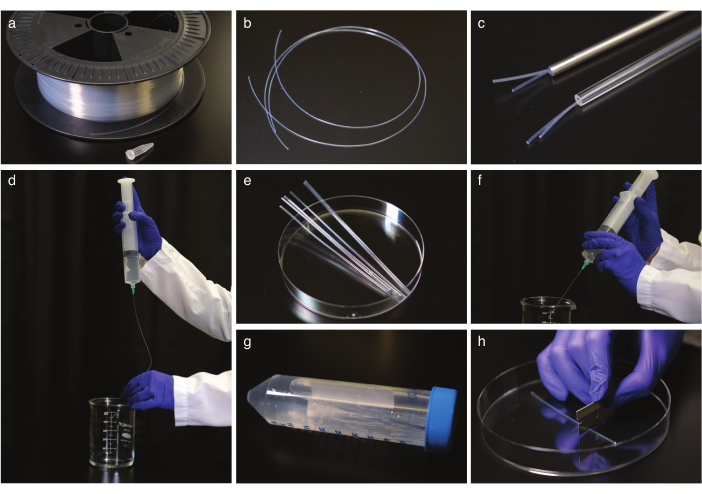
Figura 1: Limpeza e alisamento do tubo FEP. (a) tubos FEP em um tambor de cabo. b Tubos FEP antes de endireitar. c Tubos FEP em tubos de vidro e aço autoclave-seguro. d Descarga dos tubos FEP após endireitar e esfriar. e Corte do tubo FEP ao tamanho de um tubo de centrífuga para sônicação. f Descarga de tubos FEP após a sônicação. g Armazenamento dos tubos FEP limpos e endireitados em um tubo centrífuga. (h) Cortar o tubo FEP antes da imagem. Clique aqui para ver uma versão maior desta figura.
- Endireitar os tubos FEP (Figura 1a,b) colocando-os em um tubo de vidro ou aço autoclave-seguro (Figura 1c) com o diâmetro interno correto para caber tubos FEP, geralmente 1,6 ou 2,4 mm, e autoclave a 180 °C por 2 h. Deixe os tubos esfriarem à temperatura ambiente por pelo menos 5 h. Em seguida, retire dos tubos de alisamento.
NOTA: Use luvas ao manipular os tubos e trabalhe com tubos de 50 cm de cada vez. - Limpe os tubos FEP.
NOTA: As seringas com ponta de agulha sem corte do tamanho interno do tubo FEP são recomendadas para segurança, mas uma agulha regular funcionará.- Lave os tubos com 1 M NaOH duas vezes com uma seringa de 50 mL (Figura 1d).
- Corte os tubos FEP do tamanho de um tubo de centrífugas de 50 mL com uma lâmina de barbear (Figura 1e), coloque tubos cortados em tubos de centrífugas preenchidos de 0,5 M NaOH e ultrassonize-os por 10 minutos.
- Lave os tubos FEP com H2O destilado duplo, depois repita a descarga com 70% de etanol (Figura 1f).
- Transfira tubos para 70% de etanol e ultrassônicos por 10 minutos.
- Lave os tubos com H2O destilado duplo e armazene-os em tubos de centrífugas em H2O destilado duplo (Figura 1g).
3. Preparação de 2% prato de agarose
- Em um frasco de vidro, dissolva o baixo ponto de fusão em pó de agarose em E3. Aqueça a solução em um micro-ondas e mexa a cada 20 s, até que todo o pó seja dissolvido.
- Despeje agarose em uma placa de vidro ou plástico de Petri para fazer um casaco de 1-2 mm. Espere até que a garose seja solidificada.
- Para armazenar, despeje suavemente o E3 na parte superior do ágar para evitar a secagem. Enrole em filme de parafina e mantenha a 4 °C.
4. Preparação para incorporar mídia
- Prepare e3 suficiente para encher a câmara de amostra.
NOTA: Evite usar azul metil se a mídia estiver em contato com lentes objetivas. - Se usar tricaine, descongele a solução de estoque e adicione 0,02% de tricaine à E3.
5. Montagem da amostra
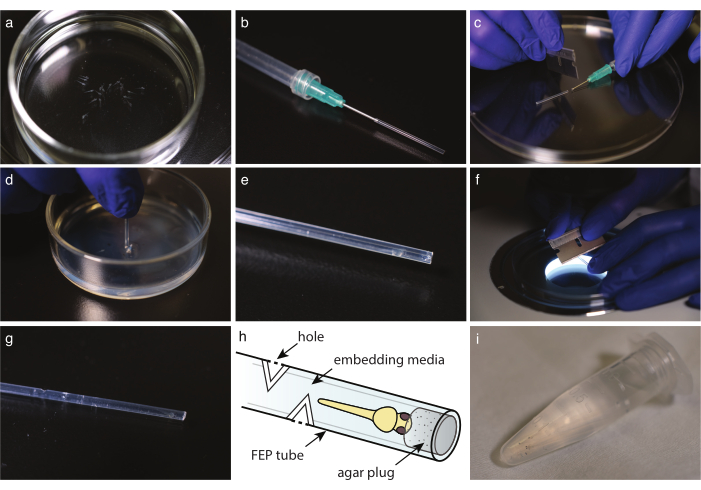
Figura 2: Montagem em embrião no tubo FEP. (a) Peixe sem pigmento anestesiado em meios de montagem. b Uma seringa com agulha de extremidade sem corte e tubo FEP anexado. c Uma vez que a mídia e os peixes sejam absoris no tubo FEP, corte o tubo na borda da agulha. d Mergulhar o tubo de corte em um prato revestido com 2% de agarose para tapar sua extremidade. e Um zebrafish em um tubo FEP conectado. f Corte suavemente o tubo FEP a 30° para criar orifícios de troca de gás. (g) Tubo FEP com quatro orifícios acima de um zebrafish incorporado. (h) Esquema de um zebrafish embutido em um tubo FEP. Buracos e plugue de ágar são indicados. (i) Vários zebrafish incorporados prontos para a imagem. Clique aqui para ver uma versão maior desta figura.
- Com uma pipeta de vidro descartável, transfira peixes para incorporar mídia (Figura 2a). Se usar tricaine, transfira o peixe para a placa de Petri cheia de E3 contendo tricaine, 10 minutos antes da imagem. Em ambos os casos, veja sob um estereómico para verificar se o peixe parou de se mover e que o coração está batendo na velocidade semelhante quando comparado ao controle.
- Corte o tubo FEP ao comprimento ideal com uma lâmina de barbear (Figura 1h).
NOTA: O comprimento deve ser ajustado ao suporte amostral do microscópio; o comprimento típico é de cerca de 3 cm. - Prepare uma seringa com uma cânula de extremidade sem cortes. Encha a seringa com ar, em seguida, monte o tubo FEP sobre a agulha e limpe suavemente qualquer água restante esvaziando a seringa (Figura 2b).
NOTA: Evite fazer bolhas lavando lentamente o ar. - Com o tubo FEP montado na seringa, primeiro, pegue a mídia para encher o tubo FEP, em seguida, pegue uma cabeça de embrião para baixo. Mantenha a cabeça de peixe o mais perto possível da extremidade do tubo. Evite fazer bolhas; se uma bolha estiver presente, descarte a amostra.
- Com uma lâmina de barbear, corte cuidadosamente o tubo FEP na borda da cânula ou agulha da extremidade sem corte (Figura 2c).
- Descarte qualquer líquido na parte superior do prato revestido de ágar. Mergulhe o tubo FEP diretamente no ágar (Figura 2d). Gire o tubo e retire-o para soltar o plugue da cama agarose.
- Sob um estereoscópio, verifique a presença do plugue de ágar na extremidade do tubo (Figura 2e).
- Para imagens de longo prazo, corte 3-5 furos no tubo FEP em cada direção cardeal, pelo menos 5 mm acima da extremidade do peixe.
- Sob um estereoscópio, use uma lâmina de barbear perpendicular ao eixo do tubo para fazer uma incisão de 30° no tubo FEP até atingir a mídia de montagem (Figura 2f).
- Faça um segundo corte a 180° para criar um orifício (Figura 2g,h).
- Transfira a cabeça do embrião montado para baixo em um tubo de microcentrifuuge de 1,5 mL com mídia de incorporação até estar pronto para a imagem (Figura 2i).
6. Posicionamento amostral

Figura 3: Câmara de amostra. (a) tubo FEP montado em um suporte de amostra. b A câmara amostral com etapas e objetivos. c Visão superior da câmara de amostra preenchida por mídia, com objetivo de iluminação e detecção em uma configuração T-SPIM. d Suporte de amostra montado no microscópio, com a amostra na câmara. Clique aqui para ver uma versão maior desta figura.
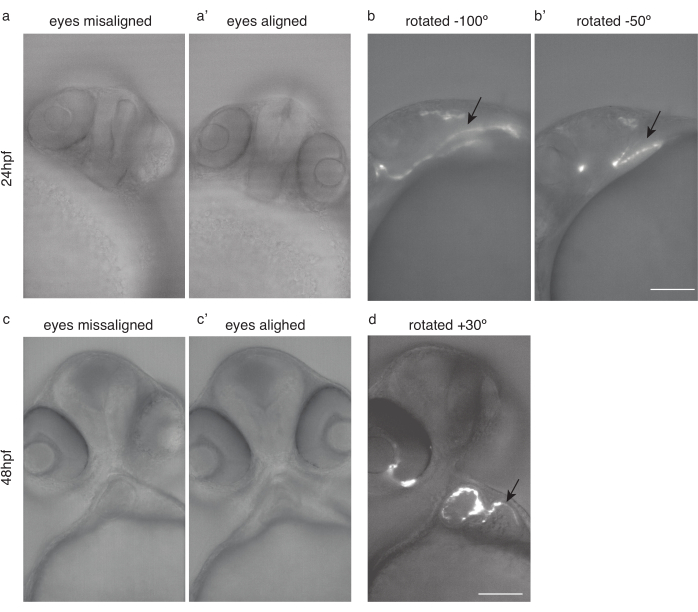
Figura 4: Posicionamento embrionário para imagem cardíaca. (a) 24 hpf Tg (kdrl:Hsa.HRAS-mCherry) com olhos desalinhados. a') O mesmo peixe, com os olhos alinhados. (b) O mesmo peixe girou -100 ° e (b') -50 ° para uma imagem cardíaca ideal. c Zebrafish de 48 hpf com olhos desalinhados. (c') O mesmo peixe, com os olhos alinhados. d O mesmo peixe girou 30° para uma imagem cardíaca ideal. Flechas negras apontam para o coração. Barra de escala 100 μm. Clique aqui para ver uma versão maior desta figura.
- No microscópio, monte o tubo FEP no suporte da amostra (Figura 3a) e encha a câmara de imagem com mídia de incorporação (Figura 3b,c). Em seguida, coloque o titular da amostra no palco com a amostra mergulhando na câmara (Figura 3d).
- Verifique a saúde da amostra. Avalie visualmente a frequência cardíaca para avaliar o bem-estar geral dos peixes, uma vez que a frequência cardíaca específica é dependente de estágio e temperatura, comparando-se com peixes de controle não montados. Se o batimento cardíaco for muito lento, descarte o peixe.
NOTA: Certifique-se de manuseio suave de embriões, transferência cuidadosa para incorporar mídia, imagem imediatamente após a incorporação, evitando rápidas mudanças de temperatura, evitando tricaine e diminuindo o tempo de exposição à tricaine. - Para imagens reprodutíveis, use sempre a mesma posição amostral. Recomenda-se alinhar os olhos e a imagem em um ângulo.
- Gire o peixe para que ambos os olhos (Figura 4a,c) estejam no plano focal (Figura 4a',c')
- A partir dessa posição, gire ainda mais o peixe aproximadamente 50 °-100 ° no sentido horário para imagens de 24 hpf (Figura 4b, b'), e aproximadamente 20°-30° no sentido anti-horário para imagens de 48 hpf (Figura 4d).
NOTA: O coração primitivo, antes de 30 cvf, pode ser difícil de imagem devido à sua posição oculta (Figura 4b).
7. Aquisição de imagens
- Escolha o lado de iluminação que dá a melhor qualidade de imagem e adapte o poder laser a cada peixe.
NOTA: Registo o poder laser utilizado para análise subsequente de imagens. - Em cada z-plane, grave 4-5 batimentos cardíacos a 300 quadros por segundo (fps) ou mais.
NOTA: O campo de visão pode ser cortado para aumentar a velocidade de aquisição. Por exemplo, a 48 hpf o coração zebrafish bate de duas a três vezes por segundo, portanto, a 300 fps, entre 300 e 600 quadros são necessários para adquirir quatro a seis batimentos cardíacos. - Para registrar o coração batendo, mova a amostra passo a passo através da folha de luz. Use um espaçamento z de 1-2 μm, cobrindo toda a profundidade do coração.
8. Processamento de imagens
- Sincronizar filme gravado para reconstruir um coração 4D (x,y,z, tempo) usando um plugin Fiji (Image J229,30) como descrito anteriormente6.
- Para explorar dados e gerar filmes do coração de zebrafish renderizado, carregue o arquivo 4D (x,y,z, time) em um software de renderização 3D.
Resultados
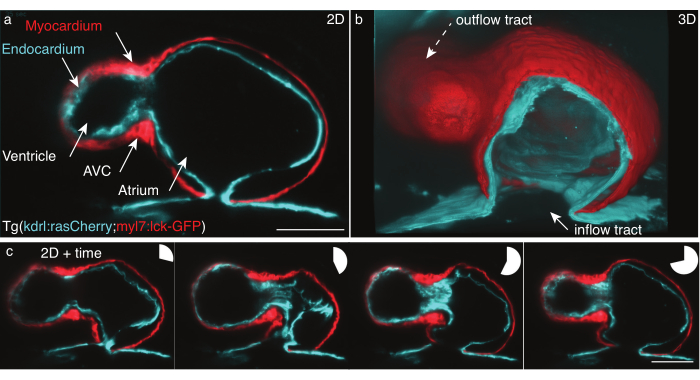
Figura 5: O coração de zebrafish de 48 hpf. (a) Ainda de um z-frame, visão anterior-ventral de 48 hpf Tg (kdrl:Hsa.HRAS-mCherry; myl7:lck-EGFP) zebrafish, imaged com LSFM, (b) reconstrução 3D de pilhas de filme, visão cortada através do átrio. c Montagem de quatro quadros sobre um batimento cardíaco completo em um z-plane. Gráficos de tortas indicam o tempo durante o batimento cardíaco. Barra de escala 50 μm. Clique aqui para ver uma versão maior desta figura.
Registramos o coração pulsante de 48 hpfs de Tg (kdrl:Hsa.HRAS-mCherry; myl7:lck-EGFP) zebrafish de acordo com o protocolo detalhado acima (Figura 5). Uma folha de luz laser de 488 nm e uma de 561 nm iluminaram a amostra simultaneamente. A fluorescência emitida foi detectada perpendicularmente utilizando uma lente objetiva de 16x/0,8 W e uma câmera de semicondutor de óxido de metal científico (sCMOS).
Com 48 cv, o coração acaba de passar por looping e tem duas câmaras, o ventrículo e o átrio, mas ainda não desenvolveu válvulas. Em nossos filmes, as diferentes estruturas cardíacas, como trato de entrada, ventrículo, canal atrioventricular (AVC), átrio e trilha de saída são facilmente distinguíveis (Figura 5a,b). Esses dados mostram a batida precisa e revelam interações complexas entre as duas camadas celulares do coração: o miocárdio, uma camada muscular unicelular contraindo e gerando força (Figura 5c, vermelho), e o endocárdio, uma única camada celular que conecta o coração à vasculatura (Figura 5c, ciano).
A reconstrução do batimento cardíaco em x,y,z (3D) + tempo (4D) + cor (5D) foi realizada de acordo com Mickoleit et al.6. A reconstrução é baseada em duas hipóteses: o movimento do coração é repetitivo, e os dados devem ser adquiridos com um pequeno passo z. A saída é um batimento cardíaco único reconstruído em 5D, medindo de 30 GB a 80 GB por batimento cardíaco. Para renderizar os dados, usamos a ferramenta fluoRender de código aberto gratuita para renderização em profundidade31 , pois foi projetada para lidar com conjuntos de dados multidimensionais e renderiza facilmente filmes 5D de camadas celulares e camadas individuais (Figura 5b).
Discussão
Linhas transgênicas para imagem do coração
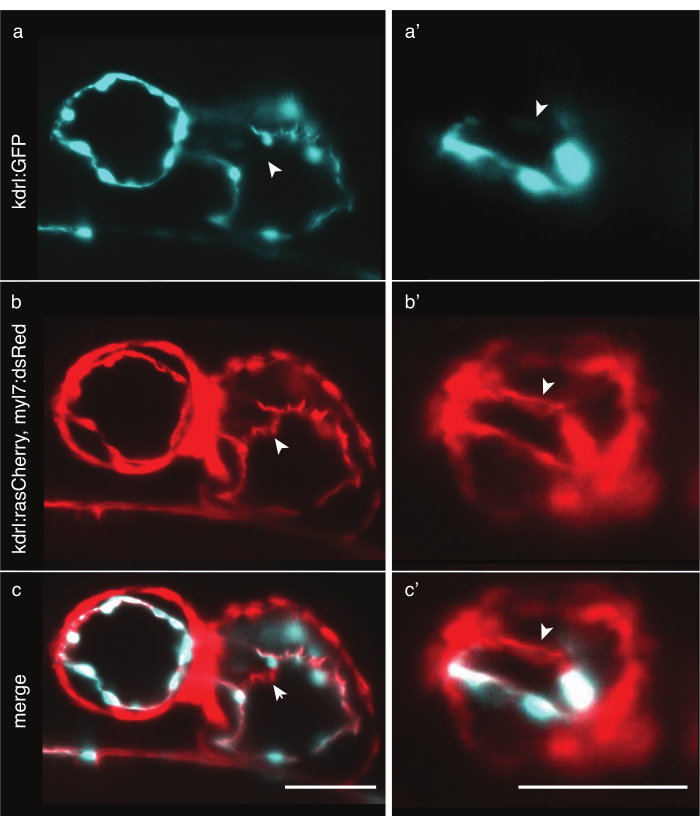
Figura 6: Comparação das linhas transgênicas de zebrafish citoplasmica e marcador de membrana. Vista anterior-ventral de corações de zebrafish de 48 hpf visualizados com LSFM. Setas brancas indicam estruturas visíveis apenas com uma linha transgênica marcador de membrana. a Tg(kdrl:EGFP)32 sinal em ciano no coração e (a') no ventrículo. b Tg(kdrl:Hsa.HRAS-mCherry; myl7:dsRed)33 sinal em vermelho no coração e (b') no ventrículo. ( c,c') mesclagem de ambos os sinais Tg(kdrl:Hsa.HRAS-mCherry; myl7:dsRed) e Tg(kdrl:EGFP). Barra de escala 50 μm. Clique aqui para ver uma versão maior desta figura.
A imagem do coração de zebrafish requer rotulagem precisa de células cardíacas. Embora a espessura do miocárdio seja relativamente constante em todas as células, as células endocárdias são grossas ao redor do núcleo, mas têm saliências finas de membrana, em algumas regiões mais finas que 2 μm. Linhas transgênicas citoplasmáticas como Tg(kdrl:EGFP)32 rotulam efetivamente as regiões ao redor dos núcleos endocárdico, mas mais longe, o citoplasma fino pode não emitir fótons suficientes para serem detectados com tempos tão curtos de exposição, levando a buracos artificiais nos dados (Figura 6a). Em contraste, linhas transgênicas de marcador de membrana como Tg(kdrl:Hsa.HRAS-mCherry)33 podem efetivamente rotular o endocardium e revelar mais detalhes (Figura 6b,c). Para cada experimento, escolha cuidadosamente a linha transgênica mais apropriada.
Imobilização de zebrafish
A escolha da técnica de imobilização depende do comprimento do experimento e da idade do peixe à imagem. Tricaine tem sido comumente usado para imobilização de zebrafish, principalmente devido à sua facilidade de uso. De fato, simplesmente adicionar 130 mg/L tricaine à mídia de peixe resulta em sua anestesia em 10 minutos. Como pode levar a defeitos de desenvolvimento e afetar a fisiologia cardíaca20,22, recomendamos o uso de tricaine apenas para experimentos curtos (menos de 30 min). Para imagens mais longas, α-bungarotoxin mRNA injeções no estágio de uma ou duas células paralisa os peixes até 3 dias após a fertilização (dpf) sem afetar o desenvolvimento cardiovascular ou a fisiologia22.
Escolhendo os tubos FEP certos
Os tubos FEP estão disponíveis em vários diâmetros e espessuras. Para a imagem 0-5 dpf peixe, 0,8 mm é um bom diâmetro interno; escolha tubos de parede grossas de 0,8 x 1,6 mm ou tubos de parede fina de 0,8 x 1,2 mm. Recomendamos tubos de paredes finas; no entanto, paredes mais grossas oferecem maior estabilidade e rigidez, o que pode ser importante se a câmara de amostra tiver mídia fluindo que poderia interromper e mover um tubo fino. Para amostras maiores, podem ser utilizadas 1,6 x 2,4 mm e 2 x 3 mm.
Trocas de temperatura e gás
Um aspecto essencial do bem-estar do embrião de zebrafish é a temperatura. O ideal é manter o peixe a 28,5 °C enquanto estiver em imagens, já que a temperatura do ambiente afeta o desenvolvimento e a frequência cardíaca34.
Em nossa experiência, a troca de oxigênio através do plugue de 2% de agarose só mantém uma frequência cardíaca estável até 3-4 dpf. Portanto, cortar orifícios no tubo garante a difusão de oxigênio. Também pode ser necessário para a entrega de medicamentos à amostra, se desejar.
Suspensão de batimentos cardíacos.
As rápidas velocidades de aquisição de microscópios de folha de luz devidamente equipados permitem a gravação do coração pulsante in vivo. No entanto, para adquirir uma pilha z imperturbável, pode-se desacelerar ou parar o coração. No entanto, parar o coração leva ao relaxamento muscular cardíaco e pode resultar no colapso do coração6. A suspensão do batimento cardíaco pode ser feita usando morfolnos, baixas temperaturas, um inibidor de contração muscular ou optogenética. Esses métodos têm suas desvantagens e devem ser cuidadosamente avaliados para cada experimento.
A injeção de 4ng de morfolino de coração silencioso (sih) no estágio de uma célula pode parar o batimento cardíaco mirando o gene tnnt2a crucial para a formação de sarcomere35. os zebrafish sih não têm batimentos cardíacos e só sobrevivem até 7 dpf, quando os embriões começam a depender da circulação de sangue para oxigenação. Como a morfogênese cardíaca é impulsionada por forças genéticas e biomecânicas36, esses peixes apresentam malformações cardíacas em torno de 3 dpf.
Como o fluxo de Ca2+ é sensível à temperatura, a temperatura influencia a frequência cardíaca em zebrafish embrionário21. Consequentemente, a redução da temperatura na câmara de imagem diminui o batimento cardíaco. Parar o batimento cardíaco requer temperaturas abaixo de 15 °C. Como os zebrafish são geralmente mantidos a 28,5 °C, essas temperaturas baixas só podem ser mantidas por breves períodos (menos de 10 min).
Drogas como inibidores químicos de contrações musculares, 2,3-Bu-tanedione 2-monoxime (BDM), podem ser adicionadas aos meios de zebrafish (50 nM37,38) para suspender os batimentos cardíacos temporariamente. O BDM é conveniente de usar, pois pára a contração cardíaca em menos de 15 minutos e pode ser lavado para restaurar a função cardíaca. No entanto, como o BDM altera o potencial de ação cardíaca, ele deve ser usado com uma cautela37.
Finalmente, o coração do zebrafish transgênico que expressa canais de íons ou bombas de íons com entrada leve, como canal de mardopsina ou halorhodopsina em seu miocárdio, pode ser manipulado e parado iluminando o marca-passo no trato de entrada com luz39,7,40,41,9.
Perspectiva
As ferramentas e soluções otimizadas apresentadas para estudar o coração de zebrafish in vivo permitem imagens suaves e de longo prazo da dinâmica cardíaca ultrarrápida. A incorporação da amostra pode ser adaptada para diferentes modalidades de imagem, como microscopia confocal, microscopia de dois fótons ou tomografia de projeção óptica (OPT). A microscopia da folha de luz, no entanto, é provavelmente a técnica preferida que oferece seção óptica a uma velocidade suficiente para capturar a dinâmica do coração. Embora este protocolo se concentre na imagem cardíaca embrionária de zebrafish, acreditamos que ele também pode ser aplicado a várias outras amostras e experimentos. Será interessante ver no futuro se técnicas semelhantes de incorporação e imagem também podem ser usadas em estágios posteriores durante o desenvolvimento, quando o coração está mais escondido e a larva menos translúcida.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Agradecemos a Madelyn Neufeld pela ilustração da Figura 2h. Este trabalho foi apoiado pela Max Planck Society, Morgridge Institute for Research, Chan Zuckerberg Initiative e Human Frontier Science Program (HFSP).
Materiais
| Name | Company | Catalog Number | Comments |
| 1.5mL Eppendorf | Eppendorf | 22364111 | To carry embedded samples |
| 15mL Falcon tubes | Falcon | 352095 | To carry embedded samples |
| 50mL centrifuge tubes | Falcon | 352070 | 50ml tubes for sonication step, and storing cleaned, straightened FEP tubes |
| 50mL syringe | BD | 309654 | 50ml syringe for FEP cleaning |
| Agarose, low gelling temperature | Sigma Aldrich | 39346-81-1 | To make plug |
| Blunt Tip Needles, 21 gauge | VWR | 89500-304 | Blunt end needle for 0.8 inner diameter FEP tube |
| Borosilicate glass tube | McMaster-Carr | 8729K33 | Tubing for FEP tube straightening 9.5mm outer diameter, 5.6 inner diameter, 30cm long, other sizes available |
| Borosilicate glass tube | McMaster-Carr | 8729K31 | Tubing for FEP tube straightening 6.35mm outer diameter, 4mm inner diameter, 30cm long, other sizes available |
| Conventional needles, 21 Gauge | BD | 305165 | Conventional needle for 0.8 inner diameter FEP tube |
| Disposable glass pipette | Grainger | 52NK56 | To transfer fish, use with pipette pump |
| E3 medium for zebrafish embryos | |||
| Ethanol | Sigma Aldrich | 64-17-5 | Ethanol for FEP cleaning |
| FEP tube, 0.8 / 1.2 mm | ProLiquid | 2001048 | FEP tube with thin wall, other sizes available |
| FEP tube, 0.8 / 1.6 mm | Bola | S1815-04 | FEP tube with thick wall, other sizes available |
| FEP tube, 2/3mm | BGB | 211581 | Large FEP tube with thick wall, other sizes available |
| Hot Hand Rubber Mitt | Cole-Parmer | 691000 | To carry hot equipment after autoclaving |
| Omnifix 1mL Syringes | B Braun | 9161406V | 1ml syringe for embedding |
| Petri dish, small | Dot Scientific | PD-94050 | To make agarose plug |
| Pipette pumps | Argos Technologies | 04395-05 | To transfer fish, use with disposable glass pipette |
| PTU | Sigma Aldrich | 103-85-5 | Also known as: N-Phenylthiourea, 1-Phenyl-2-thiourea, Phenylthiocarbamide |
| Razor blades | Azpack | 11904325 | To cut FEP tubes |
| Sodium Hydroxide | Dot Scientific | DSS24000 | NaOH for FEP cleaning |
| Tricaine | Sigma Aldrich | E10521 | Also known as: MS-222, Ethyl 3-aminobenzoate methanesulfonate, Tricaine |
Referências
- Hoebe, R. A., et al. Controlled light-exposure microscopy reduces photobleaching and phototoxicity in fluorescence live-cell imaging. Nature Biotechnology. 25 (2), 249-253 (2007).
- Jenielita, M., Taormina, M. J., Delaurier, A., Kimmel, C. B., Parthasarathy, R. Comparing phototoxicity during the development of a zebrafish craniofacial bone using confocal and light sheet fluorescence microscopy techniques. Journal of Biophotonics. 6 (11-12), 920-928 (2013).
- Icha, J., Weber, M., Waters, J. C., Norden, C. Phototoxicity in live fluorescence microscopy, and how to avoid it. BioEssays. 39 (8), 1700003 (2017).
- Reynaud, E. G., Kržič, U., Greger, K., Stelzer, E. H. K. Light sheet-based fluorescence microscopy: more dimensions, more photons, and less photodamage. Human Frontier Science Program Journal. 2 (5), 266-275 (2008).
- Weber, M., Huisken, J. Light sheet microscopy for real-time developmental biology. Current Opinion in Genetics & Development. 21 (5), 566-572 (2011).
- Mickoleit, M., et al. High-resolution reconstruction of the beating zebrafish heart. Nat Methods. 11 (9), 919-922 (2014).
- Arrenberg, A. B., Stainier, D. Y., Baier, H., Huisken, J. Optogenetic control of cardiac function. Science. 330 (6006), 971-974 (2010).
- Trivedi, V., et al. Dynamic structure and protein expression of the live embryonic heart captured by 2-photon light sheet microscopy and retrospective registration. Biomed Optics Express. 6 (6), 2056-2066 (2015).
- Weber, M., Yelon, D., et al. Cell-accurate optical mapping across the entire developing heart. eLife. 6, 28307 (2017).
- Weber, M., Huisken, J. In vivo imaging of cardiac development and function in zebrafish using light sheet microscopy. Swiss Medical Weekly. 145, 14227 (2015).
- Fei, P., et al. Cardiac light-sheet fluorescent microscopy for multi-scale and rapid imaging of architecture and function. Science Reports. 6 (1), 1-12 (2016).
- Felker, A., et al. Continuous addition of progenitors forms the cardiac ventricle in zebrafish. Nature Communication. 9 (1), 1-14 (2018).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. K. Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305 (5686), 1007-1009 (2004).
- Keller, P. J., Pampaloni, F., Stelzer, E. H. Life sciences require the third dimension. Current Opinion in Cell Biology. 18 (1), 117-124 (2006).
- Keller, P. J., Schmidt, A. D., Wittbrodt, J., Stelzer, E. H. K. Reconstruction of zebrafish early embryonic development by scanned light sheet microscopy. Science. 322 (5904), 1065-1069 (2008).
- Weber, M., Mickoleit, M., Huisken, J. Multilayer mounting for long-term light sheet microscopy of zebrafish. Journal of Visualized Experiments. (84), e51119 (2014).
- Berndt, F., Shah, G., Power, R. M., Brugués, J., Huisken, J. Dynamic and non-contact 3D sample rotation for microscopy. Nature Communications. 9 (1), 1-7 (2018).
- Daetwyler, S., Günther, U., Modes, C. D., Harrington, K., Huisken, J. Multi-sample SPIM image acquisition, processing. and analysis of vascular growth in zebrafish. Development. , 173757 (2019).
- Keomanee-Dizon, K., Fraser, S. E., Truong, T. V. A versatile, multi-laser twin-microscope system for light-sheet imaging. Review of Scientific Instruments. 91 (5), 053703 (2020).
- Kaufmann, A., Mickoleit, M., Weber, M., Huisken, J. Multilayer mounting enables long-term imaging of zebrafish development in a light sheet microscope. Development. 139 (17), 3242-3247 (2012).
- Gierten, J., et al. Automated high-throughput heartbeat quantification in medaka and zebrafish embryos under physiological conditions. Science Reports. 10 (1), 1-12 (2020).
- Swinburne, I. A., Mosaliganti, K. R., Green, A. A., Megason, S. G. Improved long-term imaging of embryos with genetically encoded α-bungarotoxin. PLOS ONE. 10 (8), 0134005-0134015 (2015).
- Taylor, J. M., et al. Adaptive prospective optical gating enables day-long 3D time-lapse imaging of the beating embryonic zebrafish heart. Nature Communication. 10 (1), 1-15 (2019).
- Power, R. M., Huisken, J. A guide to light-sheet fluorescence microscopy for multiscale imaging. Nature Methods. 14 (4), 360-373 (2017).
- Nüsslein-Volhard, C., Dahm, R. . Zebrafish: A Practical Approach. , (2002).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: An introduction. Journal of Visualized Experiments. (69), e4196 (2012).
- Cold Spring Harbor. E3 medium (for zebrafish embryos). Cold Spring Harbor Protocols. 2011, 66449 (2011).
- Yuan, S., Sun, Z. Microinjection of mRNA and morpholino antisense oligonucleotides in zebrafish embryos. Journal of Visualized Experiments. (27), e1113 (2009).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529 (2017).
- Jin, S. -. W., Beis, D., Mitchell, T., Chen, J. -. N., Stainier, D. Y. Cellular and molecular analyses of vascular tube and lumen formation in zebrafish. Development. 132 (23), 5199-5209 (2005).
- Chi, N. C., et al. Foxn4 directly regulates tbx2b expression and atrioventricular canal formation. Genes and Development. 22 (6), 734-739 (2008).
- Scott, G. R., Johnston, I. A. Temperature during embryonic development has persistent effects on thermal acclimation capacity in zebrafish. Proceedings of the National Academy of Sciences. 109 (35), 14247-14252 (2012).
- Sehnert, A. J., et al. Cardiac troponin T is essential in sarcomere assembly and cardiac contractility. Nature Genetics. 31 (1), 106-110 (2002).
- Sidhwani, P., Yelon, D., Wellik, D. M. Fluid forces shape the embryonic heart: Insights from zebrafish. Current Topics in Developmental Biology. 132, 395-416 (2019).
- Jou, C. J., Spitzer, K. W., Tristani-Firouzi, M. Blebbistatin effectively uncouples the excitation-contraction process in zebrafish embryonic heart. Cell Physiology and Biochemistry. 25 (4-5), 419-424 (2010).
- Chow, R. W. -. Y., Lamperti, P., Steed, E., Boselli, F., Vermot, J. following endocardial tissue movements via cell photoconversion in the zebrafish embryo. Journal of Visualized Experiments. (132), e57290 (2018).
- Nagel, G., et al. Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. Proccedings of the National Academy of Sciences. 100 (24), 13940-13945 (2003).
- Knollmann, B. C. Pacing lightly: optogenetics gets to the heart. Nature Methods. 7 (11), 889-891 (2010).
- Bruegmann, T., et al. Optogenetic control of heart muscle in vitro and in vivo. Nature Methods. 7 (11), 897-900 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados