Method Article
얼룩말 물고기 배아에서 빠른 심장 역학의 빛 시트 현미경 검사
요약
우리는 빛 시트 형광 현미경 검사법과 생체 내 제브라피시 심장을 연구하는 최적화 된 도구를 설명합니다. 특히, 우리는 밝은 심장 형질 전환선을 제안하고 발달과 심장 결함을 피하는 새로운 부드러운 임베드 및 고정 기술을 제시합니다. 심장 이미징에 적응된 가능한 데이터 수집 및 분석 파이프라인도 제공됩니다.
초록
배아 심장 연구는 생체 내 발광 형광 현미경 검사법 (LSFM)에서 빠른 발전에서 크게 혜택을 누리고 있다. ZEBRAfish, Danio rerio의 급속한 외부 발달, 기관 유전학 및 투명성과 결합된 LSFM은 상당한 광독성이나 광표백 없이 높은 공간 및 측두적인 해상도에서 심장 형태와 기능에 대한 통찰력을 제공했습니다. 구타 심장의 화상 진찰은 기존 견본 준비 및 현미경 기술에 도전합니다. 하나는 제한된 시야에서 건강한 샘플을 유지하고 심장 박동을 해결하기 위해 초고속 이미지를 수집해야합니다. 여기서 우리는 생체 내에서 제브라피시 심장을 연구하는 최적화된 도구와 솔루션을 설명합니다. 우리는 심장 성분을 라벨링하기위한 밝은 형질 전환선의 응용 프로그램을 시연하고 발달 결함과 심박수의 변화를 피하는 새로운 부드러운 임베드 및 고정 기술을 제시합니다. 또한 심장 이미징에 적합한 데이터 수집 및 분석 파이프라인도 제안합니다. 여기에 제시된 전체 워크플로우는 제브라피시 배아 심장 화상 진찰에 초점을 맞추고 있지만 다양한 다른 샘플 및 실험에도 적용 될 수 있습니다.
서문
초기 박동 심장에 있는 복잡한 사건 및 상호 작용을 밝히기 위하여는, 전체 기관의 생체 내 화상 진찰에서 요구됩니다. 최소한의 광독성1,2,3, 낮은 광표백4, 고속으로, 광시트 현미경 검사는 배아 및 심장 발달을 위한 1차 화상 진찰 도구로 발전했습니다5,6. 그것은 높은 공간 및 측두해상도에서 심장 형태와 기능에 대한 통찰력을 제공하고 연구원은 고속으로 심장의 형광 표시 부분을 이미지와 추적 할 수 있습니다, 혈역학력을 연구, 개발 배아의 몸 내부 심장 발달을 따라 6,10,11,12.
시야에서 제브라피시를 정확하고 재현적으로 제한하기 위해, 단기 및 장기뿐만 아니라 단일 또는 다중 샘플 13,14,15,17,18,19뿐만 아니라, 라이트 시트에 대한 다양한 포함 프로토콜이 존재한다. 가장 일반적인 프로토콜은 유리 또는 플라스틱 튜브 내부에 트리카인 고정 및 아가로즈 장착을 포함한다. 그러나, 심박수가 온도, 마취제 및 포함 물질로 인해 변경될 수 있기 때문에 20,21,22로, 제브라피쉬 심장 이미징은 시료 건강을 보장하기 위해 구체적이고 부드러운 프로토콜이 필요합니다6,8,8,11,12,20,21,22,22,23 . 단기 이미징(최대 1시간)의 경우, 130 mg/L 트리카인에서 물고기를 마취하고 0.1% 아가로즈 용액및 플러그를 가진 플루오라이트 에틸렌 프로필렌(FEP) 튜브에 포함시킬 수 있습니다. 그러나, 트리카인이 발달 결함으로 이어질 수 있기 때문에20,22, 다른 프로토콜장기 화상 진찰을 위해 사용되어야 합니다.
여기에서 우리는 장기 심장 화상 진찰을 위한 새로운 전략을 기술합니다. 많은 광시트 구현이 존재하지만24, 우리는 T-SPIM 현미경 (하나의 검출 및 공통 초점에 수직으로 매달려 샘플과 수평 평면에 두 개의 조명 렌즈)에 매달려 샘플을 사용하는 것이 좋습니다. 이를 통해 정확한 시료 포지셔닝에 필요한 이동 및 회전의 자유를 제공합니다. 물고기는 1- 또는 2 세포 단계에서 30 pg α 분가로톡신 mRNA를 주입하여 고정됩니다. α 분가로톡신은 심혈관 발달이나 생리학에 영향을 미치지 않고 근육을 마비시키는 뱀 독입니다22. 정확하고 왜곡없는 이미징을 위해 물과 거의 동일한 굴절률을 가진 폴리머인 FEP로 만든 튜브에 물고기를 장착하는 것이 좋습니다. 화상 진찰 전에 이를 곧게 펴고 청소하여 FEP 튜브를 가장 잘 준비하는 방법에 대해 설명합니다. 물고기는 다음이 튜브에 장착, 아래로 머리, 미디어에, 튜브의 바닥은 2 % 아가로즈 플러그로 밀봉, 물고기 머리가 휴식하는. FEP 튜브의 구멍을 절단하면 가스 교환을 용이하게하고 어류의 성장을 보장합니다. 임베디드 된 물고기는 이미징 직전에 샘플 홀더에 장착 될 때까지 미디어에 보관 할 수 있습니다. 또한 재현 가능한 고속 이미징을 위한 데이터 수집 및 분석 파이프라인을 제안합니다. 또한, 우리는 강력한 심장 세포 라벨링을 위한 세포질 마커 형질 대사 대 세포질 마커 의 사용을, 뿐만 아니라 심혼을 정지하는 다른 선택권에 대해 토론합니다. 이러한 장착 기술은 시야에서 심장을 정확하고 재현적으로 제한할 수 있도록 하면서 샘플 상태를 보장합니다.
프로토콜
모든 제브라피쉬(Danio rerio) 성인과 배아는 UW-매디슨 기관 동물 관리 및 사용 위원회(IACUC)가 승인한 프로토콜에 따라 처리되었습니다.
1. 제브라피시 준비
- 확립된 프로토콜25,26 및 기관 지침에 따라 제브라피시를 처리합니다. 원하는 형질 전환선의 성인 물고기를 사육 (토론 참조). 배아를 수집하고 생선 매체, 예를 들어, E327로 채워진 페트리 접시에 28 °C에서 보관하십시오.
- 고정 방법을 선택합니다(토론 참조).
- α-분가로톡신 mRNA를 사용하여 물고기를 고정하는 경우, 마이크로 조작기에 장착되고 picoinjector28에 연결된 보어 유리 바늘을 사용하여 1-또는 2 세포 단계 배아의 노른자에 30 pg mRNA22를 주입하십시오.
- 트리카인을 사용하는 경우 0.4% 스톡 용액을 pH 7.0-7.4로 버퍼링하고 1M Tris 베이스로 만들고 이미징까지 -20°C에 저장하십시오.
- E3 채워진 페트리 접시에 계란을 28°C로 보관하고 24시간마다 계란을 신선한 E3로 새로운 요리로 옮기고 이미징까지 신선한 E3를 제공합니다.
- 안료 형성을 방지하기 위해, 제브라피시 배경이 알비노가 아닌 경우, 물고기를 24시간 후 수정(hpf)에서 0.2mm 티로시나제 억제제 1-페닐 2-티오레아를 가진 새로운 E3 접시로 이송한다(토론 참조).
2. FEP 튜브 준비
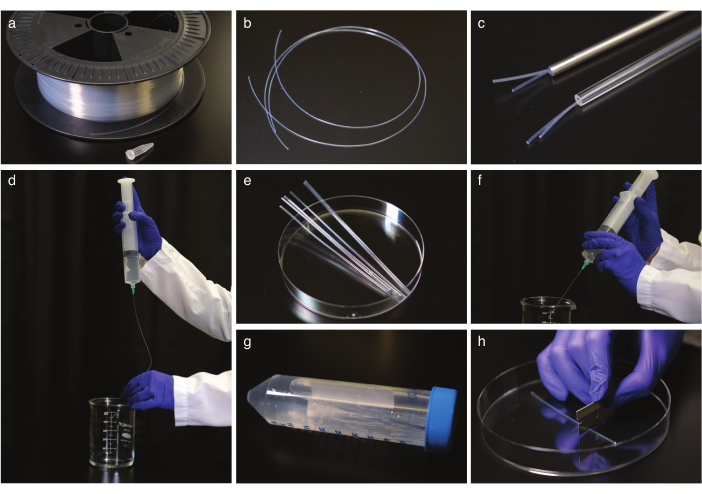
그림 1: FEP 튜브 청소 및 스트레이트. (a) 케이블 드럼에 FEP 튜브. (b) 곧게 펴기 전에 FEP 튜브. (c) 유리 및 강철 오토클레이브 안전 튜브FEP 튜브. (d) 곧게 펴고 식힌 후 FEP 튜브의 플러싱. (e) FEP 튜브는 초음파 처리를 위한 원심분리기 튜브의 크기로 절단한다. (f) 초음파 처리 후 FEP 튜브의 플러싱. (g) 원심분리기 튜브에 세척및 곧게 된 FEP 튜브의 저장. (h) 화상 진찰 전에 FEP 관을 절단합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- FEP 튜브(도 1a,b)를 FEP 튜브에 맞도록 올바른 내경을 가진 유리 또는 강철 오토클레이브 안전 튜브(도 1c)에 배치하여 2h에 대해 180°C로 자동 클랩을 직선화한다. 튜브를 실온에서 적어도 5 시간 동안 식힙니다. 그런 다음 곧게 펴는 튜브에서 제거합니다.
참고: 튜브를 조작할 때 장갑을 사용하고 한 번에 50cm 튜브로 작업합니다. - FEP 튜브를 청소합니다.
참고 : 내부 FEP 튜브 크기의 무딘 바늘 끝주사기는 안전을 위해 권장되지만 일반 바늘이 작동합니다.- 50mL 주사기(도 1d)로 튜브를 두 번 1M NaOH로 플러시합니다.
- FEP 튜브를 면도날로 50mL 원심분리기 튜브 크기로 자르고, 0.5M NaOH 충전원심분리관에 튜브를 배치하고 10분 동안 초음파처리합니다.
- FEP 튜브를 이중 증류 H2O로 플러시한 다음 70%의 에탄올로 플러싱을 반복합니다(그림 1f).
- 튜브를 70%에탄올로 옮기고 10분 동안 초음파처리합니다.
- 이중 증류된 H2O로 튜브를 플러시하고 이중 증류H2O(그림 1g)의 원심분리기 튜브에 보관하십시오.
3. 아가로즈 접시 2% 준비
- 유리 플라스크에서, E3에 낮은 융점 아가로즈 분말을 용해. 용액을 전자레인지에 가열하고 모든 분말이 녹을 때까지 20s마다 저어줍니다.
- 1-2mm 코트를 만들기 위해 유리 또는 플라스틱 페트리 접시에 아가로즈를 붓습니다. 아가로즈가 굳어지를 때까지 기다립니다.
- 보관하려면 천 위에 E3를 부드럽게 부어 건조를 방지합니다. 파라핀 필름으로 감싸고 4°C에서 보관하십시오.
4. 미디어 포함 준비
- 샘플 챔버를 채우기 위해 충분한 E3를 준비합니다.
참고: 미디어가 객관적인 렌즈와 접촉하는 경우 메틸 블루를 사용하지 마십시오. - 트리사인을 사용하는 경우, 스톡 솔루션을 해동하고 E3에 0.02 % 트리카인을 추가하십시오.
5. 샘플 마운팅
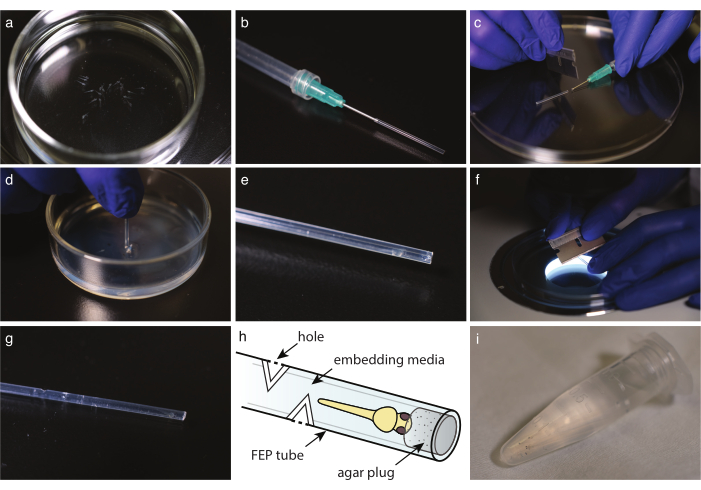
그림 2: FEP 튜브에 배아 장착. (a) 마운팅 미디어에서 마취 된 색소가없는 물고기. (b) 무딘 엔드 바늘과 FEP 튜브가 부착된 주사기. (c) FEP 튜브에서 미디어와 물고기를 채취하면 바늘 가장자리에서 튜브를 잘라냅니다. (d) 컷 튜브를 2% 아가로즈로 코팅한 접시에 찍어 끝을 연결합니다. (e) 연결된 FEP 튜브의 제브라피시. (f) FEP 튜브를 30°로 부드럽게 잘라 가스 교환 구멍을 만듭니다. (g) 페프 튜브에 임베디드 제브라피시 위에 4개의 구멍이 있습니다. (h) FEP 튜브에 내장된 제브라피시의 계획. 구멍과 한천 플러그가 표시됩니다. (i) 이미징을 위한 여러 개의 임베디드 제브라피쉬. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 일회용 유리 파이펫으로 물고기를 포함 매체로 옮겨보도록 한다(그림 2a). 트리사인을 사용하는 경우, 이미징 하기 전에 트리사인 함유 E3로 채워진 페트리 접시로 생선을 옮기. 두 경우 모두, 물고기가 움직이지 않는 지 확인하고 대조군과 비교할 때 심장이 비슷한 속도로 뛰고 있는지 확인하기 위해 스테레오 현미경으로 봅니다.
- FEP 튜브를 면도날로 이상적인 길이로 자릅니다(그림 1h).
참고: 길이는 현미경의 샘플 홀더로 조정되어야 합니다. 일반적인 길이는 약 3cm입니다. - 무딘 끝 캐뉼라로 주사기를 준비합니다. 주사기를 공기로 채운 다음 FEP 튜브를 바늘에 장착하고 주사기를 비우면 남은 물을 부드럽게 씻어냅니다(그림 2b).
참고: 천천히 공기를 씻어 거품을 만들지 마십시오. - 주사기 장착 FEP 튜브로, 먼저, FEP 튜브를 채우기 위해 미디어를 복용한 다음 배아 머리를 숙인다. 물고기 머리를 튜브 끝에 최대한 가깝게 유지하십시오. 거품을 만들지 마십시오. 거품이 있는 경우 샘플을 폐기합니다.
- 면도날로, 무딘 끝 캐뉼라 또는 바늘의 가장자리에 FEP 튜브를 조심스럽게 잘라 (도 2c).
- 한천 코팅 접시 위에 액체를 버리십시오. FEP 튜브를 바로 한천에 넣습니다(그림 2d). 튜브를 회전하고 아가로즈 침대에서 플러그를 해제하기 위해 꺼내.
- 입체 범위에서 튜브 끝에 있는 한천 플러그의 존재를 확인합니다(그림 2e).
- 장기 이미징의 경우, 물고기의 끝보다 적어도 5mm, 각 추기경 방향에서 FEP 튜브에 3-5 구멍을 잘라.
- 스테레오스코프 에서 튜브 축에 수직으로 면도날을 사용하여 장착 매체에 도달할 때까지 FEP 튜브에 30° 절개를 합니다(그림 2f).
- 구멍을 만들기 위해 180 °에서 두 번째 컷을 만듭니다 (그림 2g, h).
- 장착된 배아헤드를 이미지준비전까지 내장된 매체가 있는 1.5mL 마이크로센트심분리기 튜브로 이송한다(그림 2i).
6. 샘플 포지셔닝

그림 3: 샘플 챔버. (a) FEP 튜브가 샘플 홀더에 장착됩니다. (b) 단계와 목표가 있는 샘플 챔버. (c) T-SPIM 구성에서 조명 및 검출 목표를 가진 미디어 채워진 샘플 챔버의 최고 보기. (d) 챔버내 시료와 함께 현미경에 장착된 샘플 홀더. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
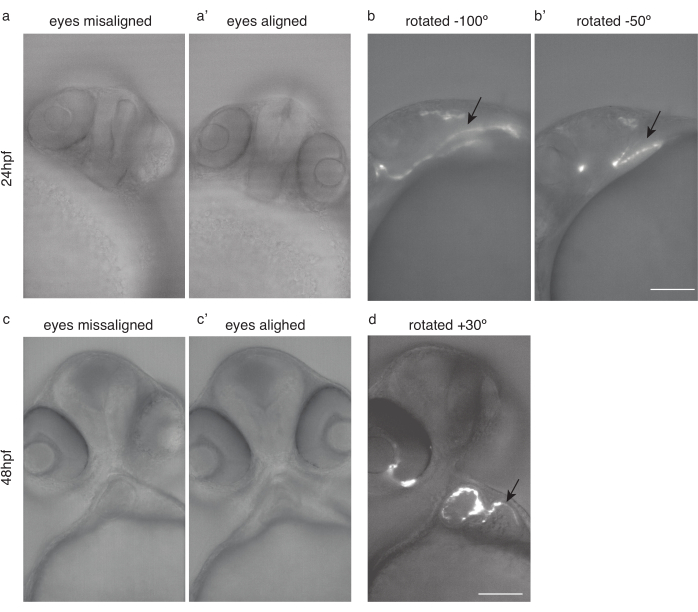
그림 4: 심장 이미징을 위한 배아 포지셔닝. (a) 24 hpf Tg (kdrl:Hsa.HRAS-mCherry) 눈이 잘못 정렬된 제브라피시. (a') 같은 물고기, 눈이 정렬. (b) 동일한 물고기가 -100 ° 및 (b') -50 ° 회전하여 최적의 심장 이미징을 합니다. (c) 48 hpf 제브라피쉬와 눈이 잘못 정렬. (c') 같은 물고기, 눈이 정렬. (d) 최적의 심장 이미징을 위해 동일한 물고기가 30° 회전합니다. 검은 색 화살표는 심장을 가리킵니다. 배율 막대 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 현미경에서, 샘플 홀더에 FEP 튜브를 장착 (도 3a) 포함 된 매체로 이미징 챔버를 채우기 (도 3b, c). 다음으로, 샘플 홀더를 챔버에 담그고 무대에 놓습니다(도 3d).
- 샘플의 상태를 확인합니다. 특정 심박수가 비 장착 된 대조군 물고기와 비교하여 단계와 온도에 따라 달라지므로 전체 물고기 의 건강을 평가하기 위해 심박수를 시각적으로 평가합니다. 심장 박동이 너무 느리면 물고기를 버리십시오.
참고: 배아의 부드러운 취급, 포함 매체에 주의 깊게 전달, 삽입 직후 이미징, 급속한 온도 변화 방지, 트리카인에 대한 노출 시간을 낮추는 것을 보장합니다. - 재현 가능한 이미징의 경우 항상 동일한 샘플 위치를 사용합니다. 눈과 이미징을 비스듬히 정렬하는 것이 좋습니다.
- 두 눈이 초점 평면에 있도록 물고기를 회전 (그림 4a',c')
- 그 위치에서, 24hpf 이미징 (도 4b, b') 및 48 hpf 이미징 (도 4d)에 대해 시계 방향으로 약 50 ° - 100 ° 물고기를 추가로 회전시다.
참고: 30hpf 이전의 초기 심장은 숨겨진 위치(그림 4b)로 인해 이미지하기가 어려울 수 있습니다.
7. 이미지 수집
- 최고의 이미지 품질을 제공하고 모든 물고기에 레이저 파워를 적응 조명 측면을 선택합니다.
참고: 후속 이미지 분석에 사용되는 레이저 전원을 기록합니다. - 각 z-평면에서 초당 300프레임(fps) 이상으로 4-5개의 하트비트를 기록합니다.
참고: 시야를 잘라 획득 속도를 높일 수 있습니다. 예를 들어, 48hpf에서 제브라피쉬 심장은 초당 2~3회 박동하므로 300fps에서 300~600프레임은 4~6개의 하트비트를 획득해야 합니다. - 박동하는 심장을 기록하려면 샘플을 라이트 시트를 통해 단계별로 이동합니다. 심장의 전체 깊이를 덮는 1-2 μm의 z 간격을 사용합니다.
8. 이미지 처리
- 녹화된 영화를 동기화하여 이전에 설명한 대로 피지(이미지 J229,30) 플러그인을 사용하여 4D(x, y, z, 시간) 심장을 재구성합니다6.
- 렌더링된 제브라피시 하트의 데이터를 탐색하고 동영상을 생성하려면 4D 파일(x, y,z, 시간)을 3D 렌더링 소프트웨어에 로드합니다.
결과
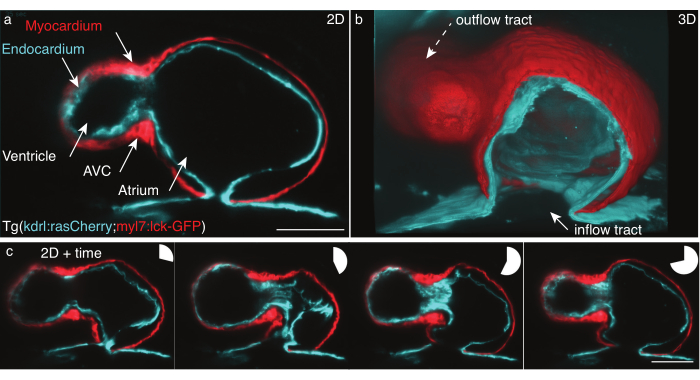
그림 5: 48 hpf 제브라피쉬 심장. (a) 여전히 하나의 z 프레임, 전방 복부 보기48 hpf Tg (kdrl:Hsa.HRAS-mCherry; myl7:lck-EGFP) 제브라피쉬, LSFM으로 이미지, (b) 영화 스택의 3D 재구성, 아트리움을 통해 보기를 잘라. (c) 하나의 z-비행기에서 전체 심장 박동을 통해 네 프레임의 몽타주. 원형 차트는 하트비트 중 시간을 나타냅니다. 배율 막대 50 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
우리는 Tg의 심장을 치는 48 hpf (kdrl:Hsa.HRAS-mCherry; myl7:lck-EGFP) 제브라피쉬 위에 상세한 프로토콜에 따라 기록했습니다 (그림 5). 488 nm와 561 nm 레이저 라이트 시트는 샘플을 동시에 조명했습니다. 방출된 형광은 16x/0.8W 객관적렌즈와 과학금속 산화물 반도체(sCMOS) 카메라를 사용하여 수직으로 검출되었다.
48 hpf에서 심장은 막 반복을 거쳤으며 심실과 아트리움의 두 개의 챔버가 있지만 아직 밸브를 개발하지 못했습니다. 우리의 영화에서, 유입 도, 심실, 대실 운하 (AVC), 아트리움 및 유출 트랙과 같은 다른 심장 구조는 쉽게 구별 할 수 있습니다 (그림 5a, b). 이러한 데이터는 심장의 두 세포 층 사이의 정확한 박동 및 복합성 상호 작용을 보여줍니다: 심근, 단세포 근육 층 수축 및 생성힘 (그림 5c, 빨강), 및 내카르듐, 혈관에 심장을 연결하는 단일 세포 층 (그림 5c, 시안).
x, y,z(3D) + 시간(4D) + 색상(5D)의 심장 박동 재구성은 미켈릿 외.6에 따라 수행되었다. 재건은 두 가지 가설을 기반으로합니다 : 심장의 움직임은 반복적이며 데이터는 작은 z 단계로 획득해야합니다. 출력은 5D로 재구성된 단일 하트비트로, 하트비트당 30GB에서 80GB의 측정입니다. 데이터를 렌더링하기 위해 다차원 데이터 집합을 처리하고 셀 레이어와 개별 레이어(그림 5b)의 5D 동영상을 쉽게 렌더링하도록 설계된 개방형 오픈 소스 도구 FluoRender를 심층 렌더링31에 사용했습니다.
토론
심장을 이미지화하는 트랜스제닉 라인
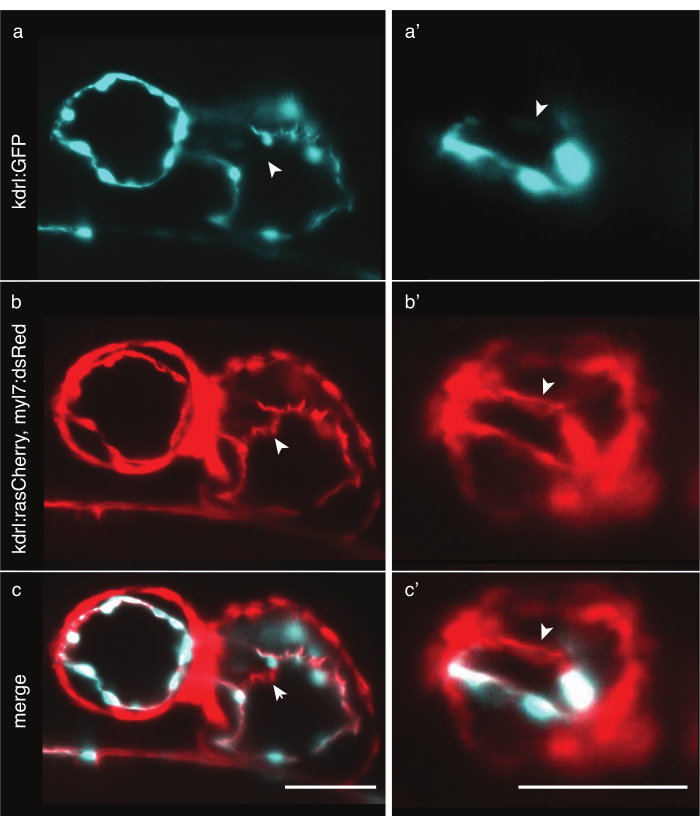
그림 6: 세포질 및 막 마커 제브라피시 형질대사의 비교. LSFM으로 이미지된 48hpf 제브라피쉬 하트의 전방 복부 보기. 흰색 화살표는 멤브레인 마커 형질 대사로만 보이는 구조를 나타냅니다. (a) 심장의 시안및 (a')에서 심실에서 Tg(kdrl:EGFP)32 신호. (b) Tg (kdrl:Hsa.HRAS-mCherry; myl7:dsRed)33 심장에 빨간색신호와 (b') 심실에. (c,c') Tg의 병합 (kdrl:Hsa.HRAS-mCherry; myl7:dsRed) 및 Tg (kdrl:EGFP) 신호. 배율 막대 50 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
얼룩말 심장을 이미징하려면 정확한 심장 세포 라벨링이 필요합니다. 심근 두께는 세포 전체에 걸쳐 상대적으로 일정한 동안, 내막 세포는 핵 의 주위에 두껍지만 얇은 막 돌출이, 2 μm 보다는 더 얇은 몇몇 지구에서. Tg(kdrl:EGFP)32와 같은 세포질 형질선은 내막 핵 주위의 부위를 효과적으로 레이블을 지정하지만, 더 멀리, 얇은 세포질은 짧은 노출 시간으로 검출될 충분한 광자를 방출하지 않을 수 있으며, 이는 데이터에 인공적인 구멍으로 이어진다(도 6a). 대조적으로, Tg(kdrl:Hsa.HRAS-mCherry)와 같은 멤브레인 마커 형질대사(33)는 내카르듐에 효과적으로 라벨을 부착하고 자세한 내용을 밝힐 수 있다(그림 6b,c). 각 실험에 대해 가장 적합한 형질 전환선을 신중하게 선택합니다.
제브라피쉬 고정
고정 기술의 선택은 실험의 길이와 이미지물고기의 나이에 따라 달라집니다. 트리카인은 일반적으로 제브라피시 고정에 사용되어 왔으며, 대부분 사용편의성 때문입니다. 실제로, 단순히 추가 130 물고기 미디어에 mg/L 트리카인 결과 그들의 마취에 10 분. 그것은 발달 결함으로 이끌어 내고 심장 생리학에 영향을 미칠 수 있기 때문에20,22, 우리는 짧은 실험에 대해서만 트리사인을 사용하는 것이 좋습니다 (30 분 미만). 더 긴 이미징을 위해, 1-또는 2 세포 단계에서 α 분가로톡신 mRNA 주사는 심혈관 발달 또는 생리학에 영향을 미치지 않고 최대 3 일 후에 수정 (dpf)까지 물고기를 마비시킵니다.
올바른 FEP 튜브 선택
FEP 튜브는 다양한 직경과 두께로 제공됩니다. 이미지 0-5 dpf 물고기, 0.8 mm는 좋은 내부 직경; 두꺼운 벽 0.8 x 1.6mm 튜브 또는 얇은 벽 0.8 x 1.2 mm 튜브 중 하나를 선택합니다. 얇은 벽으로 둘러싸인 튜브를 추천합니다. 그러나, 두꺼운 벽은 증가 된 안정성과 강성을 제공, 샘플 챔버가 중단하고 얇은 튜브를 이동할 수있는 흐르는 매체가있는 경우 중요 할 수 있습니다. 더 큰 시료의 경우 1.6 x 2.4mm 및 2 x 3mm를 사용할 수 있습니다.
온도 및 가스 교환
제브라피시 배아의 웰빙의 필수적인 측면은 온도입니다. 이상적으로, 환경의 온도가 발달과 심박수34에 영향을 미치기 때문에 이미징하는 동안 물고기를 28.5 °C로 유지하십시오.
우리의 경험에서, 2 % 아가로즈 플러그를 통해 산소 교환은 3-4 dpf까지 안정적인 심박수를 유지합니다. 따라서 튜브의 구멍을 절단하면 산소 확산이 보장됩니다. 또한 원하는 경우 샘플에 약물 전달이 필요할 수 있습니다.
심장 박동의 정지.
적절한 장착 광 시트 현미경의 빠른 획득 속도는 생체 내에서 박동 심장의 기록을 허용합니다. 그러나 방해받지 않는 z 스택을 획득하려면 심장을 느리게 하거나 멈출 수 있습니다. 그러나, 심장을 중지 심장 근육 휴식에 이르게 하 고 심장의 붕괴 발생할 수 있습니다6. 심장 박동 현탁액은 모르폴리노, 저온, 근육 수축 또는 광유전학억제제를 사용하여 수행할 수 있습니다. 이러한 메서드는 각각 단점이 있으며 모든 실험에 대해 신중하게 평가해야 합니다.
한 세포 단계에서 침묵하는 심장(sih) 모르폴리노의 4ng의 주사는 sarcomere formation35에 결정적인 유전자 tnnt2a를 표적으로 하여 심장 박동을 멈출 수 있다35. sih zebrafish는 심장 박동이 없으며 배아가 산소화를 위해 혈액순환에 의존하기 시작할 때 7 dpf까지만 생존합니다. 심장 형태 발생은 유전 및 생체 역학 힘 36에 의해 구동으로, 이 물고기는 3 dpf의 주위에 심장 기형을 현재.
Ca2+의 흐름은 온도에 민감하기 때문에 온도는 배아 제브라피시21의 심박수에 영향을 미칩니다. 따라서 이미징 챔버의 온도를 낮추면 심장 박동이 느려집니다. 심장 박동을 중지하려면 15 °C 이하의 온도가 필요합니다. 제브라피쉬는 보통 28.5°C로 유지되기 때문에, 이러한 저온은 짧은 기간(10분 미만)만 유지할 수 있습니다.
근육 수축의 화학 억제제, 2,3-부-탄데디온 2단축(BDM)과 같은 약물은 제브라피쉬 미디어(50 nM37,38)에 추가되어 일시적으로 심장 박동을 중단할 수 있다. BDM은 15분 이내에 심장 수축을 멈추고 심장 기능을 복원하기 위해 씻을 수 있으므로 사용하기에 편리합니다. 그러나 BDM이 심장 작용 잠재력을 변경함에 따라 주의해서 사용해야 합니다37.
마지막으로, 심근에 있는 채널로독신 또는 할로호독신과 같은 빛 게이트 이온 채널 또는 펌프를 표현하는 형질 전환 제브라피쉬의 심장은 light39,70,40,41,9로 유입되는 관에서 맥박 조정기를 조명하여 조작및 중지할 수 있습니다.
전망
생체 내 제브라피시 심장을 연구하는 최적화된 도구와 솔루션은 초고속 심장 역학의 장기적이고 부드러운 이미징을 허용합니다. 샘플 포함은 공초점 현미경 검사법, 2광자 현미경 검사법 또는 광학 프로젝션 단층 촬영(OPT)과 같은 다양한 이미징 양식에 맞게 조정할 수 있습니다. 그러나 광시트 현미경 검사는 심장의 역학을 포착하기에 충분한 속도로 광학 단면을 제공하는 바람직한 기술일 가능성이 높습니다. 이 프로토콜은 제브라피시 배아 심장 이미징에 초점을 맞추고 있지만, 우리는 또한 다양한 다른 샘플과 실험에 적용 될 수 있다고 생각합니다. 유사한 포함 및 이미징 기술이 심장이 더 숨지고 애벌레가 덜 반투명할 때 개발 중 후기 단계에서도 사용될 수 있다면 미래에 보는 것은 흥미로워질 것입니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
그림 2의 일러스트에 대해 매들린 노이펠트에게 감사드립니다. 이 작품은 막스 플랑크 소사이어티, 모드리지 연구소, 찬 주커버그 이니셔티브, 인간 프론티어 과학 프로그램(HFSP)에 의해 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 1.5mL Eppendorf | Eppendorf | 22364111 | To carry embedded samples |
| 15mL Falcon tubes | Falcon | 352095 | To carry embedded samples |
| 50mL centrifuge tubes | Falcon | 352070 | 50ml tubes for sonication step, and storing cleaned, straightened FEP tubes |
| 50mL syringe | BD | 309654 | 50ml syringe for FEP cleaning |
| Agarose, low gelling temperature | Sigma Aldrich | 39346-81-1 | To make plug |
| Blunt Tip Needles, 21 gauge | VWR | 89500-304 | Blunt end needle for 0.8 inner diameter FEP tube |
| Borosilicate glass tube | McMaster-Carr | 8729K33 | Tubing for FEP tube straightening 9.5mm outer diameter, 5.6 inner diameter, 30cm long, other sizes available |
| Borosilicate glass tube | McMaster-Carr | 8729K31 | Tubing for FEP tube straightening 6.35mm outer diameter, 4mm inner diameter, 30cm long, other sizes available |
| Conventional needles, 21 Gauge | BD | 305165 | Conventional needle for 0.8 inner diameter FEP tube |
| Disposable glass pipette | Grainger | 52NK56 | To transfer fish, use with pipette pump |
| E3 medium for zebrafish embryos | |||
| Ethanol | Sigma Aldrich | 64-17-5 | Ethanol for FEP cleaning |
| FEP tube, 0.8 / 1.2 mm | ProLiquid | 2001048 | FEP tube with thin wall, other sizes available |
| FEP tube, 0.8 / 1.6 mm | Bola | S1815-04 | FEP tube with thick wall, other sizes available |
| FEP tube, 2/3mm | BGB | 211581 | Large FEP tube with thick wall, other sizes available |
| Hot Hand Rubber Mitt | Cole-Parmer | 691000 | To carry hot equipment after autoclaving |
| Omnifix 1mL Syringes | B Braun | 9161406V | 1ml syringe for embedding |
| Petri dish, small | Dot Scientific | PD-94050 | To make agarose plug |
| Pipette pumps | Argos Technologies | 04395-05 | To transfer fish, use with disposable glass pipette |
| PTU | Sigma Aldrich | 103-85-5 | Also known as: N-Phenylthiourea, 1-Phenyl-2-thiourea, Phenylthiocarbamide |
| Razor blades | Azpack | 11904325 | To cut FEP tubes |
| Sodium Hydroxide | Dot Scientific | DSS24000 | NaOH for FEP cleaning |
| Tricaine | Sigma Aldrich | E10521 | Also known as: MS-222, Ethyl 3-aminobenzoate methanesulfonate, Tricaine |
참고문헌
- Hoebe, R. A., et al. Controlled light-exposure microscopy reduces photobleaching and phototoxicity in fluorescence live-cell imaging. Nature Biotechnology. 25 (2), 249-253 (2007).
- Jenielita, M., Taormina, M. J., Delaurier, A., Kimmel, C. B., Parthasarathy, R. Comparing phototoxicity during the development of a zebrafish craniofacial bone using confocal and light sheet fluorescence microscopy techniques. Journal of Biophotonics. 6 (11-12), 920-928 (2013).
- Icha, J., Weber, M., Waters, J. C., Norden, C. Phototoxicity in live fluorescence microscopy, and how to avoid it. BioEssays. 39 (8), 1700003 (2017).
- Reynaud, E. G., Kržič, U., Greger, K., Stelzer, E. H. K. Light sheet-based fluorescence microscopy: more dimensions, more photons, and less photodamage. Human Frontier Science Program Journal. 2 (5), 266-275 (2008).
- Weber, M., Huisken, J. Light sheet microscopy for real-time developmental biology. Current Opinion in Genetics & Development. 21 (5), 566-572 (2011).
- Mickoleit, M., et al. High-resolution reconstruction of the beating zebrafish heart. Nat Methods. 11 (9), 919-922 (2014).
- Arrenberg, A. B., Stainier, D. Y., Baier, H., Huisken, J. Optogenetic control of cardiac function. Science. 330 (6006), 971-974 (2010).
- Trivedi, V., et al. Dynamic structure and protein expression of the live embryonic heart captured by 2-photon light sheet microscopy and retrospective registration. Biomed Optics Express. 6 (6), 2056-2066 (2015).
- Weber, M., Yelon, D., et al. Cell-accurate optical mapping across the entire developing heart. eLife. 6, 28307 (2017).
- Weber, M., Huisken, J. In vivo imaging of cardiac development and function in zebrafish using light sheet microscopy. Swiss Medical Weekly. 145, 14227 (2015).
- Fei, P., et al. Cardiac light-sheet fluorescent microscopy for multi-scale and rapid imaging of architecture and function. Science Reports. 6 (1), 1-12 (2016).
- Felker, A., et al. Continuous addition of progenitors forms the cardiac ventricle in zebrafish. Nature Communication. 9 (1), 1-14 (2018).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. K. Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305 (5686), 1007-1009 (2004).
- Keller, P. J., Pampaloni, F., Stelzer, E. H. Life sciences require the third dimension. Current Opinion in Cell Biology. 18 (1), 117-124 (2006).
- Keller, P. J., Schmidt, A. D., Wittbrodt, J., Stelzer, E. H. K. Reconstruction of zebrafish early embryonic development by scanned light sheet microscopy. Science. 322 (5904), 1065-1069 (2008).
- Weber, M., Mickoleit, M., Huisken, J. Multilayer mounting for long-term light sheet microscopy of zebrafish. Journal of Visualized Experiments. (84), e51119 (2014).
- Berndt, F., Shah, G., Power, R. M., Brugués, J., Huisken, J. Dynamic and non-contact 3D sample rotation for microscopy. Nature Communications. 9 (1), 1-7 (2018).
- Daetwyler, S., Günther, U., Modes, C. D., Harrington, K., Huisken, J. Multi-sample SPIM image acquisition, processing. and analysis of vascular growth in zebrafish. Development. , 173757 (2019).
- Keomanee-Dizon, K., Fraser, S. E., Truong, T. V. A versatile, multi-laser twin-microscope system for light-sheet imaging. Review of Scientific Instruments. 91 (5), 053703 (2020).
- Kaufmann, A., Mickoleit, M., Weber, M., Huisken, J. Multilayer mounting enables long-term imaging of zebrafish development in a light sheet microscope. Development. 139 (17), 3242-3247 (2012).
- Gierten, J., et al. Automated high-throughput heartbeat quantification in medaka and zebrafish embryos under physiological conditions. Science Reports. 10 (1), 1-12 (2020).
- Swinburne, I. A., Mosaliganti, K. R., Green, A. A., Megason, S. G. Improved long-term imaging of embryos with genetically encoded α-bungarotoxin. PLOS ONE. 10 (8), 0134005-0134015 (2015).
- Taylor, J. M., et al. Adaptive prospective optical gating enables day-long 3D time-lapse imaging of the beating embryonic zebrafish heart. Nature Communication. 10 (1), 1-15 (2019).
- Power, R. M., Huisken, J. A guide to light-sheet fluorescence microscopy for multiscale imaging. Nature Methods. 14 (4), 360-373 (2017).
- Nüsslein-Volhard, C., Dahm, R. . Zebrafish: A Practical Approach. , (2002).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: An introduction. Journal of Visualized Experiments. (69), e4196 (2012).
- Cold Spring Harbor. E3 medium (for zebrafish embryos). Cold Spring Harbor Protocols. 2011, 66449 (2011).
- Yuan, S., Sun, Z. Microinjection of mRNA and morpholino antisense oligonucleotides in zebrafish embryos. Journal of Visualized Experiments. (27), e1113 (2009).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529 (2017).
- Jin, S. -. W., Beis, D., Mitchell, T., Chen, J. -. N., Stainier, D. Y. Cellular and molecular analyses of vascular tube and lumen formation in zebrafish. Development. 132 (23), 5199-5209 (2005).
- Chi, N. C., et al. Foxn4 directly regulates tbx2b expression and atrioventricular canal formation. Genes and Development. 22 (6), 734-739 (2008).
- Scott, G. R., Johnston, I. A. Temperature during embryonic development has persistent effects on thermal acclimation capacity in zebrafish. Proceedings of the National Academy of Sciences. 109 (35), 14247-14252 (2012).
- Sehnert, A. J., et al. Cardiac troponin T is essential in sarcomere assembly and cardiac contractility. Nature Genetics. 31 (1), 106-110 (2002).
- Sidhwani, P., Yelon, D., Wellik, D. M. Fluid forces shape the embryonic heart: Insights from zebrafish. Current Topics in Developmental Biology. 132, 395-416 (2019).
- Jou, C. J., Spitzer, K. W., Tristani-Firouzi, M. Blebbistatin effectively uncouples the excitation-contraction process in zebrafish embryonic heart. Cell Physiology and Biochemistry. 25 (4-5), 419-424 (2010).
- Chow, R. W. -. Y., Lamperti, P., Steed, E., Boselli, F., Vermot, J. following endocardial tissue movements via cell photoconversion in the zebrafish embryo. Journal of Visualized Experiments. (132), e57290 (2018).
- Nagel, G., et al. Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. Proccedings of the National Academy of Sciences. 100 (24), 13940-13945 (2003).
- Knollmann, B. C. Pacing lightly: optogenetics gets to the heart. Nature Methods. 7 (11), 889-891 (2010).
- Bruegmann, T., et al. Optogenetic control of heart muscle in vitro and in vivo. Nature Methods. 7 (11), 897-900 (2010).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유