Method Article
ゼブラフィッシュ胚における高速心臓ダイナミクスの光シート顕微鏡
要約
光シート蛍光顕微鏡で 生体内 のゼブラフィッシュの心臓を研究するための最適化されたツールについて説明します。具体的には、明るい心臓トランスジェニックラインを提案し、発達および心臓の欠陥を回避する新しい穏やかな埋め込みおよび固定化技術を提示する。また、心臓画像に適合したデータ取得および分析パイプラインも提供されています。
要約
胚性心臓研究は、 生体内 光シート蛍光顕微鏡(LSFM)における急速な進歩の恩恵を大きく受けています。急速な外部発達、難解な遺伝学、ゼブラフィッシュの半透明性と組み合 わせることで、LSFMは重要な光毒性や光漂白を伴うことなく、高い空間的および時間的解像度で心臓の形態および機能に関する洞察を提供しました。心臓を打つイメージングは、既存のサンプル調製および顕微鏡技術に挑戦する。1つは、狭い視野で健康的なサンプルを維持し、ハートビートを解決するために超高速画像を取得する必要があります。ここでは 、生体内のゼブラフィッシュの心臓を研究するための最適化されたツールとソリューションについて説明します。心臓成分の標識に対する明るいトランスジェニックラインの応用を実証し、発達上の欠陥や心拍数の変化を避ける新しい優しい埋め込み・固定化技術を提示する。また、心臓画像に適合したデータ取得・解析パイプラインも提案する。ここで示すワークフロー全体は、ゼブラフィッシュ胚性心臓イメージングに焦点を当てていますが、他の様々なサンプルや実験にも適用できます。
概要
初期の鼓動心臓における複雑な事象および相互作用を明らかにするために、全器官のインビボイメージングが必要である。その最小の光毒性1、2、3、低い光漂白4、および高速、軽板顕微鏡は胚および心臓発達のための主要な画像化具として進化した5,6。これは、高い空間的および時間的解像度で心臓の形態と機能に関する洞察を提供し、研究者が高速で心臓の蛍光標識部分を画像化し、追跡し、血行力を研究し、発達中の胚の体内で直接心臓の発達に従うことを可能にしました6,10,11,12。
ゼブラフィッシュを正確かつ再現的に視野に入れることで、ライトシート用の様々な埋め込みプロトコルが短期的および長期的に存在し、単一または複数サンプル13、14、15、16、17、18,18,19が存在します。最も一般的なプロトコルは、トリケーヌの固定化とガラスまたはプラスチックチューブ内のアガロースの取り付けが含まれます。しかし、温度、麻酔薬、埋め込み材料などにより心拍数が変化する可能性があるため、ゼブラフィッシュの心臓イメージングには、サンプルの健康を確保するための特定の穏やかなプロトコルが必要です6,8,11,12,20,21,22,23.短期間のイメージング(1時間まで)のために、130 mg/Lトリケーヌで魚を麻酔し、0.1%アガロース溶液およびプラグを有するフッ素化エチレンプロピレン(FEP)チューブに埋め込むことができる。しかし、トリケーヌは発達上の欠陥を引き起こす可能性があります20,22、異なるプロトコルは、長期的なイメージングのために使用する必要があります。
ここでは、長期の心臓イメージングのための新しい戦略について説明します。多くのライトシート実装は24に存在しますが、T-SPIM顕微鏡で吊り下げサンプルを使用することをお勧めします(1つの検出レンズと、サンプルが共通の焦点で垂直にぶら下がっている水平面の2つの照明レンズ)。これにより、正確なサンプルの位置に必要な移動と回転の自由度が与えます。魚は、1つまたは2つの細胞段階で30pg α-bungarotoxin mRNAを注入することによって固定化される。α-ブンガロトキシンは、心血管の発達や生理学に影響を与えることなく筋肉を麻痺させるヘビ毒です22.正確で歪みのないイメージングでは、水とほぼ同じ屈折率を持つポリマーであるFEP製のチューブに魚を取り付けることをお勧めします。イメージングの前に、FEPチューブを矯正し、洗浄して最適な準備をする方法について説明します。その後、魚はこれらのチューブに取り付けられ、頭を下げてメディアに入れ、チューブの底部は魚の頭が休む2%のアガロースプラグで密封されます。FEPチューブの切断穴はガス交換を促進し、魚の成長を保証します。埋め込まれた魚は、イメージングの直前にサンプルホルダーに取り付けられるまで、メディアに保管することができます。また、再現性の高い高速イメージングのためのデータ取得と解析パイプラインも提案します。さらに、強固な心臓細胞標識のための細胞質対膜マーカートランスジェニックラインの使用、ならびに心臓を停止するためのさまざまな選択肢について議論する。これらの取り付け技術は、サンプルの健康を確保しながら、視野の中で正確かつ再現的に心臓を制約することを可能にする。
プロトコル
すべてのゼブラフィッシュ(Danio rerio)の成人および胚は、UW-マディソン制度動物の世話と使用委員会(IACUC)によって承認されたプロトコルに従って処理されました。
1. ゼブラフィッシュの準備
- 確立されたプロトコル25,26と制度的ガイドラインに従ってゼブラフィッシュを扱う。目的のトランスジェニックラインの成魚を繁殖させる(議論参照)。胚を収集し、魚媒体、例えば、E327で満たされたペトリ皿で28°Cでそれらを保ちます。
- 固定化の方法を選択します(説明を参照)。
- α-bungarotoxin mRNAを使用して魚を固定化する場合は、マイクロマニピュレータに取り付けられ、ピコインジェクター28に接続されたボアガラス針を使用して、1つまたは2つの細胞段階胚の黄身に30pg mRNA22を注入します。
- トリケーヌを使用する場合は、0.4%のストック溶液を1 M TrisベースでpH 7.0-7.4にバッファリングし、イメージングまで-20°Cで保存します。
- 28°CでE3充填ペトリ皿に卵を保管し、イメージングまで新鮮なE3で新しい料理に24時間ごとに卵を転送します。
- 色素形成を防ぐために、ゼブラフィッシュの背景がアルビノでない場合、0.2 mMチロシナーゼ阻害剤1-フェニル2-チオ尿素を有する新しいE3皿に24時間受精(hpf)で魚を移す(議論参照)。
2. FEPチューブの製造
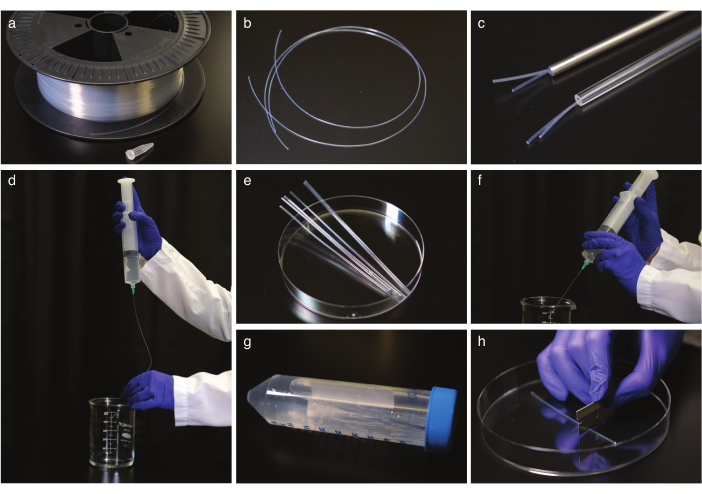
図1:ケーブルドラム上のFEPチューブのクリーニングと矯正。(b) 矯正前のFEPチューブ。(c) ガラスおよび鋼製オートクレーブ安全チューブ中の FEP チューブ。(d) 矯正後のFEPチューブのフラッシングと冷却。(e)FEPチューブは、超音波処理のための遠心分離管のサイズにカット。(f)超音波処理後のFEPチューブのフラッシング。(g) 遠心管内の洗浄および矯正されたFEPチューブの貯蔵。(h) イメージングの前にFEPチューブを切断する。この図の大きなバージョンを表示するには、ここをクリックしてください。
- FEPチューブ(図1a,b)を、通常1.6または2.4mmのFEPチューブに合わせて正しい内径のガラスまたはスチール製のオートクレーブセーフチューブ(図1c)に入れ、オートクレーブを2時間180°Cにします。チューブを室温で少なくとも5時間冷まします。次に、矯正チューブから取り出します。
メモ:チューブを操作する際は手袋を使用し、一度に50cmのチューブで作業してください。 - FEPチューブをクリーニングします。
注:内側のFEPチューブサイズの鈍い針の先端を持つ注射器は、安全性のために推奨されますが、通常の針が動作します。- 50 mL のシリンジで 1 M NaOH でチューブを 2 回洗い流します(図 1d)。
- FEPチューブをカミソリの刃で50 mL遠心分離管の大きさに切り、0.5 M NaOH充填遠心管にカットチューブを入れ、10分間超音波処理します。
- FEPチューブを二重蒸留H2Oで洗い流し、70%エタノールでフラッシングを繰り返します(図1f)。
- チューブを70%エタノールに移し、超音波処理を10分間行います。
- チューブを二重蒸留H2Oで洗い流し、二重蒸留H2Oで遠心管に入れて保管します(図1g)。
3. 2%アガロース皿の作製
- ガラスフラスコに、低融点アガロース粉末をE3に溶かします。溶液を電子レンジで加熱し、すべての粉末が溶解するまで20sごとに攪拌します。
- ガラスやプラスチックペトリ皿にアガロースを注ぎ、1〜2mmのコートを作ります。アガロースが固まるまで待ちます。
- 保存するには、乾燥を防ぐために寒天の上にE3を静かに注ぎます。パラフィンフィルムで包み、4°Cに保ちます。
4. 埋め込みメディアの準備
- サンプルチャンバーを満たすのに十分なE3を準備します。
注:メディアが対物レンズに接触している場合は、メチルブルーの使用は避けてください。 - トリケーヌを使用する場合, 解凍ストック溶液と E3 に 0.02% トリケーヌを追加.
5. サンプル取り付け
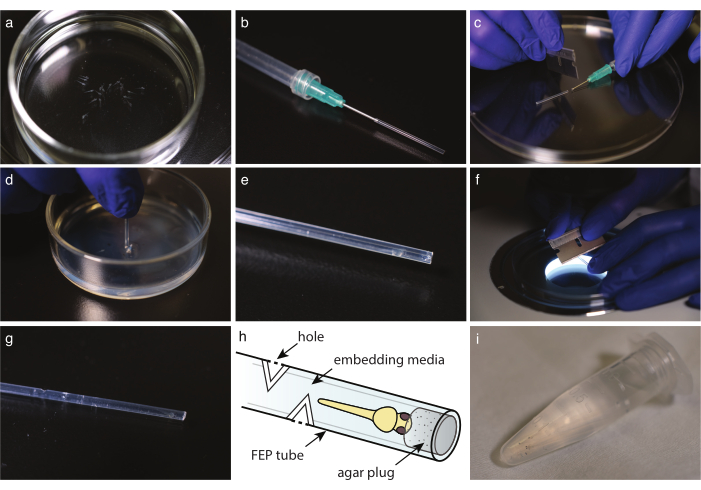
図2:FEPチューブ中の胚取り付け. (a)取り付け培地中の麻酔付き顔料を含まない魚。(b) 鈍い端針とFEPチューブが付いているシリンジ。(c)FEPチューブにメディアや魚を取り込んだら、針の端でチューブを切ります。(d) カットチューブを2%アガロースでコーティングされた皿に浸漬し、その端を差し込む。(e) 差し込み FEP チューブに入ったゼブラフィッシュ。(f) FEPチューブを30°に軽く切って、ガス交換穴を作ります。(g) 埋め込まれたゼブラフィッシュの上に4つの穴を持つFEPチューブ。(h) FEPチューブに埋め込まれたゼブラフィッシュのスキーム。穴と寒天プラグが示されています。(i) 複数の組み込みゼブラフィッシュをイメージングする準備が整いました。 この図の大きなバージョンを表示するには、ここをクリックしてください。
- 使い捨てガラスピペットで、魚を埋め込み培地に移します(図2a)。トリケーヌを使用する場合は、イメージングの10分前にトリケーヌ含有E3を充填したペトリ皿に魚を移します。どちらの場合も、実体顕微鏡で見て、魚が動かなくなったこと、およびコントロールと比較して心臓が同じような速度で鼓動していることを確認します。
- FEPチューブをカミソリの刃で理想的な長さに切ります(図1h)。
メモ:長さは顕微鏡のサンプルホルダーに合わせて調整する必要があります。典型的な長さは約3cmです。 - 鈍いエンドカニューレで注射器を準備します。注射器に空気を入れ、FEPチューブを針に取り付け、残りの水をシリンジを空にして静かに洗い流します(図2b)。
注:ゆっくりと空気を洗い流すことによって、泡を作ることを避けてください。 - 注射器を取り付けたFEPチューブで、まず、FEPチューブを満たすためにメディアを取り、次に胚の頭を下に取り上げる。できるだけチューブの端に近い魚の頭を保ちます。泡を作らないようにしてください。バブルが存在する場合は、サンプルを破棄します。
- カミソリの刃で、鈍い端のカニューレまたは針の端で慎重にFEPチューブを切ります(図2c)。
- 寒天コーティングされた皿の上に液体を捨てます。FEPチューブを寒天にまっすぐ突き刺します(図2d)。チューブを回転させ、それを取り出してアガロースのベッドからプラグを外します。
- ステレオスコープの下で、チューブの端にある寒天プラグの存在を確認します(図2e)。
- 長期イメージングの場合、魚の端部から少なくとも5mm上の各基方向のFEPチューブに3〜5個の穴を切断する。
- ステレオスコープの下で、取り付け媒体に到達するまでFEPチューブに30°切開を作るために管の軸に垂直なカミソリの刃を使用する(図2f)。
- 180度で2回目のカットを行い、穴を作ります(図2g,h)。
- 取り付けられた胚は、画像に準備ができるまで、埋め込みメディアを備えた1.5 mLマイクロ遠心分離チューブに下向きに取り付けられました(図2i)。
6. サンプル位置決め

図3:サンプルチャンバ(a)FEPチューブをサンプルホルダーに取り付けた。(b) 段階と目的を持つサンプルチャンバー。(c) T-SPIM構成における照明および検出目的を有する、媒体充填サンプルチャンバのトップビュー。(d)サンプルホルダーは、チャンバー内のサンプルで、顕微鏡に取り付けられています。この図の大きなバージョンを表示するには、ここをクリックしてください。
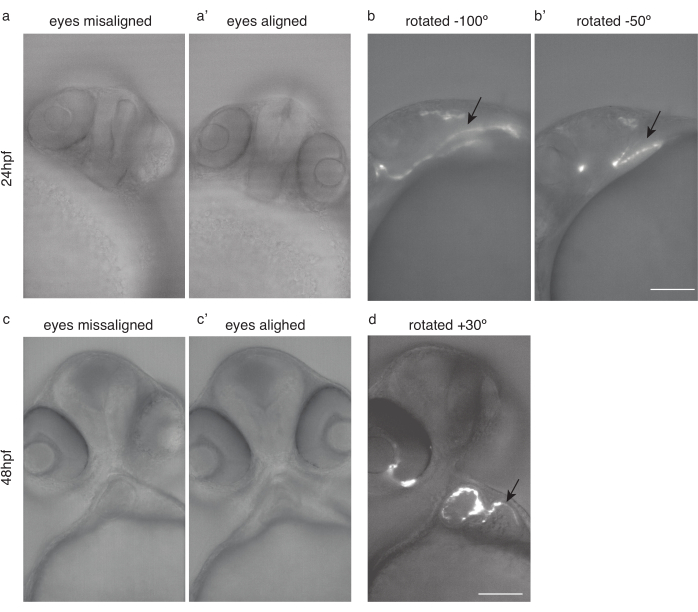
図4:心臓イメージングのための胚の位置決め。 (a)24 hpf Tg(kdrl:Hsa.HRAS-mCherry)ゼブラフィッシュの目がずれている。(a')同じ魚、目を揃えて。(b)同じ魚が-100°および(b')-50°回転し、最適な心臓イメージングを行った。(c)48 hpf目がずれているゼブラフィッシュ。(c')同じ魚、目を揃えて。(d) 最適な心臓イメージングのために同じ魚を30°回転させた。黒い矢印がハートを指しています。スケールバー100 μm. この図の大きなバージョンを表示するには、ここをクリックしてください。
- 顕微鏡では、FEPチューブをサンプルホルダー(図3a)に取り付け、埋め込み媒体(図3b,c)でイメージングチャンバーを充填します。次に、サンプルホルダーをチャンバーに浸したステージに置きます(図3d)。
- サンプルの正常性を確認します。特定の心拍数はステージと温度に依存するため、非取り付け対照魚と比較して、全体的な魚のウェルネスを評価するために心拍数を視覚的に評価します。ハートビートが遅すぎる場合は、魚を捨てます。
注:胚の穏やかな取り扱い、埋め込みメディアへの慎重な転送、埋め込み直後のイメージング、急激な温度変化の回避、トリケーヌの回避、トリケーヌへの暴露時間の短縮を確保してください。 - 再現可能なイメージングでは、常に同じサンプル位置を使用してください。目を合わせ、画像を斜めに配置することをお勧めします。
- 両方の目(図4a,c)が焦点面に入るように魚を回転させます(図4a',c')
- その位置から、さらに24 hpfイメージング(図4b、b')のために約50°-100°時計回りに魚を回転させ、48 hpfイメージングのために約20°-30°反時計回りに回転させます(図4d)。
注:初期の心臓は、30 hpfより前に、隠された位置のためにイメージするのが難しい場合があります(図4b)。
7. 画像取得
- 最高の画質を与え、すべての魚にレーザーパワーを適応させる照明側を選択してください。
メモ:後続の画像解析に使用するレーザーパワーを記録します。 - 各 Z プレーンで、4 ~ 5 回のハートビートを 300 フレーム/秒 (fps) 以上で録音します。
注: 視野は、取得速度を上げるためにトリミングすることができます。例えば、48 hpfではゼブラフィッシュの心臓は毎秒2〜3回拍動するため、300fpsでは、300〜600フレームの間で4〜6回の心拍を獲得する必要があります。 - 鼓動の心臓を記録するには、サンプルをライトシートをステップワイズで移動します。心臓の深さ全体をカバーする1~2μmのZ間隔を使用します。
8. 画像処理
- 記録されたムービーを同期して、フィジー(イメージJ229,30)プラグインを使用して4D(x、y、z、時間)の心臓を再構築する6。
- データを探索し、レンダリングされたゼブラフィッシュの心臓のムービーを生成するには、3D レンダリング ソフトウェアに 4D ファイル (x、y、z、time) をロードします。
結果
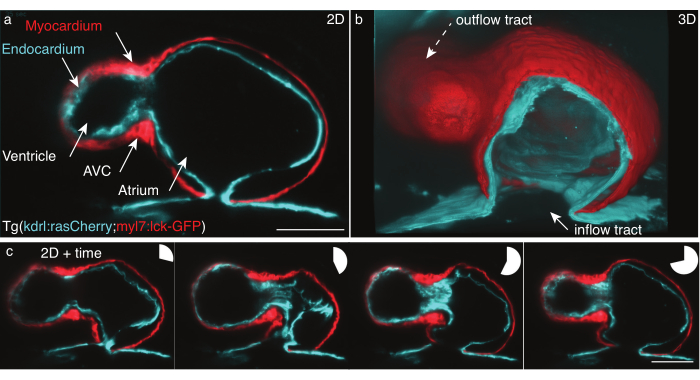
図5:48hpfゼブラフィッシュ心臓。 (a)まだ1つの zフレームの前腹側ビュー48 hpf Tg(kdrl:Hsa.HRAS-mCherry;myl7:lck-EGFP)ゼブラフィッシュは、LSFMで撮影され、(b)映画スタックの3D再構築は、アトリウムを通してビューをカットします。(c) 1つのz面での完全な心拍上の4フレームのモンタージュ。円グラフは、ハートビートの時間を示します。スケールバー50 μm. この図の大きなバージョンを表示するには、ここをクリックしてください。
上記のプロトコルに従ってTg(kdrl:Hsa.HRAS-mCherry;myl7:lck-EGFP)ゼブラフィッシュの48 hpf拍動心臓を記録しました(図5)。488 nmと561 nmのレーザー光シートが同時にサンプルを照らしました。放射された蛍光は、16x/0.8W対物レンズと、科学的金属酸化物半導体(sCMOS)カメラを用いて垂直に検出された。
48 hpfでは、心臓はループを受けたばかりで、心室と心房の2つのチャンバーを持っていますが、まだバルブを開発していません。我々の映画では、流路、心室、房室管(AVC)、心房、および流出トラックなどの異なる心臓構造は容易に識別可能である(図5a、b)。これらのデータは、心臓の2つの細胞層(心筋、単細胞筋層収縮および生成力(図5c、赤)、および心臓を血管系に接続する単一細胞層である心内膜(図5c、シアン)の間の正確な鼓動を示し、複雑な相互作用を明らかにする。
X,y,z(3D)+時間(4D)+色(5D)の心拍再建を、ミコリットららによって行った。再構築は2つの仮説に基づいています:心臓の動きは繰り返しであり、データは小さなzステップで取得する必要があります。出力は、5Dで再構築された単一のハートビートで、ハートビートあたり30 GB〜80 GBを測定します。データをレンダリングするために、多次元データセットを処理し、セルレイヤーと個々のレイヤーの両方の5Dムービーを簡単にレンダリングするように設計された、レンダリング31 の自由なオープンソースツールFluoRenderを使用しました(図5b)。
ディスカッション
心臓をイメージするトランスジェニックライン
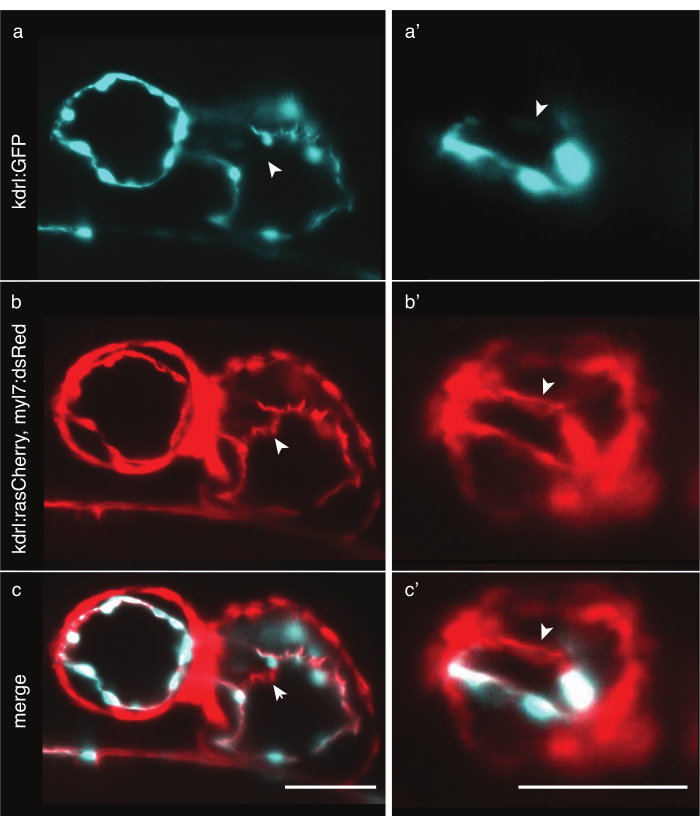
図6:細胞質マーカーと膜マーカーゼブラフィッシュトランスジェニックラインの比較。 LSFMで画像化された48hpfゼブラフィッシュの心臓の前腹側図。白い矢印は、膜マーカートランスジェニックラインでのみ見える構造を示しています。(a) Tg(kdrl:EGFP)32 シグナルは、心のシアンと(a')心室での。(b) Tg(kdrl:Hsa.HRAS-mCherry; myl7:dsRed)33 シグナルは心臓に赤、(b')心室で。( c,c')Tg(kdrl:Hsa.HRAS-mCherry;myl7:dsRed)とTg(kdrl:EGFP)信号の両方のマージ。スケールバー50 μm. この図の大きなバージョンを表示するには、ここをクリックしてください。
ゼブラフィッシュの心臓をイメージングするには、正確な心臓細胞標識が必要です。心筋の厚さは細胞全体で比較的一定であるが、心筋細胞は核の周りに厚いが、薄い膜突起を有する、いくつかの領域では2μmよりも薄い。Tg(kdrl:EGFP)32のような細胞質トランスジェニックラインは、心内膜核の周りの領域に効果的にラベルを付けますが、さらに遠く、薄い細胞質がそのような短い暴露時間で検出されるのに十分な光子を放出しないことがあります(図6a)。対照的に、Tg(kdrl:Hsa.HRAS-mCherry)33のような膜マーカートランスジェニックラインは、効果的に心内膜にラベルを付け、より詳細を明らかにすることができます(図6b,c)。各実験に対して、最も適切なトランスジェニックラインを慎重に選択します。
ゼブラフィッシュの固定化
固定化技術の選択は、実験の長さと画像に魚の年齢に依存します。トリケーヌは、ゼブラフィッシュの固定化に一般的に使用されています, 主にその使いやすさのために.実際に, 単に魚のメディアに 130 mg/L トリカインを追加すると、その麻酔で 10 分.発達障害を引き起こし、心臓生理学20,22に影響を与える可能性があるので、短い実験(30分未満)にのみトリカインを使用することをお勧めします。より長いイメージングのために、1または2細胞段階でのα-バンガロトキシンmRNA注射は、心血管の発達または生理学に影響を与えることなく、受精後3日(dpf)まで魚を麻痺させる22。
適切な FEP チューブの選択
FEPの管はさまざまな直径および厚さで利用できる。イメージ0-5 dpf魚に、0.8ミリメートルは良い内径です。厚い壁0.8 x 1.6 mmチューブまたは薄い壁0.8 x 1.2 mmチューブのいずれかを選択してください。薄肉のチューブをお勧めします。しかし、厚い壁は、サンプルチャンバーが中断し、薄いチューブを移動する可能性のある流れる媒体を持っている場合に重要な高い安定性と剛性を提供します。より大きなサンプルの場合、1.6 x 2.4 mmおよび2 x 3 mmを使用できます。
温度とガス交換
ゼブラフィッシュ胚の幸福の本質的な側面は温度です。理想的には、環境の温度が発達と心拍数34に影響を与えるため、イメージング中に魚を28.5 °Cに保ちます。
我々の経験では、2%アガロースプラグを介した酸素交換は3-4 dpfまで安定した心拍数を維持するだけである。そのため、チューブに穴を切断することで酸素拡散が保証されます。また、必要に応じてサンプルへのドラッグデリバリーが必要な場合もあります。
ハートビートの中断。
適切に装備された軽シート顕微鏡の速い獲得速度は 、生体内の鼓動心臓の記録を可能にする。しかし、邪魔されないzスタックを獲得するために、心臓を減速または停止させることができます。しかし、心臓を停止すると心臓の筋肉の弛緩につながり、心臓の崩壊につながる可能性があります6。心拍懸濁は、モルフォリノ、低温、筋肉収縮または光遺伝学の阻害剤を使用して行うことができる。これらの方法にはそれぞれの欠点があり、実験ごとに慎重に評価する必要があります。
1つの細胞段階で のサイレント心臓(sih) モルフォリーノの4ngの注入は、サルコメア形成に重要な遺伝子 tnnt2a を標的とすることによって心拍を止めることができる35。 sih ゼブラフィッシュは心拍を持っていないし、胚が酸素化のために循環血液に依存し始めるとき、唯一の7 dpfまで生き残る。心臓形態形成は遺伝的および生体力の両方によって駆動される36として、これらの魚は3dpfの周りに心臓奇形を提示する。
Ca2+の流れは温度に敏感であるため、温度は胚性ゼブラフィッシュ21の心拍数に影響を与えます。その結果、撮像チャンバー内の温度を下げると、心拍が遅くなります。心拍を止めるには15°C以下の温度が必要です。 ゼブラフィッシュは通常28.5 °Cに保たれ、そのような低温は短い期間(10分未満)しか維持できません。
筋肉収縮の化学的阻害剤などの薬剤は、2,3-ブタンジオン2-モノキシム(BDM)、ゼブラフィッシュ培地(50 nM37,38)に加え、心拍を一時的に中断することができる。BDMは、心臓の収縮を15分以内に止め、心臓機能を回復させるために洗い流すことができるので、使用するのに便利です。しかし、BDMは心臓行動の可能性を変えるため、注意37と共に使用しなければならない。
最後に、心筋の中のチャネルロドプシンやハロロドプシンなどの光ゲートイオンチャネルまたはポンプを発現するトランスジェニックゼブラフィッシュの心臓部は、流入路のペースメーカーをlight39,7,40,41,9で照らして操作し、停止することができます。
前途
提示された最適化されたツールとソリューションは 、生体内の ゼブラフィッシュの心臓を研究するために、超高速心臓ダイナミクスの長期的で穏やかなイメージングを可能にします。サンプル埋め込みは、共焦点顕微鏡、2光子顕微鏡、または光学投影断層撮影(OPT)などの異なるイメージングモダリティに合わせて適合させることができます。しかし、ライトシート顕微鏡は、心臓のダイナミクスを捉えるのに十分な速度で光学的断面を提供する好ましい技術である可能性が高い。このプロトコルはゼブラフィッシュ胚性心臓イメージングに焦点を当てていますが、他の様々なサンプルや実験にも適用できると考えています。心臓がより隠れて幼虫が半透明でない開発中に、同様の埋め込み技術やイメージング技術を後の段階でも使用できるかどうかは、将来的に興味深いでしょう。
開示事項
著者らは開示するものは何もない。
謝辞
図2のマデリン・ノイフェルトのイラストに感謝します。この研究は、マックス・プランク・ソサエティ、モーグリッジ研究所、チャン・ザッカーバーグ・イニシアチブ、ヒューマン・フロンティア・サイエンス・プログラム(HFSP)によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 1.5mL Eppendorf | Eppendorf | 22364111 | To carry embedded samples |
| 15mL Falcon tubes | Falcon | 352095 | To carry embedded samples |
| 50mL centrifuge tubes | Falcon | 352070 | 50ml tubes for sonication step, and storing cleaned, straightened FEP tubes |
| 50mL syringe | BD | 309654 | 50ml syringe for FEP cleaning |
| Agarose, low gelling temperature | Sigma Aldrich | 39346-81-1 | To make plug |
| Blunt Tip Needles, 21 gauge | VWR | 89500-304 | Blunt end needle for 0.8 inner diameter FEP tube |
| Borosilicate glass tube | McMaster-Carr | 8729K33 | Tubing for FEP tube straightening 9.5mm outer diameter, 5.6 inner diameter, 30cm long, other sizes available |
| Borosilicate glass tube | McMaster-Carr | 8729K31 | Tubing for FEP tube straightening 6.35mm outer diameter, 4mm inner diameter, 30cm long, other sizes available |
| Conventional needles, 21 Gauge | BD | 305165 | Conventional needle for 0.8 inner diameter FEP tube |
| Disposable glass pipette | Grainger | 52NK56 | To transfer fish, use with pipette pump |
| E3 medium for zebrafish embryos | |||
| Ethanol | Sigma Aldrich | 64-17-5 | Ethanol for FEP cleaning |
| FEP tube, 0.8 / 1.2 mm | ProLiquid | 2001048 | FEP tube with thin wall, other sizes available |
| FEP tube, 0.8 / 1.6 mm | Bola | S1815-04 | FEP tube with thick wall, other sizes available |
| FEP tube, 2/3mm | BGB | 211581 | Large FEP tube with thick wall, other sizes available |
| Hot Hand Rubber Mitt | Cole-Parmer | 691000 | To carry hot equipment after autoclaving |
| Omnifix 1mL Syringes | B Braun | 9161406V | 1ml syringe for embedding |
| Petri dish, small | Dot Scientific | PD-94050 | To make agarose plug |
| Pipette pumps | Argos Technologies | 04395-05 | To transfer fish, use with disposable glass pipette |
| PTU | Sigma Aldrich | 103-85-5 | Also known as: N-Phenylthiourea, 1-Phenyl-2-thiourea, Phenylthiocarbamide |
| Razor blades | Azpack | 11904325 | To cut FEP tubes |
| Sodium Hydroxide | Dot Scientific | DSS24000 | NaOH for FEP cleaning |
| Tricaine | Sigma Aldrich | E10521 | Also known as: MS-222, Ethyl 3-aminobenzoate methanesulfonate, Tricaine |
参考文献
- Hoebe, R. A., et al. Controlled light-exposure microscopy reduces photobleaching and phototoxicity in fluorescence live-cell imaging. Nature Biotechnology. 25 (2), 249-253 (2007).
- Jenielita, M., Taormina, M. J., Delaurier, A., Kimmel, C. B., Parthasarathy, R. Comparing phototoxicity during the development of a zebrafish craniofacial bone using confocal and light sheet fluorescence microscopy techniques. Journal of Biophotonics. 6 (11-12), 920-928 (2013).
- Icha, J., Weber, M., Waters, J. C., Norden, C. Phototoxicity in live fluorescence microscopy, and how to avoid it. BioEssays. 39 (8), 1700003 (2017).
- Reynaud, E. G., Kržič, U., Greger, K., Stelzer, E. H. K. Light sheet-based fluorescence microscopy: more dimensions, more photons, and less photodamage. Human Frontier Science Program Journal. 2 (5), 266-275 (2008).
- Weber, M., Huisken, J. Light sheet microscopy for real-time developmental biology. Current Opinion in Genetics & Development. 21 (5), 566-572 (2011).
- Mickoleit, M., et al. High-resolution reconstruction of the beating zebrafish heart. Nat Methods. 11 (9), 919-922 (2014).
- Arrenberg, A. B., Stainier, D. Y., Baier, H., Huisken, J. Optogenetic control of cardiac function. Science. 330 (6006), 971-974 (2010).
- Trivedi, V., et al. Dynamic structure and protein expression of the live embryonic heart captured by 2-photon light sheet microscopy and retrospective registration. Biomed Optics Express. 6 (6), 2056-2066 (2015).
- Weber, M., Yelon, D., et al. Cell-accurate optical mapping across the entire developing heart. eLife. 6, 28307 (2017).
- Weber, M., Huisken, J. In vivo imaging of cardiac development and function in zebrafish using light sheet microscopy. Swiss Medical Weekly. 145, 14227 (2015).
- Fei, P., et al. Cardiac light-sheet fluorescent microscopy for multi-scale and rapid imaging of architecture and function. Science Reports. 6 (1), 1-12 (2016).
- Felker, A., et al. Continuous addition of progenitors forms the cardiac ventricle in zebrafish. Nature Communication. 9 (1), 1-14 (2018).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. K. Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305 (5686), 1007-1009 (2004).
- Keller, P. J., Pampaloni, F., Stelzer, E. H. Life sciences require the third dimension. Current Opinion in Cell Biology. 18 (1), 117-124 (2006).
- Keller, P. J., Schmidt, A. D., Wittbrodt, J., Stelzer, E. H. K. Reconstruction of zebrafish early embryonic development by scanned light sheet microscopy. Science. 322 (5904), 1065-1069 (2008).
- Weber, M., Mickoleit, M., Huisken, J. Multilayer mounting for long-term light sheet microscopy of zebrafish. Journal of Visualized Experiments. (84), e51119 (2014).
- Berndt, F., Shah, G., Power, R. M., Brugués, J., Huisken, J. Dynamic and non-contact 3D sample rotation for microscopy. Nature Communications. 9 (1), 1-7 (2018).
- Daetwyler, S., Günther, U., Modes, C. D., Harrington, K., Huisken, J. Multi-sample SPIM image acquisition, processing. and analysis of vascular growth in zebrafish. Development. , 173757 (2019).
- Keomanee-Dizon, K., Fraser, S. E., Truong, T. V. A versatile, multi-laser twin-microscope system for light-sheet imaging. Review of Scientific Instruments. 91 (5), 053703 (2020).
- Kaufmann, A., Mickoleit, M., Weber, M., Huisken, J. Multilayer mounting enables long-term imaging of zebrafish development in a light sheet microscope. Development. 139 (17), 3242-3247 (2012).
- Gierten, J., et al. Automated high-throughput heartbeat quantification in medaka and zebrafish embryos under physiological conditions. Science Reports. 10 (1), 1-12 (2020).
- Swinburne, I. A., Mosaliganti, K. R., Green, A. A., Megason, S. G. Improved long-term imaging of embryos with genetically encoded α-bungarotoxin. PLOS ONE. 10 (8), 0134005-0134015 (2015).
- Taylor, J. M., et al. Adaptive prospective optical gating enables day-long 3D time-lapse imaging of the beating embryonic zebrafish heart. Nature Communication. 10 (1), 1-15 (2019).
- Power, R. M., Huisken, J. A guide to light-sheet fluorescence microscopy for multiscale imaging. Nature Methods. 14 (4), 360-373 (2017).
- Nüsslein-Volhard, C., Dahm, R. . Zebrafish: A Practical Approach. , (2002).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: An introduction. Journal of Visualized Experiments. (69), e4196 (2012).
- Cold Spring Harbor. E3 medium (for zebrafish embryos). Cold Spring Harbor Protocols. 2011, 66449 (2011).
- Yuan, S., Sun, Z. Microinjection of mRNA and morpholino antisense oligonucleotides in zebrafish embryos. Journal of Visualized Experiments. (27), e1113 (2009).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529 (2017).
- Jin, S. -. W., Beis, D., Mitchell, T., Chen, J. -. N., Stainier, D. Y. Cellular and molecular analyses of vascular tube and lumen formation in zebrafish. Development. 132 (23), 5199-5209 (2005).
- Chi, N. C., et al. Foxn4 directly regulates tbx2b expression and atrioventricular canal formation. Genes and Development. 22 (6), 734-739 (2008).
- Scott, G. R., Johnston, I. A. Temperature during embryonic development has persistent effects on thermal acclimation capacity in zebrafish. Proceedings of the National Academy of Sciences. 109 (35), 14247-14252 (2012).
- Sehnert, A. J., et al. Cardiac troponin T is essential in sarcomere assembly and cardiac contractility. Nature Genetics. 31 (1), 106-110 (2002).
- Sidhwani, P., Yelon, D., Wellik, D. M. Fluid forces shape the embryonic heart: Insights from zebrafish. Current Topics in Developmental Biology. 132, 395-416 (2019).
- Jou, C. J., Spitzer, K. W., Tristani-Firouzi, M. Blebbistatin effectively uncouples the excitation-contraction process in zebrafish embryonic heart. Cell Physiology and Biochemistry. 25 (4-5), 419-424 (2010).
- Chow, R. W. -. Y., Lamperti, P., Steed, E., Boselli, F., Vermot, J. following endocardial tissue movements via cell photoconversion in the zebrafish embryo. Journal of Visualized Experiments. (132), e57290 (2018).
- Nagel, G., et al. Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. Proccedings of the National Academy of Sciences. 100 (24), 13940-13945 (2003).
- Knollmann, B. C. Pacing lightly: optogenetics gets to the heart. Nature Methods. 7 (11), 889-891 (2010).
- Bruegmann, T., et al. Optogenetic control of heart muscle in vitro and in vivo. Nature Methods. 7 (11), 897-900 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved