Method Article
Световая листовая микроскопия быстрой сердечной динамики у эмбрионов рыбок данио
В этой статье
Резюме
Описаны оптимизированные инструменты для изучения сердца рыбок данио in vivo с помощью флуоресцентной микроскопии светового листа. В частности, мы предлагаем яркие сердечные трансгенные линии и представляем новые мягкие методы встраивания и иммобилизации, которые позволяют избежать пороков развития и сердца. Также предусмотрен возможный конвейер сбора и анализа данных, адаптированный для визуализации сердца.
Аннотация
Эмбриональные исследования сердца значительно выиграли от достижений в области быстрой флуоресцентной микроскопии in vivo (LSFM). В сочетании с быстрым внешним развитием, поддающейся лечению генетикой и полупрозрачностью рыбок данио, Данио Рерио, LSFM дал представление о форме и функции сердца с высоким пространственным и временным разрешением без значительной фототоксичности или фотоотбеливания. Визуализация бьющихся сердец бросает вызов существующим методам пробоподготовки и микроскопии. Нужно поддерживать здоровый образец в суженном поле зрения и получать сверхбыстрые изображения, чтобы разрешить сердцебиение. Здесь мы опишем оптимизированные инструменты и решения для изучения сердца рыбок данио in vivo. Мы демонстрируем применение ярких трансгенных линий для маркировки сердечных компонентов и представляем новые мягкие методы встраивания и иммобилизации, которые позволяют избежать дефектов развития и изменений частоты сердечных сокращений. Мы также предлагаем конвейер сбора и анализа данных, адаптированный для визуализации сердца. Весь рабочий процесс, представленный здесь, фокусируется на визуализации эмбрионального сердца рыбок данио, но также может быть применен к различным другим образцам и экспериментам.
Введение
Чтобы выявить сложные события и взаимодействия в сердце с ранним биением, требуется визуализация in vivo всего органа. Благодаря своей минимальной фототоксичности1,2,3, низкому фотоотбеливанию4 и высокой скорости, микроскопия светового листа превратилась в основной инструмент визуализации эмбрионального и сердечного развития5,6. Он дал представление о форме и функции сердца с высоким пространственным и временным разрешением7,8,9 и позволил исследователям получать изображения и отслеживать флуоресцентно меченые части сердца на высокой скорости, изучать гемодинамические силы и следить за развитием сердца непосредственно внутри тела развивающихся эмбрионов6,10,11,12.
Чтобы точно и воспроизводимо ограничивать рыбок данио в поле зрения, существуют различные протоколы встраивания для светового листа на краткосрочную и долгосрочную перспективу, а также для одного или нескольких образцов13,14,15,16,17,18,19. Наиболее распространенный протокол включает в себя иммобилизацию трикаина и установку агарозы внутри стеклянной или пластиковой трубки. Однако, поскольку частота сердечных сокращений может изменяться из-за температуры, анестетиков и используемого материала для встраивания20,21,22, визуализация сердца рыбок данио требует специальных, мягких протоколов для обеспечения здоровья образца6,8,11,12,20,21,22,23 . Для кратковременной визуализации (до часа) можно обезболить рыбу в трикаине 130 мг / л и встроить его во фторированные этиленпропиленовые (FEP) пробирки с 0,1% раствором агарозы и пробкой, как описано в Weber et al. 201416. Однако, поскольку трикаин может привести к дефектам развития20,22, для долгосрочной визуализации необходимо использовать различные протоколы.
Здесь мы описываем новую стратегию долгосрочной визуализации сердца. Хотя существует много реализаций световых листов24, мы рекомендуем использовать висящий образец в микроскопе T-SPIM (одна детекторная и две линзы освещения в горизонтальной плоскости с образцом, висящим вертикально в общем фокусе). Это дает необходимую свободу движения и вращения для точного позиционирования образца. Рыбы обездвиживаются путем инъекции 30 пг α-бунгаротоксиновой мРНК на одно- или двухклеточной стадии. α-бунгаротоксин представляет собой змеиный яд, который парализует мышцы, не влияя на сердечно-сосудистое развитие или физиологию22. Для точного изображения без искажений мы рекомендуем устанавливать рыбу в трубки из FEP, полимера с показателем преломления, почти идентичным воде. Мы обсуждаем, как лучше всего подготовить трубки FEP путем их выпрямления и очистки перед визуализацией. Затем рыбы устанавливаются в эти трубки, головой вниз, в средах, а дно трубки герметизируется 2% агарозной пробкой, на которую покоятся рыбьи головы. Вырезание отверстий в трубке FEP облегчает газообмен и обеспечивает рост рыбы. Встроенная рыба может храниться в среде до тех пор, пока не будет установлена на держатель образца прямо перед визуализацией. Мы также предлагаем конвейер сбора и анализа данных для воспроизводимой высокоскоростной визуализации. Кроме того, мы обсуждаем использование цитоплазматических и мембранных маркерных трансгенных линий для надежной маркировки клеток сердца, а также различные варианты остановки сердца. Эти методы монтажа обеспечивают здоровье образца, позволяя точно и воспроизводимо ограничивать сердце в поле зрения.
протокол
Со всеми взрослыми и эмбрионами рыбок данио (Danio rerio) обращались в соответствии с протоколами, одобренными Комитетом по уходу и использованию животных UW-Madison Institutional Animal Care and Use Committee (IACUC).
1. Подготовка рыбок данио
- Обрабатывайте рыбок данио в соответствии с установленными протоколами25,26 и институциональными руководящими принципами. Разводите взрослых рыб нужной трансгенной линии (см. Обсуждение). Соберите эмбрионы и храните их при температуре 28 °C в чашке Петри, наполненной рыбной средой, например, E327.
- Выберите метод иммобилизации (см. Обсуждение).
- При использовании мРНК α-бунгаротоксина для иммобилизации рыбы вводят 30 пг мРНК22 в желток эмбрионов одно- или двухклеточной стадии с помощью стеклянной иглы, установленной на микроманипуляторе и подключенной к пиконжектору28.
- При использовании трикаина делают 0,4% стоковый раствор, буферизованный до рН 7,0-7,4 с основанием 1 М Трис, и хранят при -20 °C до получения изображения.
- Храните яйца в чашке Петри, наполненной E3, при 28 °C и переносите яйца каждые 24 часа в новую чашку со свежим E3 до получения изображения.
- Чтобы предотвратить образование пигмента, если фон у рыбок данио не альбинос, перенесите рыбу через 24 ч после оплодотворения (hpf) в новое блюдо E3 с ингибитором тирозиназы 0,2 мМ 1-фенил-2-тиомочевины (см. Обсуждение).
2. Подготовка ТЭП трубок
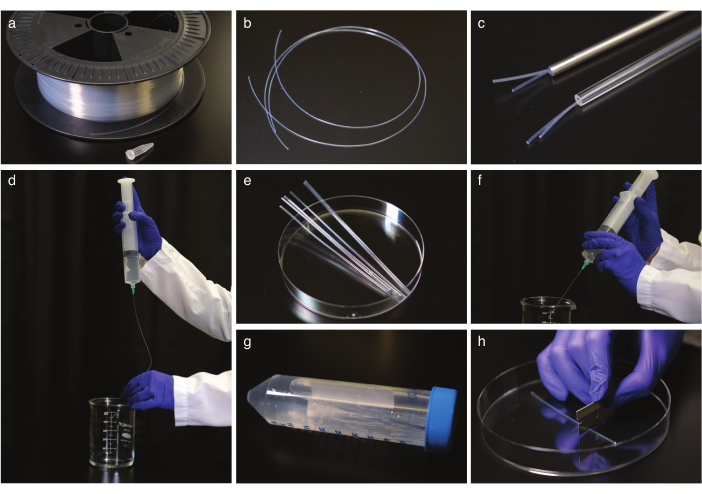
Рисунок 1: Очистка и выпрямление труб FEP. (a) Трубы FEP на кабельном барабане. b) трубы FEP перед выпрямлением. с) трубы FEP из стеклянных и стальных автоклавно-безопасных трубок. d) Промывка трубОК FEP после выпрямления и охлаждения. e) трубка FEP, разрезанная до размера центрифужной трубки для обработки ультразвуком. f) промывка трубок FEP после обработки ультразвуком. g) Хранение очищенных и выпрямленных трубок FEP в центрифужной трубке. h) разрезание трубки FEP перед визуализацией. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Выпрямите трубки FEP (рисунок 1a,b), поместив их в стеклянную или стальную автоклавно-безопасную трубку (рисунок 1c) с правильным внутренним диаметром для установки труб FEP, обычно 1,6 или 2,4 мм, и автоклав до 180 °C в течение 2 ч. Дайте трубкам остыть при комнатной температуре не менее 5 ч. Затем снимите с выпрямления трубки.
ПРИМЕЧАНИЕ: Используйте перчатки при манипулировании трубками и работайте с трубками 50 см за один раз. - Очистите трубки FEP.
ПРИМЕЧАНИЕ: Шприцы с тупым наконечником иглы внутреннего размера трубки FEP рекомендуются для безопасности, но обычная игла будет работать.- Промывайте трубки 1 M NaOH дважды шприцем объемом 50 мл (рисунок 1d).
- Вырежьте трубки FEP до размера центрифужной трубки объемом 50 мл с лезвием бритвы (рисунок 1e), поместите разрезанные трубки в заполненные центрифуги на 0,5 М NaOH трубки и ультразвуком в течение 10 минут.
- Промыть трубки FEP двойным дистиллированным H2O, затем повторно промыть 70% этанолом (рисунок 1f).
- Переведите трубки на 70% этанол и ультразвук в течение 10 мин.
- Промывайте трубки двойным дистиллированным H2O и храните их в центрифужных трубках в двойном дистиллированном H2O (рисунок 1g).
3. Приготовление 2% агарозного блюда
- В стеклянной колбе растворить порошок агарозы с низкой температурой плавления в Е3. Нагревайте раствор в микроволновой печи и помешивайте его каждые 20 с, пока весь порошок не растворится.
- Налейте агарозу в стеклянную или пластиковую чашку Петри, чтобы сделать слой 1-2 мм. Подождите, пока агароза затвердеет.
- Для хранения аккуратно вылейте Е3 поверх агара, чтобы предотвратить высыхание. Завернуть в парафиновую пленку и держать при температуре 4 °C.
4. Подготовка встраиваемых носителей
- Подготовьте достаточное количество E3 для заполнения камеры для отбора проб.
ПРИМЕЧАНИЕ: Избегайте использования метилового синего, если среда контактирует с объективами. - При использовании трикаина разморозьте раствор и добавьте 0,02% трикаин в Е3.
5. Монтаж образца
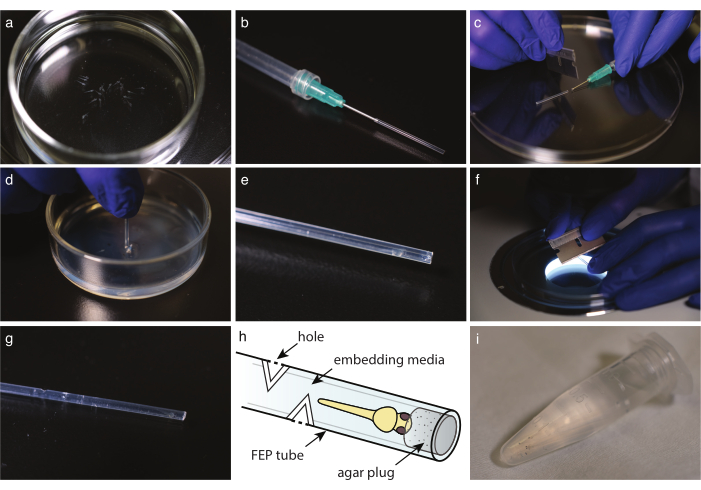
Рисунок 2: Установка эмбриона в трубку FEP. (a) Анестезированная рыба без пигмента в монтажных средах. b) шприц с тупой конечной иглой и трубкой FEP. с) После того, как среда и рыба будут взяты в трубку FEP, отрежьте трубку на краю иглы. d) окунуть разрезанную трубку в тарелку, покрытую 2% агарозой, чтобы заткнуть ее конец. e) рыбка данио в закупоренной трубке FEP. f) Осторожно разрезать трубку FEP под углом 30° для создания газообменных отверстий. g) трубка FEP с четырьмя отверстиями над встроенной рыбкой данио. h) Схема рыбки данио, встроенной в трубку FEP. Указаны отверстия и агаровая пробка. i) несколько встроенных рыбок данио, готовых к визуализации. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- С помощью одноразовой стеклянной пипетки переложите рыбу на встраиваемую среду (рисунок 2а). При использовании трикаина переложите рыбу в чашку Петри, наполненную трикаинсодержащим Е3, за 10 мин до визуализации. В обоих случаях просмотрите под стереомикроскопом, чтобы убедиться, что рыба перестала двигаться и что сердце бьется с одинаковой скоростью по сравнению с контрольной.
- Разрежьте трубку FEP до идеальной длины лезвием бритвы (рисунок 1h).
ПРИМЕЧАНИЕ: Длина должна быть отрегулирована к держателю образца микроскопа; типичная длина около 3 см. - Приготовьте шприц с тупым концом канюли. Наполните шприц воздухом, затем установите трубку FEP на иглу и осторожно смойте оставшуюся воду, опорожнив шприц (рисунок 2b).
ПРИМЕЧАНИЕ: Избегайте образования пузырьков, медленно вымывая воздух. - С трубкой FEP, установленной на шприце, сначала возьмите среду, чтобы заполнить трубку FEP, а затем возьмите головку эмбриона вниз. Держите голову рыбы как можно ближе к концу трубки. Избегайте образования пузырьков; если пузырь присутствует, отбросьте образец.
- Лезвием бритвы аккуратно вырежьте трубку FEP на краю тупого конца канюли или иглы (рисунок 2c).
- Выбросьте любую жидкость поверх блюда, покрытого агаром. Погрузите трубку FEP прямо в агар (рисунок 2d). Поверните трубку и выньте ее, чтобы освободить пробку от агарозного слоя.
- Под стереоскопом проверьте наличие агаровой пробки на конце трубки (рисунок 2e).
- Для длительной визуализации вырежьте 3-5 отверстий в трубке FEP в каждом стороне света, по крайней мере, на 5 мм выше конца рыбы.
- Под стереоскопом используйте лезвие бритвы перпендикулярно оси трубки, чтобы сделать 30° разрез в трубке FEP до достижения монтажного носителя (рисунок 2f).
- Сделайте второй срез под углом 180°, чтобы создать отверстие (рисунок 2g,h).
- Перенос смонтированной головки эмбриона вниз в микроцентрифужную трубку объемом 1,5 мл с встраиваемой средой до готовности к изображению (рисунок 2i).
6. Позиционирование образца

Рисунок 3: Пробоотборная камера. (a) Трубка FEP, установленная на держателе образца. b) камера для отбора проб со ступенями и объективами. с) вид сверху заполненной средой камеры для отбора проб с подсветкой и объективом обнаружения в конфигурации T-SPIM. d) держатель образца, установленный на микроскопе, с образцом в камере. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
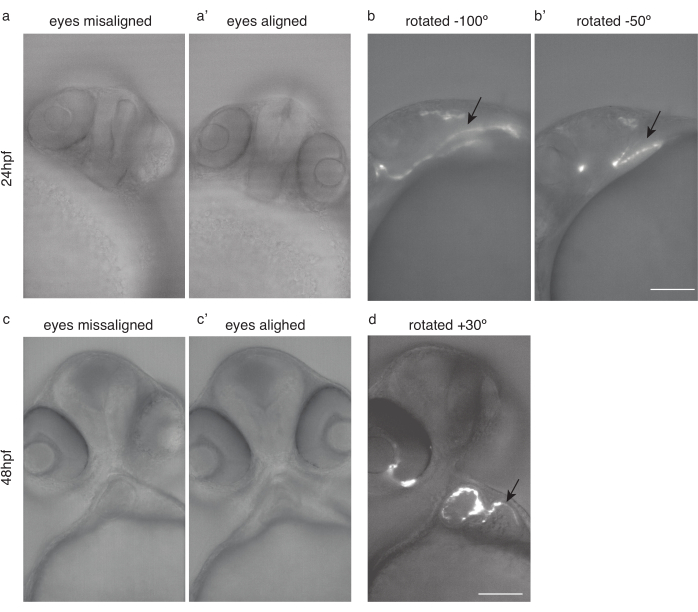
Рисунок 4: Позиционирование эмбриона для визуализации сердца. (a) 24 hpf Tg(kdrl:Hsa.HRAS-mCherry) рыбки данио с смещенными глазами. (а') Та же рыба, с выровненными глазами. (b) Те же рыбы повернуты на -100° и (b') -50° для оптимальной визуализации сердца. c) рыбки данио мощностью 48 л.с. с выровненными глазами. (с') Та же рыба, с выровненными глазами. d) та же рыба, повернутая на 30° для оптимальной визуализации сердца. Черные стрелки указывают на сердце. Шкала 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- На микроскопе установите трубку FEP в держатель образца (рисунок 3a) и заполните камеру визуализации встраиваемыми средами (рисунок 3b, c). Затем поместите держатель образца на сцену с погружением образца в камеру (рисунок 3d).
- Проверьте работоспособность образца. Визуально оцените частоту сердечных сокращений, чтобы оценить общее самочувствие рыб, так как конкретный сердечный ритм зависит от стадии и температуры, сравнивая с неустановленными контрольными рыбами. Если сердцебиение слишком медленное, выбросьте рыбу.
ПРИМЕЧАНИЕ: Обеспечьте бережное обращение с эмбрионами, тщательный перенос на встраиваемые среды, визуализацию сразу после встраивания, избегая быстрых изменений температуры, избегая трицина и снижая время воздействия трицина. - Для воспроизводимого изображения всегда используйте одно и то же положение образца. Рекомендуется выравнивание глаз и визуализация под углом.
- Поверните рыбу так, чтобы оба глаза (рисунок 4a,c) находились в фокальной плоскости (рисунок 4a',c')
- Из этого положения дополнительно поверните рыбу примерно на 50 °-100 ° по часовой стрелке для изображения 24 л.с. (рисунок 4b, b') и примерно на 20 °-30 ° против часовой стрелки для изображения 48 л.с. (рисунок 4d).
ПРИМЕЧАНИЕ: Раннее сердце, до 30 л.с.ф., может быть трудно изобразить из-за его скрытого положения (рисунок 4b).
7. Получение изображений
- Выберите сторону освещения, которая дает наилучшее качество изображения и адаптируйте мощность лазера к каждой рыбе.
ПРИМЕЧАНИЕ: Запишите мощность лазера, используемую для последующего анализа изображения. - На каждой z-плоскости записывайте 4-5 сердечных сокращений со скоростью 300 кадров в секунду (fps) или более.
ПРИМЕЧАНИЕ: Поле зрения может быть обрезано для увеличения скорости захвата. Например, при 48 л.с. сердце рыбки данио бьется два-три раза в секунду, поэтому при 300 кадрах в секунду требуется от 300 до 600 кадров, чтобы получить от четырех до шести сердечных сокращений. - Чтобы записать бьющееся сердце, переместите образец шаг в ногу со световым листом. Используйте z-интервал 1-2 мкм, охватывающий всю глубину сердца.
8. Обработка изображений
- Синхронизируйте записанный фильм для восстановления 4D (x,y,z, time) сердца с помощью плагина Fiji (Image J229,30), как описано ранее6.
- Чтобы изучить данные и создать фильмы о сердце рыбки данио, загрузите 4D-файл (x, y, z, время) в программное обеспечение для 3D-рендеринга.
Результаты
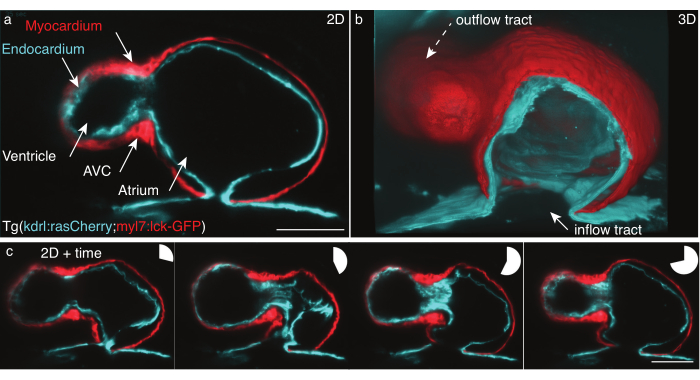
Рисунок 5: Сердце рыбки данио мощностью 48 л.с.. (a) Неподвижный z-кадр, передне-вентральный вид 48 hpf Tg(kdrl:Hsa.HRAS-mCherry; myl7:lck-EGFP) рыбки данио, изображенной с помощью LSFM, (b) 3D-реконструкция стеков фильмов, вырезанный вид через атриум. c) монтаж четырех кадров в течение полного сердцебиения на одной Z-плоскости. Круговые диаграммы показывают время во время сердцебиения. Шкала 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Мы зафиксировали 48 л.с.ф. бьющегося сердца рыбок данио Tg(kdrl:Hsa.HRAS-mCherry; myl7:lck-EGFP) в соответствии с протоколом, описанным выше (рисунок 5). Лазерный световой лист 488 нм и 561 нм освещали образец одновременно. Излучаемая флуоресценция была обнаружена перпендикулярно с помощью объектива 16x/0,8 Вт и научной полупроводниковой камеры оксида металла (sCMOS).
При 48 л.с. сердце только что подверглось петле и имеет две камеры, желудочек и предсердие, но еще не развило клапаны. В наших фильмах легко различимы различные структуры сердца, такие как приток, желудочек, атриовентрикулярный канал (AVC), предсердие и дорожка оттока (рисунок 5a, b). Эти данные показывают точное биение и выявляют сложные взаимодействия между двумя клеточными слоями сердца: миокардом, одноклеточным мышечным слоем, сокращающимся и генерирующим силу (рисунок 5c, красный), и эндокардом, одним клеточным слоем, который соединяет сердце с сосудистой системой (рисунок 5c, голубой).
Реконструкция сердцебиения в x,y,z (3D) + время (4D) + цвет (5D) была выполнена по данным Mickoleit et al.6. Реконструкция основана на двух гипотезах: движение сердца повторяется, а данные должны быть получены с помощью небольшого z-шага. Выход представляет собой реконструированное одиночное сердцебиение в 5D, измеряющее от 30 ГБ до 80 ГБ на сердцебиение. Для рендеринга данных мы использовали бесплатный инструмент с открытым исходным кодом FluoRender для углубленного рендеринга31 , поскольку он был разработан для обработки многомерных наборов данных и легкого рендеринга 5D-фильмов как слоев ячеек, так и отдельных слоев (рисунок 5b).
Обсуждение
Трансгенные линии для изображения сердца
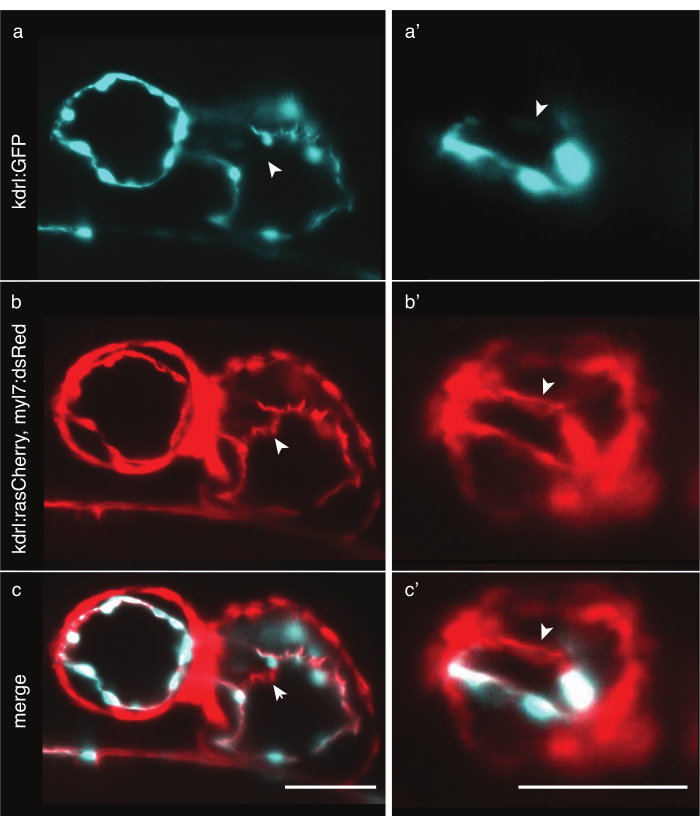
Рисунок 6: Сравнение цитоплазматических и мембранно-маркерных трансгенных линий рыбок данио. Передне-вентральный вид сердец рыбок данио мощностью 48 л.с., изображенных с помощью LSFM. Белыми стрелками обозначены структуры, видимые только мембранно-маркерной трансгенной линией. (a) Tg(kdrl:EGFP)32 сигнал в голубом цвете в сердце и (a') в желудочке. (b) Tg(kdrl:Hsa.HRAS-mCherry; myl7:dsRed)33 сигнал красного цвета в сердце и (b') в желудочке. ( c,c') слияние сигнала Tg(kdrl:Hsa.HRAS-mCherry; myl7:dsRed) и Tg(kdrl:EGFP). Шкала 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Визуализация сердца рыбок данио требует точной маркировки клеток сердца. В то время как толщина миокарда относительно постоянна во всех клетках, клетки эндокарда толстые вокруг ядра, но имеют тонкие мембранные выступы, в некоторых областях тоньше 2 мкм. Цитоплазматические трансгенные линии, такие как Tg(kdrl:EGFP)32, эффективно маркируют области вокруг эндокардиальных ядер, но дальше тонкая цитоплазма может не испускать достаточно фотонов, чтобы быть обнаруженной с таким коротким временем воздействия, что приводит к искусственным дырам в данных (рисунок 6a). Напротив, мембранные маркерные трансгенные линии, такие как Tg(kdrl:Hsa.HRAS-mCherry)33, могут эффективно маркировать эндокард и раскрывать более подробную информацию (рисунок 6b,c). Для каждого эксперимента тщательно выбирайте наиболее подходящую трансгенную линию.
Иммобилизация рыбок данио
Выбор техники иммобилизации зависит от продолжительности эксперимента и возраста рыбы для изображения. Трикаин обычно используется для иммобилизации рыбок данио, в основном из-за его простоты использования. Действительно, простое добавление 130 мг / л трикаина в рыбьи среды приводит к их обезболиванию через 10 минут. Поскольку он может привести к порокам развития и повлиять на физиологию сердца20,22, мы рекомендуем использовать трикаин только для коротких экспериментов (менее 30 мин). Для более длительной визуализации инъекции мРНК α-бунгаротоксина на одно- или двухклеточной стадии парализует рыбу в течение 3 дней после оплодотворения (dpf), не влияя на сердечно-сосудистое развитие или физиологию22.
Выбор правильных трубОК FEP
Трубы FEP доступны в различных диаметрах и толщинах. Для изображения рыбы 0-5 dpf, 0,8 мм является хорошим внутренним диаметром; выбирайте либо толстостенные трубы 0,8 x 1,6 мм, либо тонкостенные трубы 0,8 x 1,2 мм. Мы рекомендуем тонкостенные трубы; однако более толстые стенки обеспечивают повышенную стабильность и жесткость, что может быть важно, если камера для отбора проб имеет текучие среды, которые могут нарушить и переместить тонкую трубку. Для более крупных образцов можно использовать 1,6 x 2,4 мм и 2 x 3 мм.
Температура и газообмен
Важным аспектом благополучия эмбриона рыбки данио является температура. В идеале, держите рыбу при температуре 28,5 ° C во время визуализации, так как температура окружающей среды влияет на развитие и частоту сердечных сокращений34.
По нашему опыту, кислородный обмен через 2% агарозную пробку поддерживает стабильную частоту сердечных сокращений только до 3-4 дпф. Поэтому вырезание отверстий в трубке обеспечивает диффузию кислорода. Он также может быть необходим для доставки препарата к образцу при желании.
Приостановка сердцебиения.
Высокая скорость захвата соответствующим образом оборудованных световых листовых микроскопов позволяет регистрировать бьющееся сердце in vivo. Однако, чтобы приобрести ненарушенный z-стек, можно замедлить или остановить сердце. Однако остановка сердца приводит к расслаблению сердечной мышцы и может привести к коллапсу сердца6. Суспензию сердцебиения можно делать с помощью морфолиноса, низких температур, ингибитора сокращения мышц или оптогенетики. Каждый из этих методов имеет свои недостатки и должен быть тщательно оценен для каждого эксперимента.
Инъекция 4 нг бесшумного сердечного (sih) морфолина на стадии одной клетки может остановить сердцебиение, нацеливаясь на ген tnnt2a, имеющий решающее значение для формирования саркомера35. У рыбок данио нет сердцебиения и они доживают только до 7 dpf, когда эмбрионы начинают полагаться на циркулирующую кровь для оксигенации. Поскольку морфогенез сердца обусловлен как генетическими, так и биомеханическими силами36, у этих рыб присутствуют пороки развития сердца около 3 dpf.
Поскольку поток Ca2+ чувствителен к температуре, температура влияет на частоту сердечных сокращений у эмбриональных рыбок данио21. Следовательно, снижение температуры в камере визуализации замедляет сердцебиение. Остановка сердцебиения требует температуры ниже 15 °C. Поскольку рыбки данио обычно содержатся при температуре 28,5 ° C, такие низкие температуры могут поддерживаться только в течение коротких периодов времени (менее 10 минут).
Такие препараты, как химические ингибиторы мышечных сокращений, 2,3-Bu-tanedione 2-monoxime (BDM), могут быть добавлены в среду рыбок данио (50 nM37,38), чтобы временно приостановить сердцебиение. BDM удобен в использовании, так как он останавливает сокращение сердца менее чем за 15 минут и может быть смыт для восстановления сердечной функции. Однако, поскольку БДМ изменяет потенциал сердечного действия, его следует использовать с осторожностью37.
Наконец, сердцем трансгенных рыбок данио, экспрессирующих световые ионные каналы или насосы, такие как канальный родопсин или галорходопсин в их миокарде, можно манипулировать и останавливать, освещая кардиостимулятор в приточном тракте светом39,7,40,41,9.
Вид
Представленные оптимизированные инструменты и решения для изучения сердца рыбок данио in vivo позволяют в долгосрочной, щадящей визуализации сверхбыстрой сердечной динамики. Встраивание образца может быть адаптировано к различным методам визуализации, таким как конфокальная микроскопия, двухфотонная микроскопия или оптическая проекционная томография (OPT). Однако световая листовая микроскопия, вероятно, является предпочтительным методом, который предлагает оптическое сечение со скоростью, достаточной для захвата динамики сердца. Хотя этот протокол фокусируется на визуализации эмбрионального сердца рыбок данио, мы считаем, что он также может быть применен к различным другим образцам и экспериментам. Будет интересно посмотреть в будущем, могут ли подобные методы встраивания и визуализации также использоваться на более поздних стадиях развития, когда сердце более скрыто, а личинка менее полупрозрачна.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы благодарим Мадлен Ньюфелд за иллюстрацию на рисунке 2h. Эта работа была поддержана Обществом Макса Планка, Институтом исследований Моргриджа, Инициативой Чана Цукерберга и Программой науки о границах человека (HFSP).
Материалы
| Name | Company | Catalog Number | Comments |
| 1.5mL Eppendorf | Eppendorf | 22364111 | To carry embedded samples |
| 15mL Falcon tubes | Falcon | 352095 | To carry embedded samples |
| 50mL centrifuge tubes | Falcon | 352070 | 50ml tubes for sonication step, and storing cleaned, straightened FEP tubes |
| 50mL syringe | BD | 309654 | 50ml syringe for FEP cleaning |
| Agarose, low gelling temperature | Sigma Aldrich | 39346-81-1 | To make plug |
| Blunt Tip Needles, 21 gauge | VWR | 89500-304 | Blunt end needle for 0.8 inner diameter FEP tube |
| Borosilicate glass tube | McMaster-Carr | 8729K33 | Tubing for FEP tube straightening 9.5mm outer diameter, 5.6 inner diameter, 30cm long, other sizes available |
| Borosilicate glass tube | McMaster-Carr | 8729K31 | Tubing for FEP tube straightening 6.35mm outer diameter, 4mm inner diameter, 30cm long, other sizes available |
| Conventional needles, 21 Gauge | BD | 305165 | Conventional needle for 0.8 inner diameter FEP tube |
| Disposable glass pipette | Grainger | 52NK56 | To transfer fish, use with pipette pump |
| E3 medium for zebrafish embryos | |||
| Ethanol | Sigma Aldrich | 64-17-5 | Ethanol for FEP cleaning |
| FEP tube, 0.8 / 1.2 mm | ProLiquid | 2001048 | FEP tube with thin wall, other sizes available |
| FEP tube, 0.8 / 1.6 mm | Bola | S1815-04 | FEP tube with thick wall, other sizes available |
| FEP tube, 2/3mm | BGB | 211581 | Large FEP tube with thick wall, other sizes available |
| Hot Hand Rubber Mitt | Cole-Parmer | 691000 | To carry hot equipment after autoclaving |
| Omnifix 1mL Syringes | B Braun | 9161406V | 1ml syringe for embedding |
| Petri dish, small | Dot Scientific | PD-94050 | To make agarose plug |
| Pipette pumps | Argos Technologies | 04395-05 | To transfer fish, use with disposable glass pipette |
| PTU | Sigma Aldrich | 103-85-5 | Also known as: N-Phenylthiourea, 1-Phenyl-2-thiourea, Phenylthiocarbamide |
| Razor blades | Azpack | 11904325 | To cut FEP tubes |
| Sodium Hydroxide | Dot Scientific | DSS24000 | NaOH for FEP cleaning |
| Tricaine | Sigma Aldrich | E10521 | Also known as: MS-222, Ethyl 3-aminobenzoate methanesulfonate, Tricaine |
Ссылки
- Hoebe, R. A., et al. Controlled light-exposure microscopy reduces photobleaching and phototoxicity in fluorescence live-cell imaging. Nature Biotechnology. 25 (2), 249-253 (2007).
- Jenielita, M., Taormina, M. J., Delaurier, A., Kimmel, C. B., Parthasarathy, R. Comparing phototoxicity during the development of a zebrafish craniofacial bone using confocal and light sheet fluorescence microscopy techniques. Journal of Biophotonics. 6 (11-12), 920-928 (2013).
- Icha, J., Weber, M., Waters, J. C., Norden, C. Phototoxicity in live fluorescence microscopy, and how to avoid it. BioEssays. 39 (8), 1700003 (2017).
- Reynaud, E. G., Kržič, U., Greger, K., Stelzer, E. H. K. Light sheet-based fluorescence microscopy: more dimensions, more photons, and less photodamage. Human Frontier Science Program Journal. 2 (5), 266-275 (2008).
- Weber, M., Huisken, J. Light sheet microscopy for real-time developmental biology. Current Opinion in Genetics & Development. 21 (5), 566-572 (2011).
- Mickoleit, M., et al. High-resolution reconstruction of the beating zebrafish heart. Nat Methods. 11 (9), 919-922 (2014).
- Arrenberg, A. B., Stainier, D. Y., Baier, H., Huisken, J. Optogenetic control of cardiac function. Science. 330 (6006), 971-974 (2010).
- Trivedi, V., et al. Dynamic structure and protein expression of the live embryonic heart captured by 2-photon light sheet microscopy and retrospective registration. Biomed Optics Express. 6 (6), 2056-2066 (2015).
- Weber, M., Yelon, D., et al. Cell-accurate optical mapping across the entire developing heart. eLife. 6, 28307 (2017).
- Weber, M., Huisken, J. In vivo imaging of cardiac development and function in zebrafish using light sheet microscopy. Swiss Medical Weekly. 145, 14227 (2015).
- Fei, P., et al. Cardiac light-sheet fluorescent microscopy for multi-scale and rapid imaging of architecture and function. Science Reports. 6 (1), 1-12 (2016).
- Felker, A., et al. Continuous addition of progenitors forms the cardiac ventricle in zebrafish. Nature Communication. 9 (1), 1-14 (2018).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. K. Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305 (5686), 1007-1009 (2004).
- Keller, P. J., Pampaloni, F., Stelzer, E. H. Life sciences require the third dimension. Current Opinion in Cell Biology. 18 (1), 117-124 (2006).
- Keller, P. J., Schmidt, A. D., Wittbrodt, J., Stelzer, E. H. K. Reconstruction of zebrafish early embryonic development by scanned light sheet microscopy. Science. 322 (5904), 1065-1069 (2008).
- Weber, M., Mickoleit, M., Huisken, J. Multilayer mounting for long-term light sheet microscopy of zebrafish. Journal of Visualized Experiments. (84), e51119 (2014).
- Berndt, F., Shah, G., Power, R. M., Brugués, J., Huisken, J. Dynamic and non-contact 3D sample rotation for microscopy. Nature Communications. 9 (1), 1-7 (2018).
- Daetwyler, S., Günther, U., Modes, C. D., Harrington, K., Huisken, J. Multi-sample SPIM image acquisition, processing. and analysis of vascular growth in zebrafish. Development. , 173757 (2019).
- Keomanee-Dizon, K., Fraser, S. E., Truong, T. V. A versatile, multi-laser twin-microscope system for light-sheet imaging. Review of Scientific Instruments. 91 (5), 053703 (2020).
- Kaufmann, A., Mickoleit, M., Weber, M., Huisken, J. Multilayer mounting enables long-term imaging of zebrafish development in a light sheet microscope. Development. 139 (17), 3242-3247 (2012).
- Gierten, J., et al. Automated high-throughput heartbeat quantification in medaka and zebrafish embryos under physiological conditions. Science Reports. 10 (1), 1-12 (2020).
- Swinburne, I. A., Mosaliganti, K. R., Green, A. A., Megason, S. G. Improved long-term imaging of embryos with genetically encoded α-bungarotoxin. PLOS ONE. 10 (8), 0134005-0134015 (2015).
- Taylor, J. M., et al. Adaptive prospective optical gating enables day-long 3D time-lapse imaging of the beating embryonic zebrafish heart. Nature Communication. 10 (1), 1-15 (2019).
- Power, R. M., Huisken, J. A guide to light-sheet fluorescence microscopy for multiscale imaging. Nature Methods. 14 (4), 360-373 (2017).
- Nüsslein-Volhard, C., Dahm, R. . Zebrafish: A Practical Approach. , (2002).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: An introduction. Journal of Visualized Experiments. (69), e4196 (2012).
- Cold Spring Harbor. E3 medium (for zebrafish embryos). Cold Spring Harbor Protocols. 2011, 66449 (2011).
- Yuan, S., Sun, Z. Microinjection of mRNA and morpholino antisense oligonucleotides in zebrafish embryos. Journal of Visualized Experiments. (27), e1113 (2009).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529 (2017).
- Jin, S. -. W., Beis, D., Mitchell, T., Chen, J. -. N., Stainier, D. Y. Cellular and molecular analyses of vascular tube and lumen formation in zebrafish. Development. 132 (23), 5199-5209 (2005).
- Chi, N. C., et al. Foxn4 directly regulates tbx2b expression and atrioventricular canal formation. Genes and Development. 22 (6), 734-739 (2008).
- Scott, G. R., Johnston, I. A. Temperature during embryonic development has persistent effects on thermal acclimation capacity in zebrafish. Proceedings of the National Academy of Sciences. 109 (35), 14247-14252 (2012).
- Sehnert, A. J., et al. Cardiac troponin T is essential in sarcomere assembly and cardiac contractility. Nature Genetics. 31 (1), 106-110 (2002).
- Sidhwani, P., Yelon, D., Wellik, D. M. Fluid forces shape the embryonic heart: Insights from zebrafish. Current Topics in Developmental Biology. 132, 395-416 (2019).
- Jou, C. J., Spitzer, K. W., Tristani-Firouzi, M. Blebbistatin effectively uncouples the excitation-contraction process in zebrafish embryonic heart. Cell Physiology and Biochemistry. 25 (4-5), 419-424 (2010).
- Chow, R. W. -. Y., Lamperti, P., Steed, E., Boselli, F., Vermot, J. following endocardial tissue movements via cell photoconversion in the zebrafish embryo. Journal of Visualized Experiments. (132), e57290 (2018).
- Nagel, G., et al. Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. Proccedings of the National Academy of Sciences. 100 (24), 13940-13945 (2003).
- Knollmann, B. C. Pacing lightly: optogenetics gets to the heart. Nature Methods. 7 (11), 889-891 (2010).
- Bruegmann, T., et al. Optogenetic control of heart muscle in vitro and in vivo. Nature Methods. 7 (11), 897-900 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены