Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Desarrollo de una tira inmunocromatográfica de flujo lateral para la detección rápida y cuantitativa de compuestos de moléculas pequeñas
* Estos autores han contribuido por igual
En este artículo
Resumen
Las tiras inmunocromatográficas de flujo lateral (CSI) basadas en membranas son herramientas útiles para el autodiagnóstico de bajo costo y se han aplicado de manera eficiente a la detección de toxinas, índices fisiológicos y biomarcadores clínicos. En este protocolo, proporcionamos una descripción detallada de los pasos para desarrollar un inmunoensayo de flujo lateral rápido, sensible y cuantitativo (utilizando AuNPs como marcador y mAbs como sonda). El procedimiento describe la preparación y caracterización del oro coloidal, la síntesis del conjugado AuNP-mAb, el ensamblaje de la tira inmunocromatográfica y la investigación metodológica del ensayo. Los resultados mostraron que las tiras finales se pueden utilizar aún más para el autodiagnóstico rápido y conveniente de una molécula pequeña, lo que puede proporcionar una herramienta alternativa en el análisis rápido y preciso de los índices fisiológicos y biológicos.
Introducción
Las tiras inmunocromatográficas de flujo lateral (CSI) basadas en membranas son herramientas útiles para la detección rápida y de bajo costo. La membrana de nitrocelulosa como portadora y el oro coloidal como marcadores de los reactivos de diagnóstico rápido de cromatografía inmune son el método POCT (prueba de punto de atención) más utilizado, y el alcance de la prueba del proyecto es más amplio. Desde su aplicación original en el monitoreo durante el embarazo, su uso se ha extendido para monitorear el estado de coagulación sanguínea1,2, lesiónmiocárdica3,medicina veterinaria4,residuos de pesticidas5,enfermedades infecciosas6 y concentraciones de medicamentos. Se pueden evaluar más tipos de muestras, incluyendo orina, saliva, sangre total, suero y otros fluidos corporales7,8,9.
En los últimos años, se han desarrollado numerosos ensayos novedosos para detectar biomarcadores en el diagnóstico de trastornos, incluidos HPLC, UPLC, LC-MS y ELISA, que son sensibles y precisos, creíbles y específicos. Sin embargo, estos métodos requieren instrumentación sofisticada, preprocesamiento complejo y tratamientos que consumen mucho tiempo9. Por lo tanto, el desarrollo de una estrategia de diagnóstico en el punto de atención más rápida y conveniente para la detección automática y en tiempo real de compuestos activos medicinales es urgente10,11.
La popularidad de los CSI, especialmente para pruebas comunes, está impulsada por su facilidad de uso, ya que no requieren profesionales ni configuraciones instrumentales elaboradas12. En otras palabras, las personas que no tienen entrenamiento especial pueden operar tiras o autopruebas13. Los resultados de la prueba se pueden obtener en 5 minutos, lo que significa que se puede utilizar para inspecciones in situ14. Además, según nuestros cálculos, el costo de las tiras podría ser inferior a 1 RMB15,lo que significa que las pruebas son baratas para promover16. Por lo tanto, el ICS es un dispositivo desechable relativamente preciso, simple y económico. Los CSI basados en oro coloidal17,18 también se aplican en la detección rápida de COVID-19.
El principio de ICS se puede dividir en ICS sándwich e ICS competitivo. La Figura 1A es un diagrama esquemático del CSI sándwich, que se utiliza principalmente para detectar sustancias macromoleculares como proteínas, incluidos marcadores tumorales, factores inflamatorios y gonadotropina coriónica humana (HCG, antígeno del embarazo temprano). En este método, se utilizan anticuerpos pareados dirigidos a diferentes epítopos del antígeno, y el anticuerpo de captura se seca en la membrana NC como una línea de prueba. El anticuerpo marcado se seca en la almohadilla conjugada, y el anticuerpo secundario se utiliza como línea de control.
La Figura 1B es un diagrama esquemático de ICS competitivo, que se utiliza principalmente para detectar sustancias de moléculas pequeñas (MWCO < 2000 Da). El antígeno de recubrimiento se fija en la membrana NC como una línea de prueba, y el anticuerpo marcado se seca en la almohadilla conjugada. Durante la detección, la muestra y el anticuerpo marcado fluyen a través de la línea de detección bajo acción capilar, y el antígeno recubierto se une competitivamente al antígeno libre en la muestra y desarrolla un color rojo en la línea de detección.
Recientemente, describimos el procedimiento de generación de anticuerpos monoclonales contra productosnaturales 19. En este trabajo, desarrollamos un nuevo inmunoensayo de flujo lateral basado en el anti-SSD mA20 preparado para una detección rápida in situ. Los resultados indican que el ensayo de inmunocromatografía es una herramienta indispensable y conveniente para detectar compuestos derivados de productos naturales.
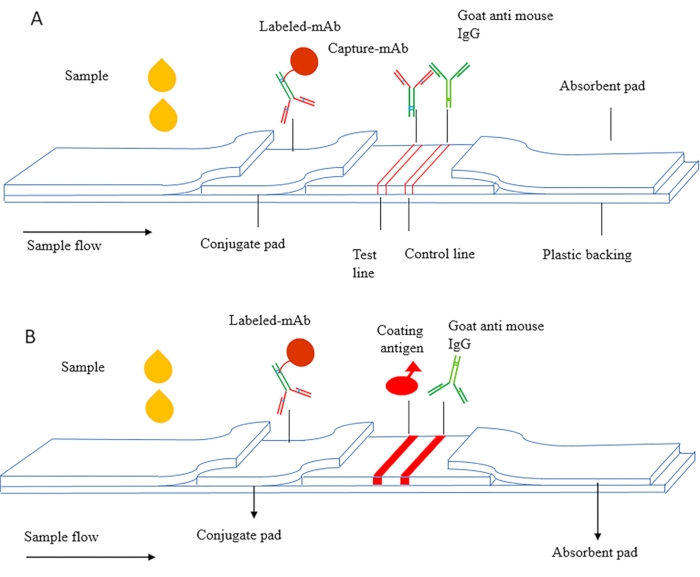
Figura 1 Diagrama esquemático del ensayo de inmunocromatografía (A) Tiras reactivas inmunocromatográficas sándwich. (B) Tiras reactivas cromatográficas inmunes competitivas indirectas. Esta cifra ha sido modificada de Zhang et al.,201821. Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
Todos los procedimientos realizados en este estudio fueron aprobados por el Comité de Revisión de Ética de la Universidad de Medicina China de Beijing (número de aprobación 2017BZYYL00120).
1. Preparación y caracterización del oro coloidal
NOTA: Para la síntesis de oro coloidal, como el oro coloidal se adsorbe fácilmente en la pared interna del recipiente y es propenso a la precipitación por impurezas, el recipiente para la síntesis y el almacenamiento de oro coloidal debe limpiarse a fondo y empaparse en ácido (40 ml de agua destilada, 360 ml de ácido sulfúrico concentrado, 20 g de dicromato de potasio) o someterse a un tratamiento de pasivación superficial. Se utilizó un método de reducción de ácido cítrico para sintetizar oro coloidal.
- Encienda el agitador magnético y coloque el matraz (250 ml) en el mezclador.
- Prepare una solución de ácido de cloruro de oro al 4% y una solución de citrato de sodio al 1%, respectivamente.
- Agregue 120 ml de agua destilada a un matraz de fondo redondo y caliéntelo hasta que hierva en un agitador magnético termostático.
- Siga hirviendo y agregue rápidamente 0.5 ml de ácido cloroáurico al 4% y 5 ml de citrato de sodio al 1%.
- Observe el color de la solución. La solución de ácido cloroáurico de color amarillo pálido se vuelve roja para el vino en unos pocos minutos.
- Continúe calentando durante 10 minutos, hasta que la solución cambie de incoloro a rojo vino transparente.
- Apague la alimentación del mezclador magnético termostático, enfríe a temperatura ambiente y mueva la mezcla a una botella limpia. Guárdelo a 4 °C.
- Determinar el tamaño y la morfología de los AuNPs mediante espectroscopia ultravioleta e imágenes TEM.
NOTA: Se pueden obtener diferentes tamaños de partículas de oro coloide para diversas aplicaciones cambiando la proporción de citrato sódico y ácido cloroáurico.
2. Síntesis de AuNPs-mAb conjugado
NOTA: Dado que los anticuerpos se unen al oro coloidal por adsorción electrostática, las cargas en la superficie de las proteínas y el oro coloidal afectan directamente la intensidad de la unión; por lo tanto, el valor de pH tampón es un factor importante que afecta la estabilidad del conjugado de oro anticuerpo-coloidal. SSD y anti-SSD mAbs se utilizan como ejemplos en este protocolo.
- Evaluación del pH de acoplamiento
- Añadir 100 μL de solución de NaCl (10% m/v) en ocho tubos.
- Ajuste las soluciones AuNP a pH 5, 6, 7, 8, 9, 10, 11 y 12 con 0,1 M K2CO3.
- Añadir 100 μL de solución de oro coloidal (pH ajustado 5-12) a ocho tubos que contengan NaCl.
- Deje que las soluciones se mantengan durante varios minutos después de la mezcla. Observe el cambio de color de cada solución de tubo y registre el tubo que permanece rojo.
- Elija el valor de pH con la menor adición de K2CO3 y el color de la solución estable como el valor de pH óptimo para preparar conjugados AuNP-mAb.
NOTA: No utilice un medidor de pH porque la sonda puede ser destruida por AuNPs.
- Evaluación de la cantidad de anticuerpos
- Añadir 100 μL de solución de NaCl (10% m/v) a ocho tubos.
- Añadir 100 μL de solución de oro coloidal con pH óptimo a cada tubo.
- Añadir las soluciones de anticuerpos monoclonales (concentración de proteínas 0,1 mg/mL-3,2 mg/mL) a los ocho tubos antes mencionados.
- Deje que las soluciones se mantengan durante varios minutos después de la mezcla. Observe el cambio de color de cada solución de tubo y registre el tubo que permanece rojo.
- Elija la cantidad de anticuerpos con la concentración más baja de mAb y el color de la solución estable como la cantidad óptima de mAb para preparar conjugados AuNP-mAb.
- Prepare el búfer de resuspensión: agregue 1 M Tris-HCl (pH 8.8), 1% (p/v) BSA, 0.5% (v/v) Tween 20 y 1% (v/v) PEG 20000 y mezcle bien.
- Síntesis del conjugado AuNP-mAb
- Tome 10 ml de solución de oro coloidal y use 0.1 M K2CO3 para ajustar la solución al valor óptimo de pH.
- Agregue lentamente los mAbs de SSD a concentraciones apropiadas y agite a temperatura ambiente durante 30 min.
- Centrifugar la mezcla a 83 x g (1.000 rpm) durante 10 min a 4 °C. Retire el precipitado, que contiene impurezas u oro coloidal precipitado.
- Centrifugar la mezcla a 8.330 x g (10.000 rpm) durante 30 min a 4 °C. Descarte el sobrenadante, y el precipitado es el conjugado coloidal oro-mAb.
- Agregue el tampón de resuspensión para disociar la precipitación.
3. Montaje de la Franja
NOTA: Para los inmunoensayos de flujo posteriores, la selección y el pretratamiento del material de membrana afectarán directamente a la prueba, que debe investigarse. La tira inmunocromatográfica consiste en una almohadilla de muestra, una almohadilla conjugada, una membrana de nitrocelulosa (NC), una almohadilla absorbente y una placa de PVC (Figura 1). El material de la membrana debe ser revisado y evaluado por estereomicroscopía para eliminar la inhomogeneidad.
- Pegue la membrana NC en una placa de PVC a 2 cm de distancia del borde del extremo de succión de la placa.
- Agregue SSD-BSA (2 mg/mL) gota a gota a la membrana NC (2 cm de distancia del borde superior) como línea de prueba (1 mm de ancho), y agregue IgG anti-ratón de cabra (1,5 mg/ ml) en forma de gota en la membrana NC (2 cm aparte del borde inferior) como línea de control (1 mm de ancho). Controle la cantidad de proteína añadida.
- Conecte la almohadilla absorbente a la lámina de PVC sobre la membrana NC y superponga con la membrana NC en 2 mm.
- Sumergir la membrana de fibra de vidrio en la solución conjugada AuNPs-mAb. Seque la membrana húmeda en una incubadora a 37 °C.
- Recorte la membrana de fibra de vidrio a 5 cm de largo y 2 cm de ancho y úselo como una almohadilla conjugada.
- Pegue la almohadilla conjugada pretratada debajo de la membrana NC. La longitud de superposición con la membrana NC debe ser de 0,1 cm.
NOTA: La membrana de fibra de vidrio tiene una fuerte capacidad para unirse y liberar proteínas. - Recorte la membrana fusion 3 a 1,8 cm de largo y 3,5 cm de ancho y úselo como almohadilla de muestra.
- Pegue la almohadilla de muestra en la placa de PVC y superponga con la almohadilla conjugada en 2 mm.
- Corte el cartón ensamblado en tiras de 3,5 mm de ancho con una máquina de corte y compactarlo utilizando un sistema de laminación por lotes.
- Finalmente, coloque las tiras reactivas en la carcasa, séllelas en una bolsa de papel de aluminio que contenga desecante y guárdelo lejos de la luz. Los ICS ya están ensamblados.
NOTA: Lo anterior es el procedimiento de laboratorio. En la producción, los equipos de pulverización de oro y los instrumentos de membrana cruzada se utilizan para rociar oro y hacer las líneas T y C.
4. Detección cuantitativa
- Deje caer 50 μL de solución de muestra sobre el orificio de muestra para observar el proceso de cromatografía.
NOTA: Como resultado de la acción capilar impulsada por la almohadilla absorbente, la solución de muestra migra al otro extremo de la tira. Cuando la solución de muestra llega a la almohadilla conjugada, el SSD (antígeno) en la muestra reacciona con el AuNPs-mAb precargado en la almohadilla. Cuando la solución migra y alcanza la línea T, el AuNPs-mAb sin SSD puede ser capturado selectivamente por SSD-BSA (antígeno-portador de proteína conjugada), mostrándose como un color rojo en la línea T. Luego, la solución migra a la línea C, donde los AuNPs-mAb son capturados por igG anti-ratón de cabra en la región, mostrándose así como un color rojo en la línea C. - Analice las tiras con un lector de tiras portátil. La máquina puede proporcionar la relación entre la línea de prueba y la línea de control (T/C).
- Evaluar la especificidad, sensibilidad, repetibilidad y estabilidad de la prueba ICS.
NOTA: En la detección cualitativa, una línea roja indica un resultado positivo (línea de control). Dos líneas rojas indican un resultado negativo (líneas de prueba y control). Si la línea de control no está presente, la prueba se considera inválida.
Resultados
Caracterización del oro coloidal
Las soluciones de oro coloidal preparadas eran de color rojo clarete. Se utilizaron análisis TEM para determinar la morfología y la forma de los AuNPs(Figura 2A-D). La Figura 2A y la Figura 2B revelan que las partículas tienen forma poliédrica y están distribuidas uniformemente. Se encontró que el diámetro promedio de AuNPs era de aproximadamente 14 nm
Discusión
En este trabajo, presentamos un protocolo para la preparación de mAbs contra moléculas pequeñas derivadas de productos naturales. Se han esbozado los pasos esenciales y los asuntos que necesitan atención en el procedimiento, y hemos demostrado la utilidad de este protocolo utilizando la molécula pequeña SSD como ejemplo. Los espectros de ejemplo, las imágenes TEM, los resultados cuantitativos y las investigaciones metodológicas se muestran en datos representativos. Por lo tanto, hemos demostrado que la producció...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por los Fondos Especiales para Fondos de Investigación Fundamental de instituciones de educación superior afiliadas a departamentos centrales. Agradecemos el apoyo del Equipo de Investigación Básica de Prescripción Clásica de la Universidad de Medicina China de Beijing.
Materiales
| Name | Company | Catalog Number | Comments |
| Chloroauric acid solution (HAuCl4) | Tianjin Fu Chen Chemical Reagents Factory | JY-SJ102 | |
| bovine serum albumin | AMRESCO | 332 | |
| centrifuge tube 15 mL | Corning | 430645 | |
| centrifuge tube 50 mL | Corning | 430828 | |
| ELISA plates, 96 well | NUNC | 655101 | |
| Filter paper | Sinopharm | H5072 | |
| Glass fibre membranes | Jieyi | XQ-Y6 | |
| goat-anti-mouse IgG antibody | applygen | C1308 | |
| Nitrocellulose membranes | Millipore | millipore 180 | |
| ovalbumin | Beijing BIODEE | 5008-25g | |
| PEG20000 | Sigma Aldrich | RNBC6325 | |
| Pipette 10mL | COSTAR | 4488 | |
| Pipette 25mL | FALCON | 357525 | |
| semi-rigid PVC sheets | Jieyi | JY-C104 | |
| Sodium citrate | Beijing Chemical Works | C1034 | |
| sodium periodate | Sinopharm Chemical | BW-G0008 | |
| Sulfo-GMBS | Perbio Science Germany | 22324 | |
| TipOne Tips 1,000 µL | Starlab | S1111-2021 | |
| Tris-HCl | Solarbio | 77-86-1 | |
| TWEEN 20 | Solarbio | 9005-64-5 |
Referencias
- Huang, X., et al. Membrane-based lateral flow immunochromatographic strip with nanoparticles as reporters for detection: A review. Biosensors and Bioelectronics. 75, 166-180 (2016).
- Chang, H. -. F., Wang, J. -. Q., Wang, B., Deng, A. -. P. An immune chromatographic assay for rapid and simultaneous detection of levonorgestrel and methylprednisolone in water samples. Chinese Chemical Letters. 24 (10), 937-940 (2013).
- Lai, J. J., Stayton, P. S. Improving lateral-flow immunoassay (LFIA) diagnostics via biomarker enrichment for mHealth. Methods in Molecular Biology. 1256, 71-84 (2015).
- Zhang, M. Z., et al. Development of a colloidal gold-based lateral-flow immunoassay for the rapid simultaneous detection of clenbuterol and ractopamine in swine urine. Analytical & Bioanalytical Chemistry. 395 (8), 2591-2599 (2009).
- Kranthi, K. R., et al. Development of a colloidal-gold based lateral-flow immunoassay kit for 'quality-control' assessment of pyrethroid and endosulfan formulations in a novel single strip format. Crop Protection. 28 (5), 428-434 (2009).
- Qian, K., et al. Development and evaluation of an immunochromatographic strip for rapid detection of capsid protein antigen p27 of avian leukosis virus. Journal of Virological Methods. (221), 115-118 (2015).
- Guo, H., et al. Lateral flow immunoassay devices for testing saliva and other liquid samples and methods of use of same. US Patent. , (2003).
- Miočević, O., et al. Quantitative Lateral Flow Assays for Salivary Biomarker Assessment: A Review. Frontiers in Public Health. 5, 1-13 (2017).
- Lisa, M., et al. Gold nanoparticles based dipstick immunoassay for the rapid detection of dichlorodiphenyltrichloroethane: an organochlorine pesticide. Biosensors and Bioelectronics. 25 (1), 224-227 (2009).
- Zhang, Z., et al. Monoclonal Antibody-Europium Conjugate-Based Lateral Flow Time-Resolved Fluoroimmunoassay for Quantitative Determination of T-2 Toxin in Cereals and Feed. Analytical Methods. 7 (6), 2822-2829 (2015).
- Shen, H., et al. Facile synthesis of high-quality CuInZnxS2+x core/shell nanocrystals and their application for detection of C-reactive protein. Journal of Materials Chemistry. 22 (35), 18623-18630 (2012).
- Xiang, T., et al. A novel double antibody sandwich-lateral flow immunoassay for the rapid and simple detection of hepatitis C virus. International Journal of Molecular Medicine. 30 (5), 1041-1047 (2012).
- Yang, Q., et al. Quantum dot-based immunochromatography test strip for rapid, quantitative and sensitive detection of alpha fetoprotein. Biosensors & Bioelectronics. 30 (1), 145 (2011).
- Song, L. W., et al. Rapid fluorescent lateral-flow immunoassay for hepatitis B virus genotyping. Analytical Chemistry. 87, 5173-5180 (2015).
- Zhang, Y., et al. Quantum dot-based lateral-flow immunoassay for rapid detection of rhein using specific egg yolk antibodies. Artificial Cells, Nanomedicine, and Biotechnology. 1, (2017).
- Qu, H., et al. Rapid Lateral-Flow Immunoassay for the Quantum Dot-based Detection of GsRerarin. Biosensors and Bioelectronics. 81, 358-362 (2016).
- Li, Z., et al. Development and Clinical Application of a Rapid IgM-IgG Combined Antibody Test for SARS-CoV-2 Infection Diagnosis. Journal of Medical Virology. 92 (9), (2020).
- Xiaomei, L., Jing, W., Ya, Z. The clinical application value analysis of the 2019-coronary virus disease was analyzed by the whole blood Sars-COV 2 specific antibody detection. Natural Science Edition. 42, (2020).
- Zhang, Y., et al. Generation of Monoclonal Antibodies Against Natural Products. Journal of Visualized Experiments. , e57116 (2019).
- Sai, J., et al. Development of an Enzyme-Linked Immunosorbent Assay and Immunoaffinity Column Chromatography for Saikosaponin d Using an Anti-Saikosaponin d Monoclonal Antibody. Planta Medica. 82, 432-439 (2016).
- Yue, Z., et al. A Highly Sensitive Immunochromatographic Strip Test for Rapid and Quantitative Detection of Saikosaponin d. Molecules. 23 (2), 338 (2018).
- Qu, H., et al. Rapid Lateral-Flow Immunoassay for the Quantum Dot-based Detection of Puerarin. Biosensors and Bioelectronics. 81, 358-362 (2016).
- Zhang, Y., et al. Quantum dot-based lateral-flow immunoassay for rapid detection of rhein using specific egg yolk antibodies. Artificial Cells, Nanomedicine, and Biotechnology. 1, (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados