Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Küçük Molekül Bileşiklerinin Hızlı ve Nicel Tespiti için Yanal Akış İmmünokromatografik Şeridinin Geliştirilmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Membran bazlı lateral akış immünokromatografik şeritler (ICSs) düşük maliyetli kendi kendine tanı için yararlı araçlardır ve toksin, fizyolojik indeks ve klinik biyobelirteç tespitine verimli bir şekilde uygulanmıştır. Bu protokolde, hızlı, hassas ve nicel yanal akışlı bir immünoassay geliştirme adımlarının ayrıntılı bir açıklamasını sunuyoruz (AuNP'leri bir işaretleyici olarak ve mAb'leri prob olarak kullanarak). Prosedür kolloidal altının hazırlanmasını ve karakterizasyonunu, AuNP-mAb konjugesinin sentezini, immünromatografik şeridin montajını ve tahlil metodolojik incelemesini açıklar. Sonuçlar, son şeritlerin, fizyolojik ve biyolojik endekslerin hızlı ve hassas analizinde alternatif bir araç sağlayabilecek küçük bir molekülün hızlı ve rahat kendi kendine teşhisi için daha fazla kullanılabileceğini göstermiştir.
Giriş
Membran bazlı yanal akış immünokromatografik şeritler (ICSs) düşük maliyetli ve hızlı algılama için kullanışlı araçlardır. Taşıyıcı olarak nitroselüloz membran ve immün kromatografi hızlı tanı reaktiflerinin belirteçleri olarak kolloidal altın en sık kullanılan POCT (bakım noktası testi) yöntemidir ve projenin test kapsamı daha geniştir. Hamilelik sırasında izlemedeki orijinal uygulamalarından, kan pıhtılaşma durumu 1,2, miyokard yaralanması3, veteriner hekimlik4, pestisit kalıntıları5, bulaşıcı hastalıklar6ve ilaç konsantrasyonlarını izlemek için kullanımları genişletilmiştir. İdrar, tükürük, tam kan, serum ve diğer vücut sıvıları dahil olmak üzere daha fazla örnek türü değerlendirilebilir7,8,9.
Son yıllarda, hassas ve doğru, güvenilir ve spesifik olan HPLC, UPLC, LC-MS ve ELISA dahil olmak üzere bozuklukların tanısında biyobelirteçleri tespit etmek için çok sayıda yeni tahlil geliştirilmiştir. Bununla birlikte, bu yöntemler sofistike enstrümantasyon, karmaşık ön işleme ve zaman alıcı tedaviler gerektirir9. Bu nedenle, tıbbi aktif bileşiklerin kendi kendine ve gerçek zamanlı tespiti için daha hızlı ve kullanışlı bir bakım noktası tanı stratejisi geliştirmek acildir10,11.
ICS'lerin popülaritesi, özellikle yaygın testler için, profesyonellere veya ayrıntılı enstrümantal kurulumlara ihtiyaç duydukları için kullanım kolaylığından kaynaklanır12. Başka bir deyişle, özel eğitimi olmayan kişiler şeritleri veya kendi kendine testleri çalıştırabilir13. Testin sonuçları 5 dakika içinde elde edilebilir, bu da saha incelemeleri için kullanılabileceği anlamına gelir14. Ayrıca, hesaplamalarımıza göre, şeritlerin maliyeti 1 RMB15'ten düşük olabilir , bu da testlerin16. Bu nedenle, ICS nispeten doğru, basit ve ucuz bir tek kullanımlık cihazdır. Kolloidal altın17,18 bazlı ICS'ler hızlı COVID-19 tespitinde de uygulanmaktadır.
ICS prensibi sandviç ICS ve rekabetçi ICS olarak ayrılabilir. Şekil 1A, esas olarak tümör belirteçleri, enflamatuar faktörler ve insan koryonik gonadotropin (HCG, erken gebelik antijeni) dahil olmak üzere proteinler gibi makromoleküler maddeleri tespit etmek için kullanılan sandviç ICS'nin şematik bir diyagramıdır. Bu yöntemde antijenin farklı epitoplarını hedefleyen eşleştirilmiş antikorlar kullanılır ve yakalama antikorı test hattı olarak NC membranında kurutulur. Etiketli antikor konjuge ped üzerinde kurutulur ve kontrol hattı olarak ikincil antikor kullanılır.
Şekil 1B, esas olarak küçük molekül maddeleri tespit etmek için kullanılan rekabetçi ICS'nin şematik bir diyagramıdır (MWCO < 2000 Da). Kaplama antijeni test hattı olarak NC membran üzerine sabitlenir ve etiketli antikor konjuge ped üzerinde kurutulur. Algılama sırasında, numune ve etiketli antikor kılcal etki altında algılama hattından akar ve kaplanmış antijen, numunedeki serbest antijeni rekabetçi bir şekilde bağlar ve algılama hattında kırmızı bir renk geliştirir.
Son zamanlarda, doğal ürünlere karşı monoklonal antikor üretimi prosedürünü tanımladık19. Bu çalışmada, hızlı ve yerinde tespit için hazırlanan anti-SSD mA20'ye dayanan yeni bir yanal akış immünoassay geliştirdik. Sonuçlar, immünokromatografi testinin doğal ürün türevi bileşikleri tespit etmek için vazgeçilmez ve kullanışlı bir araç olduğunu göstermektedir.
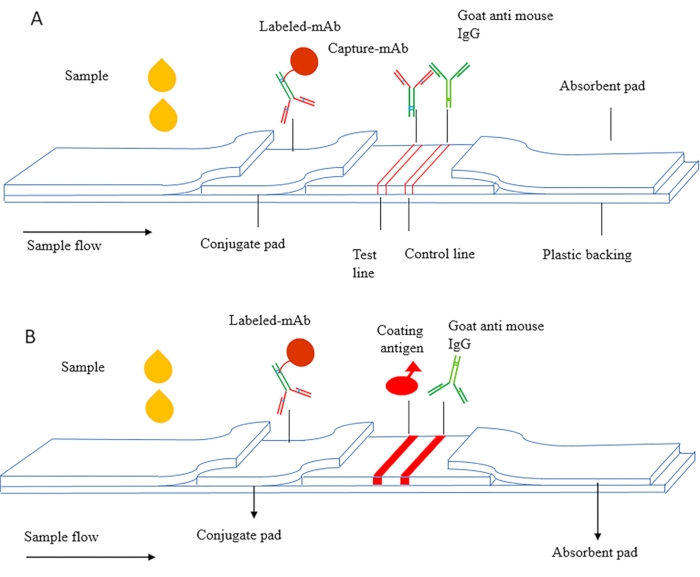
Şekil 1 İmmünromatografi testinin şematik şeması (A) Sandviç immünokromatografik test şeritleri. (B) Dolaylı rekabetçi immün kromatografik test şeritleri. Bu rakam Zhang ve ark.,201821. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protokol
Bu çalışmada yapılan tüm prosedürler Pekin Çin Tıp Üniversitesi Etik İnceleme Komitesi tarafından onaylanmıştır (onay numarası 2017BZYYL00120).
1. Kolloidal Altının Hazırlanması ve Karakterizasyonu
NOT: Kolloidal altın sentezi için, kolloidal altın damarın iç duvarına kolayca adsorbe edildiği ve safsızlıklar nedeniyle çökeltmeye eğilimli olduğu için kolloidal altının sentezi ve depolanması için damar iyice temizlenmeli ve aside batırılmalıdır (40 mL damıtılmış su, 360 mL konsantre sülfürik asit, 20 g potasyum dikromat) veya yüzey geçişi işlemine tabi tutulmalıdır. Kolloidal altını sentezlemek için sitrik asit azaltma yöntemi kullanılmıştır.
- Manyetik karıştırıcıyı açın ve şişeyi (250 mL) karıştırıcıya yerleştirin.
- Sırasıyla% 4 altın klorür asit çözeltisi ve% 1 sodyum sitrat çözeltisi hazırlayın.
- Yuvarlak bir alt şişeye 120 mL damıtılmış su ekleyin ve termostatik manyetik karıştırıcıda kaynamaya ısıtın.
- Kaynamaya devam edin ve hızlı bir şekilde% 4 kloroaurik asit 0,5 mL ve% 1 sodyum sitrat 5 mL ekleyin.
- Çözeltinin rengine uyun. Soluk sarı kloroaurik asit çözeltisi birkaç dakika içinde şarabı kırmızıya çevirir.
- Çözelti renksizden şeffaf şarap kırmızısına dönüşene kadar 10 dakika ısıtmaya devam edin.
- Termostatik manyetik mikserin gücünü kapatın, oda sıcaklığına soğutun ve karışımı temiz bir şişeye taşıyın. 4 °C'de saklayın.
- Ultraviyole spektroskopi ve TEM görüntüleme ile AuNP'lerin boyutunu ve morfolojisini belirleyin.
NOT: Sitrat sodyum ve kloroaurik asit oranı değiştirilerek çeşitli uygulamalar için farklı boyutlarda kolloid altın parçacıkları elde edilebilir.
2. AuNPs-mAb Konjuge Sentezi
NOT: Antikorlar elektrostatik adsorpsiyon ile kolloidal altına bağlanınce, proteinlerin ve kolloidal altının yüzeyindeki yükler bağlayıcı yoğunluğu doğrudan etkiler; bu nedenle, tampon pH değeri antikor-kolloidal altın konjuge stabilitesini etkileyen önemli bir faktördür. SSD ve anti-SSD mAb'ler bu protokolde örnek olarak kullanılır.
- Kavrama pH'ının değerlendirilmesi
- Sekiz tüpe 100 μL NaCl çözeltisi (%10 m/v) ekleyin.
- AuNP çözümlerini pH 5, 6, 7, 8, 9, 10, 11 ve 12'de 0,1 M K 2 CO3ileayarlayın.
- NaCl içeren sekiz tüpe 100 μL kolloidal altın çözeltisi (pH ayarlı 5-12) ekleyin.
- Karıştırmadan sonra çözeltilerin birkaç dakika bekletin. Her tüp çözeltisinin renk değişimini gözlemleyin ve kırmızı kalan tüpü kaydedin.
- AuNP-mAb konjugelerini hazırlamak için optimum pH değeri olarak en az K2CO3 ilavesi ve kararlı çözelti rengi ile pH değerini seçin.
NOT: Prob AuNP'ler tarafından yok edilebileceğinden pH ölçer kullanmayın.
- Antikor miktarının değerlendirilmesi
- Sekiz tüpe 100 μL NaCl çözeltisi (%10 m/v) ekleyin.
- Her tüpe optimum pH ile 100 μL kolloidal altın çözeltisi ekleyin.
- Yukarıda belirtilen sekiz tüpe monoklonal antikor çözeltilerini (protein konsantrasyonu 0.1 mg/mL-3.2 mg/mL) ekleyin.
- Karıştırmadan sonra çözeltilerin birkaç dakika bekletin. Her tüp çözeltisinin renk değişimini gözlemleyin ve kırmızı kalan tüpü kaydedin.
- AuNP-mAb konjugelerini hazırlamak için optimum mAb miktarı olarak en düşük mAb konsantrasyonuna ve kararlı çözelti rengine sahip antikor miktarını seçin.
- Resüspenzyon tamponunu hazırlayın: 1 M Tris-HCl (pH 8.8), %1 (w/v) BSA, %0.5 (v/v) Ara 20 ve %1 (v/v) PEG 20000 ekleyin ve iyice karıştırın.
- AuNP-mAb konjuge sentezi
- 10 mL kolloidal altın çözeltisi alın ve çözeltiyi en uygun pH değerine ayarlamak için0,1 M K2CO 3 kullanın.
- SSD mAb'leri uygun konsantrasyonlarda yavaşça ekleyin ve oda sıcaklığında 30 dakika çalkalayın.
- Karışımı 83 x g 'da (1.000 rpm) 4 °C'de 10 dakika santrifüjleyin. Safsızlıklar veya çökelmiş kolloidal altın içeren çökelticiyi çıkarın.
- Karışımı 4 °C'de 30 dakika boyunca 8.330 x g'da (10.000 rpm) santrifüjleyin. Üstnatantı atın ve çökelti kolloidal altın-mAb konjugesidir.
- Yağışı dağıtmak için resüspenzyon tamponunu ekleyin.
3. Şeridin Montajı
NOT: Daha sonraki akış immünoassayları için, membran malzemesinin seçimi ve ön işlem, araştırılması gereken testi doğrudan etkileyecektir. İmmünromatografik şerit bir örnek ped, bir konjuge ped, bir nitroselüloz (NC) membran, bir emici ped ve bir PVC levhadan oluşur (Şekil 1). Membran malzemesi stereomikroskop ile kontrol edilmeli ve inhomogeneity ortadan kaldırılması için değerlendirilmelidir.
- NC membranını, kartın emme ucunun kenarından 2 cm uzaklıktaki bir PVC tahtaya yapıştırın.
- NC zarına (üst kenardan 2 cm) damla yönünde (1 mm genişliğinde) SSD-BSA (2 mg/mL) ekleyin ve NC zarına (alt kenardan 2 cm ayrı) keçi anti-mouse IgG (1 mm genişliğinde) damla yönünde ekleyin. Eklenen protein miktarını kontrol edin.
- Emici pedi NC membran üzerindeki PVC levhaya takın ve NC membranıyla 2 mm örtün.
- Cam elyaf membranı AuNPs-mAb konjuge çözeltisine batırın. Islak zarı 37 °C'de bir inkübatörde kurulayın.
- Cam elyaf membranını 5 cm uzunluğunda ve 2 cm genişliğinde kırpın ve konjuge ped olarak kullanın.
- Önceden tedavi edilmiş konjuge pedi NC zarın altına yapıştırın. NC membran ile örtünme uzunluğu 0,1 cm olmalıdır.
NOT: Cam elyaf membran, proteinleri bağlama ve serbest bırakma konusunda güçlü bir yetebeye sahiptir. - Füzyon 3 membranı 1,8 cm uzunluğunda ve 3,5 cm genişliğinde kırpın ve örnek ped olarak kullanın.
- Örnek pedi PVC tahtaya yapıştırın ve konjuge ped ile 2 mm örtüştürün.
- Monte edilen kağıt tahtayı bir kesme makinesi kullanarak 3,5 mm genişliğinde şeritler halinde kesin ve toplu laminasyon sistemi kullanarak sıkıştırın.
- Son olarak, test şeritlerini kabuğun içine yerleştirin, kurutucu içeren alüminyum bir folyo torbaya kapatın ve ışıktan uzak saklayın. ICS'ler şimdi toplandı.
NOT: Yukarıdaki laboratuvar prosedürüdür. Üretimde altın püskürtme ekipmanları ve çapraz zar aletleri altın püskürtmek ve T ve C hatlarını yapmak için kullanılır.
4. Nicel Algılama
- Kromatografi işlemini gözlemlemek için numune deliğine 50 μL numune çözeltisi bırakın.
NOT: Emici ped tarafından yönlendirilen kılcal etkinin bir sonucu olarak, numune çözeltisi şeridin diğer ucuna taşınır. Numune çözeltisi konjuge pedine ulaştığında, numunedeki SSD (antijen), ped üzerine önceden yüklenmiş AuNPs-mAb ile reaksiyona sokar. Çözelti taşındığında ve T hattına ulaştığında, SSD'siz AuNPs-mAb, T-line'da kırmızı bir renk olarak gösterilen SSD-BSA (antijen taşıyıcı protein konjuge) tarafından seçici olarak yakalanabilir. Daha sonra, çözüm, AuNPs-mAb'nin bölgedeki keçi fare karşıtı IgG tarafından yakalandığı C çizgisine taşınır, böylece C çizgisinde kırmızı bir renk olarak görünür. - Şeritleri taşınabilir bir şerit okuyucu ile analiz edin. Makine, test hattının kontrol hattına (T/C) oranını sağlayabilir.
- ICS testinin özgüllüğünü, hassasiyetini, tekrarlanabilirliğini ve kararlılığını değerlendirin.
NOT: Nitel algılama altında, bir kırmızı çizgi pozitif bir sonucu (kontrol çizgisi) gösterir. İki kırmızı çizgi negatif bir sonucu gösterir (test ve kontrol çizgileri). Denetim satırı yoksa, test geçersiz kabul edilir.
Sonuçlar
Kolloidal altının karakterizasyonu
Hazırlanan kolloidal altın çözeltileri bordo kırmızıydı. AuNP'lerin morfolojisini ve şeklini belirlemek için TEM analizleri kullanılmıştır (Şekil 2A-D). Şekil 2A ve Şekil 2B, parçacıkların polihedral şekilli ve düzgün bir şekilde dağıtıldığını ortaya koymaktadır. AuNP'lerin ortalama çapı yaklaşık 14 nm(?...
Tartışmalar
Bu çalışmada, mAb'lerin doğal ürün türevi küçük moleküllere karşı hazırlanması için bir protokol sunuyoruz. Prosedürde dikkat gereken temel adımlar ve konular özetlenmiştir ve örnek olarak küçük molekül SSD'yi kullanarak bu protokolün yararını gösterdik. Örnek spektrumlar, TEM görüntüleri, nicel sonuçlar ve metodolojik araştırmalar temsili verilerde gösterilmiştir. Bu nedenle, burada sunulan kolloidal altın üretimi, AuNP-mAb konjugasyon ve şerit montaj stratejisinin hedef molekül...
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu çalışma, merkezi bölümlere bağlı yüksek öğrenim kurumlarının Temel Araştırma Fonları için Özel Fonlar tarafından desteklenmiştir. Pekin Çin Tıbbı Üniversitesi Klasik Reçete Temel Araştırma Ekibinin desteğini takdir ediyoruz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Chloroauric acid solution (HAuCl4) | Tianjin Fu Chen Chemical Reagents Factory | JY-SJ102 | |
| bovine serum albumin | AMRESCO | 332 | |
| centrifuge tube 15 mL | Corning | 430645 | |
| centrifuge tube 50 mL | Corning | 430828 | |
| ELISA plates, 96 well | NUNC | 655101 | |
| Filter paper | Sinopharm | H5072 | |
| Glass fibre membranes | Jieyi | XQ-Y6 | |
| goat-anti-mouse IgG antibody | applygen | C1308 | |
| Nitrocellulose membranes | Millipore | millipore 180 | |
| ovalbumin | Beijing BIODEE | 5008-25g | |
| PEG20000 | Sigma Aldrich | RNBC6325 | |
| Pipette 10mL | COSTAR | 4488 | |
| Pipette 25mL | FALCON | 357525 | |
| semi-rigid PVC sheets | Jieyi | JY-C104 | |
| Sodium citrate | Beijing Chemical Works | C1034 | |
| sodium periodate | Sinopharm Chemical | BW-G0008 | |
| Sulfo-GMBS | Perbio Science Germany | 22324 | |
| TipOne Tips 1,000 µL | Starlab | S1111-2021 | |
| Tris-HCl | Solarbio | 77-86-1 | |
| TWEEN 20 | Solarbio | 9005-64-5 |
Referanslar
- Huang, X., et al. Membrane-based lateral flow immunochromatographic strip with nanoparticles as reporters for detection: A review. Biosensors and Bioelectronics. 75, 166-180 (2016).
- Chang, H. -. F., Wang, J. -. Q., Wang, B., Deng, A. -. P. An immune chromatographic assay for rapid and simultaneous detection of levonorgestrel and methylprednisolone in water samples. Chinese Chemical Letters. 24 (10), 937-940 (2013).
- Lai, J. J., Stayton, P. S. Improving lateral-flow immunoassay (LFIA) diagnostics via biomarker enrichment for mHealth. Methods in Molecular Biology. 1256, 71-84 (2015).
- Zhang, M. Z., et al. Development of a colloidal gold-based lateral-flow immunoassay for the rapid simultaneous detection of clenbuterol and ractopamine in swine urine. Analytical & Bioanalytical Chemistry. 395 (8), 2591-2599 (2009).
- Kranthi, K. R., et al. Development of a colloidal-gold based lateral-flow immunoassay kit for 'quality-control' assessment of pyrethroid and endosulfan formulations in a novel single strip format. Crop Protection. 28 (5), 428-434 (2009).
- Qian, K., et al. Development and evaluation of an immunochromatographic strip for rapid detection of capsid protein antigen p27 of avian leukosis virus. Journal of Virological Methods. (221), 115-118 (2015).
- Guo, H., et al. Lateral flow immunoassay devices for testing saliva and other liquid samples and methods of use of same. US Patent. , (2003).
- Miočević, O., et al. Quantitative Lateral Flow Assays for Salivary Biomarker Assessment: A Review. Frontiers in Public Health. 5, 1-13 (2017).
- Lisa, M., et al. Gold nanoparticles based dipstick immunoassay for the rapid detection of dichlorodiphenyltrichloroethane: an organochlorine pesticide. Biosensors and Bioelectronics. 25 (1), 224-227 (2009).
- Zhang, Z., et al. Monoclonal Antibody-Europium Conjugate-Based Lateral Flow Time-Resolved Fluoroimmunoassay for Quantitative Determination of T-2 Toxin in Cereals and Feed. Analytical Methods. 7 (6), 2822-2829 (2015).
- Shen, H., et al. Facile synthesis of high-quality CuInZnxS2+x core/shell nanocrystals and their application for detection of C-reactive protein. Journal of Materials Chemistry. 22 (35), 18623-18630 (2012).
- Xiang, T., et al. A novel double antibody sandwich-lateral flow immunoassay for the rapid and simple detection of hepatitis C virus. International Journal of Molecular Medicine. 30 (5), 1041-1047 (2012).
- Yang, Q., et al. Quantum dot-based immunochromatography test strip for rapid, quantitative and sensitive detection of alpha fetoprotein. Biosensors & Bioelectronics. 30 (1), 145 (2011).
- Song, L. W., et al. Rapid fluorescent lateral-flow immunoassay for hepatitis B virus genotyping. Analytical Chemistry. 87, 5173-5180 (2015).
- Zhang, Y., et al. Quantum dot-based lateral-flow immunoassay for rapid detection of rhein using specific egg yolk antibodies. Artificial Cells, Nanomedicine, and Biotechnology. 1, (2017).
- Qu, H., et al. Rapid Lateral-Flow Immunoassay for the Quantum Dot-based Detection of GsRerarin. Biosensors and Bioelectronics. 81, 358-362 (2016).
- Li, Z., et al. Development and Clinical Application of a Rapid IgM-IgG Combined Antibody Test for SARS-CoV-2 Infection Diagnosis. Journal of Medical Virology. 92 (9), (2020).
- Xiaomei, L., Jing, W., Ya, Z. The clinical application value analysis of the 2019-coronary virus disease was analyzed by the whole blood Sars-COV 2 specific antibody detection. Natural Science Edition. 42, (2020).
- Zhang, Y., et al. Generation of Monoclonal Antibodies Against Natural Products. Journal of Visualized Experiments. , e57116 (2019).
- Sai, J., et al. Development of an Enzyme-Linked Immunosorbent Assay and Immunoaffinity Column Chromatography for Saikosaponin d Using an Anti-Saikosaponin d Monoclonal Antibody. Planta Medica. 82, 432-439 (2016).
- Yue, Z., et al. A Highly Sensitive Immunochromatographic Strip Test for Rapid and Quantitative Detection of Saikosaponin d. Molecules. 23 (2), 338 (2018).
- Qu, H., et al. Rapid Lateral-Flow Immunoassay for the Quantum Dot-based Detection of Puerarin. Biosensors and Bioelectronics. 81, 358-362 (2016).
- Zhang, Y., et al. Quantum dot-based lateral-flow immunoassay for rapid detection of rhein using specific egg yolk antibodies. Artificial Cells, Nanomedicine, and Biotechnology. 1, (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır