このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
小分子化合物の迅速・定量的検出用横流イムノクロマトグラフィーストリップの開発
* これらの著者は同等に貢献しました
要約
膜ベースの横流の流れイムノクロマトグラフィーストリップ(ICS)は、低コスト自己診断に有用なツールであり、毒素、生理学的指標および臨床バイオマーカー検出に効率的に適用されています。このプロトコルでは、迅速、敏感、定量的な横流免疫測定(プローブとしてAuNPsをマーカーとして使用)を開発するステップの詳細な説明を提供します。この手順は、コロイド金の調製および特性評価、AuNP-mAbコンジュゲートの合成、免疫クロマトグラフィーストリップの組み立て、およびアッセイの方法論学的調査について説明する。結果は、最終的なストリップが、生理学的および生物学的指標の迅速かつ正確な分析において代替手段となる可能性のある、小分子の迅速かつ便利な自己診断のためにさらに利用できることを示した。
概要
膜ベースの横流の流れの免疫クロマトグラフィーストリップ(ICS)は低コストおよび急速な検出のための有用な用具である。免疫クロマトグラフィーのマーカーとしてのニトロセルロース膜とコロイドゴールドは、最も一般的に使用されるPOCT(ケアポイント検査)法であり、プロジェクトの試験範囲は広い。妊娠中のモニタリングにおける彼らの元のアプリケーションから、血液凝固状態1、2、心筋傷害3、獣医学4、残留農薬5、感染症6および薬物濃度を監視するためにその使用が拡張された。尿、唾液、全血、血清および他の体液7、8、9を含む、より多くのタイプのサンプルを評価することができる。
近年、HPLC、UPLC、LC-MS、ELISAなどの疾患の診断におけるバイオマーカーの検出に関する新しいアッセイが数多く開発されています。しかし、これらの方法は、洗練された計測、複雑な前処理と時間のかかる治療9を必要とします。したがって、薬用活性化合物の自己およびリアルタイム検出のためのより迅速かつ便利なポイント・オブ・ケア診断戦略を開発することは、緊急の10、11である。
特に一般的なテストでは、ICSの人気は、彼らが専門家や精巧なインストゥルメンタルセットアップ12を必要としないように、その使いやすさによって駆動されます。言い換えれば、特別な訓練を受けていない人は、ストリップや自己テスト13を操作することができます。試験の結果は5分で得ることができ、これは現場検査14に使用できることを意味する。さらに、我々の計算によると、ストリップのコストは1 RMB15よりも低くなる可能性があり、これはテストが16を促進するために安価であることを意味します。したがって、ICSは比較的正確でシンプルで安価な使い捨てデバイスです。コロイドゴールド17、18に基づくICSも、迅速なCOVID-19検出に適用されます。
ICS の原理は、サンドイッチ ICS と競争力のある ICS に分けることができます。 図1A は、主に腫瘍マーカー、炎症因子、およびヒト絨毛性性ゴナドトロピン(HCG、妊娠初期抗原)を含むタンパク質などの高分子物質を検出するために使用されるサンドイッチICSの概略図である。この方法では、抗原の異なるエピトープを標的とした対合抗体が使用され、そして捕捉抗体を試験ラインとしてNC膜上で乾燥させる。標識抗体はコンジュゲートパッド上で乾燥し、二次抗体は対照線として使用される。
図1B は、主に低分子物質(MWCO<2000 Da)の検出に使用される競合性ICSの模式図である。被覆抗原は、試験ラインとしてNC膜上に固定され、標識された抗体はコンジュゲートパッド上で乾燥する。検出中、サンプルと標識された抗体は毛細血管作用下の検出ラインを流れ、被覆された抗原はサンプル中の自由な抗原に競合的に結合し、検出ライン上に赤色を発生させる。
最近、天然物19に対するモノクローナル抗体生成の手順について説明した。本研究では、迅速なオンサイト検出のために調製された抗SSD mA20 に基づく新規の横流フローイムノアッセイを開発しました。この結果は、天然物由来化合物を検出する上で、免疫クロマトグラフィーアッセイが不可欠で便利なツールであることを示しています。
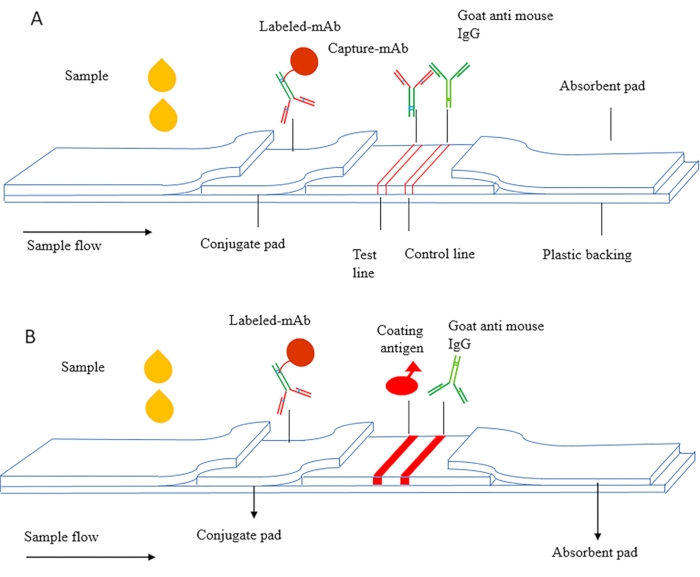
図1 イムノクロマトグラフィーアッセイ(A)サンドイッチイムノクロマトグラフィー試験ストリップの概略図。(B) 間接的な競合性免疫クロマトグラフィーテストストリップ。この図は、Zhangら、201821から変更されています。この図の大きなバージョンを表示するには、ここをクリックしてください。
プロトコル
本研究で行われたすべての手順は、北京中医科大学の倫理審査委員会(承認番号2017BZYYL00120)によって承認されました。
コロイド金の作成と特徴付け
注:コロイド金合成では、コロイド金が容器の内壁に容易に吸着され、不純物によって沈殿しやすいため、コロイド金の合成および貯蔵のための容器を徹底的に洗浄し、酸に浸す必要があります(蒸留水40mL、硫酸360mL濃縮物、20gのカリウムジクロメートの20g)コロイド金を合成するためにクエン酸還元法を用いた。
- 磁気スターラーをオンにし、フラスコ(250 mL)をミキサーに置きます。
- 4%の塩化金酸溶液と1%クエン酸ナトリウム溶液をそれぞれ調製する。
- 丸底フラスコに蒸留水120mLを加え、サーモスタット磁気攪拌機で沸騰させます。
- 沸騰させ、4%クロロアウリン酸の0.5mLとクエン酸ナトリウム1%5 mLを素早く加えます。
- 溶液の色を観察します。淡い黄色のクロロアウリン酸溶液は、数分以内にワインを赤くします。
- 溶液が無色から透明なワインレッドに変わるまで、10分間加熱を続けます。
- サーモスタット磁気ミキサーの電源をオフにし、室温まで冷却し、混合物をクリーンボトルに移動します。4°Cで保管してください。
- 紫外線分光法とTEMイメージングにより、AuNPsのサイズと形態を決定します。
注:クエン酸ナトリウムとクロロアウリン酸の割合を変更することで、様々な用途に対するコロイド金粒子の異なるサイズを得ることができます。
2. AuNPs-mAbコンジュゲートの合成
注:抗体は静電吸着によってコロイド金に結合するので、タンパク質とコロイド金の表面の電荷は結合強度に直接影響を与えます。したがって、バッファーpH値は、抗体コロイド金共役体の安定性に影響を与える重要な因子である。SSD および反 SSD mAbs は、このプロトコルの例として使用されます。
- カップリングpHの評価
- NaCl溶液(10%m/v)を8本のチューブに100 μL加えます。
- 0.1 M K2CO3で pH 5、6、7、8、9、10、11、12 で AuNP ソリューションを調整します。
- NaClを含む8本のチューブにコロイドゴールド溶液(pH調整5-12)を100μL加えます。
- ブレンド後、ソリューションを数分間放置します。各チューブ溶液の色の変化を観察し、赤いままのチューブを記録します。
- AuNP-mAbコンジュゲートを調製するための最適なpH値として、K2CO3と安定した溶液色を最少添加したpH値を選択してください。
注: プローブは AuNPs によって破壊される可能性があるため、pH メーターは使用しないでください。
- 抗体量の評価
- NaCl溶液(10%m/v)を8本のチューブに100 μL加えます。
- 各チューブに最適なpHを持つコロイドゴールド溶液を100 μL加えます。
- 上記8本のチューブにモノクローナル抗体溶液(タンパク質濃度0.1 mg/mL-3.2 mg/mL)を加えます。
- ブレンド後、ソリューションを数分間放置します。各チューブ溶液の色の変化を観察し、赤いままのチューブを記録します。
- 最も低濃度のmAbと安定した溶液色を有する抗体量を、AuNP-mAbコンジュゲートを調製するための最適なmAb量として選択します。
- 再懸濁液バッファーを準備する:1 M Tris-HCl(pH 8.8)、1%(w/v)BSA、0.5%(v/v)トゥイーン20と1%(v/v)PEG 20000を追加し、よくブレンドします。
- AuNP-mAbコンジュゲートの合成
- コロイドゴールド溶液を10 mLとし、0.1 M K2CO3を使用して溶液を最適なpH値に調整します。
- 適当な濃度でゆっくりとSSD mAbsを加え、室温で30分間振ります。
- 4°Cで10分間83xg(1,000rpm)で混合物を遠心分離する。 不純物または沈殿したコロイドゴールドを含む沈殿物を除去します。
- 4°Cで30分間8,330 x g(10,000rpm)で混合物を遠心する。 上清を捨て、沈殿物はコロイドゴールド-mAbコンジュゲートである。
- 再懸濁液バッファーを追加して沈殿を解化します。
3. ストリップの組み立て
注:後のフローイムノアッセイでは、膜材料の選択と前処理が直接試験に影響を与え、調査する必要があります。イムノクロマトグラフィーストリップは、サンプルパッド、コンジュゲートパッド、ニトロセルロース(NC)膜、吸収パッドおよびPVCボードから構成される(図1)。膜材料は、不均一性を排除するために、ステレオ顕微鏡でチェックおよび評価する必要があります。
- PVCボードの2cmの上に、基板の吸引端の端から離れてNC膜を貼り付けます。
- SSD-BSA(2 mg/mL)をNC膜に滴下(上端から2cm離す)をテストライン(1mm幅)として加え、制御ライン(下端から2cm離れた)の抗マウスIgG(1.5mg/mL)を制御ライン(1mm幅)として加えます。添加するタンパク質の量を制御します。
- NC膜上のPVCシートに吸収パッドを取り付け、NC膜と2mm重ね合たします。
- ガラス繊維膜をAuNPs-mAbコンジュゲート溶液に沈めます。湿った膜を37°Cでインキュベーターで乾かします。
- ガラス繊維膜を長さ5cm、幅2cmにトリミングし、コンジュゲートパッドとして使用します。
- 前処理コンジュゲートパッドをNC膜の下に貼り付けます。NC膜とのオーバーラップの長さは0.1cmでなければなりません。
注:ガラス繊維膜は、タンパク質を結合および放出する強力な能力を有します。 - 融合3膜を長さ1.8cm、幅3.5cmにトリミングし、サンプルパッドとして使用します。
- サンプルパッドをPVCボードに貼り付け、コンジュゲートパッドと2mm重ねます。
- 組み立てた紙台を切断機を使用して3.5mm幅のストリップに切り、バッチラミネーションシステムを使用して圧縮します。
- 最後に、テストストリップをシェルに入れ、乾燥剤を含むアルミホイル袋に密封し、光から離して保管します。ICSが組み立てられました。
注: 上記の手順は、ラボの手順です。製造では、金のスプレー装置とクロス膜器具を使用して、金を吹き付け、TラインとCラインを作ります。
4. 定量的検出
- 50 μL のサンプル溶液をサンプルホールにドロップして、クロマトグラフィープロセスを観察します。
注: 吸収パッドによって駆動される毛細血管アクションの結果として、サンプル溶液はストリップの反対側に移動します。サンプル溶液がコンジュゲートパッドに到達すると、サンプル中のSSD(抗原)がパッドにプリロードされたAuNPs-mAbと反応します。溶液がT線に移行して到達すると、SSDを含まないAuNPs-mAbをSSD-BSA(抗原キャリアタンパク質コンジュゲート)によって選択的に捕捉することができ、T線上に赤色として示されます。次に、この溶液はCラインに移行し、そこでAuNPs-mAbが領域内のヤギ抗マウスIgGによって捕捉され、Cラインに赤色で表示されます。 - ポータブルストリップリーダーでストリップを分析します。機械は制御線(T/C)にテストラインの比率を提供できる。
- ICS試験の特異性、感度、再現性、安定性を評価します。
注: 定性検出では、正の結果 (制御線) を示す赤い線が 1 つ示されます。2 本の赤い線は、負の結果 (テスト行と制御線) を示します。制御行が存在しない場合、テストは無効と見なされます。
結果
コロイド金の特徴付け
準備されたコロイドゴールド溶液はクラレットレッドであった。TEM解析は、AuNPsの形態と形状を決定するために使用されました(図2A-D)。図2A及び図2Bは、粒子が形状が均一に分布している多面体であることを明らかにした。AuNPsの平均直径は約14nmであることが判明した(
ディスカッション
本研究では、天然物由来の小分子に対するmAbsの調製のためのプロトコルを提示する。重要なステップと、その手順に注意を要する事項を概説し、小分子SSDを例に用いてこのプロトコルの有用性を実証した。スペクトル例、TEM画像、定量的結果および方法論的調査は代表的なデータに示されている。そこで、ここで提示した金コロイド金生産、AuNP-mAbコンジュゲーション、ストリップ組立戦略?...
開示事項
著者らは開示するものは何もない。
謝辞
この研究は、中央部と提携する高等教育機関の基礎研究資金の特別資金によって支援されました。北京中国医学大学の古典処方基礎研究チームの支援に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Chloroauric acid solution (HAuCl4) | Tianjin Fu Chen Chemical Reagents Factory | JY-SJ102 | |
| bovine serum albumin | AMRESCO | 332 | |
| centrifuge tube 15 mL | Corning | 430645 | |
| centrifuge tube 50 mL | Corning | 430828 | |
| ELISA plates, 96 well | NUNC | 655101 | |
| Filter paper | Sinopharm | H5072 | |
| Glass fibre membranes | Jieyi | XQ-Y6 | |
| goat-anti-mouse IgG antibody | applygen | C1308 | |
| Nitrocellulose membranes | Millipore | millipore 180 | |
| ovalbumin | Beijing BIODEE | 5008-25g | |
| PEG20000 | Sigma Aldrich | RNBC6325 | |
| Pipette 10mL | COSTAR | 4488 | |
| Pipette 25mL | FALCON | 357525 | |
| semi-rigid PVC sheets | Jieyi | JY-C104 | |
| Sodium citrate | Beijing Chemical Works | C1034 | |
| sodium periodate | Sinopharm Chemical | BW-G0008 | |
| Sulfo-GMBS | Perbio Science Germany | 22324 | |
| TipOne Tips 1,000 µL | Starlab | S1111-2021 | |
| Tris-HCl | Solarbio | 77-86-1 | |
| TWEEN 20 | Solarbio | 9005-64-5 |
参考文献
- Huang, X., et al. Membrane-based lateral flow immunochromatographic strip with nanoparticles as reporters for detection: A review. Biosensors and Bioelectronics. 75, 166-180 (2016).
- Chang, H. -. F., Wang, J. -. Q., Wang, B., Deng, A. -. P. An immune chromatographic assay for rapid and simultaneous detection of levonorgestrel and methylprednisolone in water samples. Chinese Chemical Letters. 24 (10), 937-940 (2013).
- Lai, J. J., Stayton, P. S. Improving lateral-flow immunoassay (LFIA) diagnostics via biomarker enrichment for mHealth. Methods in Molecular Biology. 1256, 71-84 (2015).
- Zhang, M. Z., et al. Development of a colloidal gold-based lateral-flow immunoassay for the rapid simultaneous detection of clenbuterol and ractopamine in swine urine. Analytical & Bioanalytical Chemistry. 395 (8), 2591-2599 (2009).
- Kranthi, K. R., et al. Development of a colloidal-gold based lateral-flow immunoassay kit for 'quality-control' assessment of pyrethroid and endosulfan formulations in a novel single strip format. Crop Protection. 28 (5), 428-434 (2009).
- Qian, K., et al. Development and evaluation of an immunochromatographic strip for rapid detection of capsid protein antigen p27 of avian leukosis virus. Journal of Virological Methods. (221), 115-118 (2015).
- Guo, H., et al. Lateral flow immunoassay devices for testing saliva and other liquid samples and methods of use of same. US Patent. , (2003).
- Miočević, O., et al. Quantitative Lateral Flow Assays for Salivary Biomarker Assessment: A Review. Frontiers in Public Health. 5, 1-13 (2017).
- Lisa, M., et al. Gold nanoparticles based dipstick immunoassay for the rapid detection of dichlorodiphenyltrichloroethane: an organochlorine pesticide. Biosensors and Bioelectronics. 25 (1), 224-227 (2009).
- Zhang, Z., et al. Monoclonal Antibody-Europium Conjugate-Based Lateral Flow Time-Resolved Fluoroimmunoassay for Quantitative Determination of T-2 Toxin in Cereals and Feed. Analytical Methods. 7 (6), 2822-2829 (2015).
- Shen, H., et al. Facile synthesis of high-quality CuInZnxS2+x core/shell nanocrystals and their application for detection of C-reactive protein. Journal of Materials Chemistry. 22 (35), 18623-18630 (2012).
- Xiang, T., et al. A novel double antibody sandwich-lateral flow immunoassay for the rapid and simple detection of hepatitis C virus. International Journal of Molecular Medicine. 30 (5), 1041-1047 (2012).
- Yang, Q., et al. Quantum dot-based immunochromatography test strip for rapid, quantitative and sensitive detection of alpha fetoprotein. Biosensors & Bioelectronics. 30 (1), 145 (2011).
- Song, L. W., et al. Rapid fluorescent lateral-flow immunoassay for hepatitis B virus genotyping. Analytical Chemistry. 87, 5173-5180 (2015).
- Zhang, Y., et al. Quantum dot-based lateral-flow immunoassay for rapid detection of rhein using specific egg yolk antibodies. Artificial Cells, Nanomedicine, and Biotechnology. 1, (2017).
- Qu, H., et al. Rapid Lateral-Flow Immunoassay for the Quantum Dot-based Detection of GsRerarin. Biosensors and Bioelectronics. 81, 358-362 (2016).
- Li, Z., et al. Development and Clinical Application of a Rapid IgM-IgG Combined Antibody Test for SARS-CoV-2 Infection Diagnosis. Journal of Medical Virology. 92 (9), (2020).
- Xiaomei, L., Jing, W., Ya, Z. The clinical application value analysis of the 2019-coronary virus disease was analyzed by the whole blood Sars-COV 2 specific antibody detection. Natural Science Edition. 42, (2020).
- Zhang, Y., et al. Generation of Monoclonal Antibodies Against Natural Products. Journal of Visualized Experiments. , e57116 (2019).
- Sai, J., et al. Development of an Enzyme-Linked Immunosorbent Assay and Immunoaffinity Column Chromatography for Saikosaponin d Using an Anti-Saikosaponin d Monoclonal Antibody. Planta Medica. 82, 432-439 (2016).
- Yue, Z., et al. A Highly Sensitive Immunochromatographic Strip Test for Rapid and Quantitative Detection of Saikosaponin d. Molecules. 23 (2), 338 (2018).
- Qu, H., et al. Rapid Lateral-Flow Immunoassay for the Quantum Dot-based Detection of Puerarin. Biosensors and Bioelectronics. 81, 358-362 (2016).
- Zhang, Y., et al. Quantum dot-based lateral-flow immunoassay for rapid detection of rhein using specific egg yolk antibodies. Artificial Cells, Nanomedicine, and Biotechnology. 1, (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved