Method Article
Operación de fotobiorreactores de laboratorio con mediciones de crecimiento en línea y regímenes de luz personalizables
En este artículo
Resumen
Esta publicación describe el diseño de fotobiorreactores de laboratorio (PBR) con regímenes de luz personalizables. El crecimiento de cianobacterias o microalgas, utilizando bicarbonato como fuente de carbono, se monitorea continuamente midiendo la producción volumétrica de oxígeno. Estos PBR facilitan comparaciones de crecimiento de laboratorio rápidas y replicadas con poca intervención del usuario durante los experimentos.
Resumen
El estudio de laboratorio de microalgas puede ser un desafío experimental. Además de los requisitos de cultivo de microorganismos no fotosintéticos, los fotótrofos también requieren iluminación. Rutinariamente, los investigadores buscan proporcionar suministros de luz personalizados, es decir, variar la intensidad de la luz y el tiempo durante el cual se entrega. Tal flexibilidad es difícil con las luces de sobremesa estándar. Por lo general, los estudios de cultivo también requieren comparaciones de crecimiento entre tratamientos experimentales. Con frecuencia, el crecimiento se evalúa durante una duración prolongada, por ejemplo, varias veces al día durante un ensayo de una semana de duración. Las mediciones manuales pueden llevar mucho tiempo y carecer de resolución de datos. Por lo tanto, los fotobiorreactores (PBR) con monitoreo automático del crecimiento y suministro de luz personalizable son útiles para experimentos replicados con múltiples tratamientos. El trabajo actual presenta el diseño, construcción y operación de PBR de laboratorio. Los materiales son de fácil obtención y relativamente baratos. El diseño podría duplicarse con una habilidad moderada. Cada estructura tiene una huella de ~ 40 cm2 y alberga tres botellas de vidrio de 1 L para la replicación por triplicado. Las botellas descansan sobre plataformas que contienen agitadores magnéticos y están dispuestas verticalmente dentro de una tubería de cloruro de polivinilo (PVC) de 1 m de alto y 15 cm de diámetro. El interior de la tubería está revestido con diodos emisores de luz (LED). Estos LED producen intensidades de luz continuas de 0 a 2400 fotones μmol m-2 s-1 de radiación fotosintéticamente activa (PAR). Los usuarios diseñan un programa de iluminación personalizado. La intensidad de la luz se puede ajustar cada segundo o mantenerse constante durante más tiempo. El oxígeno producido a partir de la fotosíntesis sale de cada botella a través de un sensor de gas volumétrico unidireccional. El software se utiliza para registrar los datos del sensor de gas. La cantidad de oxígeno producido se puede correlacionar con el crecimiento de la biomasa. Si se requieren muestras de biomasa, se puede utilizar una jeringa para extraer el cultivo. El método es adecuado para microalgas cultivadas con bicarbonato como fuente de carbono. Estos PBR son valiosos para un laboratorio que requiere experimentos replicados, flexibilidad de régimen de luz y datos de crecimiento continuo de alta resolución.
Introducción
Las microalgas y las cianobacterias, llamadas colectivamente microalgas por simplicidad, se defienden por su potencial en la biotecnología sostenible. Son candidatos atractivos debido a su rápido crecimiento, capacidad para ser cultivados en tierras no cultivables y por su uso de la luz solar para impulsar la conversión de dióxido de carbono en biomasa 1,2,3. La biomasa de microalgas se puede convertir en productos como la bioenergía en forma de petróleo o gas, colorantes alimentarios y suplementos nutricionales, y materiales como biopolímeros 1,4,5,6,7. Además, se pueden utilizar para tratar aguas residuales o remediar cuerpos de agua consumiendo exceso de nutrientes 8,9. Dado esto, la investigación de microalgas está muy extendida y establecida. El campo crece a medida que la sociedad reconsidera la intensidad de carbono y la sostenibilidad ambiental de los enfoques actuales de fabricación y generación de energía.
Tres requisitos fundamentales de los estudios de microalgas basados en laboratorio son un recipiente de cultivo, una fuente de luz y un método para cuantificar el crecimiento. El término fotobiorreactor (PBR) describe una configuración en la que se iluminan los vasos de cultivo10. Comúnmente, los estudios de microalgas tienen como objetivo comparar el crecimiento entre dos o más tratamientos, por ejemplo, diferentes medios de crecimiento, regímenes ligeros o especies 11,12,13. Para la relevancia estadística, cada condición, por ejemplo, tratamiento y control, debe ser replicada. Si el control y el tratamiento se ejecutan simultáneamente, esto significa que muchos PBR deben ser monitoreados y muestreados durante la duración de un experimento. El desafío de operar múltiples PBR es doble. En primer lugar, suministrar una intensidad de luz uniforme a cada PBR es esencial para la reproducibilidad, pero puede ser difícil. La cantidad de luz incidente en la superficie del recipiente está influenciada por su distancia de la fuente de luz, el sombreado de los recipientes adyacentes y las fluctuaciones de la luz de fondo14. En segundo lugar, se debe seleccionar un método para cuantificar con precisión el crecimiento.
El crecimiento se mide comúnmente por el recuento de células, la densidad óptica (OD), el contenido de clorofila A, la densidad de peso seco (DW) y la densidad de peso seco libre de cenizas (AFDW)15. Los recuentos celulares, el contenido de clorofila A y los métodos gravimétricos son procesos manuales que producen puntos de datos discretos. La OD se puede medir de forma continua y no invasiva con un espectrofotómetro, siempre que esté bien calibrado con otro método como la densidad AFDW15. Sin embargo, las mediciones de OD y el contenido de clorofila A pueden ser poco confiables, ya que los resultados varían en diferentes condiciones de cultivo, por ejemplo, entre especies y a lo largo del ciclo de crecimiento15,16. Para la clorofila A, el método de extracción también puede afectar el rendimiento del pigmento17. El contenido de clorofila A es particularmente útil para rastrear el crecimiento de microalgas dentro de comunidades microbianas que también contienen organismos no fotosintéticos17,18. Al elegir un método para determinar el crecimiento, es esencial considerar la morfología de la suspensión. Cuando los organismos se agrupan y no están bien mezclados, los recuentos de OD y células no sonposibles 15. Un solo método no es adecuado para todas las aplicaciones experimentales: los investigadores deben decidir qué métodos son prácticos y relevantes para sus objetivos experimentales.
AFDW es un método confiable que permite comparaciones de crecimiento entre diversas condiciones de cultivo, en particular, entre especies y medios de cultivo 15,19,20. Para calcular el AFDW, primero se concentra una muestra de cultivo de microalgas, ya sea por filtración o centrifugación, y se seca. En esta etapa, se puede determinar el DW. Por lo general, la muestra de DW contiene al menos un 8-10% de material inorgánico de cenizas, como sales y partículas15. DW rastrea las tendencias de crecimiento, pero puede estar sesgado si la contribución de los inorgánicos varía. Para determinar la densidad de AFDW, la biomasa seca se quema a alta temperatura; esto vaporiza la porción orgánica o útil mientras deja cenizas (inorgánicas) detrás de19. Para calcular el AFDW, el peso de la fracción de ceniza se resta del de la fracción de DW. Típicamente, en suspensiones de microalgas, AFDW varía de 0.1 a 3 g / L 12,21,22. Pequeños volúmenes de suspensiones diluidas producen poca biomasa seca, <10 mg. Después de la combustión, la ceniza solo puede pesar 1 mg. Por lo tanto, dependiendo de la densidad de cultivo, este método requiere volúmenes entre 5-100 ml y escalas analíticas precisas a 0,1 mg 12,15,19,22. Los PBR de laboratorio suelen ser pequeños, un par de litros como máximo, por lo tanto, cada muestra líquida agota el volumen de cultivo. Además, el método AFDW es manual y tarda de 2 a 3 días. Para experimentos replicados y repetitivos, es preferible un proceso automatizado y continuo.
Para las microalgas que utilizan bicarbonato como fuente de carbono, se pueden medir continuamente dos métricas de crecimiento adicionales. La fotosíntesis consume bicarbonato y produce oxígeno. El consumo de bicarbonato eleva el pH medio23. Una sonda de pH sumergida puede medir este cambio. La producción de oxígeno fotosintético aumenta la concentración de oxígeno disuelto (DO) del medio hasta que el medio se satura. Más allá de la saturación, el oxígeno existe como burbujas. La producción de oxígeno se mide mediante muchas técnicas diferentes: las sondas miden la concentración de OD, los dispositivos manométricos evalúan la presión del espacio de cabeza, la cromatografía de gases mide la composición del espacio de cabeza y los sensores volumétricos registran la salida de gas 24,25,26,27. Cuando se utiliza oxígeno como un proxy de crecimiento, los recipientes de cultivo deben estar completamente sellados o permitir solo la salida de gas. Para las mediciones de pH y oxígeno, el carbono debe suministrarse en forma de bicarbonato, no mediante la absorción de CO2. El ahorro de CO2 disminuye el pH medio23 y, como gas, puede alterar las mediciones de oxígeno. Una ventaja del pH y el oxígeno sobre la densidad óptica es que el método no se ve comprometido si las microalgas forman grupos. Aunque indirectos, tanto el pH como el oxígeno son efectivos para comparar el crecimiento entre los tratamientos.
Los PBR en uso hoy en día varían en complejidad. Los laboratorios pueden usar matraces de sobremesa simples, prototipos personalizados o productos disponibles comercialmente. Para los grupos de investigación que buscan actualizar a partir de matraces, el costo de los PBR comerciales o la habilidad técnica y la fabricación de piezas requerida para construir muchos prototipos puede ser una barrera. Este manuscrito tiene como objetivo describir el diseño paso a paso, la construcción y la operación de pbr de laboratorio que cierran esta brecha. Estos PBR tienen un régimen de luz personalizable y monitorean el crecimiento continuamente mediante el registro de la producción volumétrica de oxígeno. Este diseño alberga tres recipientes de cultivo para la replicación triplicada y se puede construir con habilidades moderadas y materiales de fácil acceso. Este PBR es una valiosa adición a un laboratorio que busca expandir su capacidad para la investigación de microalgas sin invertir en productos muy técnicos o costosos. Al elegir adquirir o construir un PBR, los investigadores deben considerar la idoneidad de un diseño para sus condiciones culturales, posición financiera y preguntas de investigación.
Protocolo
1. Construcción del soporte PBR
- Con una sierra de mano, corte cinco longitudes de 380 mm y dos longitudes de 200 mm de acero ranurado en ángulo. Sujete junto con pernos y tirantes de esquina grandes para hacer la base de un soporte (Figura 1A). Pegamento en las tapas de los extremos de seguridad.
- Conecte dos longitudes verticales sin cortar (1220 mm) de acero ranurado en ángulo a la base. Asegure con pernos y refuerzos metálicos en las esquinas (Figura 1B). Pegamento en las tapas de los extremos de seguridad.
- Cortar cuatro longitudes planas de 65 mm de acero ranurado. Atornillarlos en ángulos de 90° en los soportes verticales: conecta dos a cada soporte, uno 130 mm desde la base (Figura 1C) y otro 60 mm hacia abajo desde la parte superior.
- Sujete los soportes verticales a través de su parte superior con una longitud horizontal de 140 mm de acero ranurado plano (travesaño) atornillado a la parte posterior del marco (Figura 2A).
2. Construcción de la cámara de luz
- Corte una tubería blanca de cloruro de polivinilo (PVC) de 153 mm de diámetro a una longitud de 1070 mm. Corta la tubería por la mitad a lo largo con una sierra de cinta. Lija todos los bordes.
- Espacio uniforme y centro de cuatro canales de disipador de calor de aluminio verticalmente junto con el interior de la tubería. No conecte los canales a menos de 20 mm del borde cortado de la tubería. Con pernos pequeños, asegure los canales en su lugar en su parte superior e inferior (Figura 2B).
- Atornille la mitad de la tubería al soporte utilizando los soportes horizontales diseñados en el paso 1.3.
- Coloque el reactor y reúna las mitades de la tubería pegándolas con cinta adhesiva. Centra la bisagra del piano a lo largo de una línea de corte. Trace los orificios de la bisagra y perfore la tubería en consecuencia. Use una pistola de remache y remaches de longitud media para sujetar la bisagra a la tubería.
- Use un pequeño cable elástico (consulte la Tabla de materiales) para mantener la tubería cerrada (Figura 1C).
- Consulte a un electricista para conectar las luces LED e instale los siguientes cuatro componentes: controlador LED, decodificador de múltiplex digital (DMX), controlador de iluminación DMX y caja de interruptores (consulte la Tabla de materiales). Fije todos los componentes en la parte posterior del PBR de acuerdo con la Figura 2A.
3. Construcción de las plataformas de botellas
- Cortar formas de plataforma (Figura 3A) de plástico duro, por ejemplo, polietileno de alta densidad (HDPE) (consulte la Tabla de materiales), utilizando fresado de control numérico por computadora (CNC). Haz tres de cada forma.
NOTA: Se recomienda cortar las capas superior e inferior de repuesto. - Pega con cinta adhesiva la capa inferior y superior. Marque y perfore cinco pequeños orificios, de 6 mm de diámetro, a través de ambas formas (Figura 3A). Usando una broca más grande, expanda cuidadosamente la superficie de estos orificios para que las cabezas de los pernos puedan empotradas (Figura 3B).
- Para cada una de las tres plataformas, atornille dos pequeños tirantes de esquina a la mitad posterior de la tubería.
NOTA: La distancia entre la parte superior de los tirantes debe ser de 350 mm. - Centra cada capa inferior en la parte superior de sus brackets. Marque la ubicación de los orificios de perforación debajo de los tirantes. Taladra dos orificios de 6 mm de diámetro. Usando una broca más grande, expanda cuidadosamente la superficie de los orificios para que los pernos puedan empotrarse.
- Atornillar las capas inferiores a sus tirantes (Figura 3B-C).
- Cortar quince piezas de tubo rígido de 12 mm de largo y 6,35 mm de diámetro exterior (OD). Coloque cinco piezas del tubo rígido entre cada capa superior e inferior. Sujete las capas y los tubos junto con pernos largos y estrechos de acuerdo con la Figura 3B-D.
- Perfore un agujero grande en la tubería de PVC detrás de cada plataforma. Inserte cada agitador micromagnético en su plataforma. Enrosque el cable eléctrico de cada agitador a través de estos orificios recién cortados (Figura 3C–E). Conecte cada agitador a su respectiva unidad de control, así como a una toma de corriente.
- Coloque una botella de 1 L en cada plataforma. Agregue pernos oculares en el tubo trasero a nivel del cuello de la botella. Envuelva un pequeño cordón elástico alrededor de cada cuello de botella para agregar estabilidad (Figura 4A).
NOTA: A lo largo del protocolo, las plataformas de codificación de colores, las botellas, los agitadores magnéticos y todos los cables y sensores asociados serán útiles.
4. Construcción de los puertos de muestreo de líquidos (opcional)
- Corte tres tubos rígidos de 60 mm de longitud de 6,35 mm OD. Usando una broca de 5 mm, perfore agujeros a través de cada tapón de goma. Empuje longitudes de tubo rígido a través del tapón.
- Corte tres tubos rígidos de 60 mm de longitud de 3,18 mm OD. Conéctelos con un reductor recto al tubo que sobresale en la parte inferior de cada tapón.
- Inserte una válvula de llave de paso unidireccional (por ejemplo, puerto 1 = Luer hembra, puerto 2 = Luer deslizante macho) en el tubo que sobresale en cada superficie del tapón (Figura 4A).
- Corte tres tubos flexibles de 30 mm de longitud de 3,18 mm OD. Inserte accesorios Luer (por ejemplo, Luer macho a la púa de la manguera y Luer hembra a la púa de la manguera) en cada extremo.
- Conecte las piezas realizadas en el paso 4.4 a las válvulas de llave de paso en la superficie de cada tapón de goma (Figura 4A).
NOTA: Muchas combinaciones de llaves de paso y accesorios Luer pueden producir el mismo resultado. El diseño debe permitir que el líquido se extraiga o inserte a través de una jeringa.
5. Conexión de sensores de gas volumétricos
- Prepare los sensores de gas de acuerdo con las instrucciones del fabricante.
NOTA: Esto implica principalmente el llenado de sensores de gas con líquido de embalaje (Figura 4B). - Para hacer las líneas de gas, corte tres tubos flexibles de 1000 mm de longitud de 3,18 mm OD.
- Perfore tres orificios de 4 mm de diámetro en la tubería trasera de PVC. Coloque los orificios junto a la bisagra a la altura del cuello de la botella. Enhebrar líneas de gas a través de estos orificios (Figura 4A).
- Al final de la línea de gas dentro de la tubería de PVC, agregue un accesorio Luer (por ejemplo, púa de manguera al Luer macho) y conecte una válvula de llave de paso unidireccional (por ejemplo, puerto 1 = Luer hembra, puerto 2 = Luer macho).
NOTA: La válvula solo es necesaria cuando también se instalan puertos de muestreo de líquidos. - Unir el otro extremo de la línea de gas al puerto de entrada del sensor de gas utilizando un reductor recto. Asegure esta conexión con una cremallera.
- Conecte todos los sensores de gas al módulo de entrada digital (DIM) con cables de conexión jack y el DIM a un ordenador cercano.
- Instale el software de adquisición de datos (consulte la Tabla de materiales) en un sistema operativo Windows y conecte el dongle de clave de licencia. Agregue archivos de calibración del sensor al directorio de calibración del software.
6. Programación del régimen de luz
- Usando el interruptor trasero de encendido / apagado, encienda el PBR y conecte el controlador de iluminación DMX a una computadora a través de un cable micro-USB.
- Descargue Store Upgrade Tools (SUT) y el software de control LED (consulte la Tabla de materiales). Registre el controlador de iluminación DMX en línea.
- Abra el software de control LED y seleccione Haga clic aquí para trabajar con la interfaz USB-DMX: SUSHI-RB-RJ.
- En la pestaña Configuración del cuadro ScanLibrary , seleccione la carpeta Genérico y Canal único. Cambie la configuración de ScanLibrary a DMX universo 1, el número de accesorios a 4 y el número de índice a 1. En la esquina superior derecha, cambie el cuadro desplegable a Vista de lista. Por último, haga clic en Parche (Figura suplementaria 1).
NOTA: En el universo DMX, un cuadro prueba el control de cada tira de LED deslizando los botones de atenuación o introduciendo un valor numérico en el cuadro de texto. - Realice una curva estándar que relacione el ajuste de luz digital en el software de control de iluminación con la intensidad de luz experimentada en el centro del tubo de PVC (Figura 5). Mida la intensidad de la luz interna con una pequeña sonda esférica (consulte la Tabla de materiales) suspendida en el centro de la tubería de PVC.
- Avance a la pestaña Editor . Para crear un programa de luz personalizado, cree una nueva escena y comience a agregar pasos. Consulte la Tabla suplementaria 1 para ver un ejemplo de programa diurno de 16:8 h. Establezca la escena en bucle.
NOTA: Los pasos dividen las escenas en bloques de tiempo, cada uno de los cuales se puede configurar a una intensidad de luz diferente. Los pasos van desde 1 s hasta 43 min. Aquí, los pasos de 30 minutos son los más convenientes. Se pueden cargar varias escenas en un dispositivo controlador de iluminación DMX. - Cree una escena auxiliar adicional que sea inmediatamente reconocible, por ejemplo, dos de los cuatro LED encendidos.
NOTA: Las escenas se pueden recorrer manualmente utilizando el botón en el lateral del controlador de iluminación DMX. Si el programa de luz deseado comienza durante la noche, será imposible distinguir si el programa de luz ya ha comenzado. La escena auxiliar sirve como un indicador de que el controlador de iluminación DMX está funcionando correctamente. - Guarde las escenas y avance a la pestaña Independiente . Escriba la memoria del controlador de iluminación DMX y desconecte el dispositivo de la computadora.
- Conecte el controlador de iluminación DMX a su fuente de alimentación mediante un micro-USB.
- Antes de comenzar un experimento, pruebe el programa de luz registrando la intensidad de la luz interna durante 24 horas. Si la temperatura del líquido es de interés, regístrela simultáneamente con una sonda de temperatura sumergida (Figura 6).
7. Iniciar un experimento
- Esterilice medios, botellas, barras de agitación, tapones de goma, puertos de muestreo, tapones de rosca de apertura roscada y tubos.
NOTA: Todos los componentes utilizados en este diseño son esterilizables en autoclave, excepto las válvulas y los accesorios Luer; hay alternativas en autoclave de otros fabricantes. - Abra el software de adquisición de datos y rellene la página de configuración (Figura complementaria 2). Asigne archivos de calibración a sus respectivos sensores.
- En Nombre de archivo de directorio , seleccione la carpeta de número de puerto DIM correspondiente. Haga clic en Carpeta actual y repita para todos los puertos.
- Haga clic en Aceptar para pasar a la página de registro.
- Llene las botellas al volumen deseado con el medio de cultivo (Tablas suplementarias 2,3).
NOTA: Cada una de estas botellas tendrá un máximo de ~ 1.1 L con un pequeño espacio para la cabeza (~ 80 ml, incluida la línea de gas). - Centrifugar el cultivo de stock en tres tubos equilibrados de 50 ml durante 15 min a 4500 x g para producir tres pellets. Agregue un pellet a cada botella, lave en gránulos con una pipeta serológica y un medio fresco.
NOTA: La densidad de cultivo del día 0 también se conoce como concentración inicial de biomasa (IBC). Para medir el IBC en gAFDW. L-1, un tubo adicional de 50 ml puede ser centrifugado en el paso 7.6. El pellet resultante se puede secar y quemar15,19. El paso 7.6 probablemente requerirá una modificación basada en los objetivos individuales de los usuarios y sus experimentos. - Deje caer un agitador magnético, de 25 x 8 mm, en cada botella.
- Selle cada abertura de la botella con un tapón de goma y un tapón de rosca de apertura roscada (Figura 4A). Si se instalan puertos de muestreo opcionales, cierre las válvulas.
- Ubique el extremo de cada línea de gas dentro de la tubería de PVC (construida en el paso 5.4) y conecte una aguja al puerto Luer macho de la válvula.
- Conecte cada botella a su sensor de gas perforando cada tapón de goma con la aguja correspondiente.
- Inicie cada sensor de gas individualmente marcando la casilla de verificación en el lado izquierdo de la pantalla, haciendo clic en Inicio e ingresando un nombre de archivo. Haga clic en Aceptar y repita para todos los sensores (Figura suplementaria 3).
NOTA: Durante el registro, no salga de la ventana de adquisición de datos. Establezca la configuración de encendido y suspensión de la computadora para nunca y posponga las actualizaciones de la computadora durante la duración del experimento. - Encienda el PBR y asegúrese de que el controlador de iluminación DMX esté conectado a una fuente de alimentación. La primera escena programada comenzará automáticamente. Consulte el paso 6.7 para confirmar que el controlador de iluminación DMX funciona correctamente.
8. Muestreo de botellas (opcional)
- Preparar 500 ml adicionales del medio fresco antes de comenzar el experimento (Tabla suplementaria 2).
NOTA: Si se inició un programa de luz de 24 h con un ciclo diurno de 16:8 h a las 9 am, entonces los tiempos de muestreo antes del anochecer y el amanecer caerían a las 8 am y 4 pm (Tabla suplementaria 1). Aquí, el amanecer y el anochecer se refieren a pasos de 30 minutos que hacen la transición de las luces de ON a OFF y viceversa. - Cierre la válvula de la línea de gas.
- Conecte una jeringa (10 ml) a la válvula del puerto de muestreo (Figura 4A).
- Abra la válvula del puerto de muestreo y retire 8 ml de cultivo.
NOTA: Se recomienda entre 5 y 10 ml. La eliminación del líquido genera un vacío en el espacio de cabeza, lo que dificulta la extracción de volúmenes >10 ml. - Cierre la válvula del puerto de muestreo y desconecte la jeringa.
- Conecte una jeringa que contenga 8 ml de medio fresco (a partir del paso 8.1) a la válvula del puerto de muestreo.
- Abra la válvula del puerto de muestreo e inyecte el medio fresco.
NOTA: Reemplazar el volumen de cultivo muestreado con medio fresco sirve para mantener un volumen y presión de espacio de cabeza iguales y enjuagar la línea del puerto de muestreo. - Cierre la válvula del puerto de muestreo antes de desconectar la jeringa.
- Repita los pasos 8.2 a 8.8 en cada momento de muestreo.
9. Poner fin a un experimento
- Marque todas las casillas de verificación de puertos activos en la ventana de adquisición de datos y haga clic en Detener.
- Para exportar datos, seleccione Archivo y datos sin conexión. Seleccione todos los archivos de registro relevantes. Exporte los datos al software de hoja de cálculo y guárdelos.
- Para cada botella, convierta el volumen total de oxígeno medido en ml a moles utilizando la ley del gas ideal. Predecir el peso de la biomasa cultivada (gAFDW) si se generan 1,05 mole de O2 por cada mol de biomasa producida. Tome el peso molar de la biomasa como 24,6 g mol-1.
- Seleccione manualmente los datos de caudal. Utilice unidades de ml/h y una media móvil de 3 puntos.
Resultados
Aquí la tasa de flujo de oxígeno es una medida de la tasa fotosintética de la cultura. Las tasas más altas de fotosíntesis, y por lo tanto la fijación de carbono, se traducen en mayores tasas de crecimiento. Esto significa que el usuario puede comparar las tasas de flujo de oxígeno entre diferentes tratamientos y días operativos como un indicador del crecimiento. Brevemente, el sensor de gas funciona atrapando y liberando burbujas de gas en una celda de medición de doble cámara (Figura 4B). Las burbujas de gas de la entrada en la base del sensor viajan hacia arriba a través del líquido de embalaje. Las burbujas se acumulan en una cámara de la celda de medición a un volumen de ~ 3.2 mL. Una vez que se alcanza este umbral, la celda de medición se inclina. Esto libera el gas y restablece el sistema. Cada consejo es registrado por el software de adquisición de datos.
En los datos de ejemplo, se comparó la tasa de crecimiento de tres tratamientos con intensidades de luz diurna variables y concentraciones iniciales de biomasa (IBC). Estos tratamientos fueron elegidos arbitrariamente con fines demostrativos. Fueron (A)fotones de 300 μmol m-2 s-1 y 0,03 gAFDW L-1, (B)fotones de 600 μmol m-2 s-1 y 0,13 gAFDW L-1, y (C)fotones de 600 μmol m-2 s-1 y 0,40 gAFDW L-1. Estas irradiancias se midieron con una sonda esférica en el centro de la tubería de PVC antes de colocar las botellas en las plataformas. La profundidad y la densidad del cultivo afectan la atenuación de la luz. Por lo tanto, la intensidad de luz real experimentada por las microalgas puede variar de las reportadas. Cada tratamiento se realizó por triplicado, dentro de un PBR que contenía tres botellas.
Aquí, un experimento exitoso se caracterizó por patrones diurnos de producción de gas estrechamente replicados (Figura 7A-C). Durante las horas iluminadas (día), la producción de gas aumentó constantemente, y durante las horas no iluminadas (noche), la producción de gas se detuvo (Figura 7A-C). Dos gases son producidos por las microalgas, el oxígeno de la fotosíntesis y el dióxido de carbono de la respiración28. La fotosíntesis está restringida a horas iluminadas, mientras que la respiración ocurre continuamente, pero es más activa por la noche28. La fotosíntesis construye, mientras que la respiración cataboliza la biomasa28. Inicialmente, la composición del gas del espacio de cabeza es idéntica a la de la atmósfera. Con cada giro de la celda de medición, el O2 desplaza el gas atmosférico. Por lo tanto, las lecturas del sensor de gas se atribuyeron a la producción de O2, incluso si el gas saliente no era puro O2. La presión mínima de entrada de gas para el sensor de gas es extremadamente baja, de 8 a 9 mbar, lo que hace que la presión del espacio de cabeza de la botella sea solo ligeramente superior a la atmosférica (1,01 bar a nivel del mar). Por lo tanto, las lecturas del sensor de gas comienzan poco después de que las burbujas de O2 abandonan el medio.
El CO2 liberado de la respiración no contribuye a las lecturas del sensor de gas por dos razones. En primer lugar, en el medio alcalino, el CO2 reacciona al bicarbonato, disminuyendo el pH (Figura 8). En segundo lugar, si el CO2 se escapa, el líquido que contiene el sensor de gas, Silox, disuelve las burbujas de CO2 antes de que puedan llegar a la celda de medición, desgasificando el CO2 en la superficie líquida29. Esto se ve respaldado por la falta de lecturas de sensores de gas durante la noche. Los que ocurrieron se registraron poco después de que se apagaron las luces, lo que indica que las lecturas representaban la liberación residual de oxígeno durante el día (Figura 7).
En la configuración experimental (utilizando datos locales de temperatura y presión), un espacio de cabeza de 80 ml a presión ambiente requirió 340 ml de O2 ex resuelto para establecer una presión parcial de O2 del 99%. Aquí, el volumen total de oxígeno producido durante 4 días varió de 316 (SEM ± 11) ml en el tratamiento A a 902 (SEM ± 51) ml en el tratamiento C (Tabla 1). Por lo tanto, al final del experimento, el espacio de cabeza de todas las botellas habría contenido principalmente O2. El aumento de la concentración de espacio de cabeza O2, y por lo tanto la disminución de la concentración de N2, habría afectado la presión parcial y la saturación de estos gases. Con un espacio de cabeza de O2 del 99%, se calculó un aumento de 5 veces en DO. Para los cultivos de 1,1 L, esto se tradujo en 23 ml adicionales de DO. Por el contrario, se estimó que el cambio a un espacio de cabeza de N2 del 1% habría causado que 15 ml de N2 se disolvieran. Esto significa que bajo un espacio de cabeza de oxígeno casi puro, se disolvió más O2 que N2 . Por lo tanto, debido a que queda más O2 en el medio, este efecto habría llevado a ligeras subestimaciones en la cantidad de oxígeno fotosintético producido.
El principal desafío de este método surgió cuando las culturas se volvieron densas. Con más biomasa y, por lo tanto, más respiración, la demanda de O2 aumentó. El consumo nocturno de O2 generó un espacio de cabeza bajo presión. Esto hizo que el líquido de embalaje del sensor de gas viajara a través de la línea de gas. Cuando se reanudó la producción de O2 , el líquido de embalaje tuvo que ser devuelto a los sensores de gas. Esto causó un retraso en la primera lectura del sensor de gas. Sin embargo, en la cuarta noche, la magnitud de esta presión hizo que el líquido de embalaje alcanzara y goteara en dos de las tres réplicas del tratamiento B, generando una mancha de aceite superficial. Debido a la reducción del nivel de líquido de embalaje, los sensores de gas se cortocircuitaron, liberando O2 no medido directamente a la atmósfera. Esto hizo que la recopilación de datos se estabilizara (Figura 7B).
La presión insuficiente también puede ser causada por una contracción inducida por la temperatura del volumen del espacio de cabeza. Sin embargo, el efecto aquí fue mínimo. Los canales del disipador de calor y el flujo de aire disiparon adecuadamente el exceso de calor. De los dos regímenes ligeros probados, el cambio de temperatura máximo redujo el volumen del espacio de cabeza en un 1% o menos, lo que equivale a un desplazamiento de líquido de embalaje de 800 μL en un espacio de cabeza de 80 ml. El cambio máximo de temperatura diurna fue de 1,4 °C para losregímenes de fotones m-2 s-1 de 300 μmol (Figura 6) y de 3,2 °C para los regímenes defotones de 600 μmol m-2 s-1. El aumento promedio de la temperatura diurna para los regímenes defotones m-2 s-1 de 300 y 600 μmol fue de 0,7 y 1,8 °C, respectivamente. Las temperaturas de cultivo volvieron a la línea de base durante la noche (Figura 6).
Los datos de tasa de crecimiento de alta resolución pueden revelar tendencias que de otro modo podrían pasar desapercibidas. Considere los tratamientos B y C. A pesar de sus diferentes IBC, ambos generaron la misma cantidad de biomasa total (gAFDW), lo que causó un cambio idéntico en el pH medio (Tabla 1). Dados solo los puntos de datos iniciales y finales, un individuo puede asumir correctamente que no hay diferencia en la tasa de crecimiento promedio entre los dos tratamientos (Tabla 1). Sin embargo, los datos de la tasa de flujo de oxígeno en línea revelaron que cada tratamiento tenía tasas de crecimiento diarias variables. Estas variaciones también se reflejaron en mediciones de pH dos veces al día (Figura 8). El primer día, la tasa de crecimiento del tratamiento B fue menor que la del tratamiento C. Para el tercer día, esto se revirtió con la tasa de crecimiento del tratamiento B superando la del tratamiento C (Figura 7B, C). Los datos de la tasa de flujo de oxígeno indicaron que la tasa de crecimiento más alta ocurrió en el tercer día en el tratamiento B (Figura 7B).
El volumen total de oxígeno generado por cada botella en los tres tratamientos se utilizó para estimar su respectivo cambio en la biomasa total (gAFDW). Esto se logró utilizando una ecuación genérica para la síntesis fotosintética de biomasa: CO2 + 0.2 NH3 + 0.6 H2O = CH1.8 O0.5 N0.2 + 1.05 O2. Se esperaba que el aumento de la presión parcial del espacio de cabeza O2 y el posterior aumento de la saturación de OD causaran una ligera subestimación del crecimiento de la biomasa. Esto fue cierto para cinco de los siete ejemplos (Tabla 2). En promedio, el crecimiento estimado de la biomasa estuvo dentro del 10% del crecimiento de la biomasa medido. Algunas estimaciones difirieron en solo 1-3 mg del crecimiento medido. Dos ejemplos sobreestimaron el crecimiento, es decir, se produjo más oxígeno del que el crecimiento de la biomasa podría explicar. Cualquier O2 consumido por la respiración durante la noche debe reflejarse en el retraso en la producción de O2 al día siguiente. Aquí, los experimentos terminaron al final de la noche. De esta manera, el catabolismo de biomasa durante la noche durante las últimas 8 h de cada experimento no se mide. Esto puede causar sobreestimaciones del crecimiento de la biomasa, especialmente en cultivos densos. Como tal, se recomienda que los experimentos finalicen al final de las horas iluminadas.

Figura 1: Base del soporte del reactor. (A) Dimensiones de los componentes de la base en mm. (B) Orientación de los refuerzos de esquina metálica que aseguran los dos soportes verticales. (C) Una de las cuatro longitudes cortas de acero conecta la mitad posterior de la tubería de PVC al soporte del reactor. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Componentes eléctricos. (A) Vista trasera del PBR que muestra el travesaño superior y la configuración de los componentes eléctricos. (B) Vista frontal de PBR después de la instalación de luz. Haga clic aquí para ver una versión más grande de esta figura.
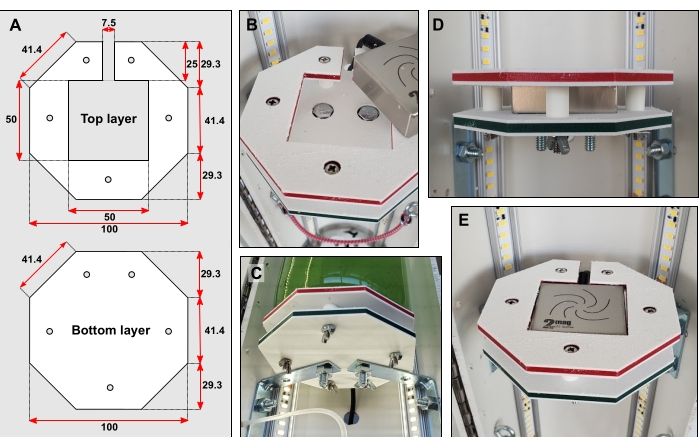
Figura 3: Detalles de la plataforma de la botella. (A) Dimensiones de la capa superior e inferior en mm. (B) Cabezales de pernos empotrados en ambas capas. (C) Los tirantes conectan la capa inferior directamente a la mitad trasera de la tubería de PVC. (D) Cinco piezas cortas de tubos rígidos colocados sobre pernos estrechos mantienen separadas las capas superior e inferior. (E) Cuando la plataforma de la botella esté completa, la superficie debe estar al ras. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Línea de gas y puerto de muestreo opcional. (A) Las líneas de gas conectan cada espacio de cabeza de botella con los sensores de gas exteriores. Si se requiere el puerto de muestreo, las líneas de gas deben incluir una válvula unidireccional inmediatamente aguas abajo de la aguja. (B) Sensor volumétrico de gases. El nivel de embalaje del líquido debe tocar el tornillo de calco. Haga clic aquí para ver una versión más grande de esta figura.
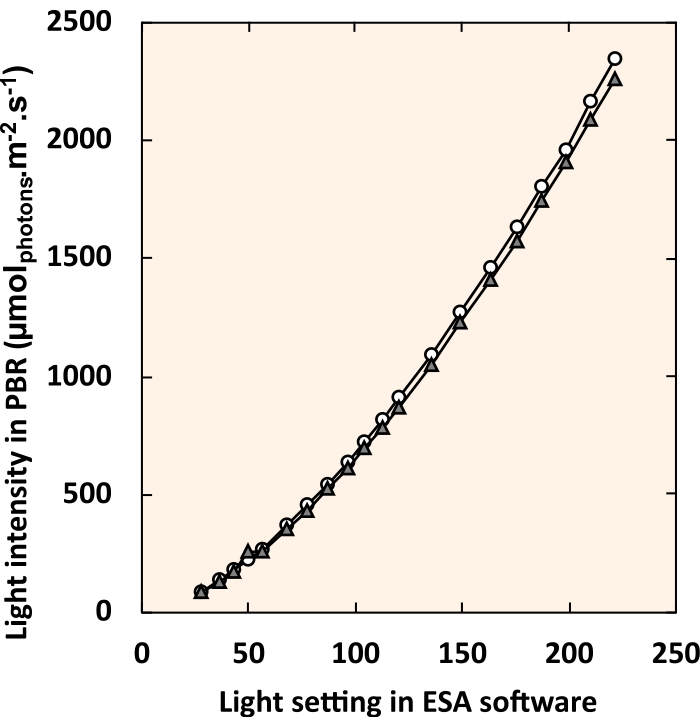
Figura 5: Curva estándar que relaciona la configuración del software de control LED con la intensidad de la luz interna. Los círculos blancos y los triángulos grises representan cada uno un PBR individual. Para cada ajuste de luz, los cuatro accesorios se ajustaron a un valor idéntico. Haga clic aquí para ver una versión más grande de esta figura.
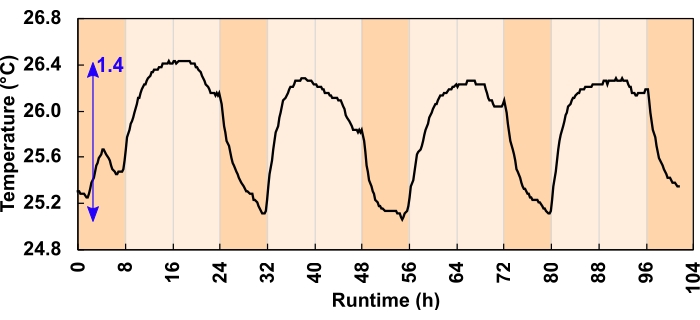
Figura 6: Cambio de temperatura de cultivo para los regímenes de luz m-2 s-1 defotones de 300 μmol. Durante el programa diurno de 24 h y 16:8 h, los LED aumentaron la temperatura de cultivo durante el día. La flecha azul indica la diferencia entre la temperatura mínima y máxima. Un error de programa de luz causó la caída de la temperatura antes del anochecer; esto se corrigió antes de que comenzara el experimento. Haga clic aquí para ver una versión más grande de esta figura.
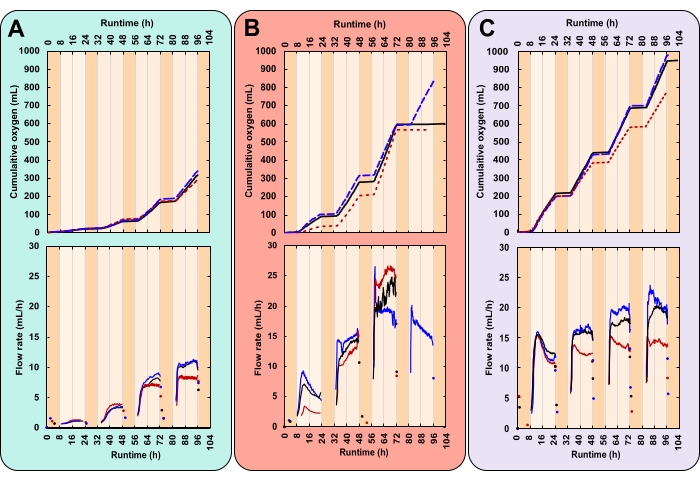
Figura 7: Producción de oxígeno para tres condiciones experimentales únicas. Cada reactor recibió una combinación diferente de intensidad de luz y concentración inicial de biomasa (IBC); (A)Fotones de 300 μmol m-2 s-1 e IBC 0,03 gAFDW L-1, (B)Fotones de 600 μmol m-2 s-1 e IBC 0,13 gAFDW L-1, (C)Fotones de 600 μmol m-2 s-1 e IBC 0,40 gAFDW L-1. Los gráficos superiores muestran la producción acumulada de oxígeno (ml) y el caudal de gas (ml/h). Las líneas negras sólidas, las líneas azules discontinuas y las líneas rojas punteadas son réplicas. El tiempo de ejecución para cada experimento fue de 104 h, que incluyó cuatro ciclos completos de 16:8 h día-noche. El sombreado naranja oscuro representa las horas nocturnas y las horas diurnas de color naranja claro. Tenga en cuenta que en el tratamiento B, la producción de oxígeno se alinea en el día 4 para dos de las tres réplicas. Haga clic aquí para ver una versión más grande de esta figura.

Figura 8: Respuesta al pH. Cada reactor recibió una combinación diferente de intensidad de luz e IBC; (diamantes verdes) 300 μmolfotones m-2 s-1 e IBC 0.03 gAFDW L-1, (triángulos rojos) 600 μmolfotones m2 s-1 e IBC 0.13 gAFDW L-1, (círculos púrpuras) 600 μmolfotones m-2 s-1 e IBC 0.40 gAFDW L-1 . El sombreado naranja oscuro representa las horas nocturnas y las horas diurnas de color naranja claro. Las barras de error representan el error estándar de la media. Haga clic aquí para ver una versión más grande de esta figura.
| Tratamiento | Intensidad de la luz (fotones μmol m-2 s-1) | IBC (gAFDW L-1) | Δ biomasa total (gAFDW) | Δ pH | Oxígeno total producido (ml) |
| Un | 300 | 0.031 | 0,289 (± 0,01) | 0,15 (± 0,01) | 316.2 (±11.4) |
| B | 600 | 0.130 | 0,674 (± 0,02) | 0,52 (± 0,27) | 834.6* |
| C | 600 | 0.400 | 0,675 (± 0,02) | 0,55 (± 0,03) | 902.2 (±50.5) |
| * Solo una de las tres réplicas tuvo éxito | |||||
Tabla 1: Cambio de la métrica de crecimiento de la hora 0 a la 104. Los corchetes representan el error estándar de la media.
| Tratamiento | Intensidad de la luz (fotones μmol m-2 s-1) | IBC (gAFDW L-1) | Crecimiento de biomasa medido (gAFDW) | Crecimiento de la biomasa previsto (gAFDW) | Subestimar (%) |
| Un | 300 | 0.031 | 0.289 | 0.288 | 0.5 |
| Un | 300 | 0.031 | 0.311 | 0.270 | 13.1 |
| Un | 300 | 0.031 | 0.268 | 0.247 | 7.9 |
| B | 600 | 0.13 | 0.708 | 0.705 | 0.4 |
| C | 600 | 0.4 | 0.718 | 0.796 | -10.9 |
| C | 600 | 0.4 | 0.640 | 0.830 | -29.7 |
| C | 600 | 0.4 | 0.668 | 0.659 | 1.3 |
Tabla 2: Estimaciones de crecimiento basadas en el oxígeno total medido. Solo una réplica de losfotones de 300 μmol m-2 s-1 e IBC = 0,13 gde tratamiento AFDW L-1 se completó.
Figura complementaria 1: Captura de pantalla del software de control LED. Cada una de las cuatro luminarias se puede controlar de forma independiente deslizando los botones de atenuación o introduciendo un valor numérico en el cuadro de texto. Haga clic aquí para descargar este archivo.
Figura complementaria 2: Captura de pantalla de la ventana de configuración del software de adquisición de datos. Haga clic aquí para descargar este archivo.
Figura complementaria 3: Captura de pantalla de la ventana de registro del software de adquisición de datos. Los rectángulos de color verde brillante indican sensores de gas en línea. Los datos se muestran en tiempo real. Haga clic aquí para descargar este archivo.
Tabla complementaria 1: Ejemplo de régimen ligero de 24 h. Para un programa diurno de 16:8 h, hay 48 series de 30 minutos cada una. Los asteriscos indican los tiempos de muestreo sugeridos. Haga clic aquí para descargar esta tabla.
Tabla suplementaria 2: Composición media de pH alto de alta alcalinidad. Haga clic aquí para descargar esta tabla.
Tabla suplementaria 3: Solución de oligoelementos. Añadir a una concentración final de 1 mL/L al medio base. Haga clic aquí para descargar esta tabla.
Discusión
Dentro de este protocolo, centrarse en los siguientes pasos aumenta la probabilidad de generar datos reproducibles y de alta calidad. Al construir el soporte del reactor (paso 1), la base debe ser resistente con soportes verticales bien alineados. El acero ranurado tiene bordes afilados, por lo que la adición de tapas de seguridad es esencial. Las superficies de la plataforma de la botella deben ser completamente planas, el agitador magnético y las cabezas de los pernos deben sentarse debajo de la superficie de la capa superior (pasos 3.2-3.6). De acuerdo con las instrucciones del fabricante, el líquido de embalaje del sensor de gas debe llenarse con el "tornillo de rastreo para el nivel de líquido" para mediciones precisas de oxígeno. Este nivel de líquido debe verificarse regularmente, ya que la evaporación del líquido de embalaje puede cortocircuitar la celda de medición. Las tres líneas de gas hechas en el paso 5.2 deben tener la misma longitud; esto asegura que las réplicas tengan volúmenes de espacio de cabeza idénticos. Antes de comenzar un experimento, es aconsejable probar el régimen de luz programado registrando la intensidad de la luz durante un período de 24 h (paso 6.11). Si los aumentos en la temperatura del líquido son motivo de preocupación, esta prueba también debe incluir una botella sellada con una sonda de temperatura interna (paso 6.11). Al iniciar sesión, no salga de la ventana del software de adquisición de datos; esto terminará el registro. Si toma muestras de cultivo, tenga cuidado de no liberar gas de espacio de cabeza abriendo válvulas en la secuencia incorrecta (pasos 8.2-8.8). Al revisar los datos experimentales, tenga en cuenta que el software de adquisición de datos genera automáticamente una media móvil del caudal. Esto infla el valor de una o dos lecturas de caudal generadas durante la noche. Curar los registros del sensor de gas manualmente para rectificar esto.
El contratiempo más común con este método es el potencial de cortocircuitar el sensor de gas si el nivel de empaque de líquido disminuye. Hay dos formas en que esto puede ocurrir. En primer lugar, la evaporación puede reducir lentamente el nivel de líquido. Sin embargo, esto es poco probable durante un experimento a corto plazo (<7 días)29. En segundo lugar, las altas tasas de respiración pueden atraer oxígeno a la solución y generar un espacio de cabeza bajo presión. Cuando la energía de la luz no está disponible, las microalgas utilizan la respiración aeróbica para suministrar la energía requerida para el mantenimiento y la reparación celular28. Por lo tanto, en cultivos densos durante horas no iluminadas, el consumo de oxígeno y la presión resultante pueden ser sustanciales. Esto succiona el líquido de embalaje de los sensores de gas en la línea de gas. La distancia que recorre el líquido de embalaje es proporcional a la cantidad de respiración nocturna. Si el líquido de embalaje entra en las botellas, esto genera una mancha de aceite en la superficie del líquido.
Si se esperan altas tasas de respiración nocturna, se pueden realizar modificaciones al protocolo. La forma más sencilla de evitar la presión es dejar los espacios de la cabeza de la botella abiertos durante la noche. Esto también tiene la ventaja de aliviar los niveles de OD al disminuir la presión parcial del espacio de cabeza de O2. Se cree que las altas concentraciones de OD son perjudiciales para el crecimiento, ya que el O2 puede impedir la actividad de Rubisco y puede desencadenar el estrés oxidativo30,31. No es raro que las suspensiones de cultivo alcancen 4 veces la sobresaturación incluso cuando están en contacto con la atmósfera25,32. Para abrir el espacio de cabeza, desconecte la línea de gas de la aguja que atraviesa el tapón de goma. Las horas nocturnas pueden servir como una ventana para recargar el líquido que contiene el sensor de gas o manipular experimentos continuos con poco impacto en la recopilación de datos. Por ejemplo, uno puede alterar la densidad del cultivo, refrescar nutrientes, agregar una enmienda o introducir un patógeno. Las botellas deben volver a sellarse y la línea del sensor de gas debe volver a conectarse antes de que las luces vuelvan a encenderse. Las mediciones de oxígeno recogidas de los experimentos con espacios nocturnos cerrados versus abiertos diferirán.
Cuando las botellas permanecen selladas, el consumo nocturno de oxígeno reduce el número de moles de O2 en el espacio de cabeza. Esto hace que el líquido de embalaje se arrastre por la línea del sensor de gas para mantener la presión del espacio de cabeza. Cuando las luces se encienden, se reanuda la producción de oxígeno. El líquido de embalaje debe ser empujado de nuevo en el sensor de gas antes de que comiencen las lecturas de caudal. Por lo tanto, este retraso es proporcional al grado de respiración nocturna. De esta manera, cuando el espacio de cabeza permanece cerrado, las lecturas de O2 representan la producción neta de O2 (producción fotosintética - consumo respiratorio). Por el contrario, cuando el espacio de cabeza está abierto por la noche, el gas atmosférico reemplaza el espacio de cabeza O2 que se consume, y ningún líquido de embalaje ingresa a la línea de gas. El resultado es que el consumo de O2 respiratorio no se tiene en cuenta en los datos de producción de O2 . Esto puede reducir la precisión de las estimaciones de crecimiento de biomasa afDW. Sin embargo, no debe afectar la utilidad de usar la producción diurna de O2 como métrica para comparar el crecimiento entre tratamientos.
Todos los PBR de laboratorio se ven afectados por la misma limitación; las luces artificiales no pueden replicar el espectro solar. Las microalgas utilizan longitudes de onda de luz entre 400-700 nm para la fotosíntesis. Esta región se conoce como radiación fotosintéticamente activa (PAR)33. La luz solar y la luz artificial varían en su contribución relativa de longitudes de onda dentro de este rango. Esto, junto con temperaturas favorables y un suministro de luz constante, significa que los datos de crecimiento del laboratorio a menudo no se pueden extrapolar de manera confiable a las condiciones exteriores. Sin embargo, estos PBR pueden abordar una de las limitaciones del suministro de luz PBR de laboratorio. La intensidad de la luz solar es muy variable a lo largo del día, con una capa de nubes que genera fluctuaciones transitorias en el PAR incidente. El software de control de iluminación y el controlador de iluminación DMX pueden proporcionar intensidades de luz de 0 a 2400fotones μmol m-2 s-1 y más. Los regímenes de luz se pueden dividir en incrementos individuales tan cortos como 1 s. La intensidad de la luz ajustable permite al usuario imitar los patrones de luz exterior más de cerca que las configuraciones PBR estándar. Aquí, los intervalos simulados de 30 minutos al amanecer y al atardecer desvanecen los ciclos diurnos y nocturnos juntos (Tabla suplementaria 1).
Aunque la densidad afDW se ha convertido en la medida estándar de crecimiento, este método puede requerir volúmenes de cultivo sustanciales, un período de procesamiento de 2 a 3 días y genera un punto de datos a la vez. Además, si las condiciones se vuelven desfavorables y las células mueren, la densidad de AFDW no discrimina entre las células fotosintetizadoras activas y las que se están descomponiendo. Cuantificar la tasa de producción de oxígeno fotosintético sirve como un proxy de crecimiento alternativo. Este diseño de PBR puede registrar la producción de oxígeno continuamente con poca intervención del usuario mientras conserva el volumen de cultivo. La resolución de los datos podría mejorarse seleccionando un sensor de gas con un volumen de celda de medición más bajo, por ejemplo, 1 ml. Además, si los cultivos están bien mezclados, los usuarios pueden decidir instalar un espectrofotómetro para lecturas continuas de densidad óptica. Si se desea controlar la temperatura del medio, se podría agregar un enfriador de recirculación. Estos PBR son una valiosa adición a un laboratorio que busca expandir su capacidad de investigación de microalgas sin una gran inversión financiera. Son particularmente adecuados para aquellos que trabajan con especies de alta alcalinidad y alto pH como la espirulina. Estos PBR ofrecen flexibilidad de régimen ligero y son válidos para comparaciones de crecimiento de laboratorio rápidas y replicadas.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este estudio fue apoyado por el Consejo de Investigación de Ciencias Naturales e Ingeniería (NSERC), la Fundación Canadiense para la Innovación (CFI), el Fondo de Excelencia en Investigación de Canadá First (CFREF), Alberta Innovates, la Fundación General Sir John Monash, el Gobierno de Alberta y la Universidad de Calgary. Se agradece a Mark Toonen por el trabajo eléctrico y a William Richardson por los cálculos de solubilidad.
Materiales
| Name | Company | Catalog Number | Comments |
| Aluminum channels Imperial: 0.90” x 39.37” Metric: 2.3 cm x 100 cm Quantity: 4 | LED World | AC-AR1-1M | Required as a heat sink |
| Bungee cords, small Quantity: 5 | - | - | To secure bottles |
| Computer - desktop/laptop Quantity: 1 | - | - | - |
| Data Logger, HOBO U30 USB Weather Station Quantity: 1 | HOBO, Hoskin | U30-NRC-VIA-10-S100-000 | Records light sensor information |
| Digital interface module, Rigamo, 4-channel Quantity: 1 | Ritter | N/A | This is to transmit gas sensor data to the computer |
| DMX decoder, 12~24 VDC, DMX-CV-4X5A Quantity: 1 | LITECH, LED World | LT-840-6A | Transmit messages which alter the light pattern |
| DMX lighting controller, SUSHI-RB-RJ Quantity: 1 | Arcolis, Nicolaudie America Inc. | SUSHI-RB-RJ DMX | Encodes the lighting program |
| Gas sensor packing liquid (Silox) Quantity: 1 L | Ritter | https://www.ritter.de/en/data-sheets/silox | |
| Gas sensor, volumetric Quantity: 3 | Ritter | MGC-1 V3.4 PMMA (https://www.ritter.de/downloads/mgc-milligascounter-en) | Measures oxygen production |
| Glass bottles, round 1 L with GL45 neck Quantity: 3 | Corning, Capitol Scientific | 1395-1L | Culture vessels |
| Hardware - end caps for slotted steel Quantity: 10 | Paulin, Home Depot | 142-612 | To cover sharp edges of slotted steel |
| Hardware - eye hooks Quantity: 6 | - | - | To secure bottles |
| Hardware - metal corner braces (large) Imperial: 4" x 4" Metric: 10 cm x 10 cm Quantity: 8 | - | - | Larger brackets to construct metal stand |
| Hardware - metal corner braces (small) Imperial: 2 1/2" x 2 1/2" Metric: 6.4 cm x 6.4 cm Quantity: 6 | - | - | Small brackets to connect bottle platforms to PVC pipe |
| Hardware - metal corner gussets Imperial: 3" x 3" Metric: 7.6 cm x 7.6 cm Quantity: 6 | Paulin, Home Depot | 142-616 | Flat brackets to construct metal stand |
| Hardware - piano hinge Imperial: 36" Metric: 91 cm Quantity: 1 | - | - | Connects two halves of PVC pipe |
| Hardware - rivets Quantity: 40 | - | - | To attach piano hinge to PVC tubing |
| Hardware - set of bolts, nuts, washers Quantity: 60 | - | - | Long thin bolts are required to secure bottle platforms around magentic stirrers |
| Hardware - set of bolts, nuts, washers Quantity: 30 | - | - | Larger shorter bolts are required to build the metal stand |
| LED driver, constant voltage, 96W 24VDC UL Listed IP65 Driver Class 2 regulated power supply Quantity: 1 | Magnitude Lighting, LED World | CVN96L24DC | Regulates power to the lights |
| LED lights, Cinco Bright LED Flex Strip Quantity: 4 m roll | EvenBright, LED World | FA128M57-4M-24V-X | Roll is trimmed into 4 x 1 m lengths and secured inside the PVC tube |
| Light meter, handheld with submersible sperical probe Quantity: 1 | LI-COR | LA-250A | Calibrate the reactors light intensity |
| Light sensors Photosynthetic Light (PAR) Smart Sensor Quantity: 2 | HOBO, Hoskin | S-LIA-M003 | Only one is required however two would be good practice in case one malfunctioned |
| Magnetic stirrers (MIXdrive 1 XS) with external control units and power supply (MIXcontrol eco) Quantity: 3 | 2Mag, 2MAG USA | MF 40300 | Stirrers sit sandwiched in bottle platforms |
| Metal plate Imperial: 24" x 8" Metric: 61 cm x 20.3 cm Quantity: 1 | - | - | This is a surface on which to secure electronics, it is attached to the back of the reactor |
| Pipe, white PVC Imperial: 6" diameter x 42" high Metric: 15.2 cm x 106.7 cm Quantity: 1 | - | - | Cut lengthwise in two halves, used to house lights and bottles |
| Plastic (HDPE) sheets Imperial: 4" x 4" x 1/4" Metric: 10 cm x 10 cm x 1 cm Quantity: 6 | Inventables | 30291-01 | For bottle platforms which house magentic stirrers |
| Rubber stoppers - GL45 size Quantity: 3 | Duran, VWR | 76289-760 | Seals culture vessels |
| Screw caps - with aperture and GL45 neck Quantity: 3 | Corning, Capitol Scientific | 1395-45HTSC | Generates seal of culture vessels |
| Slotted angle steel lengths Imperial: 1-1/2" X 48" x 0.074" Metric: 3.8 cm x 122 cm x 0.19 cm Quantity: 6 | Paulin, Home Depot | 142-202 | Makes up the body of the metal stand |
| Slotted flat steel lenghts Imperial: 1-3/8" x 48" x 0.074" Metric: 3.5 cm x 122 cm x 0.19 cm Quantity: 3 | Paulin, Home Depot | 142-222 | Makes up the body of the metal stand |
| Software - Easy Stand Alone (ESA) | https://www.dmxsoft.com/#apps | AKA LED control software | |
| Software - Rigamo v3.1 | AKA data acquisition software | ||
| Software - Storage Upgrade Tools (SUT) | https://store.dmxsoft.com// | ||
| Stir bar Imperial: 1" x 5/16" Metric: 2.5 cm x 0.8 cm Quantity: 3 | Fisherbrand | 14-513-59 | Stirs culture |
| Switch box Quantity: 1 | - | - | Turns power on/off to reactor |
| Syringe, 10 mL Quantity: Multiple | - | - | Optional if you wish to extract culture |
| Tube adaptor fittings, plastic - Stopcock 1-way Quantity: 6 | Masterflex, Cole Palmer | RK-12023-33 | Close/open culture vessel line |
| Tube adaptor fittings, plastic - variety of male and female luer lock fittings Imperial: to fit 1/16" and 1/8" ID tubing Metric: to fit 1.59 mm and 3.18 mm tubing Quantity: Multiple packets | Masterflex, Cole Palmer | RK-30800-16; RK-30800-18; RK-45518-26; RK-45501-00; RK-45501-04 | Many different combinations can achieve the same end result, best to order a variety of fittings |
| Tube adaptor fittings, plastic - variety of straight connectors Imperial: to fit 1/16" and 1/8" ID tubing Metric: to fit 1.59 mm and 3.18 mm tubing Quantity: Multiple packets | Masterflex, Cole Palmer | RK-40616-04 | Many different combinations can achieve the same end result, best to order a variety of fittings |
| Tubing, flexible, transparent Imperial: ID=1/16", OD=1/8" Metric: ID = 1.59 mm, 0D = 3.18 mm Quantity: 4 m | Masterflex, Cole Palmer | RK-06422-02 | Line from culture vessel to gas sensor |
| Tubing, flexible, transparent Imperial: ID=1/8", OD=1/4" Metric: ID = 3.18 mm, 0D = 6.35 mm Quantity: 2 m | Masterflex, Cole Palmer | RK-06422-05 | Gas sensor standard tubing size |
| Tubing, rigid, transparent Imperial: ID=1/16", OD=1/8" Metric: ID = 1.59 mm, 0D = 3.18 mm Quantiy: 1 m | Masterflex, Cole Palmer | RK-06605-27 | Spans rubber stopper allowing gas to exit |
| Tubing, rigid, transparent Imperial: ID=1/8", OD=1/4" Metric: ID = 3.18 mm, 0D = 6.35 mm Quantity: 1 m | Masterflex, Cole Palmer | RK-06605-30 | Spans rubber stopper allowing gas to exit |
| Zip ties, small Quantity: 1 packet | Secure tube fittings |
Referencias
- Benemann, J. R. . Opportunities and challenges in algae biofuels production. A position paper in line with Algae World. , (2008).
- Laurens, L. M. L. State of technology review - algae bioenergy. An IEA bioenergy inter-task strategic project. IEA Bioenergy. , (2017).
- Robertson, D. E., et al. A new dawn for industrial photosynthesis. Photosynthesis Research. 107, 269-277 (2011).
- Troschl, C., Meixner, K., Drosg, B. Cyanobacterial PHA production-review of recent advances and a summary of three years' working experience running a pilot plant. Bioengineering. 4 (2), (2017).
- Rizwan, M., Mujtaba, G., Memon, S. A., Lee, K., Rashid, N. Exploring the potential of microalgae for new biotechnology applications and beyond: a review. Renewable and Sustainable Energy Reviews. 92, 394-404 (2018).
- Niesa, F., et al. Characterization of Phormidium lacuna strains from the North Sea and the Mediterranean Sea for biotechnological applications. Process Biochemistry. 59, 194-206 (2017).
- Laurens, L. M. L., Chen-Glasser, M., McMillan, J. D. A perspective on renewable bioenergy from photosynthetic algae as feedstock for biofuels and bioproducts. Algal Research. 24, 261-264 (2017).
- Barreiro-Vescovo, S., Barbera, E., Bertucco, A., Sforza, E. Integration of microalgae cultivation in a biogas production process from organic municipal solid waste: From laboratory to pilot scale. ChemEngineering. 4 (2), 26 (2020).
- Zurano, A. S., et al. Year-long assessment of a pilot-scale thin-layer reactor for microalgae wastewater treatment. Variation in the microalgae-bacteria consortium and the impact of environmental conditions. Algal Research. 50, (2020).
- Deprá, M. C., Severo, I. A., Dias, R. R., Zepka, L. Q., Jacob-Lopes, E. Photobioreactor design for microalgae culture. Microalgae. , 35-61 (2021).
- Osburn, F. S., Wagner, N. D., Scott, J. T. Biological stoichiometry and growth dynamics of a diazotrophic cyanobacteria in nitrogen sufficient and deficient conditions. Harmful Algae. 103, (2021).
- Eustance, E., Badvipour, S., Wray, J. T., Sommerfeld, M. R. Biomass productivity of two Scenedesmus strains cultivated semi-continuously in outdoor raceway ponds and flat-panel photobioreactors. Journal of Applied Phycology. 28 (3), 1471-1483 (2016).
- Qiang, H., Richmond, A., Zarmi, Y. Combined effects of light intensity, light-path and culture density on output rate of spirulina platensis (cyanobacteria). European Journal of Phycology. 33 (2), 165-171 (1998).
- Ooms, M. D., Dinh, C. T., Sargent, E. H., Sinton, D. Photon management for augmented photosynthesis. Nature Communications. 7, 1-13 (2016).
- Moheimani, N. R., Borowitzka, M. A., Isdepsky, A., Sing, S. F. Standard methods for measuring growth of algae and their composition. Algae for biofuels and energy. , 265-284 (2013).
- Griffiths, M. J., Garcin, C., van Hille, R. P., Harrison, S. T. L. Interference by pigment in the estimation of microalgal biomass concentration by optical density. Journal of Microbiological Methods. 85 (2), 119-123 (2011).
- Schumann, R., Häubner, N., Klausch, S., Karsten, U. Chlorophyll extraction methods for the quantification of green microalgae colonizing building facades. International Biodeterioration and Biodegradation. 55 (3), 213-222 (2005).
- Pinckney, J. L., Richardson, T. L., Millie, D. F., Paerl, H. W. Application of photopigment biomarkers for quantifying microalgal community composition and in situ growth rates. Organic Geochemistry. 32 (4), 585-595 (2001).
- Van Wychen, S., Laurens, L. M. L. Determination of total solids and ash in algal biomass: laboratory analytical procedure (LAP). National Renewable Energy Laboratory. , (2015).
- Davis, R., Laurens, L. Algal biomass production via open pond algae farm cultivation: 2019 state of technology and future research. National Renewable Energy Laboratory. , (2020).
- Borovkov, A. B., Gudvilovich, I. N., Avsiyan, A. L. Scale-up of Dunaliella salina cultivation: from strain selection to open ponds. Journal of Applied Phycology. 32 (3), 1545-1558 (2020).
- Davies, F. K., et al. Microbiota associated with the large-scale outdoor cultivation of the cyanobacterium Synechococcus sp. PCC 7002. Algal Research. 58, (2021).
- Ataeian, M., et al. Direct capture and conversion of CO2 from air by growing a cyanobacterial consortium at pH up to 11.2. Biotechnology and Bioengineering. 116 (7), 1604-1611 (2019).
- Fu, F., et al. Sustained photosynthesis and oxygen generation of microalgae-embedded silk fibroin hydrogels. ACS Biomaterials Science & Engineering. , (2021).
- Rearte, T. A., et al. Photosynthetic performance of Chlorella vulgaris R117 mass culture is moderated by diurnal oxygen gradients in an outdoor thin layer cascade. Algal Research. 54, (2021).
- Poughon, L., et al. Limnospira indica PCC8005 growth in photobioreactor: model and simulation of the ISS and ground experiments. Life Sciences in Space Research. 25, 53-65 (2020).
- Yen, U. C., Huang, T. C., Yen, T. C. Observation of the circadian photosynthetic rhythm in cyanobacteria with a dissolved-oxygen meter. Plant Science. 166 (4), 949-952 (2004).
- Vermaas, W. F. Photosynthesis and respiration in cyanobacteria. eLS. , (2001).
- Ritter, . MilliGascounter Type MGC-1 Operation Instructions V 3.4. , (2017).
- Sousa, C., De Winter, L., Janssen, M., Vermuë, M. H., Wijffels, R. H. Growth of the microalgae Neochloris oleoabundans at high partial oxygen pressures and sub-saturating light intensity. Bioresource Technology. 104, 565-570 (2012).
- Latifi, A., Ruiz, M., Zhang, C. C. Oxidative stress in cyanobacteria. FEMS microbiology reviews. 33 (2), 258-278 (2009).
- Morillas-España, A., Lafarga, T., Gómez-Serrano, C., Acién-Fernández, F. G., González-López, C. V. Year-long production of Scenedesmus almeriensis in pilot-scale raceway and thin-layer cascade photobioreactors. Algal Research. 51, (2020).
- Melis, A. Solar energy conversion efficiencies in photosynthesis: minimizing the chlorophyll antennae to maximize efficiency. Plant Science. 177 (4), 272-280 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados