Method Article
Funzionamento di fotobioreattori da laboratorio con misurazioni di crescita online e regimi di luce personalizzabili
In questo articolo
Riepilogo
Questa pubblicazione descrive la progettazione di fotobioreattori da laboratorio (PBR) con regimi di luce personalizzabili. La crescita di cianobatteri o microalghe, utilizzando il bicarbonato come fonte di carbonio, viene monitorata continuamente misurando la produzione volumetrica di ossigeno. Questi PBR facilitano confronti di crescita di laboratorio rapidi e replicati con un piccolo intervento dell'utente durante gli esperimenti.
Abstract
Lo studio di laboratorio delle microalghe può essere sperimentalmente impegnativo. Oltre ai requisiti di coltivazione di microrganismi non fotosintetici, i fototrofi richiedono anche l'illuminazione. Di routine, i ricercatori cercano di fornire forniture di luce personalizzate, cioè variare l'intensità della luce e il tempo in cui viene consegnata. Tale flessibilità è difficile con le luci da banco standard. Di solito, gli studi di coltivazione richiedono anche confronti di crescita tra trattamenti sperimentali. Spesso, la crescita viene valutata per una durata prolungata, ad esempio, più volte al giorno per una prova di una settimana. Le misurazioni manuali possono richiedere molto tempo e non avere risoluzione dei dati. Pertanto, i fotobioreattori (PBR) con monitoraggio automatico della crescita e alimentazione della luce personalizzabile sono utili per esperimenti replicati con trattamenti multipli. Il lavoro attuale presenta la progettazione, la costruzione e il funzionamento dei PBR di laboratorio. I materiali sono facilmente reperibili e relativamente economici. Il design potrebbe essere duplicato con moderata abilità. Ogni struttura ha un'impronta di ~ 40 cm2 e ospita tre bottiglie di vetro da 1 L per la replica triplicata. Le bottiglie poggiano su piattaforme contenenti agitatori magnetici e sono disposte verticalmente all'interno di un tubo di cloruro di polivinile (PVC) alto 1 m e diametro 15 cm. L'interno del tubo è rivestito con diodi emettitori di luce (LED). Questi LED producono intensità luminose continue da fotoni 0-2400 μmol m-2 s-1 di radiazione fotosinteticamente attiva (PAR). Gli utenti progettano un programma di illuminazione personalizzato. L'intensità della luce può essere regolata ogni secondo o mantenuta costante per periodi più lunghi. L'ossigeno prodotto dalla fotosintesi esce da ogni bottiglia tramite un sensore di gas volumetrico unidirezionale. Il software viene utilizzato per registrare i dati del sensore di gas. La quantità di ossigeno prodotta può essere correlata alla crescita della biomassa. Se sono necessari campioni di biomassa, è possibile utilizzare una siringa per estrarre la coltura. Il metodo è adatto per le microalghe coltivate con bicarbonato come fonte di carbonio. Questi PBR sono preziosi per un laboratorio che richiede esperimenti replicati, flessibilità del regime di luce e dati di crescita continui ad alta risoluzione.
Introduzione
Microalghe e cianobatteri, collettivamente chiamati microalghe per semplicità, sono sostenuti per il loro potenziale nella biotecnologia sostenibile. Sono candidati interessanti per la loro rapida crescita, la capacità di essere coltivati su terreni non coltivabili e per il loro uso della luce solare per guidare la conversione dell'anidride carbonica in biomassa 1,2,3. La biomassa microalgale può essere convertita in prodotti come la bioenergia sotto forma di petrolio o gas, coloranti alimentari e integratori alimentari e materiali come i biopolimeri 1,4,5,6,7. Inoltre, possono essere utilizzati per trattare le acque reflue o bonificare i corpi idrici consumando nutrienti in eccesso 8,9. Detto questo, la ricerca microalgale è diffusa e consolidata. Il campo cresce man mano che la società riconsidera l'intensità di carbonio e la sostenibilità ambientale degli attuali approcci di produzione e generazione di energia.
Tre requisiti fondamentali degli studi di microalgali basati su laboratorio sono un vaso di coltura, una fonte di luce e un metodo per quantificare la crescita. Il termine fotobioreattore (PBR) descrive un set-up in cui i vasi di coltura sono illuminati10. Comunemente, gli studi sulle microalghe mirano a confrontare la crescita tra due o più trattamenti, ad esempio diversi mezzi di crescita, regimi di luce o specie 11,12,13. Per rilevanza statistica, ogni condizione, ad esempio il trattamento e il controllo, deve essere replicata. Se il controllo e il trattamento vengono eseguiti contemporaneamente, ciò significa che molti PBR devono essere monitorati e campionati per la durata di un esperimento. La sfida con il funzionamento di più PBR è duplice. In primo luogo, fornire un'intensità luminosa uniforme a ciascun PBR è essenziale per la riproducibilità, ma può essere difficile. La quantità di luce incidente sulla superficie del recipiente è influenzata dalla sua distanza dalla sorgente luminosa, dall'ombreggiatura dai vasi adiacenti e dalle fluttuazioni della luce di fondo14. In secondo luogo, è necessario selezionare un metodo per quantificare con precisione la crescita.
La crescita è comunemente misurata dal conteggio cellulare, dalla densità ottica (OD), dal contenuto di clorofilla A, dalla densità di peso secco (DW) e dalla densità di peso secco senza ceneri (AFDW)15. Il conteggio delle cellule, il contenuto di clorofilla A e i metodi gravimetrici sono processi manuali che producono punti dati discreti. L'OD può essere misurato in modo continuo e non invasivo con uno spettrofotometro, a condizione che sia ben calibrato rispetto a un altro metodo come la densità AFDW15. Tuttavia, le misurazioni OD e il contenuto di clorofilla A possono essere inaffidabili in quanto i risultati variano in diverse condizioni di coltura, ad esempio tra le specie e durante tutto il ciclodi crescita 15,16. Per la clorofilla A, il metodo di estrazione può anche influire sulla resa del pigmento17. Il contenuto di clorofilla A è particolarmente utile per tracciare la crescita delle microalghe all'interno di comunità microbiche che contengono anche organismi non fotosintetici17,18. Quando si sceglie un metodo per determinare la crescita, è essenziale considerare la morfologia della sospensione. Quando gli organismi si aggregano e non sono ben miscelati, la conta OD e cellulare non è possibile15. Un singolo metodo non è adatto a tutte le applicazioni sperimentali: i ricercatori devono decidere quali metodi sono pratici e rilevanti per i loro obiettivi sperimentali.
AFDW è un metodo affidabile che consente confronti di crescita tra varie condizioni di coltura, in particolare, tra specie e terreni di coltura 15,19,20. Per calcolare l'AFDW, un campione di coltura microalgale viene prima concentrato, mediante filtrazione o centrifugazione, ed essiccato. In questa fase, è possibile determinare il DW. Di solito, il campione DW contiene almeno l'8-10% di materiale inorganico di cenere come sali e particolato15. DW tiene traccia delle tendenze di crescita, ma può essere distorto se il contributo degli inorganici varia. Per determinare la densità AFDW, la biomassa secca viene bruciata ad alta temperatura; questo vaporizza la porzione organica o utile lasciando cenere (inorganica) dietro19. Per calcolare l'AFDW, il peso della frazione di cenere viene sottratto da quello della frazione DW. Tipicamente, nelle sospensioni microalgali, l'AFDW varia da 0,1 a 3 g / L 12,21,22. Piccoli volumi di sospensioni diluite producono poca biomassa secca, <10 mg. Dopo la combustione, la cenere può pesare solo 1 mg. Pertanto, a seconda della densità di coltura, questo metodo richiede volumi compresi tra 5-100 ml e scale analitiche accurate a 0,1 mg 12,15,19,22. I PBR di laboratorio sono in genere piccoli, un paio di litri al massimo, quindi ogni campione liquido esaurisce il volume di coltura. Inoltre, il metodo AFDW è manuale e richiede 2-3 giorni. Per gli esperimenti replicati e ripetitivi, è preferibile un processo automatizzato e continuo.
Per le microalghe che utilizzano il bicarbonato come fonte di carbonio, due metriche di crescita aggiuntive possono essere misurate continuamente. La fotosintesi consuma bicarbonato e produce ossigeno. Il consumo di bicarbonato aumenta il pH medio23. Una sonda di pH immersa può misurare questo cambiamento. La produzione di ossigeno fotosintetico aumenta la concentrazione di ossigeno disciolto (DO) del mezzo fino a quando il mezzo non è saturo. Oltre la saturazione, l'ossigeno esiste come bolle. La produzione di ossigeno viene misurata con molte tecniche diverse: le sonde misurano la concentrazione di DO, i dispositivi manometrici valutano la pressione dello spazio di testa, la gascromatografia misura la composizione dello spazio di testa e i sensori volumetrici registrano il deflusso di gas 24,25,26,27. Quando l'ossigeno viene utilizzato come proxy di crescita, i vasi di coltura devono essere completamente sigillati o consentire solo il deflusso di gas. Per le misurazioni del pH e dell'ossigeno, il carbonio deve essere fornito sotto forma di bicarbonato, non mediante sparging di CO2. Lo sparging di CO2 riduce il pHmedio 23 e, come gas, può disturbare le misurazioni dell'ossigeno. Un vantaggio del pH e dell'ossigeno rispetto alla densità ottica è che il metodo non è compromesso se le microalghe formano grumi. Sebbene indiretti, sia il pH che l'ossigeno sono efficaci nel confrontare la crescita tra i trattamenti.
I PBR in uso oggi variano in complessità. I laboratori possono utilizzare semplici palloni da banco, prototipi personalizzati o prodotti disponibili in commercio. Per i gruppi di ricerca che cercano di aggiornare dai palloni, il costo dei PBR commerciali o le competenze tecniche e la fabbricazione di parti necessarie per costruire molti prototipi possono essere una barriera. Questo manoscritto mira a descrivere la progettazione, la costruzione e il funzionamento passo-passo dei PBR di laboratorio che colmano questa lacuna. Questi PBR hanno un regime di luce personalizzabile e monitorano continuamente la crescita registrando la produzione volumetrica di ossigeno. Questo progetto ospita tre vasi di coltura per la replica triplicata e può essere costruito con moderata abilità e materiali facilmente accessibili. Questo PBR è una preziosa aggiunta a un laboratorio che cerca di espandere la sua capacità di ricerca microalgale senza investire in prodotti molto tecnici o costosi. Quando scelgono di acquisire o costruire un PBR, i ricercatori devono considerare l'idoneità di un progetto alle loro condizioni culturali, alla posizione finanziaria e alle domande di ricerca.
Protocollo
1. Costruzione dello stand PBR
- Con un seghetto portatile, taglia cinque lunghezze da 380 mm e due lunghezze da 200 mm di acciaio scanalato angolato. Fissare insieme con bulloni e grandi bretelle angolari per creare la base di un supporto (Figura 1A). Colla sui tappi terminali di sicurezza.
- Collegare alla base due lunghezze verticali non tagliate (1220 mm) di acciaio scanalato angolato. Fissare con bulloni e soffietti angolari in metallo (Figura 1B). Colla sui tappi terminali di sicurezza.
- Tagliare quattro lunghezze piatte da 65 mm di acciaio scanalato. Imbullonarli con angoli di 90° sui supporti verticali: attaccarne due a ciascun supporto, uno a 130 mm dalla base (Figura 1C) e uno a 60 mm verso il basso dall'alto.
- Fissare i supporti verticali sulla parte superiore con una lunghezza orizzontale di 140 mm di acciaio a fessura piatta (traversa) imbullonata sul retro del telaio (Figura 2A).
2. Costruzione della camera luminosa
- Tagliare un tubo bianco di cloruro di polivinile (PVC) di 153 mm di diametro a una lunghezza di 1070 mm. Tagliare il tubo a metà longitudinalmente con una sega a nastro. Carteggia tutti i bordi.
- Uniformemente spazio e centro quattro canali di dissipatore di calore in alluminio verticalmente insieme all'interno del tubo. Non fissare canali entro 20 mm dal bordo tagliato del tubo. Con piccoli bulloni, fissare i canali in posizione superiore e inferiore (Figura 2B).
- Imbullonare metà del tubo al supporto utilizzando i supporti orizzontali modellati nel passaggio 1.3.
- Posare il reattore e riunire le metà del tubo nastrandole insieme. Centrare la cerniera del pianoforte lungo una linea di taglio. Traccia i fori della cerniera e fora il tubo di conseguenza. Utilizzare una pistola rivettato e rivetti di media lunghezza per fissare la cerniera al tubo.
- Utilizzare un piccolo cavo elastico (vedere Tabella dei materiali) per tenere chiuso il tubo (Figura 1C).
- Consultare un elettricista per collegare le luci a LED e installare i seguenti quattro componenti: driver LED, decodificatore digitale multiplex (DMX), controller di illuminazione DMX e scatola di commutazione (vedere Tabella dei materiali). Fissare tutti i componenti sul retro del PBR secondo la Figura 2A.
3. Costruzione delle piattaforme per bottiglie
- Tagliare le forme della piattaforma (Figura 3A) dalla plastica dura, ad esempio polietilene ad alta densità (HDPE) (vedere Tabella dei materiali), utilizzando la fresatura a controllo numerico computerizzato (CNC). Crea tre di ogni forma.
NOTA: si consiglia di tagliare gli strati superiori e inferiori di ricambio. - Nastro insieme lo strato inferiore e superiore. Contrassegnare e praticare cinque piccoli fori, di 6 mm di diametro, attraverso entrambe le forme (Figura 3A). Utilizzando una punta più grande, espandere con attenzione la superficie di questi fori in modo che le teste dei bulloni possano essere incassate (Figura 3B).
- Per ciascuna delle tre piattaforme, imbullonare due piccole parentesi angolari alla metà posteriore del tubo.
NOTA: la distanza tra la parte superiore delle parentesi graffe deve essere di 350 mm. - Centra ogni strato inferiore sopra le sue parentesi graffe. Segna la posizione dei fori di perforazione da sotto le parentesi graffe. Praticare due fori di 6 mm di diametro. Utilizzando una punta più grande, espandere con attenzione la superficie dei fori in modo che i bulloni possano essere incassati.
- Imbullonare gli strati inferiori alle loro parentesi graffe (Figura 3B–C).
- Tagliare quindici pezzi di tubi rigidi di diametro esterno (OD) lunghi 12 mm e 6,35 mm. Sandwich cinque pezzi del tubo rigido tra ogni strato superiore e inferiore. Fissare strati e tubi insieme a bulloni lunghi e stretti secondo la Figura 3B-D.
- Praticare un grande foro nel tubo in PVC dietro ogni piattaforma. Inserire ogni micro agitatore magnetico nella sua piattaforma. Infilare il cavo elettrico di ciascun agitatore attraverso questi fori appena tagliati (Figura 3C-E). Collegare ogni agitatore alla rispettiva unità di controllo e a una presa di corrente.
- Posizionare una bottiglia da 1 L su ogni piattaforma. Aggiungere golfari nel tubo posteriore a livello del collo della bottiglia. Avvolgere un piccolo cavo elastico attorno a ciascun collo della bottiglia per aggiungere stabilità (Figura 4A).
NOTA: in tutto il protocollo, saranno utili piattaforme di codifica a colori, bottiglie, agitatori magnetici e tutti i cavi e sensori associati.
4. Costruzione delle porte di campionamento dei liquidi (opzionale)
- Tagliare tre lunghezze di 60 mm di tubi rigidi OD da 6,35 mm. Utilizzando una punta da trapano da 5 mm, praticare fori attraverso ciascun tappo di gomma. Spingere le lunghezze del tubo rigido attraverso il tappo.
- Tagliare tre lunghezze di 60 mm di tubi rigidi OD da 3,18 mm. Collegarli con un riduttore dritto al tubo sporgente sul lato inferiore di ciascun tappo.
- Inserire una valvola di arresto unidirezionale (ad esempio, porta 1 = Luer femmina, porta 2 = Luer maschio) nel tubo sporgente su ciascuna superficie del tappo (Figura 4A).
- Tagliare tre lunghezze di 30 mm di tubi flessibili OD da 3,18 mm. Inserire i raccordi Luer (ad esempio, Luer maschio per il barbo del tubo e Luer femmina per il barbo del tubo) su entrambe le estremità.
- Collegare i pezzi realizzati al punto 4.4 alle valvole del rubinetto sulla superficie di ciascun tappo di gomma (Figura 4A).
NOTA: molte combinazioni di rubinetti e raccordi Luer possono produrre lo stesso risultato. Il disegno deve consentire di estrarre o inserire il liquido tramite una siringa.
5. Collegamento di sensori di gas volumetrici
- Preparare i sensori di gas secondo le istruzioni del produttore.
NOTA: Ciò comporta principalmente il riempimento di sensori di gas con liquido di imballaggio (Figura 4B). - Per realizzare le tubazioni del gas, tagliare tre lunghezze di 1000 mm di tubi flessibili OD da 3,18 mm.
- Praticare tre fori di diametro 4 mm nel tubo posteriore in PVC. Posizionare i fori accanto alla cerniera all'altezza del collo della bottiglia. Filettare le linee del gas attraverso questi fori (Figura 4A).
- Alla fine della linea del gas all'interno del tubo in PVC, aggiungere un raccordo Luer (ad esempio, il tubo flessibile a Luer maschio) e collegare una valvola di arresto unidirezionale (ad esempio, porta 1 = Luer femmina, porta 2 = Luer maschio).
NOTA: la valvola è necessaria solo quando sono installate anche le porte di campionamento del liquido. - Unire l'altra estremità della linea del gas alla porta di ingresso del sensore di gas utilizzando un riduttore dritto. Fissare questa connessione con una cravatta con zip.
- Collegare tutti i sensori di gas al modulo di ingresso digitale (DIM) con cavi jack plug e il DIM a un computer nelle vicinanze.
- Installare il software di acquisizione dati (vedere Tabella dei materiali) su un sistema operativo Windows e collegare il dongle della chiave di licenza. Aggiungere i file di calibrazione del sensore alla directory di calibrazione del software.
6. Programmazione del regime di luce
- Utilizzando l'interruttore on/off posteriore, accendere il PBR e collegare il controller di illuminazione DMX a un computer tramite un cavo micro-USB.
- Scarica Store Upgrade Tools (SUT) e il software di controllo LED (vedi Tabella dei materiali). Registrare il controller di illuminazione DMX online.
- Aprire il software di controllo LED e selezionare Fare clic qui per lavorare con l'interfaccia USB-DMX: SUSHI-RB-RJ.
- Nella scheda Configurazione della casella ScanLibrary selezionare la cartella Generica e il Canale singolo. Modificare le impostazioni di ScanLibrary in DMX universe 1, il numero di dispositivi in 4 e il numero di indice in 1. Nell'angolo in alto a destra, modificare la casella a discesa in Visualizzazione elenco. Infine, fare clic su Patch (Figura supplementare 1).
NOTA: nell'universo DMX, una casella verifica il controllo di ciascuna striscia LED facendo scorrere i pulsanti del dimmer o inserendo un valore numerico nella casella di testo. - Creare una curva standard che metta in relazione l'impostazione della luce digitale nel software di controllo dell'illuminazione con l'intensità luminosa sperimentata al centro del tubo in PVC (Figura 5). Misurare l'intensità della luce interna con una piccola sonda sferica (vedi Tabella dei Materiali) sospesa al centro del tubo in PVC.
- Passa alla scheda Editor . Per creare un programma di illuminazione personalizzato, crea una nuova scena e inizia ad aggiungere passaggi. Fare riferimento alla Tabella supplementare 1 per un esempio di programma diurno 16:8 h. Impostare la scena in loop.
NOTA: i passaggi suddividono le scene in blocchi di tempo, ognuno dei quali può essere impostato su diversa intensità luminosa. I passi vanno da 1 s a 43 min. Qui, i passaggi di 30 minuti sono i più convenienti. È possibile caricare più scene su un dispositivo di controllo dell'illuminazione DMX. - Crea una scena di supporto aggiuntiva che sia immediatamente riconoscibile, ad esempio due dei quattro LED accesi.
NOTA: le scene possono essere ciclizzate manualmente utilizzando il pulsante sul lato del controller di illuminazione DMX. Se il programma di luce desiderato inizia durante la notte, sarà impossibile distinguere se il programma di luce è già iniziato. La scena dell'helper funge da indicatore del corretto funzionamento del controller di illuminazione DMX. - Salva le scene e passa alla scheda Stand Alone . Scrivere la memoria del controller di illuminazione DMX e scollegare il dispositivo dal computer.
- Collegare il controller di illuminazione DMX alla sua fonte di alimentazione utilizzando una micro-USB.
- Prima di iniziare un esperimento, testare il programma di luce registrando l'intensità della luce interna per una durata di 24 ore. Se la temperatura del liquido è interessante, registrarla contemporaneamente a una sonda di temperatura sommersa (Figura 6).
7. Avvio di un esperimento
- Sterilizzare supporti, bottiglie, barre di agitazione, tappi di gomma, porte di campionamento, tappi a vite con apertura filettata e tubi.
NOTA: tutti i componenti utilizzati in questo progetto sono autoclavabili ad eccezione delle valvole e dei raccordi Luer: esistono alternative autoclavabili di altri produttori. - Aprire il software di acquisizione dati e compilare la pagina di configurazione (Figura supplementare 2). Assegnare i file di calibrazione ai rispettivi sensori.
- In Nome file directory selezionare la cartella del numero di porta DIM corrispondente. Fare clic su Cartella corrente e ripetere per tutte le porte.
- Fare clic su OK per passare alla pagina di registrazione.
- Riempire le bottiglie al volume desiderato con terreno di coltivazione (Tabelle supplementari 2,3).
NOTA: Ognuna di queste bottiglie conterrà un massimo di ~ 1,1 L con un piccolo spazio per la testa (~ 80 ml, compresa la linea del gas). - Centrifugare la coltura di riserva in tre tubi bilanciati da 50 ml per 15 minuti a 4500 x g per produrre tre pellet. Aggiungere un pellet a ogni bottiglia: lavare in pellet con una pipetta sierologica e un mezzo fresco.
NOTA: la densità di coltura del giorno 0 è anche nota come concentrazione iniziale di biomassa (IBC). Per misurare l'IBC in gAFDW. L-1, un ulteriore tubo da 50 ml può essere centrifugato nel passaggio 7.6. Il pellet risultante può quindi essere essiccato e bruciato15,19. Il passaggio 7.6 richiederà probabilmente modifiche in base agli obiettivi individuali degli utenti e ai loro esperimenti. - Lascia cadere un agitatore magnetico, 25 x 8 mm, in ogni bottiglia.
- Sigillare ogni apertura della bottiglia con un tappo di gomma e un tappo a vite ad apertura filettata (Figura 4A). Se sono installate porte di campionamento opzionali, chiudere le valvole.
- Individuare l'estremità di ogni linea del gas all'interno del tubo in PVC (costruito nel passaggio 5.4) e collegare un ago alla porta Luer maschio della valvola.
- Collegare ogni bottiglia al suo sensore di gas perforando ogni tappo di gomma con l'ago corrispondente.
- Avvia ogni sensore di gas singolarmente selezionando la casella di controllo sul lato sinistro dello schermo, facendo clic su Start e inserendo un nome di file. Fare clic su OK e ripetere per tutti i sensori (Figura supplementare 3).
NOTA: durante la registrazione, non uscire dalla finestra di acquisizione dati. Impostare le impostazioni di alimentazione e sospensione del computer su mai e posticipare gli aggiornamenti del computer per la durata dell'esperimento. - Accendere il PBR e assicurarsi che il controller di illuminazione DMX sia collegato a un alimentatore. La prima scena programmata inizierà automaticamente. Fare riferimento al passaggio 6.7 per verificare che il controller di illuminazione DMX funzioni correttamente.
8. Campionamento della bottiglia (opzionale)
- Preparare altri 500 mL del mezzo fresco prima di iniziare l'esperimento (tabella supplementare 2).
NOTA: se alle 9 del mattino iniziasse un programma di luce di 24 ore con un ciclo diurno di 16:8 h, i tempi di campionamento prima del tramonto e dell'alba cadrebbero alle 8:00 e alle 16:00 (Tabella supplementare 1). Qui, l'alba e il tramonto si riferiscono a passi di 30 minuti che passano le luci da ON a OFF e viceversa. - Chiudere la valvola sulla linea del gas.
- Collegare una siringa (10 mL) alla valvola della porta di campionamento (Figura 4A).
- Aprire la valvola della porta di campionamento e prelevare 8 ml di coltura.
NOTA: si consiglia tra 5-10 ml. La rimozione del liquido genera un vuoto nello spazio di testa, rendendo difficili da estrarre volumi > 10 ml. - Chiudere la valvola della porta di campionamento e scollegare la siringa.
- Collegare una siringa contenente 8 mL di mezzo fresco (dal punto 8.1) alla valvola della porta di campionamento.
- Aprire la valvola della porta di campionamento e iniettare il mezzo fresco.
NOTA: la sostituzione del volume della coltura campionata con un mezzo fresco serve a mantenere un volume e una pressione uguali allo spazio di testa e a lavare la linea della porta di campionamento. - Chiudere la valvola della porta di campionamento prima di scollegare la siringa.
- Ripetere i passaggi 8.2–8.8 ad ogni momento di campionamento.
9. Terminare un esperimento
- Seleziona tutte le caselle di controllo della porta attiva nella finestra di acquisizione dati e fai clic su Stop.
- Per esportare i dati, selezionare File e dati offline. Selezionare tutti i file di registro pertinenti. Esporta i dati in un software per fogli di calcolo e salva.
- Per ogni bottiglia, convertire il volume totale di ossigeno misurato in ml in talpe utilizzando la legge del gas ideale. Prevedere il peso della biomassa coltivata (gAFDW) se viene generata 1,05 mole di O2 per ogni mole di biomassa prodotta. Prendi il peso molare della biomassa come 24,6 g mol-1.
- Curare manualmente i dati della portata. Utilizzare unità di mL/h e una media mobile a 3 punti.
Risultati
Qui la portata di ossigeno è una misura della velocità fotosintetica della coltura. Tassi più elevati di fotosintesi, e quindi di fissazione del carbonio, si traducono in tassi di crescita più elevati. Ciò significa che l'utente può confrontare le portate di ossigeno tra diversi trattamenti e giorni operativi come proxy per la crescita. In breve, il sensore di gas funziona intrappolando e rilasciando bolle di gas in una cella di misurazione a doppia camera (Figura 4B). Le bolle di gas dall'ingresso alla base del sensore viaggiano verso l'alto attraverso il liquido di imballaggio. Le bolle si accumulano in una camera della cella di misura per un volume di ~ 3,2 ml. Una volta raggiunta questa soglia, la cella di misura punta. Questo rilascia il gas e ripristina il sistema. Ogni punta viene registrata dal software di acquisizione dati.
Nei dati di esempio, è stato confrontato il tasso di crescita di tre trattamenti con intensità di luce diurna variabili e concentrazioni iniziali di biomassa (IBC). Questi trattamenti sono stati scelti arbitrariamente a scopo dimostrativo. Erano (A) 300 μmolfotoni m-2 s-1 e 0,03 gAFDW L-1, (B) 600 μmolfotoni m-2 s-1 e 0,13 gAFDW L-1, e (C) 600 μmolfotoni m-2 s-1 e 0,40 gAFDW L-1. Queste irradianze sono state misurate con una sonda sferica al centro del tubo in PVC prima che le bottiglie fossero posizionate sulle piattaforme. La profondità e la densità della coltura influenzano l'attenuazione della luce. Quindi l'effettiva intensità luminosa sperimentata dalle microalghe può variare da quelle riportate. Ogni trattamento è stato eseguito in triplice copia, all'interno di un PBR contenente tre bottiglie.
Qui, un esperimento di successo è stato caratterizzato da modelli diurni di produzione di gas strettamente replicati (Figura 7A-C). Durante le ore illuminate (giorno), la produzione di gas è aumentata costantemente e, nelle ore non illuminate (notte), la produzione di gas si è fermata (Figura 7A-C). Due gas sono prodotti da microalghe, ossigeno dalla fotosintesi e anidride carbonica dalla respirazione28. La fotosintesi è limitata alle ore illuminate, mentre la respirazione avviene continuamente ma è più attiva di notte28. La fotosintesi costruisce, mentre la respirazione catabolizza la biomassa28. Inizialmente, la composizione del gas dello spazio di testa è identica a quella dell'atmosfera. Ad ogni capovolgimento della cella di misura, O2 sposta il gas atmosferico. Pertanto, le letture dei sensori di gas sono state attribuite alla produzione di O2 anche se il gas in uscita non era puro O2. La pressione minima di ingresso del gas per il sensore di gas è estremamente bassa, 8-9 mbar, rendendo la pressione dello spazio di testa della bottiglia solo leggermente superiore a quella atmosferica (1,01 bar a livello del mare). Quindi, le letture dei sensori di gas iniziano poco dopo che le bolle di O2 lasciano il mezzo.
La CO2 rilasciata dalla respirazione non contribuisce alle letture dei sensori di gas per due motivi. In primo luogo, nel mezzo alcalino, la CO2 reagisce al bicarbonato, diminuendo il pH (Figura 8). In secondo luogo, se la CO2 fuoriesce, il liquido di imballaggio del sensore di gas, Silox, dissolve le bolle di CO2 prima che possano raggiungere la cella di misurazione, degassando CO2 sulla superficie liquida29. Ciò è supportato dalla mancanza di letture notturne del sensore di gas. Quelli che si sono verificati sono stati registrati poco dopo lo spegnimento delle luci, indicando che le letture rappresentavano il rilascio di ossigeno residuo diurno (Figura 7).
Nella configurazione sperimentale (utilizzando i dati locali di temperatura e pressione), uno spazio di testa di 80 mL a pressione ambiente richiedeva 340 mL di O2 essolato per stabilire una pressione parziale O2 del 99%. Qui, il volume totale di ossigeno prodotto in 4 giorni variava da 316 (SEM ± 11) mL nel trattamento A a 902 (SEM ± 51) mL nel trattamento C (Tabella 1). Pertanto, alla fine dell'esperimento, lo spazio di testa di tutte le bottiglie avrebbe contenuto principalmente O2. L'aumento della concentrazione dello spazio di testa O2, e quindi la diminuzione della concentrazione di N2, avrebbe avuto un impatto sulla pressione parziale e sulla saturazione di questi gas. Con uno spazio di testa del 99% O2 , è stato calcolato un aumento di 5 volte del DO. Per le colture da 1,1 L, ciò si è tradotto in ulteriori 23 mL di DO. Al contrario, è stato stimato che lo spostamento verso uno spazio di testa N2 dell'1 % avrebbe causato l'assoluzione di 15 mL di N2 . Ciò significa che sotto uno spazio di testa di ossigeno quasi puro, più O2 disciolto di N2 è stato spostato. Quindi, poiché più O2 rimane nel mezzo, questo effetto avrebbe portato a lievi sottostime nella quantità di ossigeno fotosintetico prodotto.
La sfida principale di questo metodo è sorta quando le culture sono diventate dense. Con più biomassa, e quindi più respirazione, la domanda di O2 è aumentata. Il consumo notturno di O2 ha generato uno spazio di testa sotto pressione. Ciò ha causato il trasporto del liquido di imballaggio del sensore di gas a viaggiare attraverso la linea del gas. Quando la produzione di O2 è ripresa, il liquido di imballaggio ha dovuto essere reimmesso nei sensori di gas. Ciò ha causato un ritardo nella prima lettura del sensore di gas. Tuttavia, la quarta notte, l'entità di questa sottopressione ha fatto sì che il liquido di imballaggio raggiungesse e gocciolasse in due delle tre repliche del trattamento B, generando una chiazza d'olio superficiale. A causa del ridotto livello del liquido di imballaggio, i sensori di gas sono andati in cortocircuito, rilasciando O2 non misurato direttamente nell'atmosfera. Ciò ha causato la raccolta dei dati a flatline (Figura 7B).
La sottopressione può anche essere causata da una contrazione indotta dalla temperatura del volume dello spazio di testa. Tuttavia, l'effetto qui è stato minimo. I canali del dissipatore di calore e il flusso d'aria hanno adeguatamente dissipato il calore in eccesso. Dei due regimi di luce sperimentati, la variazione massima della temperatura ha ridotto il volume dello spazio di testa dell'1% o meno, equivalente a uno spostamento del liquido di imballaggio di 800 μL in uno spazio di testa di 80 ml. L'oscillazione massima della temperatura diurna è stata di 1,4 °C per i regimi difotoni da 300 μmol m-2 s-1 (Figura 6) e di 3,2 °C per i regimi difotoni da 600 μmol m-2 s-1. L'aumento medio della temperatura diurna per i regimi di 300 e 600 μmolfotoni m-2 s-1 è stato rispettivamente di 0,7 e 1,8 °C. Le temperature di coltura sono tornate al basale durante la notte (Figura 6).
I dati sul tasso di crescita ad alta risoluzione possono rivelare tendenze che altrimenti potrebbero passare inosservate. Considerare i trattamenti B e C. Nonostante i loro diversi IBC, entrambi hanno generato la stessa quantità di biomassa totale (gAFDW), che ha causato uno spostamento identico del pH medio (Tabella 1). Dati solo i punti di dati iniziali e finali, un individuo può giustamente non assumere alcuna differenza nel tasso di crescita medio tra i due trattamenti (Tabella 1). Tuttavia, i dati sulla portata di ossigeno online hanno rivelato che ogni trattamento aveva tassi di crescita giornalieri variabili. Queste variazioni si sono riflesse anche nelle misurazioni del pH due volte al giorno (Figura 8). Il primo giorno, il tasso di crescita del trattamento B era inferiore a quello del trattamento C. Al terzo giorno, questo si è invertito con il tasso di crescita del trattamento B che ha superato quello del trattamento C (Figura 7B, C). I dati sulla portata di ossigeno hanno indicato che il tasso di crescita più elevato si è verificato il terzo giorno nel trattamento B (Figura 7B).
Il volume totale di ossigeno generato da ciascun flacone nei tre trattamenti è stato utilizzato per stimare la rispettiva variazione della biomassa totale (gAFDW). Ciò è stato ottenuto utilizzando un'equazione generica per la sintesi della biomassa fotosintetica: CO2 + 0,2 NH3 + 0,6 H2O = CH1,8 O0,5 N0,2 + 1,05 O2. L'aumento della pressione parziale dello spazio di testa O2 e il successivo aumento della saturazione di DO dovrebbero causare una leggera sottostima della crescita della biomassa. Questo era vero per cinque esempi su sette (Tabella 2). In media, la crescita stimata della biomassa è stata entro il 10% della crescita della biomassa misurata. Alcune stime differivano solo di 1-3 mg dalla crescita misurata. Due esempi hanno sovrastimato la crescita, vale a dire che è stato prodotto più ossigeno di quanto la crescita della biomassa potrebbe spiegare. Qualsiasi O2 consumato dalla respirazione durante la notte dovrebbe riflettersi nel ritardo nella produzione di O2 il giorno successivo. Qui, gli esperimenti si sono conclusi alla fine della notte. In questo modo, il catabolismo notturno della biomassa durante le ultime 8 ore di ogni esperimento non viene misurato. Ciò può causare sovrastime della crescita della biomassa, specialmente nelle colture dense. Pertanto, si raccomanda che gli esperimenti siano terminati alla fine delle ore illuminate.

Figura 1: Base del supporto del reattore. (A) Dimensioni dei componenti di base in mm. (B) Orientamento dei soffietti angolari metallici che fissano i due supporti verticali. (C) Una delle quattro lunghezze corte di acciaio collega la metà posteriore del tubo in PVC al supporto del reattore. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Componenti elettrici. (A) Retrovisione del PBR che mostra la traversa superiore e la configurazione dei componenti elettrici. (B) Vista frontale del PBR dopo l'installazione luminosa. Fare clic qui per visualizzare una versione più grande di questa figura.
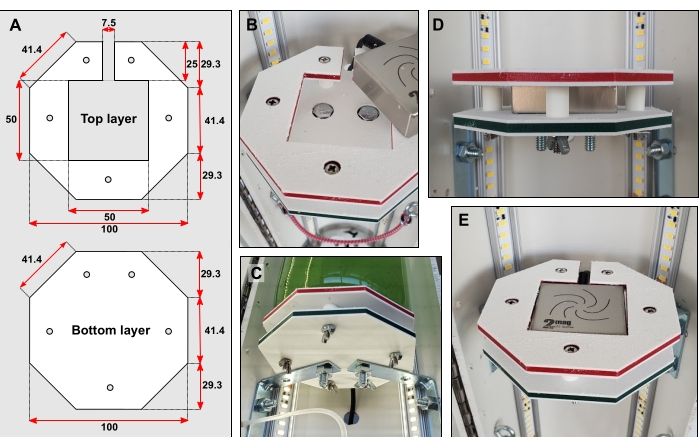
Figura 3: Dettagli della piattaforma della bottiglia. (A) Dimensioni dello strato superiore e inferiore in mm. (B) Teste dei bulloni incassate in entrambi gli strati. (C) Le parentesi graffe collegano lo strato inferiore direttamente alla metà posteriore del tubo in PVC. (D) Cinque brevi pezzi di tubi rigidi montati su bulloni stretti tengono separati gli strati superiore e inferiore. (E) Quando la piattaforma del flacone è completa, la superficie deve essere a filo. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Linea del gas e porta di campionamento opzionale. (A) Le linee del gas collegano ogni spazio di testa della bombola ai sensori di gas esterni. Se è necessaria la porta di campionamento, le tubazioni del gas devono includere una valvola unidirezionale immediatamente a valle dell'ago. (B) Sensore volumetrico di gas. Il livello di imballaggio del liquido dovrebbe toccare la vite di tracciamento. Fare clic qui per visualizzare una versione più grande di questa figura.
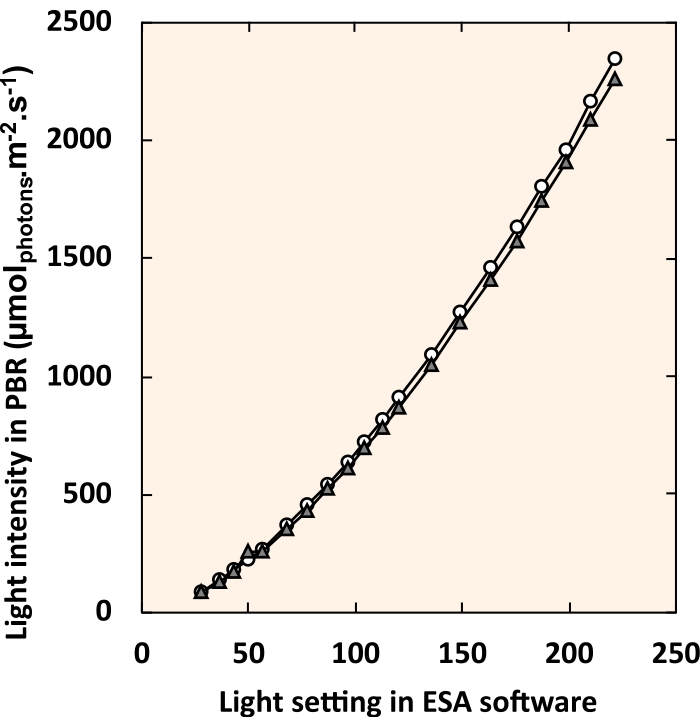
Figura 5: Curva standard che mette in relazione le impostazioni del software di controllo LED con l'intensità della luce interna. I cerchi bianchi e i triangoli grigi rappresentano ciascuno un singolo PBR. Per ogni impostazione di luce, tutti e quattro gli apparecchi sono stati impostati su un valore identico. Fare clic qui per visualizzare una versione più grande di questa figura.
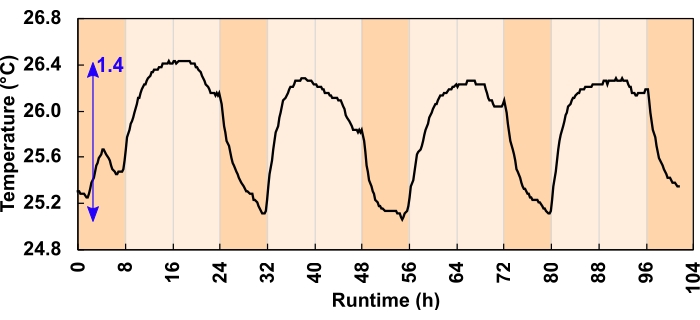
Figura 6: Variazione della temperatura di coltura per i regimi di luce m-2 s-1 dei fotoni da 300 μmol. Durante il programma diurno di 24 ore, 16:8 ore, i LED hanno aumentato la temperatura di coltura diurna. La freccia blu indica la differenza tra la temperatura minima e massima. Un errore di programma leggero ha causato il calo della temperatura prima del tramonto; questo è stato corretto prima dell'inizio dell'esperimento. Fare clic qui per visualizzare una versione più grande di questa figura.
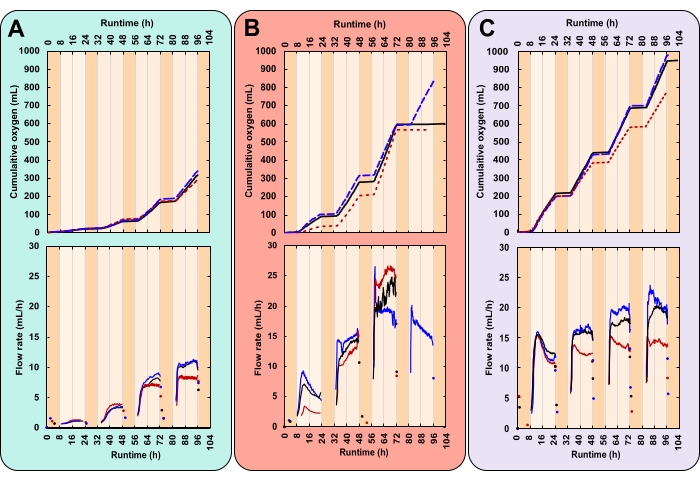
Figura 7: Produzione di ossigeno per tre condizioni sperimentali uniche. Ogni reattore ha ricevuto una diversa combinazione di intensità luminosa e concentrazione iniziale di biomassa (IBC); (A) 300 μmolfotoni m-2 s-1 e IBC 0,03 gAFDW L-1, (B) 600 μmolfotoni m-2 s-1 e IBC 0,13 gAFDW L-1, (C) 600 μmolfotoni m-2 s-1 e IBC 0,40 gAFDW L-1. I grafici superiori mostrano la produzione cumulativa di ossigeno (mL) e la portata del gas (mL/h). Linee nere continue, linee blu tratteggiate e linee rosse tratteggiate sono repliche. Il tempo di esecuzione per ogni esperimento era di 104 ore, che includeva quattro cicli completi giorno-notte di 16:8 ore. L'ombreggiatura arancione scuro rappresenta le ore notturne e le ore diurne arancioni chiare. Si noti che nel trattamento B, la produzione di ossigeno si appiattisce il giorno 4 per due delle tre repliche. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 8: Risposta al pH. Ogni reattore ha ricevuto una diversa combinazione di intensità luminosa e IBC; (diamanti verdi) 300 μmolfotoni m-2 s-1 e IBC 0,03 gAFDW L-1, (triangoli rossi) 600 μmolfotoni m2 s-1 e IBC 0,13 gAFDW L-1, (cerchi viola) 600 μmolfotoni m-2 s-1 e IBC 0,40 gAFDW L-1 . L'ombreggiatura arancione scuro rappresenta le ore notturne e le ore diurne arancioni chiare. Le barre di errore rappresentano l'errore standard della media. Fare clic qui per visualizzare una versione più grande di questa figura.
| Trattamento | Intensità luminosa (fotoni μmol m-2 s-1) | IBC (gAFDW L-1) | Δ biomassa totale (gAFDW) | Δ pH | Ossigeno totale prodotto (mL) |
| Un | 300 | 0.031 | 0,289 (± 0,01) | 0,15 (± 0,01) | 316,2 (±11,4) |
| B | 600 | 0.130 | 0,674 (± 0,02) | 0,52 (± 0,27) | 834.6* |
| C | 600 | 0.400 | 0,675 (± 0,02) | 0,55 (± 0,03) | 902,2 (±50,5) |
| * Solo una delle tre repliche ha avuto successo | |||||
Tabella 1: Spostamento della metrica di crescita dall'ora 0 alla 104. Le parentesi rappresentano l'errore standard della media.
| Trattamento | Intensità luminosa (fotoni μmol m-2 s-1) | IBC (gAFDW L-1) | Crescita della biomassa misurata (gAFDW) | Prevista crescita della biomassa (gAFDW) | Sottostimare (%) |
| Un | 300 | 0.031 | 0.289 | 0.288 | 0.5 |
| Un | 300 | 0.031 | 0.311 | 0.270 | 13.1 |
| Un | 300 | 0.031 | 0.268 | 0.247 | 7.9 |
| B | 600 | 0.13 | 0.708 | 0.705 | 0.4 |
| C | 600 | 0.4 | 0.718 | 0.796 | -10.9 |
| C | 600 | 0.4 | 0.640 | 0.830 | -29.7 |
| C | 600 | 0.4 | 0.668 | 0.659 | 1.3 |
Tabella 2: Stime di crescita basate sull'ossigeno totale misurato. Solo una replica dai 300 μmolfotoni m-2 s-1 e IBC = 0,13 gdi trattamento AFDW L-1 è stata completata.
Figura 1 supplementare: Screenshot dal software di controllo LED. Ciascuna delle quattro lampade può essere controllata in modo indipendente facendo scorrere i pulsanti dimmer o inserendo un valore numerico nella casella di testo. Fare clic qui per scaricare questo file.
Figura 2 supplementare: Screenshot della finestra di configurazione del software di acquisizione dati. Fare clic qui per scaricare questo file.
Figura 3 supplementare: Screenshot della finestra di registrazione del software di acquisizione dati. I rettangoli verde brillante indicano i sensori di gas online. I dati vengono visualizzati in tempo reale. Fare clic qui per scaricare questo file.
Tabella supplementare 1: Esempio di regime di luce 24 ore. Per un programma diurno di 16:8 h, ci sono 48 set di 30 minuti ciascuno. Gli asterischi indicano i tempi di campionamento suggeriti. Fare clic qui per scaricare questa tabella.
Tabella supplementare 2: Composizione del mezzo ad alto pH alcalino. Fare clic qui per scaricare questa tabella.
Tabella supplementare 3: Soluzione di oligoelementi. Aggiungere ad una concentrazione finale di 1 mL/L al mezzo di base. Fare clic qui per scaricare questa tabella.
Discussione
All'interno di questo protocollo, concentrarsi sui passaggi seguenti aumenta la probabilità di generare dati riproducibili e di alta qualità. Quando si costruisce il supporto del reattore (fase 1), la base deve essere robusta con supporti verticali ben allineati. L'acciaio a fessura ha spigoli vivi, quindi l'aggiunta di tappi di sicurezza è essenziale. Le superfici della piattaforma della bottiglia devono essere completamente piatte, l'agitatore magnetico e le teste dei bulloni devono entrambi trovarsi sotto la superficie dello strato superiore (passaggi 3.2-3.6). Secondo le istruzioni del produttore, il liquido di imballaggio del sensore di gas deve essere riempito con la "vite di tracciamento per il livello del liquido" per misurazioni accurate dell'ossigeno. Questo livello di liquido deve essere controllato regolarmente poiché l'evaporazione del liquido di imballaggio può cortocircuitare la cella di misurazione. Tutte e tre le tubazioni del gas realizzate nel punto 5.2 dovrebbero avere la stessa lunghezza; questo assicura che le repliche abbiano volumi di spazio di testa identici. Prima di iniziare un esperimento, è consigliabile testare il regime di luce programmata registrando l'intensità della luce su un periodo di 24 ore (passaggio 6.11). Se gli aumenti della temperatura del liquido destano preoccupazione, questo test dovrebbe includere anche una bottiglia sigillata con una sonda di temperatura interna (punto 6.11). Durante la registrazione, non uscire dalla finestra del software di acquisizione dati; questo terminerà la registrazione. Se si prelevano campioni di coltura, fare attenzione a non rilasciare gas dello spazio di testa aprendo le valvole nella sequenza sbagliata (passaggi 8.2-8.8). Durante la revisione dei dati sperimentali, si noti che il software di acquisizione dati genera automaticamente una media mobile della portata. Questo gonfia il valore di una o due letture di portata generate durante la notte. Curare manualmente i registri dei sensori di gas per correggere questo problema.
La battuta d'arresto più comune con questo metodo è il potenziale di cortocircuito del sensore di gas se il livello di imballaggio del liquido diminuisce. Ci sono due modi in cui questo può accadere. In primo luogo, l'evaporazione può ridurre lentamente il livello del liquido. Tuttavia, questo è improbabile in un esperimento a breve termine (<7 giorni)29. In secondo luogo, alti tassi di respirazione possono attirare ossigeno nella soluzione e generare uno spazio di testa sotto pressione. Quando l'energia luminosa non è disponibile, le microalghe utilizzano la respirazione aerobica per fornire l'energia necessaria per la manutenzione e la riparazione cellulare28. Quindi, nelle colture dense durante le ore non illuminate, il consumo di ossigeno e la conseguente sottopressione possono essere sostanziali. Questo aspira il liquido di imballaggio dai sensori di gas nella linea del gas. La distanza percorsa dal liquido di imballaggio è proporzionale alla quantità di respirazione notturna. Se il liquido di imballaggio entra nelle bottiglie, questo genera una chiazza d'olio sulla superficie del liquido.
Se sono previsti alti tassi di respirazione notturna, è possibile apportare modifiche al protocollo. Il modo più semplice per evitare la sottopressione è lasciare aperti gli spazi di testata della bottiglia durante la notte. Ciò ha anche il vantaggio di allentare i livelli di DO diminuendo la pressione parziale dello spazio di testa di O2. Si ritiene che alte concentrazioni di DO siano dannose per la crescita in quanto l'O2 può impedire l'attività di Rubisco e può innescare lo stress ossidativo30,31. Non è raro che le sospensioni di coltura raggiungano una sovrasaturazione 4x anche a contatto con l'atmosfera25,32. Per aprire lo spazio di testa, scollegare la linea del gas dall'ago che attraversa il tappo di gomma. Le ore notturne possono servire come finestra per rabboccare il liquido di imballaggio del sensore di gas o manipolare esperimenti continui con un impatto minimo sulla raccolta dei dati. Ad esempio, si può alterare la densità della coltura, aggiornare i nutrienti, aggiungere un emendamento o introdurre un agente patogeno. Le bombole devono essere richiuse e la linea del sensore di gas ricollegata prima che le luci si riaccendano. Le misurazioni dell'ossigeno raccolte da esperimenti con spazi di testa notturni chiusi rispetto a quelli aperti saranno diverse.
Quando le bottiglie rimangono sigillate, il consumo notturno di ossigeno riduce il numero di moli di O2 nello spazio di testa. Ciò fa sì che il liquido di imballaggio si insinui lungo la linea del sensore di gas per mantenere la pressione dello spazio di testa. Quando le luci si accendono, la produzione di ossigeno riprende. Il liquido di imballaggio deve essere reinserito nel sensore di gas prima che inizino le letture della portata. Questo ritardo è quindi proporzionale al grado di respirazione notturna. In questo modo, quando lo spazio di testa rimane chiuso, le letture O2 rappresentano la produzione netta di O2 (produzione fotosintetica - consumo respiratorio). Al contrario, quando lo spazio di testa è aperto di notte, il gas atmosferico sostituisce lo spazio di testa O2 consumato e nessun liquido di imballaggio entra nella linea del gas. Il risultato è che il consumo respiratorio di O2 non è contabilizzato nei dati di produzione di O2 . Ciò potrebbe ridurre l'accuratezza delle stime di crescita della biomassa AFDW. Tuttavia, non dovrebbe influire sull'utilità di utilizzare la produzione diurna di O2 come metrica per confrontare la crescita tra i trattamenti.
Tutti i PBR di laboratorio sono afflitti dalla stessa limitazione; le luci artificiali non possono replicare lo spettro solare. Le microalghe utilizzano lunghezze d'onda della luce tra 400-700 nm per la fotosintesi. Questa regione è indicata come radiazione fotosinteticamente attiva (PAR)33. La luce solare e la luce artificiale variano nel loro contributo relativo di lunghezze d'onda all'interno di questo intervallo. Questo, insieme a temperature favorevoli e una fornitura di luce costante, significa che i dati di crescita di laboratorio spesso non possono essere estrapolati in modo affidabile alle condizioni esterne. Questi PBR possono, tuttavia, affrontare uno dei limiti dell'alimentazione della luce PBR di laboratorio. L'intensità della luce solare è molto variabile durante il giorno, con la copertura nuvolosa che genera fluttuazioni transitorie nel PAR incidente. Il software di controllo dell'illuminazione e il controller di illuminazione DMX possono fornire intensità luminose da 0 a 2400 μmolfotoni m-2 s-1 e oltre. I regimi di luce possono essere suddivisi in incrementi individuali fino a 1 s. L'intensità della luce sintonizzabile consente all'utente di imitare i modelli di luce esterna più da vicino rispetto alle configurazioni PBR standard. Qui, gli intervalli simulati di 30 minuti all'alba e al tramonto svaniscono insieme i cicli giorno e notte (Tabella supplementare 1).
Sebbene la densità AFDW sia diventata la misura standard della crescita, questo metodo può richiedere volumi di coltura sostanziali, un periodo di elaborazione di 2-3 giorni e genera un punto dati alla volta. Inoltre, se le condizioni diventano sfavorevoli e le cellule muoiono, la densità AFDW non discrimina tra le cellule attivamente fotosintetizzanti e quelle che si stanno decomponendo. Quantificare il tasso di produzione di ossigeno fotosintetico serve come proxy di crescita alternativo. Questo design PBR può registrare continuamente la produzione di ossigeno con un piccolo intervento da parte dell'utente, preservando al contempo il volume della coltura. La risoluzione dei dati potrebbe essere migliorata selezionando un sensore di gas con un volume di cella di misura inferiore, ad esempio 1 mL. Inoltre, se le colture sono ben miscelate, gli utenti possono decidere di installare uno spettrofotometro per letture continue della densità ottica. Se si desidera il controllo della temperatura del mezzo, è possibile aggiungere un refrigeratore a ricircolo. Questi PBR sono una preziosa aggiunta a un laboratorio che cerca di espandere la sua capacità di ricerca microalgale senza ingenti investimenti finanziari. Sono particolarmente adatti a chi lavora con specie ad alta alcalinità e ad alto pH come la Spirulina. Questi PBR offrono flessibilità del regime di luce e sono validi per confronti di crescita rapidi, replicati e di laboratorio.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo studio è stato sostenuto dal Natural Sciences and Engineering Research Council (NSERC), dalla Canada Foundation for Innovation (CFI), dal Canada First Research Excellence Fund (CFREF), dall'Alberta Innovates, dalla General Sir John Monash Foundation, dal governo dell'Alberta e dall'Università di Calgary. I ringraziamenti sono estesi a Mark Toonen per il lavoro elettrico e William Richardson per i calcoli di solubilità.
Materiali
| Name | Company | Catalog Number | Comments |
| Aluminum channels Imperial: 0.90” x 39.37” Metric: 2.3 cm x 100 cm Quantity: 4 | LED World | AC-AR1-1M | Required as a heat sink |
| Bungee cords, small Quantity: 5 | - | - | To secure bottles |
| Computer - desktop/laptop Quantity: 1 | - | - | - |
| Data Logger, HOBO U30 USB Weather Station Quantity: 1 | HOBO, Hoskin | U30-NRC-VIA-10-S100-000 | Records light sensor information |
| Digital interface module, Rigamo, 4-channel Quantity: 1 | Ritter | N/A | This is to transmit gas sensor data to the computer |
| DMX decoder, 12~24 VDC, DMX-CV-4X5A Quantity: 1 | LITECH, LED World | LT-840-6A | Transmit messages which alter the light pattern |
| DMX lighting controller, SUSHI-RB-RJ Quantity: 1 | Arcolis, Nicolaudie America Inc. | SUSHI-RB-RJ DMX | Encodes the lighting program |
| Gas sensor packing liquid (Silox) Quantity: 1 L | Ritter | https://www.ritter.de/en/data-sheets/silox | |
| Gas sensor, volumetric Quantity: 3 | Ritter | MGC-1 V3.4 PMMA (https://www.ritter.de/downloads/mgc-milligascounter-en) | Measures oxygen production |
| Glass bottles, round 1 L with GL45 neck Quantity: 3 | Corning, Capitol Scientific | 1395-1L | Culture vessels |
| Hardware - end caps for slotted steel Quantity: 10 | Paulin, Home Depot | 142-612 | To cover sharp edges of slotted steel |
| Hardware - eye hooks Quantity: 6 | - | - | To secure bottles |
| Hardware - metal corner braces (large) Imperial: 4" x 4" Metric: 10 cm x 10 cm Quantity: 8 | - | - | Larger brackets to construct metal stand |
| Hardware - metal corner braces (small) Imperial: 2 1/2" x 2 1/2" Metric: 6.4 cm x 6.4 cm Quantity: 6 | - | - | Small brackets to connect bottle platforms to PVC pipe |
| Hardware - metal corner gussets Imperial: 3" x 3" Metric: 7.6 cm x 7.6 cm Quantity: 6 | Paulin, Home Depot | 142-616 | Flat brackets to construct metal stand |
| Hardware - piano hinge Imperial: 36" Metric: 91 cm Quantity: 1 | - | - | Connects two halves of PVC pipe |
| Hardware - rivets Quantity: 40 | - | - | To attach piano hinge to PVC tubing |
| Hardware - set of bolts, nuts, washers Quantity: 60 | - | - | Long thin bolts are required to secure bottle platforms around magentic stirrers |
| Hardware - set of bolts, nuts, washers Quantity: 30 | - | - | Larger shorter bolts are required to build the metal stand |
| LED driver, constant voltage, 96W 24VDC UL Listed IP65 Driver Class 2 regulated power supply Quantity: 1 | Magnitude Lighting, LED World | CVN96L24DC | Regulates power to the lights |
| LED lights, Cinco Bright LED Flex Strip Quantity: 4 m roll | EvenBright, LED World | FA128M57-4M-24V-X | Roll is trimmed into 4 x 1 m lengths and secured inside the PVC tube |
| Light meter, handheld with submersible sperical probe Quantity: 1 | LI-COR | LA-250A | Calibrate the reactors light intensity |
| Light sensors Photosynthetic Light (PAR) Smart Sensor Quantity: 2 | HOBO, Hoskin | S-LIA-M003 | Only one is required however two would be good practice in case one malfunctioned |
| Magnetic stirrers (MIXdrive 1 XS) with external control units and power supply (MIXcontrol eco) Quantity: 3 | 2Mag, 2MAG USA | MF 40300 | Stirrers sit sandwiched in bottle platforms |
| Metal plate Imperial: 24" x 8" Metric: 61 cm x 20.3 cm Quantity: 1 | - | - | This is a surface on which to secure electronics, it is attached to the back of the reactor |
| Pipe, white PVC Imperial: 6" diameter x 42" high Metric: 15.2 cm x 106.7 cm Quantity: 1 | - | - | Cut lengthwise in two halves, used to house lights and bottles |
| Plastic (HDPE) sheets Imperial: 4" x 4" x 1/4" Metric: 10 cm x 10 cm x 1 cm Quantity: 6 | Inventables | 30291-01 | For bottle platforms which house magentic stirrers |
| Rubber stoppers - GL45 size Quantity: 3 | Duran, VWR | 76289-760 | Seals culture vessels |
| Screw caps - with aperture and GL45 neck Quantity: 3 | Corning, Capitol Scientific | 1395-45HTSC | Generates seal of culture vessels |
| Slotted angle steel lengths Imperial: 1-1/2" X 48" x 0.074" Metric: 3.8 cm x 122 cm x 0.19 cm Quantity: 6 | Paulin, Home Depot | 142-202 | Makes up the body of the metal stand |
| Slotted flat steel lenghts Imperial: 1-3/8" x 48" x 0.074" Metric: 3.5 cm x 122 cm x 0.19 cm Quantity: 3 | Paulin, Home Depot | 142-222 | Makes up the body of the metal stand |
| Software - Easy Stand Alone (ESA) | https://www.dmxsoft.com/#apps | AKA LED control software | |
| Software - Rigamo v3.1 | AKA data acquisition software | ||
| Software - Storage Upgrade Tools (SUT) | https://store.dmxsoft.com// | ||
| Stir bar Imperial: 1" x 5/16" Metric: 2.5 cm x 0.8 cm Quantity: 3 | Fisherbrand | 14-513-59 | Stirs culture |
| Switch box Quantity: 1 | - | - | Turns power on/off to reactor |
| Syringe, 10 mL Quantity: Multiple | - | - | Optional if you wish to extract culture |
| Tube adaptor fittings, plastic - Stopcock 1-way Quantity: 6 | Masterflex, Cole Palmer | RK-12023-33 | Close/open culture vessel line |
| Tube adaptor fittings, plastic - variety of male and female luer lock fittings Imperial: to fit 1/16" and 1/8" ID tubing Metric: to fit 1.59 mm and 3.18 mm tubing Quantity: Multiple packets | Masterflex, Cole Palmer | RK-30800-16; RK-30800-18; RK-45518-26; RK-45501-00; RK-45501-04 | Many different combinations can achieve the same end result, best to order a variety of fittings |
| Tube adaptor fittings, plastic - variety of straight connectors Imperial: to fit 1/16" and 1/8" ID tubing Metric: to fit 1.59 mm and 3.18 mm tubing Quantity: Multiple packets | Masterflex, Cole Palmer | RK-40616-04 | Many different combinations can achieve the same end result, best to order a variety of fittings |
| Tubing, flexible, transparent Imperial: ID=1/16", OD=1/8" Metric: ID = 1.59 mm, 0D = 3.18 mm Quantity: 4 m | Masterflex, Cole Palmer | RK-06422-02 | Line from culture vessel to gas sensor |
| Tubing, flexible, transparent Imperial: ID=1/8", OD=1/4" Metric: ID = 3.18 mm, 0D = 6.35 mm Quantity: 2 m | Masterflex, Cole Palmer | RK-06422-05 | Gas sensor standard tubing size |
| Tubing, rigid, transparent Imperial: ID=1/16", OD=1/8" Metric: ID = 1.59 mm, 0D = 3.18 mm Quantiy: 1 m | Masterflex, Cole Palmer | RK-06605-27 | Spans rubber stopper allowing gas to exit |
| Tubing, rigid, transparent Imperial: ID=1/8", OD=1/4" Metric: ID = 3.18 mm, 0D = 6.35 mm Quantity: 1 m | Masterflex, Cole Palmer | RK-06605-30 | Spans rubber stopper allowing gas to exit |
| Zip ties, small Quantity: 1 packet | Secure tube fittings |
Riferimenti
- Benemann, J. R. . Opportunities and challenges in algae biofuels production. A position paper in line with Algae World. , (2008).
- Laurens, L. M. L. State of technology review - algae bioenergy. An IEA bioenergy inter-task strategic project. IEA Bioenergy. , (2017).
- Robertson, D. E., et al. A new dawn for industrial photosynthesis. Photosynthesis Research. 107, 269-277 (2011).
- Troschl, C., Meixner, K., Drosg, B. Cyanobacterial PHA production-review of recent advances and a summary of three years' working experience running a pilot plant. Bioengineering. 4 (2), (2017).
- Rizwan, M., Mujtaba, G., Memon, S. A., Lee, K., Rashid, N. Exploring the potential of microalgae for new biotechnology applications and beyond: a review. Renewable and Sustainable Energy Reviews. 92, 394-404 (2018).
- Niesa, F., et al. Characterization of Phormidium lacuna strains from the North Sea and the Mediterranean Sea for biotechnological applications. Process Biochemistry. 59, 194-206 (2017).
- Laurens, L. M. L., Chen-Glasser, M., McMillan, J. D. A perspective on renewable bioenergy from photosynthetic algae as feedstock for biofuels and bioproducts. Algal Research. 24, 261-264 (2017).
- Barreiro-Vescovo, S., Barbera, E., Bertucco, A., Sforza, E. Integration of microalgae cultivation in a biogas production process from organic municipal solid waste: From laboratory to pilot scale. ChemEngineering. 4 (2), 26 (2020).
- Zurano, A. S., et al. Year-long assessment of a pilot-scale thin-layer reactor for microalgae wastewater treatment. Variation in the microalgae-bacteria consortium and the impact of environmental conditions. Algal Research. 50, (2020).
- Deprá, M. C., Severo, I. A., Dias, R. R., Zepka, L. Q., Jacob-Lopes, E. Photobioreactor design for microalgae culture. Microalgae. , 35-61 (2021).
- Osburn, F. S., Wagner, N. D., Scott, J. T. Biological stoichiometry and growth dynamics of a diazotrophic cyanobacteria in nitrogen sufficient and deficient conditions. Harmful Algae. 103, (2021).
- Eustance, E., Badvipour, S., Wray, J. T., Sommerfeld, M. R. Biomass productivity of two Scenedesmus strains cultivated semi-continuously in outdoor raceway ponds and flat-panel photobioreactors. Journal of Applied Phycology. 28 (3), 1471-1483 (2016).
- Qiang, H., Richmond, A., Zarmi, Y. Combined effects of light intensity, light-path and culture density on output rate of spirulina platensis (cyanobacteria). European Journal of Phycology. 33 (2), 165-171 (1998).
- Ooms, M. D., Dinh, C. T., Sargent, E. H., Sinton, D. Photon management for augmented photosynthesis. Nature Communications. 7, 1-13 (2016).
- Moheimani, N. R., Borowitzka, M. A., Isdepsky, A., Sing, S. F. Standard methods for measuring growth of algae and their composition. Algae for biofuels and energy. , 265-284 (2013).
- Griffiths, M. J., Garcin, C., van Hille, R. P., Harrison, S. T. L. Interference by pigment in the estimation of microalgal biomass concentration by optical density. Journal of Microbiological Methods. 85 (2), 119-123 (2011).
- Schumann, R., Häubner, N., Klausch, S., Karsten, U. Chlorophyll extraction methods for the quantification of green microalgae colonizing building facades. International Biodeterioration and Biodegradation. 55 (3), 213-222 (2005).
- Pinckney, J. L., Richardson, T. L., Millie, D. F., Paerl, H. W. Application of photopigment biomarkers for quantifying microalgal community composition and in situ growth rates. Organic Geochemistry. 32 (4), 585-595 (2001).
- Van Wychen, S., Laurens, L. M. L. Determination of total solids and ash in algal biomass: laboratory analytical procedure (LAP). National Renewable Energy Laboratory. , (2015).
- Davis, R., Laurens, L. Algal biomass production via open pond algae farm cultivation: 2019 state of technology and future research. National Renewable Energy Laboratory. , (2020).
- Borovkov, A. B., Gudvilovich, I. N., Avsiyan, A. L. Scale-up of Dunaliella salina cultivation: from strain selection to open ponds. Journal of Applied Phycology. 32 (3), 1545-1558 (2020).
- Davies, F. K., et al. Microbiota associated with the large-scale outdoor cultivation of the cyanobacterium Synechococcus sp. PCC 7002. Algal Research. 58, (2021).
- Ataeian, M., et al. Direct capture and conversion of CO2 from air by growing a cyanobacterial consortium at pH up to 11.2. Biotechnology and Bioengineering. 116 (7), 1604-1611 (2019).
- Fu, F., et al. Sustained photosynthesis and oxygen generation of microalgae-embedded silk fibroin hydrogels. ACS Biomaterials Science & Engineering. , (2021).
- Rearte, T. A., et al. Photosynthetic performance of Chlorella vulgaris R117 mass culture is moderated by diurnal oxygen gradients in an outdoor thin layer cascade. Algal Research. 54, (2021).
- Poughon, L., et al. Limnospira indica PCC8005 growth in photobioreactor: model and simulation of the ISS and ground experiments. Life Sciences in Space Research. 25, 53-65 (2020).
- Yen, U. C., Huang, T. C., Yen, T. C. Observation of the circadian photosynthetic rhythm in cyanobacteria with a dissolved-oxygen meter. Plant Science. 166 (4), 949-952 (2004).
- Vermaas, W. F. Photosynthesis and respiration in cyanobacteria. eLS. , (2001).
- Ritter, . MilliGascounter Type MGC-1 Operation Instructions V 3.4. , (2017).
- Sousa, C., De Winter, L., Janssen, M., Vermuë, M. H., Wijffels, R. H. Growth of the microalgae Neochloris oleoabundans at high partial oxygen pressures and sub-saturating light intensity. Bioresource Technology. 104, 565-570 (2012).
- Latifi, A., Ruiz, M., Zhang, C. C. Oxidative stress in cyanobacteria. FEMS microbiology reviews. 33 (2), 258-278 (2009).
- Morillas-España, A., Lafarga, T., Gómez-Serrano, C., Acién-Fernández, F. G., González-López, C. V. Year-long production of Scenedesmus almeriensis in pilot-scale raceway and thin-layer cascade photobioreactors. Algal Research. 51, (2020).
- Melis, A. Solar energy conversion efficiencies in photosynthesis: minimizing the chlorophyll antennae to maximize efficiency. Plant Science. 177 (4), 272-280 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon