Method Article
オンライン成長測定とカスタマイズ可能な光レジームを備えた実験室用フォトバイオリアクターの操作
要約
この出版物は、カスタマイズ可能な光レジームを備えた実験室用フォトバイオリアクター(PBR)の設計について説明しています。シアノバクテリアまたは微細藻類の増殖は、炭酸水素塩を炭素源として使用し、体積酸素産生を測定することによって継続的に監視される。これらのPBRは、実験中のユーザーの介入をほとんど伴わずに、迅速で複製された実験室の成長比較を容易にします。
要約
微細藻類の実験室研究は実験的に困難な場合があります。非光合成微生物の培養要件に加えて、光栄養はまた、照明を必要とする。日常的に、研究者はカスタムの光源、すなわちそれが供給される光強度と時間を変えようとします。このような柔軟性は、標準的なベンチトップライトでは困難です。通常、栽培研究は、実験的処置間の成長比較も必要とする。多くの場合、成長は、例えば、1週間にわたる試験にわたって1日に複数回、長期間にわたって評価される。手動測定は時間がかかり、データ分解能が不足する可能性があります。したがって、自動増殖モニタリングとカスタマイズ可能な光供給を備えたフォトバイオリアクター(PBR)は、複数の処理を伴う複製実験に有用である。現在の研究は、実験室PBRの設計、建設、および操作を提示する。材料は容易に調達され、比較的安価である。デザインは適度なスキルで複製することができます。各構造物のフットプリントは約40 cm2で、3 回の複製用に3本の1 Lガラス瓶をホストしています。ボトルはマグネチックスターラーを含むプラットフォームの上に置かれ、高さ1 m、直径15 cmのポリ塩化ビニル(PVC)パイプ内に垂直に配置されます。パイプ内部には発光ダイオード(LED)が並んでいます。これらのLEDは、光合成活性放射線(PAR)の0〜2400μmol光子m-2 s-1からの連続光強度を生成する。ユーザーはカスタム照明プログラムを設計します。光の強度は、毎秒調整することも、より長い期間一定に保持することもできます。光合成から生成された酸素は、一方向容積式ガスセンサーを介して各ボトルから出ます。ソフトウェアは、ガスセンサーのデータを記録するために使用されます。生成される酸素の量は、バイオマス成長と相関し得る。バイオマスサンプルが必要な場合は、シリンジを使用して培養物を抽出することができます。この方法は、重炭酸塩を炭素源として増殖させた微細藻類に適している。これらのPBRは、複製実験、光レジームの柔軟性、および継続的な高解像度成長データを必要とする研究室にとって貴重です。
概要
微細藻類とシアノバクテリアは、簡単にするために微細藻類と総称され、持続可能なバイオテクノロジーにおけるその可能性のために擁護されています。彼らは、その急速な成長、耕作不可能な土地で栽培する能力、および二酸化炭素のバイオマスへの変換を促進するために日光を使用するため、魅力的な候補です1,2,3。微細藻類バイオマスは、石油またはガス、食品染料および栄養補助食品、ならびに生体高分子1,4,5,6,7などの材料の形でバイオエネルギーなどの製品に変換することができる。さらに、それらは排水を処理したり、過剰な栄養素を消費することによって水域を修復したりするために使用することができます 8,9.これを考えると、微細藻類の研究は広範かつ確立されています。この分野は、社会が現在の製造とエネルギー生成のアプローチの炭素強度と環境の持続可能性を再考するにつれて成長します。
実験室ベースの微細藻類研究の3つの基本的な要件は、培養容器、光源、および増殖を定量化する方法です。光バイオリアクター(PBR)という用語は、培養容器10が照明されるセットアップを記述する。一般に、微細藻類の研究は、2つ以上の処置、例えば、異なる成長培地、光レジーム、または種11、12、13の間の成長を比較することを目的としている。統計的関連性のために、各状態、例えば、治療および対照は、複製されるべきである。コントロールと治療を同時に実行する場合、実験期間中、多くのPBRをモニターおよびサンプリングする必要があります。複数のPBRを運用する場合の課題は2つあります。まず、各PBRに均一な光強度を供給することは、再現性のために不可欠ですが、困難な場合があります。容器表面に入射する光の量は、光源からの距離、隣接する容器からのシェーディング、および背景光変動14によって影響される。第二に、成長を正確に定量化する方法を選択する必要があります。
増殖は一般に、細胞数、光学密度(OD)、クロロフィルA含有量、乾燥重量(DW)密度、および無灰乾燥重量(AFDW)密度15によって測定される。細胞数、クロロフィルA含有量、および重量法は、離散的なデータポイントを生成する手動プロセスです。ODは、AFDW密度15などの別の方法に対して十分に較正されていれば、分光光度計を用いて連続的かつ非侵襲的に測定することができる。しかしながら、OD測定値およびクロロフィルA含量は、結果が異なる培養条件下、例えば、種間および成長サイクル全体を通して変化するため、信頼性が低い可能性がある15、16。クロロフィルAの場合、抽出方法は色素収率17にも影響を与えることができる。クロロフィルA含有量は、非光合成生物も含む微生物群集内の微細藻類の成長を追跡するのに特に有用である17、18。成長を決定する方法を選択する際には、懸濁液の形態を考慮することが不可欠である。生物が凝集し、十分に混合されていない場合、ODと細胞数は不可能です15。単一の方法がすべての実験用途に適しているわけではなく、研究者はどの方法が実用的で実験目的に関連しているかを決定する必要があります。
AFDWは、様々な培養条件間、特に種と培養培地との間の増殖比較を可能にする信頼できる方法である15、19、20。AFDWを計算するために、微細藻類培養物のサンプルを、まず、濾過または遠心分離のいずれかによって濃縮し、乾燥させる。この段階で、DW を決定することができます。通常、DWサンプルには、塩や粒子状物質などの灰質無機材料が少なくとも8〜10%含まれています15。DWは成長傾向を追跡しますが、無機物の寄与が異なる場合、歪む可能性があります。AFDW密度を決定するために、乾燥バイオマスを高温で燃焼させる。これは、19の後ろに灰(無機物)を残しながら、有機または有用な部分を気化させます。AFDWを計算するために、灰分率の重量をDW分率の重量から差し引く。典型的には、微細藻類懸濁液において、AFDWの範囲は0.1〜3g/L12,21,22である。少量の希薄懸濁液は、乾燥バイオマスをほとんどもたらさない、<10mgである。燃焼後、灰の重さはわずか1mgです。したがって、培養密度に応じて、この方法は5〜100mLの容量と0.1mg 12,15,19,22の正確な分析スケールを必要とします。実験室用PBRは通常、小さく、最大で数リットルであるため、すべての液体サンプルは培養量を枯渇させます。さらに、AFDW法は手動であり、2〜3日かかります。反復実験と反復実験では、自動化された連続的なプロセスが好ましい。
炭素源として重炭酸塩を使用する微細藻類の場合、2つの追加の成長メトリックを連続的に測定することができる。光合成は重炭酸塩を消費し、酸素を生成します。重炭酸塩の消費量は、中pH23を駆動します。浸漬pHプローブは、この変化を測定することができます。光合成酸素生成は、培地が飽和するまで培地の溶存酸素(DO)濃度を増加させる。飽和を超えて、酸素は気泡として存在します。酸素生成は、プローブがDO濃度を測定し、マノメトリックデバイスがヘッドスペースの圧力を評価し、ガスクロマトグラフィーがヘッドスペースの組成を測定し、体積センサーがガス流出24、25、26、27を記録するなど、さまざまな技術によって測定されます。酸素を増殖プロキシとして使用する場合、培養容器は完全に密閉されているか、ガスの流出のみを許可する必要があります。pHおよび酸素測定の場合、炭素はCO2散布ではなく、重炭酸塩の形で供給されなければなりません。CO2散布は培地pH23を低下させ、気体として酸素測定を妨げる可能性がある。光学密度に対するpHおよび酸素の利点の1つは、微細藻類が凝集塊を形成してもこの方法が損なわれないことである。間接的ではありますが、pHと酸素の両方が治療間の成長を比較するのに効果的です。
現在使用されている PBR は、複雑さがさまざまです。実験室では、単純なベンチトップフラスコ、カスタムプロトタイプ、または市販製品を使用できます。フラスコからのアップグレードを目指す研究グループにとって、多くのプロトタイプを構築するために必要な市販PBRのコストや技術的スキルと部品製造のコストが障壁になる可能性があります。この原稿は、このギャップを埋めるラボ用PBRの設計、構築、運用を段階的に説明することを目的としています。これらのPBRはカスタマイズ可能な光レジームを持ち、体積酸素産生を記録することによって成長を継続的に監視します。この設計には、3 つの複製用の 3 つの培養容器が収容されており、適度なスキルと簡単にアクセスできる材料で構築できます。このPBRは、非常に技術的または高価な製品に投資することなく、微細藻類研究の能力を拡大しようとしている研究室への貴重な追加です。PBRの取得または構築を選択する場合、研究者は、文化条件、財政状態、および研究上の質問に対する設計の適合性を考慮する必要があります。
プロトコル
1. PBRスタンドの建設
- ハンドヘルド弓のこぎりで、長さ380mmの5本と長さ200mmの角度付きスロット付きスチールを2本切断します。ボルトと大きなコーナーブレースで固定して、スタンドのベースを作ります(図1A)。安全エンドキャップの接着剤。
- 2つの未カット(1220 mm)垂直長さの角度付きスロット付きスチールをベースに接続します。ボルトと金属製のコーナーマチで固定します(図1B)。安全エンドキャップの接着剤。
- スロット付きスチールの4つの65 mmフラットな長さを切断します。これらを垂直サポートに90°の角度でボルトで固定し、各サポートに2つ、ベースから130 mm上に1つ、上から60 mm下に1つ取り付けます。
- 垂直サポートを上部に固定し、水平長さ140 mmの平らなスロット付きスチール(クロスビーム)をフレームの背面にボルトで固定します(図2A)。
2. ライトチャンバーの建設
- 直径153mmの白いポリ塩化ビニル(PVC)パイプを1070mmの長さに切断します。バンドソーでパイプを縦に半分に切ります。すべてのエッジを砂にします。
- 均等にスペースを確保し、パイプの内部とともに4つのアルミニウムヒートシンクチャンネルを垂直に中央に配置します。パイプの切断端から 20 mm 以内にチャンネルを取り付けないでください。小さなボルトで、チャネルを上下の所定の位置に固定します(図2B)。
- 手順 1.3 で作成した水平サポートを使用して、パイプの半分をスタンドにボルトで固定します。
- 原子炉を下ろし、パイプの半分をテープでつなぎ合わせて再結合させます。ピアノヒンジを1つのカットラインに沿って中央に配置します。ヒンジ穴をトレースし、それに応じてパイプをドリルします。リベットガンと中長リベットを使用して、ヒンジをパイプに固定します。
- 小さなバンジーコード( 材料表を参照)を使用して、パイプを閉じたままにします(図1C)。
- 電気技師に相談してLEDライトを配線し、LEDドライバ、デジタルマルチプレックス(DMX)デコーダ、DMX照明コントローラ、スイッチボックスの4つのコンポーネントを取り付けます( 材料表を参照)。 図2Aに従って、すべてのコンポーネントをPBRの背面に固定します。
3. ボトルプラットフォームの構築
- コンピュータ数値制御(CNC)フライス加工を使用して、高密度ポリエチレン(HDPE)(材料表を参照)などの硬質プラスチックからプラットフォーム形状(図3A)を切り取ります。各図形を 3 つ作成します。
メモ: 予備の上層と最下層の切断をお勧めします。 - 最下層と最上層を一緒にテープで留めます。両方の形状に直径6mmの5つの小さな穴をあけて穴を開けます(図3A)。大きなドリルビットを使用して、ボルトヘッドをくぼませることができるように、これらの穴の表面を慎重に広げます(図3B)。
- 3 つのプラットフォームのそれぞれについて、2 つの小さなコーナー ブレースをパイプの後ろ半分にボルトで固定します。
メモ: 中括弧の上部間の距離は 350 mm にする必要があります。 - 各最下層を中括弧の上に配置します。中括弧の下からドリル穴の位置をマークします。直径 6 mm の穴を 2 つ開けます。大きなドリルビットを使用して、ボルトがくぼむことができるように穴の表面を慎重に広げます。
- 最下層を中括弧にボルトで固定します(図3B-C)。
- 長さ12 mm、外径6.35 mm(OD)の硬質チューブを15本切ります。各上層と最下層の間に5本の硬質チューブを挟みます。図3B-Dに従って、長い狭いボルトで層とチューブを固定します。
- 各プラットフォームの後ろにあるPVCパイプに大きな穴を開けます。各マイクロマグネチックスターラーをプラットフォームに挿入します。各スターラーの電気ケーブルをこれらの新しく切断された穴に通します(図3C-E)。各スターラーをそれぞれのコントロールユニットと電源コンセントに接続します。
- 各プラットフォームに1 Lボトルを置きます。ボトルネックレベルでリアパイプにアイボルトを追加します。小さなバンジーコードを各ボトルネックに巻き付けて、安定性を高めます(図4A)。
メモ:プロトコル全体を通して、色分けプラットフォーム、ボトル、マグネチックスターラー、および関連するすべてのケーブルとセンサーが役立ちます。
4. 液体サンプリングポートの建設(オプション)
- 長さ 60 mm の 6.35 mm 外径の硬質チューブを 3 本切断します。5 mmのドリルビットを使用して、各ゴム栓に穴を開けます。剛性チューブの長さをストッパーに押し込みます。
- 長さ 60 mm の 3.18 mm 外径硬質チューブを 3 本切断します。これらをストレート減速機で各ストッパーの下側の突出したチューブに接続します。
- 一方向活栓バルブ(ポート1=メスルアー、ポート2=オススリップルアー)を各ストッパー表面の突出チューブに挿入します(図4A)。
- 長さ30 mmの 3.18 mm 外径フレキシブルチューブを 3 本切断します。ルアー継手(例えば、オスルアーをホースバーブに、メスルアーをホースバーブに)を両端に挿入します。
- ステップ4.4で作成したピースを、各ゴム栓の表面にある活栓バルブに接続します(図4A)。
メモ: 活栓とルアー継手の多くの組み合わせで、同じ結果が得られます。設計上、液体を引き出したり、シリンジ を介して 挿入したりできるようにする必要があります。
5. 容積式ガスセンサーの接続
- ガスセンサーは、製造元の指示に従って準備してください。
メモ:これには主に、ガスセンサに梱包液を充填することが含まれます(図4B)。 - ガスラインを作成するには、長さ3.18 mm ODのフレキシブルチューブを3本1000 mm切断します。
- 背面のPVCパイプに直径4mmの穴を3つ開けます。ヒンジの横の穴をボトルネックの高さで配置します。これらの穴にガスラインを通します(図4A)。
- PVCパイプ内のガスラインの端に、ルアー継手(例えば、ホースバーブをオスルアーに)を追加し、一方向活栓バルブ(例えば、ポート1 =メスルアー、ポート2 =オスルアー)を接続します。
メモ:バルブは、液体サンプリングポートも取り付けられている場合にのみ必要です。 - ストレート減速機を使用して、ガスラインの他端をガスセンサの入口ポートに接合します。この接続はジップネクタイで固定します。
- すべてのガスセンサーをジャックプラグケーブルでデジタル入力モジュール(DIM)に接続し、DIMを近くのコンピュータに接続します。
- データ収集ソフトウェア( 資料の表を参照)をWindowsオペレーティングシステムにインストールし、ライセンスキードングルを接続します。センサーキャリブレーションファイルをソフトウェアのキャリブレーションディレクトリに追加します。
6. 光のレジームのプログラミング
- 背面のオン/オフスイッチを使用してPBRの電源を入れ、DMX照明コントローラをマイクロUSBケーブル で コンピュータに接続します。
- ストアアップグレードツール(SUT)とLED制御ソフトウェアをダウンロードします( 材料表を参照)。DMX照明コントローラをオンラインで登録します。
- LED 制御ソフトウェアを開き、[ USB-DMX インターフェイスを操作するにはここをクリックしてください: SUSHI-RB-RJ] を選択します。
- [スキャンライブラリ]ボックスの[セットアップ]タブで、[汎用]フォルダと[シングルチャンネル]を選択します。スキャン・ライブラリの設定をDMXユニバース1、フィクスチャ数を4、インデックス番号を1に変更します。右上隅で、ドロップダウン ボックスをリスト ビューに変更します。最後に、[パッチ]をクリックします(補足図1)。
メモ:DMXの世界では、1つのボックスで各LEDストリップのコントロールをテストするには、調光ボタンをスライドさせるか、テキストボックスに数値を入力します。 - 照明制御ソフトウェアのデジタル光設定をPVCチューブの中央で経験する光強度に関連付ける標準曲線を作成します(図5)。PVCパイプの中央に吊り下げられた小さな球形プローブ( 材料表を参照)で内部光強度を測定します。
- [ エディタ] タブに進みます。カスタム ライト プログラムを作成するには、新しいシーンを作成し、 ステップの追加を開始します。16:8 h 日周プログラムの例については、 補足表 1 を参照してください。シーンをループするように設定します。
メモ: ステップでは、シーンを時間ブロックに分割し、それぞれを異なる光強度に設定できます。ステップの範囲は1秒から43分です。ここでは、30分のステップが最も便利です。複数のシーンを1つのDMX照明コントローラデバイスにロードできます。 - すぐに認識できる追加のヘルパー シーンを作成します (たとえば、4 つの LED のうち 2 つがオンになっているなど)。
メモ: DMX 照明コントローラの側面にあるボタンを使用して、シーンを手動で循環させることができます。所望の光プログラムが夜間に開始される場合、光プログラムがすでに開始されているかどうかを区別することは不可能であろう。ヘルパー シーンは、DMX ライティング コントローラーが正しく機能していることを示すインジケーターとして機能します。 - シーンを保存し、[ スタンドアローン] タブに進みます。DMX照明コントローラのメモリに書き込み、デバイスをコンピュータから取り外します。
- DMX照明コントローラをマイクロUSBを使用して電源に接続します。
- 実験を開始する前に、内部光強度を 24 時間記録して、光プログラムをテストします。液体温度が重要な場合は、水没温度プローブと同時にこれをログに記録します(図6)。
7. 実験の開始
- 媒体、ボトル、攪拌バー、ゴム栓、サンプリングポート、ねじ付き絞りスクリューキャップ、チューブを滅菌します。
注:この設計で使用されるすべてのコンポーネントは、バルブとルアー継手を除いてオートクレーブ可能です - 他のメーカーからのオートクレーブ可能な代替品があります。 - データ集録ソフトウェアを開き、設定ページに入力します(補足図2)。キャリブレーションファイルをそれぞれのセンサーに割り当てます。
- 「ディレクトリー・ファイル名」で、対応する DIM ポート番号フォルダーを選択します。[現在のフォルダ]をクリックし、すべてのポートに対して繰り返します。
- [ OK ]をクリックして、ログページに進みます。
- ボトルを栽培培地で所望の容量に充填する(補足表2、3)。
注:これらのボトルのそれぞれは、小さなヘッドスペース(ガスラインを含む〜80mL)で最大約1.1 Lを保持します。 - ストック培養物を3本の平衡50mLチューブ中で4500 x g で15分間遠心分離し、3つのペレットを得た。各ボトルにペレットを1つ追加し、血清学的ピペットと新鮮な培地でペレットを洗います。
注: 0 日目の培養密度は、初期バイオマス濃度 (IBC) とも呼ばれます。gAFDWでIBCを測定する。L-1、追加の50 mLチューブをステップ7.6で遠心分離してもよい。得られたペレットは、次いで、乾燥し、燃焼させることができる15、19。ステップ 7.6 では、ユーザーの個々の目的と実験に基づいて変更が必要になる可能性があります。 - マグネチックスターラー(25 x 8 mm)を各ボトルに落とします。
- 各ボトルの開口部をゴム栓とネジ付きアパーチャスクリューキャップでシールします(図4A)。オプションのサンプリングポートが取り付けられている場合は、バルブを閉じます。
- PVCパイプ(ステップ5.4で構築)内の各ガスラインの端を見つけ、バルブのオスルアーポートに針を取り付けます。
- 各ボトルをガスセンサーに接続し、各ゴム栓を対応する針で突き刺します。
- 各ガスセンサーを個別に起動するには、画面左側のチェックボックスにチェックを入れ、[ スタート]をクリックし、ファイル名を入力します。[ OK] をクリックし、すべてのセンサーについて繰り返します(補足図3)。
メモ:ロギング中は、データ集録ウィンドウを終了しないでください。コンピューターの電源とスリープの設定を [決してしない ] に設定し、実験中はコンピューターの更新を延期します。 - PBRの電源を入れ、DMX照明コントローラがPSUに接続されていることを確認します。最初にプログラムされたシーンが自動的に開始されます。手順6.7を参照して、DMX照明コントローラが正しく機能していることを確認します。
8.ボトルサンプリング(オプション)
- 実験を開始する前に、さらに500mLの新鮮な培地を調製する(補足表2)。
注: 16:8 時間の日周サイクルを持つ 24 時間のライト プログラムが午前 9 時に開始された場合、夕暮れと夜明けの前のサンプリング時間は午前 8 時と午後 4 時になります(補足表 1)。ここで、夜明けと夕暮れとは、ライトを ON から OFF に、またはその逆に遷移させる 30 分間のステップを指します。 - ガスラインのバルブを閉じます。
- シリンジ(10mL)をサンプリングポートバルブに接続します(図4A)。
- サンプリングポートバルブを開き、培養液8mLを抜き出す。
注: 5 ~ 10 mL を推奨します。液体を除去すると、ヘッドスペースに真空が発生し、容量>10mLの抽出が困難になります。 - サンプリングポートバルブを閉じ、シリンジを取り外します。
- 8 mLの新鮮な培地を含むシリンジ(ステップ8.1から)をサンプリングポートバルブに接続します。
- サンプリングポートバルブを開き、新鮮な培地を注入します。
メモ:サンプリングされた培養液の量を新鮮な培地に置き換えると、ヘッドスペースの体積と圧力が等しくなり、サンプリングポートラインがフラッシュされます。 - シリンジを取り外す前に、サンプリングポートバルブを閉じてください。
- 各サンプリング時間で手順 8.2 ~ 8.8 を繰り返します。
9. 実験の終了
- データ集録ウィンドウのすべてのアクティブなポートチェックボックスをオンにして、[ 停止]をクリックします。
- データをエクスポートするには、[ ファイル と オフラインのデータ] を選択します。関連するすべてのログファイルを選択します。表計算ソフトにデータをエクスポートして保存します。
- 各ボトルについて、理想気体の法則を使用して、mLで測定した酸素の全量をモル数に変換します。生産されたバイオマスのモルごとに1.05モルのO2 が生成された場合、成長したバイオマスの重量(gAFDW)を予測する。バイオマスのモル重量を24.6 g mol-1とします。
- 流量データを手動でキュレーションします。mL/h の単位と 3 点移動平均を使用します。
結果
ここで酸素流量は、培養物の光合成速度の尺度である。光合成の速度が高くなり、したがって炭素固定がより高い成長率に変換されます。これは、ユーザーが成長の代理として、異なる治療と稼働日間の酸素流量を比較できることを意味します。簡単に言うと、ガスセンサは、デュアルチャンバ測定セルに気泡を閉じ込めて放出することによって機能します(図4B)。センサーの底にある入口からの気泡は、梱包液を通って上に移動します。気泡は、測定セルの1つのチャンバ内に〜3.2mLの体積まで蓄積する。この閾値に達すると、測定セルチップ。これにより、ガスが放出され、システムがリセットされます。各チップは、データ収集ソフトウェアによって記録されます。
サンプルデータでは、昼間の光強度および初期バイオマス濃度(IBC)が変化する3つの処置の増殖速度を比較した。これらの治療法は、実証目的のために任意に選択された。それらは、(A)300μmol光子m-2 s-1および0.03g AFDW L-1、(B)600μmol光子m-2 s-1および0.13g AFDW L-1、および(C)600μmol光子m-2 s-1および0.40g AFDW L-1であった。これらの放射照度は、ボトルがプラットフォームに置かれる前に、PVCパイプの中央にある球面プローブで測定されました。培養の深さと密度は、光の減衰に影響します。したがって、微細藻類が経験する実際の光強度は、報告されたものとは異なる可能性がある。各処理は、3本のボトルを含む1つのPBR内で3連で実施した。
ここで成功した実験は、ガス生成の密接に複製された日周パターンによって特徴付けられました(図7A-C)。照明時間(日)の間、ガス生産は着実に増加し、非点灯時間(夜間)ではガス生産が停止しました(図7A-C)。微細藻類によって生成されるガスは、光合成からの酸素と呼吸からの二酸化炭素の28である。光合成は照らされた時間に制限されるが、呼吸は連続的に起こるが、28日目の夜に最も活発である。光合成は構築するが、呼吸はバイオマス28を異化させる。当初、ヘッドスペースガスの組成は大気の組成と同じです。測定セルを反転させるたびに、O2は大気ガスを置き換えます。したがって、ガスセンサの読み取り値は、発信ガスが純粋なO2でなくてもO2の生成に起因していた。ガスセンサの最小ガス入口圧力は8~9mbarと非常に低く、ボトルのヘッドスペースの圧力は大気(海抜1.01 bar)をわずかに上回るだけです。したがって、ガスセンサの読み取り値は、O2気泡が媒体を離れた直後に開始されます。
呼吸から放出されるCO2は、2つの理由でガスセンサの読み取り値に寄与しない。まず、アルカリ性媒体中では、CO2が重炭酸塩に反応し、pHが低下します(図8)。第二に、CO2が逃げた場合、ガスセンサパッキング液体であるSiloxは、測定セルに到達する前にCO2気泡を溶解し、液面29でCO2をガス放出する。これは、夜間のガスセンサーの読み取り値がないことによってサポートされています。実際に発生したものは、ライトが消灯した直後に記録され、測定値が昼間の残留酸素放出を表していることを示しています(図7)。
実験セットアップ(局所温度および圧力データを使用)では、周囲圧力で80mLのヘッドスペースは、99%のO2分圧を確立するために340mLの分解O2を必要とした。 ここで、4日間にわたって生成された酸素の全体積は、処理Aにおける316(SEM±11)mLから処理Cにおける902(SEM±51)mLまでの範囲であった(表1)。したがって、実験の終わりまでに、すべてのボトルのヘッドスペースは主にO2を含んでいたであろう。ヘッドスペースO2の濃度の増加、したがってN2の濃度の低下は、これらのガスの分圧と飽和に影響を与えたであろう。99%のO2ヘッドスペースで、DOの5倍の増加が計算されました。1.1 L培養では、これはさらに23 mLのDOに変換され、逆に、1%のN2ヘッドスペースへのシフトにより、15 mLのN2が溶解すると推定されました。これは、ほぼ純酸素ヘッドスペースの下で、N2よりも多くの固溶したO2が変位したことを意味する。したがって、より多くのO2が媒体中に残存するので、この効果は、生成される光合成酸素の量におけるわずかな過小評価につながったであろう。
この方法の主な課題は、文化が密になったときに起こりました。より多くのバイオマス、したがってより多くの呼吸により、O2の需要が増加した。夜間のO2消費は、ヘッドスペースの圧力低下を引き起こした。これにより、ガスセンサーのパッキング液がガスラインを通って上がっていきました。O2の生産が再開されると、梱包液をガスセンサーに戻す必要がありました。これにより、最初のガスセンサーの読み取りに遅延が生じました。しかし、4日目の夜、この圧力不足の大きさにより、充填液が処理Bの3つの反復のうちの2つに到達して滴下され、表面油膜が生成されました。パッキング液面が低下したため、ガスセンサが短絡し、未測定のO2が大気に直接放出されました。これにより、データ収集が平坦化しました(図7B)。
低圧は、ヘッドスペース容積の温度誘発収縮によっても引き起こされ得る。しかし、ここでの効果は最小限でした。ヒートシンクチャンネルとエアフローは、余分な熱を適切に放散しました。試行された2つの光レジームのうち、最大温度変化はヘッドスペース容積を1%以下減少させ、80mLヘッドスペース内の800μL充填液変位に相当します。最大日周温度スイングは、300μmol光子m-2 s-1レジーム(図6)では1.4°C、600μmol光子m-2 s-1レジームでは3.2°Cであった。300 μmolおよび600 μmol光子m-2 s-1レジームの日中平均温度上昇は、それぞれ0.7°Cおよび1.8°Cであった。培養温度は一晩でベースラインに戻った(図6)。
高解像度の成長率データは、そうでなければ気づかれないかもしれない傾向を明らかにすることができます。治療BとCを検討してください。IBCが異なるにもかかわらず、両者は同量の全バイオマス(gAFDW)を生成し、培地pHに同じシフトを引き起こした(表1)。開始データポイントと最終データポイントのみが与えられると、個人は2つの治療間で平均成長率に差がないと正しく仮定することができます(表1)。しかし、オンライン酸素流量データは、各治療が毎日の成長率を変化させることを明らかにした。これらの変動は、1日2回のpH測定にも反映されました(図8)。初日、治療Bの成長率は治療Cの成長率よりも低かった。3日目までに、これは治療Bの成長率が治療Cの成長率を上回ることで逆転した(図7B、C)。酸素流量データは、処置Bにおいて最も高い増殖速度が3日目に起こったことを示した(図7B)。
3つの処理における各ボトルによって生成された酸素の総体積を用いて、総バイオマスにおけるそれらのそれぞれの変化(gAFDW)を推定した。これは、光合成バイオマス合成のための一般的な式を使用して達成された:CO2 + 0.2NH3 + 0.6 H2 O = CH 1.8 O 0.5 N0.2 +1.05 O2。ヘッドスペースO2分圧の増加とそれに続くDO飽和度の上昇は、バイオマス成長のわずかな過小評価を引き起こすと予想された。これは、7例中5例に当てはまる(表2)。平均して、推定バイオマス成長は、測定されたバイオマス成長の10%以内であった。いくつかの推定値は、測定された成長からわずか1〜3mgしか異なっていなかった。成長を過大評価した2つの例、すなわち、バイオマス成長が説明できるよりも多くの酸素が生産された。一晩の呼吸によって消費されたO2は、翌日のO2産生の遅れに反映されるべきである。ここで、実験は夜の終わりに終了した。このようにして、各実験の最後の8時間の間の一晩のバイオマス異化作用は測定されないままになる。これは、特に高密度培養において、バイオマス成長の過大評価を引き起こす可能性がある。そのため、照明時間の終わりに実験を終了することをお勧めします。

図1:リアクタースタンドベース。 (A)ベースコンポーネントの寸法(mm単位)(B)2つの垂直サポートを固定する金属製のコーナーマチの向き。(C)4つの短い鋼の長さのうちの1つは、PVCパイプの後ろ半分を反応器スタンドに接続する。 この図の拡大版を表示するには、ここをクリックしてください。

図 2: 電気部品。(A) PBR の背面図で、上部のクロス ビームと電気部品の構成を示します。(B) ライト設置後のPBRの正面図。この図の拡大版を表示するには、ここをクリックしてください。
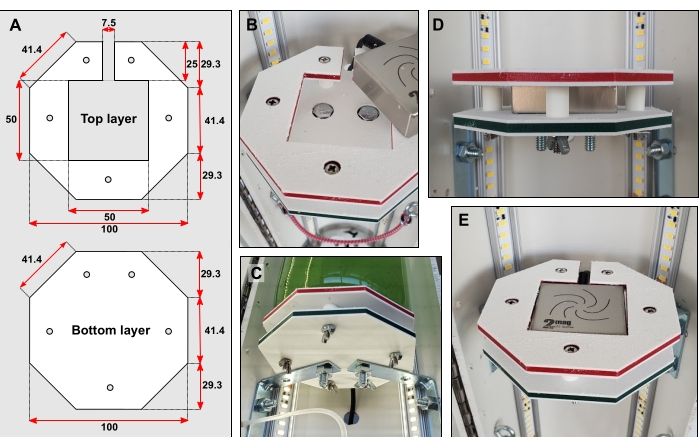
図3:ボトルプラットフォームの詳細。 (A)上層と最下層の寸法(mm単位)。 (B)ボルトヘッドを両方の層にくぼませる。(C)ブレースは、最下層をPVCパイプの後半分に直接接続します。(D)狭いボルトの上に取り付けられた5つの短い剛性チューブは、上層と底層を離して保持する。(E)ボトルプラットフォームが完成したら、表面は平らでなければなりません。 この図の拡大版を表示するには、ここをクリックしてください。

図4:ガスラインとオプションのサンプリングポート(A)ガスラインは、各ボトルヘッドスペースを外部ガスセンサに接続します。サンプリングポートが必要な場合は、ガスラインに針のすぐ下流に一方向バルブを含める必要があります。(B)容積式ガスセンサー。液体パッキングレベルは、トレースネジに触れる必要があります。この図の拡大版を表示するには、ここをクリックしてください。
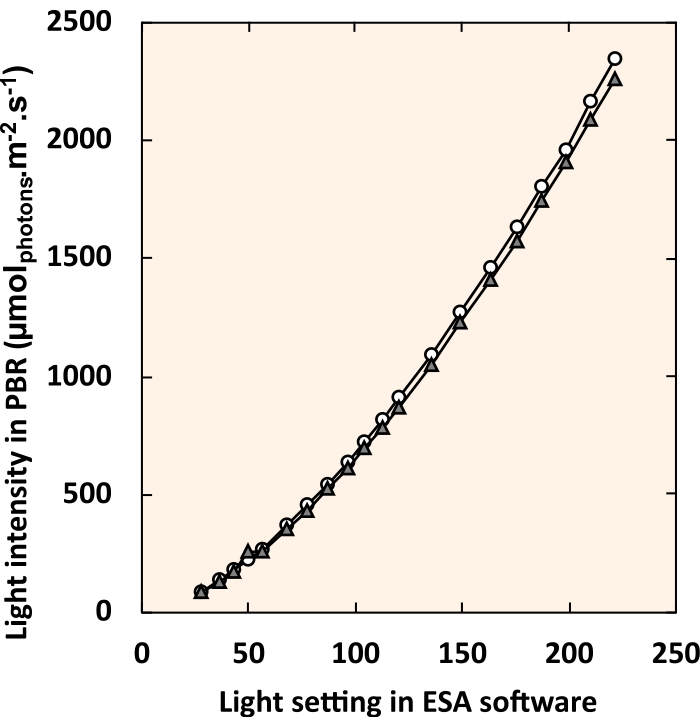
図5:LED制御ソフトウェアの設定と内部光強度に関連する標準曲線 白い円と灰色の三角形は、それぞれ個々の PBR を表します。各ライト設定について、4 つの器具はすべて同じ値に設定されました。 この図の拡大版を表示するには、ここをクリックしてください。
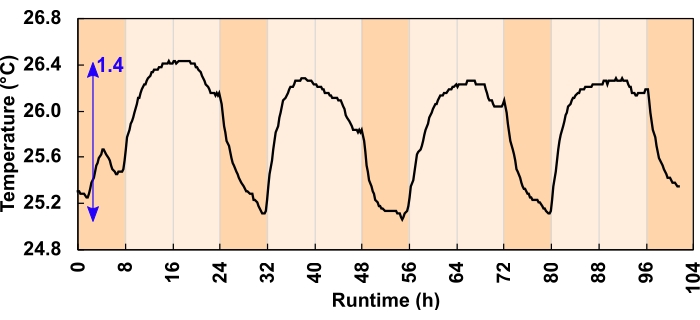
図6:300μmol光子m-2 s-1光レジームに対する培養温度変化。 24時間、16:8時間の日周プログラムの間、LEDは昼間の培養温度を上昇させた。青い矢印は、最低気温と最高気温の差を示します。軽いプログラムエラーにより、夕暮れ前に温度が下がった。これは実験開始前に修正されました。この図の拡大版を表示するには、ここをクリックしてください。
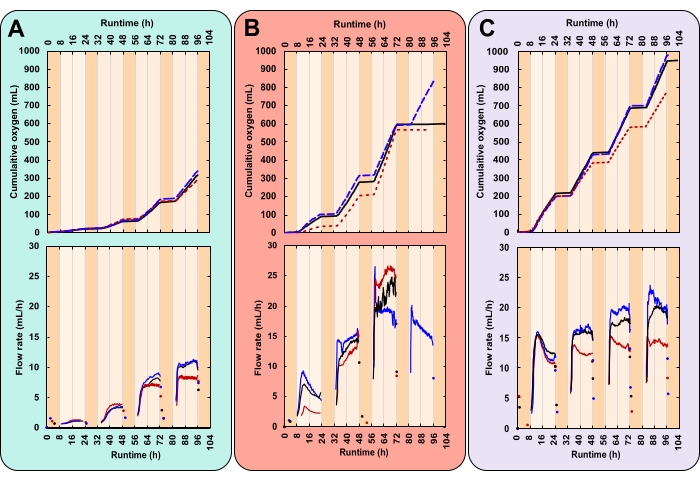
図7:3つのユニークな実験条件に対する酸素生産。 各反応器は、光強度と初期バイオマス濃度(IBC)の異なる組み合わせを受けた。(A)300μmol光子m-2 s-1およびIBC 0.03g AFDW L-1、(B)600μmol光子m-2 s-1およびIBC 0.13g AFDW L-1、(C)600μmol光子m-2 s-1およびIBC 0.40g AFDW L-1。上部のグラフには、累積酸素生産量(mL)とガス流量(mL/h)が表示されます。黒い実線、青い破線、赤い点線が反復です。各実験の実行時間は104時間で、これには4つの完全な16:8時間の昼夜サイクルが含まれていました。濃いオレンジ色の網かけは夜間の時間、明るいオレンジ色の昼間の時間を表します。なお、処理Bでは、3回の反復のうち2回について4日目に酸素産生フラットラインが並ぶ。この図の拡大版を表示するには、ここをクリックしてください。

図8:pH応答 各反応器は、光強度とIBCの異なる組み合わせを受けた。(緑色のひし形)300μmolの光子m-2 s-1およびIBC 0.03g AFDW L-1、(赤色の三角形)600μmolの光子m2 s-1およびIBC 0.13g AFDW L-1、(紫色の円)600μmolの光子m-2 s-1およびIBC 0.40gAFDW L-1.濃いオレンジ色の網かけは夜間の時間、明るいオレンジ色の昼間の時間を表します。エラーバーは、平均の標準誤差を表します。この図の拡大版を表示するには、ここをクリックしてください。
| 処遇 | 光強度(μmol光子m-2 s-1) | IBC (gAFDW L-1) | Δ 全バイオマス (gAFDW) | δ pH | 生成される全酸素(mL) |
| ある | 300 | 0.031 | 0.289 (± 0.01) | 0.15 (± 0.01) | 316.2 (±11.4) |
| B | 600 | 0.130 | 0.674 (± 0.02) | 0.52 (± 0.27) | 834.6* |
| C | 600 | 0.400 | 0.675 (± 0.02) | 0.55 (± 0.03) | 902.2 (±50.5) |
| * 3回の反復のうち1回のみが成功しました | |||||
表 1: 時間 0 から 104 への成長メトリックのシフト。 括弧は平均の標準誤差を表します。
| 処遇 | 光強度(μmol光子m-2 s-1) | IBC (gAFDW L-1) | バイオマス成長測定(gAFDW) | バイオマス成長予測(gAFDW) | 過小評価(%) |
| ある | 300 | 0.031 | 0.289 | 0.288 | 0.5 |
| ある | 300 | 0.031 | 0.311 | 0.270 | 13.1 |
| ある | 300 | 0.031 | 0.268 | 0.247 | 7.9 |
| B | 600 | 0.13 | 0.708 | 0.705 | 0.4 |
| C | 600 | 0.4 | 0.718 | 0.796 | -10.9 |
| C | 600 | 0.4 | 0.640 | 0.830 | -29.7 |
| C | 600 | 0.4 | 0.668 | 0.659 | 1.3 |
表2:測定された全酸素に基づく成長推定値。 300μmolの光子m-2 s-1およびIBC = 0.13g AFDW L-1処理からの複製は1つだけ完了まで走った。
補足図1:LED制御ソフトウェアのスクリーンショット 4つの照明器具のそれぞれは、調光ボタンをスライドさせるか、テキストボックスに数値を入力することによって独立して制御することができます。 このファイルをダウンロードするには、ここをクリックしてください。
補足図2:データ集録ソフトウェア構成ウィンドウのスクリーンショット。このファイルをダウンロードするには、ここをクリックしてください。
補足図3:データ集録ソフトウェアのロギングウィンドウのスクリーンショット。 明るい緑色の長方形は、オンラインガスセンサーを示します。データはリアルタイムで表示されます。 このファイルをダウンロードするには、ここをクリックしてください。
補足表1:実施例24時間光レジーム。16:8時間の日周プログラムの場合、それぞれ30分の48セットがあります。アスタリスクは、推奨されるサンプリング時間を示します。 この表をダウンロードするには、ここをクリックしてください。
補足表2:高アルカリ度高pH培地組成物。この表をダウンロードするには、ここをクリックしてください。
補足表3:微量元素溶液。 最終濃度1mL/Lをベース培地に加える。 この表をダウンロードするには、ここをクリックしてください。
ディスカッション
このプロトコルでは、次の手順に重点を置くと、再現性のある高品質のデータを生成する可能性が高くなります。リアクタースタンドを構築するとき(ステップ1)、ベースは十分に整列された垂直支持体で頑丈でなければならない。スロット付きスチールは鋭いエッジを持っているので、安全キャップの追加は不可欠です。ボトルプラットフォームの表面は完全に平らである必要があり、マグネチックスターラーとボルトヘッドは両方とも最上層表面の下に配置する必要があります(ステップ3.2-3.6)。メーカーの指示によると、正確な酸素測定のために、ガスセンサーパッキング液を「液体レベルのトレーススクリュー」に充填する必要があります。この液体レベルは、パッキング液体の蒸発が測定セルを短絡させる可能性があるため、定期的にチェックする必要があります。ステップ 5.2 で製造された 3 つのガス ラインはすべて同じ長さにする必要があります。これは、複製が同じヘッドスペースボリュームを持つエヌアです。実験を開始する前に、24時間にわたって光強度を記録して、プログラムされた光レジームをテストすることをお勧めします(ステップ6.11)。液温の上昇が懸念される場合は、このテストには内部温度プローブを備えた密閉ボトルも含める必要があります(ステップ6.11)。ロギング時には、データ集録ソフトウェアのウィンドウを終了しないでください。これにより、ログ記録が終了します。培養サンプルを採取する場合は、間違った順序でバルブを開けてヘッドスペースガスを放出しないように注意してください(ステップ8.2-8.8)。実験データを確認するときは、データ収集ソフトウェアが自動的に流量の移動平均を生成することに注意してください。これにより、一晩で生成された1つまたは2つの流量測定値の値が膨らみます。ガスセンサーログを手動でキュレートしてこれを修正します。
この方法の最も一般的な欠点は、液体パッキングレベルが低下した場合にガスセンサを短絡させる可能性があることです。これには 2 つの方法があります。第一に、蒸発はゆっくりと液体レベルを低下させることができる。しかしながら、これは短期的(<7日間)の実験29では起こりそうもない。第二に、高い呼吸数は酸素を溶液に引き込み、ヘッドスペースの圧力低下を引き起こす可能性があります。光エネルギーが利用できない場合、微細藻類は好気呼吸を使用して、細胞の維持および修復に必要なエネルギーを供給する28。したがって、非照明時間中の高密度培養では、酸素消費量、および結果として生じる圧力下は相当なものになる可能性があります。これにより、ガスセンサーから梱包液がガスラインに吸い込まれます。パッキング液体が移動する距離は、夜間の呼吸量に比例します。包装液がボトルに入ると、液面に油膜が発生します。
夜間の高い呼吸数が予想される場合は、プロトコルを変更することができます。過少圧力を避ける最も簡単な方法は、ボトルのヘッドスペースを一晩開いたままにしておくことです。これはまた、O2の部分的なヘッドスペース圧力を低下させることによってDOレベルを緩和するという利点を有する。高いDO濃度は、O2がルビスコの活性を妨げ、酸化ストレスを引き起こす可能性があるため、成長に有害であると考えられている30、31。培養懸濁液が大気25,32と接触した場合でも4倍の過飽和に達することは珍しくない。ヘッドスペースを開くには、ゴム栓にまたがる針からガスラインを外します。夜間の時間は、ガスセンサーの梱包液を補充したり、データ収集にほとんど影響を及ぼさずに連続実験を操作したりするための窓として機能します。例えば、培養密度を変更したり、栄養素をリフレッシュしたり、修正を加えたり、病原体を導入したりすることができる。ボトルは再密封し、ガスセンサーラインを再接続してからライトが再び点灯する必要があります。夜間の閉鎖ヘッドスペースと開放ヘッドスペースの実験から収集された酸素測定値は異なります。
ボトルが密封されたままになると、夜間の酸素消費により、ヘッドスペース内のO2のモル数が減少します。これにより、梱包液がガスセンサーラインを這い上がり、ヘッドスペースの圧力を維持します。ライトが点灯すると、酸素生成が再開されます。流量の読み取りを開始する前に、梱包液をガスセンサーに押し戻す必要があります。したがって、この遅れは夜間の呼吸の程度に比例する。このようにして、ヘッドスペースが閉じたままのとき、O2読み取り値は正味のO2産生(光合成産生−呼吸消費)を表す。逆に、夜間にヘッドスペースが開いていると、ヘッドスペースO2が消費されるものに大気ガスが取って代わり、ガスライン内に充填液が入らない。その結果、呼吸O2消費はO2産生データでは考慮されない。これにより、AFDWバイオマス成長推定値の精度が低下する可能性があります。しかしながら、治療間の成長を比較するための指標として昼間のO2産生を使用することの有用性に影響を及ぼすべきではない。
すべての実験室PBRは同じ制限に悩まされています。人工光は太陽スペクトルを複製することはできません。微細藻類は、光合成のために400〜700nmの光の波長を使用する。この領域は、光合成活性放射線(PAR)33と呼ばれる。太陽光と人工光は、この範囲内で波長の相対的な寄与が異なります。これは、良好な温度と一定の光供給に加えて、実験室の成長データを屋外条件に確実に外挿できないことが多いことを意味します。ただし、これらのPBRは、実験室用PBRライト供給の限界の1つに対処することができます。日光の強度は1日を通して非常に変動し、雲量によって入射PARに一時的な変動が生じます。照明制御ソフトウェアとDMX照明コントローラは、0~2400μmolの光子m-2 s-1以降の光強度を提供できます。光のレジームは、1秒という短い個々の増分に分解することができます。調整可能な光強度により、ユーザーは標準のPBRセットアップよりも屋外の光パターンをより厳密に模倣できます。ここでは、シミュレートされた30分の夜明けと夕暮れの間隔が昼と夜のサイクルを一緒にフェードします(補足表1)。
AFDW密度は増殖の標準的な尺度となっていますが、この方法は、かなりの培養量、2〜3日間の処理期間を必要とし、一度に1つのデータポイントを生成する可能性があります。さらに、条件が悪くなり、細胞が死滅した場合、AFDW密度は、活発に光合成する細胞と分解している細胞とを区別しない。光合成酸素産生の速度を定量化することは、代替成長プロキシとして役立つ。このPBR設計は、培養量を節約しながら、ユーザーの介入をほとんど必要とせずに酸素生産を継続的に記録することができます。データ分解能は、測定セル容積の小さいガスセンサ(例えば、1mL)を選択することによって改善することができる。さらに、培養物がよく混合されている場合、ユーザーは連続的な光学密度測定値のために分光光度計を設置することを決定することができる。媒体の温度制御が必要な場合は、再循環チラーを追加することができます。これらのPBRは、多額の財政的投資なしに微細藻類研究能力を拡大しようとしている研究所にとって貴重な追加です。それらは、 スピルリナのような高アルカリ度、高pH種を扱う人々に特に適しています。これらのPBRは、光レジームの柔軟性を提供し、迅速で複製された実験室の成長比較に有効です。
開示事項
著者らには開示するものは何もありません。
謝辞
この研究は、自然科学・工学研究評議会(NSERC)、カナダイノベーション財団(CFI)、カナダ・ファースト・リサーチ・エクセレンス・ファンド(CFREF)、アルバータ・イノベーツ、ジェネラル・サー・ジョン・モナッシュ財団、アルバータ州政府、カルガリー大学の支援を受けた。電気工事のマーク・トゥーネンと溶解度計算のウィリアム・リチャードソンに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Aluminum channels Imperial: 0.90” x 39.37” Metric: 2.3 cm x 100 cm Quantity: 4 | LED World | AC-AR1-1M | Required as a heat sink |
| Bungee cords, small Quantity: 5 | - | - | To secure bottles |
| Computer - desktop/laptop Quantity: 1 | - | - | - |
| Data Logger, HOBO U30 USB Weather Station Quantity: 1 | HOBO, Hoskin | U30-NRC-VIA-10-S100-000 | Records light sensor information |
| Digital interface module, Rigamo, 4-channel Quantity: 1 | Ritter | N/A | This is to transmit gas sensor data to the computer |
| DMX decoder, 12~24 VDC, DMX-CV-4X5A Quantity: 1 | LITECH, LED World | LT-840-6A | Transmit messages which alter the light pattern |
| DMX lighting controller, SUSHI-RB-RJ Quantity: 1 | Arcolis, Nicolaudie America Inc. | SUSHI-RB-RJ DMX | Encodes the lighting program |
| Gas sensor packing liquid (Silox) Quantity: 1 L | Ritter | https://www.ritter.de/en/data-sheets/silox | |
| Gas sensor, volumetric Quantity: 3 | Ritter | MGC-1 V3.4 PMMA (https://www.ritter.de/downloads/mgc-milligascounter-en) | Measures oxygen production |
| Glass bottles, round 1 L with GL45 neck Quantity: 3 | Corning, Capitol Scientific | 1395-1L | Culture vessels |
| Hardware - end caps for slotted steel Quantity: 10 | Paulin, Home Depot | 142-612 | To cover sharp edges of slotted steel |
| Hardware - eye hooks Quantity: 6 | - | - | To secure bottles |
| Hardware - metal corner braces (large) Imperial: 4" x 4" Metric: 10 cm x 10 cm Quantity: 8 | - | - | Larger brackets to construct metal stand |
| Hardware - metal corner braces (small) Imperial: 2 1/2" x 2 1/2" Metric: 6.4 cm x 6.4 cm Quantity: 6 | - | - | Small brackets to connect bottle platforms to PVC pipe |
| Hardware - metal corner gussets Imperial: 3" x 3" Metric: 7.6 cm x 7.6 cm Quantity: 6 | Paulin, Home Depot | 142-616 | Flat brackets to construct metal stand |
| Hardware - piano hinge Imperial: 36" Metric: 91 cm Quantity: 1 | - | - | Connects two halves of PVC pipe |
| Hardware - rivets Quantity: 40 | - | - | To attach piano hinge to PVC tubing |
| Hardware - set of bolts, nuts, washers Quantity: 60 | - | - | Long thin bolts are required to secure bottle platforms around magentic stirrers |
| Hardware - set of bolts, nuts, washers Quantity: 30 | - | - | Larger shorter bolts are required to build the metal stand |
| LED driver, constant voltage, 96W 24VDC UL Listed IP65 Driver Class 2 regulated power supply Quantity: 1 | Magnitude Lighting, LED World | CVN96L24DC | Regulates power to the lights |
| LED lights, Cinco Bright LED Flex Strip Quantity: 4 m roll | EvenBright, LED World | FA128M57-4M-24V-X | Roll is trimmed into 4 x 1 m lengths and secured inside the PVC tube |
| Light meter, handheld with submersible sperical probe Quantity: 1 | LI-COR | LA-250A | Calibrate the reactors light intensity |
| Light sensors Photosynthetic Light (PAR) Smart Sensor Quantity: 2 | HOBO, Hoskin | S-LIA-M003 | Only one is required however two would be good practice in case one malfunctioned |
| Magnetic stirrers (MIXdrive 1 XS) with external control units and power supply (MIXcontrol eco) Quantity: 3 | 2Mag, 2MAG USA | MF 40300 | Stirrers sit sandwiched in bottle platforms |
| Metal plate Imperial: 24" x 8" Metric: 61 cm x 20.3 cm Quantity: 1 | - | - | This is a surface on which to secure electronics, it is attached to the back of the reactor |
| Pipe, white PVC Imperial: 6" diameter x 42" high Metric: 15.2 cm x 106.7 cm Quantity: 1 | - | - | Cut lengthwise in two halves, used to house lights and bottles |
| Plastic (HDPE) sheets Imperial: 4" x 4" x 1/4" Metric: 10 cm x 10 cm x 1 cm Quantity: 6 | Inventables | 30291-01 | For bottle platforms which house magentic stirrers |
| Rubber stoppers - GL45 size Quantity: 3 | Duran, VWR | 76289-760 | Seals culture vessels |
| Screw caps - with aperture and GL45 neck Quantity: 3 | Corning, Capitol Scientific | 1395-45HTSC | Generates seal of culture vessels |
| Slotted angle steel lengths Imperial: 1-1/2" X 48" x 0.074" Metric: 3.8 cm x 122 cm x 0.19 cm Quantity: 6 | Paulin, Home Depot | 142-202 | Makes up the body of the metal stand |
| Slotted flat steel lenghts Imperial: 1-3/8" x 48" x 0.074" Metric: 3.5 cm x 122 cm x 0.19 cm Quantity: 3 | Paulin, Home Depot | 142-222 | Makes up the body of the metal stand |
| Software - Easy Stand Alone (ESA) | https://www.dmxsoft.com/#apps | AKA LED control software | |
| Software - Rigamo v3.1 | AKA data acquisition software | ||
| Software - Storage Upgrade Tools (SUT) | https://store.dmxsoft.com// | ||
| Stir bar Imperial: 1" x 5/16" Metric: 2.5 cm x 0.8 cm Quantity: 3 | Fisherbrand | 14-513-59 | Stirs culture |
| Switch box Quantity: 1 | - | - | Turns power on/off to reactor |
| Syringe, 10 mL Quantity: Multiple | - | - | Optional if you wish to extract culture |
| Tube adaptor fittings, plastic - Stopcock 1-way Quantity: 6 | Masterflex, Cole Palmer | RK-12023-33 | Close/open culture vessel line |
| Tube adaptor fittings, plastic - variety of male and female luer lock fittings Imperial: to fit 1/16" and 1/8" ID tubing Metric: to fit 1.59 mm and 3.18 mm tubing Quantity: Multiple packets | Masterflex, Cole Palmer | RK-30800-16; RK-30800-18; RK-45518-26; RK-45501-00; RK-45501-04 | Many different combinations can achieve the same end result, best to order a variety of fittings |
| Tube adaptor fittings, plastic - variety of straight connectors Imperial: to fit 1/16" and 1/8" ID tubing Metric: to fit 1.59 mm and 3.18 mm tubing Quantity: Multiple packets | Masterflex, Cole Palmer | RK-40616-04 | Many different combinations can achieve the same end result, best to order a variety of fittings |
| Tubing, flexible, transparent Imperial: ID=1/16", OD=1/8" Metric: ID = 1.59 mm, 0D = 3.18 mm Quantity: 4 m | Masterflex, Cole Palmer | RK-06422-02 | Line from culture vessel to gas sensor |
| Tubing, flexible, transparent Imperial: ID=1/8", OD=1/4" Metric: ID = 3.18 mm, 0D = 6.35 mm Quantity: 2 m | Masterflex, Cole Palmer | RK-06422-05 | Gas sensor standard tubing size |
| Tubing, rigid, transparent Imperial: ID=1/16", OD=1/8" Metric: ID = 1.59 mm, 0D = 3.18 mm Quantiy: 1 m | Masterflex, Cole Palmer | RK-06605-27 | Spans rubber stopper allowing gas to exit |
| Tubing, rigid, transparent Imperial: ID=1/8", OD=1/4" Metric: ID = 3.18 mm, 0D = 6.35 mm Quantity: 1 m | Masterflex, Cole Palmer | RK-06605-30 | Spans rubber stopper allowing gas to exit |
| Zip ties, small Quantity: 1 packet | Secure tube fittings |
参考文献
- Benemann, J. R. . Opportunities and challenges in algae biofuels production. A position paper in line with Algae World. , (2008).
- Laurens, L. M. L. State of technology review - algae bioenergy. An IEA bioenergy inter-task strategic project. IEA Bioenergy. , (2017).
- Robertson, D. E., et al. A new dawn for industrial photosynthesis. Photosynthesis Research. 107, 269-277 (2011).
- Troschl, C., Meixner, K., Drosg, B. Cyanobacterial PHA production-review of recent advances and a summary of three years' working experience running a pilot plant. Bioengineering. 4 (2), (2017).
- Rizwan, M., Mujtaba, G., Memon, S. A., Lee, K., Rashid, N. Exploring the potential of microalgae for new biotechnology applications and beyond: a review. Renewable and Sustainable Energy Reviews. 92, 394-404 (2018).
- Niesa, F., et al. Characterization of Phormidium lacuna strains from the North Sea and the Mediterranean Sea for biotechnological applications. Process Biochemistry. 59, 194-206 (2017).
- Laurens, L. M. L., Chen-Glasser, M., McMillan, J. D. A perspective on renewable bioenergy from photosynthetic algae as feedstock for biofuels and bioproducts. Algal Research. 24, 261-264 (2017).
- Barreiro-Vescovo, S., Barbera, E., Bertucco, A., Sforza, E. Integration of microalgae cultivation in a biogas production process from organic municipal solid waste: From laboratory to pilot scale. ChemEngineering. 4 (2), 26 (2020).
- Zurano, A. S., et al. Year-long assessment of a pilot-scale thin-layer reactor for microalgae wastewater treatment. Variation in the microalgae-bacteria consortium and the impact of environmental conditions. Algal Research. 50, (2020).
- Deprá, M. C., Severo, I. A., Dias, R. R., Zepka, L. Q., Jacob-Lopes, E. Photobioreactor design for microalgae culture. Microalgae. , 35-61 (2021).
- Osburn, F. S., Wagner, N. D., Scott, J. T. Biological stoichiometry and growth dynamics of a diazotrophic cyanobacteria in nitrogen sufficient and deficient conditions. Harmful Algae. 103, (2021).
- Eustance, E., Badvipour, S., Wray, J. T., Sommerfeld, M. R. Biomass productivity of two Scenedesmus strains cultivated semi-continuously in outdoor raceway ponds and flat-panel photobioreactors. Journal of Applied Phycology. 28 (3), 1471-1483 (2016).
- Qiang, H., Richmond, A., Zarmi, Y. Combined effects of light intensity, light-path and culture density on output rate of spirulina platensis (cyanobacteria). European Journal of Phycology. 33 (2), 165-171 (1998).
- Ooms, M. D., Dinh, C. T., Sargent, E. H., Sinton, D. Photon management for augmented photosynthesis. Nature Communications. 7, 1-13 (2016).
- Moheimani, N. R., Borowitzka, M. A., Isdepsky, A., Sing, S. F. Standard methods for measuring growth of algae and their composition. Algae for biofuels and energy. , 265-284 (2013).
- Griffiths, M. J., Garcin, C., van Hille, R. P., Harrison, S. T. L. Interference by pigment in the estimation of microalgal biomass concentration by optical density. Journal of Microbiological Methods. 85 (2), 119-123 (2011).
- Schumann, R., Häubner, N., Klausch, S., Karsten, U. Chlorophyll extraction methods for the quantification of green microalgae colonizing building facades. International Biodeterioration and Biodegradation. 55 (3), 213-222 (2005).
- Pinckney, J. L., Richardson, T. L., Millie, D. F., Paerl, H. W. Application of photopigment biomarkers for quantifying microalgal community composition and in situ growth rates. Organic Geochemistry. 32 (4), 585-595 (2001).
- Van Wychen, S., Laurens, L. M. L. Determination of total solids and ash in algal biomass: laboratory analytical procedure (LAP). National Renewable Energy Laboratory. , (2015).
- Davis, R., Laurens, L. Algal biomass production via open pond algae farm cultivation: 2019 state of technology and future research. National Renewable Energy Laboratory. , (2020).
- Borovkov, A. B., Gudvilovich, I. N., Avsiyan, A. L. Scale-up of Dunaliella salina cultivation: from strain selection to open ponds. Journal of Applied Phycology. 32 (3), 1545-1558 (2020).
- Davies, F. K., et al. Microbiota associated with the large-scale outdoor cultivation of the cyanobacterium Synechococcus sp. PCC 7002. Algal Research. 58, (2021).
- Ataeian, M., et al. Direct capture and conversion of CO2 from air by growing a cyanobacterial consortium at pH up to 11.2. Biotechnology and Bioengineering. 116 (7), 1604-1611 (2019).
- Fu, F., et al. Sustained photosynthesis and oxygen generation of microalgae-embedded silk fibroin hydrogels. ACS Biomaterials Science & Engineering. , (2021).
- Rearte, T. A., et al. Photosynthetic performance of Chlorella vulgaris R117 mass culture is moderated by diurnal oxygen gradients in an outdoor thin layer cascade. Algal Research. 54, (2021).
- Poughon, L., et al. Limnospira indica PCC8005 growth in photobioreactor: model and simulation of the ISS and ground experiments. Life Sciences in Space Research. 25, 53-65 (2020).
- Yen, U. C., Huang, T. C., Yen, T. C. Observation of the circadian photosynthetic rhythm in cyanobacteria with a dissolved-oxygen meter. Plant Science. 166 (4), 949-952 (2004).
- Vermaas, W. F. Photosynthesis and respiration in cyanobacteria. eLS. , (2001).
- Ritter, . MilliGascounter Type MGC-1 Operation Instructions V 3.4. , (2017).
- Sousa, C., De Winter, L., Janssen, M., Vermuë, M. H., Wijffels, R. H. Growth of the microalgae Neochloris oleoabundans at high partial oxygen pressures and sub-saturating light intensity. Bioresource Technology. 104, 565-570 (2012).
- Latifi, A., Ruiz, M., Zhang, C. C. Oxidative stress in cyanobacteria. FEMS microbiology reviews. 33 (2), 258-278 (2009).
- Morillas-España, A., Lafarga, T., Gómez-Serrano, C., Acién-Fernández, F. G., González-López, C. V. Year-long production of Scenedesmus almeriensis in pilot-scale raceway and thin-layer cascade photobioreactors. Algal Research. 51, (2020).
- Melis, A. Solar energy conversion efficiencies in photosynthesis: minimizing the chlorophyll antennae to maximize efficiency. Plant Science. 177 (4), 272-280 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved