Method Article
Fonctionnement de photobioréacteurs de laboratoire avec mesures de croissance en ligne et régimes de lumière personnalisables
Dans cet article
Résumé
Cette publication décrit la conception de photobioréacteurs de laboratoire (PBR) avec des régimes lumineux personnalisables. La croissance des cyanobactéries ou des microalgues, utilisant le bicarbonate comme source de carbone, est surveillée en permanence en mesurant la production volumétrique d’oxygène. Ces PBR facilitent des comparaisons rapides et répliquées de la croissance en laboratoire avec peu d’intervention de l’utilisateur pendant les expériences.
Résumé
L’étude en laboratoire des microalgues peut être expérimentalement difficile. En plus des exigences de culture des micro-organismes non photosynthétiques, les phototrophes nécessitent également un éclairage. Régulièrement, les chercheurs cherchent à fournir des fournitures lumineuses personnalisées, c’est-à-dire à faire varier l’intensité lumineuse et le temps pendant lequel elles sont livrées. Une telle flexibilité est difficile avec les lampes de paillasse standard. Habituellement, les études de culture nécessitent également des comparaisons de croissance entre les traitements expérimentaux. Souvent, la croissance est évaluée sur une durée prolongée, par exemple, plusieurs fois par jour au cours d’un essai d’une semaine. Les mesures manuelles peuvent prendre beaucoup de temps et manquer de résolution des données. Par conséquent, les photobioréacteurs (PBR) avec surveillance automatique de la croissance et alimentation lumineuse personnalisable sont utiles pour les expériences répliquées avec plusieurs traitements. Les travaux actuels présentent la conception, la construction et l’exploitation des PBR de laboratoire. Les matériaux sont faciles à trouver et relativement peu coûteux. La conception pourrait être dupliquée avec une habileté modérée. Chaque structure a une empreinte d’environ 40 cm2 et accueille trois bouteilles en verre de 1 L pour une réplication en triple. Les bouteilles reposent sur des plates-formes contenant des agitateurs magnétiques et sont disposées verticalement dans un tuyau en polychlorure de vinyle (PVC) de 1 m de haut et de 15 cm de diamètre. L’intérieur du tuyau est recouvert de diodes électroluminescentes (LED). Ces LED produisent des intensités lumineuses continues à partir de photons m-2400 μmol m-2 s-1 de rayonnement photosynthétiquement actif (PAR). Les utilisateurs conçoivent un programme d’éclairage personnalisé. L’intensité lumineuse peut être ajustée chaque seconde ou maintenue constante pendant de plus longues durées. L’oxygène produit par la photosynthèse sort de chaque bouteille via un capteur de gaz volumétrique unidirectionnel. Un logiciel est utilisé pour enregistrer les données des capteurs de gaz. La quantité d’oxygène produite peut être corrélée à la croissance de la biomasse. Si des échantillons de biomasse sont nécessaires, une seringue peut être utilisée pour extraire la culture. La méthode est adaptée aux microalgues cultivées avec du bicarbonate comme source de carbone. Ces PBR sont précieux pour un laboratoire qui a besoin d’expériences répliquées, d’une flexibilité du régime de lumière et de données de croissance continues à haute résolution.
Introduction
Les microalgues et les cyanobactéries, collectivement appelées microalgues pour plus de simplicité, sont défendues pour leur potentiel dans la biotechnologie durable. Ils sont des candidats attrayants en raison de leur croissance rapide, de leur capacité à être cultivés sur des terres non arables et de leur utilisation de la lumière du soleil pour stimuler la conversion du dioxyde de carbone en biomasse 1,2,3. La biomasse de microalgues peut être convertie en produits tels que la bioénergie sous forme de pétrole ou de gaz, de colorants alimentaires et de suppléments nutritionnels, et en matériaux tels que les biopolymères 1,4,5,6,7. De plus, ils peuvent être utilisés pour traiter les eaux usées ou assainir les plans d’eau en consommant l’excès de nutriments 8,9. Compte tenu de cela, la recherche sur les microalgues est répandue et établie. Le domaine se développe à mesure que la société reconsidère l’intensité en carbone et la durabilité environnementale des approches actuelles de fabrication et de production d’énergie.
Trois exigences fondamentales des études de microalgues en laboratoire sont un récipient de culture, une source de lumière et une méthode pour quantifier la croissance. Le terme photobioréacteur (PBR) décrit une configuration dans laquelle les récipients de culture sont éclairés10. Généralement, les études sur les microalgues visent à comparer la croissance entre deux traitements ou plus, par exemple différents milieux de croissance, régimes de lumière ou espèces 11,12,13. Pour des raisons statistiques, chaque condition, par exemple le traitement et le contrôle, doit être reproduite. Si le contrôle et le traitement sont exécutés simultanément, cela signifie que de nombreux PBR doivent être surveillés et échantillonnés pendant toute la durée d’une expérience. Le défi lié à l’utilisation de plusieurs PBR est double. Tout d’abord, fournir une intensité lumineuse uniforme à chaque PBR est essentiel pour la reproductibilité, mais peut être difficile. La quantité de lumière incidente à la surface du navire est influencée par sa distance par rapport à la source lumineuse, l’ombrage des navires adjacents et les fluctuations de la lumière de fond14. Deuxièmement, il faut choisir une méthode pour quantifier avec précision la croissance.
La croissance est généralement mesurée par le nombre de cellules, la densité optique (OD), la teneur en chlorophylle A, la densité du poids sec (DW) et la densité du poids sec sans cendres (AFDW)15. Le nombre de cellules, la teneur en chlorophylle A et les méthodes gravimétriques sont des processus manuels qui produisent des points de données discrets. La DO peut être mesurée en continu et de manière non invasive avec un spectrophotomètre, à condition qu’elle soit bien calibrée par rapport à une autre méthode telle que la densité AFDW15. Cependant, les mesures de LA OD et la teneur en chlorophylle A peuvent ne pas être fiables, car les résultats varient selon les conditions de culture, par exemple entre les espèces et tout au long du cyclede croissance 15,16. Pour la chlorophylle A, la méthode d’extraction peut également avoir un impact sur le rendement enpigments 17. La teneur en chlorophylle A est particulièrement utile pour suivre la croissance des microalgues au sein des communautés microbiennes qui contiennent également des organismes non photosynthétiques17,18. Lors du choix d’une méthode pour déterminer la croissance, il est essentiel de prendre en compte la morphologie de la suspension. Lorsque les organismes s’agglutinent et ne sont pas bien mélangés, le NOMBRE de DO et de cellules n’est pas possible15. Une seule méthode n’est pas adaptée à toutes les applications expérimentales – les chercheurs doivent décider quelles méthodes sont pratiques et pertinentes pour leurs objectifs expérimentaux.
L’AFDW est une méthode fiable qui permet de comparer la croissance entre diverses conditions de culture, notamment entre les espèces et les milieux de culture 15,19,20. Pour calculer l’AFDW, un échantillon de culture de microalgues est d’abord concentré, soit par filtration, soit par centrifugation, puis séché. À ce stade, le DW peut être déterminé. Habituellement, l’échantillon de DW contient au moins 8 à 10% de cendres et de matières inorganiques telles que des sels et des particules15. DW suit les tendances de croissance, mais peut être faussé si la contribution des inorganiques varie. Pour déterminer la densité AFDW, la biomasse sèche est brûlée à haute température; cela vaporise la partie organique ou utile tout en laissant des cendres (inorganiques) derrière19. Pour calculer l’AFDW, le poids de la fraction de cendres est soustrait de celui de la fraction DW. En règle générale, dans les suspensions de microalgues, l’AFDW varie de 0,1 à 3 g/L 12,21,22. De petits volumes de suspensions diluées produisent peu de biomasse sèche, <10 mg. Après combustion, les cendres ne peuvent peser que 1 mg. Par conséquent, selon la densité de culture, cette méthode nécessite des volumes compris entre 5 et 100 mL et des échelles analytiques précises à 0,1 mg 12,15,19,22. Les PBR de laboratoire sont généralement petits, quelques litres au maximum, donc chaque échantillon liquide épuise le volume de culture. De plus, la méthode AFDW est manuelle et prend 2 à 3 jours. Pour les expériences répliquées et répétitives, un processus automatisé et continu est préférable.
Pour les microalgues qui utilisent le bicarbonate comme source de carbone, deux mesures de croissance supplémentaires peuvent être mesurées en continu. La photosynthèse consomme du bicarbonate et produit de l’oxygène. La consommation de bicarbonate fait augmenter le pH moyende 23. Une sonde de pH immergée peut mesurer ce changement. La production d’oxygène photosynthétique augmente la concentration d’oxygène dissous (OD) du milieu jusqu’à ce que le milieu soit saturé. Au-delà de la saturation, l’oxygène existe sous forme de bulles. La production d’oxygène est mesurée par de nombreuses techniques différentes: les sondes mesurent la concentration en OD, les dispositifs manométriques évaluent la pression de l’espace de tête, la chromatographie en phase gazeuse mesure la composition de l’espace de tête et les capteurs volumétriques enregistrent le débit de gaz 24,25,26,27. Lorsque l’oxygène est utilisé comme indicateur de croissance, les récipients de culture doivent être entièrement scellés ou ne permettre que l’écoulement de gaz. Pour les mesures de pH et d’oxygène, le carbone doit être fourni sous forme de bicarbonate, et non par épandage de CO2. Le dosage du CO2 diminue le pH du milieude 23 et, en tant que gaz, peut perturber les mesures d’oxygène. L’un des avantages du pH et de l’oxygène par rapport à la densité optique est que la méthode n’est pas compromise si les microalgues forment des amas. Bien qu’indirects, le pH et l’oxygène sont efficaces pour comparer la croissance entre les traitements.
Les PBR utilisés aujourd’hui sont plus complexes. Les laboratoires peuvent utiliser de simples flacons de paillasse, des prototypes personnalisés ou des produits disponibles dans le commerce. Pour les groupes de recherche qui cherchent à mettre à niveau à partir de flacons, le coût des PBR commerciaux ou les compétences techniques et la fabrication de pièces nécessaires à la construction de nombreux prototypes peuvent constituer un obstacle. Ce manuscrit vise à décrire la conception, la construction et l’exploitation étape par étape des PBR de laboratoire qui comblent cette lacune. Ces PBR ont un régime lumineux personnalisable et surveillent la croissance en continu en enregistrant la production volumétrique d’oxygène. Cette conception abrite trois récipients de culture pour une réplication en trois exemplaires et peut être construite avec une habileté modérée et des matériaux facilement accessibles. Ce PBR est un ajout précieux à un laboratoire qui cherche à étendre sa capacité de recherche sur les microalgues sans investir dans des produits très techniques ou coûteux. Lorsqu’ils choisissent d’acquérir ou de construire un PBR, les chercheurs doivent tenir compte de l’adéquation d’une conception à leurs conditions de culture, à leur situation financière et à leurs questions de recherche.
Protocole
1. Construction du stand PBR
- À l’aide d’une scie à métaux portative, coupez cinq longueurs de 380 mm et deux longueurs de 200 mm d’acier fendu incliné. Fixez-les ensemble à l’aide de boulons et de grandes entretoises d’angle pour former la base d’un support (Figure 1A). Coller sur les embouts de sécurité.
- Connectez deux longueurs verticales non coupées (1220 mm) d’acier fendu incliné à la base. Fixez-les à l’aide de boulons et de soufflets d’angle métalliques (Figure 1B). Coller sur les embouts de sécurité.
- Découpez quatre longueurs plates de 65 mm d’acier fendu. Boulonnez-les à des angles de 90° sur les supports verticaux : fixez-en deux à chaque support, un à 130 mm de la base (Figure 1C) et un à 60 mm du haut.
- Fixez les supports verticaux sur leur dessus avec une longueur horizontale de 140 mm d’acier plat fendu (traverse) boulonné à l’arrière du cadre (Figure 2A).
2. Construction de la chambre lumineuse
- Coupez un tuyau blanc en polychlorure de vinyle (PVC) de 153 mm de diamètre à une longueur de 1070 mm. Coupez le tuyau en deux dans le sens de la longueur avec une scie à ruban. Poncez tous les bords.
- Espacez uniformément et centrez quatre canaux de dissipateur de chaleur en aluminium verticalement avec l’intérieur du tuyau. Ne fixez pas de canaux à moins de 20 mm du bord coupé du tuyau. À l’aide de petits boulons, fixez les canaux en place en haut et en bas (Figure 2B).
- Boulonnez la moitié du tuyau au support à l’aide des supports horizontaux façonnés à l’étape 1.3.
- Posez le réacteur et réunissez les moitiés du tuyau en les collant ensemble. Centrez la charnière du piano le long d’une ligne de coupe. Tracez les trous de charnière et percez le tuyau en conséquence. Utilisez un pistolet à rivet et des rivets de longueur moyenne pour fixer la charnière au tuyau.
- Utilisez un petit cordon élastique (voir Tableau des matériaux) pour maintenir le tuyau fermé (Figure 1C).
- Consultez un électricien pour brancher les lumières LED et installer les quatre composants suivants : pilote LED, décodeur multiplex numérique (DMX), contrôleur d’éclairage DMX et boîtier de commutation (voir tableau des matériaux). Fixez tous les composants à l’arrière du PBR conformément à la Figure 2A.
3. Construction des plates-formes de bouteilles
- Découpez des formes de plate-forme (figure 3A) en plastique dur, par exemple en polyéthylène haute densité (PEHD) (voir tableau des matériaux), à l’aide d’un fraisage à commande numérique par ordinateur (CNC). Faites trois de chaque forme.
REMARQUE: Il est recommandé de couper les couches supérieure et inférieure de rechange. - Collez les couches inférieure et supérieure ensemble. Marquez et percez cinq petits trous de 6 mm de diamètre à travers les deux formes (Figure 3A). À l’aide d’un foret plus grand, élargissez soigneusement la surface de ces trous afin que les têtes de boulon puissent être encastrées (Figure 3B).
- Pour chacune des trois plates-formes, boulonnez deux petites entretoises d’angle à la moitié arrière du tuyau.
REMARQUE: La distance entre le haut des accolades doit être de 350 mm. - Centrez chaque couche inférieure sur le dessus de ses accolades. Marquez l’emplacement des trous de forage sous les accolades. Percez deux trous de 6 mm de diamètre. À l’aide d’un foret plus grand, élargissez soigneusement la surface des trous afin que les boulons puissent être encastrés.
- Boulonnez les couches inférieures à leurs accolades (Figure 3B–C).
- Couper quinze pièces de tubes rigides de 12 mm de long et de 6,35 mm de diamètre extérieur (OD). Sandwich cinq morceaux du tube rigide entre chaque couche supérieure et inférieure. Fixez les couches et les tubes avec de longs boulons étroits conformément à la figure 3B–D.
- Percez un grand trou dans le tuyau en PVC derrière chaque plate-forme. Insérez chaque micro agitateur magnétique dans sa plate-forme. Enfilez le câble électrique de chaque agitateur à travers ces trous nouvellement coupés (Figure 3C–E). Connectez chaque agitateur à son unité de commande respective ainsi qu’à une prise de courant.
- Placez une bouteille de 1 L sur chaque plate-forme. Ajouter des boulons oculaires dans le tuyau arrière au niveau du goulot de la bouteille. Enroulez un petit cordon élastique autour de chaque goulot d’étranglement pour ajouter de la stabilité (Figure 4A).
REMARQUE: Tout au long du protocole, des plates-formes de codage couleur, des bouteilles, des agitateurs magnétiques et tous les câbles et capteurs associés seront utiles.
4. Construction des orifices d’échantillonnage liquide (facultatif)
- Couper trois longueurs de 60 mm de tubes rigides OD de 6,35 mm. À l’aide d’un foret de 5 mm, percez des trous à travers chaque bouchon en caoutchouc. Poussez les longueurs de tube rigides à travers le bouchon.
- Couper trois longueurs de 60 mm de tubes rigides OD de 3,18 mm. Connectez-les avec un réducteur droit au tube saillant sur la face inférieure de chaque bouchon.
- Insérez une vanne de robinet d’arrêt unidirectionnelle (p. ex., orifice 1 = Luer femelle, orifice 2 = Luer mâle) dans le tube saillant sur chaque surface de bouchon (Figure 4A).
- Découpez trois longueurs de 30 mm de tubes flexibles OD de 3,18 mm. Insérez des raccords Luer (par exemple, Luer mâle à la barbe du tuyau et Luer femelle à la barbe du tuyau) à chaque extrémité.
- Reliez les pièces fabriquées à l’étape 4.4 aux vannes du robinet d’arrêt à la surface de chaque bouchon en caoutchouc (Figure 4A).
REMARQUE: De nombreuses combinaisons de robinets d’arrêt et de raccords Luer peuvent produire le même résultat. La conception doit permettre d’extraire ou d’insérer du liquide à l’aide d’une seringue.
5. Connexion des capteurs de gaz volumétriques
- Préparez les capteurs de gaz conformément aux instructions du fabricant.
REMARQUE: Il s’agit principalement de remplir des capteurs de gaz avec du liquide d’emballage (Figure 4B). - Pour fabriquer les conduites de gaz, coupez trois longueurs de 1000 mm de tubes flexibles de 3,18 mm OD.
- Percez trois trous de 4 mm de diamètre dans le tuyau arrière en PVC. Placez les trous à côté de la charnière à la hauteur du goulot d’étranglement. Filetage des conduites de gaz à travers ces trous (Figure 4A).
- À l’extrémité de la conduite de gaz à l’intérieur du tuyau en PVC, ajoutez un raccord Luer (par exemple, une barbe de tuyau à Luer mâle) et connectez une vanne d’arrêt unidirectionnelle (par exemple, port 1 = Luer femelle, port 2 = Luer mâle).
REMARQUE: La vanne n’est requise que lorsque des orifices d’échantillonnage de liquide sont également installés. - Reliez l’autre extrémité de la conduite de gaz à l’orifice d’entrée du capteur de gaz à l’aide d’un réducteur droit. Sécurisez cette connexion avec une attache zippée.
- Connectez tous les capteurs de gaz au module d’entrée numérique (DIM) à l’aide de câbles jack et le DIM à un ordinateur à proximité.
- Installez le logiciel d’acquisition de données (voir Tableau des matériaux) sur un système d’exploitation Windows et branchez le dongle de clé de licence. Ajoutez les fichiers d’étalonnage du capteur au répertoire d’étalonnage du logiciel.
6. Programmation du régime lumineux
- À l’aide de l’interrupteur marche/arrêt arrière, allumez le PBR et connectez le contrôleur d’éclairage DMX à un ordinateur via un câble micro-USB.
- Téléchargez Store Upgrade Tools (SUT) et le logiciel de contrôle LED (voir Tableau des matériaux). Enregistrez le contrôleur d’éclairage DMX en ligne.
- Ouvrez le logiciel de contrôle LED et sélectionnez Cliquez ici pour travailler avec l’interface USB-DMX : SUSHI-RB-RJ.
- Sous l’onglet Configuration de la zone ScanLibrary , sélectionnez le dossier Générique et Canal unique. Définissez les paramètres de ScanLibrary sur l’univers DMX 1, le nombre de luminaires sur 4 et le numéro d’index sur 1. Dans le coin supérieur droit, remplacez la liste déroulante par Affichage de liste. Enfin, cliquez sur Patch (Figure supplémentaire 1).
REMARQUE: Dans l’univers DMX, une boîte teste le contrôle de chaque bande LED en faisant glisser les boutons du gradateur ou en entrant une valeur numérique dans la zone de texte. - Créez une courbe standard qui relie le réglage de la lumière numérique dans le logiciel de contrôle de l’éclairage à l’intensité lumineuse ressentie au centre du tube en PVC (Figure 5). Mesurez l’intensité lumineuse interne avec une petite sonde sphérique (voir Tableau des matériaux) suspendue au centre du tuyau en PVC.
- Passez à l’onglet Éditeur . Pour créer un programme d’éclairage personnalisé, créez une nouvelle scène et commencez à ajouter des étapes. Reportez-vous au tableau supplémentaire 1 pour un exemple de programme diurne de 16:8 h. Réglez la scène en boucle.
REMARQUE: Les étapes décomposent les scènes en blocs de temps, chacun pouvant être réglé sur une intensité lumineuse différente. Les étapes vont de 1 s à 43 min. Ici, les étapes de 30 minutes sont les plus pratiques. Plusieurs scènes peuvent être chargées sur un seul contrôleur d’éclairage DMX. - Créez une scène d’assistance supplémentaire immédiatement reconnaissable, par exemple deux des quatre voyants allumés.
REMARQUE: Les scènes peuvent être parcourues manuellement à l’aide du bouton sur le côté du contrôleur d’éclairage DMX. Si le programme de lumière souhaité commence pendant la nuit, il sera impossible de distinguer si le programme d’éclairage a déjà commencé. La scène d’assistance sert d’indicateur que le contrôleur d’éclairage DMX fonctionne correctement. - Enregistrez les scènes et passez à l’onglet Autonome . Écrivez la mémoire du contrôleur d’éclairage DMX et déconnectez le périphérique de l’ordinateur.
- Connectez le contrôleur d’éclairage DMX à sa source d’alimentation à l’aide d’un micro-USB.
- Avant de commencer une expérience, testez le programme d’éclairage en enregistrant l’intensité lumineuse interne pendant une durée de 24 heures. Si la température du liquide est intéressante, enregistrez-la simultanément avec une sonde de température immergée (Figure 6).
7. Démarrage d’une expérience
- Stérilisez les supports, les bouteilles, les barres d’agitation, les bouchons en caoutchouc, les orifices d’échantillonnage, les bouchons à vis à ouverture filetée et les tubes.
REMARQUE: Tous les composants utilisés dans cette conception sont autoclavables, à l’exception des vannes et des raccords Luer - il existe des alternatives autoclavables d’autres fabricants. - Ouvrez le logiciel d’acquisition de données et remplissez la page de configuration (Figure supplémentaire 2). Attribuez des fichiers d’étalonnage à leurs capteurs respectifs.
- Sous Nom du fichier du répertoire, sélectionnez le dossier de numéro de port DIM correspondant. Cliquez sur Dossier actuel et répétez l’opération pour tous les ports.
- Cliquez sur OK pour passer à la page de journalisation.
- Remplir les bouteilles au volume souhaité avec le milieu de culture (tableaux supplémentaires 2,3).
REMARQUE: Chacune de ces bouteilles contiendra un maximum de ~ 1,1 L avec un petit espace de tête (~ 80 mL, y compris la conduite de gaz). - Centrifuger la culture mère dans trois tubes équilibrés de 50 mL pendant 15 min à 4500 x g pour obtenir trois pastilles. Ajouter une pastille à chaque bouteille – laver les granulés avec une pipette sérologique et un milieu frais.
REMARQUE: La densité de culture du jour 0 est également connue sous le nom de concentration initiale de biomasse (GRV). Mesurer le GRV en gAFDW. L-1, un tube supplémentaire de 50 mL peut être centrifugé à l’étape 7.6. La pastille résultante peut ensuite être séchée et brûlée15,19. L’étape 7.6 nécessitera probablement des modifications en fonction des objectifs individuels des utilisateurs et de leurs expériences. - Déposer un agitateur magnétique, 25 x 8 mm, dans chaque bouteille.
- Scellez chaque ouverture de bouteille à l’aide d’un bouchon en caoutchouc et d’un bouchon à vis d’ouverture fileté (Figure 4A). Si des orifices d’échantillonnage optionnels sont installés, fermez les vannes.
- Localisez l’extrémité de chaque conduite de gaz à l’intérieur du tuyau en PVC (intégré à l’étape 5.4) et fixez une aiguille à l’orifice Luer mâle de la vanne.
- Connectez chaque bouteille à son capteur de gaz en perçant chaque bouchon en caoutchouc avec l’aiguille correspondante.
- Lancez chaque capteur de gaz individuellement en cochant la case sur le côté gauche de l’écran, en cliquant sur Démarrer et en entrant un nom de fichier. Cliquez sur OK et répétez l’opération pour tous les capteurs (Figure supplémentaire 3).
REMARQUE : Lors de la journalisation, ne quittez pas la fenêtre d’acquisition de données. Réglez les paramètres d’alimentation et de veille de l’ordinateur pour qu’ils ne jamais et reportez les mises à jour de l’ordinateur pendant toute la durée de l’expérience. - Allumez le PBR et assurez-vous que le contrôleur d’éclairage DMX est branché sur une alimentation. La première scène programmée commencera automatiquement. Reportez-vous à l’étape 6.7 pour vérifier que le contrôleur d’éclairage DMX fonctionne correctement.
8. Échantillonnage des bouteilles (facultatif)
- Préparer 500 ml supplémentaires du milieu frais avant de commencer l’expérience (tableau supplémentaire 2).
REMARQUE : Si un programme d’éclairage de 24 h avec un cycle diurne de 16 h 8 h commençait à 9 h, les temps d’échantillonnage avant le crépuscule et l’aube tomberaient à 8 h et à 16 h (tableau supplémentaire 1). Ici, l’aube et le crépuscule se réfèrent à des étapes de 30 minutes qui font passer les lumières de ON à OFF et vice versa. - Fermez la vanne sur la conduite de gaz.
- Connectez une seringue (10 mL) à la vanne de l’orifice d’échantillonnage (Figure 4A).
- Ouvrez la vanne de l’orifice d’échantillonnage et retirez 8 mL de culture.
REMARQUE: Entre 5 et 10 mL est recommandé. L’élimination du liquide génère un vide dans l’espace de tête, ce qui rend les volumes >10 mL difficiles à extraire. - Fermez la vanne de l’orifice d’échantillonnage et débranchez la seringue.
- Raccorder une seringue contenant 8 mL de milieu frais (à partir de l’étape 8.1) à la vanne de l’orifice d’échantillonnage.
- Ouvrez la vanne de l’orifice d’échantillonnage et injectez du milieu frais.
REMARQUE : Le remplacement du volume de culture échantillonnée par un milieu frais permet de maintenir un volume et une pression égaux dans l’espace de tête et de rincer la ligne du port d’échantillonnage. - Fermez la vanne de l’orifice d’échantillonnage avant de déconnecter la seringue.
- Répétez les étapes 8.2 à 8.8 à chaque moment d’échantillonnage.
9. Mettre fin à une expérience
- Cochez toutes les cases à cocher du port actif dans la fenêtre d’acquisition de données et cliquez sur Arrêter.
- Pour exporter des données, sélectionnez Fichier et Données hors connexion. Sélectionnez tous les fichiers journaux pertinents. Exportez les données vers un tableur et enregistrez-les.
- Pour chaque bouteille, convertissez le volume total d’oxygène mesuré en mL en moles en utilisant la loi du gaz idéal. Prédire le poids de la biomasse cultivée (gAFDW) si 1,05 moled’O2 est générée pour chaque mole de biomasse produite. Prenez le poids molaire de la biomasse comme 24,6 g mol-1.
- Organisez manuellement les données de débit. Utilisez des unités de mL/h et une moyenne mobile à 3 points.
Résultats
Ici, le débit d’oxygène est une mesure du taux photosynthétique de la culture. Des taux plus élevés de photosynthèse, et donc de fixation du carbone, se traduisent par des taux de croissance plus élevés. Cela signifie que l’utilisateur peut comparer les débits d’oxygène entre différents traitements et jours opérationnels comme indicateur de croissance. En bref, le capteur de gaz fonctionne en piégeant et en libérant des bulles de gaz dans une cellule de mesure à double chambre (Figure 4B). Les bulles de gaz de l’entrée à la base du capteur remontent à travers le liquide d’emballage. Les bulles s’accumulent dans une chambre de la cellule de mesure pour un volume d’environ 3,2 mL. Une fois ce seuil atteint, les extrémités de la cellule de mesure. Cela libère le gaz et réinitialise le système. Chaque pointe est enregistrée par le logiciel d’acquisition de données.
Dans les données d’exemple, le taux de croissance de trois traitements avec des intensités lumineuses diurnes et des concentrations initiales de biomasse (GRV) variables a été comparé. Ces traitements ont été choisis arbitrairement à des fins démonstratives. Il s’agissait de (A)photons de 300 μmol m-2 s-1 et 0,03 gAFDW L-1, (B)photons de 600 μmol m-2 s-1 et 0,13 gAFDW L-1, et (C) dephotons de 600 μmol m-2 s-1 et 0,40 g AFDW L-1. Ces irradiances ont été mesurées à l’aide d’une sonde sphérique au centre du tuyau en PVC avant que les bouteilles ne soient placées sur les plates-formes. La profondeur et la densité de la culture affectent l’atténuation de la lumière. Par conséquent, l’intensité lumineuse réelle ressentie par les microalgues peut varier de celles rapportées. Chaque traitement a été effectué en trois exemplaires, dans un PBR contenant trois bouteilles.
Ici, une expérience réussie a été caractérisée par des modèles diurnes de production de gaz étroitement répliqués (Figure 7A-C). Pendant les heures éclairées (jour), la production de gaz augmentait régulièrement et, au cours des heures non éclairées (nuit), la production de gaz s’arrêtait (figure 7A–C). Deux gaz sont produits par les microalgues, l’oxygène de la photosynthèse et le dioxyde de carbone de la respiration28. La photosynthèse est limitée aux heures éclairées, tandis que la respiration se produit en continu mais est plus active la nuit28. La photosynthèse se développe, tandis que la respiration catalyse la biomasse28. Initialement, la composition du gaz de l’espace de tête est identique à celle de l’atmosphère. À chaque retournement de la cellule de mesure, O2 déplace le gaz atmosphérique. Par conséquent, les lectures des capteurs de gaz ont été attribuées à la production d’O2 même si le gaz sortant n’était pas purO2. La pression minimale d’entrée de gaz pour le capteur de gaz est extrêmement faible, 8–9 mbar, ce qui rend la pression de l’espace de tête de la bouteille légèrement supérieure à l’atmosphère (1,01 bar au niveau de la mer). Par conséquent, les lectures des capteurs de gaz commencent peu de temps après que les bulles o2 aient quitté le milieu.
Le CO2 libéré par la respiration ne contribue pas aux lectures des capteurs de gaz pour deux raisons. Tout d’abord, dans le milieu alcalin, le CO2 réagit au bicarbonate, diminuant le pH (Figure 8). Deuxièmement, si le CO2 s’échappe, le liquide d’emballage du capteur de gaz, Silox, dissout les bulles de CO2 avant qu’elles ne puissent atteindre la cellule de mesure, dégazantle CO 2 à la surface du liquide29. Ceci est soutenu par l’absence de lectures de capteur de gaz pendant la nuit. Ceux qui se sont produits ont été enregistrés peu de temps après l’extinction des lumières, ce qui indique que les lectures représentaient une libération résiduelle d’oxygène pendant la journée (figure 7).
Dans la configuration expérimentale (utilisant des données locales de température et de pression), un espace de tête de 80 mL à pression ambiante nécessitait 340 mL d’O2 exsolvé pour établir une pression partielle d’O2 de 99%. Ici, le volume total d’oxygène produit sur 4 jours variait de 316 (SEM ± 11) mL dans le traitement A à 902 (SEM ± 51) mL dans le traitement C (tableau 1). Par conséquent, à la fin de l’expérience, l’espace de tête de toutes les bouteilles aurait contenu principalement de l’O2. L’augmentation de la concentration d’espace de têteO2, et donc la diminution de la concentration deN2, aurait eu un impact sur la pression partielle et la saturation de ces gaz. Avec un espace de tête O2 de 99 %, une augmentation de 5 fois de l’OD a été calculée. Pour les cultures de 1,1 L, cela s’est traduit par 23 mL supplémentaires de DO. Inversement, on a estimé que le passage à un espace de tête de 1 % de N2 aurait entraîné l’exsolvtion de 15 mL deN2. Cela signifie que sous un espace de tête d’oxygène presque pur, plus d’O2 dissous que deN2 a été déplacé. Ainsi, comme il reste plus d’O2 dans le milieu, cet effet aurait conduit à de légères sous-estimations de la quantité d’oxygène photosynthétique produite.
Le principal défi de cette méthode est apparu lorsque les cultures sont devenues denses. Avec plus de biomasse, et donc plus de respiration, la demande d’O2 a augmenté. La consommation nocturne d’O2 a généré un espace de tête sous pression. Cela a provoqué le déplacement du liquide d’emballage du capteur de gaz à travers la conduite de gaz. Lorsquela production d’O 2 a repris, le liquide d’emballage a dû être renvoyé dans les capteurs de gaz. Cela a provoqué un retard dans la première lecture du capteur de gaz. Cependant, la quatrième nuit, l’ampleur de cette sous-pression a provoqué l’atteinte et l’égouttement du liquide d’emballage dans deux des trois répliques du traitement B, générant une nappe de pétrole de surface. En raison du niveau réduit de liquide d’emballage, les capteurs de gaz ont court-circuité, libérant del’O2 non mesuré directement dans l’atmosphère. Cela a entraîné la collecte de données à plat (Figure 7B).
La sous-pression peut également être causée par une contraction induite par la température du volume de l’espace de tête. Cependant, l’effet ici était minime. Les canaux de dissipateur de chaleur et le flux d’air ont dissipé adéquatement l’excès de chaleur. Parmi les deux régimes d’éclairage testés, le changement de température maximal a réduit le volume de l’espace de tête de 1 % ou moins, ce qui équivaut à un déplacement de liquide d’emballage de 800 μL dans un espace de tête de 80 mL. La variation de température diurne maximale était de 1,4 °C pour lesrégimes m-2 s-1 de photons de 300 μmol (figure 6) et de 3,2 °C pour lesrégimes de photons m-2 s-1 de 600 μmol. L’augmentation moyenne de la température diurne pour les régimes m-2 s-1 dephotons de 300 et 600 μmol était de 0,7 et 1,8 °C, respectivement. Les températures de culture sont revenues au niveau de référence pendant la nuit (figure 6).
Les données sur le taux de croissance à haute résolution peuvent révéler des tendances qui, autrement, pourraient passer inaperçues. Envisagez les traitements B et C. Malgré leurs GRV différents, les deux ont généré la même quantité de biomasse totale (gAFDW), ce qui a provoqué un changement identique du pH moyen (tableau 1). Compte tenu uniquement des points de données de départ et de fin d’études, un individu peut à juste titre supposer qu’il n’y a pas de différence dans le taux de croissance moyen entre les deux traitements (tableau 1). Cependant, les données en ligne sur le débit d’oxygène ont révélé que chaque traitement avait des taux de croissance quotidiens variables. Ces variations ont également été reflétées dans les mesures de pH deux fois par jour (figure 8). Le premier jour, le taux de croissance du traitement B était inférieur à celui du traitement C. Au troisième jour, cela s’est inversé, le taux de croissance du traitement B dépassant celui du traitement C (figure 7B, C). Les données sur le débit d’oxygène indiquent que le taux de croissance le plus élevé s’est produit le troisième jour du traitement B (figure 7B).
Le volume total d’oxygène généré par chaque bouteille dans les trois traitements a été utilisé pour estimer leur variation respective de la biomasse totale (gAFDW). Ceci a été réalisé en utilisant une équation générique pour la synthèse de la biomasse photosynthétique: CO2 + 0,2 NH3 + 0,6 H2O = CH1,8 O0,5 N0,2 + 1,05 O2. L’augmentation de la pression partielle de l’espace de têteO2 et l’augmentation subséquente de la saturation en OD devraient entraîner une légère sous-estimation de la croissance de la biomasse. Cela était vrai pour cinq exemples sur sept (tableau 2). En moyenne, la croissance estimée de la biomasse se situait à moins de 10 % de la croissance mesurée de la biomasse. Certaines estimations ne différaient que de 1 à 3 mg de la croissance mesurée. Deux exemples ont surestimé la croissance, c’est-à-dire que plus d’oxygène a été produit que la croissance de la biomasse ne pouvait en représenter. ToutO2 consommé par la respiration pendant la nuit doit être reflété dans le décalage dans la production d’O2 le lendemain. Ici, les expériences ont été terminées à la fin de la nuit. De cette façon, le catabolisme de la biomasse pendant la nuit pendant les 8 dernières heures de chaque expérience n’est pas mesuré. Cela peut entraîner des surestimations de la croissance de la biomasse, en particulier dans les cultures denses. En tant que tel, il est recommandé que les expériences se terminent à la fin des heures d’éclairage.

Figure 1: Base du support du réacteur. (A) Dimensions des composants de base en mm. (B) Orientation des soufflets d’angle métalliques qui fixent les deux supports verticaux. (C) L’une des quatre courtes longueurs d’acier relie la moitié arrière du tuyau en PVC au support du réacteur. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2: Composants électriques. (A) Vue arrière du PBR montrant le faisceau transversal supérieur et la configuration des composants électriques. (B) Vue de face du PBR après l’installation de l’éclairage. Veuillez cliquer ici pour voir une version agrandie de cette figure.
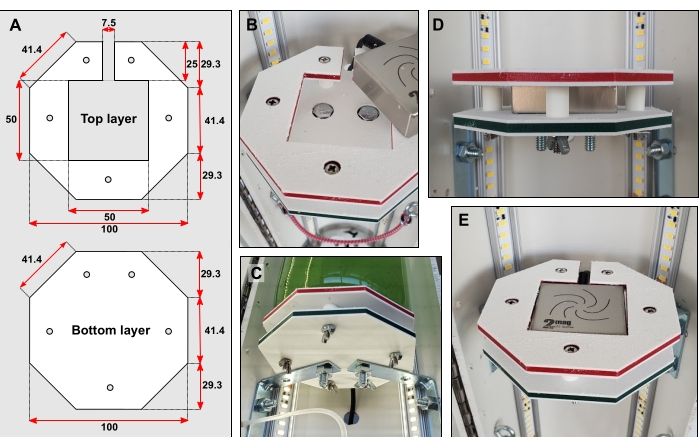
Figure 3: Détails de la plate-forme de la bouteille. (A) Dimensions des couches supérieure et inférieure en mm. (B) Encastrablement des têtes de boulon dans les deux couches. (C) Les accolades relient la couche inférieure directement à la moitié arrière du tuyau en PVC. D) Cinq courts tubes rigides montés sur des boulons étroits maintiennent les couches supérieure et inférieure séparées. (E) Lorsque la plate-forme de la bouteille est terminée, la surface doit être affleurante. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Conduite de gaz et orifice d’échantillonnage en option. (A) Les conduites de gaz relient chaque espace de tête de bouteille aux capteurs de gaz extérieurs. Si l’orifice d’échantillonnage est requis, les conduites de gaz doivent inclure une vanne unidirectionnelle immédiatement en aval de l’aiguille. (B) Capteur de gaz volumétrique. Le niveau d’emballage du liquide doit toucher la vis de traçage. Veuillez cliquer ici pour voir une version agrandie de cette figure.
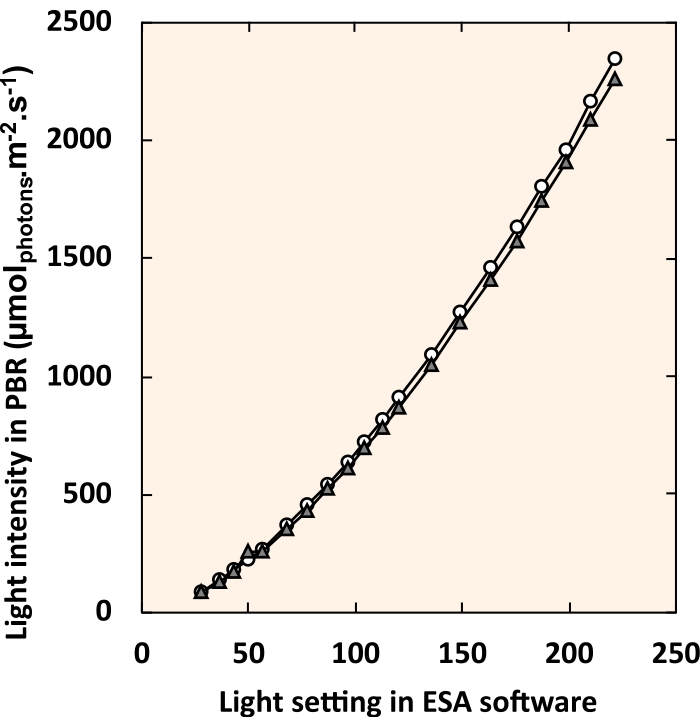
Figure 5 : Courbe standard reliant les paramètres du logiciel de contrôle LED à l’intensité lumineuse interne. Les cercles blancs et les triangles gris représentent chacun un PBR individuel. Pour chaque réglage d’éclairage, les quatre luminaires ont été réglés sur une valeur identique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
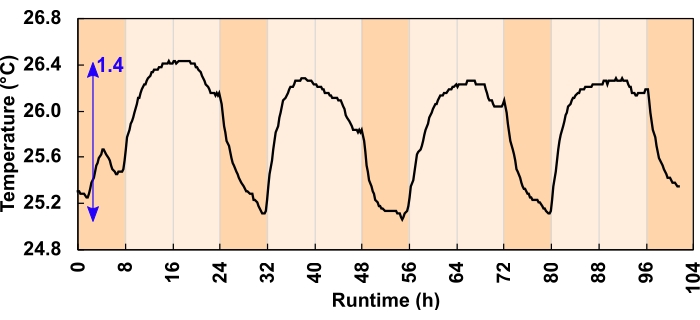
Figure 6 : Changement de température de culture pour lesrégimes lumineux m-2 s-1 des photons de 300 μmol. Pendant le programme diurne de 24 h, 16:8 h, les LED ont augmenté la température de culture diurne. La flèche bleue indique la différence entre la température minimale et maximale. Une erreur de programme lumineux a provoqué la baisse de température avant le crépuscule; cela a été corrigé avant le début de l’expérience. Veuillez cliquer ici pour voir une version agrandie de cette figure.
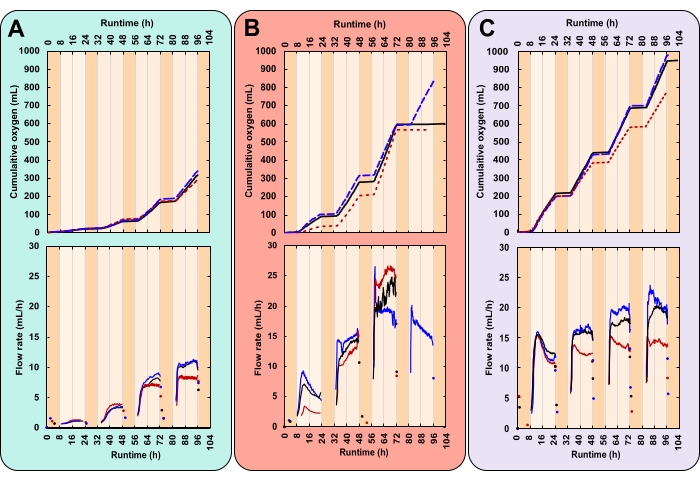
Figure 7 : Production d’oxygène pour trois conditions expérimentales uniques. Chaque réacteur a reçu une combinaison différente d’intensité lumineuse et de concentration initiale de biomasse (GRV); (A) 300photons μmol m-2 s-1 et IBC 0,03 gAFDW L-1, (B) 600 μmolphotons m-2 s-1 et IBC 0,13 gAFDW L-1, (C) 600 μmolphotons m-2 s-1 et IBC 0,40 gAFDW L-1. Les graphiques du haut montrent la production cumulée d’oxygène (mL) et le débit de gaz (mL/h). Les lignes noires pleines, les lignes bleues pointillées et les lignes rouges pointillées sont des répliques. La durée d’exécution de chaque expérience était de 104 h, ce qui comprenait quatre cycles complets jour-nuit de 16:8 h. L’ombrage orange foncé représente les heures nocturnes et les heures diurnes orange clair. Notez que dans le traitement B, la production d’oxygène s’aplatit le jour 4 pour deux des trois répliques. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 8 : Réponse au pH. Chaque réacteur a reçu une combinaison différente d’intensité lumineuse et de GRV; (diamants verts) 300 μmolphotons m-2 s-1 et IBC 0,03 gAFDW L-1, (triangles rouges) 600 μmolphotons m2 s-1 et IBC 0,13 gAFDW L-1, (cercles violets) 600photons μmol m-2 s-1 et IBC 0,40 gAFDW L-1 . L’ombrage orange foncé représente les heures nocturnes et les heures diurnes orange clair. Les barres d’erreur représentent l’erreur-type de la moyenne. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Traitement | Intensité lumineuse (photons μmol m-2 s-1) | GRV (gAFDW L-1) | Δ biomasse totale (gAFDW) | Δ pH | Oxygène total produit (mL) |
| Un | 300 | 0.031 | 0,289 (± 0,01) | 0,15 (± 0,01) | 316,2 (±11,4) |
| B | 600 | 0.130 | 0,674 (± 0,02) | 0,52 (± 0,27) | 834.6* |
| C | 600 | 0.400 | 0,675 (± 0,02) | 0,55 (± 0,03) | 902,2 (±50,5) |
| * Une seule des trois répliques a été couronnée de succès | |||||
Tableau 1 : Déplacement de la métrique de croissance de l’heure 0 à l’heure 104. Les parenthèses représentent l’erreur type de la moyenne.
| Traitement | Intensité lumineuse (photons μmol m-2 s-1) | GRV (gAFDW L-1) | Croissance de la biomasse mesurée (gAFDW) | Croissance prévue de la biomasse (gAFDW) | Sous-estimer (%) |
| Un | 300 | 0.031 | 0.289 | 0.288 | 0.5 |
| Un | 300 | 0.031 | 0.311 | 0.270 | 13.1 |
| Un | 300 | 0.031 | 0.268 | 0.247 | 7.9 |
| B | 600 | 0.13 | 0.708 | 0.705 | 0.4 |
| C | 600 | 0.4 | 0.718 | 0.796 | -10.9 |
| C | 600 | 0.4 | 0.640 | 0.830 | -29.7 |
| C | 600 | 0.4 | 0.668 | 0.659 | 1.3 |
Tableau 2 : Estimations de la croissance fondées sur l’oxygène total mesuré. Un seul réplicat desphotons de 300 μmol m-2 s-1 et IBC = 0,13 gde traitement AFDW L-1 a été achevé.
Figure supplémentaire 1 : Capture d’écran du logiciel de contrôle LED. Chacun des quatre luminaires peut être contrôlé indépendamment en faisant glisser les boutons du gradateur ou en entrant une valeur numérique dans la zone de texte. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 2 : Capture d’écran de la fenêtre de configuration du logiciel d’acquisition de données. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 3 : Capture d’écran de la fenêtre de journalisation du logiciel d’acquisition de données. Des rectangles vert vif indiquent des capteurs de gaz en ligne. Les données sont affichées en temps réel. Veuillez cliquer ici pour télécharger ce fichier.
Tableau supplémentaire 1 : Exemple de régime d’éclairage de 24 heures. Pour un programme diurne de 16:8 h, il y a 48 séries de 30 min chacune. Les astérisques indiquent les temps d’échantillonnage suggérés. Veuillez cliquer ici pour télécharger ce tableau.
Tableau supplémentaire 2 : Composition du milieu à haute alcalinité et pH élevé. Veuillez cliquer ici pour télécharger ce tableau.
Tableau supplémentaire 3: Solution d’oligo-éléments. Ajouter à une concentration finale de 1 mL/L au milieu de base. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
Dans ce protocole, se concentrer sur les étapes suivantes augmente la probabilité de générer des données reproductibles et de haute qualité. Lors de la construction du support du réacteur (étape 1), la base doit être robuste avec des supports verticaux bien alignés. L’acier fendu a des arêtes vives, de sorte que l’ajout de bouchons de sécurité est essentiel. Les surfaces de la plate-forme de la bouteille doivent être complètement plates, l’agitateur magnétique et les têtes de boulon doivent tous deux se trouver sous la surface de la couche supérieure (étapes 3.2 à 3.6). Selon les instructions du fabricant, le liquide d’emballage du capteur de gaz doit être rempli sur la « vis de traçage du niveau de liquide » pour des mesures précises de l’oxygène. Ce niveau de liquide doit être vérifié régulièrement car l’évaporation du liquide d’emballage peut court-circuiter la cellule de mesure. Les trois conduites de gaz fabriquées à l’étape 5.2 doivent avoir la même longueur; cela signifie que les répliques ont des volumes d’espace de tête identiques. Avant de commencer une expérience, il est conseillé de tester le régime lumineux programmé en enregistrant l’intensité lumineuse sur une période de 24 heures (étape 6.11). Si l’augmentation de la température du liquide est préoccupante, cet essai devrait également inclure une bouteille scellée avec une sonde de température interne (étape 6.11). Lors de la journalisation, ne quittez pas la fenêtre du logiciel d’acquisition de données; cela mettra fin à la journalisation. Si vous prélevez des échantillons de culture, veillez à ne pas libérer de gaz d’espace de tête en ouvrant les vannes dans le mauvais ordre (étapes 8.2 à 8.8). Lors de l’examen des données expérimentales, sachez que le logiciel d’acquisition de données génère automatiquement une moyenne mobile du débit. Cela gonfle la valeur d’une ou deux lectures de débit générées pendant la nuit. Organisez manuellement les journaux des capteurs de gaz pour y remédier.
Le recul le plus courant avec cette méthode est la possibilité de court-circuiter le capteur de gaz si le niveau d’emballage du liquide diminue. Cela peut se produire de deux façons. Tout d’abord, l’évaporation peut réduire lentement le niveau de liquide. Cependant, cela est peu probable sur une expérience à court terme (<7 jours)29. Deuxièmement, des taux de respiration élevés peuvent attirer l’oxygène dans la solution et générer un espace de tête sous pression. Lorsque l’énergie lumineuse n’est pas disponible, les microalgues utilisent la respiration aérobie pour fournir l’énergie nécessaire à l’entretien et à la réparationcellulaires 28. Par conséquent, dans les cultures denses pendant les heures non éclairées, la consommation d’oxygène et la sous-pression qui en résulte peuvent être importantes. Cela aspire le liquide d’emballage des capteurs de gaz dans la conduite de gaz. La distance parcourue par le liquide d’emballage est proportionnelle à la quantité de respiration nocturne. Si le liquide d’emballage pénètre dans les bouteilles, cela génère une nappe d’huile sur la surface du liquide.
Si des taux de respiration nocturne élevés sont attendus, des modifications peuvent être apportées au protocole. Le moyen le plus simple d’éviter la sous-pression est de laisser les espaces de tête de bouteille ouverts pendant la nuit. Cela a également l’avantage d’atténuer les niveaux d’OD en diminuant la pression partielle de l’espace de tête de O2. On pense que des concentrations élevées d’OD nuisent à la croissance, car l’O2 peut entraver l’activité de Rubisco et déclencher un stress oxydatif30,31. Il n’est pas rare que les suspensions de culture atteignent 4x la sursaturation même en contact avec l’atmosphère25,32. Pour ouvrir l’espace de tête, débranchez la conduite de gaz de l’aiguille enjambant le bouchon en caoutchouc. Les heures nocturnes peuvent servir de fenêtre pour recharger le liquide d’emballage du capteur de gaz ou manipuler des expériences continues ayant peu d’impact sur la collecte de données. Par exemple, on peut modifier la densité de culture, rafraîchir les nutriments, ajouter un amendement ou introduire un agent pathogène. Les bouteilles doivent être refermées et la ligne du capteur de gaz reconnectée avant que les lumières ne se rallument. Les mesures d’oxygène recueillies à partir d’expériences avec des espaces de tête fermés ou ouverts seront différentes.
Lorsque les bouteilles restent scellées, la consommation nocturne d’oxygène réduit le nombre de moles d’O2 dans l’espace de tête. Cela provoque le glissement du liquide d’emballage vers le haut de la conduite du capteur de gaz pour maintenir la pression de l’espace de tête. Lorsque les lumières s’allument, la production d’oxygène reprend. Le liquide d’emballage doit être repoussé dans le capteur de gaz avant que les lectures de débit ne commencent. Ce décalage est donc proportionnel au degré de respiration nocturne. De cette façon, lorsque l’espace de tête reste fermé, les lectures d’O2 représentent la production nette d’O2 (production photosynthétique - consommation respiratoire). Inversement, lorsque l’espace de tête est ouvert la nuit, le gaz atmosphérique remplace l’espace de têteO2 consommé, et aucun liquide d’emballage ne pénètre dans la conduite de gaz. Le résultat est que la consommation d’O2 respiratoire n’est pas prise en compte dans les données de production d’O2. Cela peut réduire la précision des estimations de la croissance de la biomasse de l’AFDW. Cependant, cela ne devrait pas avoir d’incidence sur l’utilité d’utiliser la production diurne d’O2 comme mesure pour comparer la croissance entre les traitements.
Tous les PBR de laboratoire sont affectés par la même limitation; les lumières artificielles ne peuvent pas reproduire le spectre solaire. Les microalgues utilisent des longueurs d’onde de lumière comprises entre 400 et 700 nm pour la photosynthèse. Cette région est appelée rayonnement photosynthétiquement actif (PAR)33. La lumière du soleil et la lumière artificielle varient dans leur contribution relative des longueurs d’onde dans cette gamme. Ceci, associé à des températures favorables et à un apport constant en lumière, signifie que les données de croissance en laboratoire ne peuvent souvent pas être extrapolées de manière fiable aux conditions extérieures. Ces PBR peuvent toutefois répondre à l’une des limites de l’alimentation en lumière PBR de laboratoire. L’intensité de la lumière du soleil est très variable tout au long de la journée, la couverture nuageuse générant des fluctuations transitoires du PAR incident. Le logiciel de contrôle de l’éclairage et le contrôleur d’éclairage DMX peuvent fournir des intensités lumineuses de 0 à 2400photons μmol m-2 s-1 et au-delà . Les régimes de lumière peuvent être décomposés en incréments individuels aussi courts que 1 s. L’intensité lumineuse réglable permet à l’utilisateur d’imiter les modèles de lumière extérieure plus étroitement que les configurations PBR standard. Ici, les intervalles simulés de 30 minutes à l’aube et au crépuscule estompent les cycles du jour et de la nuit ensemble (tableau supplémentaire 1).
Bien que la densité AFDW soit devenue la mesure standard de la croissance, cette méthode peut nécessiter des volumes de culture importants, une période de traitement de 2 à 3 jours et génère un point de données à la fois. De plus, si les conditions deviennent défavorables et que les cellules meurent, la densité AFDW ne fait pas de distinction entre les cellules photosynthétisantes actives et celles qui se décomposent. La quantification du taux de production d’oxygène photosynthétique sert de substitut de croissance alternatif. Cette conception PBR peut enregistrer la production d’oxygène en continu avec peu d’intervention de l’utilisateur tout en conservant le volume de culture. La résolution des données pourrait être améliorée en sélectionnant un capteur de gaz avec un volume de cellule de mesure inférieur, par exemple 1 mL. De plus, si les cultures sont bien mélangées, les utilisateurs peuvent décider d’installer un spectrophotomètre pour des lectures continues de densité optique. Si le contrôle de la température du milieu est souhaité, un refroidisseur à recirculation pourrait être ajouté. Ces PBR sont un ajout précieux à un laboratoire qui cherche à étendre sa capacité de recherche sur les microalgues sans investissement financier lourd. Ils sont particulièrement adaptés à ceux qui travaillent avec une alcalinité élevée, des espèces à pH élevé comme la spiruline. Ces PBR offrent une flexibilité de régime léger et sont valables pour des comparaisons rapides et répliquées de croissance en laboratoire.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Cette étude a été soutenue par le Conseil de recherches en sciences naturelles et en génie (CRSNG), la Fondation du Canada pour l’innovation (FCI), le Fonds d’excellence en recherche Canada First (CFREF), Alberta Innovates, la General Sir John Monash Foundation, le gouvernement de l’Alberta et l’Université de Calgary. Nous remercions Mark Toonen pour les travaux électriques et William Richardson pour les calculs de solubilité.
matériels
| Name | Company | Catalog Number | Comments |
| Aluminum channels Imperial: 0.90” x 39.37” Metric: 2.3 cm x 100 cm Quantity: 4 | LED World | AC-AR1-1M | Required as a heat sink |
| Bungee cords, small Quantity: 5 | - | - | To secure bottles |
| Computer - desktop/laptop Quantity: 1 | - | - | - |
| Data Logger, HOBO U30 USB Weather Station Quantity: 1 | HOBO, Hoskin | U30-NRC-VIA-10-S100-000 | Records light sensor information |
| Digital interface module, Rigamo, 4-channel Quantity: 1 | Ritter | N/A | This is to transmit gas sensor data to the computer |
| DMX decoder, 12~24 VDC, DMX-CV-4X5A Quantity: 1 | LITECH, LED World | LT-840-6A | Transmit messages which alter the light pattern |
| DMX lighting controller, SUSHI-RB-RJ Quantity: 1 | Arcolis, Nicolaudie America Inc. | SUSHI-RB-RJ DMX | Encodes the lighting program |
| Gas sensor packing liquid (Silox) Quantity: 1 L | Ritter | https://www.ritter.de/en/data-sheets/silox | |
| Gas sensor, volumetric Quantity: 3 | Ritter | MGC-1 V3.4 PMMA (https://www.ritter.de/downloads/mgc-milligascounter-en) | Measures oxygen production |
| Glass bottles, round 1 L with GL45 neck Quantity: 3 | Corning, Capitol Scientific | 1395-1L | Culture vessels |
| Hardware - end caps for slotted steel Quantity: 10 | Paulin, Home Depot | 142-612 | To cover sharp edges of slotted steel |
| Hardware - eye hooks Quantity: 6 | - | - | To secure bottles |
| Hardware - metal corner braces (large) Imperial: 4" x 4" Metric: 10 cm x 10 cm Quantity: 8 | - | - | Larger brackets to construct metal stand |
| Hardware - metal corner braces (small) Imperial: 2 1/2" x 2 1/2" Metric: 6.4 cm x 6.4 cm Quantity: 6 | - | - | Small brackets to connect bottle platforms to PVC pipe |
| Hardware - metal corner gussets Imperial: 3" x 3" Metric: 7.6 cm x 7.6 cm Quantity: 6 | Paulin, Home Depot | 142-616 | Flat brackets to construct metal stand |
| Hardware - piano hinge Imperial: 36" Metric: 91 cm Quantity: 1 | - | - | Connects two halves of PVC pipe |
| Hardware - rivets Quantity: 40 | - | - | To attach piano hinge to PVC tubing |
| Hardware - set of bolts, nuts, washers Quantity: 60 | - | - | Long thin bolts are required to secure bottle platforms around magentic stirrers |
| Hardware - set of bolts, nuts, washers Quantity: 30 | - | - | Larger shorter bolts are required to build the metal stand |
| LED driver, constant voltage, 96W 24VDC UL Listed IP65 Driver Class 2 regulated power supply Quantity: 1 | Magnitude Lighting, LED World | CVN96L24DC | Regulates power to the lights |
| LED lights, Cinco Bright LED Flex Strip Quantity: 4 m roll | EvenBright, LED World | FA128M57-4M-24V-X | Roll is trimmed into 4 x 1 m lengths and secured inside the PVC tube |
| Light meter, handheld with submersible sperical probe Quantity: 1 | LI-COR | LA-250A | Calibrate the reactors light intensity |
| Light sensors Photosynthetic Light (PAR) Smart Sensor Quantity: 2 | HOBO, Hoskin | S-LIA-M003 | Only one is required however two would be good practice in case one malfunctioned |
| Magnetic stirrers (MIXdrive 1 XS) with external control units and power supply (MIXcontrol eco) Quantity: 3 | 2Mag, 2MAG USA | MF 40300 | Stirrers sit sandwiched in bottle platforms |
| Metal plate Imperial: 24" x 8" Metric: 61 cm x 20.3 cm Quantity: 1 | - | - | This is a surface on which to secure electronics, it is attached to the back of the reactor |
| Pipe, white PVC Imperial: 6" diameter x 42" high Metric: 15.2 cm x 106.7 cm Quantity: 1 | - | - | Cut lengthwise in two halves, used to house lights and bottles |
| Plastic (HDPE) sheets Imperial: 4" x 4" x 1/4" Metric: 10 cm x 10 cm x 1 cm Quantity: 6 | Inventables | 30291-01 | For bottle platforms which house magentic stirrers |
| Rubber stoppers - GL45 size Quantity: 3 | Duran, VWR | 76289-760 | Seals culture vessels |
| Screw caps - with aperture and GL45 neck Quantity: 3 | Corning, Capitol Scientific | 1395-45HTSC | Generates seal of culture vessels |
| Slotted angle steel lengths Imperial: 1-1/2" X 48" x 0.074" Metric: 3.8 cm x 122 cm x 0.19 cm Quantity: 6 | Paulin, Home Depot | 142-202 | Makes up the body of the metal stand |
| Slotted flat steel lenghts Imperial: 1-3/8" x 48" x 0.074" Metric: 3.5 cm x 122 cm x 0.19 cm Quantity: 3 | Paulin, Home Depot | 142-222 | Makes up the body of the metal stand |
| Software - Easy Stand Alone (ESA) | https://www.dmxsoft.com/#apps | AKA LED control software | |
| Software - Rigamo v3.1 | AKA data acquisition software | ||
| Software - Storage Upgrade Tools (SUT) | https://store.dmxsoft.com// | ||
| Stir bar Imperial: 1" x 5/16" Metric: 2.5 cm x 0.8 cm Quantity: 3 | Fisherbrand | 14-513-59 | Stirs culture |
| Switch box Quantity: 1 | - | - | Turns power on/off to reactor |
| Syringe, 10 mL Quantity: Multiple | - | - | Optional if you wish to extract culture |
| Tube adaptor fittings, plastic - Stopcock 1-way Quantity: 6 | Masterflex, Cole Palmer | RK-12023-33 | Close/open culture vessel line |
| Tube adaptor fittings, plastic - variety of male and female luer lock fittings Imperial: to fit 1/16" and 1/8" ID tubing Metric: to fit 1.59 mm and 3.18 mm tubing Quantity: Multiple packets | Masterflex, Cole Palmer | RK-30800-16; RK-30800-18; RK-45518-26; RK-45501-00; RK-45501-04 | Many different combinations can achieve the same end result, best to order a variety of fittings |
| Tube adaptor fittings, plastic - variety of straight connectors Imperial: to fit 1/16" and 1/8" ID tubing Metric: to fit 1.59 mm and 3.18 mm tubing Quantity: Multiple packets | Masterflex, Cole Palmer | RK-40616-04 | Many different combinations can achieve the same end result, best to order a variety of fittings |
| Tubing, flexible, transparent Imperial: ID=1/16", OD=1/8" Metric: ID = 1.59 mm, 0D = 3.18 mm Quantity: 4 m | Masterflex, Cole Palmer | RK-06422-02 | Line from culture vessel to gas sensor |
| Tubing, flexible, transparent Imperial: ID=1/8", OD=1/4" Metric: ID = 3.18 mm, 0D = 6.35 mm Quantity: 2 m | Masterflex, Cole Palmer | RK-06422-05 | Gas sensor standard tubing size |
| Tubing, rigid, transparent Imperial: ID=1/16", OD=1/8" Metric: ID = 1.59 mm, 0D = 3.18 mm Quantiy: 1 m | Masterflex, Cole Palmer | RK-06605-27 | Spans rubber stopper allowing gas to exit |
| Tubing, rigid, transparent Imperial: ID=1/8", OD=1/4" Metric: ID = 3.18 mm, 0D = 6.35 mm Quantity: 1 m | Masterflex, Cole Palmer | RK-06605-30 | Spans rubber stopper allowing gas to exit |
| Zip ties, small Quantity: 1 packet | Secure tube fittings |
Références
- Benemann, J. R. . Opportunities and challenges in algae biofuels production. A position paper in line with Algae World. , (2008).
- Laurens, L. M. L. State of technology review - algae bioenergy. An IEA bioenergy inter-task strategic project. IEA Bioenergy. , (2017).
- Robertson, D. E., et al. A new dawn for industrial photosynthesis. Photosynthesis Research. 107, 269-277 (2011).
- Troschl, C., Meixner, K., Drosg, B. Cyanobacterial PHA production-review of recent advances and a summary of three years' working experience running a pilot plant. Bioengineering. 4 (2), (2017).
- Rizwan, M., Mujtaba, G., Memon, S. A., Lee, K., Rashid, N. Exploring the potential of microalgae for new biotechnology applications and beyond: a review. Renewable and Sustainable Energy Reviews. 92, 394-404 (2018).
- Niesa, F., et al. Characterization of Phormidium lacuna strains from the North Sea and the Mediterranean Sea for biotechnological applications. Process Biochemistry. 59, 194-206 (2017).
- Laurens, L. M. L., Chen-Glasser, M., McMillan, J. D. A perspective on renewable bioenergy from photosynthetic algae as feedstock for biofuels and bioproducts. Algal Research. 24, 261-264 (2017).
- Barreiro-Vescovo, S., Barbera, E., Bertucco, A., Sforza, E. Integration of microalgae cultivation in a biogas production process from organic municipal solid waste: From laboratory to pilot scale. ChemEngineering. 4 (2), 26 (2020).
- Zurano, A. S., et al. Year-long assessment of a pilot-scale thin-layer reactor for microalgae wastewater treatment. Variation in the microalgae-bacteria consortium and the impact of environmental conditions. Algal Research. 50, (2020).
- Deprá, M. C., Severo, I. A., Dias, R. R., Zepka, L. Q., Jacob-Lopes, E. Photobioreactor design for microalgae culture. Microalgae. , 35-61 (2021).
- Osburn, F. S., Wagner, N. D., Scott, J. T. Biological stoichiometry and growth dynamics of a diazotrophic cyanobacteria in nitrogen sufficient and deficient conditions. Harmful Algae. 103, (2021).
- Eustance, E., Badvipour, S., Wray, J. T., Sommerfeld, M. R. Biomass productivity of two Scenedesmus strains cultivated semi-continuously in outdoor raceway ponds and flat-panel photobioreactors. Journal of Applied Phycology. 28 (3), 1471-1483 (2016).
- Qiang, H., Richmond, A., Zarmi, Y. Combined effects of light intensity, light-path and culture density on output rate of spirulina platensis (cyanobacteria). European Journal of Phycology. 33 (2), 165-171 (1998).
- Ooms, M. D., Dinh, C. T., Sargent, E. H., Sinton, D. Photon management for augmented photosynthesis. Nature Communications. 7, 1-13 (2016).
- Moheimani, N. R., Borowitzka, M. A., Isdepsky, A., Sing, S. F. Standard methods for measuring growth of algae and their composition. Algae for biofuels and energy. , 265-284 (2013).
- Griffiths, M. J., Garcin, C., van Hille, R. P., Harrison, S. T. L. Interference by pigment in the estimation of microalgal biomass concentration by optical density. Journal of Microbiological Methods. 85 (2), 119-123 (2011).
- Schumann, R., Häubner, N., Klausch, S., Karsten, U. Chlorophyll extraction methods for the quantification of green microalgae colonizing building facades. International Biodeterioration and Biodegradation. 55 (3), 213-222 (2005).
- Pinckney, J. L., Richardson, T. L., Millie, D. F., Paerl, H. W. Application of photopigment biomarkers for quantifying microalgal community composition and in situ growth rates. Organic Geochemistry. 32 (4), 585-595 (2001).
- Van Wychen, S., Laurens, L. M. L. Determination of total solids and ash in algal biomass: laboratory analytical procedure (LAP). National Renewable Energy Laboratory. , (2015).
- Davis, R., Laurens, L. Algal biomass production via open pond algae farm cultivation: 2019 state of technology and future research. National Renewable Energy Laboratory. , (2020).
- Borovkov, A. B., Gudvilovich, I. N., Avsiyan, A. L. Scale-up of Dunaliella salina cultivation: from strain selection to open ponds. Journal of Applied Phycology. 32 (3), 1545-1558 (2020).
- Davies, F. K., et al. Microbiota associated with the large-scale outdoor cultivation of the cyanobacterium Synechococcus sp. PCC 7002. Algal Research. 58, (2021).
- Ataeian, M., et al. Direct capture and conversion of CO2 from air by growing a cyanobacterial consortium at pH up to 11.2. Biotechnology and Bioengineering. 116 (7), 1604-1611 (2019).
- Fu, F., et al. Sustained photosynthesis and oxygen generation of microalgae-embedded silk fibroin hydrogels. ACS Biomaterials Science & Engineering. , (2021).
- Rearte, T. A., et al. Photosynthetic performance of Chlorella vulgaris R117 mass culture is moderated by diurnal oxygen gradients in an outdoor thin layer cascade. Algal Research. 54, (2021).
- Poughon, L., et al. Limnospira indica PCC8005 growth in photobioreactor: model and simulation of the ISS and ground experiments. Life Sciences in Space Research. 25, 53-65 (2020).
- Yen, U. C., Huang, T. C., Yen, T. C. Observation of the circadian photosynthetic rhythm in cyanobacteria with a dissolved-oxygen meter. Plant Science. 166 (4), 949-952 (2004).
- Vermaas, W. F. Photosynthesis and respiration in cyanobacteria. eLS. , (2001).
- Ritter, . MilliGascounter Type MGC-1 Operation Instructions V 3.4. , (2017).
- Sousa, C., De Winter, L., Janssen, M., Vermuë, M. H., Wijffels, R. H. Growth of the microalgae Neochloris oleoabundans at high partial oxygen pressures and sub-saturating light intensity. Bioresource Technology. 104, 565-570 (2012).
- Latifi, A., Ruiz, M., Zhang, C. C. Oxidative stress in cyanobacteria. FEMS microbiology reviews. 33 (2), 258-278 (2009).
- Morillas-España, A., Lafarga, T., Gómez-Serrano, C., Acién-Fernández, F. G., González-López, C. V. Year-long production of Scenedesmus almeriensis in pilot-scale raceway and thin-layer cascade photobioreactors. Algal Research. 51, (2020).
- Melis, A. Solar energy conversion efficiencies in photosynthesis: minimizing the chlorophyll antennae to maximize efficiency. Plant Science. 177 (4), 272-280 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon