Method Article
Эксплуатация лабораторных фотобиореакторов с онлайн-измерениями роста и настраиваемыми режимами освещения
В этой статье
Резюме
В данной публикации описывается конструкция лабораторных фотобиореакторов (ПБР) с настраиваемыми режимами освещения. Рост цианобактерий или микроводорослей, использующих бикарбонат в качестве источника углерода, непрерывно контролируется путем измерения объемного производства кислорода. Эти PBR облегчают быстрое, реплицированное сравнение лабораторного роста с небольшим вмешательством пользователей во время экспериментов.
Аннотация
Лабораторное исследование микроводорослей может быть экспериментально сложным. В дополнение к требованиям культивирования нефотосинтетических микроорганизмов, фототрофы также требуют освещения. Обычно исследователи стремятся обеспечить пользовательские источники света, то есть варьировать интенсивность света и время, в течение которого он доставляется. Такая гибкость затруднена со стандартными настольными светильниками. Как правило, исследования культивирования также требуют сравнения роста между экспериментальными методами лечения. Часто рост оценивается в течение длительного периода времени, например, несколько раз в день в течение недельного исследования. Ручные измерения могут занимать много времени и не разрешать данные. Поэтому фотобиореакторы (PBR) с автоматическим мониторингом роста и настраиваемым источником света полезны для реплицированных экспериментов с несколькими методами лечения. Текущая работа представляет проектирование, строительство и эксплуатацию лабораторных ПБР. Материалы легко доступны и относительно недороги. Дизайн может быть продублирован с умеренным мастерством. Каждая структура имеет площадь ~ 40см2 и содержит три стеклянные бутылки по 1 л для тройной репликации. Бутылки покоятся на платформах, содержащих магнитные мешалки, и расположены вертикально в пределах трубы высотой 1 м и диаметром 15 см из поливинилхлорида (ПВХ). Внутренняя часть трубы облицована светодиодами (СВЕТОДИОДАМИ). Эти светодиоды производят непрерывную интенсивность света от 0 до 2400 мкмоль фотонов m-2 s-1 фотосинтетически активного излучения (PAR). Пользователи разрабатывают пользовательскую программу освещения. Интенсивность света можно регулировать каждую секунду или удерживать постоянной в течение более длительных периодов времени. Кислород, образующийся в результате фотосинтеза, выходит из каждой бутылки через односторонний датчик объемного газа. Программное обеспечение используется для записи данных датчиков газа. Количество производимого кислорода может быть коррелировано с ростом биомассы. Если требуются образцы биомассы, шприц может быть использован для извлечения культуры. Метод подходит для микроводорослей, выращенных с бикарбонатом в качестве источника углерода. Эти PBR ценны для лаборатории, которая требует воспроизводимых экспериментов, гибкости светового режима и непрерывных данных о росте с высоким разрешением.
Введение
Микроводоросли и цианобактерии, совместно называемые микроводорослями для простоты, отстаиваются за их потенциал в устойчивой биотехнологии. Они являются привлекательными кандидатами из-за их быстрого роста, способности культивироваться на непахотных землях и использования солнечного света для преобразования углекислого газа в биомассу 1,2,3. Биомасса микроводорослей может быть преобразована в такие продукты, как биоэнергия в виде нефти или газа, пищевых красителей и пищевых добавок, а также такие материалы, как биополимеры 1,4,5,6,7. Кроме того, их можно использовать для очистки сточных вод или рекультивации водоемов путем потребления избыточных питательных веществ 8,9. Учитывая это, исследования микроводорослей широко распространены и установлены. Область растет по мере того, как общество пересматривает углеродоемкость и экологическую устойчивость современных подходов к производству и производству энергии.
Тремя фундаментальными требованиями лабораторных исследований микроводорослей являются культуральный сосуд, источник света и метод количественной оценки роста. Термин фотобиореактор (PBR) описывает установку, в которой сосуды культурыосвещаются 10. Как правило, исследования микроводорослей направлены на сравнение роста между двумя или более методами лечения, например, различными питательными средами, световыми режимами или видами 11,12,13. Для статистической значимости каждое состояние, например, лечение и контроль, должно быть воспроизведено. Если контроль и лечение проводятся одновременно, это означает, что многие ПБР должны контролироваться и отбираться в течение всего эксперимента. Задача эксплуатации нескольких ПБР состоит из двух частей. Во-первых, обеспечение равномерной интенсивности света для каждого PBR имеет важное значение для воспроизводимости, но может быть затруднено. На количество света, падающего на поверхность сосуда, влияет его расстояние от источника света, затенение от соседних сосудов и фоновые световые колебания14. Во-вторых, должен быть выбран метод точной количественной оценки роста.
Рост обычно измеряется количеством клеток, оптической плотностью (OD), содержанием хлорофилла A, плотностью сухого веса (DW) и плотностью сухого веса без золы (AFDW)15. Количество клеток, содержание хлорофилла А и гравиметрические методы являются ручными процессами, которые производят дискретные точки данных. OD может быть измерен непрерывно и неинвазивно с помощью спектрофотометра, при условии, что он хорошо откалиброван по другому методу, такому как плотность AFDW15. Однако измерения ОД и содержания хлорофилла А могут быть ненадежными, поскольку результаты варьируются в зависимости от различных условий культивирования, например, между видами и на протяжении всего цикла роста15,16. Для хлорофилла А метод экстракции также может влиять на выход пигмента17. Содержание хлорофилла А особенно полезно для отслеживания роста микроводорослей в микробных сообществах, которые также содержат нефотосинтезирующие организмы 17,18. При выборе метода определения роста важно учитывать морфологию суспензии. Когда организмы сгущаются и плохо смешиваются, количество ОД и клеток невозможно15. Один метод не подходит для всех экспериментальных применений — исследователи должны решить, какие методы являются практичными и актуальными для их экспериментальных целей.
AFDW является надежным методом, который позволяет сравнивать рост между различными условиями культивирования, в частности, между видами и питательными средами 15,19,20. Для расчета AFDW образец культуры микроводорослей сначала концентрируют, либо путем фильтрации, либо центрифугирования, и сушат. На этом этапе можно определить DW. Обычно образец DW содержит, по меньшей мере, 8–10% золоорганического материала, такого как соли и твердые частицы15. DW отслеживает тенденции роста, но может быть искажена, если вклад неорганики варьируется. Для определения плотности AFDW сухую биомассу сжигают при высокой температуре; это испаряет органическую или полезную часть, оставляя золу (неорганические вещества) после19. Для расчета AFDW вес фракции золы вычитается из массы фракции DW. Как правило, в микроводоростных суспензиях AFDW колеблется в пределах 0,1–3 г/л 12,21,22. Небольшие объемы разбавленных суспензий дают мало сухой биомассы, <10 мг. После сгорания зола может весить всего 1 мг. Поэтому, в зависимости от плотности культуры, этот метод требует объемов от 5 до 100 мл и аналитических шкал с точностью до 0,1 мг 12,15,19,22. Лабораторные PBR, как правило, небольшие, максимум пара литров, поэтому каждый жидкий образец истощает объем культуры. Кроме того, метод AFDW является ручным и занимает 2-3 дня. Для реплицированных и повторяющихся экспериментов предпочтительнее автоматизированный и непрерывный процесс.
Для микроводорослей, которые используют бикарбонат в качестве источника углерода, можно непрерывно измерять два дополнительных показателя роста. Фотосинтез потребляет бикарбонат и производит кислород. Потребление бикарбоната повышает средний рН23. Погруженный датчик pH может измерить это изменение. Производство фотосинтетического кислорода увеличивает концентрацию растворенного кислорода (DO) среды до тех пор, пока среда не будет насыщена. Помимо насыщения, кислород существует в виде пузырьков. Производство кислорода измеряется многими различными методами: зонды измеряют концентрацию DO, манометрические приборы оценивают давление в пространстве над головой, газовая хроматография измеряет состав пространства над головой, а объемные датчики регистрируют отток газа 24,25,26,27. Когда кислород используется в качестве прокси роста, сосуды культуры должны быть полностью герметизированы или допускать только отток газа. Для измерения pH и кислорода углерод должен подаваться в виде бикарбоната, а не путем разбрызгиванияCO2. РазбрызгиваниеCO2 снижает средний рН23 и, как газ, может нарушить измерения кислорода. Одним из преимуществ pH и кислорода по сравнению с оптической плотностью является то, что метод не скомпрометирован, если микроводоросли образуют сгустки. Несмотря на косвенность, как рН, так и кислород эффективны при сравнении роста между методами лечения.
PBR, используемые сегодня, различаются по сложности. Лаборатории могут использовать простые настольные колбы, пользовательские прототипы или коммерчески доступные продукты. Для исследовательских групп, стремящихся модернизировать колбы, стоимость коммерческих ПБР или технических навыков и изготовления деталей, необходимых для создания многих прототипов, может быть препятствием. Эта рукопись направлена на описание поэтапного проектирования, строительства и эксплуатации лабораторных ПБР, которые устраняют этот разрыв. Эти PBR имеют настраиваемый режим освещения и непрерывно контролируют рост, регистрируя объемное производство кислорода. Эта конструкция содержит три культурных сосуда для тройного воспроизведения и может быть построена с умеренным мастерством и легкодоступными материалами. Этот PBR является ценным дополнением к лаборатории, стремящейся расширить свои возможности для исследований микроводорослей, не инвестируя в очень технические или дорогие продукты. При выборе приобретения или создания PBR исследователи должны учитывать пригодность дизайна для их культурных условий, финансового положения и исследовательских вопросов.
протокол
1. Строительство стенда PBR
- С помощью ручной ножовки вырежьте пять длин 380 мм и две длины 200 мм из угловой щелевой стали. Крепитесь вместе болтами и большими угловыми скобами, чтобы сделать основание подставки (рисунок 1А). Клей на предохранительные торцевые колпачки.
- Соедините с основанием две неразрезанные (1220 мм) вертикальные длины из угловой щелевой стали. Закрепите болтами и металлическими угловыми наконечниками (рисунок 1B). Клей на предохранительные торцевые колпачки.
- Вырежьте четыре плоских стальных станка длиной 65 мм. Прикрепите их под углом 90° к вертикальным опорам — прикрепите по два к каждой опоре, одну на 130 мм вверх от основания (рисунок 1C) и одну на 60 мм вниз сверху.
- Крепление вертикальных опор поперек их верхней части с горизонтальной длиной 140 мм из плоской щелевой стали (поперечной балки), прикрепленной болтами к задней части рамы (рисунок 2А).
2. Конструкция световой камеры
- Вырежьте белую трубу диаметром 153 мм из поливинилхлорида (ПВХ) длиной 1070 мм. Разрежьте трубу пополам вдоль ленточной пилой. Шлифуйте все края.
- Равномерно расположены четыре алюминиевых канала радиатора вертикально вместе с внутренней частью трубы. Не прикрепляйте каналы в пределах 20 мм от края среза трубы. С помощью небольших болтов закрепите каналы на месте сверху и снизу (рисунок 2B).
- Прикрутите половину трубы к подставке с помощью горизонтальных опор, изготовленных на шаге 1.3.
- Положите реактор вниз и воссоедините половинки трубы, склеив их вместе. Центрируйте шарнир фортепиано вдоль одной линии разреза. Проследите шарнирные отверстия и просверлите трубу соответствующим образом. Используйте заклепочный пистолет и заклепки средней длины, чтобы закрепить шарнир к трубе.
- Используйте небольшой шнур тарзанки (см. Таблицу материалов), чтобы держать трубу закрытой (рисунок 1C).
- Проконсультируйтесь с электриком, чтобы подключить светодиодные фонари и установить следующие четыре компонента: светодиодный драйвер, декодер цифрового мультиплекса (DMX), контроллер освещения DMX и распределительную коробку (см. Таблицу материалов). Закрепите все компоненты на задней части PBR согласно рисунку 2A.
3. Строительство бутылочных платформ
- Вырезайте формы платформ (рисунок 3А) из твердого пластика, например, полиэтилена высокой плотности (HDPE) (см. Таблицу материалов), с помощью фрезерования с числовым программным управлением (ЧПУ). Сделайте по три фигуры.
ПРИМЕЧАНИЕ: Рекомендуется резка запасных верхних и нижних слоев. - Скрепите нижний и верхний слои вместе. Отметьте и просверлите пять небольших отверстий диаметром 6 мм через обе формы (рисунок 3А). Используя более крупное сверло, осторожно расширьте поверхность этих отверстий, чтобы головки болтов могли быть утоплены (рисунок 3B).
- Для каждой из трех платформ прикрутите две небольшие угловые скобы к задней половине трубы.
ПРИМЕЧАНИЕ: Расстояние между верхней частью брекетов должно составлять 350 мм. - Центрируйте каждый нижний слой поверх его брекетов. Отметьте расположение отверстий для сверления из-под брекетов. Просверлите два отверстия диаметром 6 мм. Используя более крупное сверло, осторожно расширьте поверхность отверстий, чтобы болты можно было утопить.
- Болтовые нижние слои к их брекетам (рисунок 3B–C).
- Вырежьте пятнадцать кусков жестких труб длиной 12 мм 6,35 мм наружного диаметра (OD). Сэндвич по пять кусочков жесткой трубки между каждым верхним и нижним слоем. Скрепите слои и трубки вместе длинными узкими болтами согласно рисунку 3B–D.
- Просверлите большое отверстие в трубе из ПВХ за каждой платформой. Вставьте каждую микромагнитную мешалку в ее платформу. Проденьте электрический кабель каждой мешалки через эти недавно вырезанные отверстия (рисунок 3C–E). Подключите каждую мешалку к соответствующему блоку управления, а также к розетке.
- Поместите бутылку объемом 1 л на каждую платформу. Добавьте болты в заднюю трубу на уровне горлышка бутылки. Оберните небольшой банджи-шнур вокруг каждого горлышка бутылки, чтобы добавить стабильности (рисунок 4A).
ПРИМЕЧАНИЕ: На протяжении всего протокола будут полезны платформы цветового кодирования, бутылки, магнитные мешалки и все связанные с ними кабели и датчики.
4. Конструкция отверстий для отбора проб жидкости (опционально)
- Вырежьте три 60 мм длиной 6,35 мм OD жестких труб. Используя сверло 5 мм, просверлите отверстия через каждую резиновую пробку. Протолкните жесткую трубу длиной через пробку.
- Вырежьте три 60 мм длиной 3,18 мм OD жестких труб. Соедините их с помощью прямого редуктора к выступающей трубке на нижней стороне каждой пробки.
- Вставьте односторонний запорный клапан (например, порт 1 = женский Luer, порт 2 = мужской скользящий Luer) в выступающую трубу на поверхности пробки (рисунок 4A).
- Вырежьте три гибкие трубки длиной 30 мм 3,18 мм OD. Вставьте фитинги Luer (например, мужской Luer для шланга barb и женский Luer для шланга barb) на обоих концах.
- Соедините детали, выполненные на этапе 4.4, с запорными клапанами на поверхности каждой резиновой пробки (рисунок 4А).
ПРИМЕЧАНИЕ: Многие комбинации запорных кранов и фитингов Luer могут дать один и тот же результат. Конструкция должна позволять вытягивать жидкость или вставлять ее через шприц.
5. Подключение объемных газовых датчиков
- Подготовьте газовые датчики в соответствии с инструкциями производителя.
ПРИМЕЧАНИЕ: В основном это связано с заполнением газовых датчиков упаковочной жидкостью (рисунок 4B). - Для изготовления газопроводов вырежьте три гибкие трубки длиной 1000 мм 3,18 мм.
- Просверлите три отверстия диаметром 4 мм в задней трубе из ПВХ. Расположите отверстия рядом с шарниром на высоте горлышка бутылки. Резьба газовых линий через эти отверстия (рисунок 4А).
- К концу газопровода внутри трубы из ПВХ добавьте фитинг Luer (например, шланговый барбус к мужскому Luer) и подключите односторонний запорный клапан (например, порт 1 = женский Luer, порт 2 = мужской Luer).
ПРИМЕЧАНИЕ: Клапан требуется только в том случае, если также установлены отверстия для отбора проб жидкости. - Присоедините другой конец газопровода к входному отверстию газового датчика с помощью прямого редуктора. Закрепите это соединение с помощью застежки-молнии.
- Подключите все газовые датчики к цифровому модулю ввода (DIM) с помощью кабелей разъема, а DIM — к соседнему компьютеру.
- Установите программное обеспечение для сбора данных (см. таблицу материалов) в операционной системе Windows и подключите ключ лицензирования. Добавьте файлы калибровки датчиков в каталог калибровки программного обеспечения.
6. Программирование светового режима
- С помощью заднего переключателя включения/выключения включите PBR и подключите контроллер освещения DMX к компьютеру с помощью кабеля micro-USB.
- Загрузите средства обновления магазина (SUT) и программное обеспечение для управления светодиодами (см. Таблицу материалов). Зарегистрируйте контроллер освещения DMX в режиме онлайн.
- Откройте программное обеспечение управления светодиодами и выберите Щелкните здесь для работы с интерфейсом USB-DMX: SUSHI-RB-RJ.
- На вкладке Настройка в поле ScanLibrary выберите Универсальную папку и Одноканальный канал. Измените параметры ScanLibrary на ВСЕЛЕННУЮ DMX 1, количество светильников на 4 и номер индекса на 1. В правом верхнем углу измените раскрывающийся список на Представление списка. Наконец, нажмите на Патч (Дополнительный рисунок 1).
ПРИМЕЧАНИЕ: Во вселенной DMX одна коробка проверяет управление каждой светодиодной лентой, перемещая кнопки диммера или вводя числовое значение в текстовое поле. - Сделайте стандартную кривую, которая связывает цифровую настройку света в программном обеспечении управления освещением с интенсивностью света, испытываемой в центре трубки из ПВХ (рисунок 5). Измерьте внутреннюю интенсивность света с помощью небольшого сферического зонда (см. Таблицу материалов), подвешенного в центре трубы из ПВХ.
- Перейдите на вкладку Редактор . Чтобы создать пользовательскую программу освещения, создайте новую сцену и начните добавлять шаги. Обратитесь к Дополнительной таблице 1 для примера суточной программы 16:8 ч. Установите сцену в цикл.
ПРИМЕЧАНИЕ: Шаги разбивают сцены на блоки времени, каждый из которых может быть настроен на разную интенсивность света. Шаги варьируются от 1 с до 43 мин. Здесь удобнее всего 30-минутные шаги. Несколько сцен могут быть загружены на одно устройство контроллера освещения DMX. - Создайте дополнительную вспомогательную сцену, которая будет сразу узнаваема, например, два из четырех включенных светодиодов.
ПРИМЕЧАНИЕ: Сцены можно циклически просматривать вручную с помощью кнопки на боковой стороне контроллера освещения DMX. Если желаемая световая программа начинается ночью, невозможно будет различить, началась ли уже световая программа. Вспомогательная сцена служит индикатором того, что контроллер освещения DMX функционирует правильно. - Сохраните сцены и перейдите на вкладку «Автономный ». Запишите память контроллера освещения DMX и отсоедините устройство от компьютера.
- Подключите контроллер освещения DMX к источнику питания с помощью micro-USB.
- Перед началом эксперимента протестируйте программу освещения, регистрируя внутреннюю интенсивность света в течение 24 часов. Если температура жидкости представляет интерес, зарегистрируйте ее одновременно с помощью погружного температурного зонда (рисунок 6).
7. Начало эксперимента
- Стерилизуйте среды, бутылки, мешалки, резиновые пробки, отверстия для отбора проб, резьбовые винтовые крышки отверстий и трубки.
ПРИМЕЧАНИЕ: Все компоненты, используемые в этой конструкции, являются автоклавируемыми, за исключением клапанов и фитингов Luer - есть автоклавируемые альтернативы от других производителей. - Откройте программное обеспечение для сбора данных и заполните страницу конфигурации (дополнительный рисунок 2). Назначьте файлы калибровки соответствующим датчикам.
- В разделе Имя файла каталога выберите соответствующую папку с номером порта DIM. Нажмите на Текущую папку и повторите для всех портов.
- Нажмите кнопку ОК , чтобы перейти на страницу ведения журнала.
- Наполните бутылки до нужного объема средой для выращивания (Дополнительные таблицы 2,3).
ПРИМЕЧАНИЕ: Каждая из этих бутылок будет вмещать максимум ~ 1,1 л с небольшим пространством над головой (~ 80 мл, включая газовую линию). - Центрифугируйте сток культуры в трех сбалансированных пробирках по 50 мл в течение 15 мин при 4500 х г для получения трех гранул. Добавьте по одной грануле в каждую бутылку – вымойте гранулами с серологической пипеткой и свежей средой.
ПРИМЕЧАНИЕ: Плотность культуры дня 0 также известна как начальная концентрация биомассы (IBC). Измерить КСГМГ в гAFDW. L-1, дополнительная трубка объемом 50 мл может быть центрифугирована на этапе 7.6. Полученную гранулу затем можно высушить и сжечь15,19. Шаг 7.6, вероятно, потребует модификации на основе индивидуальных целей пользователей и их экспериментов. - Опустите магнитную мешалку размером 25 x 8 мм в каждый флакон.
- Запечатайте каждое отверстие бутылки резиновой пробкой и резьбовым винтовым колпачком отверстия (рисунок 4А). Если установлены дополнительные отверстия для отбора проб, закройте клапаны.
- Найдите конец каждой газовой магистрали внутри трубы из ПВХ (встроенной на шаге 5.4) и прикрепите иглу к мужскому порту Luer клапана.
- Подключите каждый баллон к датчику газа, проткнув каждую резиновую пробку соответствующей иглой.
- Запустите каждый датчик газа отдельно, установив флажок в левой части экрана, нажав « Пуск» и введя имя файла. Нажмите OK и повторите для всех датчиков (дополнительный рисунок 3).
ПРИМЕЧАНИЕ: Во время ведения журнала не выходите из окна сбора данных. Установите параметры питания и спящего режима компьютера на «Никогда » и отложите обновления компьютера на время эксперимента. - Включите PBR и убедитесь, что контроллер освещения DMX подключен к источнику питания. Первая запрограммированная сцена начнется автоматически. Обратитесь к шагу 6.7, чтобы убедиться, что контроллер освещения DMX работает правильно.
8. Дегустация бутылок (опционально)
- Подготовьте дополнительно 500 мл свежей среды перед началом эксперимента (Дополнительная таблица 2).
ПРИМЕЧАНИЕ: Если 24-часовая программа освещения с суточным циклом 16:8 часов была начата в 9 утра, то время отбора проб до заката и рассвета выпадало бы на 8 утра и 4 часа дня (Дополнительная таблица 1). Здесь рассвет и сумерки относятся к 30-минутным шагам, которые переходят от ВКЛ к ВЫКЛ и наоборот. - Закройте клапан на газопроводе.
- Подключите шприц (10 мл) к клапану пробоотборника (рисунок 4А).
- Откройте клапан отбора проб и извлеките 8 мл культуры.
ПРИМЕЧАНИЕ: Рекомендуется от 5 до 10 мл. Удаление жидкости создает вакуум в пространстве над головой, что затрудняет извлечение объемов >10 мл. - Закройте клапан пробоотборника и отсоедините шприц.
- Подключите шприц, содержащий 8 мл свежей среды (с этапа 8.1), к клапану пробоотборника.
- Откройте клапан отбора проб и впрыскивайте свежую среду.
ПРИМЕЧАНИЕ: Замена объема отобранной культуры свежей средой служит для поддержания равного объема и давления в пространстве над головой и промывки линии отверстия для отбора проб. - Перед отсоединением шприца закройте клапан отверстия для отбора проб.
- Повторяйте шаги 8.2–8.8 во время каждой выборки.
9. Завершение эксперимента
- Установите флажки для всех активных портов в окне сбора данных и нажмите «Стоп».
- Чтобы экспортировать данные, выберите Файл и автономные данные. Выберите все соответствующие файлы журнала. Экспортируйте данные в программное обеспечение для работы с электронными таблицами и сохраните.
- Для каждой бутылки преобразуйте общий объем кислорода, измеренный в мл, в моли, используя закон идеального газа. Прогнозируйте вес выращенной биомассы (gAFDW), если на каждый моль произведенной биомассы генерируется 1,05 моляO2 . Возьмите молярную массу биомассы как 24,6 г моль-1.
- Вручную курируйте данные о скорости потока. Используйте единицы мл/ч и 3-точечную скользящую среднюю.
Результаты
Здесь скорость потока кислорода является мерой скорости фотосинтеза культуры. Более высокие темпы фотосинтеза и, следовательно, фиксация углерода приводят к более высоким темпам роста. Это означает, что пользователь может сравнивать скорость потока кислорода между различными методами лечения и рабочими днями в качестве прокси для роста. Вкратце, газовый датчик работает, улавливая и выпуская пузырьки газа в двухкамерной измерительной ячейке (рисунок 4B). Пузырьки газа из входного отверстия в основании датчика проходят вверх через упаковочную жидкость. Пузырьки накапливаются в одной камере измерительной ячейки до объема ~3,2 мл. Как только этот порог достигнут, измерительные ячейки кончики. Это высвобождает газ и перезагружает систему. Каждый совет записывается программным обеспечением для сбора данных.
В примерах данных сравнивались темпы роста трех обработок с различной интенсивностью дневного света и начальными концентрациями биомассы (КСГМГ). Эти методы лечения были выбраны произвольно в демонстративных целях. Это были (A) 300 мкмольфотоны m-2 s-1 и 0,03 гAFDW L-1, (B) 600 мкмольфотоны m-2 s-1 и 0,13 гAFDW L-1, и (C) 600 мкмольфотоны m-2 s-1 и 0,40 гAFDW L-1. Эти излучения измерялись сферическим зондом в центре трубы из ПВХ до того, как бутылки были размещены на платформах. Глубина и плотность культуры влияют на затухание света. Следовательно, фактическая интенсивность света, испытываемая микроводорослями, может отличаться от тех, о которых сообщалось. Каждая обработка проводилась в трех экземплярах — в пределах одного ПБР, содержащего три флакона.
Здесь успешный эксперимент характеризовался близко воспроизводимыми суточными закономерностями газообразования (рисунок 7А–С). В освещенные часы (день) добыча газа неуклонно увеличивалась, а в течение неосвещенных часов (ночью) добыча газа прекращалась (рисунок 7А–С). Два газа образуются микроводорослями, кислород от фотосинтеза и углекислый газ от дыхания28. Фотосинтез ограничен освещенными часами, тогда как дыхание происходит непрерывно, но наиболее активно ночью28. Фотосинтез накапливается, тогда как дыхание катаболизирует биомассу28. Первоначально состав газа в пространстве над головой идентичен составу атмосферы. При каждом переворачивании измерительной ячейки O2 вытесняет атмосферный газ. Таким образом, показания газовых датчиков были отнесены к образованию O2 , даже если выходящий газ не был чистым O2. Минимальное давление газа на входе для газового датчика чрезвычайно низкое, 8-9 мбар, что делает давление в пространстве баллона лишь незначительно над атмосферным (1,01 бар на уровне моря). Следовательно, показания газового датчика начинаются вскоре после того, как пузырьки O2 покидают среду.
CO2 , выделяемый из дыхания, не влияет на показания газовых датчиков по двум причинам. Во-первых, в щелочной среде CO2 реагирует на бикарбонат, снижая рН (рисунок 8). Во-вторых, если CO2 действительно улетучивается, газовый датчик, упаковывающий жидкость Silox, растворяет пузырьки CO2 до того, как они могут достичь измерительной ячейки, выделяя CO2 на поверхности жидкости29. Это подтверждается отсутствием ночных показаний датчика газа. Те, которые произошли, были зарегистрированы вскоре после выключения света, что указывает на то, что показания представляют собой остаточное дневное высвобождение кислорода (рисунок 7).
В экспериментальной установке (с использованием локальных данных о температуре и давлении) пространство над головой 80 мл при давлении окружающей среды требовало 340 мл экс растворенногоO2 для установления парциального давленияO2 99%. Здесь общий объем кислорода, произведенного в течение 4 дней, варьировался от 316 (SEM ± 11) мл при лечении A до 902 (SEM ± 51) mL при лечении C (таблица 1). Поэтому к концу эксперимента пространство над головой всех бутылок содержало бы в основном O2. Увеличение концентрации пространства над головой O2 и, следовательно, снижение концентрации N2 повлияли бы на парциальное давление и насыщение этих газов. При 99% пространстве над головой O2 было рассчитано 5-кратное увеличение DO. Для культур объемом 1,1 л это привело бы к дополнительным 23 мл DO. И наоборот, было подсчитано, что сдвиг к 1% N2 над головным пространством привел бы к освобождению 15 млN2 . Это означает, что под почти чистым кислородным пространством над головой было смещено больше O2 , чемN2 . Таким образом, поскольку в среде остается большеO2 , этот эффект привел бы к небольшой недооценке количества производимого фотосинтетического кислорода.
Основная проблема этого метода возникла, когда культуры стали плотными. С увеличением биомассы и, следовательно, большим дыханием спрос на O2 увеличился. Потребление O2 в ночное время создавало давление в пространстве над головой. Это привело к тому, что упаковочная жидкость газового датчика прошла через газовую линию. Когда производство O2 возобновилось, упаковочная жидкость должна была быть возвращена в газовые датчики. Это вызвало задержку в первых показаниях газового датчика. Однако на четвертую ночь величина этого пониженного давления привела к тому, что упаковочная жидкость достигла и капала в две из трех реплик обработки B, создавая поверхностное нефтяное пятно. Из-за пониженного уровня упаковочной жидкости газовые датчики замыкаются, высвобождая неизмеренный O2 непосредственно в атмосферу. Это привело к тому, что сбор данных стал плоским (рисунок 7B).
Пониженное давление также может быть вызвано температурным сокращением объема пространства над головой. Однако эффект здесь был минимальным. Каналы теплоотвода и воздушный поток адекватно рассеивают избыточное тепло. Из двух испытанных режимов освещения максимальное изменение температуры уменьшило объем пространства над головой на 1% или менее, что эквивалентно смещению упаковочной жидкости в 800 мл в пространстве над головой 80 мл. Максимальное суточное колебание температуры составляло 1,4 °C для режимов 300 мкмольфотонов m-2 s-1 (рисунок 6) и 3,2 °C для режимов 600 мкмольфотонов m-2 s-1. Среднее дневное повышение температуры для режимов 300 и 600 мкмольфотонов m-2 s-1 составило 0,7 и 1,8 °C соответственно. Температура культуры вернулась к исходному уровню в одночасье (рисунок 6).
Данные о темпах роста с высоким разрешением могут выявить тенденции, которые в противном случае могут остаться незамеченными. Рассмотрим методы лечения B и C. Несмотря на различия в КСГМГ, оба они генерируют одинаковое количество общей биомассы (гAFDW), что вызывает идентичный сдвиг рН среды (таблица 1). Учитывая только начальную и конечную точки данных, человек может справедливо предположить отсутствие разницы в средней скорости роста между двумя методами лечения (таблица 1). Тем не менее, онлайн-данные о скорости потока кислорода показали, что каждое лечение имело различные суточные темпы роста. Эти изменения также отражались в измерениях рН два раза в день (рисунок 8). В первый день скорость роста лечения В была ниже, чем при лечении С. На третий день это изменилось, и скорость роста лечения В превысила скорость роста лечения С (рисунок 7B, C). Данные о скорости потока кислорода показали, что наибольший темп роста наблюдался на третий день при лечении В (рисунок 7B).
Общий объем кислорода, вырабатываемого каждой бутылкой в трех обработках, использовался для оценки их соответствующего изменения общей биомассы (гAFDW). Это было достигнуто с использованием общего уравнения для синтеза фотосинтетической биомассы: CO2 + 0,2 NH3 + 0,6 H2O = CH1,8 O0,5 N0,2 + 1,05 O2. Ожидается, что увеличение парциального давления в пространстве над головойO2 и последующее повышение насыщенности DO приведут к небольшой недооценке роста биомассы. Это справедливо для пяти из семи примеров (таблица 2). В среднем, предполагаемый рост биомассы был в пределах 10% от измеренного роста биомассы. Некоторые оценки отличались только на 1-3 мг от измеренного роста. Два примера переоценили рост, т.е. было произведено больше кислорода, чем мог бы объяснить рост биомассы. ЛюбойO2 , потребляемый дыханием в течение ночи, должен отражаться в задержке производстваO2 на следующий день. Здесь эксперименты были прекращены в конце ночи. Таким образом, ночной катаболизм биомассы в течение последних 8 часов каждого эксперимента остается неизмеримым. Это может привести к завышению роста биомассы, особенно в плотных культурах. Таким образом, рекомендуется, чтобы эксперименты прекращались в конце освещенных часов.

Рисунок 1: Основание стойки реактора. (А) Размеры компонентов основания в мм. (Б) Ориентация металлических угловых опор, крепящих две вертикальные опоры. (C) Одна из четырех коротких стальных длин соединяет заднюю половину трубы из ПВХ с подставкой реактора. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Электрические компоненты. (A) Вид Сзади PBR с указанием верхнего поперечного балка и конфигурации электрических компонентов. (B) Вид спереди PBR после установки света. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
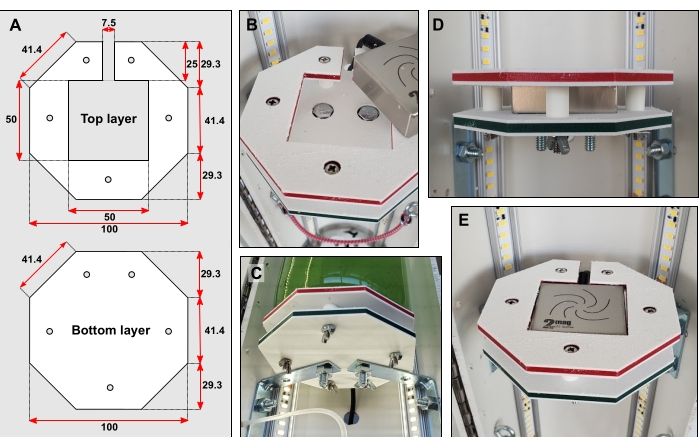
Рисунок 3: Детали платформы бутылки. (A) Размеры верхнего и нижнего слоя в мм. (B) Углубление головки болтов в оба слоя. (C) Скобы соединяют нижний слой непосредственно с задней половиной трубы из ПВХ. D) Пять коротких кусков жестких труб, установленных на узких болтах, удерживают верхний и нижний слои друг от друга. (E) Когда платформа для бутылок готова, поверхность должна быть заподлицо. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Газовая магистраль и дополнительный порт для отбора проб. (A) Газовые линии соединяют каждое пространство баллона с внешними газовыми датчиками. Если требуется отверстие для отбора проб, газовые магистрали должны включать односторонний клапан непосредственно после иглы. (B) Датчик объемного газа. Уровень упаковки жидкости должен касаться трассировочного винта. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
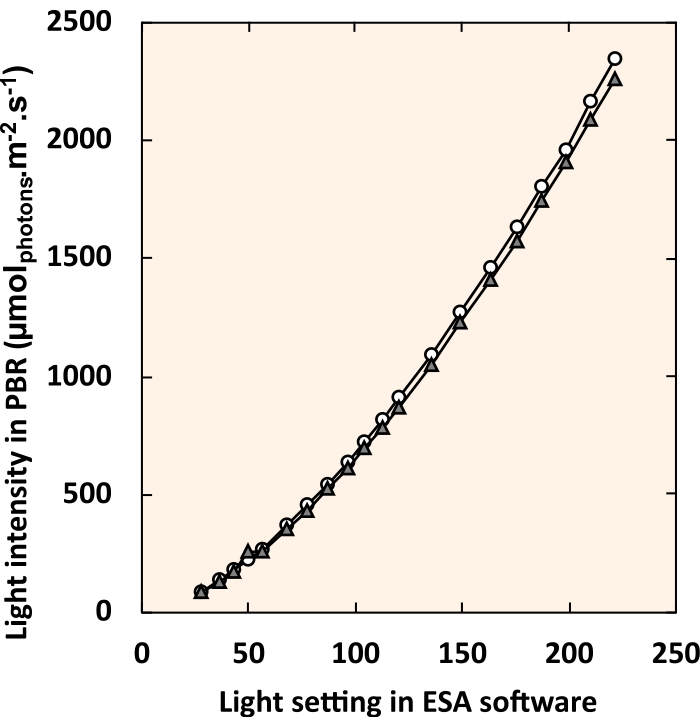
Рисунок 5: Стандартная кривая, связывающая настройки программного обеспечения управления светодиодами с внутренней интенсивностью света. Белые круги и серые треугольники представляют собой индивидуальную PBR. Для каждой настройки освещения все четыре светильника были установлены на одинаковое значение. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
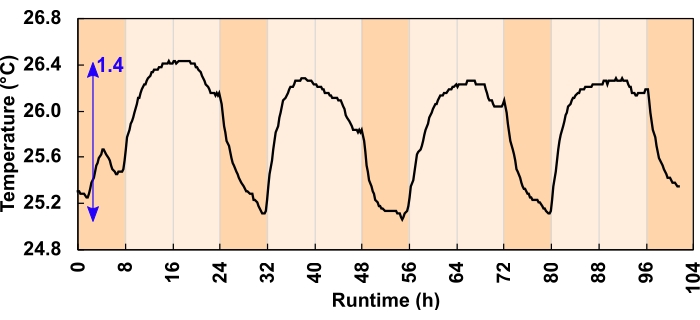
Рисунок 6: Изменение температуры культуры для световыхрежимов фотонов m-2 s-1 300 мкмоль. В течение 24 ч, 16:8-ч суточной программы светодиоды повышали дневную температуру культуры. Синяя стрелка указывает на разницу между минимальной и максимальной температурой. Ошибка световой программы вызвала падение температуры перед сумерками; это было исправлено до начала эксперимента. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
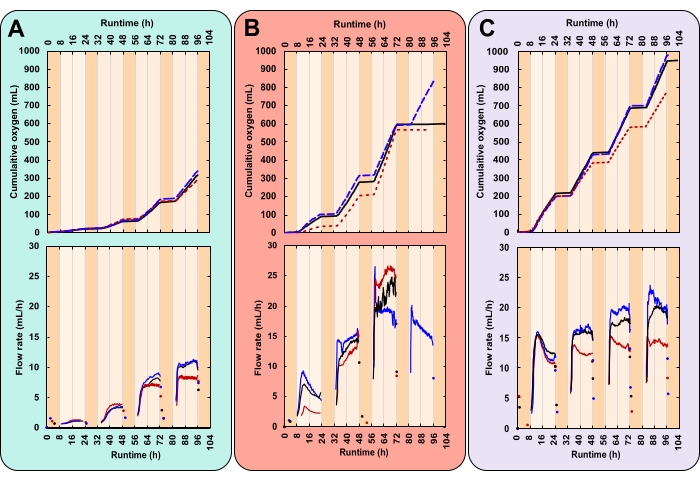
Рисунок 7: Производство кислорода для трех уникальных экспериментальных условий. Каждый реактор получил различную комбинацию интенсивности света и начальной концентрации биомассы (IBC); (A) 300 мкмольфотоны m-2 s-1 и IBC 0,03 гAFDW L-1, (B) 600 мкмольфотоны m-2 s-1 и IBC 0,13 гAFDW L-1, (C) 600 мкмольфотоны m-2 s-1 и IBC 0,40 гAFDW L-1. Верхние графики отображают кумулятивное производство кислорода (мл) и расход газа (мл / ч). Сплошные черные линии, пунктирные синие линии и пунктирные красные линии являются репликами. Время выполнения для каждого эксперимента составляло 104 часа, которое включало четыре полных цикла 16:8 ч день-ночь. Темно-оранжевое затенение представляет ночные часы и светло-оранжевые дневные часы. Отметим, что при лечении В выработка кислорода выравнивается на 4-й день для двух из трех реплик. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 8: Реакция pH. Каждый реактор получил различную комбинацию интенсивности света и IBC; (зеленые алмазы) 300 мкмольфотоны m-2 s-1 и IBC 0,03 гAFDW L-1, (красные треугольники) 600 мкмольфотоны m2 s-1 и IBC 0,13 гAFDW L-1, (фиолетовые круги) 600 мкмольфотоны m-2 s-1 и IBC 0,40 гAFDW L-1 . Темно-оранжевое затенение представляет ночные часы и светло-оранжевые дневные часы. Полосы ошибок представляют стандартную погрешность среднего значения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Лечение | Интенсивность света (мкмоль фотоны m-2 s-1) | IBC (gAFDW L-1) | Δ общая биомасса (гAFDW) | Δ pH | Общий производимый кислород (мл) |
| A | 300 | 0.031 | 0.289 (± 0.01) | 0,15 (± 0,01) | 316.2 (±11.4) |
| B | 600 | 0.130 | 0,674 (± 0,02) | 0,52 (± 0,27) | 834.6* |
| C | 600 | 0.400 | 0,675 (± 0,02) | 0,55 (± 0,03) | 902.2 (±50.5) |
| * Только одна из трех реплик была успешной | |||||
Таблица 1: Сдвиг метрики роста с часа 0 на 104. Квадратные скобки обозначают стандартную погрешность среднего значения.
| Лечение | Интенсивность света (мкмольфотоны m-2 s-1) | IBC (gAFDW L-1) | Измеренный рост биомассы (гAFDW) | Прогнозируемый рост биомассы (гAFDW) | Недооценка (%) |
| A | 300 | 0.031 | 0.289 | 0.288 | 0.5 |
| A | 300 | 0.031 | 0.311 | 0.270 | 13.1 |
| A | 300 | 0.031 | 0.268 | 0.247 | 7.9 |
| B | 600 | 0.13 | 0.708 | 0.705 | 0.4 |
| C | 600 | 0.4 | 0.718 | 0.796 | -10.9 |
| C | 600 | 0.4 | 0.640 | 0.830 | -29.7 |
| C | 600 | 0.4 | 0.668 | 0.659 | 1.3 |
Таблица 2: Оценки роста, основанные на общем измеренном количестве кислорода. Только одна реплика из 300 мкмольфотонов m-2 s-1 и IBC = 0,13 гAFDW L-1 прошла до завершения.
Дополнительный рисунок 1: Снимок экрана из программного обеспечения управления светодиодами. Каждым из четырех светильников можно управлять независимо, перемещая кнопки диммера или вводя числовое значение в текстовое поле. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 2: Снимок экрана окна конфигурации программного обеспечения для сбора данных. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 3: Снимок экрана окна регистрации программного обеспечения для сбора данных. Ярко-зеленые прямоугольники указывают на онлайн газовые датчики. Данные отображаются в режиме реального времени. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительная таблица 1: Пример режима освещения 24 ч. Для дневной программы 16:8 часов предусмотрено 48 комплектов по 30 минут каждый. Звездочками обозначено рекомендуемое время выборки. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Дополнительная таблица 2: Высокая щелочность и высокая рН средняя композиция. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Дополнительная таблица 3: Раствор микроэлементов. Добавьте к конечной концентрации 1 мл/л в базовую среду. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Обсуждение
В рамках этого протокола сосредоточение внимания на следующих шагах увеличивает вероятность получения воспроизводимых, высококачественных данных. При строительстве стенда реактора (этап 1) основание должно быть прочным с хорошо выровненными вертикальными опорами. Щелевая сталь имеет острые края, поэтому добавление защитных колпачков имеет важное значение. Поверхности платформы для бутылок должны быть полностью плоскими, магнитная мешалка и головки болтов должны располагаться ниже поверхности верхнего слоя (шаги 3.2–3.6). Согласно инструкции производителя, газовый датчик упаковки жидкости должен быть заполнен до «прослеживающего винта для уровня жидкости» для точных измерений кислорода. Этот уровень жидкости следует регулярно проверять, так как испарение упаковочной жидкости может привести к короткому замыканию измерительной ячейки. Все три газопровода, выполненные на этапе 5.2, должны иметь одинаковую длину; это enures, которое реплицирует, имеет одинаковые объемы пространства над головой. Перед началом эксперимента рекомендуется проверить запрограммированный режим освещения путем регистрации интенсивности света в течение 24 часов (этап 6.11). Если повышение температуры жидкости вызывает обеспокоенность, то это испытание должно также включать герметичный флакон с внутренним датчиком температуры (этап 6.11). При ведении журнала не выходите из окна программного обеспечения для сбора данных; это приведет к прекращению ведения журнала. При взятии проб культуры будьте осторожны, чтобы не выпустить газ в пространстве над головой, открыв клапаны в неправильной последовательности (шаги 8.2-8.8). При рассмотрении экспериментальных данных следует иметь в виду, что программное обеспечение для сбора данных автоматически генерирует скользящую среднюю скорости потока. Это завышает значение одного или двух показаний скорости потока, генерируемых за ночь. Курируйте журналы датчиков газа вручную, чтобы исправить это.
Наиболее распространенной неудачей этого метода является возможность короткого замыкания газового датчика, если уровень упаковки жидкости снижается. Это может произойти двумя способами. Во-первых, испарение может медленно снижать уровень жидкости. Однако это маловероятно в краткосрочном (<7 дней)эксперименте 29. Во-вторых, высокая скорость дыхания может втягивать кислород в раствор и генерировать под давлением пространства над головой. Когда световая энергия недоступна, микроводоросли используют аэробное дыхание для подачи энергии, необходимой для поддержания и восстановления клеток28. Следовательно, в плотных культурах в течение неосвещенных часов потребление кислорода и, как следствие, недостаточное давление могут быть значительными. Это всасывает упаковочную жидкость из газовых датчиков в газовую магистраль. Расстояние, которое проходит упаковочная жидкость, пропорционально количеству ночного дыхания. Если упаковочная жидкость попадает в бутылки, это создает масляное пятно на поверхности жидкости.
Если ожидается высокий уровень дыхания в ночное время, могут быть внесены изменения в протокол. Самый простой способ избежать недостаточного давления — оставить места для бутылок открытыми на ночь. Это также имеет преимущество в ослаблении уровней DO за счет уменьшения частичного давления в пространстве над головой O2. Считается, что высокие концентрации DO наносят ущерб росту, поскольку O2 может препятствовать активности Рубиско и может вызвать окислительный стресс30,31. Нередко культурные суспензии достигают 4-кратного перенасыщения даже при контакте с атмосферой25,32. Чтобы открыть пространство над головой, отсоедините газовую магистраль от иглы, охватывающей резиновую пробку. Ночные часы могут служить окном для пополнения газового датчика, упаковывающего жидкость или манипулирования непрерывными экспериментами с небольшим влиянием на сбор данных. Например, можно изменить плотность культуры, освежить питательные вещества, добавить поправку или ввести патоген. Баллоны должны быть повторно запечатаны, а линия датчика газа снова подключена до того, как снова загорится свет. Измерения кислорода, собранные из экспериментов с закрытыми и открытыми ночными пространствами, будут отличаться.
Когда бутылки остаются закрытыми, ночное потребление кислорода уменьшает количество молей O2 в головном пространстве. Это приводит к тому, что упаковочная жидкость ползет вверх по линии датчика газа для поддержания давления в пространстве над головой. Когда включается свет, производство кислорода возобновляется. Упаковочная жидкость должна быть отодвинута обратно в газовый датчик до начала показаний расхода. Поэтому это отставание пропорционально степени ночного дыхания. Таким образом, когда пространство над головой остается закрытым, показания O2 представляют собой чистую выработкуO2 (фотосинтетическое производство - потребление дыхательных путей). И наоборот, когда пространство над головой открыто ночью, атмосферный газ заменяет то, что потребляется в пространстве над головой O2 , и никакая упаковочная жидкость не попадает в газовую линию. В результате потребление орвиальногоО2 не учитывается в данных о производствеО2 . Это может снизить точность оценок роста биомассы AFDW. Тем не менее, это не должно влиять на полезность использования дневного производства O2 в качестве метрики для сравнения роста между обработками.
Все лабораторные ПБР страдают от одного и того же ограничения; искусственное освещение не может воспроизвести солнечный спектр. Микроводоросли используют длины волн света между 400-700 нм для фотосинтеза. Эта область называется фотосинтетически активным излучением (PAR)33. Солнечный свет и искусственный свет различаются по относительному вкладу длин волн в этом диапазоне. Это, наряду с благоприятными температурами и постоянным источником света, означает, что лабораторные данные о росте часто не могут быть надежно экстраполированы на наружные условия. Однако эти PBR могут устранить одно из ограничений лабораторного источника света PBR. Интенсивность солнечного света сильно варьируется в течение дня, а облачный покров генерирует переходные колебания в падающем PAR. Программное обеспечение управления освещением и контроллер освещения DMX могут обеспечивать интенсивность света от 0 до 2400 мкмольфотонов m-2 s-1 и выше. Световые режимы могут быть разбиты на отдельные приращения длиной до 1 с. Настраиваемая интенсивность света позволяет пользователю имитировать внешние световые паттерны более точно, чем стандартные настройки PBR. Здесь смоделированные 30-минутные интервалы рассвета и заката исчезают дневными и ночными циклами вместе (Дополнительная таблица 1).
Хотя плотность AFDW стала стандартной мерой роста, этот метод может потребовать значительных объемов культуры, 2-3-дневного периода обработки и генерации одной точки данных за раз. Кроме того, если условия становятся неблагоприятными и клетки умирают, плотность AFDW не различает активно фотосинтезирующие клетки и те, которые разлагаются. Количественная оценка скорости производства фотосинтетического кислорода служит альтернативным прокси роста. Эта конструкция PBR может непрерывно регистрировать производство кислорода с небольшим вмешательством пользователя, сохраняя при этом объем культуры. Разрешение данных может быть улучшено путем выбора газового датчика с меньшим объемом измерительной ячейки, например, 1 мл. Кроме того, если культуры хорошо смешаны, пользователи могут решить установить спектрофотометр для непрерывных показаний оптической плотности. Если требуется контроль температуры среды, может быть добавлен рециркуляционный чиллер. Эти ПБР являются ценным дополнением к лаборатории, стремящейся расширить свой исследовательский потенциал в области микроводорослей без больших финансовых инвестиций. Они особенно подходят для тех, кто работает с высокой щелочностью, высоким рН, такими как спирулина. Эти ПБР обеспечивают гибкость светового режима и допустимы для быстрых, воспроизводимых, лабораторных сравнений роста.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Это исследование было поддержано Советом по естественным наукам и инженерным исследованиям (NSERC), Канадским фондом инноваций (CFI), Канадским фондом первого передового опыта исследований (CFREF), Alberta Innovates, Фондом генерала сэра Джона Монаша, правительством Альберты и Университетом Калгари. Спасибо Марку Тоонену за электрические работы и Уильяму Ричардсону за расчеты растворимости.
Материалы
| Name | Company | Catalog Number | Comments |
| Aluminum channels Imperial: 0.90” x 39.37” Metric: 2.3 cm x 100 cm Quantity: 4 | LED World | AC-AR1-1M | Required as a heat sink |
| Bungee cords, small Quantity: 5 | - | - | To secure bottles |
| Computer - desktop/laptop Quantity: 1 | - | - | - |
| Data Logger, HOBO U30 USB Weather Station Quantity: 1 | HOBO, Hoskin | U30-NRC-VIA-10-S100-000 | Records light sensor information |
| Digital interface module, Rigamo, 4-channel Quantity: 1 | Ritter | N/A | This is to transmit gas sensor data to the computer |
| DMX decoder, 12~24 VDC, DMX-CV-4X5A Quantity: 1 | LITECH, LED World | LT-840-6A | Transmit messages which alter the light pattern |
| DMX lighting controller, SUSHI-RB-RJ Quantity: 1 | Arcolis, Nicolaudie America Inc. | SUSHI-RB-RJ DMX | Encodes the lighting program |
| Gas sensor packing liquid (Silox) Quantity: 1 L | Ritter | https://www.ritter.de/en/data-sheets/silox | |
| Gas sensor, volumetric Quantity: 3 | Ritter | MGC-1 V3.4 PMMA (https://www.ritter.de/downloads/mgc-milligascounter-en) | Measures oxygen production |
| Glass bottles, round 1 L with GL45 neck Quantity: 3 | Corning, Capitol Scientific | 1395-1L | Culture vessels |
| Hardware - end caps for slotted steel Quantity: 10 | Paulin, Home Depot | 142-612 | To cover sharp edges of slotted steel |
| Hardware - eye hooks Quantity: 6 | - | - | To secure bottles |
| Hardware - metal corner braces (large) Imperial: 4" x 4" Metric: 10 cm x 10 cm Quantity: 8 | - | - | Larger brackets to construct metal stand |
| Hardware - metal corner braces (small) Imperial: 2 1/2" x 2 1/2" Metric: 6.4 cm x 6.4 cm Quantity: 6 | - | - | Small brackets to connect bottle platforms to PVC pipe |
| Hardware - metal corner gussets Imperial: 3" x 3" Metric: 7.6 cm x 7.6 cm Quantity: 6 | Paulin, Home Depot | 142-616 | Flat brackets to construct metal stand |
| Hardware - piano hinge Imperial: 36" Metric: 91 cm Quantity: 1 | - | - | Connects two halves of PVC pipe |
| Hardware - rivets Quantity: 40 | - | - | To attach piano hinge to PVC tubing |
| Hardware - set of bolts, nuts, washers Quantity: 60 | - | - | Long thin bolts are required to secure bottle platforms around magentic stirrers |
| Hardware - set of bolts, nuts, washers Quantity: 30 | - | - | Larger shorter bolts are required to build the metal stand |
| LED driver, constant voltage, 96W 24VDC UL Listed IP65 Driver Class 2 regulated power supply Quantity: 1 | Magnitude Lighting, LED World | CVN96L24DC | Regulates power to the lights |
| LED lights, Cinco Bright LED Flex Strip Quantity: 4 m roll | EvenBright, LED World | FA128M57-4M-24V-X | Roll is trimmed into 4 x 1 m lengths and secured inside the PVC tube |
| Light meter, handheld with submersible sperical probe Quantity: 1 | LI-COR | LA-250A | Calibrate the reactors light intensity |
| Light sensors Photosynthetic Light (PAR) Smart Sensor Quantity: 2 | HOBO, Hoskin | S-LIA-M003 | Only one is required however two would be good practice in case one malfunctioned |
| Magnetic stirrers (MIXdrive 1 XS) with external control units and power supply (MIXcontrol eco) Quantity: 3 | 2Mag, 2MAG USA | MF 40300 | Stirrers sit sandwiched in bottle platforms |
| Metal plate Imperial: 24" x 8" Metric: 61 cm x 20.3 cm Quantity: 1 | - | - | This is a surface on which to secure electronics, it is attached to the back of the reactor |
| Pipe, white PVC Imperial: 6" diameter x 42" high Metric: 15.2 cm x 106.7 cm Quantity: 1 | - | - | Cut lengthwise in two halves, used to house lights and bottles |
| Plastic (HDPE) sheets Imperial: 4" x 4" x 1/4" Metric: 10 cm x 10 cm x 1 cm Quantity: 6 | Inventables | 30291-01 | For bottle platforms which house magentic stirrers |
| Rubber stoppers - GL45 size Quantity: 3 | Duran, VWR | 76289-760 | Seals culture vessels |
| Screw caps - with aperture and GL45 neck Quantity: 3 | Corning, Capitol Scientific | 1395-45HTSC | Generates seal of culture vessels |
| Slotted angle steel lengths Imperial: 1-1/2" X 48" x 0.074" Metric: 3.8 cm x 122 cm x 0.19 cm Quantity: 6 | Paulin, Home Depot | 142-202 | Makes up the body of the metal stand |
| Slotted flat steel lenghts Imperial: 1-3/8" x 48" x 0.074" Metric: 3.5 cm x 122 cm x 0.19 cm Quantity: 3 | Paulin, Home Depot | 142-222 | Makes up the body of the metal stand |
| Software - Easy Stand Alone (ESA) | https://www.dmxsoft.com/#apps | AKA LED control software | |
| Software - Rigamo v3.1 | AKA data acquisition software | ||
| Software - Storage Upgrade Tools (SUT) | https://store.dmxsoft.com// | ||
| Stir bar Imperial: 1" x 5/16" Metric: 2.5 cm x 0.8 cm Quantity: 3 | Fisherbrand | 14-513-59 | Stirs culture |
| Switch box Quantity: 1 | - | - | Turns power on/off to reactor |
| Syringe, 10 mL Quantity: Multiple | - | - | Optional if you wish to extract culture |
| Tube adaptor fittings, plastic - Stopcock 1-way Quantity: 6 | Masterflex, Cole Palmer | RK-12023-33 | Close/open culture vessel line |
| Tube adaptor fittings, plastic - variety of male and female luer lock fittings Imperial: to fit 1/16" and 1/8" ID tubing Metric: to fit 1.59 mm and 3.18 mm tubing Quantity: Multiple packets | Masterflex, Cole Palmer | RK-30800-16; RK-30800-18; RK-45518-26; RK-45501-00; RK-45501-04 | Many different combinations can achieve the same end result, best to order a variety of fittings |
| Tube adaptor fittings, plastic - variety of straight connectors Imperial: to fit 1/16" and 1/8" ID tubing Metric: to fit 1.59 mm and 3.18 mm tubing Quantity: Multiple packets | Masterflex, Cole Palmer | RK-40616-04 | Many different combinations can achieve the same end result, best to order a variety of fittings |
| Tubing, flexible, transparent Imperial: ID=1/16", OD=1/8" Metric: ID = 1.59 mm, 0D = 3.18 mm Quantity: 4 m | Masterflex, Cole Palmer | RK-06422-02 | Line from culture vessel to gas sensor |
| Tubing, flexible, transparent Imperial: ID=1/8", OD=1/4" Metric: ID = 3.18 mm, 0D = 6.35 mm Quantity: 2 m | Masterflex, Cole Palmer | RK-06422-05 | Gas sensor standard tubing size |
| Tubing, rigid, transparent Imperial: ID=1/16", OD=1/8" Metric: ID = 1.59 mm, 0D = 3.18 mm Quantiy: 1 m | Masterflex, Cole Palmer | RK-06605-27 | Spans rubber stopper allowing gas to exit |
| Tubing, rigid, transparent Imperial: ID=1/8", OD=1/4" Metric: ID = 3.18 mm, 0D = 6.35 mm Quantity: 1 m | Masterflex, Cole Palmer | RK-06605-30 | Spans rubber stopper allowing gas to exit |
| Zip ties, small Quantity: 1 packet | Secure tube fittings |
Ссылки
- Benemann, J. R. . Opportunities and challenges in algae biofuels production. A position paper in line with Algae World. , (2008).
- Laurens, L. M. L. State of technology review - algae bioenergy. An IEA bioenergy inter-task strategic project. IEA Bioenergy. , (2017).
- Robertson, D. E., et al. A new dawn for industrial photosynthesis. Photosynthesis Research. 107, 269-277 (2011).
- Troschl, C., Meixner, K., Drosg, B. Cyanobacterial PHA production-review of recent advances and a summary of three years' working experience running a pilot plant. Bioengineering. 4 (2), (2017).
- Rizwan, M., Mujtaba, G., Memon, S. A., Lee, K., Rashid, N. Exploring the potential of microalgae for new biotechnology applications and beyond: a review. Renewable and Sustainable Energy Reviews. 92, 394-404 (2018).
- Niesa, F., et al. Characterization of Phormidium lacuna strains from the North Sea and the Mediterranean Sea for biotechnological applications. Process Biochemistry. 59, 194-206 (2017).
- Laurens, L. M. L., Chen-Glasser, M., McMillan, J. D. A perspective on renewable bioenergy from photosynthetic algae as feedstock for biofuels and bioproducts. Algal Research. 24, 261-264 (2017).
- Barreiro-Vescovo, S., Barbera, E., Bertucco, A., Sforza, E. Integration of microalgae cultivation in a biogas production process from organic municipal solid waste: From laboratory to pilot scale. ChemEngineering. 4 (2), 26 (2020).
- Zurano, A. S., et al. Year-long assessment of a pilot-scale thin-layer reactor for microalgae wastewater treatment. Variation in the microalgae-bacteria consortium and the impact of environmental conditions. Algal Research. 50, (2020).
- Deprá, M. C., Severo, I. A., Dias, R. R., Zepka, L. Q., Jacob-Lopes, E. Photobioreactor design for microalgae culture. Microalgae. , 35-61 (2021).
- Osburn, F. S., Wagner, N. D., Scott, J. T. Biological stoichiometry and growth dynamics of a diazotrophic cyanobacteria in nitrogen sufficient and deficient conditions. Harmful Algae. 103, (2021).
- Eustance, E., Badvipour, S., Wray, J. T., Sommerfeld, M. R. Biomass productivity of two Scenedesmus strains cultivated semi-continuously in outdoor raceway ponds and flat-panel photobioreactors. Journal of Applied Phycology. 28 (3), 1471-1483 (2016).
- Qiang, H., Richmond, A., Zarmi, Y. Combined effects of light intensity, light-path and culture density on output rate of spirulina platensis (cyanobacteria). European Journal of Phycology. 33 (2), 165-171 (1998).
- Ooms, M. D., Dinh, C. T., Sargent, E. H., Sinton, D. Photon management for augmented photosynthesis. Nature Communications. 7, 1-13 (2016).
- Moheimani, N. R., Borowitzka, M. A., Isdepsky, A., Sing, S. F. Standard methods for measuring growth of algae and their composition. Algae for biofuels and energy. , 265-284 (2013).
- Griffiths, M. J., Garcin, C., van Hille, R. P., Harrison, S. T. L. Interference by pigment in the estimation of microalgal biomass concentration by optical density. Journal of Microbiological Methods. 85 (2), 119-123 (2011).
- Schumann, R., Häubner, N., Klausch, S., Karsten, U. Chlorophyll extraction methods for the quantification of green microalgae colonizing building facades. International Biodeterioration and Biodegradation. 55 (3), 213-222 (2005).
- Pinckney, J. L., Richardson, T. L., Millie, D. F., Paerl, H. W. Application of photopigment biomarkers for quantifying microalgal community composition and in situ growth rates. Organic Geochemistry. 32 (4), 585-595 (2001).
- Van Wychen, S., Laurens, L. M. L. Determination of total solids and ash in algal biomass: laboratory analytical procedure (LAP). National Renewable Energy Laboratory. , (2015).
- Davis, R., Laurens, L. Algal biomass production via open pond algae farm cultivation: 2019 state of technology and future research. National Renewable Energy Laboratory. , (2020).
- Borovkov, A. B., Gudvilovich, I. N., Avsiyan, A. L. Scale-up of Dunaliella salina cultivation: from strain selection to open ponds. Journal of Applied Phycology. 32 (3), 1545-1558 (2020).
- Davies, F. K., et al. Microbiota associated with the large-scale outdoor cultivation of the cyanobacterium Synechococcus sp. PCC 7002. Algal Research. 58, (2021).
- Ataeian, M., et al. Direct capture and conversion of CO2 from air by growing a cyanobacterial consortium at pH up to 11.2. Biotechnology and Bioengineering. 116 (7), 1604-1611 (2019).
- Fu, F., et al. Sustained photosynthesis and oxygen generation of microalgae-embedded silk fibroin hydrogels. ACS Biomaterials Science & Engineering. , (2021).
- Rearte, T. A., et al. Photosynthetic performance of Chlorella vulgaris R117 mass culture is moderated by diurnal oxygen gradients in an outdoor thin layer cascade. Algal Research. 54, (2021).
- Poughon, L., et al. Limnospira indica PCC8005 growth in photobioreactor: model and simulation of the ISS and ground experiments. Life Sciences in Space Research. 25, 53-65 (2020).
- Yen, U. C., Huang, T. C., Yen, T. C. Observation of the circadian photosynthetic rhythm in cyanobacteria with a dissolved-oxygen meter. Plant Science. 166 (4), 949-952 (2004).
- Vermaas, W. F. Photosynthesis and respiration in cyanobacteria. eLS. , (2001).
- Ritter, . MilliGascounter Type MGC-1 Operation Instructions V 3.4. , (2017).
- Sousa, C., De Winter, L., Janssen, M., Vermuë, M. H., Wijffels, R. H. Growth of the microalgae Neochloris oleoabundans at high partial oxygen pressures and sub-saturating light intensity. Bioresource Technology. 104, 565-570 (2012).
- Latifi, A., Ruiz, M., Zhang, C. C. Oxidative stress in cyanobacteria. FEMS microbiology reviews. 33 (2), 258-278 (2009).
- Morillas-España, A., Lafarga, T., Gómez-Serrano, C., Acién-Fernández, F. G., González-López, C. V. Year-long production of Scenedesmus almeriensis in pilot-scale raceway and thin-layer cascade photobioreactors. Algal Research. 51, (2020).
- Melis, A. Solar energy conversion efficiencies in photosynthesis: minimizing the chlorophyll antennae to maximize efficiency. Plant Science. 177 (4), 272-280 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены