Method Article
Producción de escamas libres de células y adición adyuvante a una proteína principal recombinante de membrana externa de Chlamydia muridarum para el desarrollo de vacunas
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo describe el uso de kits comerciales de expresión de proteínas libres de células para producir proteínas de membrana soportadas en nanodiscos que se pueden usar como antígenos en vacunas de subunidades.
Resumen
Las vacunas de subunidades ofrecen ventajas sobre las vacunas más tradicionales inactivadas o atenuadas derivadas de células enteras en cuanto a seguridad, estabilidad y fabricación estándar. Para lograr una vacuna eficaz de subunidades basadas en proteínas, el antígeno proteico a menudo necesita adoptar una conformación similar a la nativa. Esto es particularmente importante para los antígenos de superficie de patógenos que son proteínas unidas a la membrana. Los métodos libres de células se han utilizado con éxito para producir proteínas de membrana funcionales correctamente plegadas a través de la cotraducción de partículas de nanolipoproteínas (NLP), comúnmente conocidas como nanodiscos.
Esta estrategia se puede utilizar para producir vacunas de subunidades que consisten en proteínas de membrana en un entorno unido a lípidos. Sin embargo, la producción de proteínas libres de células a menudo se limita a pequeña escala (<1 mL). La cantidad de proteína producida en las series de producción a pequeña escala suele ser suficiente para los estudios bioquímicos y biofísicos. Sin embargo, el proceso libre de células debe ampliarse, optimizarse y probarse cuidadosamente para obtener suficiente proteína para estudios de vacunas en modelos animales. Otros procesos implicados en la producción de vacunas, como la purificación, la adición de adyuvantes y la liofilización, deben optimizarse en paralelo. En este artículo se informa sobre el desarrollo de un protocolo ampliado para expresar, purificar y formular una vacuna de subunidades proteicas unidas a la membrana.
Las reacciones libres de células a escala requieren la optimización de las concentraciones y proporciones de plásmidos cuando se utilizan múltiples vectores de expresión de plásmidos, la selección de lípidos y la adición de adyuvantes para la producción de alto nivel de partículas de nanolipoproteínas formuladas. El método se demuestra aquí con la expresión de una proteína principal de membrana externa (MOMP) de clamidia, pero puede aplicarse ampliamente a otros antígenos de proteínas de membrana. La eficacia del antígeno puede evaluarse in vivo a través de estudios de inmunización para medir la producción de anticuerpos, como se demuestra aquí.
Introducción
Los lisados procariotas o eucariotas para la expresión libre de células de proteínas están fácilmente disponibles como productos comerciales para sintetizar proteínas de interés (para una revisión completa, ver 1). Estos sistemas de expresión están disponibles a varias escalas y utilizan lisados de varios organismos, incluyendo E. coli, plantas de tabaco y cultivos de mamíferos. Los lisados libres de células ofrecen múltiples beneficios sobre los enfoques tradicionales de producción de proteínas recombinantes, incluida la facilidad de uso y la producción de proteínas robusta y rápida. Si bien estos enfoques se utilizan principalmente para producir proteínas solubles, este grupo ha sido pionero en un enfoque para su uso para expresar proteínas de membrana.
Este novedoso enfoque realiza modificaciones menores en los sistemas de expresión libre de células existentes mediante la inclusión de ADN que codifica dos productos proteicos para la expresión, una apolipoproteína y la proteína de membrana de interés. La apolipoproteína expresada (derivados de ApoA1 o ApoE4) interactúa con los lípidos añadidos al lisado libre de células para ensamblar espontáneamente (~20 nm) los NLP. Cuando se cotraducen con una proteína de membrana de interés, el NLP y la proteína de membrana forman un complejo de nanopartículas solubles en el que la proteína de membrana está incrustada dentro de la bicapa lipídica de NLP. Por lo tanto, la proteína de membrana es más accesible para aplicaciones posteriores, ya que está contenida en partículas solubles y discretas. Este enfoque puede producir complejos de proteínas oligoméricas funcionales dentro de la bicapa2 de NLP y puede producir el componente de antígeno de una vacuna de subunidad, que posteriormente se mezcla con adyuvantes lipofílicos para formar una vacuna de nanopartículas con antígeno colocalizado y adyuvante adecuado para la evaluación in vivo .
Este método actual es una modificación de un protocolo publicado anteriormente3. Las modificaciones clave se centran en el escalado de la reacción libre de células y la posterior purificación del complejo proteína-NLP. Una modificación adicional incluye la adición de un polímero anfifílico conocido como telodendrimer, que primero se mezcla con los lípidos antes de agregarlo a la reacción libre de células. La co-traducción de los plásmidos en presencia del telodendrimer y los lípidos produce un NLP de telodendrimer (tNLP). La adición del telodendrimer también ayuda a modular el tamaño y la monodispersidad de las nanopartículas de tNLPresultantes 4. Este protocolo está específicamente optimizado para estudios de vacunas a gran escala para producir una proteína antigénica de subunidad unida a la membrana, la clamidia MOMP 5,6. El método produce MOMP recombinante asociado con tNLP para formar un complejo MOMP-tNLP altamente soluble que retiene la oligomerización de MOMP. Una producción típica de escalado de 3 ml produce >1,5 mg de MOMP purificado. El MOMP-tNLP producido sin células es susceptible de adición adyuvante rápida para pruebas de inmunogenicidad in vivo.
Protocolo
Todos los estudios en animales se realizaron en la Universidad de California, Irvine, en instalaciones aseguradas por el Servicio de Salud Pública (PHS) de acuerdo con las pautas establecidas por el Comité Institucional de Cuidado y Uso de Animales.
1. Preparación de la cristalería
NOTA: Todos los materiales utilizados en la producción de formulaciones de grado vacunal para animales están libres de endotoxinas.
- Para destruir la endotoxina contaminante, hornee una cristalería limpia que contenga tampones en un horno a 180 °C durante 4 h.
2. Preparación del tampón
- Prepare 250 ml de los tampones de purificación por afinidad de Ni enumerados en la Tabla 1. Guárdelos a 4 °C durante un máximo de 6 meses.
3. Preparación de la reacción
- Pesar 20 mg de 1,2-dimiristoyl-sn-glicero-3-fosfocolina (DMPC) en un tubo de centrífuga de 1,5 ml libre de endotoxinas. Disuélvalo en 1 ml de agua libre de endotoxinas, sonda sónica al menos cuatro veces a 6 A durante 1 minuto, con pausas de 1 minuto entre ellas, hasta que esté claro. Eliminar cualquier metal contaminante de la sonda mediante centrifugación a 13.000 × g durante 2 min a 22 °C y luego transferir el lípido solubilizado a un nuevo tubo libre de endotoxinas de 1,5 mL.
- Pesar 1 mg de telodendrimer PEG5k-CA8 en un tubo libre de endotoxinas de 1,5 ml. Disolver en agua libre de endotoxinas hasta una concentración de 20 mg/mL. Vértice hasta que se disuelva por completo y diluya a 2 mg/ml.
- En un nuevo tubo libre de endotoxinas, combine 210 μL de solución de 20 mg/mL de DMPC con 210 μL de solución de telodendrimer de 2 mg/mL.
4. Producción libre de células de MOMP-tNLP para formulaciones de vacunas de subunidades
- Preparar MOMP-tNLPs utilizando métodos libres de células modificados a partir de un protocolo previamente publicado5.
- Dos horas antes de configurar la reacción libre de células, abra el kit de expresión de proteínas libres de células procariotas y descongele uno de los tampones de reconstitución. Una vez descongelado, añadir un comprimido de cóctel de inhibidores de la proteasa sin EDTA y dejar que se disuelva por completo.
- Siga este protocolo utilizando un kit diseñado para ejecutar reacciones de 5 x 1 ml.
NOTA: Una producción típica de escalado es de 3 x 1 mL.- Para cada reacción de 1 mL, agregue 525 μL de tampón de reconstitución al frasco de lisado de E. coli y enrolle suavemente para disolver. Agregue 250 μL de tampón de reconstitución a la botella que contiene aditivos de reacción (por ejemplo, ATP, GTP) y enrolle suavemente para disolver.
- Agregue 8,1 ml de tampón de reconstitución a la botella de alimentación de reacción, vuelva a tapar con un tapón de goma (tenga cuidado de no tocar el interior del tapón de goma) e invierta/enrolle suavemente para disolver.
- Agregue 3 ml de tampón de reconstitución a la botella de mezcla de aminoácidos, vuelva a tapar con un tapón de goma e invierta/enrolle suavemente para disolver.
NOTA: Tenga cuidado de no tocar el interior del tapón de goma, ya que esto puede provocar contaminación. - Agregue 1,8 ml de tampón de reconstitución a la botella de metionina, enrolle suavemente para disolver y luego guárdelo en hielo hasta su uso.
- Prepare la solución de reacción.
- Al frasco de lisado de E. coli , agregue 225 μL de mezcla de reacción reconstituida, 270 μL de mezcla de aminoácidos reconstituidos sin metionina y 30 μL de metionina reconstituida. Además, agregue 400 μL de la mezcla de DMPC/telodendrimer, 15 μg de plásmido MOMP y 0,6 μg de plásmido Δ49ApoA1. Enrolle / agite suavemente para mezclar.
NOTA: Asegúrese de que ambos plásmidos estén construidos a partir de la misma columna vertebral de plásmidos. No haga vórtices. - Tome 20 μl de la solución total y déjela a un lado en un tubo de 1,5 ml para la reacción de control que expresa GFP (ver más abajo).
- Al frasco de lisado de E. coli , agregue 225 μL de mezcla de reacción reconstituida, 270 μL de mezcla de aminoácidos reconstituidos sin metionina y 30 μL de metionina reconstituida. Además, agregue 400 μL de la mezcla de DMPC/telodendrimer, 15 μg de plásmido MOMP y 0,6 μg de plásmido Δ49ApoA1. Enrolle / agite suavemente para mezclar.
- Prepare la solución de alimentación. Al frasco de mezcla de pienso, añadir 2,65 ml de mezcla de aminoácidos reconstituidos sin metionina y 300 μl de metionina reconstituida. Enrolle / agite suavemente para disolver.
NOTA: En este momento, el tampón de reconstitución y la metionina no utilizados se pueden devolver al congelador para su almacenamiento. - Transfiera 1 ml de la solución de reacción a la cámara de reacción interna provista en el kit de reacción libre de celdas y selle cuando esté lleno. Transfiera 10 ml de la solución de alimentación a la cámara exterior del recipiente de reacción y selle.
NOTA: ¡No llene demasiado las cámaras! La presencia de burbujas de aire en la parte superior de la cámara de reacción interna y la cámara de alimentación interna afectará negativamente la reacción. Cualquier solución de reacción restante se puede colocar en un tubo de 1,5 ml y dejar que se mezcle junto con el recipiente principal. - Añadir 0,5 μL del plásmido de control de GFP (0,5 mg/mL) a la mezcla de reacción de 20 μL previamente alícuota.
NOTA: Muchos kits se suministran con un plásmido de control para fines de control de calidad. La mayoría de los plásmidos que expresan GFP con un promotor T7 y un sitio de unión al ribosoma (RBS) de E. coli también se pueden utilizar como plásmido de control. - Coloque la reacción en un agitador a 300 rpm, 30 °C durante un máximo de 18 h. Para verificar que la reacción fue exitosa, use una fuente de luz UV para verificar la fluorescencia debido a la síntesis de la GFP de control (Figura 1A) después de tan solo 15 minutos de incubación.
NOTA: Es posible que estas condiciones, en particular la temperatura, deban optimizarse para la expresión de otras proteínas de membrana.
5. Purificación MOMP-tNLP
- Utilice la cromatografía de afinidad de níquel inmovilizada para purificar el complejo de nanopartículas MOMP-tNLP de la mezcla de reacción libre de células utilizando la etiqueta His en la proteína Δ49ApoA1.
- Transfiera 1 ml de una suspensión al 50 % de la resina de purificación His-Tag a una columna de cromatografía desechable de 10 ml y equilibre con 3 ml de tampón de unión.
- Deje que el tampón se drene, tape la salida y agregue 250 μL de tampón aglutinante a la resina.
- Antes de añadir la reacción libre de células a la columna, guarde 20 μL para su posterior análisis por SDS-PAGE. Mezclar la reacción libre de células con la resina equilibrada e incubarla en un balancín de laboratorio a 4 °C durante 1 h.
- Destape la columna, lave la tapa con 500 μL de tampón de unión adicional y agregue este líquido al resto de la columna.
- Recoja el flujo de líquido de la columna para su posterior análisis por SDS-PAGE.
- Lave la columna con 1 ml de tampón de lavado que contenga 20 mM de imidazol seis veces y recoja las fracciones. Ten cuidado de no dejar que la resina se seque entre lavados. En el segundo lavado, agite vigorosamente la resina pipeteando hacia arriba y hacia abajo con una pipeta de 1 ml.
- Eluir los MOMP-tNLPs en seis fracciones de 300 μL de tampón de elución 1 (que contiene 250 mM de imidazol), seguido de una elución final con 300 μL de tampón de elución 2 (que contiene 500 mM de imidazol). En la segunda elución, agite vigorosamente la resina pipeteando hacia arriba y hacia abajo con una pipeta de 1 ml.
6. Análisis por SDS-PAGE
NOTA: Todas las fracciones de elución deben ser analizadas por SDS-PAGE para detectar la cantidad y pureza de la proteína de interés.
- Cargue 1 μL de cada uno de los lavados totales y del flujo continuo y luego 5 μL para todos los lavados y fracciones de elución recogidos.
- Mezcle alícuotas de los MOMP-tNLP eluidos, lavados, flujo continuo y lisado total con 4 tampones de carga de muestras SDS-PAGE. Mezcle y desnaturalice con calor las muestras con un agente reductor de muestras 10x, a menos que se indique lo contrario.
- Analice las fracciones mediante electroforesis en gel utilizando geles Bis-Tris SDS-PAGE de 1,0 mm, 4 a 12%, con tampón de funcionamiento MES-SDS 1x, junto con un estándar de peso molecular adecuado. Deje correr los geles durante 35 min a 200 V.
- Tiñe los geles de acuerdo con las instrucciones del fabricante.
- Retire el gel del casete y colóquelo en 60 ml de tinte de gel. Calienta el gel en el microondas en la mancha de gel durante 30 s y balancea suavemente el recipiente durante 30 s para distribuir el calor de manera uniforme. Calienta el gel de la mancha en el microondas a 80-85 °C durante otros 30 s y coloca el gel en un agitador orbital para que se balancee durante 5 minutos.
- Calienta el gel en el microondas por tercera vez durante 30 segundos y luego vuelve a la coctelera orbital para que se balancee durante otros 23 minutos.
- Transfiera el gel a un recipiente limpio y lave en 100 ml de solución de lavado (10% de metanol, 7% de ácido acético) durante 30 min.
NOTA: Este es un paso crítico, ya que es esencial evitar calentar la solución de lavado. Si no lo hace, puede provocar manchas de fondo e irregularidades en la imagen final del gel. - Después del lavado, enjuague el gel en agua ultrapura dos veces durante 5 minutos cada una.
- Obtenga imágenes de los geles utilizando un generador de imágenes en gel a 600 nm (Figura 2). Utilice SDS-PAGE para cuantificar la cantidad de proteína individual en la solución de nanopartículas si existe un estándar de proteína para la comparación.
NOTA: En este ejemplo, las diluciones seriadas de MOMP expresadas recombinantemente se resuelven mediante SDS-PAGE y las densidades de las bandas se cuantifican utilizando el software del instrumento. - Genere una curva estándar utilizando las densidades de las bandas MOMP. Resuelva las muestras de MOMP-tNLP en el mismo gel SDS-PAGE y calcule el componente MOMP de las partículas utilizando la curva estándar MOMP (Figura 3).
7. Western y dot blots y almacenamiento
- En el caso de la transferencia occidental, resuelva las muestras con SDS-PAGE y transfiera los geles utilizando un sistema comercial de transferencia en seco con ajustes estándar de acuerdo con el protocolo del fabricante.
- Retirar las transferencias de la pila una vez finalizada la transferencia e incubar cada transferencia durante la noche a 4 °C en un tampón de bloqueo adecuado que contenga 0,2 % de Tween 20 y 0,5 mg/ml de anticuerpos MAb40 o 0,2 mg/ml de anticuerpos anti-His-His, dirigidos contra la etiqueta His, de la proteína Δ49ApoA1.
NOTA: Las diluciones de anticuerpos utilizadas para el blot son 1:1.000 para el MAb40 y 1:500-1.000 para el anticuerpo MAbHIS. - Lave cada secado 3 veces durante 5 minutos con PBS-T (1x PBS, 0,2% Tween 20, pH 7,4).
- Incubar los blots durante 1 h en un tampón de bloqueo que contenga un anticuerpo secundario conjugado con un fluoróforo (p. ej., IRDye) en una dilución de 1:10.000.
- Vuelva a lavar las manchas 3 veces durante 5 minutos con PBS-T. Use un generador de imágenes de fluorescencia para obtener imágenes de las manchas después del lavado final.
- Retirar las transferencias de la pila una vez finalizada la transferencia e incubar cada transferencia durante la noche a 4 °C en un tampón de bloqueo adecuado que contenga 0,2 % de Tween 20 y 0,5 mg/ml de anticuerpos MAb40 o 0,2 mg/ml de anticuerpos anti-His-His, dirigidos contra la etiqueta His, de la proteína Δ49ApoA1.
- En el caso de las manchas de puntos, secar 3 μg de MOMP-tNLP purificada y vaciar la tNLP con un aparato de transferencia de puntos. Bloquee y revele las manchas utilizando los mismos métodos descritos anteriormente para la transferencia occidental.
8. Evaluación de endotoxinas
- Cuantificar los niveles de endotoxinas mediante un sistema de análisis de endotoxinas basado en el ensayo de lisado de amebocitos de Limulus (LAL). Prepare un tampón de muestra de 25 mM de Tris libre de endotoxinas, pH 7,4, utilizando una solución de clorhidrato de Tris 1 M y agua libre de endotoxinas.
NOTA: Por lo general, las muestras deben diluirse con este tampón de muestra y las diluciones deben ajustarse para encontrar el rango adecuado para muestras individuales. En este caso, las muestras de MOMP-tNLP se diluyen 500 veces en tampón de muestra y se cargan 25 μL en cada pocillo de un cartucho de dispositivo con una sensibilidad de 0,05 UE/ml. Los niveles de endotoxinas de MOMP-tNLP y tNLP vacío utilizados en los estudios con ratones que se describen a continuación están entre 0,4 y 12 UE/μg de proteína, dependiendo de la muestra.
9. Liofilización
- Liofilizar y almacenar las nanopartículas MOMP-tNLP para su uso a largo plazo (hasta años) a -20 °C. Para preparar las suspensiones de tNLP y MOMP-tNLP para la liofilización, agregue trehalosa como protector durante el proceso de congelación y liofilización.
NOTA: Este proceso ha sido ampliamente validado para una variedad de formulaciones de tNLP 7,8. - Divida el volumen actual de la solución MOMP-tNLP por 9 para obtener el volumen de trehalosa de 1 M en agua desionizada estéril, libre de endotoxinas, necesario para alcanzar una concentración final de 0,1 M de trehalosa. Tome nota del volumen final y alícuota en tubos de polipropileno de 15 ml o 50 ml libres de endotoxinas, según lo desee.
- Congele la solución mezclada en hielo seco y liofícela durante la noche con un liofilizador. Almacenar las formulaciones secas a -20 °C hasta que las necesite.
- Reconstituir los tNLPs liofilizados utilizando agua libre de endotoxinas. Enrolle suavemente hasta que la torta liofilizada se disuelva por completo y se rehidrate. Para eliminar la trehalosa, dialice la solución contra PBS utilizando una membrana de diálisis de corte de 3,5 kDa.
10. Adición adyuvante
NOTA: Estas y otras formulaciones similares de vacunas de subunidades basadas en PNL pueden incorporar fácilmente adyuvantes lipofílicos como CpG-ODN1826 y FSL-1. CpG-ODN1826 es un oligonucleótido CpG de clase B modificado (5'-tccatgacgttcctgacgtt-3') con una columna vertebral de fosforotioato completa con una fracción de colesterol 5' (5'-chol-C6). La conjugación de CpG-ODN1826 a las pNLPt está mediada por las interacciones hidrofóbicas entre la fracción de colesterol y la bicapa de fosfolípidos de la pNLPt y ha sido demostrada y bien caracterizada, como se ha descrito previamente 9,10.
- Antes de incorporarlo a estas formulaciones, purifique la CpG modificada con colesterol mediante cromatografía de fase reversa para eliminar la endotoxina contaminante, así como cualquier molécula de CpG no modificada.
- Al recibirlo del proveedor, rehidrate el material CpG liofilizado en agua libre de endotoxinas y purifíquelo en una columna preparativa C4 RP-HPLC utilizando un gradiente de separación que consta de acetato de trietilamonio (TEAA) de 10 mM (fase móvil A) y acetonitrilo (fase móvil B).
NOTA: En la Tabla 2 se encuentran disponibles más detalles. - Agrupar y liofilizar las fracciones que contienen CpG modificado con colesterol. Para asegurar la eliminación completa de la TEAA residual, reconstituya la CpG con 15 ml de agua libre de endotoxinas y vuelva a liofilizarla tres veces.
- Después de la liofilización final, reconstituir la CpG en agua libre de endotoxinas (>concentración final de CpG de 20 mg/mL), alícuota, y almacenarla a -80 °C hasta que se necesite. Para agregar a las formulaciones, diluya la CpG a una concentración de 1-2.5 mg/mL.
NOTA: FSL-1 está disponible como un polvo liofilizado de grado vacunal. Este se reconstituye utilizando agua estéril y libre de endotoxinas a una concentración de 1 mg/mL. La vacuna se administra por vía intramuscular (i.m.), y cada dosis contiene 10 μg de MOMP en un volumen total de 50 μL.
- Al recibirlo del proveedor, rehidrate el material CpG liofilizado en agua libre de endotoxinas y purifíquelo en una columna preparativa C4 RP-HPLC utilizando un gradiente de separación que consta de acetato de trietilamonio (TEAA) de 10 mM (fase móvil A) y acetonitrilo (fase móvil B).
- Para lograr la dosis de formulación deseada, dialice las nanopartículas en PBS y concéntrelas utilizando un concentrador de vacío centrífugo antes de la adición de adyuvantes. Tenga cuidado al hacer esto para evitar que la muestra se seque por completo: verifique el volumen de la muestra cada 20 a 30 minutos durante la centrifugación.
- Agregue el adyuvante en condiciones estériles en un gabinete de bioseguridad. Para evaluar el éxito de la incorporación, se analizan las formulaciones finales y sus componentes mediante cromatografía analítica de exclusión por tamaño (SEC).
NOTA: Para estas preparaciones, se utilizó una columna SEC en tampón PBS (0,5 mL/m de caudal) y la elución se detectó utilizando un detector de matriz de diodos UV-vis. La incorporación se evaluó comparando la absorción de las partículas adyuvantes con la de las partículas no adyuvantes a 214 y 280 nm. - Almacenar la MOMP-tNLP adyuvada y la tNLP vacía a 4 °C antes de su uso en animales durante un período de hasta 14 días. Para evaluar completamente la estabilidad de una nueva formulación de tNLP, analice periódicamente los tNLP almacenados por SEC.
NOTA: La estabilidad variará de una formulación a otra.
11. Pruebas de suero
- Obtener ratones hembra de 3 semanas de edad (BALB/c, n = 6).
- Vacunar a los ratones por vía intramuscular (i.m.) en cada extremidad posterior con 10 μg de MOMP en forma de MOMP-tNLP adyuvado con 5 μg de CpG y 1 μg de FSL-1 (volumen total por inyección = 50 mL).
- Después de la vacunación, observe a los ratones hasta que sean capaces de mantener la decúbito esternal.
- Cuatro semanas después de la vacunación inicial (prime), vacunar a los animales por segunda vez (refuerzo) con 10 μg de MOMP en forma de MOMP-tNLP adyuvado con 5 μg de CpG y 1 μg de FSL-1 (volumen total por inyección = 50 mL).
- En el día 56 después de la vacunación inicial, recolecte sangre para evaluar los títulos de anticuerpos. Comience anestesiando a los ratones inyectando i.p. una solución de xilacina (0,3 mg/20 g de peso corporal) y ketamina (3,0 mg/20 g de peso corporal). Pellizca las patas delanteras y traseras para asegurarte de que no se produzcan sacudidas. Aplique vaselina alrededor de los ojos para prevenir la sequedad ocular durante la anestesia.
- Con un tubo capilar de microhematocrito, punción del plexo retroorbitario. Recolectar 100 ml de sangre en un tubo de microcentrífuga.
- Después de la extracción de sangre, observe a los ratones hasta que se recuperen de la anestesia y puedan mantener la decúbito esternal.
- Deje que la sangre coagule a temperatura ambiente durante 30 minutos y luego gire a 2.000 × g durante 10 minutos. Recoger el sérum y congelar a -80 °C.
- En este momento, desafía a los animales con Chlamydia muridarum o eutanasia. Sacrificar a los ratones inyectando primero una solución i.p. de xilacina (0,3 mg/20 g de peso corporal) y ketamina (3,0 mg/20 g de peso corporal) seguida de una luxación cervical.
- Pruebe los anticuerpos séricos específicos para MOMP utilizando técnicas de Western blot como se ha descrito anteriormente. Agrupar sueros de ratón de todos los ratones inmunizados y utilizar el suero combinado en lugar de un anticuerpo primario con una dilución de 1:5.000.
Resultados
En la Figura 1B se muestra el perfil SDS-PAGE de la purificación por afinidad de Ni de MOMP-tNLP a partir de una reacción libre de células de 1 mL. La reacción dio lugar a altos niveles de expresión tanto de la MOMP como de la proteína Δ49ApoA1. Los resultados anteriores mostraron que la expresión libre de células de Δ49ApoA1 en presencia de DMPC y telodendrimer dio lugar a la formación de partículas de nanolipoproteínas de telodendrimer (tNLPs)4. La coelución de MOMP con Δ49ApoA1 indicó que MOMP está asociada con tNLPs, ya que la etiqueta His solo está presente en el andamio de tNLP Δ49ApoA1 y no en MOMP. MOMP es una proteína altamente insoluble que solo puede eluirse a través de la formación de complejos con tNLPs, que se ha demostrado que facilitan la solubilización de proteínas de membrana.
Las fracciones de elución que contenían MOMP-tNLPs se agruparon y la concentración total de proteínas se determinó utilizando un dispositivo de cuantificación basado en fluorescencia, o un dispositivo que mide la concentración a través de la absorbancia a 280 nm, siguiendo las instrucciones del fabricante para la cuantificación de proteínas. Para permitir una dosificación precisa de la vacuna MOM, también es importante determinar la concentración de MOMP en los complejos purificados. Desarrollamos un método para cuantificar el MOMP basado en la densitometría en gel (Figura 2) en el que se utilizó como estándar un MOMP recombinante purificado con concentración conocida. Al establecer la curva estándar y compararla con la muestra MOMP-tNLP, la concentración de MOMP se puede cuantificar con precisión. La determinación de la concentración de MOMP en la muestra purificada permitió estimar el rendimiento de MOMP en reacciones libres de células a varias escalas, lo cual es importante para planificar la configuración de la reacción apropiada para los estudios posteriores (Tabla 3).
MOMP necesita formar oligómeros para provocar una respuesta inmunitaria robusta11. Para probar el estado oligomérico de MOMP, se analizó MOMP-tNLP en presencia y ausencia tanto de calor como del agente reductor ditiotreitol (DTT, 50 mM, Figura 3A). Los oligómeros de orden superior de MOMP se identificaron a través de SDS-PAGE cuando las muestras no se trataron con calor y DTT. En comparación, las muestras tratadas con calor en presencia de TDT mostraron principalmente dos bandas distintas en el gel, correspondientes a MOMP y Δ49ApoA1 (aproximadamente 40 kDa y 22 kDa, respectivamente). Estos resultados se asemejan mucho al patrón de bandas de gel atribuido a la formación de oligómeros de MOMP, que es fundamental para su eficacia.
Un análisis adicional de Western blot utilizando MAb40, un anticuerpo contra el epítopo lineal en el dominio variable de la proteína MOMP, mostró un patrón de bandas similar, confirmando la formación de oligómeros por la proteína MOMP en su estado no desnaturalizado (Figura 3B). Un factor importante que afecta a la formación de oligómeros MOMP es la relación entre el plásmido MOMP y el plásmido Δ49ApoA1 durante la configuración de la reacción libre de células. En la Tabla 4 se muestra la proporción de plásmidos y la tasa de inserción resultante de MOMP en tNLPs. Estudios previos indicaron que la clamidia MOMP y otras proteínas de la membrana externa pueden existir principalmente como trímeros12. Para maximizar la formación de trímeros en la reacción libre de células, es deseable tener una tasa de inserción cercana a tres proteínas MOMP por NLP, lo que corresponde a una relación de plásmido ~25:1 MOMP a Δ49ApoA1.
Se utilizó un ensayo de transferencia de puntos como un método más simplificado para detectar la presencia de MOMP y tNLP. Se utilizó el anticuerpo MAb40 para detectar MOMP total. Para evaluar la presencia de tNLP se utilizó el anticuerpo MAbHIS dirigido a la etiqueta His en el andamio Δ49ApoA1 de la pNLPt. La coseñalización de los anticuerpos MAb40 y MAbHIS indicó la formación de MOMP-tNLP. La reacción de control produjo tNLP vacío, que solo mostró una señal positiva de MAbHIS (Figura 3C). Para probar la inmunogenicidad de las MOMP-tNLP producidas en la reacción libre de células, adyuvamos MOMP-tNLP con CpG + FSL-1 e inyectamos por vía intramuscular (i.m.) en ratones en un régimen de cebado-refuerzo como se describió anteriormente. Se recogieron sueros de los ratones inmunizados y se midieron los anticuerpos IgG específicos de MOMP mediante un ensayo de Western blot (Figura 4). Los sueros de ratones inyectados con MOMP-tNLP adyuvado mostraron una fuerte unión a MOMP, lo que indica que MOMP-tNLP podría provocar una respuesta inmunitaria in vivo.
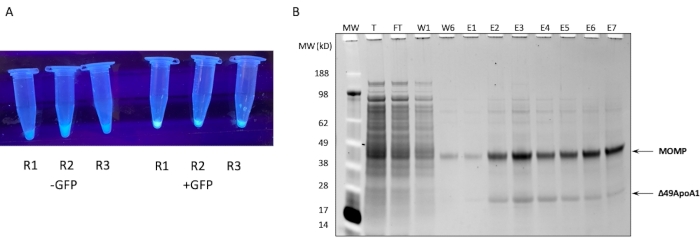
Figura 1: Expresión y purificación de MOMP-tNLP. (A) Imagen de tubos que contienen pequeñas alícuotas de una reacción libre de células que expresa con éxito los controles de GFP que se iluminan bajo una fuente de luz UV (derecha) en comparación con los lisados sin plásmido de GFP (izquierda). (B) El gel de proteínas teñido con SYPRO Ruby después de SDS-PAGE muestra el perfil de purificación de MOMP-tNLP. MOMP migra a 40 kDa y el 49ApoA1 migra a 22 kDa. Abreviaturas: MOMP = proteína principal de la membrana externa de clamidia; tNLP = partícula de nanolipoproteína de telodendrimer; MOMP-tNLP = complejo MOMP-tNLP; GFP = plásmido fluorescente verde codificante de proteínas; MW = Marcador de peso molecular; T = lisado total de células libres; FT = flujo continuo; R1-R3 = alícuotas de reacción libre de células; W1, W6 = lavados 1 y 6; E1-E7 = Eluciones 1 a 7; Δ49ApoA1 = Derivada de ApoA1 de ratón marcado con His. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Cuantificación de MOMP en muestras de MOMP-tNLP. (A) Gel SDS-PAGE teñido con SYPRO Ruby para la cuantificación de MOMP. Se cargó MOMP recombinante con concentración conocida en el gel para obtener la curva estándar. Cada carril contenía 0,1 μg, 0,5 μg, 1,0 μg, 2,0 μg y 4,0 μg de MOMP. Las muestras de MOMP-tNLP que se estaban cuantificando se cargaron en el mismo gel. (B) La curva estándar de concentración MOMP se generó mediante densitometría. Se estableció una ecuación que relaciona la densidad de banda normalizada y la cantidad de MOM. La ecuación se utilizó para calcular el contenido de MOMP en las muestras desconocidas. Abreviaturas: MOMP = proteína principal de la membrana externa de clamidia; tNLP = partícula de nanolipoproteína de telodendrimer; MOMP-tNLP = complejo MOMP-tNLP; SDS-PAGE = electroforesis en gel de poliacrilamida dodecilsulfato de sodio. Haga clic aquí para ver una versión más grande de esta figura.
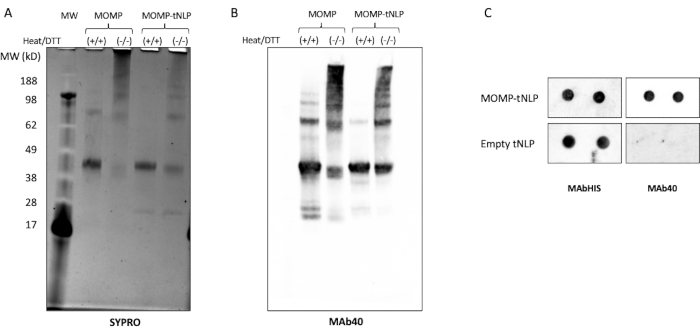
Figura 3: La MOMP-tNLP producida sin células permite que la MOMP forme estructuras de orden superior. (A) Gel SDS-PAGE de MOMP-tNLP con y sin tratamiento de calor y agente reductor DTT, teñido con SYPRO Ruby. Con el calor y la TDT, el MOMP apareció principalmente como una banda de monómero a ~40 kDa, ya que el calor y el agente reductor descompusieron la mayor parte de la estructura del MOMP de orden superior. En ausencia de calor y TDT, las bandas de orden superior estaban presentes, lo que indica la conformación del oligómero MOM. (B) Western blot de MOMP-tNLP y MOMP solo, sin tratar y tratado con calor y TDT. Después de la transferencia, la membrana se sondeó con MAb40 (dilución 1:1.000). Se observó un patrón de bandas similar al gel teñido con rubí SYPRO, lo que confirma que las bandas de mayor peso molecular eran de hecho oligómeros de MOMP. (C) Mancha de puntos de MOMP-tNLP y muestras vacías de tNLP (por duplicado) sondeadas con MAb40 y MAbHIS. Abreviaturas: MOMP = proteína principal de la membrana externa de clamidia; tNLP = partícula de nanolipoproteína de telodendrimer; MOMP-tNLP = complejo MOMP-tNLP; SDS-PAGE = electroforesis en gel de poliacrilamida dodecilsulfato de sodio; DTT = ditiotreitol. Haga clic aquí para ver una versión más grande de esta figura.
Figura 4: La MOMP-tNLP producida libremente es altamente inmunogénica. El suero de ratones inmunizados mostró una fuerte señal de IgG anti-MOM. Para inmunizar ratones se utilizó MOMP-tNLP adyuvado con CpG + FSL-1. Se recolectaron, agruparon y utilizaron sueros de seis ratones inmunizados para sondear MOMP-tNLP. El suero fue capaz de unirse a MOMP en un ensayo de Western blot y mostró una fuerte señal de IgG (izquierda). El western blot que utilizó MAb40 como anticuerpo primario (derecha) mostró bandas similares, lo que indica que el suero contenía IgG específica de MOMP. Abreviaturas: MOMP = proteína principal de la membrana externa de clamidia; tNLP = partícula de nanolipoproteína de telodendrimer; MOMP-tNLP = complejo MOMP-tNLP; CpG = adyuvante de CpG modificado con colesterol; FSL-1 = adyuvante lipofílico. Haga clic aquí para ver una versión más grande de esta figura.
| Nombre del búfer | NaH2PO4 | NaCl | Imidazol | pH |
| Búfer de enlace | 50 mM | 300 mM | 10 mM | 8.0 |
| Tampón de lavado | 50 mM | 300 mM | 20 mM | 8.0 |
| Tampón de elución 1 | 50 mM | 300 mM | 250 mM | 8.0 |
| Tampón de elución 2 | 50 mM | 300 mM | 500 mM | 8.0 |
Tabla 1: Lista de tampones necesarios para la purificación por afinidad de níquel detallando las concentraciones de cada componente y el pH.
| Ejecución | 50 minutos |
| Gasto | 6.0 mL/min |
| Tipo de degradado | Binario |
| Búfer A | 10 mM TEAA en H20 |
| Búfer B | MeCN |
| Gradiente | % de tampón B |
| 0 minutos | 25% |
| 30 minutos | 60% |
| 30.5 minutos | 100% |
| 40 minutos | 100% |
| 40.5 minutos | 25% |
| 50 minutos | 25% |
Tabla 2: Condiciones para la purificación por HPLC en fase reversa de CpG modificado con colesterol. Abreviaturas: TEAA = acetato de trietilamonio; MeCN = acetonitrilo.
| Lisado libre de células (mL) | Lípidos DMPC (mg) | Telodendrimer (mg) | Plásmido MOMP (μg) | Rendimiento de MOMP purificado (mg) |
| 1 | 4 | 0.4 | 15 | 0.5 |
| 2 | 8 | 0.8 | 30 | 1.1 |
| 3 | 12 | 1.2 | 45 | 1.6 |
| 5 | 20 | 2 | 75 | 2.7 |
Tabla 3: La cantidad de lípidos, telodendrimeros y plásmidos utilizados para reacciones libres de células a diferentes escalas y los rendimientos correspondientes. Abreviaturas: MOMP = proteína principal de la membrana externa de clamidia; DMPC = 1,2-dimiristoil-sn-glicero-3-fosfocolina.
| Proporciones de entrada de plásmidos, MOMP : Δ49ApoA1 | 1:1 | 5:1 | 10:1 | 25:1 | 50:1 | 100:1 | |
| Proporciones de la cantidad de proteína producida, MOMP : Δ49ApoA1 | 0.02 | 0.32 | 0.64 | 3.46 | 6.55 | 20.04 | |
| Número estimado de inserciones de MOMP por tNLP | 0.03 | 0.37 | 0.75 | 4.04 | 7.65 | 23.39 | |
Tabla 4: Las proporciones de plásmidos en una reacción libre de células y las tasas de inserción de MOMP resultantes. Abreviaturas: MOMP = proteína principal de la membrana externa de clamidia; tNLP = partícula de nanolipoproteína de telodendrimer; Δ49ApoA1 = Derivada de ApoA1 de ratón marcado con His.
Discusión
La clamidia es la infección de transmisión sexual más común que afecta tanto a hombres como a mujeres. Aunque la investigación de la vacuna contra la clamidia abarca décadas, una vacuna segura y eficaz que pueda ampliarse a la producción masiva ha sido difícil de alcanzar13. La clamidia MOMP se considera el principal candidato como antígeno protector de la vacuna; sin embargo, el MOMP es altamente hidrofóbico y propenso a un plegado incorrecto14,15. Estudios posteriores han revelado que MOMP existe en estados oligoméricos que son esenciales para su inmunogenicidad11. Aquí se detalla un método validado de coexpresión libre de células que produce MOMP oligomérico formado dentro de la nanopartícula de tNLP como vacuna, con rendimientos de aproximadamente 1,5 mg de MOMP purificado por 3 ml de lisado. Este procedimiento totalmente cotejado puede ampliarse aún más para la producción industrial, lo que aumenta sus perspectivas como un enfoque útil para la generación de vacunas.
Hemos publicado previamente sobre el uso de la expresión libre de células para producir proteínas de membrana incrustadas en NLPs 3,16, así como la expresión en discos estabilizados con telodendrimer. Sin embargo, esta última técnica produjo partículas de proteína de membrana con mayor heterogeneidad y menor solubilidad. 4 Además, la inmunogenicidad de las partículas de MOMP-telodendrimer no está clara en comparación con las partículas de MOMP-tNLP6.
Este procedimiento se puede adaptar para ampliar la expresión de proteínas de membrana bacteriana que son candidatas prometedoras como antígenos para su uso en vacunas de subunidades. Este procedimiento no solo produce proteínas de membrana bacterianas solubilizadas, sino que la estructura general de nanopartículas es susceptible de modificaciones adicionales utilizando una variedad de adyuvantes de vacunas lipofílicas que incluyen, entre otros, CpG conjugado con una fracción de colesterol o FSL-1. La expresión de otros antígenos candidatos a partir de bacterias es factible, aunque puede ser necesario explorar parámetros como la temperatura de expresión, la elección de lípidos y el tipo de sistema de expresión para lograr rendimientos óptimos.
Además, la elección y la proporción de plásmidos son fundamentales en este proceso. Ambos plásmidos utilizados deben construirse a partir de la misma columna vertebral. Si los insertos tienen aproximadamente la misma longitud, las proporciones se pueden basar en la masa del plásmido agregado, como se describe aquí. Sin embargo, la proporción basada en moles dará resultados más reproducibles, especialmente al escalar las reacciones. Es posible que las proporciones que funcionan bien en reacciones a escala de pantalla (< 0,5 ml) no sean aplicables a reacciones más grandes y requieran una optimización adicional. Las proteínas que no son de membrana aún se pueden expresar utilizando kits libres de células, pero es posible que no requieran la nanopartícula lipídica (coexpresión) para producir un producto soluble. Además, si bien este protocolo describe el adyuvante con CpG y FSL-1, este sistema es susceptible de formulación con otros adyuvantes lipofílicos o mezcla con adyuvantes solubles según se desee.
Es esencial evitar la contaminación al configurar la reacción de expresión libre de células, ya que esto puede afectar los rendimientos. Cualquier aditivo para la reacción, incluidos los propios plásmidos, debe ser muy puro. Además, las proteínas expresadas solo deben estar en contacto con materiales y soluciones que estén libres de contaminación por endotoxinas. La contaminación por endotoxinas en las formulaciones candidatas puede dar lugar a resultados inconsistentes y espurios de los ensayos inmunológicos y puede ser perjudicial en cantidades suficientes. Si bien no se describe aquí, puede ser necesaria una purificación adicional después de la cromatografía de afinidad de níquel si se observan muchos contaminantes en los pasos de análisis posteriores, como a través de SDS-PAGE. Esto podría lograrse con SEC, aunque las condiciones pueden requerir una optimización formulación por formulación.
Divulgaciones
Los autores declaran que no tienen intereses financieros o relaciones personales que puedan haber influido en el trabajo reportado en este artículo.
Agradecimientos
Este trabajo fue financiado por la subvención R21 AI20925 y U19 AI144184 del Servicio de Salud Pública del Instituto Nacional de Alergias y Enfermedades Infecciosas. Este trabajo fue realizado bajo los auspicios del Departamento de Energía de los Estados Unidos por el Laboratorio Nacional Lawrence Livermore bajo el contrato DE-AC52-07NA27344 [LLNL-JRNL-822525, LLNL-VIDEO-832788].
Materiales
| Name | Company | Catalog Number | Comments |
| 1,2-dimyristoyl-sn-glycero-3-phosphocholine (DMPC) as powder | Avanti Polar Lipids | 850345 | |
| 1.5 mL endotoxin-free centrifuge tubes | Eppendorf | 2600028 | |
| 1 M Trizma hydrochloride solution | Millipore Sigma | T2194 | |
| Acetic acid, glacial, ACS reagent, ≥99.7% | Millipore Sigma | 695092 | |
| Bio-Dot apparatus | Bio-Rad | 1706545 | |
| Buffer Dam for XCell SureLock | Life Technologies | EI0012 | |
| C24 Incubator shaker | New Brunswick Scientific | ||
| Cell-Free Expression System: RTS 500 ProteoMaster E. coli HY Kit | BiotechRabbit | BR1400201 | |
| cOmplete His-Tag Purification Resin | Roche Molecular Diagnostics | 5893682001 | |
| cOmplete, EDTA-free Protease Inhibitor Cocktail | Roche Molecular Diagnostics | 4693132001 | |
| CpG-ODN1826 | Biosearch Technologies | T9449 | |
| D-(+)-Trehalose dihydrate | Millipore Sigma | 71509 | |
| Dialysis tubes D-Tube Dialyzer Maxi | Millipore Sigma | 71508-3 | |
| Disposable, polypropylene fritted columns 10 mL capacity | Bio-Rad | 7311550EDU | |
| Dulbecco’s Phosphate-buffered Saline (PBS) | Millipore Sigma | D8537 | |
| Electrophoresis Power Supply | |||
| Endosafe PTS cartridge | Thermo Fisher Scientific | NC9594798 | |
| Endosafe-PTS Testing System | Charles River | ||
| Gel wash solution: 10% methanol, 7% acetic acid | |||
| HCl and NaOH solutions for pH adjustment | |||
| HPLC with UV-vis diode array detector | Shimadzu | ||
| HyClone HyPure culture-grade water | VWR | 82007-328 | |
| iBlot 2 Dry Blotting System | Life Technologies | ||
| iBlot 2 Transfer Stacks, PVDF | Life Technologies | IB24001 | |
| Image Studio V2.0 software | Li-COR Biiosciences | ||
| Imidazole | Millipore Sigma | I5513 | |
| Immun-Blot PVDF Membrane | Bio-Rad | 1620177 | |
| LI-COR Odyssey Fc imager | Li-COR Biiosciences | ||
| Lyophilizer | Labconco | ||
| Methanol (≥99.9%) | Millipore Sigma | 34860 | |
| Microcentrifuge | |||
| Microwave oven | |||
| NanoDrop One/OneC Microvolume UV-Vis Spectrophotometer | Thermo Fisher Scientific | ND-ONE-W | |
| NuPAGE 4 to 12%, Bis-Tris, 1.0 mm | Life Technologies | NP0321 | |
| NuPAGE LDS Sample Buffer (4x) | Life Technologies | NP0007 | |
| NuPAGE MES SDS Running Buffer (20x) | Life Technologies | NP000202 | |
| NuPAGE Sample Reducing Agent (10x) | Life Technologies | NP0009 | |
| Odyssey Blocking Buffer in TBS containing 0.2% Tween 20 | Li-COR Biosciences | 927-50000 | |
| Orbital Shaker | |||
| PBS-T (1x PBS, 0.2% Tween 20, pH 7.4) | |||
| PEG5K-CA8 Telodendrimer (custom synthesis product) | |||
| pIVEX2.4d vector | Roche Molecular Diagnostics | ||
| Plasmid Maxi Kit | Qiagen | 12162 | |
| Primary antibody: MAb40 (monoclonal antibody to the variable domain 1 (VD1) of C. muridarum MOMP, de la Maza laboratory)4 | |||
| Primary antibody: MAbHIS, Penta-His antibody | Qiagen | 34660 | |
| Probe sonicator | |||
| Qubit 3.0 Fluorometer | Life Technologies | Q33216 | |
| Qubit Protein Assay Kit | Life Technologies | Q33212 | |
| Rainin Pipette tips: LTS 1000 µL | Rainin | 17002428 | |
| Rainin Pipette tips: LTS 20 µL | Rainin | 17002429 | |
| Rainin Pipette tips: LTS 200 µL | Rainin | 17002426 | |
| Rainin Pipettes | Rainin | ||
| Secondary antibody: IRDye 800CW goat (polyclonal) anti-mouse IgG (heavy and light) | Li-COR Biosciences | 926-32210 | |
| SeeBlue Plus2 Pre-stained Protein Standard | Life Technologies | LC5925 | |
| Sodium chloride NaCl | Millipore Sigma | S7653 | |
| Sodium phosphate monobasic NaH2PO4 | Millipore Sigma | S0751 | |
| Superdex 200, 5/150 GL column | Cytiva | GE28-9909-45 | |
| Synthetic diacylated lipoprotein-TLR2/6 FSL-1 | Invivogen | tlrl-fsl | |
| SYPRO Ruby Protein Gel Stain | Life Technologies | S12001 | |
| TWEEN 20 | Millipore Sigma | P1379 | |
| UV light source | |||
| Vacufuge Bench Top Centrifuge | Eppendorf | ||
| Vortexer | |||
| VWR 15 mL conicals (89039-666) | VWR | ||
| VWR 50 mL conicals (89039-656) | VWR | ||
| XCell SureLock Mini-Cell (Life Technologies ) | Life Technologies | EI0001 |
Referencias
- Carlson, E. D., Gan, R., Hodgman, C. E., Jewett, M. C. Cell-free protein synthesis: applications come of age. Biotechnology Advances. 30 (5), 1185-1194 (2012).
- Coleman, M. A., et al. Expression and association of the Yersinia pestis translocon proteins, YopB and YopD, are facilitated by nanolipoprotein particles. PLoS One. 11 (3), 0150166(2016).
- Cappuccio, J. A., et al. Cell-free co-expression of functional membrane proteins and apolipoprotein, forming soluble nanolipoprotein particles. Molecular & Cellular Proteomics: MCP. 7 (11), 2246-2253 (2008).
- He, W., et al. Controlling the diameter, monodispersity, and solubility of ApoA1 nanolipoprotein particles using telodendrimer chemistry. Protein Science. 22 (8), 1078-1086 (2013).
- He, W., et al. Cell-free production of a functional oligomeric form of a Chlamydia major outer-membrane protein (MOMP) for vaccine development. Journal of Biological Chemistry. 292 (36), 15121-15132 (2017).
- Tifrea, D. F., et al. Induction of protection in mice against a Chlamydia muridarum respiratory challenge by a vaccine formulated with the major outer membrane protein in nanolipoprotein particles. Vaccines. 9 (7), 755(2021).
- Cleveland, T. E., et al. Small-angle X-ray and neutron scattering demonstrates that cell-free expression produces properly formed disc-shaped nanolipoprotein particles. Protein Science. 27 (3), 780-789 (2018).
- Fischer, N. O., et al. Conjugation to nickel-chelating nanolipoprotein particles increases the potency and efficacy of subunit vaccines to prevent West Nile encephalitis. Bioconjugate Chemistry. 21 (6), 1018-1022 (2010).
- Fischer, N. O., et al. Colocalized delivery of adjuvant and antigen using nanolipoprotein particles enhances the immune response to recombinant antigens. Journal of the American Chemical Society. 135 (6), 2044-2047 (2013).
- Fischer, N. O., et al. Evaluation of nanolipoprotein particles (NLPs) as an in vivo delivery platform. PLoS One. 9 (3), 93342(2014).
- Pal, S., Peterson, E. M., de la Maza, L. M. Vaccination with the Chlamydia trachomatis major outer membrane protein can elicit an immune response as protective as that resulting from inoculation with live bacteria. Infection and Immunity. 73 (12), 8153-8160 (2005).
- Sun, G., et al. Structural and functional analyses of the major outer membrane protein of Chlamydia trachomatis. Journal of Bacteriology. 189 (17), 6222-6235 (2007).
- Hafner, L. M., Wilson, D. P., Timms, P. Development status and future prospects for a vaccine against Chlamydia trachomatis infection. Vaccine. 32 (14), 1563-1571 (2014).
- Findlay, H. E., McClafferty, H., Ashley, R. H. Surface expression, single-channel analysis and membrane topology of recombinant Chlamydia trachomatis Major Outer Membrane Protein. BMC Microbiology. 5, 5(2005).
- Sun, G., Pal, S., Weiland, J., Peterson, E. M., de la Maza, L. M. Protection against an intranasal challenge by vaccines formulated with native and recombinant preparations of the Chlamydia trachomatis major outer membrane protein. Vaccine. 27 (36), 5020-5025 (2009).
- He, W., et al. Cell-free expression of functional receptor tyrosine kinases. Scientific Reports. 5 (1), 12896(2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados