Method Article
Бесклеточное масштабное производство и адъювантное добавление к рекомбинантному белку внешней мембраны из Chlamydia muridarum для разработки вакцины
* Эти авторы внесли равный вклад
В этой статье
Резюме
Этот протокол описывает использование коммерческих наборов для экспрессии внеклеточных белков для производства мембранных белков, поддерживаемых в нанодиске, которые могут быть использованы в качестве антигенов в субъединичных вакцинах.
Аннотация
Субъединичные вакцины имеют преимущества по сравнению с более традиционными инактивированными или аттенуированными вакцинами цельноклеточного происхождения в отношении безопасности, стабильности и стандартного производства. Для получения эффективной субъединичной вакцины на основе белка белковый антиген часто должен принимать нативную конформацию. Это особенно важно для поверхностных антигенов патогена, которые представляют собой мембраносвязанные белки. Бесклеточные методы были успешно использованы для получения правильно свернутого функционального мембранного белка путем котрансляции частиц нанолипопротеинов (NLP), широко известных как нанодиски.
Эта стратегия может быть использована для производства субъединичных вакцин, состоящих из мембранных белков в липидно-связанной среде. Однако производство бесклеточного белка часто ограничивается небольшими масштабами (<1 мл). Количество белка, производимого в небольших производственных циклах, обычно достаточно для биохимических и биофизических исследований. Тем не менее, бесклеточный процесс должен быть масштабирован, оптимизирован и тщательно протестирован, чтобы получить достаточное количество белка для исследований вакцины на животных моделях. Другие процессы, связанные с производством вакцин, такие как очистка, добавление адъювантов и лиофилизация, должны быть оптимизированы параллельно. В этом документе сообщается о разработке расширенного протокола экспрессии, очистки и составления мембранно-связанной белковой субъединичной вакцины.
Масштабные внеклеточные реакции требуют оптимизации концентраций и соотношений плазмид при использовании нескольких векторов экспрессии плазмид, селекции липидов и адъювантного добавления для высокоуровневого производства формулированных частиц нанолипопротеинов. Метод демонстрируется здесь с экспрессией основного белка внешней мембраны хламидия (MOMP), но может быть широко применен к другим антигенам мембранных белков. Эффективность антигена может быть оценена in vivo с помощью исследований иммунизации для измерения выработки антител, как показано здесь.
Введение
Прокариотические или эукариотические лизаты для бесклеточной экспрессии белков легко доступны в качестве коммерческих продуктов для синтеза интересующих белков (полный обзор см. в разделе 1). Эти системы экспрессии доступны в различных масштабах и используют лизаты различных организмов, включая кишечную палочку, растения табака и культуры млекопитающих. Бесклеточные лизаты обладают множеством преимуществ по сравнению с традиционными подходами к производству рекомбинантных белков, включая простоту использования и надежное и быстрое производство белка. В то время как эти подходы в основном используются для получения растворимых белков, эта группа стала пионером в их использовании для экспрессии мембранных белков.
Этот новый подход вносит незначительные изменения в существующие системы бесклеточной экспрессии, включая ДНК, кодирующую два белковых продукта для экспрессии: аполипопротеин и мембранный белок, представляющий интерес. Экспрессируемый аполипопротеин (производные ApoA1 или ApoE4) взаимодействует с липидами, добавленными к бесклеточному лизату, для спонтанной сборки (~20 нм) NLP. При совместном переводе с интересующим нас мембранным белком НЛП и мембранный белок образуют растворимый комплекс наночастиц, в котором мембранный белок встроен в липидный бислой НЛП. Таким образом, мембранный белок более доступен для последующих применений, поскольку он содержится в растворимых дискретных частицах. Этот подход позволяет продуцировать функциональные олигомерные белковые комплексы в бислоеNLP 2 и производить антигенный компонент субъединичной вакцины, который впоследствии смешивают с липофильными адъювантами с образованием вакцины на основе наночастиц с совместно локализованным антигеном и адъювантом, пригодным для оценки in vivo .
Этот текущий метод является модификацией ранее опубликованного протокола3. Основные модификации направлены на масштабирование внеклеточной реакции и последующую очистку комплекса белок-НЛП. Дальнейшая модификация включает в себя добавление амфифильного полимера, известного как телодендример, который сначала смешивается с липидами, а затем добавляется к внеклеточной реакции. Котрансляция плазмид в присутствии телодендримера и липидов приводит к образованию телодендримерного НЛП (тНЛП). Добавление телодендримера также помогает модулировать размер и монодисперсность полученных наночастиц tNLP4. Этот протокол специально оптимизирован для крупномасштабных исследований вакцин с целью получения связанного с мембраной белка-субъединичного антигена, хламидийного MOMP 5,6. Метод позволяет получить рекомбинантный MOMP, ассоциированный с tNLP, с образованием высокорастворимого комплекса MOMP-tNLP, который сохраняет олигомеризацию MOMP. Типичное производство объемом 3 мл позволяет получить >1,5 мг очищенного MOMP. Бесклеточный, продуцируемый MOMP-tNLP поддается быстрому добавлению адъюванта для тестирования иммуногенности in vivo.
протокол
Все исследования на животных проводились в Калифорнийском университете в Ирвайне в учреждениях, гарантированных Службой общественного здравоохранения (PHS) в соответствии с руководящими принципами, установленными Комитетом по уходу за животными и их использованию.
1. Подготовка стеклянной посуды
ПРИМЕЧАНИЕ: Все материалы, используемые при производстве вакцинных составов для животных, не содержат эндотоксинов.
- Чтобы уничтожить загрязняющий эндотоксин, запекайте очищенную стеклянную посуду, которая будет удерживать буферы, в духовке при 180 °C в течение 4 часов.
2. Подготовка буфера
- Приготовьте 250 мл буферов для очистки сродства Ni, перечисленных в таблице 1. Храните их при температуре 4 °C до 6 месяцев.
3. Подготовка к реакции
- Взвесьте 20 мг 1,2-димиристоил-sn-глицеро-3-фосфохолина (DMPC) в центрифужную пробирку объемом 1,5 мл, не содержащую эндотоксинов. Растворите его в 1 мл воды, не содержащей эндотоксинов, прощупайте ультразвуком не менее четырех раз при 6 А в течение 1 минуты с паузами 1 минута между ними, пока не станет ясно. Удалите все загрязняющие металлические вещества из зонда центрифугированием при 13 000 × г в течение 2 мин при 22 °C, а затем перенесите солюбилизированный липид в новую пробирку объемом 1,5 мл, не содержащую эндотоксинов.
- Взвесьте 1 мг телодендримера PEG5k-CA8 в пробирку объемом 1,5 мл, не содержащую эндотоксинов. Растворять в воде, не содержащей эндотоксинов, до концентрации 20 мг/мл. Фортекс до полного растворения и разбавить до 2 мг/мл.
- В новой пробирке, не содержащей эндотоксинов, смешайте 210 мкл раствора DMPC 20 мг/мл с 210 мкл раствора телодендримера 2 мг/мл.
4. Бесклеточное производство MOMP-tNLP для субъединичных вакцинных составов
- Подготовка MOMP-tNLP с использованием бесклеточных методов, модифицированных на основе ранее опубликованного протокола5.
- За два часа до начала бесклеточной реакции откройте набор для экспрессии прокариотических бесклеточных белков и разморозьте один из буферов восстановления. После размораживания добавьте одну таблетку коктейля ингибиторов протеазы без ЭДТА и дайте ему полностью раствориться.
- Следуйте этому протоколу, используя набор, предназначенный для запуска реакций 5 x 1 мл.
ПРИМЕЧАНИЕ: Типичное масштабирование составляет 3 x 1 мл.- Для каждой реакции объемом 1 мл добавьте 525 мкл восстановительного буфера во флакон с лизатом E. coli и осторожно раскатайте до растворения. Добавьте 250 мкл буфера для восстановления во флакон, содержащий реакционные добавки (например, АТФ, ГТФ), и осторожно раскатайте до растворения.
- Добавьте 8,1 мл буфера для восстановления в бутылку для реакционной подачи, закройте крышкой резиновой пробкой (следите за тем, чтобы не касаться внутренней части резиновой пробки) и осторожно переверните/покатайте до растворения.
- Добавьте 3 мл буфера для восстановления во флакон со смесью аминокислот, закройте крышкой резиновой пробкой и осторожно переверните/сверните до полного растворения.
ПРИМЕЧАНИЕ: Будьте осторожны, чтобы не прикасаться к внутренней части резиновой пробки, так как это может привести к загрязнению. - Добавьте 1,8 мл буфера для восстановления в флакон с метионином, аккуратно сверните до растворения, а затем храните на льду до использования.
- Приготовьте реакционный раствор.
- Во флакон с лизатом кишечной палочки добавьте 225 мкл восстановленной реакционной смеси, 270 мкл восстановленной смеси аминокислот без метионина и 30 мкл восстановленного метионина. Дополнительно добавляют 400 мкл смеси DMPC/телодендримера, 15 мкг плазмиды MOMP и 0,6 мкг плазмиды Δ49ApoA1. Сверните / аккуратно встряхните, чтобы перемешать.
ПРИМЕЧАНИЕ: Убедитесь, что обе плазмиды построены из одной и той же плазмидной основы. Не вихритесь. - Возьмите 20 мкл общего раствора и отложите его в пробирку объемом 1,5 мл для контрольной реакции экспрессии GFP (см. ниже).
- Во флакон с лизатом кишечной палочки добавьте 225 мкл восстановленной реакционной смеси, 270 мкл восстановленной смеси аминокислот без метионина и 30 мкл восстановленного метионина. Дополнительно добавляют 400 мкл смеси DMPC/телодендримера, 15 мкг плазмиды MOMP и 0,6 мкг плазмиды Δ49ApoA1. Сверните / аккуратно встряхните, чтобы перемешать.
- Приготовьте кормовой раствор. В бутылку с кормовой смесью добавьте 2,65 мл восстановленной аминокислотной смеси без метионина и 300 мкл восстановленного метионина. Раскатайте / осторожно встряхните, чтобы раствориться.
ПРИМЕЧАНИЕ: В это время неиспользованный буфер для восстановления и метионин могут быть возвращены в морозильную камеру для хранения. - Перелейте 1 мл реакционного раствора во внутреннюю реакционную камеру, предусмотренную в бесклеточном реакционном наборе, и запечатайте после заполнения. Перелейте 10 мл подаваемого раствора во внешнюю камеру реакционного сосуда и уплотните.
ПРИМЕЧАНИЕ: Не переполняйте камеры! Наличие пузырьков воздуха в верхней части как внутренней реакционной камеры, так и внутренней камеры подачи отрицательно повлияет на реакцию. Оставшийся реакционный раствор можно поместить в пробирку объемом 1,5 мл и дать ему перемешаться вместе с основным сосудом. - Добавьте 0,5 мкл контрольной плазмиды GFP (0,5 мг/мл) к ранее аликвотированной реакционной смеси объемом 20 мкл.
ПРИМЕЧАНИЕ: Многие наборы поставляются с контрольной плазмидой для контроля качества. Большинство плазмид, экспрессирующих GFP, с промотором Т7 и сайтом связывания рибосом E.coli (RBS), также могут быть использованы в качестве контрольной плазмиды. - Поместите реакцию в шейкер при 300 об/мин, 30 °C на срок до 18 ч. Чтобы убедиться в том, что реакция прошла успешно, используйте источник ультрафиолетового света для проверки флуоресценции из-за синтеза контрольного GFP (рис. 1A) уже через 15 минут инкубации.
ПРИМЕЧАНИЕ: Эти условия, особенно температура, могут нуждаться в оптимизации для экспрессии других мембранных белков.
5. Очистка MOMP-tNLP
- Используйте иммобилизованную никелевую аффинную хроматографию для очистки комплекса наночастиц MOMP-tNLP от внеклеточной реакционной смеси с использованием His-метки на белке Δ49ApoA1.
- Перелейте 1 мл 50% суспензии очищающей смолы His-Tag в одноразовую хроматографическую колонку объемом 10 мл и уравновешивайте ее 3 мл связующего буфера.
- Дайте буферу стечь, закройте выпускное отверстие и добавьте 250 мкл связывающего буфера в смолу.
- Перед добавлением бесклеточной реакции в колонку сохраните 20 мкл для последующего анализа с помощью SDS-PAGE. Бесклеточную реакцию смешивают с равновесной смолой и инкубируют на лабораторном коромысле при 4 °C в течение 1 ч.
- Снимите колпачок с колонки, промойте колпачок 500 мкл дополнительного связующего буфера и добавьте эту жидкость в остальную часть колонки.
- Соберите жидкость, протекающую из колонны, для последующего анализа с помощью SDS-PAGE.
- Промыть колонку 1 мл промывочного буфера, содержащего 20 мМ имидазола, шесть раз и собрать фракции. Следите за тем, чтобы смола не высыхала между стирками. Во время второй промывки энергично перемешайте смолу, пипетируя вверх и вниз с помощью пипетки объемом 1 мл.
- Элюируют MOMP-tNLP в шесть фракций по 300 мкл элюирующего буфера 1 (содержащего 250 мМ имидазола) с последующим окончательным элюированием 300 мкл элюирующего буфера 2 (содержащего 500 мМ имидазола). Во время второго элюирования энергично перемешайте смолу, пипетируя вверх и вниз с помощью пипетки объемом 1 мл.
6. Анализ с помощью SDS-PAGE
ПРИМЕЧАНИЕ: Все фракции элюирования должны быть проанализированы с помощью SDS-PAGE для проверки количества и чистоты интересующего белка.
- Загрузите по 1 мкл каждого из общего лизата и проточного раствора, а затем 5 мкл для всех собранных промывок и фракций элюирования.
- Смешивайте аликвоты элюированных MOMP-tNLP, промывок, проточных и общего лизата с 4-кратным буфером загрузки образцов SDS-PAGE. Если не указано иное, перемешайте и термически денатурируйте образцы с помощью 10-кратного восстановителя пробы.
- Анализируйте фракции методом гель-электрофореза с использованием гелей Bis-Tris SDS-PAGE размером от 1,0 мм, от 4 до 12% с 1x работающим буфером MES-SDS, а также с соответствующим стандартом молекулярной массы. Запустите гели в течение 35 минут при напряжении 200 В.
- Окрашивайте гели в соответствии с инструкцией производителя.
- Извлеките гель из кассеты и поместите его в 60 мл гелевой краски. Разогрейте гель в пятне в микроволновой печи в течение 30 секунд и осторожно покачайте контейнер в течение 30 секунд, чтобы равномерно распределить тепло. Разогрейте гель в микроволновой печи до 80–85 °C еще на 30 секунд и поместите гель на орбитальный шейкер на 5 минут.
- Разогрейте гель в микроволновой печи в третий раз в течение 30 секунд, а затем вернитесь в орбитальный шейкер, чтобы раскачиваться еще 23 минуты.
- Переложите гель в чистую емкость и промыть в 100 мл промывочного раствора (10% метанол, 7% уксусная кислота) в течение 30 мин.
ПРИМЕЧАНИЕ: Это критически важный шаг, так как важно избегать нагрева моющего раствора. Несоблюдение этого требования может привести к появлению фоновых пятен и неровностей на окончательном гелевом изображении. - После умывания промойте гель в сверхчистой воде два раза по 5 мин.
- Визуализируйте гели с помощью гелевого тепловизора с длиной волны 600 нм (рис. 2). Используйте SDS-PAGE для количественной оценки количества отдельного белка в растворе наночастиц, если существует стандарт белка для сравнения.
ПРИМЕЧАНИЕ: В этом примере последовательные разведения рекомбинантно экспрессируемого MOMP разрешаются с помощью SDS-PAGE, а плотности полос количественно определяются с помощью программного обеспечения прибора. - Постройте стандартную кривую, используя плотности каналов MOMP. Разрешают образцы MOMP-tNLP на том же геле SDS-PAGE и рассчитывают MOMP-составляющую частиц с помощью стандартной кривой MOMP (рис. 3).
7. Западные и точечные блотна и хранение
- Для вестерн-блоттинга образцы растворяют с помощью SDS-PAGE и переносят гели с помощью коммерческой системы сухого блоттинга со стандартными настройками в соответствии с протоколом производителя.
- Извлеките блоты из стопки после завершения переноса и инкубируйте каждую блотину в течение ночи при 4 °C в подходящем блокирующем буфере, содержащем 0,2% Tween 20 и 0,5 мг/мл MAb40 или 0,2 мг/мл антител MAbHIS против His-tag, направленных против His-tag из белка Δ49ApoA1.
ПРИМЕЧАНИЕ: Для блоттинга используются разведения антител 1:1,000 для MAb40 и 1:500–1,000 для антител MAbHIS. - Промойте каждую кляксу 3 раза в течение 5 минут PBS-T (1x PBS, 0,2% Tween 20, pH 7,4).
- Инкубируют блоттинг в течение 1 ч в блокирующем буфере, содержащем вторичные антитела, конъюгированные с флуорофором (например, IRDye) в разведении 1:10 000.
- Повторно промойте кляксы 3 раза в течение 5 минут с помощью PBS-T. Используйте флуоресцентный тепловизор для визуализации клякс после окончательной стирки.
- Извлеките блоты из стопки после завершения переноса и инкубируйте каждую блотину в течение ночи при 4 °C в подходящем блокирующем буфере, содержащем 0,2% Tween 20 и 0,5 мг/мл MAb40 или 0,2 мг/мл антител MAbHIS против His-tag, направленных против His-tag из белка Δ49ApoA1.
- Для точечных блотов промокните 3 мкг очищенного MOMP-tNLP и опорожните tNLP с помощью аппарата для дот-блоттинга. Заблокируйте и проявите блоттинг, используя те же методы, что описаны выше для вестерн-блоттинга.
8. Оценка эндотоксинов
- Количественная оценка уровня эндотоксина с помощью системы тестирования эндотоксинов на основе анализа лизата амебоцитов Limulus (LAL). Приготовьте безэндотоксиновый 25 мМ Трис, рН 7,4, буфер для пробы, используя 1 М раствор гидрохлорида триса и воду, не содержащую эндотоксинов.
ПРИМЕЧАНИЕ: Как правило, образцы необходимо разбавлять с помощью этого буфера для образцов, а разведения корректировать, чтобы найти подходящий диапазон для отдельных образцов. Здесь образцы MOMP-tNLP разбавляются в 500 раз в буфере для образцов и загружаются в каждую лунку картриджа устройства с чувствительностью 0,05 EU/мл. Уровни эндотоксинов MOMP-tNLP и пустого tNLP, используемых в исследованиях на мышах, описанных ниже, составляют от 0,4 до 12 EU/мкг белка в зависимости от образца.
9. Лиофилизация
- Лиофилизация и хранение наночастиц MOMP-tNLP для длительного (до многих лет) использования при -20 °C. Для приготовления суспензий tNLP и MOMP-tNLP к лиофилизации добавляют трегалозу в качестве протектора в процессе замораживания и лиофилизации.
ПРИМЕЧАНИЕ: Этот процесс был тщательно валидирован для различных составов tNLP 7,8. - Разделите текущий объем раствора MOMP-tNLP на 9, чтобы получить объем 1 М трегалозы в стерильной, не содержащей эндотоксинов, деионизированной воде, необходимой для достижения конечной концентрации 0,1 М трегалозы. Запишите конечный объем и распределите по желанию в полипропиленовые пробирки объемом 15 мл или 50 мл, не содержащие эндотоксинов.
- Заморозьте смешанный раствор на сухом льду и лиофилизируйте его на ночь с помощью лиофилизатора. Храните высушенные составы при температуре -20 °C до тех пор, пока они не понадобятся.
- Восстановите лиофилизированные tNLP с помощью воды, не содержащей эндотоксинов. Аккуратно прокатывайте до тех пор, пока лиофилизированный жмых полностью не растворится и не регидратируется. Чтобы удалить трегалозу, диализируйте раствор против PBS с помощью мембраны для диализа с давлением 3,5 кДа.
10. Добавление адъюванта
ПРИМЕЧАНИЕ: Эти и другие подобные субъединичные составы вакцин на основе NLP могут легко включать липофильные адъюванты, такие как CpG-ODN1826 и FSL-1. CpG-ODN1826 представляет собой модифицированный олигонуклеотид CpG класса B (5'-tccatgacgttcctgacgtt-3') с полной фосфоротиоатной основой с 5'-холестериновым фрагментом (5'-chol-C6). Конъюгация CpG-ODN1826 с tNLP опосредована гидрофобными взаимодействиями между фрагментом холестерина и фосфолипидным бислоем tNLP и была продемонстрирована и хорошо охарактеризована, как сообщалось ранее 9,10.
- Перед включением в эти составы очистите модифицированный холестерином CpG с помощью хроматографии обратной фазы, чтобы удалить загрязняющий эндотоксин, а также любые немодифицированные молекулы CpG.
- После получения от поставщика регидратируют лиофилизированный материал CpG в воде, не содержащей эндотоксинов, и очищают его на препаративной колонке C4 RP-ВЭЖХ с использованием градиента разделения, состоящего из 10 мМ триэтиламмония ацетата (TEAA) (подвижная фаза А) и ацетонитрила (подвижная фаза B).
ПРИМЕЧАНИЕ: Дополнительная информация приведена в таблице 2. - Объединяют и лиофилизируют фракции, содержащие модифицированный холестерином CpG. Чтобы обеспечить полное удаление остаточного TEAA, восстановите CpG с 15 мл воды, свободной от эндотоксинов, и повторите ее лиофилизацию три раза.
- После окончательной лиофилизации восстановите CpG в воде, не содержащей эндотоксинов (конечная концентрация CpG >20 мг/мл), аликвотном и храните его при -80 °C до тех пор, пока это не понадобится. Для добавления к составам разбавляйте CpG до концентрации 1–2,5 мг/мл.
ПРИМЕЧАНИЕ: FSL-1 выпускается в виде лиофилизированного порошка вакцинного качества. Его восстанавливают с помощью стерильной воды, не содержащей эндотоксинов, в концентрации 1 мг/мл. Вакцина вводится внутримышечно (в/м), при этом каждая доза содержит 10 мкг MOMP в общем объеме 50 мкл.
- После получения от поставщика регидратируют лиофилизированный материал CpG в воде, не содержащей эндотоксинов, и очищают его на препаративной колонке C4 RP-ВЭЖХ с использованием градиента разделения, состоящего из 10 мМ триэтиламмония ацетата (TEAA) (подвижная фаза А) и ацетонитрила (подвижная фаза B).
- Для достижения желаемой дозы препарата диализируют наночастицы в PBS и концентрируют их с помощью центробежного вакуумного концентратора перед добавлением адъюванта. При этом соблюдайте осторожность, чтобы не допустить полного высыхания образца — проверяйте объем образца каждые 20–30 минут во время центрифугирования.
- Добавьте адъювант в стерильных условиях в шкаф биобезопасности. Чтобы оценить успешность внедрения, проанализируйте конечные рецептуры и их компоненты с помощью аналитической размерно-эксклюзионной хроматографии (SEC).
ПРИМЕЧАНИЕ: Для этих препаратов использовалась колонка SEC в буфере PBS (скорость потока 0,5 мл/м), а элюирование было обнаружено с помощью матричного детектора с диодами UV-vis. Инклюзирование оценивали путем сравнения поглощения адъювантных частиц с поглощением неадъювантных частиц при 214 и 280 нм. - Перед использованием на животных храните адъювантный MOMP-tNLP и пустой tNLP при температуре 4 °C в течение 14 дней. Чтобы в полной мере оценить стабильность новой формулы tNLP, периодически анализируйте сохраненные tNLP по SEC.
ПРИМЕЧАНИЕ: Стабильность будет варьироваться от рецептуры к рецептуре.
11. Анализ сыворотки крови
- Получить самок 3-недельных мышей (BALB/c, n = 6).
- Вакцинируют мышей внутримышечно (в/м) в каждую заднюю конечность 10 мкг MOMP в форме MOMP-tNLP с адъювантом 5 мкг CpG и 1 мкг FSL-1 (общий объем на инъекцию = 50 мл).
- После вакцинации наблюдайте за мышами до тех пор, пока они не смогут сохранять грудное лежачее положение.
- Через четыре недели после первичной вакцинации (прайм) вакцинируйте животных второй раз (бустер) 10 мкг MOMP в форме MOMP-tNLP с адъювантом 5 мкг CpG и 1 мкг FSL-1 (общий объем на инъекцию = 50 мл).
- На 56-й день после первичной вакцинации сдать кровь для оценки титров антител. Начинают с обезболивания мышей путем внутривенного введения раствора ксилазина (0,3 мг/20 г массы тела) и кетамина (3,0 мг/20 г массы тела). Зажмите передние и задние лапы, чтобы убедиться, что не происходит рывков. Нанесите вазелин вокруг глаз, чтобы предотвратить сухость глаз во время анестезии.
- С помощью микрогематокритной капиллярной трубки проводят пункцию ретроорбитального сплетения. Соберите 100 мл крови в микроцентрифужную пробирку.
- После забора крови наблюдайте за мышами до тех пор, пока они не оправятся от анестезии и не смогут поддерживать лежачее положение грудины.
- Дайте крови свернуться при комнатной температуре в течение 30 минут, а затем открутите при концентрации 2000 × г в течение 10 минут. Соберите сыворотку и заморозьте при температуре -80 °C.
- В это время бросайте животным вызов Chlamydia muridarum или усыпляйте их. Усыпляют мышей, сначала вводя в/в раствор ксилазина (0,3 мг/20 г массы тела) и кетамина (3,0 мг/20 г массы тела) с последующим вывихом шейки матки.
- Тестируйте сывороточные антитела, специфичные для MOMP, используя методы вестерн-блоттинга, как описано выше. Объедините сыворотки мышей от всех иммунизированных мышей и используйте объединенную сыворотку вместо первичного антитела в разведении 1:5000.
Результаты
Профиль SDS-PAGE сродства Ni MOMP-tNLP из бесклеточной реакции объемом 1 мл показан на рисунке 1B. Реакция привела к высоким уровням экспрессии как MOMP, так и белка Δ49ApoA1. Предыдущие результаты показали, что бесклеточная экспрессия Δ49ApoA1 в присутствии DMPC и телодендримера приводила к образованию телодендримерных нанолипопротеиновых частиц (tNLPs)4. Совместное элюирование MOMP с Δ49ApoA1 показало, что MOMP ассоциирован с tNLP, так как His-тег присутствует только на tNLP-скаффолде Δ49ApoA1, а не на MOMP. MOMP представляет собой высоконерастворимый белок, который может быть элюирован только путем комплексообразования с tNLP, которые, как было показано, способствуют солюбилизации мембранных белков.
Фракции элюирования, содержащие MOMP-tNLP, объединяли и определяли концентрацию общего белка с помощью флуоресцентного количественного прибора или прибора, который измеряет концентрацию через поглощение при 280 нм, в соответствии с инструкциями производителя по количественному определению белка. Для точного дозирования вакцины MOMP также важно определить концентрацию MOMP в очищенных комплексах. Нами был разработан метод количественного определения MOMP на основе гель-денситометрии (рис. 2), в котором в качестве стандарта использовался очищенный рекомбинантный MOMP с известной концентрацией. Установив стандартную кривую и сравнив ее с образцом MOMP-tNLP, можно точно определить концентрацию MOMP. Определение концентрации MOMP в очищенном образце позволило оценить выход MOMP в бесклеточных реакциях в различных масштабах, что важно для планирования реакционной установки, подходящей для последующих исследований (табл. 3).
MOMP должен образовывать олигомеры, чтобы вызвать устойчивый иммунный ответ11. Для проверки олигомерного состояния MOMP был проведен анализ MOMP-tNLP в присутствии и отсутствии тепла и восстановителя дитиотрейтола (DTT, 50 мМ, рис. 3A). Олигомеры MOMP более высокого порядка были идентифицированы с помощью SDS-PAGE, когда образцы не обрабатывались теплом и DTT. Для сравнения, в образцах, обработанных теплом в присутствии ДТТ, на геле в основном были обнаружены две отдельные полосы, соответствующие MOMP и Δ49ApoA1 (приблизительно 40 кДа и 22 кДа, соответственно). Эти результаты очень похожи на гелевую полосчатость, связанную с образованием олигомеров MOMP, что имеет решающее значение для его эффективности.
Дальнейший вестерн-блоттинг-анализ с использованием MAb40, антитела против линейного эпитопа на вариабельном домене белка MOMP, показал аналогичную картину полосчатости, подтверждая образование олигомера белком MOMP в его неденатурированном состоянии (рис. 3B). Важным фактором, влияющим на образование олигомера MOMP, является соотношение между плазмидой MOMP и плазмидой Δ49ApoA1 во время установки внеклеточной реакции. В таблице 4 приведено соотношение плазмид и результирующая скорость вставки MOMP в tNLP. Предыдущие исследования показали, что хламидийный MOMP и другие белки внешней мембраны могут существовать в основном в виде тримеров12. Чтобы максимизировать образование тримера в бесклеточной реакции, желательно, чтобы скорость вставки была близка к трем MOMP-белкам на NLP, что соответствует соотношению ~25:1 MOMP-to-Δ49ApoA1 плазмиды.
В качестве более рационального метода выявления присутствия MOMP и tNLP был использован точечно-блоттинговый анализ. Антитела MAb40 использовали для выявления общего MOMP. Для оценки наличия tNLP использовали антитела MAbHIS, нацеленные на His-метку на каркасе Δ49ApoA1 tNLP. Косигнализация антител MAb40 и MAbHIS указывала на образование MOMP-tNLP. Контрольная реакция давала пустой tNLP, который показывал только положительный сигнал от MAbHIS (рис. 3C). Для проверки иммуногенности MOMP-tNLP, продуцируемых в бесклеточной реакции, мы адъювантировали MOMP-tNLP с CpG + FSL-1 и вводили внутримышечно (внутримышечно) мышам по схеме prime-boost, как описано выше. Сыворотки были собраны у иммунизированных мышей, и MOMP-специфические антитела IgG были измерены с помощью вестерн-блоттинг-анализа (рис. 4). Сыворотки мышей, которым вводили адъювантный MOMP-tNLP, показали сильное связывание MOMP, что указывает на то, что MOMP-tNLP может вызывать иммунный ответ in vivo.
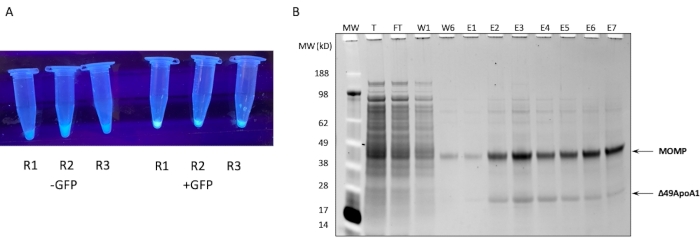
Рисунок 1: Экспрессия и очистка MOMP-tNLP. (A) Изображение пробирок, содержащих небольшие аликвоты внеклеточной реакции, которая успешно экспрессировала GFP, контролирует люминирование под источником ультрафиолетового света (справа) по сравнению с лизатами без плазмиды GFP (слева). (B) Протеиновый гель, окрашенный SYPRO Ruby после SDS-PAGE, показывает профиль очистки MOMP-tNLP. MOMP мигрирует при 40 кДа, а 49ApoA1 — при 22 кДа. Сокращения: MOMP = хламидий основного белка наружной мембраны; tNLP = телодендримерная частица нанолипопротеина; MOMP-tNLP = комплекс MOMP-tNLP; GFP = зеленая флуоресцентная плазмида, кодирующая белок; MW = маркер молекулярной массы; T = общий бесклеточный лизат; FT = проточный; R1-R3 = аликвоты бесклеточной реакции; W1, W6 = стирки 1 и 6; E1-E7 = элюции с 1 по 7; Δ49ApoA1 = Его тегированная производная мыши ApoA1. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 2: Количественное определение MOMP в образцах MOMP-tNLP . (A) Гель SDS-PAGE, окрашенный SYPRO Ruby для количественного определения MOMP. Рекомбинантный MOMP с известной концентрацией загружали на гель для получения стандартной кривой. Каждая дорожка содержала 0,1 мкг, 0,5 мкг, 1,0 мкг, 2,0 мкг и 4,0 мкг MOMP. Образцы MOMP-tNLP, которые подвергались количественному определению, загружались в тот же гель. (B) Стандартная кривая концентрации MOMP была построена с помощью денситометрии. Установлено уравнение, связывающее нормированную плотность полос и величину MOMP. Уравнение было использовано для расчета содержания MOMP в неизвестных образцах. Сокращения: MOMP = хламидий основного белка наружной мембраны; tNLP = телодендримерная частица нанолипопротеина; MOMP-tNLP = комплекс MOMP-tNLP; SDS-PAGE = электрофорез полиакриламидного геля с додецилсульфатом натрия. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
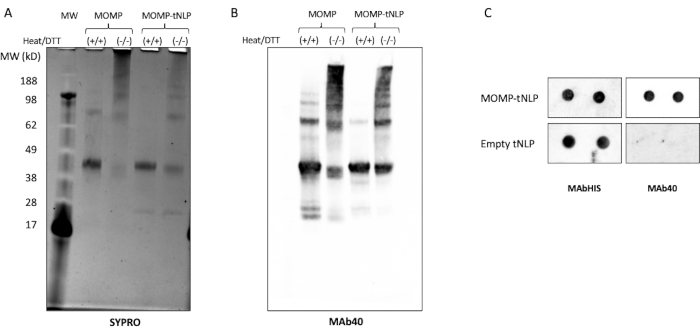
Рисунок 3: Бесклеточный MOMP-tNLP позволяет MOMP формировать структуры более высокого порядка. (A) Гель SDS-PAGE MOMP-TLP с обработкой и без обработки теплом и восстановителем DTT, окрашенный SYPRO Ruby. При нагревании и DTT MOMP в основном проявлялся в виде мономерной полосы при ~40 кДа, поскольку тепло и восстановитель разрушали большую часть структуры MOMP более высокого порядка. В отсутствие тепла и DTT присутствовали полосы более высокого порядка, что указывало на конформацию олигомеров MOMP. (Б) Вестерн-блот MOMP-tNLP и MOMP в отдельности, необработанный и обработанный теплом и DTT. После переноса мембрану исследовали с помощью MAb40 (разведение 1:1000). Была обнаружена полосатая структура, аналогичная гелю, окрашенному рубиновым цветом SYPRO, что подтверждает, что полосы с более высокой молекулярной массой действительно являются олигомерами MOMP. (C) Точечный блот MOMP-tNLP и пустые образцы tNLP (в двух экземплярах), исследованные с помощью MAb40 и MAbHIS. Сокращения: MOMP = хламидий основного белка наружной мембраны; tNLP = телодендримерная частица нанолипопротеина; MOMP-tNLP = комплекс MOMP-tNLP; SDS-PAGE = электрофорез полиакриламидного геля додецилсульфата натрия; ДТТ = дитиотрейтол. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
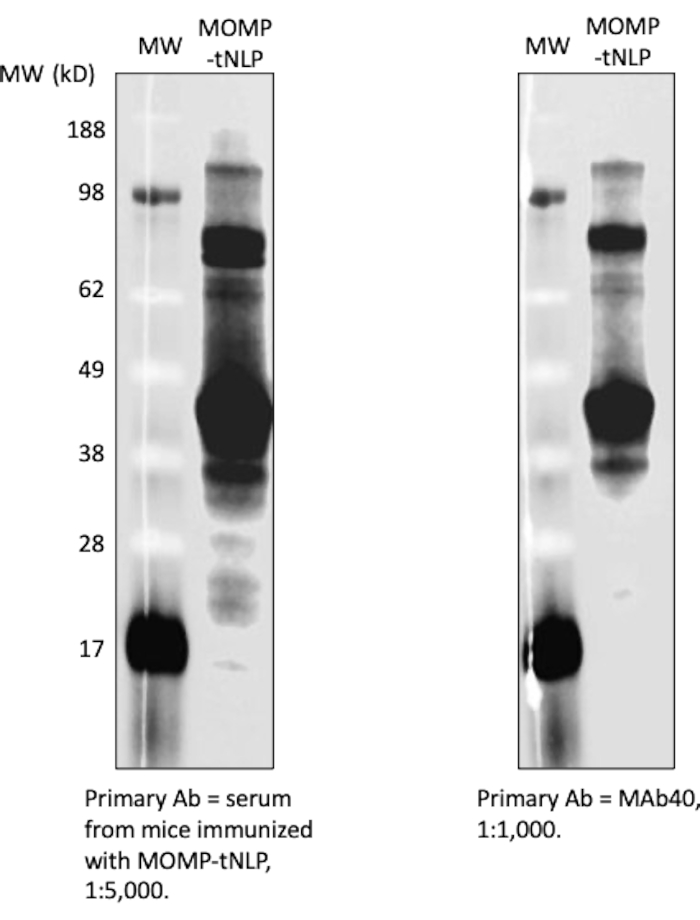
Рисунок 4: Бесклеточный MOMP-tNLP обладает высокой иммуногенностью. Сыворотка крови иммунизированных мышей показала сильный анти-MOMP сигнал IgG. Для иммунизации мышей использовали MOMP-tNLP с адъювантом CpG + FSL-1. Сыворотки шести иммунизированных мышей были собраны, объединены и использованы для зондирования MOMP-tNLP. Сыворотка смогла связываться с MOMP в вестерн-блоттинг-анализе и показала сильный сигнал IgG (слева). Вестерн-блоттинг с использованием MAb40 в качестве первичного антитела (справа) показал аналогичные полосы, что указывает на то, что сыворотка содержала MOMP-специфичный IgG. Сокращения: MOMP = хламидий основного белка наружной мембраны; tNLP = телодендримерная частица нанолипопротеина; MOMP-tNLP = комплекс MOMP-tNLP; CpG = модифицированный холестерином адъювант CpG; FSL-1 = липофильный адъювант. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
| Имя буфера | 2PO4 | NaCl | Имидазол | рН |
| Буфер привязки | 50 мМ | 300 мМ | 10 мМ | 8.0 |
| Буфер промывки | 50 мМ | 300 мМ | 20 мМ | 8.0 |
| Элюирующий буфер 1 | 50 мМ | 300 мМ | 250 мМ | 8.0 |
| Элюирующий буфер 2 | 50 мМ | 300 мМ | 500 мМ | 8.0 |
Таблица 1: Список буферов, необходимых для очистки по сродству никеля, с подробным описанием концентраций каждого компонента и рН.
| Среды выполнения | 50 мин |
| Расход | 6,0 мл/мин |
| Градиентный тип | Двоичный |
| Буфер А | 10 мМ TEAA в H20 |
| Буфер B | МеКН |
| Градиент | % буфера B |
| 0 мин | 25% |
| 30 мин | 60% |
| 30,5 мин | 100% |
| 40 мин | 100% |
| 40,5 мин. | 25% |
| 50 мин | 25% |
Таблица 2: Условия для очистки обращенной фазы ВЭЖХ модифицированного холестерином CpG. Сокращения: ТЭАА = триэтиламмоний ацетат; MeCN = ацетонитрил.
| Бесклеточный лизат (мл) | Липид DMPC (мг) | Телодендример (мг) | Плазмида MOMP (мкг) | Выход очищенного MOMP (мг) |
| 1 | 4 | 0.4 | 15 | 0.5 |
| 2 | 8 | 0.8 | 30 | 1.1 |
| 3 | 12 | 1.2 | 45 | 1.6 |
| 5 | 20 | 2 | 75 | 2.7 |
Таблица 3: Количество липидов, телодендримеров и плазмид, используемых для бесклеточных реакций различного масштаба, и соответствующие выходы. Сокращения: MOMP = хламидий основного белка наружной мембраны; ДМФК = 1,2-димиристоил-sn-глицеро-3-фосфохолин.
| Коэффициенты входа плазмиды, MOMP : Δ49ApoA1 | 1:1 | 5:1 | 10:1 | 25:1 | 50:1 | 100:1 | |
| Соотношение количества вырабатываемого белка, MOMP : Δ49ApoA1 | 0.02 | 0.32 | 0.64 | 3.46 | 6.55 | 20.04 | |
| Расчетное количество вставок MOMP на tNLP | 0.03 | 0.37 | 0.75 | 4.04 | 7.65 | 23.39 | |
Таблица 4: Соотношение плазмид в бесклеточной реакции и результирующая скорость введения MOMP. Сокращения: MOMP = хламидий основного белка наружной мембраны; tNLP = телодендримерная частица нанолипопротеина; Δ49ApoA1 = Его тегированная производная мыши ApoA1.
Обсуждение
Хламидиоз является наиболее распространенной инфекцией, передающейся половым путем, которая поражает как мужчин, так и женщин. Несмотря на то, что исследования вакцины против хламидиоза длятся десятилетиями, безопасная и эффективная вакцина, которую можно было бы масштабировать до массового производства, остается труднодостижимой13. Хламидийный MOMP считается ведущим кандидатом в качестве защитного вакцинного антигена; однако MOMP обладает высокой гидрофобностью и склонен к неправильному складыванию14,15. Дальнейшие исследования показали, что MOMP существует в олигомерных состояниях, которые необходимы для его иммуногенности11. Здесь подробно описан валидированный метод бесклеточной коэкспрессии, который производит олигомерный MOMP, образующийся в наночастице tNLP в качестве вакцины, с выходом примерно 1,5 мг очищенного MOMP на 3 мл лизата. Эта полностью упорядоченная процедура может быть в дальнейшем масштабирована для промышленного производства, что повысит ее перспективы в качестве полезного подхода к созданию вакцин.
Ранее мы публиковали работы об использовании бесклеточной экспрессии для получения мембранных белков, встроенных в NLP 3,16, а также экспрессии в диски, стабилизированные телодендримерами. Однако этот последний метод позволил получить мембранно-белковые частицы с большей гетерогенностью и меньшей растворимостью. 4 Кроме того, иммуногенность частиц MOMP-телодендримера неясна по сравнению с частицами MOMP-tNLP6.
Эта процедура может быть адаптирована для увеличения экспрессии бактериальных мембранных белков, которые являются перспективными кандидатами в качестве антигенов для использования в субъединичных вакцинах. Эта процедура не только производит солюбилизированный бактериальный мембранный белок, но и общая структура наночастиц поддается дальнейшей модификации с использованием различных липофильных вакцинных адъювантов, включая, помимо прочего, CpG, конъюгированный с фрагментом холестерина или FSL-1. Экспрессия других антигенов-кандидатов из бактерий возможна, хотя для достижения оптимальных выходов может потребоваться изучение таких параметров, как температура экспрессии, выбор липидов и тип системы экспрессии.
Кроме того, выбор и соотношение плазмид имеют решающее значение в этом процессе. Обе используемые плазмиды должны быть построены из одного и того же каркаса. Если вставки имеют примерно одинаковую длину, соотношения могут быть основаны на массе добавленной плазмиды, как описано здесь. Тем не менее, соотнесение на основе кротов даст более воспроизводимые результаты, особенно при масштабировании реакций. Соотношения, которые хорошо работают в реакциях масштаба экрана (< 0,5 мл), могут быть неприменимы к более крупным реакциям и могут потребовать дополнительной оптимизации. Немембранные белки все еще могут быть экспрессированы с помощью бесклеточных наборов, но могут не требовать липидных наночастиц (коэкспрессия) для получения растворимого продукта. Кроме того, несмотря на то, что в этом протоколе описывается адъювантирование с помощью CpG и FSL-1, эта система поддается составлению с другими липофильными адъювантами или смешиванию с растворимыми адъювантами по желанию.
Важно избегать контаминации при постановке реакции бесклеточной экспрессии, так как это может повлиять на выход. Любые добавки к реакции, в том числе и сами плазмиды, должны быть высокой чистоты. Кроме того, экспрессируемые белки должны контактировать только с материалами и растворами, свободными от загрязнения эндотоксинами. Контаминация эндотоксинами в препаратах-кандидатах может привести к противоречивым и ложным результатам иммунологических анализов и может быть вредной в достаточных количествах. Хотя это и не описано здесь, дополнительная очистка после хроматографии сродства никеля может потребоваться, если на последующих этапах анализа, например, с помощью SDS-PAGE, обнаруживается много загрязняющих веществ. Это может быть достигнуто с помощью SEC, хотя условия могут потребовать оптимизации на основе каждой рецептуры.
Раскрытие информации
Авторы заявляют, что у них нет известных конкурирующих финансовых интересов или личных отношений, которые могли бы повлиять на работу, представленную в этой статье.
Благодарности
Эта работа была поддержана грантом Службы общественного здравоохранения R21 AI20925 и AI144184 U19 от Национального института аллергии и инфекционных заболеваний. Работа выполнена под эгидой Министерства энергетики США Ливерморской национальной лабораторией им. Лоуренса по контракту DE-AC52-07NA27344 [LLNL-JRNL-822525, LLNL-VIDEO-832788].
Материалы
| Name | Company | Catalog Number | Comments |
| 1,2-dimyristoyl-sn-glycero-3-phosphocholine (DMPC) as powder | Avanti Polar Lipids | 850345 | |
| 1.5 mL endotoxin-free centrifuge tubes | Eppendorf | 2600028 | |
| 1 M Trizma hydrochloride solution | Millipore Sigma | T2194 | |
| Acetic acid, glacial, ACS reagent, ≥99.7% | Millipore Sigma | 695092 | |
| Bio-Dot apparatus | Bio-Rad | 1706545 | |
| Buffer Dam for XCell SureLock | Life Technologies | EI0012 | |
| C24 Incubator shaker | New Brunswick Scientific | ||
| Cell-Free Expression System: RTS 500 ProteoMaster E. coli HY Kit | BiotechRabbit | BR1400201 | |
| cOmplete His-Tag Purification Resin | Roche Molecular Diagnostics | 5893682001 | |
| cOmplete, EDTA-free Protease Inhibitor Cocktail | Roche Molecular Diagnostics | 4693132001 | |
| CpG-ODN1826 | Biosearch Technologies | T9449 | |
| D-(+)-Trehalose dihydrate | Millipore Sigma | 71509 | |
| Dialysis tubes D-Tube Dialyzer Maxi | Millipore Sigma | 71508-3 | |
| Disposable, polypropylene fritted columns 10 mL capacity | Bio-Rad | 7311550EDU | |
| Dulbecco’s Phosphate-buffered Saline (PBS) | Millipore Sigma | D8537 | |
| Electrophoresis Power Supply | |||
| Endosafe PTS cartridge | Thermo Fisher Scientific | NC9594798 | |
| Endosafe-PTS Testing System | Charles River | ||
| Gel wash solution: 10% methanol, 7% acetic acid | |||
| HCl and NaOH solutions for pH adjustment | |||
| HPLC with UV-vis diode array detector | Shimadzu | ||
| HyClone HyPure culture-grade water | VWR | 82007-328 | |
| iBlot 2 Dry Blotting System | Life Technologies | ||
| iBlot 2 Transfer Stacks, PVDF | Life Technologies | IB24001 | |
| Image Studio V2.0 software | Li-COR Biiosciences | ||
| Imidazole | Millipore Sigma | I5513 | |
| Immun-Blot PVDF Membrane | Bio-Rad | 1620177 | |
| LI-COR Odyssey Fc imager | Li-COR Biiosciences | ||
| Lyophilizer | Labconco | ||
| Methanol (≥99.9%) | Millipore Sigma | 34860 | |
| Microcentrifuge | |||
| Microwave oven | |||
| NanoDrop One/OneC Microvolume UV-Vis Spectrophotometer | Thermo Fisher Scientific | ND-ONE-W | |
| NuPAGE 4 to 12%, Bis-Tris, 1.0 mm | Life Technologies | NP0321 | |
| NuPAGE LDS Sample Buffer (4x) | Life Technologies | NP0007 | |
| NuPAGE MES SDS Running Buffer (20x) | Life Technologies | NP000202 | |
| NuPAGE Sample Reducing Agent (10x) | Life Technologies | NP0009 | |
| Odyssey Blocking Buffer in TBS containing 0.2% Tween 20 | Li-COR Biosciences | 927-50000 | |
| Orbital Shaker | |||
| PBS-T (1x PBS, 0.2% Tween 20, pH 7.4) | |||
| PEG5K-CA8 Telodendrimer (custom synthesis product) | |||
| pIVEX2.4d vector | Roche Molecular Diagnostics | ||
| Plasmid Maxi Kit | Qiagen | 12162 | |
| Primary antibody: MAb40 (monoclonal antibody to the variable domain 1 (VD1) of C. muridarum MOMP, de la Maza laboratory)4 | |||
| Primary antibody: MAbHIS, Penta-His antibody | Qiagen | 34660 | |
| Probe sonicator | |||
| Qubit 3.0 Fluorometer | Life Technologies | Q33216 | |
| Qubit Protein Assay Kit | Life Technologies | Q33212 | |
| Rainin Pipette tips: LTS 1000 µL | Rainin | 17002428 | |
| Rainin Pipette tips: LTS 20 µL | Rainin | 17002429 | |
| Rainin Pipette tips: LTS 200 µL | Rainin | 17002426 | |
| Rainin Pipettes | Rainin | ||
| Secondary antibody: IRDye 800CW goat (polyclonal) anti-mouse IgG (heavy and light) | Li-COR Biosciences | 926-32210 | |
| SeeBlue Plus2 Pre-stained Protein Standard | Life Technologies | LC5925 | |
| Sodium chloride NaCl | Millipore Sigma | S7653 | |
| Sodium phosphate monobasic NaH2PO4 | Millipore Sigma | S0751 | |
| Superdex 200, 5/150 GL column | Cytiva | GE28-9909-45 | |
| Synthetic diacylated lipoprotein-TLR2/6 FSL-1 | Invivogen | tlrl-fsl | |
| SYPRO Ruby Protein Gel Stain | Life Technologies | S12001 | |
| TWEEN 20 | Millipore Sigma | P1379 | |
| UV light source | |||
| Vacufuge Bench Top Centrifuge | Eppendorf | ||
| Vortexer | |||
| VWR 15 mL conicals (89039-666) | VWR | ||
| VWR 50 mL conicals (89039-656) | VWR | ||
| XCell SureLock Mini-Cell (Life Technologies ) | Life Technologies | EI0001 |
Ссылки
- Carlson, E. D., Gan, R., Hodgman, C. E., Jewett, M. C. Cell-free protein synthesis: applications come of age. Biotechnology Advances. 30 (5), 1185-1194 (2012).
- Coleman, M. A., et al. Expression and association of the Yersinia pestis translocon proteins, YopB and YopD, are facilitated by nanolipoprotein particles. PLoS One. 11 (3), 0150166(2016).
- Cappuccio, J. A., et al. Cell-free co-expression of functional membrane proteins and apolipoprotein, forming soluble nanolipoprotein particles. Molecular & Cellular Proteomics: MCP. 7 (11), 2246-2253 (2008).
- He, W., et al. Controlling the diameter, monodispersity, and solubility of ApoA1 nanolipoprotein particles using telodendrimer chemistry. Protein Science. 22 (8), 1078-1086 (2013).
- He, W., et al. Cell-free production of a functional oligomeric form of a Chlamydia major outer-membrane protein (MOMP) for vaccine development. Journal of Biological Chemistry. 292 (36), 15121-15132 (2017).
- Tifrea, D. F., et al. Induction of protection in mice against a Chlamydia muridarum respiratory challenge by a vaccine formulated with the major outer membrane protein in nanolipoprotein particles. Vaccines. 9 (7), 755(2021).
- Cleveland, T. E., et al. Small-angle X-ray and neutron scattering demonstrates that cell-free expression produces properly formed disc-shaped nanolipoprotein particles. Protein Science. 27 (3), 780-789 (2018).
- Fischer, N. O., et al. Conjugation to nickel-chelating nanolipoprotein particles increases the potency and efficacy of subunit vaccines to prevent West Nile encephalitis. Bioconjugate Chemistry. 21 (6), 1018-1022 (2010).
- Fischer, N. O., et al. Colocalized delivery of adjuvant and antigen using nanolipoprotein particles enhances the immune response to recombinant antigens. Journal of the American Chemical Society. 135 (6), 2044-2047 (2013).
- Fischer, N. O., et al. Evaluation of nanolipoprotein particles (NLPs) as an in vivo delivery platform. PLoS One. 9 (3), 93342(2014).
- Pal, S., Peterson, E. M., de la Maza, L. M. Vaccination with the Chlamydia trachomatis major outer membrane protein can elicit an immune response as protective as that resulting from inoculation with live bacteria. Infection and Immunity. 73 (12), 8153-8160 (2005).
- Sun, G., et al. Structural and functional analyses of the major outer membrane protein of Chlamydia trachomatis. Journal of Bacteriology. 189 (17), 6222-6235 (2007).
- Hafner, L. M., Wilson, D. P., Timms, P. Development status and future prospects for a vaccine against Chlamydia trachomatis infection. Vaccine. 32 (14), 1563-1571 (2014).
- Findlay, H. E., McClafferty, H., Ashley, R. H. Surface expression, single-channel analysis and membrane topology of recombinant Chlamydia trachomatis Major Outer Membrane Protein. BMC Microbiology. 5, 5(2005).
- Sun, G., Pal, S., Weiland, J., Peterson, E. M., de la Maza, L. M. Protection against an intranasal challenge by vaccines formulated with native and recombinant preparations of the Chlamydia trachomatis major outer membrane protein. Vaccine. 27 (36), 5020-5025 (2009).
- He, W., et al. Cell-free expression of functional receptor tyrosine kinases. Scientific Reports. 5 (1), 12896(2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены