Method Article
Aşı Geliştirme için Chlamydia muridarum'dan Rekombinant Majör Dış Membran Proteinine Hücresiz Ölçekli Üretim ve Adjuvan İlavesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu protokol, alt birim aşılarda antijen olarak kullanılabilen nanodiskte desteklenen zar proteinleri üretmek için ticari, hücresiz protein ekspresyon kitlerinin kullanılmasını açıklar.
Özet
Alt birim aşılar, güvenlik, stabilite ve standart üretim açısından daha geleneksel inaktive edilmiş veya zayıflatılmış tam hücre kaynaklı aşılara göre avantajlar sunar. Etkili bir protein bazlı alt birim aşısı elde etmek için, protein antijeninin genellikle doğal benzeri bir konformasyon benimsemesi gerekir. Bu, özellikle zara bağlı proteinler olan patojen yüzey antijenleri için önemlidir. Hücresiz yöntemler, yaygın olarak nanodiskler olarak bilinen nanolipoprotein parçacıklarının (NLP'ler) birlikte çevrilmesi yoluyla doğru katlanmış fonksiyonel zar proteini üretmek için başarıyla kullanılmıştır.
Bu strateji, lipide bağlı bir ortamda zar proteinlerinden oluşan alt birim aşıları üretmek için kullanılabilir. Bununla birlikte, hücresiz protein üretimi genellikle küçük ölçekle (<1 mL) sınırlıdır. Küçük ölçekli üretim çalışmalarında üretilen protein miktarı genellikle biyokimyasal ve biyofiziksel çalışmalar için yeterlidir. Bununla birlikte, hayvan modellerinde aşı çalışmaları için yeterli protein elde etmek için hücresiz sürecin ölçeklendirilmesi, optimize edilmesi ve dikkatli bir şekilde test edilmesi gerekir. Saflaştırma, adjuvan ilavesi ve liyofilizasyon gibi aşı üretiminde yer alan diğer süreçlerin paralel olarak optimize edilmesi gerekir. Bu makale, zara bağlı bir protein alt birim aşısını eksprese etmek, saflaştırmak ve formüle etmek için ölçeklendirilmiş bir protokolün geliştirilmesini bildirmektedir.
Ölçeklendirilmiş hücresiz reaksiyonlar, formüle edilmiş nanolipoprotein partiküllerinin yüksek seviyeli üretimi için çoklu plazmit ekspresyon vektörleri, lipid seçimi ve adjuvan ilavesi kullanılırken plazmit konsantrasyonlarının ve oranlarının optimizasyonunu gerektirir. Yöntem burada bir klamidyal majör dış membran proteininin (MOMP) ekspresyonu ile gösterilmiştir, ancak diğer membran protein antijenlerine yaygın olarak uygulanabilir. Antijen etkinliği, burada gösterildiği gibi, antikor üretimini ölçmek için bağışıklama çalışmaları yoluyla in vivo olarak değerlendirilebilir.
Giriş
Proteinlerin hücresiz ekspresyonu için prokaryotik veya ökaryotik lizatlar, ilgilenilen proteinleri sentezlemek için ticari ürünler olarak kolayca temin edilebilir (tam bir inceleme için, bkz. 1). Bu ekspresyon sistemleri çeşitli ölçeklerde mevcuttur ve E. coli, tütün bitkileri ve memeli kültürleri dahil olmak üzere çeşitli organizmalardan lizatları kullanır. Hücresiz lizatlar, kullanım kolaylığı ve sağlam, hızlı protein üretimi dahil olmak üzere geleneksel rekombinant protein üretim yaklaşımlarına göre birçok fayda sunar. Bu yaklaşımlar öncelikle çözünür proteinler üretmek için kullanılırken, bu grup membran proteinlerini eksprese etmek için kullanımları için bir yaklaşıma öncülük etmiştir.
Bu yeni yaklaşım, ekspresyon için iki protein ürününü, bir apolipoproteini ve ilgilenilen zar proteinini kodlayan DNA'yı dahil ederek mevcut hücresiz ekspresyon sistemlerinde küçük değişiklikler yapar. Eksprese edilen apolipoprotein (ApoA1 veya ApoE4'ün türevleri), kendiliğinden (~ 20 nm) NLP'leri birleştirmek için hücresiz lizata eklenen lipitlerle etkileşime girer. İlgilenilen bir membran proteini ile birlikte çevrildiğinde, NLP ve membran proteini, membran proteininin NLP lipid çift tabakası içine gömüldüğü çözünür bir nanopartikül kompleksi oluşturur. Bu nedenle, membran proteini, çözünür, ayrık parçacıklar içinde bulunduğundan, sonraki uygulamalar için daha erişilebilirdir. Bu yaklaşım, NLP çift tabakası2 içinde fonksiyonel oligomerik protein kompleksleri üretebilir ve daha sonra in vivo değerlendirme için uygun ko-lokalize antijen ve adjuvan içeren bir nanopartikül aşısı oluşturmak için lipofilik adjuvanlarla karıştırılan bir alt birim aşının antijen bileşenini üretebilir.
Bu geçerli yöntem, daha önce yayınlanmış bir protokol3'ten değiştirilmiştir. Anahtar modifikasyonlar, hücresiz reaksiyonun ölçeklendirilmesine ve ardından protein-NLP kompleksinin saflaştırılmasına odaklanmıştır. Başka bir modifikasyon, hücresiz reaksiyona eklenmeden önce lipitlerle karıştırılan telodendrimer olarak bilinen amfifilik bir polimerin eklenmesini içerir. Telodendrimer ve lipitlerin varlığında plazmitlerin birlikte translasyonu, bir telodendrimer NLP (tNLP) üretir. Telodendrimerin eklenmesi, elde edilen tNLP nanopartiküllerinin boyutunu ve monodispersitesini modüle etmeye de yardımcı olur4. Bu protokol, membrana bağlı bir alt birim antijen proteini olan klamidyal MOMP 5,6'yı üretmek için büyük ölçekli aşı çalışmaları için özel olarak optimize edilmiştir. Yöntem, MOMP oligomerizasyonunu koruyan yüksek oranda çözünür bir MOMP-tNLP kompleksi oluşturmak için tNLP ile ilişkili rekombinant MOMP üretir. Tipik bir 3 mL ölçek büyütme üretimi, >1.5 mg saflaştırılmış MOMP verir. Hücresiz üretilen MOMP-tNLP, in vivo immünojenisite testi için hızlı adjuvan ilavesine uygundur.
Protokol
Tüm hayvan çalışmaları, Kaliforniya Üniversitesi, Irvine'de, Kurumsal Hayvan Bakımı ve Kullanımı Komitesi tarafından belirlenen yönergelere uygun olarak Halk Sağlığı Hizmeti (PHS) güvenceli tesislerde gerçekleştirildi.
1. Züccaciye hazırlama
NOT: Hayvanlar için aşı sınıfı formülasyonların üretiminde kullanılan tüm malzemeler endotoksin içermez.
- Kirletici endotoksini yok etmek için, tamponları 180 ° C'de 4 saat boyunca bir fırında tutacak temizlenmiş cam eşyaları pişirin.
2. Tampon hazırlama
- Tablo 1'de listelenen 250 mL Ni afinite saflaştırma tamponu hazırlayın. 4 °C'de 6 aya kadar saklayın.
3. Reaksiyon hazırlığı
- 20 mg 1,2-dimyristoyl-sn-glisero-3-fosfokolin (DMPC) endotoksin içermeyen, 1.5 mL'lik bir santrifüj tüpüne tartın. 1 mL endotoksin içermeyen suda çözün, 1 dakika boyunca 6 A'da en az dört kez sonik hale getirin, aralarında 1 dakika duraklama olsun, berraklaşana kadar. 22 ° C'de 2 dakika boyunca 13.000 × g'da santrifüjleme yoluyla probdaki kirletici metalleri çıkarın ve ardından çözünmüş lipidi yeni bir 1.5 mL endotoksin içermeyen tüpe aktarın.
- 1 mg PEG5k-CA8 telodendrimer'i 1.5 mL endotoksin içermeyen bir tüpe tartın. Endotoksin içermeyen suda 20 mg/mL konsantrasyonda çözün. Tamamen eriyene kadar vorteks yapın ve 2 mg / mL'ye seyreltin.
- Yeni bir endotoksin içermeyen tüpte, 210 μL 20 mg / mL DMPC çözeltisini 210 μL 2 mg / mL telodendrimer çözeltisi ile birleştirin.
4. Alt birim aşı formülasyonları için MOMP-tNLP'lerin hücresiz üretimi
- Daha önce yayınlanmış bir protokolden değiştirilmiş hücresiz yöntemler kullanarak MOMP-tNLP'leri hazırlayın5.
- Hücresiz reaksiyonu kurmadan iki saat önce, prokaryotik hücresiz protein ekspresyon kitini açın ve sulandırma tamponlarından birini çözün. Çözüldükten sonra, bir tablet EDTA içermeyen proteaz inhibitör kokteyli ekleyin ve tamamen çözünmesine izin verin.
- 5 x 1 mL reaksiyonları çalıştırmak için tasarlanmış bir kit kullanarak bu protokolü izleyin.
NOT: Tipik bir ölçek büyütme üretimi 3 x 1 mL'dir.- Her 1 mL reaksiyon için, E. coli lizat şişesine 525 μL sulandırma tamponu ekleyin ve çözünmesi için hafifçe yuvarlayın. Reaksiyon katkı maddeleri (örneğin, ATP, GTP) içeren şişeye 250 μL sulandırma tamponu ekleyin ve çözünmesi için hafifçe yuvarlayın.
- Reaksiyon besleme şişesine 8.1 mL sulandırma tamponu ekleyin, lastik bir tıpa ile kapatın (kauçuk tıpanın iç kısmına dokunmamaya dikkat edin) ve çözünmesi için hafifçe ters çevirin/yuvarlayın.
- Amino asit karışım şişesine 3 mL sulandırma tamponu ekleyin, lastik bir tıpa ile kapatın ve çözünmesi için hafifçe ters çevirin / yuvarlayın.
NOT: Kirlenmeye neden olabileceğinden lastik tıpanın iç kısmına dokunmamaya dikkat edin. - Metiyonin şişesine 1.8 mL sulandırma tamponu ekleyin, çözünmesi için hafifçe yuvarlayın ve ardından kullanıma kadar buz üzerinde saklayın.
- Reaksiyon çözeltisini hazırlayın.
- E. coli lizat şişesine 225 μL sulandırılmış Reaksiyon Karışımı, 270 μL metiyonin içermeyen sulandırılmış amino asit karışımı ve 30 μL sulandırılmış metiyonin ekleyin. Ek olarak, 400 μL DMPC / telodendrimer karışımı, 15 μg MOMP plazmidi ve 0.6 μg Δ49ApoA1 plazmidi ekleyin. Karıştırmak için yuvarlayın/hafifçe sallayın.
NOT: Her iki plazmitin de aynı plazmit omurgasından oluşturulduğundan emin olun. Girdap yapmayın. - Toplam çözeltinin 20 μL'sini alın ve GFP eksprese eden kontrol reaksiyonu için 1.5 mL'lik bir tüpte bir kenara koyun (aşağıya bakınız).
- E. coli lizat şişesine 225 μL sulandırılmış Reaksiyon Karışımı, 270 μL metiyonin içermeyen sulandırılmış amino asit karışımı ve 30 μL sulandırılmış metiyonin ekleyin. Ek olarak, 400 μL DMPC / telodendrimer karışımı, 15 μg MOMP plazmidi ve 0.6 μg Δ49ApoA1 plazmidi ekleyin. Karıştırmak için yuvarlayın/hafifçe sallayın.
- Besleme çözeltisini hazırlayın. Yem karışımı şişesine, metiyonin içermeyen 2.65 mL sulandırılmış amino asit karışımı ve 300 μL sulandırılmış metiyonin ekleyin. Çözünmesi için yuvarlayın/hafifçe sallayın.
NOT: Şu anda, kullanılmayan sulandırma tamponu ve Metiyonin, saklama için dondurucuya geri gönderilebilir. - 1 mL reaksiyon solüsyonunu hücresiz reaksiyon kitinde sağlanan iç reaksiyon odasına aktarın ve doldurulduğunda kapatın. Besleme çözeltisinin 10 mL'sini reaksiyon kabının dış haznesine aktarın ve kapatın.
NOT: Hazneleri aşırı doldurmayın! Hem iç reaksiyon odasının hem de iç besleme odasının tepesinde hava kabarcıklarının varlığı reaksiyonu olumsuz yönde etkileyecektir. Kalan herhangi bir reaksiyon çözeltisi 1.5 mL'lik bir tüpe yerleştirilebilir ve ana kap ile birlikte karışmasına izin verilebilir. - Daha önce alıntılanmış 20 μL reaksiyon karışımına 0.5 μL GFP kontrol plazmidi (0.5 mg/mL) ekleyin.
NOT: Birçok kit, kalite kontrol amacıyla bir kontrol plazmidi ile birlikte verilir. Bir T7 promotörü ve E.coli ribozom bağlanma bölgesi (RBS) ile plazmidi eksprese eden çoğu GFP, kontrol plazmidi olarak da kullanılabilir. - Reaksiyonu 300 rpm'de, 30 °C'de 18 saate kadar bir çalkalayıcıya yerleştirin. Reaksiyonun başarılı olduğunu doğrulamak için, 15 dakika kadar kısa bir inkübasyondan sonra kontrol GFP'sinin (Şekil 1A) sentezine bağlı floresan olup olmadığını kontrol etmek için bir UV ışık kaynağı kullanın.
NOT: Bu koşulların, özellikle sıcaklığın, diğer zar proteinlerinin ekspresyonu için optimize edilmesi gerekebilir.
5. MOMP-tNLP saflaştırma
- Δ49ApoA1 proteini üzerindeki His-etiketini kullanarak MOMP-tNLP nanopartikül kompleksini hücresiz reaksiyon karışımından saflaştırmak için hareketsizleştirilmiş nikel afinite kromatografisi kullanın.
- 1 mL %50 His-Tag Saflaştırma Reçinesi bulamacını tek kullanımlık 10 mL'lik bir kromatografi kolonuna aktarın ve 3 mL Bağlayıcı tampon ile dengeleyin.
- Tamponun boşalmasına izin verin, çıkışı kapatın ve reçineye 250 μL Bağlayıcı tampon ekleyin.
- Hücresiz reaksiyonu kolona eklemeden önce, SDS-PAGE tarafından daha sonra analiz edilmek üzere 20 μL kaydedin. Hücresiz reaksiyonu dengelenmiş reçine ile karıştırın ve 1 saat boyunca 4 ° C'de bir laboratuvar külbütörü üzerinde inkübe edin.
- Kolonun kapağını açın, kapağı 500 μL ek Bağlama tamponu ile yıkayın ve bu sıvıyı kolonun geri kalanına ekleyin.
- SDS-PAGE tarafından daha sonra analiz edilmek üzere sıvı akışını kolondan toplayın.
- Kolonu 20 mM imidazol içeren 1 mL yıkama tamponu ile altı kez yıkayın ve fraksiyonları toplayın. Reçinenin yıkamalar arasında kurumasına izin vermeyin. İkinci yıkamada, 1 mL'lik bir pipet kullanarak yukarı ve aşağı pipetleyerek reçineyi kuvvetlice çalkalayın.
- MOMP-tNLP'leri altı adet 300 μL'lik Elüsyon tamponu 1 fraksiyonunda (250 mM imidazol içeren) ve ardından 300 μL Elüsyon tamponu 2 (500 mM imidazol içeren) ile son bir elüsyon elde edin. İkinci elüsyonda, 1 mL'lik bir pipet kullanarak yukarı ve aşağı pipetleyerek reçineyi kuvvetlice çalkalayın.
6. SDS-PAGE ile Analiz
NOT: Tüm elüsyon fraksiyonları, ilgilenilen proteinin miktarını ve saflığını taramak için SDS-PAGE ile analiz edilmelidir.
- Toplam lizat ve akışın her biri için 1 μL ve ardından toplanan tüm yıkama ve elüsyon fraksiyonları için 5 μL yükleyin.
- Ayrıştırılmış MOMP-tNLP'lerin, yıkamaların, akışın ve toplam lizatın alikotlarını 4x SDS-PAGE numune yükleme tamponu ile karıştırın. Aksi belirtilmedikçe numuneleri 10x numune indirgeyici ajan ile karıştırın ve ısıyla denatüre edin.
- Fraksiyonları, uygun bir moleküler ağırlık standardı ile birlikte 1.0 mm, %4 ila 12, 1x MES-SDS çalışma tamponlu Bis-Tris SDS-PAGE jelleri kullanarak jel elektroforezi ile analiz edin. Jelleri 200 V'ta 35 dakika çalıştırın.
- Jelleri üreticinin talimatlarına göre boyayın.
- Jeli kasetten çıkarın ve 60 mL jel lekesine yerleştirin. Jel lekesindeki jeli 30 saniye mikrodalgada ısıtın ve ısıyı eşit olarak dağıtmak için kabı 30 saniye hafifçe sallayın. Lekedeki jeli 30 saniye daha 80-85 °C'ye mikrodalgada ısıtın ve jeli 5 dakika sallamak için bir orbital çalkalayıcı üzerine yerleştirin.
- Jeli 30 saniye boyunca üçüncü kez mikrodalgada ısıtın ve ardından 23 dakika daha sallamak için orbital çalkalayıcıya geri dönün.
- Jeli temiz bir kaba aktarın ve 100 mL yıkama solüsyonunda (%10 metanol, %7 asetik asit) 30 dakika yıkayın.
NOT: Yıkama solüsyonunun ısıtılmasını önlemek gerekli olduğundan bu kritik bir adımdır. Bunun yapılmaması, son jel görüntüsünde arka plan lekelenmesine ve düzensizliklere neden olabilir. - Yıkadıktan sonra, jeli ultra saf suda iki kez 5 dakika durulayın.
- Jelleri 600 nm'de bir jel görüntüleyici kullanarak görüntüleyin (Şekil 2). Karşılaştırma için bir protein standardı varsa, nanopartikül çözeltisindeki tek tek protein miktarını ölçmek için SDS-PAGE'i kullanın.
NOT: Bu örnekte, rekombinant olarak eksprese edilen MOMP'nin seri dilüsyonları SDS-PAGE ile çözülür ve bantların yoğunlukları enstrüman yazılımı kullanılarak ölçülür. - MOMP bantlarının yoğunluklarını kullanarak standart bir eğri oluşturun. MOMP-tNLP örneklerini aynı SDS-PAGE jeli üzerinde çözün ve MOMP standart eğrisini kullanarak partiküllerin MOMP bileşenini hesaplayın (Şekil 3).
7. Batı ve nokta lekeleri ve depolama
- Western blotlama için, numuneleri SDS-PAGE ile çözün ve jelleri, üreticinin protokolüne göre standart ayarlara sahip ticari bir kuru kurutma sistemi kullanarak aktarın.
- Transfer tamamlandıktan sonra lekeleri yığından çıkarın ve her bir lekeyi gece boyunca 4 ° C'de% 0.2 Tween 20 ve 0.5 mg / mL MAb40 veya 0.2 mg / mL içeren uygun bir bloke edici tamponda inkübe edin Δ49ApoA1 proteininden His-tag'e karşı yönlendirilmiş anti-His-tag antikoru.
NOT: Blotlama için kullanılan antikor dilüsyonları MAb40 için 1:1.000 ve MAbHIS antikoru için 1:500-1.000'dir. - Her lekeyi PBS-T (1x PBS,% 0.2 Tween 20, pH 7.4) ile 5 dakika boyunca 3 kez yıkayın.
- Lekeleri, 1: 10.000 seyreltmede bir florofora (örneğin, IRDye) konjuge edilmiş ikincil antikor içeren bloke edici tamponda 1 saat inkübe edin.
- Lekeleri PBS-T ile 5 dakika boyunca 3 kez tekrar yıkayın. Son yıkamadan sonra lekeleri görüntülemek için bir floresan görüntüleyici kullanın.
- Transfer tamamlandıktan sonra lekeleri yığından çıkarın ve her bir lekeyi gece boyunca 4 ° C'de% 0.2 Tween 20 ve 0.5 mg / mL MAb40 veya 0.2 mg / mL içeren uygun bir bloke edici tamponda inkübe edin Δ49ApoA1 proteininden His-tag'e karşı yönlendirilmiş anti-His-tag antikoru.
- Nokta lekeleri için, 3 μg saflaştırılmış MOMP-tNLP'yi kurulayın ve bir nokta leke aparatı kullanarak tNLP'yi boşaltın. Batı lekeleme için yukarıda açıklanan yöntemlerin aynısını kullanarak lekeleri bloke edin ve geliştirin.
8. Endotoksin değerlendirmesi
- Limulus Amebosit Lizat (LAL) testine dayalı bir endotoksin test sistemi kullanarak endotoksin seviyelerini ölçün. Endotoksin içermeyen 25 mM Tris, pH 7.4, 1 M Tris hidroklorür çözeltisi ve endotoksin içermeyen su kullanarak numune tamponu hazırlayın.
NOT: Tipik olarak, numunelerin bu numune tamponu kullanılarak seyreltilmesi ve seyreltmelerin tek tek numuneler için uygun aralığı bulmak üzere ayarlanması gerekir. Burada, MOMP-tNLP numuneleri, numune tamponunda 500 kat seyreltilir ve 25 μL, 0.05 EU/mL hassasiyete sahip bir cihaz kartuşunun her bir kuyucuğuna yüklenir. Aşağıda tarif edilen fare çalışmalarında kullanılan MOMP-tNLP ve boş tNLP'nin endotoksin seviyeleri, örneğe bağlı olarak 0.4 ila 12 EU/μg protein arasındadır.
9. Liyofilizasyon
- MOMP-tNLP nanopartiküllerini -20 ° C'de uzun süreli (yıllara kadar) kullanım için liyofilize edin ve saklayın. Liyofilizasyon için tNLP ve MOMP-tNLP süspansiyonlarını hazırlamak için, dondurma ve liyofilizasyon işlemi sırasında koruyucu olarak trehaloz ekleyin.
NOT: Bu işlem, çeşitli tNLP formülasyonları 7,8 için kapsamlı bir şekilde doğrulanmıştır. - 0.1 M trehalozun nihai konsantrasyonuna ulaşmak için gereken steril, endotoksin içermeyen, deiyonize suda 1 M trehaloz hacmini elde etmek için MOMP-tNLP çözeltisinin mevcut hacmini 9'a bölün. Son hacmi not edin ve istediğiniz gibi endotoksin içermeyen 15 mL veya 50 mL polipropilen tüplere alın.
- Karışık çözeltiyi kuru buz üzerinde dondurun ve bir liyofilizatör kullanarak gece boyunca liyofilize edin. Kurutulmuş formülasyonları ihtiyaç duyulana kadar -20 °C'de saklayın.
- Endotoksin içermeyen su kullanarak liyofilize tNLP'leri sulandırın. Liyofilize kek tamamen eriyene ve yeniden sulandırılana kadar yavaşça yuvarlayın. Trehalozu çıkarmak için, 3.5 kDa'lık bir kesme diyaliz membranı kullanarak çözeltiyi PBS'ye karşı diyalize edin.
10. Adjuvan ilavesi
NOT: Bu ve diğer benzer NLP bazlı alt birim aşı formülasyonları, CpG-ODN1826 ve FSL-1 gibi lipofilik adjuvanları kolayca içerebilir. CpG-ODN1826, 5' kolesterol parçasına (5'-chol-C6) sahip tam bir fosforotiyoat omurgasına sahip, modifiye edilmiş bir B Sınıfı CpG oligonükleotididir (5'-tccatgacgttcctgacgtt-3'). CpG-ODN1826'in tNLP'lere konjugasyonuna, kolesterol kısmı ile tNLP'nin fosfolipid çift tabakası arasındaki hidrofobik etkileşimler aracılık eder ve daha önce bildirildiği gibi gösterilmiş ve iyi karakterize edilmiştir 9,10.
- Bu formülasyonlara dahil edilmeden önce, kirletici endotoksini ve modifiye edilmemiş CpG moleküllerini uzaklaştırmak için kolesterolü değiştirilmiş CpG'yi ters faz kromatografisi ile saflaştırın.
- Satıcıdan alındıktan sonra, liyofilize CpG malzemesini endotoksin içermeyen suda rehidre edin ve 10 mM trietilamonyum asetat (TEAA) (mobil faz A) ve asetonitrilden (mobil faz B) oluşan bir ayırma gradyanı kullanarak hazırlayıcı bir C4 RP-HPLC kolonunda saflaştırın.
NOT: Ek ayrıntılar Tablo 2'de mevcuttur. - Kolesterolü modifiye edilmiş CpG içeren fraksiyonları bir araya getirin ve liyofilize edin. Kalıntı TEAA'nın tamamen uzaklaştırılmasını sağlamak için, CpG'yi 15 mL endotoksin içermeyen su ile sulandırın ve üç kez yeniden liyofilize edin.
- Son liyofilizasyondan sonra, CpG'yi endotoksin içermeyen suda (>20 mg / mL nihai CpG konsantrasyonu), alikotta yeniden sulandırın ve ihtiyaç duyulana kadar -80 ° C'de saklayın. Formülasyonlara ek olarak, CpG'yi 1-2.5 mg/mL'lik bir konsantrasyona seyreltin.
NOT: FSL-1, aşı sınıfı, liyofilize toz olarak mevcuttur. Bu, 1 mg / mL konsantrasyonda steril ve endotoksin içermeyen su kullanılarak sulandırılır. Aşı, her doz toplam 50 μL hacimde 10 μg MOMP içerecek şekilde kas içine (i.m.) uygulanır.
- Satıcıdan alındıktan sonra, liyofilize CpG malzemesini endotoksin içermeyen suda rehidre edin ve 10 mM trietilamonyum asetat (TEAA) (mobil faz A) ve asetonitrilden (mobil faz B) oluşan bir ayırma gradyanı kullanarak hazırlayıcı bir C4 RP-HPLC kolonunda saflaştırın.
- İstenen formülasyon dozunu elde etmek için, nanopartikülleri PBS'ye diyalize edin ve adjuvan ilavesinden önce santrifüjlü bir vakum yoğunlaştırıcı kullanarak konsantre edin. Numunenin tamamen kurumasını önlemek için bunu yaparken dikkatli olun - santrifüjleme sırasında numune hacmini her 20-30 dakikada bir kontrol edin.
- Adjuvanı steril koşullar altında bir biyogüvenlik kabinine ekleyin. Başarılı birleştirmeyi değerlendirmek için, nihai formülasyonları ve bileşenlerini analitik boyut dışlama kromatografisi (SEC) ile analiz edin.
NOT: Bu preparatlar için, PBS tamponunda (akış hızında 0.5 mL/m) bir SEC kolonu kullanıldı ve bir UV-vis diyot dizi detektörü kullanılarak elüsyon tespit edildi. Birleşme, adjuvanlı parçacıkların absorpsiyonu 214 ve 280 nm'de adjuvansız parçacıklarınkiyle karşılaştırılarak değerlendirildi. - Adjuvanlı MOMP-tNLP'yi ve boş tNLP'yi hayvan kullanımından önce 4 ° C'de 14 güne kadar saklayın. Yeni bir tNLP formülasyonunun stabilitesini tam olarak değerlendirmek için, depolanan tNLP'leri SEC tarafından periyodik olarak analiz edin.
NOT: Stabilite formülasyondan formülasyona değişecektir.
11. Serum testi
- 3 haftalık dişi fareler elde edin (BALB/c, n = 6).
- Fareleri her bir arka bacakta kas içi (i.m.) 5 μg CpG ve 1 μg FSL-1 (enjeksiyon başına toplam hacim = 50 mL) ile adjuvanlı MOMP-tNLP formunda 10 μg MOMP ile aşılayın.
- Aşılamadan sonra, fareleri sternal yaslamayı koruyana kadar gözlemleyin.
- İlk aşılamadan dört hafta sonra (prime), hayvanları 5 μg CpG ve 1 μg FSL-1 (enjeksiyon başına toplam hacim = 50 mL) ile adjuvanlı MOMP-tNLP formunda 10 μg MOMP ile ikinci kez (boost) aşılayın.
- İlk aşılamadan sonraki 56. günde, antikor titrelerini değerlendirmek için kan toplayın. Bir ksilazin (0.3 mg / 20 g vücut ağırlığı) ve ketamin (3.0 mg / 20 g vücut ağırlığı) çözeltisi enjekte ederek fareleri uyuşturarak başlayın. Sarsıntı olmadığından emin olmak için ön ve arka ayakları sıkıştırın. Anestezi sırasında göz kuruluğunu önlemek için göz çevresine vazelin uygulayın.
- Bir mikro-hematokrit kılcal tüp kullanarak, retro-orbital pleksusu delin. Bir mikrosantrifüj tüpünde 100 mL kan toplayın.
- Kan alındıktan sonra, fareleri anesteziden kurtulana ve sternal yaslığı koruyana kadar gözlemleyin.
- Kanın oda sıcaklığında 30 dakika pıhtılaşmasına izin verin ve ardından 10 dakika boyunca 2.000 × g'da dönün. Serumu toplayın ve -80 °C'de dondurun.
- Şu anda, hayvanlara Chlamydia muridarum ile meydan okuyun veya ötenazi yapın. Farelere önce bir ksilazin (0.3 mg / 20 g vücut ağırlığı) ve ketamin (3.0 mg / 20 g vücut ağırlığı) çözeltisi enjekte ederek ötenazi yapın, ardından servikal çıkık.
- Yukarıda tarif edildiği gibi batı blotlama tekniklerini kullanarak MOMP'ye özgü serum antikorlarını test edin. Tüm aşılanmış farelerden havuz faresi serumları ve havuzlanmış serumu 1: 5.000 seyreltmede birincil antikor yerine kullanın.
Sonuçlar
1 mL hücresiz reaksiyondan MOMP-tNLP'nin Ni afinite saflaştırmasının SDS-PAGE profili Şekil 1B'de gösterilmektedir. Reaksiyon, hem MOMP hem de Δ49ApoA1 proteini için yüksek düzeyde ekspresyon ile sonuçlandı. Önceki sonuçlar, DMPC ve telodendrimer varlığında Δ49ApoA1'in hücresiz ekspresyonunun telodendrimer nanolipoprotein parçacıklarının (tNLP'ler) oluşumuna yol açtığını göstermiştir4. MOMP'nin Δ49ApoA1 ile birlikte elüksiyonu, MOMP'nin tNLP'lerle ilişkili olduğunu gösterdi, çünkü His-tag MOMP'de değil, yalnızca tNLP iskelesi Δ49ApoA1'de bulunur. MOMP, yalnızca membran proteinlerinin çözünmesini kolaylaştırdığı gösterilen tNLP'lerle kompleks oluşturma yoluyla ayrıştırılabilen, yüksek oranda çözünmeyen bir proteindir.
MOMP-tNLP'leri içeren elüsyon fraksiyonları bir araya getirildi ve toplam protein konsantrasyonu, floresan bazlı bir kantitasyon cihazı veya üreticinin protein kantitasyonu için talimatlarını izleyerek 280 nm'de absorbans yoluyla konsantrasyonu ölçen bir cihaz kullanılarak belirlendi. MOMP aşısının hassas dozlanmasına izin vermek için, saflaştırılmış komplekslerdeki MOMP konsantrasyonunun belirlenmesi de önemlidir. Jel dansitometrisine dayalı olarak MOMP'yi ölçmek için bir yöntem geliştirdik (Şekil 2), burada standart olarak bilinen konsantrasyona sahip saflaştırılmış bir rekombinant MOMP kullanıldı. Standart eğriyi oluşturarak ve bunu MOMP-tNLP örneğiyle karşılaştırarak, MOMP konsantrasyonu doğru bir şekilde ölçülebilir. Saflaştırılmış numunede MOMP konsantrasyonunun belirlenmesi, çeşitli ölçeklerde hücresiz reaksiyonlarda MOMP veriminin tahmin edilmesini sağlamıştır, bu da sonraki çalışmalara uygun reaksiyon kurulumunun planlanması için önemlidir (Tablo 3).
MOMP'nin güçlü bir bağışıklık tepkisi ortaya çıkarmak için oligomerler oluşturması gerekir11. MOMP'nin oligomerik durumunu test etmek için, MOMP-tNLP hem ısı hem de indirgeyici ajan ditiyotreitolün varlığında ve yokluğunda analiz edildi (DTT, 50 mM, Şekil 3A). MOMP'nin daha yüksek dereceli oligomerleri, numuneler ısı ve DTT ile muamele edilmediğinde SDS-PAGE aracılığıyla tanımlandı. Buna karşılık, DTT varlığında ısı ile muamele edilen numuneler, jel üzerinde MOMP ve Δ49ApoA1'e (sırasıyla yaklaşık 40 kDa ve 22 kDa) karşılık gelen iki farklı bant gösterdi. Bu sonuçlar, etkinliği için kritik olan MOMP'nin oligomer oluşumuna atfedilen jel bantlama modeline çok benzemektedir.
MOMP proteininin değişken alanındaki doğrusal epitopa karşı bir antikor olan MAb40 kullanılarak yapılan daha ileri western blot analizi, denatüre olmayan durumda MOMP proteini tarafından oligomer oluşumunu doğrulayan benzer bir bantlama modeli gösterdi (Şekil 3B). MOMP oligomer oluşumunu etkileyen önemli bir faktör, hücresiz reaksiyon kurulumu sırasında MOMP plazmidi ile Δ49ApoA1 plazmidi arasındaki orandır. Tablo 4 , plazmitlerin oranını ve sonuçta ortaya çıkan MOMP'nin tNLP'lere eklenme oranını listeler. Önceki çalışmalar, klamidyal MOMP ve diğer dış zar proteinlerinin öncelikle trimer olarak var olabileceğini göstermiştir12. Hücresiz reaksiyonda trimer oluşumunu en üst düzeye çıkarmak için, ekleme hızının NLP başına üç MOMP proteinine yakın olması arzu edilir, bu da ~25:1 MOMP-Δ49ApoA1 plazmit oranına karşılık gelir.
MOMP ve tNLP'nin varlığını tespit etmek için daha akıcı bir yöntem olarak bir nokta leke testi kullanıldı. MAb40 antikoru total MOMP'yi saptamak için kullanıldı. tNLP'nin Δ49ApoA1 iskelesindeki His-tag'ı hedefleyen MAbHIS antikoru, tNLP'nin varlığını değerlendirmek için kullanıldı. MAb40 ve MAbHIS antikorlarının birlikte sinyal vermesi MOMP-tNLP oluşumunu gösterdi. Kontrol reaksiyonu, yalnızca MAbHIS'ten pozitif bir sinyal gösteren boş tNLP üretti (Şekil 3C). Hücresiz reaksiyonda üretilen MOMP-tNLP'lerin immünojenisitesini test etmek için, MOMP-tNLP'yi CpG + FSL-1 ile adjuvanlaştırdık ve yukarıda tarif edildiği gibi bir prime-boost rejiminde farelere intramüsküler olarak (im) enjekte ettik. Aşılanmış farelerden serumlar toplandı ve MOMP'ye özgü IgG antikoru western blot testi kullanılarak ölçüldü (Şekil 4). Adjuvanlı MOMP-tNLP enjekte edilen farelerden elde edilen serumlar, MOMP-tNLP'nin in vivo bir bağışıklık tepkisi ortaya çıkarabileceğini gösteren güçlü MOMP bağlanması gösterdi.
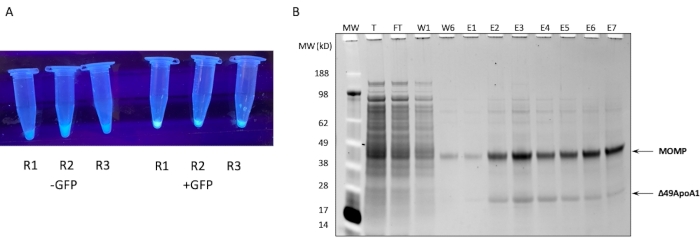
Şekil 1: MOMP-tNLP'nin ekspresyonu ve saflaştırılması . (A) GFP plazmidi olmayan lizatlara (solda) kıyasla UV ışık kaynağı altında (sağda) yanan GFP kontrollerini başarıyla ifade eden hücresiz bir reaksiyonun küçük alikotlarını içeren tüplerin görüntüsü. (B) SDS-PAGE'den sonra SYPRO Ruby ile boyanmış Protein Jeli, MOMP-tNLP'nin saflaştırma profilini gösterir. MOMP 40 kDa'da ve 49ApoA1 22 kDa'da göç eder. Kısaltmalar: MOMP = klamidyal majör dış zar proteini; tNLP = telodendrimer nanolipoprotein partikülü; MOMP-tNLP = MOMP-tNLP kompleksi; GFP = yeşil floresan protein kodlayan plazmit; MW = Moleküler ağırlık belirteci; T = toplam hücresiz lizat; FT = akış; R1-R3 = hücresiz reaksiyon alikotları; W1, W6 = 1 ve 6'yı yıkar; E1-E7 = 1'den 7'ye kadar olan Aşamalar; Δ49ApoA1 = Etiketli fare ApoA1 türevi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: MOMP-tNLP örneklerinde MOMP miktarının belirlenmesi . (A) MOMP'nin miktar tayini için SYPRO Ruby ile boyanmış SDS-PAGE jeli. Konsantrasyonu bilinen rekombinant MOMP, standart eğriyi elde etmek için jel üzerine yüklendi. Her şerit 0.1 μg, 0.5 μg, 1.0 μg, 2.0 μg ve 4.0 μg MOMP içeriyordu. Miktarı belirlenmekte olan MOMP-tNLP numuneleri aynı jel üzerine yüklendi. (B) MOMP konsantrasyon standart eğrisi dansitometri kullanılarak oluşturulmuştur. Normalleştirilmiş bant yoğunluğu ve MOMP miktarı ile ilgili bir denklem kuruldu. Denklem, bilinmeyen örneklerdeki MOMP içeriğini hesaplamak için kullanıldı. Kısaltmalar: MOMP = klamidyal majör dış zar proteini; tNLP = telodendrimer nanolipoprotein partikülü; MOMP-tNLP = MOMP-tNLP kompleksi; SDS-PAGE = sodyum dodesilsülfat poliakrilamid jel elektroforezi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
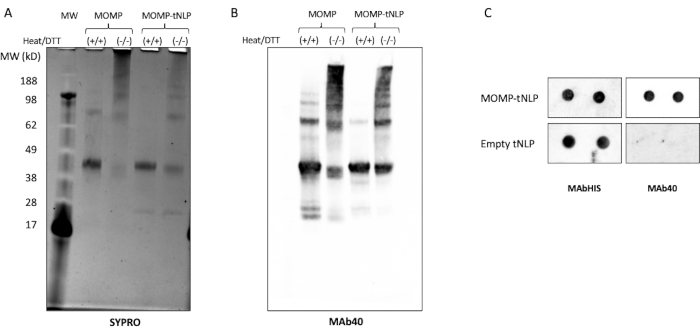
Şekil 3: Hücresiz üretilen MOMP-tNLP, MOMP'nin daha yüksek dereceli yapılar oluşturmasına izin verir. (A) SYPRO Ruby ile boyanmış, ısı ve indirgeyici ajan DTT ile muamele edilmiş ve edilmemiş MOMP-tNLP'nin SDS-PAGE jeli. Isı ve DTT ile, MOMP öncelikle ~ 40 kDa'da bir monomer bandı olarak ortaya çıktı, çünkü ısı ve indirgeyici ajan yüksek dereceli MOMP yapısının çoğunu bozdu. Isı ve DTT'nin yokluğunda, MOMP oligomer konformasyonunu gösteren daha yüksek dereceli bantlar mevcuttu. (B) MOMP-tNLP ve MOMP'nin tek başına, işlenmemiş ve ısı ve DTT ile işlenmiş Batı lekesi. Transferden sonra, membran MAb40 (1:1.000 seyreltme) ile incelendi. SYPRO Yakut lekeli jele benzer bir bantlama modeli gözlemlendi ve daha yüksek moleküler ağırlıklı bantların gerçekten MOMP oligomerleri olduğunu doğruladı. (C) MAb40 ve MAbHIS ile incelenen MOMP-tNLP ve boş tNLP örneklerinin (iki kopya halinde) nokta lekesi. Kısaltmalar: MOMP = klamidyal majör dış zar proteini; tNLP = telodendrimer nanolipoprotein partikülü; MOMP-tNLP = MOMP-tNLP kompleksi; SDS-PAGE = sodyum dodesilsülfat poliakrilamid jel elektroforezi; DTT = ditiyotreitol. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
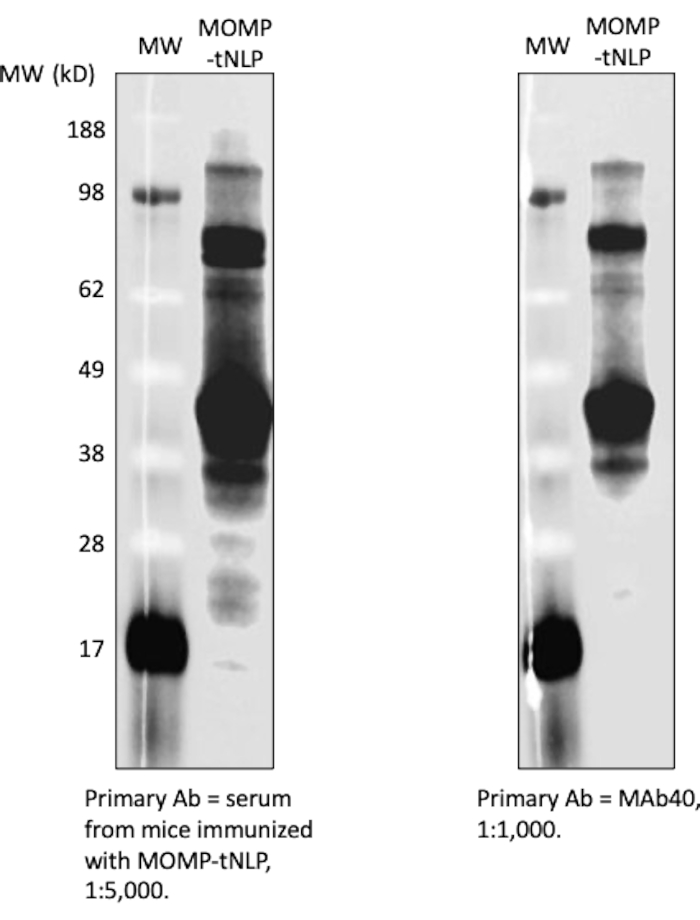
Şekil 4: Hücresiz üretilen MOMP-tNLP oldukça immünojeniktir. Aşılanmış farelerden alınan serum, güçlü anti-MOMP IgG sinyali gösterdi. Fareleri immünlemek için CpG + FSL-1 ile adjuvanlı MOMP-tNLP kullanıldı. Altı aşılanmış fareden alınan serumlar toplandı, bir araya getirildi ve MOMP-tNLP'yi araştırmak için kullanıldı. Serum, batı lekeleme testinde MOMP'ye bağlanabildi ve güçlü IgG sinyali gösterdi (solda). Birincil antikor olarak MAb40 kullanan western blot (sağda) benzer bantlar gösterdi, bu da serumun MOMP'ye özgü IgG içerdiğini gösterdi. Kısaltmalar: MOMP = klamidyal majör dış zar proteini; tNLP = telodendrimer nanolipoprotein partikülü; MOMP-tNLP = MOMP-tNLP kompleksi; CpG = kolesterol modifiye CpG adjuvanı; FSL-1 = lipofilik adjuvan. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Arabellek adı | NaH2PO4 | NaCl (Sıvı Değeri) | İmidazol | Ph |
| Bağlayıcı Tampon | 50 milyon | 300 milyon | 10 milyon | 8.0 |
| Yıkama Tamponu | 50 milyon | 300 milyon | 20 milyon | 8.0 |
| Elüsyon Tamponu 1 | 50 milyon | 300 milyon | 250 milyon | 8.0 |
| Elüsyon Tamponu 2 | 50 milyon | 300 milyon | 500 milyon | 8.0 |
Tablo 1: Nikel afinite saflaştırması için gerekli tamponların listesi, her bir bileşenin konsantrasyonlarını ve pH'ı detaylandırır.
| Çalışma zamanı | 50 dk |
| Akış hızı | 6.0 mL/dk |
| Degrade türü | İkili |
| Tampon A | H20 içinde 10 mM TEAA |
| Tampon B | MeCN (İngilizce) |
| Gradyan | % Tampon B |
| 0 dk | 25% |
| 30 dk | 60% |
| 30.5 dk | 100% |
| 40 dk | 100% |
| 40.5 dk | 25% |
| 50 dk | 25% |
Tablo 2: Kolesterolü modifiye edilmiş CpG'nin ters faz HPLC saflaştırması için koşullar. Kısaltmalar: TEAA = trietilamonyum asetat; MeCN = asetonitril.
| Hücresiz lizat (mL) | DMPC lipid (mg) | Telodendrimer (mg) | MOMP plazmidi (μg) | Saflaştırılmış MOMP verimi (mg) |
| 1 | 4 | 0.4 | 15 | 0.5 |
| 2 | 8 | 0.8 | 30 | 1.1 |
| 3 | 12 | 1.2 | 45 | 1.6 |
| 5 | 20 | 2 | 75 | 2.7 |
Tablo 3: Farklı ölçeklerde hücresiz reaksiyonlar için kullanılan lipitlerin, telodendrimerlerin ve plazmitlerin miktarı ve bunlara karşılık gelen verimler. Kısaltmalar: MOMP = klamidyal majör dış zar proteini; DMPC = 1,2-dimyristoyl-sn-glisero-3-fosfokolin.
| Plazmit giriş oranları, MOMP : Δ49ApoA1 | 1:1 | 5:1 | 10:1 | 25:1 | 50:1 | 100:1 | |
| Üretilen protein miktarının oranları, MOMP : Δ49ApoA1 | 0.02 | 0.32 | 0.64 | 3.46 | 6.55 | 20.04 | |
| tNLP başına tahmini MOMP ekleme sayısı | 0.03 | 0.37 | 0.75 | 4.04 | 7.65 | 23.39 | |
Tablo 4: Hücresiz bir reaksiyondaki plazmit oranları ve ortaya çıkan MOMP ekleme oranları. Kısaltmalar: MOMP = klamidyal majör dış zar proteini; tNLP = telodendrimer nanolipoprotein partikülü; Δ49ApoA1 = Etiketli fare ApoA1 türevi.
Tartışmalar
Klamidya, hem erkekleri hem de kadınları etkileyen en yaygın cinsel yolla bulaşan enfeksiyondur. Klamidya ile ilgili aşı araştırmaları onlarca yıla yayılmış olsa da, seri üretime ölçeklendirilebilecek güvenli ve etkili bir aşı zor kalmıştır13. Klamidyal MOMP, koruyucu bir aşı antijeni olarak lider aday olarak kabul edilir; bununla birlikte, MOMP oldukça hidrofobiktir ve yanlış katlanmayaeğilimlidir 14,15. Daha ileri çalışmalar, MOMP'nin immünojenisitesi için gerekli olan oligomerik durumlarda var olduğunu ortaya koymuştur11. Burada ayrıntılı olarak açıklanan, 3 mL lizat başına yaklaşık 1.5 mg saflaştırılmış MOMP verimi ile bir aşı olarak tNLP nanopartikül içinde oluşturulan oligomerik MOMP üreten doğrulanmış, hücresiz bir birlikte ekspresyon yöntemidir. Bu tamamen harmanlanmış prosedür, endüstriyel üretim için daha da ölçeklendirilebilir ve aşı üretimi için yararlı bir yaklaşım olarak beklentilerini artırabilir.
Daha önce, NLP'ler 3,16 içine gömülü membran proteinleri üretmek için hücresiz ekspresyonun yanı sıra telodendrimerle stabilize edilmiş disklere ekspresyon hakkında yayın yapmıştık. Bununla birlikte, bu ikinci teknik, daha fazla heterojenliğe ve daha düşük çözünürlüğe sahip zar-protein parçacıkları üretti. 4 Ek olarak, MOMP-telodendrimer partiküllerinin immünojenisitesi, MOMP-tNLP partiküllerine kıyasla belirsizdir6.
Bu prosedür, alt birim aşılarda kullanım için antijen olarak umut verici adaylar olan bakteriyel membran proteinlerinin ekspresyonunu büyütmek için uyarlanabilir. Bu prosedür sadece çözündürülmüş bakteri zarı proteini üretmekle kalmaz, aynı zamanda genel nanopartikül yapısı, bir kolesterol parçasına veya FSL-1'e konjuge edilmiş CpG dahil ancak bunlarla sınırlı olmamak üzere çeşitli lipofilik aşı adjuvanları kullanılarak daha fazla modifikasyona uygundur. Bakterilerden diğer aday antijenlerin ekspresyonu mümkündür, ancak optimum verim elde etmek için ekspresyon sıcaklığı, lipid seçimi ve ekspresyon sisteminin türü gibi parametrelerin araştırılması gerekebilir.
Ek olarak, plazmit seçimi ve oranı bu süreçte kritik öneme sahiptir. Kullanılan her iki plazmit de aynı omurgadan yapılmalıdır. Ekler yaklaşık olarak aynı uzunluktaysa, oranlar burada açıklandığı gibi eklenen plazmitin kütlesine dayanabilir. Bununla birlikte, mollere dayalı rasyonlama, özellikle reaksiyonları ölçeklendirirken daha tekrarlanabilir sonuçlar verecektir. Ekran ölçeğindeki reaksiyonlarda (0.5 mL'<) iyi çalışan oranlar, daha büyük reaksiyonlar için geçerli olmayabilir ve ek optimizasyon gerektirebilir. Membran olmayan proteinler hala hücresiz kitler kullanılarak eksprese edilebilir, ancak çözünür bir ürün üretmek için lipid nanopartikülü (birlikte ekspresyon) gerektirmeyebilir. Ek olarak, bu protokol CpG ve FSL-1 ile adjuvanlamayı açıklarken, bu sistem diğer lipofilik adjuvanlarla formülasyona veya istenildiği gibi çözünür adjuvanlarla karıştırmaya uygundur.
Hücresiz ekspresyon reaksiyonunu kurarken kontaminasyondan kaçınmak önemlidir, çünkü bu verimi etkileyebilir. Plazmitlerin kendileri de dahil olmak üzere reaksiyona herhangi bir katkı maddesi oldukça saf olmalıdır. Ek olarak, eksprese edilen proteinler sadece endotoksin kontaminasyonu içermeyen malzemeler ve çözeltilerle temas halinde olmalıdır. Aday formülasyonlarda endotoksin kontaminasyonu, immünolojik testlerin tutarsız ve sahte sonuçlarına yol açabilir ve yeterli miktarlarda zararlı olabilir. Burada açıklanmamış olsa da, SDS-PAGE gibi sonraki analiz adımlarında birçok kirletici gözlemlenirse, nikel afinite kromatografisini takiben ek saflaştırma gerekli olabilir. Bu, SEC ile gerçekleştirilebilir, ancak koşullar formülasyon bazında bir formülasyonda optimizasyon gerektirebilir.
Açıklamalar
Yazarlar, bu yazıda bildirilen çalışmayı etkilemiş gibi görünebilecek bilinen hiçbir rakip mali çıkarları veya kişisel ilişkileri olmadığını beyan ederler.
Teşekkürler
Bu çalışma, Ulusal Alerji ve Bulaşıcı Hastalıklar Enstitüsü'nden Halk Sağlığı Hizmeti hibesi R21 AI20925 ve U19 AI144184 tarafından desteklenmiştir. Bu çalışma, ABD Enerji Bakanlığı'nın himayesinde, Lawrence Livermore Ulusal Laboratuvarı tarafından DE-AC52-07NA27344 [LLNL-JRNL-822525, LLNL-VIDEO-832788] Sözleşmesi kapsamında gerçekleştirilmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1,2-dimyristoyl-sn-glycero-3-phosphocholine (DMPC) as powder | Avanti Polar Lipids | 850345 | |
| 1.5 mL endotoxin-free centrifuge tubes | Eppendorf | 2600028 | |
| 1 M Trizma hydrochloride solution | Millipore Sigma | T2194 | |
| Acetic acid, glacial, ACS reagent, ≥99.7% | Millipore Sigma | 695092 | |
| Bio-Dot apparatus | Bio-Rad | 1706545 | |
| Buffer Dam for XCell SureLock | Life Technologies | EI0012 | |
| C24 Incubator shaker | New Brunswick Scientific | ||
| Cell-Free Expression System: RTS 500 ProteoMaster E. coli HY Kit | BiotechRabbit | BR1400201 | |
| cOmplete His-Tag Purification Resin | Roche Molecular Diagnostics | 5893682001 | |
| cOmplete, EDTA-free Protease Inhibitor Cocktail | Roche Molecular Diagnostics | 4693132001 | |
| CpG-ODN1826 | Biosearch Technologies | T9449 | |
| D-(+)-Trehalose dihydrate | Millipore Sigma | 71509 | |
| Dialysis tubes D-Tube Dialyzer Maxi | Millipore Sigma | 71508-3 | |
| Disposable, polypropylene fritted columns 10 mL capacity | Bio-Rad | 7311550EDU | |
| Dulbecco’s Phosphate-buffered Saline (PBS) | Millipore Sigma | D8537 | |
| Electrophoresis Power Supply | |||
| Endosafe PTS cartridge | Thermo Fisher Scientific | NC9594798 | |
| Endosafe-PTS Testing System | Charles River | ||
| Gel wash solution: 10% methanol, 7% acetic acid | |||
| HCl and NaOH solutions for pH adjustment | |||
| HPLC with UV-vis diode array detector | Shimadzu | ||
| HyClone HyPure culture-grade water | VWR | 82007-328 | |
| iBlot 2 Dry Blotting System | Life Technologies | ||
| iBlot 2 Transfer Stacks, PVDF | Life Technologies | IB24001 | |
| Image Studio V2.0 software | Li-COR Biiosciences | ||
| Imidazole | Millipore Sigma | I5513 | |
| Immun-Blot PVDF Membrane | Bio-Rad | 1620177 | |
| LI-COR Odyssey Fc imager | Li-COR Biiosciences | ||
| Lyophilizer | Labconco | ||
| Methanol (≥99.9%) | Millipore Sigma | 34860 | |
| Microcentrifuge | |||
| Microwave oven | |||
| NanoDrop One/OneC Microvolume UV-Vis Spectrophotometer | Thermo Fisher Scientific | ND-ONE-W | |
| NuPAGE 4 to 12%, Bis-Tris, 1.0 mm | Life Technologies | NP0321 | |
| NuPAGE LDS Sample Buffer (4x) | Life Technologies | NP0007 | |
| NuPAGE MES SDS Running Buffer (20x) | Life Technologies | NP000202 | |
| NuPAGE Sample Reducing Agent (10x) | Life Technologies | NP0009 | |
| Odyssey Blocking Buffer in TBS containing 0.2% Tween 20 | Li-COR Biosciences | 927-50000 | |
| Orbital Shaker | |||
| PBS-T (1x PBS, 0.2% Tween 20, pH 7.4) | |||
| PEG5K-CA8 Telodendrimer (custom synthesis product) | |||
| pIVEX2.4d vector | Roche Molecular Diagnostics | ||
| Plasmid Maxi Kit | Qiagen | 12162 | |
| Primary antibody: MAb40 (monoclonal antibody to the variable domain 1 (VD1) of C. muridarum MOMP, de la Maza laboratory)4 | |||
| Primary antibody: MAbHIS, Penta-His antibody | Qiagen | 34660 | |
| Probe sonicator | |||
| Qubit 3.0 Fluorometer | Life Technologies | Q33216 | |
| Qubit Protein Assay Kit | Life Technologies | Q33212 | |
| Rainin Pipette tips: LTS 1000 µL | Rainin | 17002428 | |
| Rainin Pipette tips: LTS 20 µL | Rainin | 17002429 | |
| Rainin Pipette tips: LTS 200 µL | Rainin | 17002426 | |
| Rainin Pipettes | Rainin | ||
| Secondary antibody: IRDye 800CW goat (polyclonal) anti-mouse IgG (heavy and light) | Li-COR Biosciences | 926-32210 | |
| SeeBlue Plus2 Pre-stained Protein Standard | Life Technologies | LC5925 | |
| Sodium chloride NaCl | Millipore Sigma | S7653 | |
| Sodium phosphate monobasic NaH2PO4 | Millipore Sigma | S0751 | |
| Superdex 200, 5/150 GL column | Cytiva | GE28-9909-45 | |
| Synthetic diacylated lipoprotein-TLR2/6 FSL-1 | Invivogen | tlrl-fsl | |
| SYPRO Ruby Protein Gel Stain | Life Technologies | S12001 | |
| TWEEN 20 | Millipore Sigma | P1379 | |
| UV light source | |||
| Vacufuge Bench Top Centrifuge | Eppendorf | ||
| Vortexer | |||
| VWR 15 mL conicals (89039-666) | VWR | ||
| VWR 50 mL conicals (89039-656) | VWR | ||
| XCell SureLock Mini-Cell (Life Technologies ) | Life Technologies | EI0001 |
Referanslar
- Carlson, E. D., Gan, R., Hodgman, C. E., Jewett, M. C. Cell-free protein synthesis: applications come of age. Biotechnology Advances. 30 (5), 1185-1194 (2012).
- Coleman, M. A., et al. Expression and association of the Yersinia pestis translocon proteins, YopB and YopD, are facilitated by nanolipoprotein particles. PLoS One. 11 (3), 0150166(2016).
- Cappuccio, J. A., et al. Cell-free co-expression of functional membrane proteins and apolipoprotein, forming soluble nanolipoprotein particles. Molecular & Cellular Proteomics: MCP. 7 (11), 2246-2253 (2008).
- He, W., et al. Controlling the diameter, monodispersity, and solubility of ApoA1 nanolipoprotein particles using telodendrimer chemistry. Protein Science. 22 (8), 1078-1086 (2013).
- He, W., et al. Cell-free production of a functional oligomeric form of a Chlamydia major outer-membrane protein (MOMP) for vaccine development. Journal of Biological Chemistry. 292 (36), 15121-15132 (2017).
- Tifrea, D. F., et al. Induction of protection in mice against a Chlamydia muridarum respiratory challenge by a vaccine formulated with the major outer membrane protein in nanolipoprotein particles. Vaccines. 9 (7), 755(2021).
- Cleveland, T. E., et al. Small-angle X-ray and neutron scattering demonstrates that cell-free expression produces properly formed disc-shaped nanolipoprotein particles. Protein Science. 27 (3), 780-789 (2018).
- Fischer, N. O., et al. Conjugation to nickel-chelating nanolipoprotein particles increases the potency and efficacy of subunit vaccines to prevent West Nile encephalitis. Bioconjugate Chemistry. 21 (6), 1018-1022 (2010).
- Fischer, N. O., et al. Colocalized delivery of adjuvant and antigen using nanolipoprotein particles enhances the immune response to recombinant antigens. Journal of the American Chemical Society. 135 (6), 2044-2047 (2013).
- Fischer, N. O., et al. Evaluation of nanolipoprotein particles (NLPs) as an in vivo delivery platform. PLoS One. 9 (3), 93342(2014).
- Pal, S., Peterson, E. M., de la Maza, L. M. Vaccination with the Chlamydia trachomatis major outer membrane protein can elicit an immune response as protective as that resulting from inoculation with live bacteria. Infection and Immunity. 73 (12), 8153-8160 (2005).
- Sun, G., et al. Structural and functional analyses of the major outer membrane protein of Chlamydia trachomatis. Journal of Bacteriology. 189 (17), 6222-6235 (2007).
- Hafner, L. M., Wilson, D. P., Timms, P. Development status and future prospects for a vaccine against Chlamydia trachomatis infection. Vaccine. 32 (14), 1563-1571 (2014).
- Findlay, H. E., McClafferty, H., Ashley, R. H. Surface expression, single-channel analysis and membrane topology of recombinant Chlamydia trachomatis Major Outer Membrane Protein. BMC Microbiology. 5, 5(2005).
- Sun, G., Pal, S., Weiland, J., Peterson, E. M., de la Maza, L. M. Protection against an intranasal challenge by vaccines formulated with native and recombinant preparations of the Chlamydia trachomatis major outer membrane protein. Vaccine. 27 (36), 5020-5025 (2009).
- He, W., et al. Cell-free expression of functional receptor tyrosine kinases. Scientific Reports. 5 (1), 12896(2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır