Method Article
Zellfreie skalierte Produktion und adjuvante Zugabe zu einem rekombinanten Haupt-Außenmembranprotein aus Chlamydia muridarum für die Impfstoffentwicklung
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Verwendung kommerzieller, zellfreier Proteinexpressionskits zur Herstellung von Membranproteinen, die in Nanodisc unterstützt werden und als Antigene in Subunit-Impfstoffen verwendet werden können.
Zusammenfassung
Subunit-Impfstoffe bieten Vorteile gegenüber herkömmlichen inaktivierten oder abgeschwächten Ganzzell-Impfstoffen in Bezug auf Sicherheit, Stabilität und Standardherstellung. Um einen wirksamen proteinbasierten Subunit-Impfstoff zu erhalten, muss das Proteinantigen oft eine native Konformation annehmen. Dies ist besonders wichtig für Pathogen-Oberflächenantigene, bei denen es sich um membrangebundene Proteine handelt. Zellfreie Methoden wurden erfolgreich eingesetzt, um korrekt gefaltetes funktionelles Membranprotein durch die Co-Translation von Nanolipoproteinpartikeln (NLPs), allgemein bekannt als Nanodiscs, herzustellen.
Mit dieser Strategie können Untereinheiten-Impfstoffe hergestellt werden, die aus Membranproteinen in einer lipidgebundenen Umgebung bestehen. Die zellfreie Proteinproduktion ist jedoch oft auf den kleinen Maßstab (<1 ml) beschränkt. Die Menge an Protein, die in kleinen Produktionsläufen produziert wird, reicht in der Regel für biochemische und biophysikalische Studien aus. Der zellfreie Prozess muss jedoch skaliert, optimiert und sorgfältig getestet werden, um genügend Protein für Impfstoffstudien in Tiermodellen zu erhalten. Andere Prozesse, die an der Impfstoffherstellung beteiligt sind, wie z. B. die Reinigung, die Adjuvans-Zugabe und die Gefriertrocknung, müssen parallel optimiert werden. In diesem Artikel wird über die Entwicklung eines skalierten Protokolls zur Expression, Reinigung und Formulierung eines membrangebundenen Proteinuntereinheitsimpfstoffs berichtet.
Skalierte zellfreie Reaktionen erfordern eine Optimierung der Plasmidkonzentrationen und -verhältnisse bei der Verwendung mehrerer Plasmidexpressionsvektoren, der Lipidauswahl und der Adjuvansaddition für die Herstellung von formulierten Nanolipoproteinpartikeln auf hohem Niveau. Die Methode wird hier mit der Expression eines Chlamydien-Hauptmembranproteins (MOMP) demonstriert, kann aber auch auf andere Membranproteinantigene angewendet werden. Die Wirksamkeit von Antigenen kann in vivo durch Immunisierungsstudien zur Messung der Antikörperproduktion bewertet werden, wie hier gezeigt.
Einleitung
Prokaryotische oder eukaryotische Lysate für die zellfreie Expression von Proteinen sind als kommerzielle Produkte für die Synthese von Proteinen von Interesse leicht erhältlich (für eine vollständige Übersicht siehe 1). Diese Expressionssysteme sind in verschiedenen Größenordnungen verfügbar und verwenden Lysate aus verschiedenen Organismen, darunter E. coli, Tabakpflanzen und Säugetierkulturen. Zellfreie Lysate bieten mehrere Vorteile gegenüber herkömmlichen rekombinanten Proteinproduktionsansätzen, darunter Benutzerfreundlichkeit und robuste, schnelle Proteinproduktion. Während diese Ansätze in erster Linie zur Herstellung löslicher Proteine verwendet werden, hat diese Gruppe einen Ansatz für ihre Verwendung zur Expression von Membranproteinen entwickelt.
Dieser neuartige Ansatz nimmt geringfügige Modifikationen an bestehenden zellfreien Expressionssystemen vor, indem er DNA einbezieht, die für zwei Proteinprodukte für die Expression kodiert, ein Apolipoprotein und das Membranprotein von Interesse. Das exprimierte Apolipoprotein (Derivate von ApoA1 oder ApoE4) interagiert mit Lipiden, die dem zellfreien Lysat zugesetzt werden, um spontan (~20 nm) NLPs zusammenzusetzen. Bei Co-Translation mit einem interessierenden Membranprotein bilden das NLP und das Membranprotein einen löslichen Nanopartikelkomplex, wobei das Membranprotein in die NLP-Lipiddoppelschicht eingebettet ist. Somit ist das Membranprotein für nachgelagerte Anwendungen leichter zugänglich, da es in löslichen, diskreten Partikeln enthalten ist. Dieser Ansatz kann funktionelle oligomere Proteinkomplexe innerhalb der NLP-Doppelschicht2 erzeugen und die Antigenkomponente eines Untereinheitsimpfstoffs herstellen, der anschließend mit lipophilen Adjuvantien gemischt wird, um einen Nanopartikel-Impfstoff mit kolokalisiertem Antigen und Adjuvans zu bilden, der für die In-vivo-Bewertung geeignet ist.
Dieses aktuelle Verfahren ist eine Modifikation eines zuvor veröffentlichten Protokolls3. Wesentliche Modifikationen konzentrieren sich auf das Scale-up der zellfreien Reaktion und die anschließende Aufreinigung des Protein-NLP-Komplexes. Eine weitere Modifikation beinhaltet die Zugabe eines amphiphilen Polymers, das als Telodendrimer bekannt ist, das zunächst mit den Lipiden vermischt wird, bevor es zur zellfreien Reaktion hinzugefügt wird. Die Co-Translation der Plasmide in Gegenwart des Telodendrimers und der Lipide erzeugt ein Telodendrimer NLP (tNLP). Die Zugabe des Telodendrimers trägt auch dazu bei, die Größe und Monodispersität der resultierenden tNLP-Nanopartikel zu modulieren4. Dieses Protokoll ist speziell für groß angelegte Impfstoffstudien optimiert, um ein membrangebundenes Untereinheits-Antigenprotein, Chlamydien MOMP5,6, herzustellen. Die Methode erzeugt rekombinantes MOMP, das mit tNLP assoziiert ist, um einen hochlöslichen MOMP-tNLP-Komplex zu bilden, der die MOMP-Oligomerisierung beibehält. Eine typische 3-ml-Scale-up-Produktion ergibt >1,5 mg gereinigtes MOMP. Das zellfrei hergestellte MOMP-tNLP ist für eine schnelle adjuvante Zugabe für In-vivo-Immunogenitätstests geeignet.
Protokoll
Alle Tierstudien wurden an der University of California, Irvine, in Einrichtungen durchgeführt, die vom Public Health Service (PHS) in Übereinstimmung mit den Richtlinien des Institutional Animal Care and Use Committee durchgeführt wurden.
1. Vorbereitung der Glaswaren
HINWEIS: Alle Materialien, die bei der Herstellung von Impfstoffformulierungen für Tiere verwendet werden, sind endotoxinfrei.
- Um kontaminierendes Endotoxin zu zerstören, backen Sie gereinigte Gläser, die Puffer in einem Ofen bei 180 °C für 4 Stunden halten.
2. Vorbereitung des Puffers
- Bereiten Sie 250 ml der in Tabelle 1 aufgeführten Ni-Affinitätsreinigungspuffer vor. Lagern Sie sie bis zu 6 Monate bei 4 °C.
3. Vorbereitung der Reaktion
- 20 mg 1,2-Dimyristoyl-sn-glycero-3-phosphocholin (DMPC) werden in ein endotoxinfreies 1,5-ml-Zentrifugenröhrchen eingewogen. Lösen Sie es in 1 ml endotoxinfreiem Wasser auf, sondizieren Sie es mindestens viermal bei 6 A für 1 Minute, mit 1 Minute Pause dazwischen, bis es klar ist. Entfernen Sie jegliches verunreinigte Metall aus der Sonde durch Zentrifugation bei 13.000 × g für 2 Minuten bei 22 °C und überführen Sie dann das gelöste Lipid in ein neues endotoxinfreies 1,5-ml-Röhrchen.
- Wiegen Sie 1 mg PEG5k-CA8 Telodendrimer in ein endotoxinfreies 1,5-ml-Röhrchen. In endotoxinfreiem Wasser bis zu einer Konzentration von 20 mg/ml auflösen. Vortex, bis es vollständig aufgelöst und auf 2 mg/ml verdünnt ist.
- In einem neuen endotoxinfreien Röhrchen 210 μl 20 mg/ml DMPC-Lösung mit 210 μl 2 mg/ml Telodendrimer-Lösung mischen.
4. Zellfreie Herstellung von MOMP-tNLPs für Untereinheiten-Impfstoffformulierungen
- Bereiten Sie MOMP-tNLPs mit zellfreien Methoden vor, die von einem zuvor veröffentlichten Protokollmodifiziert wurden 5.
- Öffnen Sie zwei Stunden vor Beginn der zellfreien Reaktion das prokaryotische zellfreie Proteinexpressionskit und tauen Sie einen der Rekonstitutionspuffer auf. Nach dem Auftauen eine Tablette EDTA-freien Proteasehemmer-Cocktail hinzufügen und vollständig auflösen lassen.
- Befolgen Sie dieses Protokoll mit einem Kit, das für die Durchführung von 5 x 1-ml-Reaktionen ausgelegt ist.
HINWEIS: Eine typische Scale-up-Produktion ist 3 x 1 ml.- Für jede 1-ml-Reaktion werden 525 μl Rekonstitutionspuffer in die E. coli-Lysatflasche gegeben und vorsichtig gerollt, um sich aufzulösen . Geben Sie 250 μl Rekonstitutionspuffer in die Flasche mit Reaktionsadditiven (z. B. ATP, GTP) und rollen Sie sie vorsichtig, um sich aufzulösen.
- 8,1 ml Rekonstitutionspuffer in die Reaktionsflaschen geben, mit einem Gummistopfen wieder verschließen (darauf achten, dass die Innenseite des Gummistopfens nicht berührt wird) und vorsichtig umdrehen/rollen, um sich aufzulösen.
- Geben Sie 3 ml Rekonstitutionspuffer in die Flasche mit der Aminosäuremischung, verschließen Sie sie mit einem Gummistopfen und drehen Sie sie vorsichtig um, um sich aufzulösen.
HINWEIS: Achten Sie darauf, die Innenseite des Gummistopfens nicht zu berühren, da dies zu einer Kontamination führen kann. - Geben Sie 1,8 ml Rekonstitutionspuffer in die Methioninflasche, rollen Sie sie vorsichtig, um sich aufzulösen, und lagern Sie sie dann bis zur Verwendung auf Eis.
- Bereiten Sie die Reaktionslösung vor.
- In die E. coli-Lysatflasche werden 225 μl rekonstituierte Reaktionsmischung, 270 μl rekonstituierte Aminosäuremischung ohne Methionin und 30 μl rekonstituiertes Methionin gegeben . Zusätzlich werden 400 μl der DMPC/Telodendrimer-Mischung, 15 μg MOMP-Plasmid und 0,6 μg Δ49ApoA1-Plasmid zugegeben. Zum Mischen leicht rollen/schütteln.
HINWEIS: Stellen Sie sicher, dass beide Plasmide aus demselben Plasmid-Rückgrat bestehen. Keine Wirbel machen. - Nehmen Sie 20 μl der Gesamtlösung und stellen Sie sie in einem 1,5-ml-Röhrchen für die GFP-exprimierende Kontrollreaktion beiseite (siehe unten).
- In die E. coli-Lysatflasche werden 225 μl rekonstituierte Reaktionsmischung, 270 μl rekonstituierte Aminosäuremischung ohne Methionin und 30 μl rekonstituiertes Methionin gegeben . Zusätzlich werden 400 μl der DMPC/Telodendrimer-Mischung, 15 μg MOMP-Plasmid und 0,6 μg Δ49ApoA1-Plasmid zugegeben. Zum Mischen leicht rollen/schütteln.
- Bereiten Sie die Futterlösung vor. In die Futtermischungsflasche werden 2,65 ml rekonstituierte Aminosäuremischung ohne Methionin und 300 μl rekonstituiertes Methionin gegeben. Rollen/vorsichtig schütteln, um sich aufzulösen.
HINWEIS: Zu diesem Zeitpunkt können der unbenutzte Rekonstitutionspuffer und das Methionin zur Lagerung in den Gefrierschrank zurückgelegt werden. - 1 ml der Reaktionslösung in die innere Reaktionskammer überführen, die im zellfreien Reaktionskit enthalten ist, und nach dem Befüllen versiegeln. 10 ml der Zufuhrlösung werden in die äußere Kammer des Reaktionsgefäßes überführt und abgedichtet.
HINWEIS: Die Kammern nicht überfüllen! Das Vorhandensein von Luftblasen an der Oberseite sowohl der inneren Reaktionskammer als auch der inneren Zufuhrkammer wirkt sich negativ auf die Reaktion aus. Die verbleibende Reaktionslösung kann in ein 1,5-ml-Röhrchen gegeben und neben dem Hauptgefäß gemischt werden. - 0,5 μl des GFP-Kontrollplasmids (0,5 mg/ml) werden zu dem zuvor aliquotierten 20-μl-Reaktionsgemisch gegeben.
HINWEIS: Viele Kits werden mit einem Kontrollplasmid zur Qualitätskontrolle geliefert. Die meisten GFP-exprimierenden Plasmide mit einem T7-Promotor und einer E.coli-Ribosomen-Bindungsstelle (RBS) können auch als Kontrollplasmid verwendet werden. - Die Reaktion wird in einem Schüttler bei 300 U/min bei 30 °C bis zu 18 h eingegeben. Um zu überprüfen, ob die Reaktion erfolgreich war, verwenden Sie eine UV-Lichtquelle, um die Fluoreszenz aufgrund der Synthese des Kontroll-GFP (Abbildung 1A) nach nur 15 Minuten Inkubation zu überprüfen.
ANMERKUNG: Diese Bedingungen, insbesondere die Temperatur, müssen möglicherweise für die Expression anderer Membranproteine optimiert werden.
5. MOMP-tNLP-Reinigung
- Verwenden Sie die immobilisierte Nickel-Affinitätschromatographie, um den MOMP-tNLP-Nanopartikelkomplex aus dem zellfreien Reaktionsgemisch unter Verwendung des His-Tags auf dem Δ49ApoA1-Protein zu reinigen.
- 1 ml einer 50%igen Aufschlämmung des His-Tag-Reinigungsharzes in eine 10-ml-Einweg-Chromatographiesäule überführen und mit 3 ml Bindungspuffer äquilibrieren.
- Lassen Sie den Puffer ablaufen, verschließen Sie den Auslass und geben Sie 250 μl Bindepuffer in das Harz.
- Bevor Sie die zellfreie Reaktion in die Säule geben, bewahren Sie 20 μl für die spätere Analyse mit SDS-PAGE auf. Mischen Sie die zellfreie Reaktion mit dem äquilibrierten Harz und inkubieren Sie es auf einem Laborrocker bei 4 °C für 1 h.
- Lösen Sie die Kappe der Säule, waschen Sie die Kappe mit 500 μl zusätzlichem Bindepuffer und geben Sie diese Flüssigkeit in den Rest der Säule.
- Sammeln Sie den Flüssigkeitsdurchfluss aus der Säule für die spätere Analyse mit SDS-PAGE.
- Waschen Sie die Säule sechsmal mit 1 ml Waschpuffer mit 20 mM Imidazol und sammeln Sie die Fraktionen. Achten Sie darauf, das Harz zwischen den Wäschen nicht austrocknen zu lassen. Bei der zweiten Wäsche wird das Harz kräftig gerührt, indem Sie es mit einer 1-ml-Pipette auf und ab pipettieren.
- Die MOMP-tNLPs werden in sechs 300-μl-Fraktionen des Elutionspuffers 1 (mit 250 mM Imidazol) eluiert, gefolgt von einer abschließenden Elution mit 300 μl Elutionspuffer 2 (mit 500 mM Imidazol). Bei der zweiten Elution wird das Harz kräftig gerührt, indem Sie mit einer 1-ml-Pipette auf und ab pipettieren.
6. Analyse durch SDS-PAGE
HINWEIS: Alle Elutionsfraktionen sollten mit SDS-PAGE analysiert werden, um die Menge und Reinheit des interessierenden Proteins zu überprüfen.
- Laden Sie jeweils 1 μl des gesamten Lysats und des Durchflusses und dann 5 μl für alle gesammelten Wasch- und Elutionsfraktionen.
- Mischen Sie Aliquots der eluierten MOMP-tNLPs, Waschungen, Durchfluss- und Gesamtlysate mit 4x SDS-PAGE-Probenladepuffer. Mischen und denaturieren Sie die Proben mit dem 10-fachen Reduktionsmittel, sofern nicht anders angegeben.
- Analysieren Sie die Fraktionen mittels Gelelektrophorese mit 1,0 mm, 4 bis 12 %, Bis-Tris SDS-PAGE-Gelen mit 1x MES-SDS-Laufpuffer, zusammen mit einem geeigneten Molekulargewichtsstandard. Lassen Sie die Gele 35 Minuten lang bei 200 V laufen.
- Färben Sie die Gele gemäß den Anweisungen des Herstellers.
- Nehmen Sie das Gel aus der Kassette und geben Sie es in 60 ml Gelbeibe. Erhitzen Sie das Gel 30 Sekunden lang in der Mikrowelle und wiegen Sie den Behälter 30 Sekunden lang vorsichtig, um die Hitze gleichmäßig zu verteilen. Erhitzen Sie das Gel im Fleck für weitere 30 Sekunden auf 80–85 °C in der Mikrowelle und geben Sie das Gel 5 Minuten lang auf einen Orbitalschüttler, um es zu rocken.
- Erhitzen Sie das Gel ein drittes Mal für 30 Sekunden in der Mikrowelle und kehren Sie dann zum Orbitalschüttler zurück, um es weitere 23 Minuten lang zu rocken.
- Geben Sie das Gel in einen sauberen Behälter und waschen Sie es 30 Minuten lang in 100 ml Waschlösung (10 % Methanol, 7 % Essigsäure).
HINWEIS: Dies ist ein kritischer Schritt, da es wichtig ist, das Erhitzen der Waschlösung zu vermeiden. Andernfalls kann es zu Hintergrundverfärbungen und Unregelmäßigkeiten im endgültigen Gelbild kommen. - Spülen Sie das Gel nach dem Waschen zweimal für jeweils 5 Minuten in Reinstwasser aus.
- Bilden Sie die Gele mit einem Gel-Imager bei 600 nm ab (Abbildung 2). Verwenden Sie SDS-PAGE, um die Menge des einzelnen Proteins in der Nanopartikellösung zu quantifizieren, wenn es einen Proteinstandard zum Vergleich gibt.
ANMERKUNG: In diesem Beispiel werden serielle Verdünnungen von rekombinant exprimiertem MOMP durch SDS-PAGE aufgelöst und die Dichten der Banden mit Hilfe der Gerätesoftware quantifiziert. - Generieren Sie eine Standardkurve mit den Dichten der MOMP-Bänder. Lösen Sie die MOMP-tNLP-Proben auf demselben SDS-PAGE-Gel auf und berechnen Sie die MOMP-Komponente der Partikel anhand der MOMP-Standardkurve (Abbildung 3).
7. Western- und Dot-Blots und Lagerung
- Für das Western Blotting lösen Sie die Proben mit SDS-PAGE auf und übertragen die Gele mit einem handelsüblichen Trockenblotting-System mit Standardeinstellungen gemäß dem Protokoll des Herstellers.
- Entfernen Sie die Blots nach Abschluss des Transfers aus dem Stapel und inkubieren Sie jeden Blot über Nacht bei 4 °C in einem geeigneten Blockierungspuffer, der 0,2 % Tween 20 und entweder 0,5 mg/ml MAb40 oder 0,2 mg/ml MAbHIS-Anti-His-Tag-Antikörper enthält, der gegen den His-Tag des Δ49ApoA1-Proteins gerichtet ist.
HINWEIS: Die für das Blotting verwendeten Antikörperverdünnungen betragen 1:1.000 für MAb40 und 1:500–1.000 für MAbHIS-Antikörper. - Waschen Sie jeden Tupfer 3 Mal für 5 Minuten mit PBS-T (1x PBS, 0,2 % Tween 20, pH 7,4).
- Inkubieren Sie die Blots für 1 Stunde in einem Blockierungspuffer, der sekundäre Antikörper enthält, die an einen Fluorophor (z. B. IRDye) in einer Verdünnung von 1:10.000 konjugiert sind.
- Waschen Sie die Kleckse 3 Mal für 5 Minuten mit PBS-T. Verwenden Sie einen Fluoreszenz-Imager, um die Kleckse nach der letzten Wäsche abzubilden.
- Entfernen Sie die Blots nach Abschluss des Transfers aus dem Stapel und inkubieren Sie jeden Blot über Nacht bei 4 °C in einem geeigneten Blockierungspuffer, der 0,2 % Tween 20 und entweder 0,5 mg/ml MAb40 oder 0,2 mg/ml MAbHIS-Anti-His-Tag-Antikörper enthält, der gegen den His-Tag des Δ49ApoA1-Proteins gerichtet ist.
- Bei Dot-Blots werden 3 μg gereinigtes MOMP-tNLP getupft und tNLP mit einem Dot-Blot-Gerät entleert. Blockieren und entwickeln Sie die Blots mit den gleichen Methoden, die oben für das Western Blot beschrieben wurden.
8. Bewertung des Endotoxingehalts
- Quantifizierung des Endotoxinspiegels mit einem Endotoxin-Testsystem, das auf dem Limulus-Amöbozyten-Lysat-Assay (LAL) basiert. Endotoxinfreies 25 mM Tris, pH 7,4, Probenpuffer mit 1 M Trishydrochloridlösung und endotoxinfreiem Wasser herstellen.
HINWEIS: In der Regel müssen Proben mit diesem Probenpuffer verdünnt und die Verdünnungen angepasst werden, um den geeigneten Bereich für einzelne Proben zu finden. Hier werden MOMP-tNLP-Proben 500-fach in Probenpuffer verdünnt und 25 μl in jede Vertiefung einer Gerätekartusche mit einer Empfindlichkeit von 0,05 EU/ml geladen. Die Endotoxingehalte von MOMP-tNLP und leerem tNLP, die in den unten beschriebenen Mausstudien verwendet wurden, liegen je nach Probe zwischen 0,4 und 12 EU/μg Protein.
9. Gefriertrocknung
- Lyophilisieren und lagern Sie die MOMP-tNLP-Nanopartikel für den Langzeitgebrauch (bis zu Jahren) bei -20 °C. Um tNLP- und MOMP-tNLP-Suspensionen für die Gefriertrocknung vorzubereiten, fügen Sie Trehalose als Schutzmittel während des Gefrier- und Gefriertrocknungsprozesses hinzu.
HINWEIS: Dieses Verfahren wurde für eine Vielzahl von tNLP-Formulierungen umfassend validiert 7,8. - Das Stromvolumen der MOMP-tNLP-Lösung wird durch 9 dividiert, um das Volumen von 1 M Trehalose in sterilem, endotoxinfreiem, deionisiertem Wasser zu erhalten, das erforderlich ist, um eine Endkonzentration von 0,1 M Trehalose zu erreichen. Notieren Sie sich das Endvolumen und aliquotieren Sie es je nach Wunsch in endotoxinfreie 15-ml- oder 50-ml-Polypropylenröhrchen.
- Die gemischte Lösung auf Trockeneis einfrieren und über Nacht mit einem Gefriertrockner gefrieren. Lagern Sie die getrockneten Formulierungen bis zur Verwendung bei -20 °C.
- Rekonstituieren Sie lyophilisierte tNLPs mit endotoxinfreiem Wasser. Vorsichtig ausrollen, bis sich der gefriergetrocknete Kuchen vollständig aufgelöst und rehydriert hat. Um Trehalose zu entfernen, dialysieren Sie die Lösung gegen PBS mit einer 3,5-kDa-Cutoff-Dialysemembran.
10. Adjuvante Zugabe
HINWEIS: Diese und andere ähnliche NLP-basierte Sub-Unit-Impfstoffformulierungen können problemlos lipophile Adjuvantien wie CpG-ODN1826 und FSL-1 enthalten. CpG-ODN1826 ist ein modifiziertes CpG-Oligonukleotid der Klasse B (5'-tccatgacgttcctgacgtt-3') mit einem vollständigen Phosphorthioat-Rückgrat mit einem 5'-Cholesterinanteil (5'-chol-C6). Die Konjugation von CpG-ODN1826 an tNLPs wird durch die hydrophoben Wechselwirkungen zwischen dem Cholesterinanteil und der Phospholipid-Doppelschicht des tNLP vermittelt und wurde, wie bereits berichtet 9,10, nachgewiesen und gut charakterisiert.
- Vor der Einarbeitung in diese Formulierungen ist das cholesterinmodifizierte CpG durch Umkehrphasenchromatographie zu reinigen, um kontaminierendes Endotoxin sowie alle unmodifizierten CpG-Moleküle zu entfernen.
- Nach Erhalt durch den Lieferanten wird das lyophilisierte CpG-Material in endotoxinfreiem Wasser rehydriert und auf einer präparativen C4-RP-HPLC-Säule unter Verwendung eines Trenngradienten aus 10 mM Triethylammoniumacetat (TEAA) (mobile Phase A) und Acetonitril (mobile Phase B) gereinigt.
HINWEIS: Weitere Details finden Sie in Tabelle 2. - Die Fraktionen, die Cholesterin-modifiziertes CpG enthalten, werden gepoolt und gefriergetrocknet. Um eine vollständige Entfernung des restlichen TEAA zu gewährleisten, wird das CpG mit 15 ml endotoxinfreiem Wasser rekonstituiert und dreimal relyophilisiert.
- Nach der abschließenden Gefriertrocknung wird CpG in endotoxinfreiem Wasser (>20 mg/ml endgültige CpG-Konzentration) aliquot rekonstituiert und bis zur Verwendung bei -80 °C gelagert. Für die Zugabe zu Formulierungen wird das CpG auf eine Konzentration von 1–2,5 mg/ml verdünnt.
HINWEIS: FSL-1 ist als gefriergetrocknetes Pulver in Impfstoffqualität erhältlich. Diese wird mit sterilem und endotoxinfreiem Wasser in einer Konzentration von 1 mg/ml rekonstituiert. Der Impfstoff wird intramuskulär (i.m.) verabreicht, wobei jede Dosis 10 μg MOMP in einem Gesamtvolumen von 50 μl enthält.
- Nach Erhalt durch den Lieferanten wird das lyophilisierte CpG-Material in endotoxinfreiem Wasser rehydriert und auf einer präparativen C4-RP-HPLC-Säule unter Verwendung eines Trenngradienten aus 10 mM Triethylammoniumacetat (TEAA) (mobile Phase A) und Acetonitril (mobile Phase B) gereinigt.
- Um die gewünschte Formulierungsdosis zu erreichen, dialysieren Sie die Nanopartikel zu PBS und konzentrieren Sie sie mit einem zentrifugalen Vakuumkonzentrator vor der adjuvanten Zugabe. Achten Sie dabei darauf, eine vollständige Trocknung der Probe zu vermeiden – überprüfen Sie das Probenvolumen während der Zentrifugation alle 20 bis 30 Minuten.
- Geben Sie das Adjuvans unter sterilen Bedingungen in eine Biosicherheitswerkbank. Um die erfolgreiche Einarbeitung zu beurteilen, analysieren Sie die endgültigen Formulierungen und ihre Bestandteile mittels analytischer Größenausschlusschromatographie (SEC).
HINWEIS: Für diese Vorbereitungen wurde eine SEC-Säule in PBS-Puffer (0,5 ml/m Flussrate) verwendet, und die Elution wurde mit einem UV-Vis-Diodenarray-Detektor detektiert. Die Inkorporation wurde bewertet, indem die Absorption der adjuvantierten Partikel mit der der nicht adjuvantierten Partikel bei 214 und 280 nm verglichen wurde. - Lagern Sie das adjuvantierte MOMP-tNLP und entleeren Sie tNLP bei 4 °C vor der Tieranwendung für einen Zeitraum von bis zu 14 Tagen. Um die Stabilität einer neuen tNLP-Formulierung vollständig beurteilen zu können, analysieren Sie die gespeicherten tNLPs regelmäßig per SEC.
HINWEIS: Die Stabilität variiert von Formulierung zu Formulierung.
11. Serum-Tests
- Besorgen Sie sich weibliche 3 Wochen alte Mäuse (BALB/c, n = 6).
- Die Mäuse werden intramuskulär (i.m.) in jeder Hintergliedmaße mit 10 μg MOMP in Form von MOMP-tNLP adjuvantiert mit 5 μg CpG und 1 μg FSL-1 (Gesamtvolumen pro Injektion = 50 ml) geimpft.
- Beobachten Sie die Mäuse nach der Impfung, bis sie in der Lage sind, das Brustbein zu halten.
- Vier Wochen nach der Erstimpfung (Prime) werden die Tiere ein zweites Mal geimpft (Boost) mit 10 μg MOMP in Form von MOMP-tNLP adjuvantiert mit 5 μg CpG und 1 μg FSL-1 (Gesamtvolumen pro Injektion = 50 ml).
- Am Tag 56 nach der Erstimpfung Blut entnehmen, um die Antikörpertiter zu bestimmen. Beginnen Sie mit der Betäubung der Mäuse durch Injektion einer Lösung aus Xylazin (0,3 mg/20 g Körpergewicht) und Ketamin (3,0 mg/20 g Körpergewicht). Kneifen Sie die Vorder- und Hinterbeine zusammen, um sicherzustellen, dass kein Ruckeln auftritt. Tragen Sie Vaseline um die Augen herum auf, um Augentrockenheit während der Anästhesie zu verhindern.
- Mit einem Mikro-Hämatokrit-Kapillarrohr wird der retroorbitale Plexus punktiert. Sammeln Sie 100 ml Blut in einem Mikrozentrifugenröhrchen.
- Beobachten Sie die Mäuse nach der Blutentnahme, bis sie sich von der Narkose erholt haben und das Brustbein beibehalten können.
- Lassen Sie das Blut 30 Minuten bei Raumtemperatur gerinnen und schleudern Sie dann 10 Minuten lang bei 2.000 × g herunter. Das Serum auffangen und bei -80 °C einfrieren.
- Fordern Sie die Tiere zu diesem Zeitpunkt mit Chlamydia muridarum heraus oder schläfern Sie sie ein. Euthanasieren Sie die Mäuse, indem Sie zuerst eine Lösung aus Xylazin (0,3 mg/20 g Körpergewicht) und Ketamin (3,0 mg/20 g Körpergewicht) injizieren, gefolgt von einer Zervixluxation.
- Testen Sie Serumantikörper, die spezifisch für MOMP sind, mit Western-Blotting-Techniken, wie oben beschrieben. Pool-Mausseren von allen immunisierten Mäusen und verwenden Sie das gepoolte Serum anstelle eines primären Antikörpers in einer Verdünnung von 1:5.000.
Ergebnisse
Das SDS-PAGE-Profil der Ni-Affinitätsreinigung von MOMP-tNLP aus einer zellfreien 1-ml-Reaktion ist in Abbildung 1B dargestellt. Die Reaktion führte zu einer hohen Expression sowohl des MOMP- als auch des Δ49ApoA1-Proteins. Frühere Ergebnisse zeigten, dass die zellfreie Expression von Δ49ApoA1 in Gegenwart von DMPC und Telodendrimer zur Bildung von Telodendrimer-Nanolipoproteinpartikeln (tNLPs) führte4. Die Ko-Elution von MOMP mit Δ49ApoA1 deutete darauf hin, dass MOMP mit tNLPs assoziiert ist, da der His-Tag nur auf dem tNLP-Gerüst Δ49ApoA1 und nicht auf MOMP vorhanden ist. MOMP ist ein hochgradig unlösliches Protein, das nur durch Komplexierung mit tNLPs eluiert werden kann, die nachweislich die Solubilisierung von Membranproteinen erleichtern.
Die Elutionsfraktionen, die MOMP-tNLPs enthielten, wurden gepoolt und die Gesamtproteinkonzentration mit einem fluoreszenzbasierten Quantifizierungsgerät oder einem Gerät, das die Konzentration durch Absorption bei 280 nm misst, gemäß den Anweisungen des Herstellers für die Proteinquantifizierung bestimmt. Um eine präzise Dosierung des MOMP-Impfstoffs zu ermöglichen, ist es auch wichtig, die Konzentration von MOMP in den gereinigten Komplexen zu bestimmen. Wir entwickelten eine Methode zur Quantifizierung von MOMP auf der Grundlage der Geldensitometrie (Abbildung 2), bei der ein gereinigtes rekombinantes MOMP mit bekannter Konzentration als Standard verwendet wurde. Durch die Erstellung der Standardkurve und den Vergleich mit der MOMP-tNLP-Probe kann die MOMP-Konzentration genau quantifiziert werden. Die Bestimmung der MOMP-Konzentration in der gereinigten Probe ermöglichte die Abschätzung der Ausbeute von MOMP in zellfreien Reaktionen auf verschiedenen Skalen, was für die Planung des Reaktionsaufbaus für nachgelagerte Studien wichtig ist (Tabelle 3).
MOMP muss Oligomere bilden, um eine robuste Immunantwort hervorzurufen11. Um den oligomeren Zustand von MOMP zu testen, wurde MOMP-tNLP in Gegenwart und Abwesenheit von Wärme und dem Reduktionsmittel Dithiothreitol (DTT, 50 mM, Abbildung 3A) analysiert. Oligomere höherer Ordnung von MOMP wurden mittels SDS-PAGE identifiziert, wenn die Proben nicht mit Hitze und DTT behandelt wurden. Im Vergleich dazu zeigten Proben, die mit Hitze in Gegenwart von DTT behandelt wurden, hauptsächlich zwei unterschiedliche Banden auf dem Gel, die MOMP und Δ49ApoA1 (ca. 40 kDa bzw. 22 kDa) entsprechen. Diese Ergebnisse ähneln stark dem Gelbandenmuster, das der Oligomerbildung von MOMP zugeschrieben wird, was für seine Wirksamkeit entscheidend ist.
Eine weitere Western-Blot-Analyse mit MAb40, einem Antikörper gegen das lineare Epitop auf der variablen Domäne des MOMP-Proteins, zeigte ein ähnliches Bandenmuster, das die Oligomerbildung durch das MOMP-Protein in seinem nicht denaturierten Zustand bestätigte (Abbildung 3B). Ein wichtiger Faktor, der die Bildung von MOMP-Oligomeren beeinflusst, ist das Verhältnis zwischen dem MOMP-Plasmid und dem Δ49ApoA1-Plasmid während des zellfreien Reaktionsaufbaus. Tabelle 4 listet das Verhältnis der Plasmide und die resultierende Insertionsrate von MOMP in tNLPs auf. Frühere Studien deuteten darauf hin, dass Chlamydien-MOMP und andere Proteine der äußeren Membran hauptsächlich als Trimere vorliegenkönnten 12. Um die Trimerbildung in der zellfreien Reaktion zu maximieren, ist es wünschenswert, die Insertionsrate nahe bei drei MOMP-Proteinen pro NLP zu haben, was einem Plasmidverhältnis von ~25:1 MOMP zu Δ49ApoA1 entspricht.
Ein Dot-Blot-Assay wurde als optimierte Methode verwendet, um das Vorhandensein von MOMP und tNLP nachzuweisen. Der MAb40-Antikörper wurde zum Nachweis der Gesamt-MOMP verwendet. Der MAbHIS-Antikörper, der auf den His-Tag auf dem Δ49ApoA1-Gerüst des tNLP gerichtet war, wurde verwendet, um das Vorhandensein von tNLP zu bestimmen. Die Co-Signaltransduktion von MAb40- und MAbHIS-Antikörpern deutete auf die Bildung von MOMP-tNLP hin. Die Kontrollreaktion produzierte leeres tNLP, das nur ein positives Signal von MAbHIS zeigte (Abbildung 3C). Um die Immunogenität von MOMP-tNLPs, die in der zellfreien Reaktion produziert werden, zu testen, haben wir MOMP-tNLP mit CpG + FSL-1 adjuvantiert und Mäusen in einem Prime-Boost-Regime, wie oben beschrieben, intramuskulär (i.m.) injiziert. Den immunisierten Mäusen wurden Seren entnommen und der MOMP-spezifische IgG-Antikörper wurde mit einem Western-Blot-Assay gemessen (Abbildung 4). Die Seren von Mäusen, denen adjuvantiertes MOMP-tNLP injiziert wurde, zeigten eine starke MOMP-Bindung, was darauf hindeutet, dass MOMP-tNLP in vivo eine Immunantwort hervorrufen könnte.
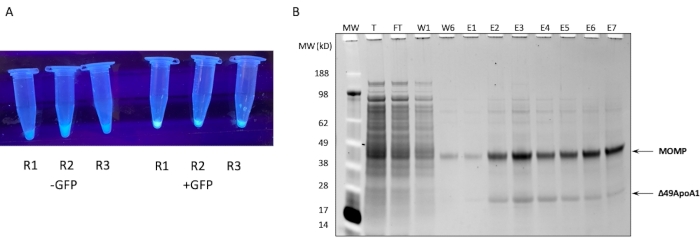
Abbildung 1: Expression und Aufreinigung von MOMP-tNLP. (A) Bild von Röhrchen, die kleine Aliquots einer zellfreien Reaktion enthalten, die erfolgreich exprimiert, GFP kontrolliert die Luminanz unter UV-Lichtquelle (rechts) im Vergleich zu Lysaten ohne GFP-Plasmid (links). (B) Das mit SYPRO Ruby gefärbte Proteingel nach SDS-PAGE zeigt das Aufreinigungsprofil von MOMP-tNLP. MOMP migriert mit 40 kDa und der 49ApoA1 mit 22 kDa. Abkürzungen: MOMP = chlamydiales major outer membrane protein; tNLP = Telodendrimer-Nanolipoproteinpartikel; MOMP-tNLP = MOMP-tNLP-Komplex; GFP = grün fluoreszierendes Protein-kodierendes Plasmid; MW = Molekulargewichtsmarker; T = zellfreies Lysat insgesamt; FT = Durchfluss; R1-R3 = zellfreie Reaktionsaliquote; W1, W6 = Waschgänge 1 und 6; E1-E7 = Elutionen 1 bis 7; Δ49ApoA1 = ApoA1-Derivat der His-markierten Maus. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Quantifizierung von MOMP in MOMP-tNLP-Proben . (A) SDS-PAGE-Gel, gefärbt mit SYPRO Ruby zur Quantifizierung von MOMP. Rekombinantes MOMP mit bekannter Konzentration wurde auf das Gel geladen, um die Standardkurve zu erhalten. Jede Spur enthielt 0,1 μg, 0,5 μg, 1,0 μg, 2,0 μg und 4,0 μg MOMP. MOMP-tNLP-Proben, die quantifiziert wurden, wurden auf dasselbe Gel geladen. (B) Die MOMP-Konzentrationsstandardkurve wurde mittels Densitometrie erstellt. Es wurde eine Gleichung aufgestellt, die die normalisierte Banddichte und die Menge an MOMP in Beziehung setzt. Die Gleichung wurde verwendet, um den MOMP-Gehalt in den unbekannten Proben zu berechnen. Abkürzungen: MOMP = chlamydiales major outer membrane protein; tNLP = Telodendrimer-Nanolipoproteinpartikel; MOMP-tNLP = MOMP-tNLP-Komplex; SDS-PAGE = Natriumdodecylsulfat-Polyacrylamid-Gelelektrophorese. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Abbildung 3: Zellfrei produziertes MOMP-tNLP ermöglicht es MOMP, Strukturen höherer Ordnung zu bilden. (A) SDS-PAGE-Gel aus MOMP-tNLP mit und ohne Behandlung von Hitze und Reduktionsmittel DTT, gefärbt mit SYPRO Ruby. Mit Hitze und DTT trat MOMP in erster Linie als Monomerbande bei ~40 kDa auf, da Wärme und das Reduktionsmittel den Großteil der MOMP-Struktur höherer Ordnung abbauten. In Abwesenheit von Wärme und DTT waren die Banden höherer Ordnung vorhanden, was auf eine MOMP-Oligomerkonformation hindeutet. (B) Western Blot von MOMP-tNLP und MOMP allein, unbehandelt und mit Hitze und DTT behandelt. Nach dem Transfer wurde die Membran mit MAb40 (1:1.000 Verdünnung) untersucht. Es wurde ein Bandenmuster beobachtet, das dem SYPRO-Rubin-gefärbten Gel ähnelte, was bestätigte, dass es sich bei den Banden mit höherem Molekulargewicht tatsächlich um MOMP-Oligomere handelte. (C) Punktfleck von MOMP-tNLP und leeren tNLP-Proben (in doppelter Ausführung), die mit MAb40 und MAbHIS untersucht wurden. Abkürzungen: MOMP = chlamydiales major outer membrane protein; tNLP = Telodendrimer-Nanolipoproteinpartikel; MOMP-tNLP = MOMP-tNLP-Komplex; SDS-PAGE = Natriumdodecylsulfat-Polyacrylamid-Gelelektrophorese; DTT = Dithiothreitol. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Abbildung 4: Zellfrei produziertes MOMP-tNLP ist hochgradig immunogen. Das Serum von immunisierten Mäusen zeigte ein starkes Anti-MOMP-IgG-Signal. MOMP-tNLP adjuvantiert mit CpG + FSL-1 wurde zur Immunisierung von Mäusen verwendet. Seren von sechs immunisierten Mäusen wurden gesammelt, gepoolt und zur Untersuchung von MOMP-tNLP verwendet. Das Serum konnte in einem Western-Blotting-Assay an MOMP binden und zeigte ein starkes IgG-Signal (links). Der Western Blot mit MAb40 als primärem Antikörper (rechts) zeigte ähnliche Banden, was darauf hindeutet, dass das Serum MOMP-spezifisches IgG enthielt. Abkürzungen: MOMP = chlamydiales major outer membrane protein; tNLP = Telodendrimer-Nanolipoproteinpartikel; MOMP-tNLP = MOMP-tNLP-Komplex; CpG = cholesterinmodifiziertes CpG-Adjuvans; FSL-1 = lipophiles Adjuvans. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Name des Puffers | NaH2PO4 | NaCl | Imidazol | Ph |
| Bindungspuffer | 50 mM | 300 mM | 10 mM | 8.0 |
| Wasch-Puffer | 50 mM | 300 mM | 20 mM | 8.0 |
| Elutions-Puffer 1 | 50 mM | 300 mM | 250 mM | 8.0 |
| Elutions-Puffer 2 | 50 mM | 300 mM | 500 mM | 8.0 |
Tabelle 1: Liste der Puffer, die für die Reinigung der Nickelaffinität benötigt werden, mit Angabe der Konzentrationen der einzelnen Komponenten und des pH-Werts.
| Laufzeit | 50 Minuten |
| Durchflussmenge | 6,0 ml/min |
| Verlaufstyp | Binär |
| Puffer A | 10 mM TEAA in H20 |
| Puffer B | MeCN |
| Steigung | % Puffer B |
| 0 min | 25% |
| 30 min | 60% |
| 30,5 Minuten | 100% |
| 40 Minuten | 100% |
| 40,5 Minuten | 25% |
| 50 Minuten | 25% |
Tabelle 2: Bedingungen für die Umkehrphasen-HPLC-Aufreinigung von cholesterinmodifiziertem CpG. Abkürzungen: TEAA = Triethylammoniumacetat; MeCN = Acetonitril.
| Zellfreies Lysat (ml) | DMPC-Lipid (mg) | Telodendrimer (mg) | MOMP-Plasmid (μg) | Gereinigte MOMP-Ausbeute (mg) |
| 1 | 4 | 0.4 | 15 | 0.5 |
| 2 | 8 | 0.8 | 30 | 1.1 |
| 3 | 12 | 1.2 | 45 | 1.6 |
| 5 | 20 | 2 | 75 | 2.7 |
Tabelle 3: Die Menge an Lipiden, Telodendrimeren und Plasmiden, die für unterschiedlich skalierte zellfreie Reaktionen verwendet werden, und die entsprechenden Ausbeuten. Abkürzungen: MOMP = chlamydiales major outer membrane protein; DMPC = 1,2-Dimyristoyl-sn-glycero-3-phosphocholin.
| Verhältnisse des Plasmideingangs, MOMP : Δ49ApoA1 | 1:1 | 5:1 | 10:1 | 25:1 | 50:1 | 100:1 | |
| Verhältnis der produzierten Proteinmenge, MOMP : Δ49ApoA1 | 0.02 | 0.32 | 0.64 | 3.46 | 6.55 | 20.04 | |
| Geschätzte Anzahl der MOMP-Insertionen pro tNLP | 0.03 | 0.37 | 0.75 | 4.04 | 7.65 | 23.39 | |
Tabelle 4: Die Plasmidverhältnisse in einer zellfreien Reaktion und die resultierenden MOMP-Insertionsraten. Abkürzungen: MOMP = chlamydiales major outer membrane protein; tNLP = Telodendrimer-Nanolipoproteinpartikel; Δ49ApoA1 = ApoA1-Derivat der His-markierten Maus.
Diskussion
Chlamydien sind die häufigste sexuell übertragbare Infektion, die sowohl Männer als auch Frauen betrifft. Obwohl sich die Impfstoffforschung zu Chlamydien über Jahrzehnte erstreckt, ist ein sicherer und wirksamer Impfstoff, der auf die Massenproduktion skaliert werden kann, nach wie vor schwer zu finden13. Das Chlamydien-MOMP gilt als Hauptkandidat als schützendes Impfantigen; MOMP ist jedoch stark hydrophob und anfällig für falsche Faltungen14,15. Weitere Studien haben gezeigt, dass MOMP in oligomeren Zuständen existiert, die für seine Immunogenität unerlässlich sind11. Hier wird eine validierte, zellfreie Co-Expressionsmethode beschrieben, die oligomeres MOMP produziert, das in tNLP-Nanopartikeln als Impfstoff gebildet wird, mit Ausbeuten von ca. 1,5 mg gereinigtem MOMP pro 3 ml Lysat. Dieses vollständig zusammengetragene Verfahren kann für die industrielle Produktion weiter skaliert werden, was seine Aussichten als nützlicher Ansatz für die Herstellung von Impfstoffen erhöht.
Wir haben bereits über die Verwendung der zellfreien Expression zur Herstellung von Membranproteinen, die in NLPseingebettet sind, 3,16 sowie über die Expression in Telodendrimer-stabilisierten Scheiben veröffentlicht. Diese letztere Technik erzeugte jedoch Membranproteinpartikel mit größerer Heterogenität und geringerer Löslichkeit. 4 Darüber hinaus ist die Immunogenität von MOMP-Telodendrimer-Partikeln im Vergleich zu MOMP-tNLP-Partikeln unklar6.
Dieses Verfahren kann angepasst werden, um die Expression von bakteriellen Membranproteinen zu erhöhen, die vielversprechende Kandidaten als Antigene für den Einsatz in Subunit-Impfstoffen sind. Dieses Verfahren erzeugt nicht nur ein gelöstes bakterielles Membranprotein, sondern die gesamte Nanopartikelstruktur ist auch für eine weitere Modifikation mit einer Vielzahl von lipophilen Impfstoffadjuvantien zugänglich, einschließlich, aber nicht beschränkt auf CpG, das an einen Cholesterinanteil oder FSL-1 konjugiert ist. Die Expression anderer Antigenkandidaten aus Bakterien ist möglich, obwohl Parameter wie Expressionstemperatur, Lipidwahl und Art des Expressionssystems möglicherweise untersucht werden müssen, um optimale Ausbeuten zu erzielen.
Darüber hinaus sind die Wahl und das Verhältnis der Plasmide in diesem Prozess entscheidend. Beide verwendeten Plasmide sollten aus dem gleichen Rückgrat aufgebaut sein. Wenn die Inserts annähernd gleich lang sind, können die Verhältnisse auf der Masse des zugegebenen Plasmids basieren, wie hier beschrieben. Die Verhältnisierung auf der Grundlage von Molen führt jedoch zu reproduzierbareren Ergebnissen, insbesondere bei der Skalierung der Reaktionen. Verhältnisse, die bei Reaktionen im Bildschirmmaßstab gut funktionieren (< 0,5 ml), sind möglicherweise nicht auf größere Reaktionen anwendbar und erfordern möglicherweise zusätzliche Optimierungen. Nicht-Membranproteine können weiterhin mit zellfreien Kits exprimiert werden, benötigen jedoch möglicherweise nicht das Lipid-Nanopartikel (Co-Expression), um ein lösliches Produkt zu produzieren. Während dieses Protokoll die Adjuvantierung mit CpG und FSL-1 beschreibt, ist dieses System für die Formulierung mit anderen lipophilen Adjuvantien oder das Mischen mit löslichen Adjuvantien nach Wunsch zugänglich.
Es ist wichtig, bei der Einrichtung der zellfreien Expressionsreaktion eine Kontamination zu vermeiden, da dies die Ausbeute beeinträchtigen kann. Alle Zusätze zur Reaktion, einschließlich der Plasmide selbst, sollten hochrein sein. Darüber hinaus sollten die exprimierten Proteine nur mit Materialien und Lösungen in Kontakt kommen, die frei von Endotoxin-Kontamination sind. Eine Endotoxin-Kontamination in Formulierungskandidaten kann zu inkonsistenten und falschen Ergebnissen immunologischer Assays führen und in ausreichenden Mengen schädlich sein. Obwohl hier nicht beschrieben, kann eine zusätzliche Reinigung nach der Nickelaffinitätschromatographie erforderlich sein, wenn viele Verunreinigungen in nachfolgenden Analyseschritten wie z. B. DURCH SDS-PAGE beobachtet werden. Dies könnte mit SEC erreicht werden, obwohl die Bedingungen möglicherweise von Formulierung zu Formulierung optimiert werden müssen.
Offenlegungen
Die Autoren erklären, dass ihnen keine konkurrierenden finanziellen Interessen oder persönlichen Beziehungen bekannt sind, die den Anschein erwecken könnten, dass sie die in diesem Artikel berichtete Arbeit beeinflusst haben.
Danksagungen
Diese Arbeit wurde durch den Zuschuss des Public Health Service R21 AI20925 und U19 AI144184 des National Institute of Allergy and Infectious Diseases unterstützt. Diese Arbeit wurde unter der Schirmherrschaft des U.S. Department of Energy vom Lawrence Livermore National Laboratory unter dem Vertrag DE-AC52-07NA27344 [LLNL-JRNL-822525, LLNL-VIDEO-832788] durchgeführt.
Materialien
| Name | Company | Catalog Number | Comments |
| 1,2-dimyristoyl-sn-glycero-3-phosphocholine (DMPC) as powder | Avanti Polar Lipids | 850345 | |
| 1.5 mL endotoxin-free centrifuge tubes | Eppendorf | 2600028 | |
| 1 M Trizma hydrochloride solution | Millipore Sigma | T2194 | |
| Acetic acid, glacial, ACS reagent, ≥99.7% | Millipore Sigma | 695092 | |
| Bio-Dot apparatus | Bio-Rad | 1706545 | |
| Buffer Dam for XCell SureLock | Life Technologies | EI0012 | |
| C24 Incubator shaker | New Brunswick Scientific | ||
| Cell-Free Expression System: RTS 500 ProteoMaster E. coli HY Kit | BiotechRabbit | BR1400201 | |
| cOmplete His-Tag Purification Resin | Roche Molecular Diagnostics | 5893682001 | |
| cOmplete, EDTA-free Protease Inhibitor Cocktail | Roche Molecular Diagnostics | 4693132001 | |
| CpG-ODN1826 | Biosearch Technologies | T9449 | |
| D-(+)-Trehalose dihydrate | Millipore Sigma | 71509 | |
| Dialysis tubes D-Tube Dialyzer Maxi | Millipore Sigma | 71508-3 | |
| Disposable, polypropylene fritted columns 10 mL capacity | Bio-Rad | 7311550EDU | |
| Dulbecco’s Phosphate-buffered Saline (PBS) | Millipore Sigma | D8537 | |
| Electrophoresis Power Supply | |||
| Endosafe PTS cartridge | Thermo Fisher Scientific | NC9594798 | |
| Endosafe-PTS Testing System | Charles River | ||
| Gel wash solution: 10% methanol, 7% acetic acid | |||
| HCl and NaOH solutions for pH adjustment | |||
| HPLC with UV-vis diode array detector | Shimadzu | ||
| HyClone HyPure culture-grade water | VWR | 82007-328 | |
| iBlot 2 Dry Blotting System | Life Technologies | ||
| iBlot 2 Transfer Stacks, PVDF | Life Technologies | IB24001 | |
| Image Studio V2.0 software | Li-COR Biiosciences | ||
| Imidazole | Millipore Sigma | I5513 | |
| Immun-Blot PVDF Membrane | Bio-Rad | 1620177 | |
| LI-COR Odyssey Fc imager | Li-COR Biiosciences | ||
| Lyophilizer | Labconco | ||
| Methanol (≥99.9%) | Millipore Sigma | 34860 | |
| Microcentrifuge | |||
| Microwave oven | |||
| NanoDrop One/OneC Microvolume UV-Vis Spectrophotometer | Thermo Fisher Scientific | ND-ONE-W | |
| NuPAGE 4 to 12%, Bis-Tris, 1.0 mm | Life Technologies | NP0321 | |
| NuPAGE LDS Sample Buffer (4x) | Life Technologies | NP0007 | |
| NuPAGE MES SDS Running Buffer (20x) | Life Technologies | NP000202 | |
| NuPAGE Sample Reducing Agent (10x) | Life Technologies | NP0009 | |
| Odyssey Blocking Buffer in TBS containing 0.2% Tween 20 | Li-COR Biosciences | 927-50000 | |
| Orbital Shaker | |||
| PBS-T (1x PBS, 0.2% Tween 20, pH 7.4) | |||
| PEG5K-CA8 Telodendrimer (custom synthesis product) | |||
| pIVEX2.4d vector | Roche Molecular Diagnostics | ||
| Plasmid Maxi Kit | Qiagen | 12162 | |
| Primary antibody: MAb40 (monoclonal antibody to the variable domain 1 (VD1) of C. muridarum MOMP, de la Maza laboratory)4 | |||
| Primary antibody: MAbHIS, Penta-His antibody | Qiagen | 34660 | |
| Probe sonicator | |||
| Qubit 3.0 Fluorometer | Life Technologies | Q33216 | |
| Qubit Protein Assay Kit | Life Technologies | Q33212 | |
| Rainin Pipette tips: LTS 1000 µL | Rainin | 17002428 | |
| Rainin Pipette tips: LTS 20 µL | Rainin | 17002429 | |
| Rainin Pipette tips: LTS 200 µL | Rainin | 17002426 | |
| Rainin Pipettes | Rainin | ||
| Secondary antibody: IRDye 800CW goat (polyclonal) anti-mouse IgG (heavy and light) | Li-COR Biosciences | 926-32210 | |
| SeeBlue Plus2 Pre-stained Protein Standard | Life Technologies | LC5925 | |
| Sodium chloride NaCl | Millipore Sigma | S7653 | |
| Sodium phosphate monobasic NaH2PO4 | Millipore Sigma | S0751 | |
| Superdex 200, 5/150 GL column | Cytiva | GE28-9909-45 | |
| Synthetic diacylated lipoprotein-TLR2/6 FSL-1 | Invivogen | tlrl-fsl | |
| SYPRO Ruby Protein Gel Stain | Life Technologies | S12001 | |
| TWEEN 20 | Millipore Sigma | P1379 | |
| UV light source | |||
| Vacufuge Bench Top Centrifuge | Eppendorf | ||
| Vortexer | |||
| VWR 15 mL conicals (89039-666) | VWR | ||
| VWR 50 mL conicals (89039-656) | VWR | ||
| XCell SureLock Mini-Cell (Life Technologies ) | Life Technologies | EI0001 |
Referenzen
- Carlson, E. D., Gan, R., Hodgman, C. E., Jewett, M. C. Cell-free protein synthesis: applications come of age. Biotechnology Advances. 30 (5), 1185-1194 (2012).
- Coleman, M. A., et al. Expression and association of the Yersinia pestis translocon proteins, YopB and YopD, are facilitated by nanolipoprotein particles. PLoS One. 11 (3), 0150166(2016).
- Cappuccio, J. A., et al. Cell-free co-expression of functional membrane proteins and apolipoprotein, forming soluble nanolipoprotein particles. Molecular & Cellular Proteomics: MCP. 7 (11), 2246-2253 (2008).
- He, W., et al. Controlling the diameter, monodispersity, and solubility of ApoA1 nanolipoprotein particles using telodendrimer chemistry. Protein Science. 22 (8), 1078-1086 (2013).
- He, W., et al. Cell-free production of a functional oligomeric form of a Chlamydia major outer-membrane protein (MOMP) for vaccine development. Journal of Biological Chemistry. 292 (36), 15121-15132 (2017).
- Tifrea, D. F., et al. Induction of protection in mice against a Chlamydia muridarum respiratory challenge by a vaccine formulated with the major outer membrane protein in nanolipoprotein particles. Vaccines. 9 (7), 755(2021).
- Cleveland, T. E., et al. Small-angle X-ray and neutron scattering demonstrates that cell-free expression produces properly formed disc-shaped nanolipoprotein particles. Protein Science. 27 (3), 780-789 (2018).
- Fischer, N. O., et al. Conjugation to nickel-chelating nanolipoprotein particles increases the potency and efficacy of subunit vaccines to prevent West Nile encephalitis. Bioconjugate Chemistry. 21 (6), 1018-1022 (2010).
- Fischer, N. O., et al. Colocalized delivery of adjuvant and antigen using nanolipoprotein particles enhances the immune response to recombinant antigens. Journal of the American Chemical Society. 135 (6), 2044-2047 (2013).
- Fischer, N. O., et al. Evaluation of nanolipoprotein particles (NLPs) as an in vivo delivery platform. PLoS One. 9 (3), 93342(2014).
- Pal, S., Peterson, E. M., de la Maza, L. M. Vaccination with the Chlamydia trachomatis major outer membrane protein can elicit an immune response as protective as that resulting from inoculation with live bacteria. Infection and Immunity. 73 (12), 8153-8160 (2005).
- Sun, G., et al. Structural and functional analyses of the major outer membrane protein of Chlamydia trachomatis. Journal of Bacteriology. 189 (17), 6222-6235 (2007).
- Hafner, L. M., Wilson, D. P., Timms, P. Development status and future prospects for a vaccine against Chlamydia trachomatis infection. Vaccine. 32 (14), 1563-1571 (2014).
- Findlay, H. E., McClafferty, H., Ashley, R. H. Surface expression, single-channel analysis and membrane topology of recombinant Chlamydia trachomatis Major Outer Membrane Protein. BMC Microbiology. 5, 5(2005).
- Sun, G., Pal, S., Weiland, J., Peterson, E. M., de la Maza, L. M. Protection against an intranasal challenge by vaccines formulated with native and recombinant preparations of the Chlamydia trachomatis major outer membrane protein. Vaccine. 27 (36), 5020-5025 (2009).
- He, W., et al. Cell-free expression of functional receptor tyrosine kinases. Scientific Reports. 5 (1), 12896(2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten